夏天無粉直接口服中藥飲片的制作方法
本發明涉及一種夏天無粉直接口服中藥飲片,屬于醫藥技術領域。
背景技術:
夏天無為罌粟科紫堇屬多年生草本伏生紫堇corydalisdecumbens
(thunb.)pers.的干燥塊莖,又名伏地延胡索,伏地元胡,無柄紫堇,夏無蹤。夏天無在初夏來臨前完成開花、結果等生命過程,然后開始整株植物的枯萎,等到夏日炎炎來臨時,地面上就找不到夏天無的植株,故名為“夏天無”
夏天無是一種常見的中藥材,其性溫,味辛,具有活血止痛的功效,對治療淤血紅腫、關節疼痛、跌打損傷、類風濕等有治愈功效。而且夏天無中含有的生物堿對于心血管疾病有治療作用,可以起到降血壓、降血脂的功效,通過實驗發現,夏天無還可以治療血栓等心血管疾病。對于骨折扭傷,夏天無能起到治療緩解作用,而且對小兒麻痹癥也有治療的功效。
夏天無所含有的化學成分主要為生物堿,包括普魯托品(protopine),別隱品堿(allocryptopine),隱品堿(cryptopine),隱品巴馬亭(muramine),四氫巴馬亭(tetrahydropalmatine),延胡索丹酚堿(kikemanine),斯闊任(scoulerine),球紫堇堿(bulbocapnine),加若定(capnoidine),季胺生物堿部分共有6個化合物,分別為二氫巴馬亭,巴馬亭(palmatine),藥根堿(jatrorrhizine),白毛莨堿寧(hydroxyhydrastine),蝙蝠葛林(menisperine)和阿魏酸(ferulicacid)等;其藥理研究表明:1)抗炎作用:夏天無總堿中含量最高的是原阿片堿,具有解痙止痛之功效,延胡索乙素具有解痙鎮痛活血的作用。2)作用于外周神經系統:在對夏天無總生物堿的研究中,有學者發現其具有的較強的抑制乙酰膽堿酯酶(ache)活性的作用,通過色譜法從夏天無總生物堿中提取并分離出5中成分,用改進的ellman法對其進行體外抗ache活性測定,其中原阿片堿的作用最強,表明原阿片堿是夏天無總生物堿中抗ache活性的主要成分之一。3)其他作用:夏天無總生物堿和普魯托品對睫狀肌均有解痙作用,可用于近視眼的治療,夏天無中的四氫巴馬汀對突觸體及囊泡攝取多巴胺產生影響,且夏天無具有抗瘧疾的作用,夏天無中含有多種生物堿,且有些成分藥理不明確,若對其進行深入系統的研究,有可能發現其他新的藥理活性物質。
《中國藥典》2015版一部夏天無【炮制】項下的飲片產品為夏天無粉,即取夏天無,凈制,干燥,碾成細粉,其用法為吞服(直接口服)。細粉按《中國藥典》的標準為95%通過六號篩(150μm±6.6μm,即100篩目)。
夏天無粉質量標準中的“浸出物”及含量測定樣品的制備,往往都是使用醇或有機溶劑,因此,所測定的結果只能反映其本身的質量,不能說明指標成分或有效成分經口服后在體內能溶出或釋放“量”的真實情況,使夏天無粉作為直接口服飲片的最佳生產工藝的設計和選擇缺乏科學依據,由此,夏天無粉對心血管的恢復功能和臨床療效也受到很大影響或得不到保障。
中藥粉末的滅菌歷來是中藥制藥行業中一大難題。干熱、高溫高壓蒸汽等物理滅菌法,環氧乙烷等化學滅菌法,以及鈷-60等伽馬射線滅菌法均存在重大缺陷,其滅菌方式有的滅菌效果欠佳,有的對不同質地中藥中所含有的不同結構類型的有效成分產生破壞和部分化學性質改變,有的留有核物質殘留,有的則存在污染因素等等。
直接口服中藥飲片是近年來國家剛剛定義的一類新型的現代中藥飲片,除了《中國藥典》2015版四部對直接口服飲片列有微生物限度標準外,至今仍然沒有國家統一的直接口服中藥飲片質量執行標準,夏天無(粉)產品也不例外。此外,由于每味中藥所含有的不同類型結構的化學成分非常復雜,加之產地不同,品質不一樣,其含量質量要求往往是以其指標成分或有效成分的含量達到某一值以上(毒性成分除外),加上有效成分大都儲存其細胞內,如此種種原因,夏天無粉作為藥品,至今仍未有數據性,科學性的“有效期”。
技術實現要素:
本發明的目的是克服現有技術的不足,提供一種夏天無粉直接口服中藥飲片。
本發明的夏天無粉直接口服中藥飲片,其制備工藝特征如下:
1)將夏天無原藥材檢驗、凈制、干燥后粉碎,得到中間體;
2)檢驗中間體,包裝后進行電子束輻照滅菌;
3)進行成品標準檢驗,包裝后得到成品;
所述的步驟1)中,粉碎條件如下:在d級潔凈區,應用吸塵式低溫粉碎技術,將夏天無原藥材粉碎成100-300目;
所述的步驟2)中,電子束輻照滅菌的照射劑量為3-10kgy。
優選地,
所述的步驟1)中,粉碎條件如下:在d級潔凈區,應用吸塵式低溫粉碎技術,將夏天無原藥材粉碎成200-300目。
所述的步驟2)中,電子束輻照滅菌的照射劑量為5kgy。
本發明是引用現代天然藥物分析手段和方法,模擬人體體溫37℃,對不同細度(篩目數)的夏天無粉進行水浸實驗(可較為真實地反映夏天無粉在體內溶出或釋放可供吸收的成分情況),在相同的10、30、60、90和120分鐘的各時間段內,不同細度的夏天無粉分別以水浸出物總量及水浸出物中所含原阿片堿和鹽酸巴馬汀的溶出總量為指標,確定了『夏天無粉』的最佳粉碎細度,以及利用快速、低溫、高效、無污染、無殘留和不會破壞有效成分的電子束輻照滅菌技術的最佳gmp生產工藝。同時,建立了符合現行國家相關藥品標準的『夏天無粉』直接口服中藥飲片的質量執行標準。本發明可使夏天無(粉)產品較《中國藥典》的細粉標準(100目)的水浸出物總量及水浸出物中原阿片堿和鹽酸巴馬汀水溶出總量提高15~35%(每6克『夏天無粉』產品第一次可溶出被體內吸收的純原阿片堿和鹽酸巴馬汀的總量達9.15毫克以上),微生物限度檢驗結果則能完全符合相關直接口服飲片的標準,同時,通過新藥加速考察實驗方法,以『夏天無粉』中的總生物堿含量為指標,初步考察了其產品的【有效期】。
附圖說明
圖1為夏天無粉(6克)不同細度滅菌前后水浸泡(37±1℃)浸出物重量(毫克)比較;
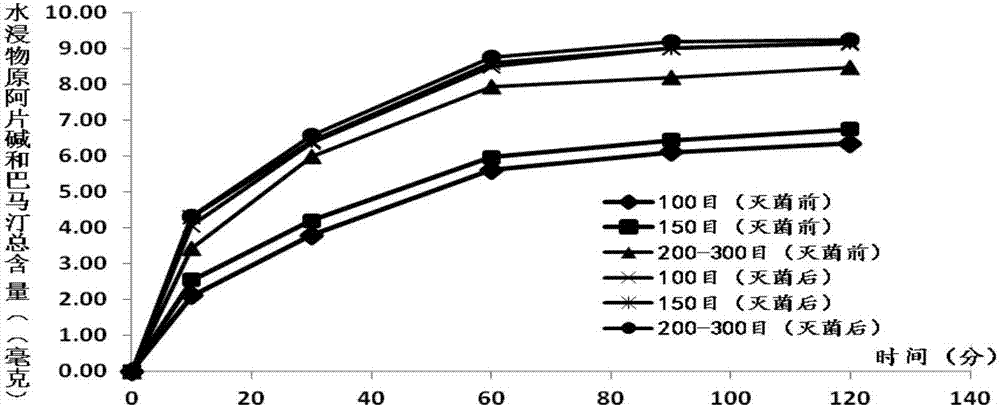
圖2為夏天無粉(6克)不同細度滅菌前后水浸泡(37±1℃)浸出物原阿片堿和鹽酸巴馬汀重量(毫克)比較;
圖3為夏天無粉經電子束輻照滅菌(5kgy,室溫)工藝處理前后hplc特征圖譜(分析柱:phenomenex,c18,3μm,4.6x250mm);
圖4為夏天無粉經電子束輻照滅菌(5kgy)工藝處理與未經處理的夏天無粉產品不同貯藏(40±2℃)時間hplc特征圖譜(分析柱:phenomenex,c18,3μm,4.6x250mm)
圖5為夏天無粉的加速穩定性考察。
圖6為夏天無粉的特征圖譜。
表1為夏天無粉(100目,6克)滅菌前水浸(37±1℃)浸出物重量(毫克);
表2為夏天無粉(150目,6克)滅菌前水浸(37±1℃)浸出物重量(毫克);
表3為夏天無粉(200-300目,6克)滅菌前水浸(37±1℃)浸出物重量(毫克);
表4為夏天無粉(100目,6克)滅菌后水浸(37±1℃)浸出物重量(毫克);
表5為夏天無粉(150目,6克)滅菌后水浸(37±1℃)浸出物重量(毫克);
表6為夏天無粉(200-300目,6克)滅菌后水浸(37±1℃)浸出物重量(毫克);
表7為夏天無粉(100目,6克)滅菌前水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀含量(毫克);
表8為夏天無粉(150目,6克)滅菌前水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀含量(毫克);
表9為夏天無粉(200-300目,6克)滅菌前水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀含量(毫克);
表10為夏天無粉(100目,6克)滅菌后水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀含量(毫克);
表11為夏天無粉(150目,6克)滅菌后水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀含量(毫克);
表12為夏天無粉(150目,6克)滅菌后水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀含量(毫克);
表13為電子束照射劑量對不同細度(篩目)的夏天無粉的滅菌效果;
表14為夏天無粉微生物限度穩定性檢查;
表15為夏天無粉滅菌后原阿片堿和鹽酸巴馬汀含量(%);
表16為夏天無粉滅菌前原阿片堿和鹽酸巴馬汀含量(%)。
具體實施方式
本發明中,夏天無粉xiatianwufen說明如下:
【來源】本品為罌粟科紫堇屬多年生草本伏生紫堇corydalisdecumbens(thunb.)pers.的干燥塊莖
【炮制】本品按《中國藥典》2015年版夏天無【炮制】項下規范經凈制、干燥(離地)、碰碎、粉碎、干燥、包裝、滅菌等工藝制成的小包裝夏天無粉(直接口服中藥飲片)。
【成品性狀】本品為淺黃棕色粉末。氣微,味苦。
【裝量差異】±7%。
【鑒別】
(1)本品粉末淺黃棕色。下表皮厚壁細胞成片,淡黃棕色,細胞呈類長方形或不規則形,壁稍厚,呈斷續的連珠狀,常具壁孔。薄壁細胞淡黃色或幾無色,呈類方形或類圓形;螺紋導管或網紋導管細小。淀粉粒單粒類圓形或長圓形,直徑5~16pm,臍點點狀或飛鳥狀,復粒由2~6分粒組成。糊化淀粉粒隱約可見,或經水合氯醛透化可見糊化淀粉粒痕跡。
(2)取本品粗粉4g,加1%碳酸鈉溶液25ml,置近沸的水浴中浸潰5分鐘,濾過,濾液用稀鹽酸調節ph值至6,加三氯甲烷15ml振搖提取,分取三氯甲烷液2ml,加硫酸1ml,振搖,硫酸層即顯棕紅色,放置后顯棕黑色。
(3)取本品粉末4g,加三氯甲烷-甲醇-濃氨試液(5:1:0.1)混合溶液40ml,超聲處理30分鐘,濾過,濾液濃縮至干,殘渣加甲醇2ml使溶解,作為供試品溶液。另取原阿片堿對照品,加三氯甲烷制成每lml含2mg的溶液,作為對照品溶液。照薄層色譜法(通則0502)試驗,吸取上述兩種溶液各5ul,分別點于同一硅膠g薄層板上,以環己烷-乙酸乙酯-二乙胺(16:3:1)為展開劑,預飽和15分鐘,展開,取出,晾干,噴以稀碘化鉍鉀試液。供試品色譜中,在與對照品色譜相應的位置上,顯相同顏色的斑點。
【檢查】
水分不得過15.0%(《中國藥典》2015年版四部通則0832第二法)。
總灰分不得過5.0%(《中國藥典》2015年版四部通則2302)。
二氧化硫殘留量照二氧化硫殘留量測定法(《中國藥典》2015年版四部通則2331)測定,不得過150mg/kg。
【浸出物】照醇溶性浸出物測定法(《中國藥典》2015年版四部通則2201)項下的熱浸法測定,用乙醇作溶劑,不得少于8.0%。
【含量測定】照高效液相色譜法(《中國藥典》2015年版四部通則0512)測定。
色譜條件與系統適用性試驗以十八烷基硅烷鍵合硅膠為填充劑;以乙腈-三乙胺醋酸溶液(取三乙胺8ml,冰醋酸30ml,加水稀釋至1000)(18:32)為流動相,原阿片堿的檢測波長為289nm,鹽酸巴馬汀的檢測波長為345nm。理論板數按原阿片堿和鹽酸巴馬汀峰計算均不低于3000。
對照品溶液的制備取原阿片堿對照品10mg,精密稱定,置50ml量瓶中,加1%鹽酸溶液5ml使溶解,再加甲醇至刻度,搖勻。另取鹽酸巴馬汀對照品10mg,精密稱定,置100ml量瓶中,加甲醇溶解并稀釋至刻度,搖勻。精密量取上述兩種溶液各5ml,置同一25ml量瓶中,加甲醇至刻度,搖勻,即得(每lml含原阿片堿40ug、鹽酸巴馬汀20ug)。
供試品溶液的制備取本品細粉約0.5g,精密稱定,置具塞錐形瓶中,精密加入甲醇50ml,稱定重量,加熱回流1小時,放冷,再稱定重量,用甲醇補足減失的重量,搖勻,濾過,取續濾液,即得。
測定法分別精密吸取對照品溶液與供試品溶液各10μl,注入液相色譜儀,測定,即得。
本品按干燥品計算,,含原阿片堿(c20h19no5)不得少于0.30%,鹽酸巴馬汀(c21h21no4·hc1)不得少于0.080%。
【特征圖譜】按【含量測定】方法,測定高效液相色譜(hplc)的特征圖譜。如圖6所示。
【微生物限度檢查】需氧菌總數可接受的最大菌數為103cfu/g;霉菌和酵母菌總數可接受的最大菌數為102cfu/g;不得檢出沙門菌(10g);耐膽鹽革蘭陰性菌應小于104cfu(1g)。
【性味與歸經】苦、微辛,溫。歸肝經。
【功能與主治】活血止痛,舒筋活絡,祛風除濕。用于中風偏癱,頭痛,跌撲損傷,風濕痹痛,腰腿疼痛。
【規格】每袋6克。
【用法與用量】6~12g;粉末分3次服。
【貯藏】置通風干燥處
【有效期】五年。
編制依據:《中國藥典》2015年版一部夏天無項下標準,以及《中國藥典》2015年版四部相關標準;
裝量差異依據《中國藥典》2015年版四部通則0115散劑項下標準,本品規格為每袋6克,根據散劑項下標示示裝量:1.5g以上至6g,裝量差異限度應為±7%。
微生物限度檢查依據《中國藥典》2015年版四部通則1107非無菌藥品微生物限度標準,非無菌藥品的需氧菌總數、霉菌和酵母菌總數照“非無菌產品微生物限度檢查:微生物計數法(通則1105)”檢査;非無菌藥品的控制菌照“非無菌產品微生物限度檢査:控制菌檢查法(通則1106)”檢查。
實施例1
夏天無原藥材120公斤,分3個實驗批次(每批次40.0公斤),按藥品gmp規范,分別經凈制、干燥、粉碎(d級潔凈區,應用吸塵式低溫粉碎技術,分別粉碎成100、150、200-300目)、中間體(檢驗)、定量包裝(6克/袋,d級潔凈區)、電子束輻照滅菌(每批次剩下定量包裝的30%不進行滅菌工序),所得到的產品(供試品)供本發明的夏天無粉最佳gmp生產工藝及其質量標準實驗研究用。
1﹑『夏天無粉』直接口服中藥飲片產品的最佳生產工藝:
(1)最佳細度(篩目數)生產工藝:
夏天無根莖細胞大小為直經十幾至幾十微米,處于《中國藥典》相應200篩目標準以內。《中國藥典》2015版一部夏天無【炮制】項下的飲片產品夏天無粉的細度標準是細粉,即100目,遠大于夏天無細胞直經,由此,細胞內的有效成分不易溶出或釋放,使夏天無的有效成分在體內不能完全被吸收或吸收不完全,其結果是即影響了夏天無對心血管恢復的功能和臨床療效,又浪費了夏天無原藥材的資源。
本項發明的產品是基于模擬人體體溫37℃,對不同細度(目數)的夏天無粉進行水浸實驗,如此可較為真實地反映夏天無粉在體內溶出或釋放可供吸收的成分情況。在相同的10、30、60、90和120分鐘(水溫保持37±1℃)的各時間段內,經吸塵式低溫粉碎技術粉碎成不同細度的夏天無粉分別以水浸出物總量及水浸出物中原阿片堿(c20h19no5)和鹽酸巴馬汀(c21h21no4·hc1)的溶出總量為指標,得出的數據指明并確定『夏天無粉』在200-300目(篩目數)下為的最佳粉碎細度。
通過上述實驗研究(見表1-3、表7-9,圖1-2),其結果顯示:應用本發明的研究成果,在37±1℃水中,夏天無粉的水浸出物總量(毫克)及水浸出物中原阿片堿(c20h19no5)和鹽酸巴馬汀(c21h21no4·hc1)的溶出總量(毫克)隨著夏天無粉的細度增加(100目,150,200-300目)而增加,200-300目細度的水浸出物總量(毫克)及夏天無原阿片堿(c20h19no5)和鹽酸巴馬汀(c21h21no4·hc1)溶出總量(毫克)較相應的未經電子束輻照提高35~45%。上述實驗結果表明,電子束輻照可使夏天無粉的細胞產生裂痕或裂開,細胞內容物可以通過新的通道浸出。
(2)電子束輻照滅菌工藝
電子束輻照滅菌技術已非常成熟,用電子加速器產生的高能電子束照射可使一些物質產生物理、化學和生物學效應,并能有效地殺滅病菌、病毒和害蟲。這一技術已被廣泛應用于工業生產中的材料改性、新材料制作、環境保護、加工生產、醫療衛生用品滅菌消毒和食品滅菌保鮮等。它同鈷源輻照一樣,具有常溫、無損傷、無殘毒、環保、低能耗、運行操作簡便、自動化程度高、適宜于大規模工業化生產等特點。與鈷源相比,其最大優點是輻照束流集中定向,能源利用充分,輻照效率高,不產生放射性廢物。電子加速器輻照裝置具有明顯的價格和經濟優勢。為指導和規范輻照技術在中藥滅菌中的正確應用,保證中藥藥品的安全、有效、質量穩定,國家食品藥品監督管理總局于2015年11月制定了《中藥輻照滅菌技術指導原則》,對中藥輻照滅菌應進行中藥個體的和針對性的輻照前后的對比研究,包括所含成分種類或含量的變化情況、指紋或特征圖譜的對比研究等等。基于上述指導原則,本項發明對夏天無粉電子束輻照滅菌的照射劑量、滅菌效果,以及滅菌前后指紋或特征圖譜、水浸出物重量、夏天無原阿片堿和鹽酸巴馬汀總含量的變化進行了詳細的考察研究。
①電子束輻照滅菌的照射劑量及滅菌效果:
分別使用3、5、10kgy的照射劑量對不同目數(100、150、200-300目)的夏天無粉(6克/袋)進行照射,并進行照射前后滅菌效果考察(見表13)。
結果表明,本項發明引用不同輻照劑量即3、5、10kgy的電子束照射劑量完全能達到《中國藥典》2015版四部對直接口服飲片的微生物限度標準。為減少輻照對夏天無粉所含成分種類及含量變化可能造成的影響,根據本項發明滅菌數據表明并確定夏天無粉的電子束輻照滅菌的最佳制備工藝輻照劑量為5kgy。
②電子束輻照滅菌對夏天無粉水浸出物量及原阿片堿和鹽酸巴馬汀溶出量的影響:
高能電子束輻照可使一些生物細胞體產生物理、化學和生物學效應,尤其是能使細胞壁產生留痕或破碎,促進細胞內容物溶出。
按《中國藥典》2015年版一部夏天無項下含量測定方法,分別測定100、150、200-300目的夏天無粉(6克)電子束輻照滅菌前后水浸出物總量(毫克)及水浸出物中原阿片堿(c20h19no5)和鹽酸巴馬汀(c21h21no4·hc1)的溶出總量(毫克),本發明考察了電子束輻照滅菌對夏天無粉水浸出物量及總皂苷溶出量的影響(見表1-12,圖1-2)。結果顯示,應用本發明的電子束輻照(3kgy照射劑量)滅菌工藝,可顯著提高相應的不同細度的夏天無粉的水浸出物量及總皂苷溶出量(p﹤0.05或0.01)(200-300目除外,因為在此細度,大部分夏天無細胞都已破碎)。
③電子束輻照滅菌對夏天無粉有效期的影響:
為考察電子束輻照滅菌對夏天無粉所含成分種類或含量的變化、質量的長期穩定性等與產品的有效期有關因素的影響,本發明應用新藥的加速穩定性的研究方法,在40±2℃溫度及65%相對濕度的環境中存放9個月,每個月按質量標準中的含量測定方法,測定夏天無中的原阿片堿和鹽酸巴馬汀的總含量,同時,選擇不同月份,依直接口服飲片微生物限度檢查方法對夏天無粉微生物限度進行檢驗,測定結果說明(見表14-16,圖3-5),電子束輻照滅菌工藝對『夏天無粉』產品的長期穩定性沒有影響,應用本發明gmp生產工藝的生產的『夏天無粉』直接口服飲片產品的有效期可達10年。
2﹑『夏天無粉』直接口服中藥飲片質量標準:
本發明旨在建立高于《中國藥典》2015版一部夏天無項下、《中國藥典》2015版四部相關直接口服中藥飲片標準、新置入夏天無粉的高效液相(hplc)特征圖及有效期的『夏天無粉』直接口服中藥飲片質量執行標準,以確保『夏天無粉』直接口服中藥飲片質量。
在《中國藥典》2015版一部夏天無項下的質量執行標準為普通飲片標準,依照該項下標準、《中國藥典》2015版四部直接口服飲片微生物限度檢查標準以及相關標準,制定了完全符合現行國家有關直接口服飲片藥品標準的『夏天無粉』直接口服中藥飲片的質量執行標準。
按『夏天無粉』直接口服中藥飲片質量標準各項下要求,檢驗連續生產的三個批次的『夏天無粉』產品,均應符合規定。
表1、夏天無(粉)(100目,6克)滅菌前水浸(37±1℃)浸出物重量(毫克)
表2、夏天無(粉)(150目,6克)滅菌前水浸(37±1℃)浸出物重量(毫克)
表3、夏天無(粉)(200~300目,6克)滅菌前水浸(37±℃)浸出物重量(毫克)
表4、夏天無(粉)(100目,6克)滅菌后水浸(37±1℃)浸出物重量(毫克)
表5、夏天無(粉)(150目,3克)水浸滅菌后(37±℃)浸出物重量(毫克)
表6、夏天無(粉)(200~300目,3克)滅菌后水浸(37±1℃)浸出物重量(毫克)
表7、夏天無(粉)(100目,6克)滅菌前水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀總含量(毫克)
表8、夏天無(粉)(150目,6克)滅菌前水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀總含量(毫克)
表9、夏天無(粉)(200-300目,6克)滅菌前水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀總含量(毫克)
表10、夏天無(粉)(100目,6克)滅菌后水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀總含量(毫克)
表11、夏天無(粉)(150目,6克)滅菌后水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀總含量(毫克)
表12、夏天無(粉)(200-300目,6克)滅菌后水浸出物(37±1℃)原阿片堿和鹽酸巴馬汀總含量(毫克)
- 還沒有人留言評論。精彩留言會獲得點贊!