一種腫瘤靶向雙載藥納米載體及其制備方法與流程
本發明屬于生物醫學工程材料領域,具體的說,涉及一種腫瘤靶向雙載藥納米載體及其制備方法。
背景技術:
據統計,惡性腫瘤是僅次于心腦血管疾病的第二大殺手,目前絕大多數的患者是通過手術切除、放射治療和化學藥物進行治療。這些療法對早期腫瘤患者可獲得快速有效的治療效果,但對晚期伴有局部擴散和轉移的患者,并未能顯著延長患者的生存期和改善患者的生存質量,且毒副作用較大。近年來,研究發現,癌癥是一種基因病,是人體細胞在外環境因素的作用下,內在多種前癌基因被激活和抑癌基因失活的多階段長期演變的過程。因此,將化學藥物治療與基因治療結合,對提高腫瘤治療效果有著重要意義。
基因治療需要借助合適的載體將外源基因導入靶細胞中,使基因藥物能夠跨越體內環境的各種屏障,將其輸送至靶細胞,實現藥物的高效表達。其中,具有核-殼結構的聚合物自組裝納米體系,因其藥物負載能力高、適用藥物范圍較廣、粒徑小且分布非常窄等優點,在基因藥物輸送體系中具有良好的應用前景。然而,現有的聚合物自組裝納米體系仍存在腫瘤特異性較低、細胞毒性較大、生物降解慢、無法控制藥物釋放等問題,限制了其應用。
技術實現要素:
為了克服現有技術的缺點與不足,本發明的首要目的是提供一種腫瘤靶向雙載藥納米載體,其能夠同時將化療藥物和基因藥物靶向運送至腫瘤組織中,并具有藥物包封率高、腫瘤靶向性強、細胞毒性低等優點。
本發明的另一目的是提供所述腫瘤靶向雙載藥納米載體的制備方法。
本發明的目的通過下述技術方案實現:
一種腫瘤靶向雙載藥納米載體,是由聚己內酯(pcl)、聚酰胺-胺型樹枝狀高分子(pamam)、聚乙二醇(peg)與多肽組裝而成的陽離子型聚合物納米載體。
本發明所述的腫瘤靶向雙載藥納米載體,是以聚己內酯(pcl)為內核、以聚酰胺-胺型樹枝狀高分子(pamam)為外殼,經自組裝聚合形成的聚合物納米載體;疏水性的pcl內核能夠包裹疏水性藥物,pamam外殼能夠通過靜電作用攜載基因藥物,從而形成雙載藥載體,發揮藥物協同效果。pamam外殼表面經peg和多肽修飾,能夠顯著降低高電荷密度的pamam所導致的細胞毒性;表面peg修飾還能阻止人體內皮網狀系統對本納米載體的捕獲和清除作用,延長血液循環時間,提高藥物作用效果;而表面多肽修飾則能提高腫瘤靶向性,并提高腫瘤細胞對本納米載體的攝取量,提高腫瘤靶向治療效果。本發明所述的腫瘤靶向雙載藥納米載體,能夠作為腫瘤靶向雙載藥遞釋系統,并具有水溶性好、生物相容性好、易降解,藥物包封率高,腫瘤靶向性強,細胞毒性低等優點。
進一步地,所述的聚己內酯(pcl)為含有雙硫鍵的聚己內酯。
細胞內環境的谷胱甘肽(gsh)濃度(2~10mm)遠遠高于細胞外環境的谷胱甘肽濃度(2~20μm),本發明采用含有雙硫鍵的聚己內酯,其在細胞外環境能夠穩定地負載藥物,而進入細胞后在谷胱甘肽的還原作用下發生斷裂,一方面能夠實現藥物的靶向釋放,另一方面能夠促進本納米載體的體內降解,顯著降低本納米載體對細胞功能的不良影響。
進一步地,所述的聚酰胺-胺型樹枝狀高分子(pamam)是末端帶有氨基、以乙二胺為核的1.0、2.0或3.0代的聚酰胺-胺型樹枝狀高分子(即pamam-g1、pamam-g2或pamam-g3)。
本發明采用pamam-g1、pamam-g2或pamam-g3,能夠提高本納米載體對基因藥物的載藥量,同時能夠避免本納米載體的分子結構過大而影響藥物遞送和細胞攝取效果,還能避免本納米載體表面過高的電荷密度對細胞造成損害。
進一步地,所述的多肽為轉鐵蛋白受體特異性多肽。所述的轉鐵蛋白受體特異性多肽包括t7多肽。
本發明采用t7多肽等轉鐵蛋白受體特異性多肽,能夠特異性結合腫瘤細胞表面高表達的轉鐵蛋白受體,能夠顯著提高本納米載體的腫瘤靶向性和細胞攝取量,從而提高腫瘤的藥物攝取效率和治療效果。
本發明所述的腫瘤靶向雙載藥納米載體的制備方法,包括以下操作步驟:
1)采用含有雙硫鍵的胱胺引發ε-己內酯反應,制備具有雙硫鍵的雙羥基聚己內酯;
2)采用丙烯酰氯作封端處理,制備丙烯酸酯封端的雙羥基聚己內酯;
3)采用丙烯酸酯封端的雙羥基聚己內酯與聚酰胺-胺型樹枝狀高分子進行酰胺反應,制備聚己內酯-聚(酰胺-胺)聚合物;
4)將聚己內酯-聚(酰胺-胺)聚合物與雙嵌段聚乙二醇及多肽進行反應,制備本發明所述的腫瘤靶向雙載藥納米載體。
進一步地,本發明所述的腫瘤靶向雙載藥納米載體的制備方法,具體包括以下操作步驟:
1)制備具有雙硫鍵的雙羥基聚己內酯:
將具有雙硫鍵的胱胺和ε-己內酯溶解于干燥的甲苯中,在無水無氧條件下緩慢滴加入催化劑,滴加完后在氮氣環境中冷凝回流反應,反應結束后除去未反應的甲苯,再用冷乙醚沉淀,干燥,得到具有雙硫鍵的雙羥基聚己內酯;
2)制備丙烯酸酯封端的雙羥基聚己內酯:
將三乙胺、丙烯酰氯分別溶于干燥的甲苯中,將步驟1)制得的雙羥基聚己內酯置于冰浴中,然后在避光、真空及氮氣保護下依次緩慢滴加三乙胺和丙烯酰氯的甲苯溶液,滴加完后在氮氣環境中冷凝回流反應,反應結束后過濾除去三乙胺鹽酸鹽結晶,濾液在過量的冷正己烷中沉淀,抽濾,干燥,得到丙烯酸酯封端的雙羥基聚己內酯;
3)制備聚己內酯-聚(酰胺-胺)聚合物:
將聚酰胺-胺型樹枝狀高分子和步驟2)制得的雙羥基聚己內酯分別溶于氯仿中,將雙羥基聚己內酯的氯仿溶液滴加入聚酰胺-胺型樹枝狀高分子的氯仿溶液中,在真空及氮氣保護下冷凝回流反應,反應結束后在三氯甲烷中進行透析處理,再用過量的冷石油醚沉淀,將所得到的白色沉淀用二氯甲烷溶解后緩慢滴加到去離子水中攪拌過夜,揮發有機溶劑后,冷凍干燥,得到聚己內酯-聚(酰胺-胺)聚合物;
4)制備所述的腫瘤靶向雙載藥納米載體:
將步驟3)制得的聚己內酯-聚(酰胺-胺)聚合物溶于磷酸鹽緩沖液中,調節ph值,加入雙嵌段聚乙二醇,在室溫下攪拌反應,制得聚己內酯-聚(酰胺-胺)-聚乙二醇聚合物;再次調節ph值,加入多肽的磷酸鹽緩沖液,在室溫下攪拌反應,反應結束后進行超濾處理,冷凍干燥,得到所述的腫瘤靶向雙載藥納米載體。
本發明所述腫瘤靶向雙載藥納米載體的制備方法,通過胱胺引發ε-己內酯進行開環聚合反應,形成帶有雙硫鍵的雙羥基聚己內酯(ho-pcl-ss-pcl-oh),再通過邁克爾加成反應將丙烯酰化的雙羥基聚己內酯接枝到聚酰胺-胺型樹枝狀高分子(pamam)的伯氨基上,然后可通過疏水端與親水端的相互排斥作用,形成具有疏水性內核和親水性外殼的納米載體。本發明的制備方法,具有工藝簡單、反應溫和、副反應少、無需特殊處理等優點,可適用于規模化生產。
進一步地,在步驟1)中,所述的催化劑為異辛酸亞錫或氯化亞錫;所述的胱胺、ε-己內酯與催化劑的摩爾比為1:(100~200):(0.05~0.1);所述的胱胺在反應體系中的濃度為5~20mg/ml;所述的冷乙醚與反應體系溶液的體積比為(10~20):1。
進一步地,在步驟2)中,所述的雙羥基聚己內酯與丙烯酰氯、三乙胺的摩爾比為1:(4.2~10):(4.2~10);所述的雙羥基聚己內酯在反應體系中的濃度為10~50mg/ml;所述的冷正己烷與反應體系溶液的體積比為(5~10):1。
進一步地,在步驟3)中,所述的聚酰胺-胺型樹枝狀高分子與雙羥基聚己內酯的摩爾比為(4~10):1;所述的雙羥基聚己內酯在反應體系中的濃度為0.8~8mmol/l;所述透析處理的截留分子量為8000~14000;所述的冷乙醚與反應體系溶液的體積比為(2~10):1。
進一步地,在步驟4)中,所述的雙嵌段聚乙二醇是末端基團為馬來酰亞胺基(mal)和n-羥基丁二酰亞胺基(nhs)的雙嵌段聚乙二醇;所述的ph值調節為7.8~8.2;所述的雙嵌段聚乙二醇與步驟3)的雙羥基聚己內酯的摩爾比為(1~10):1;所述的聚己內酯-聚(酰胺-胺)聚合物在反應體系中的濃度為8~80mmol/l;所述的多肽與聚己內酯-聚(酰胺-胺)-聚乙二醇聚合物的質量比為1:(1~5);所述的多肽在反應體系中的濃度為0.5~2.5mg/ml;所述的ph值再次調節為6.0~7.0。
附圖說明
圖1是實施例1制得的具有雙硫鍵的雙羥基聚己內酯的核磁氫譜圖;
圖2是實施例2制得的丙烯酸酯封端的雙羥基聚己內酯的核磁氫譜圖;
圖3是實施例4制得的聚己內酯-聚(酰胺-胺)-聚乙二醇的核磁氫譜圖;
圖4是實施例4制得的腫瘤靶向雙載藥納米載體的核磁氫譜圖。
具體實施方式
下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
實施例1:制備具有雙硫鍵的雙羥基聚己內酯(pcl)
將具有雙硫鍵的胱胺和ε-己內酯溶解于干燥的甲苯中,在無水無氧條件下20min緩慢滴加入催化劑異辛酸亞錫,滴加完后在氮氣環境中110℃下冷凝回流反應18h,反應過程中磁力攪拌,轉速為300rpm;反應結束后40℃旋蒸除去甲苯溶劑,再用冷乙醚沉淀,然后40℃真空干燥12h,得到具有雙硫鍵的雙羥基聚己內酯(pcl)。
其中,胱胺的質量是200mg;甲苯的總體積是10ml;胱胺、ε-己內酯、異辛酸亞錫的摩爾比為1:132:0.05;冷乙醚與反應體系溶液的體積比為10:1。
將制得的具有雙硫鍵的雙羥基聚己內酯(pcl)溶解于氘代氯仿中進行核磁氫譜表征。如圖1所示,化學位移在4.08、2.33、1.40、1.67ppm處的峰均為己內酯開環后五個亞甲基氫的特征峰,其中4.08ppm代表與氧相連的亞甲基氫的特征峰,2.33ppm代表與羰基相連的亞甲基氫的特征峰;3.55ppm處的峰為與胱胺相連的亞甲基的氫峰。圖1核磁氫譜結果證明,本實施例制備得到了所述的具有雙硫鍵的雙羥基聚己內酯(pcl)。
實施例2:制備丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate):
將三乙胺、丙烯酰氯分別溶于干燥的甲苯中,向實施例1制備得到的具有雙硫鍵的雙羥基聚己內酯(pcl)中先抽真空通氮氣,再依次將三乙胺和丙烯酰氯的甲苯溶液在冰浴和避光的條件下30min緩慢滴加其中;80℃冷凝回流8h,反應過程中磁力攪拌,轉速為300rpm,反應結束后,反應液過濾除去三乙胺鹽酸鹽結晶,濾液在過量的冷正己烷中沉淀,抽濾,收集白色粉末產物,最后40℃真空干燥24h,得到丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)。
其中,實施例1制得的具有雙硫鍵的雙羥基聚己內酯(pcl)的質量是200mg;具有雙硫鍵的雙羥基聚己內酯(pcl)與丙烯酰氯、三乙胺的摩爾比為1:10:10;甲苯的總體積為10ml;冷正己烷和反應體系溶液的體積比為10:1。
將制得的丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)溶解于氘代氯仿中進行核磁表征。如圖2所示,化學位移在5.85ppm和6.40ppm處出現了亞甲基的兩個β-h特征峰,化學位移在6.14ppm處出現的亞甲基的α-h特征峰。圖2核磁氫譜結果證明,本實施例制備得到了所述的丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)。
實施例3:制備聚己內酯-聚(酰胺-胺)聚合物(pcl-pamam)
將聚酰胺-胺型樹枝狀高分子(pamam)和實施例2制得的丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)分別溶于氯仿中,聚酰胺-胺型樹枝狀高分子(pamam)在55℃和氮氣環境下完全溶解,然后將丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)的氯仿溶液于30min內緩慢滴加入至聚酰胺-胺型樹枝狀高分子(pamam)的氯仿溶液中,抽真空,通氮氣,55℃下冷凝回流反應24h,反應過程中磁力攪拌,轉速為300rpm;反應結束后,在三氯甲烷中使用截留分子量為10000的透析袋透析1天,透析掉未反應的單體,再用過量的冷石油醚沉淀,得到白色沉淀,再用少量二氯甲烷溶解后,緩慢滴加到去離子水中,攪拌過夜,揮發有機溶劑后,冷凍干燥48h,得到所述的聚己內酯-聚(酰胺-胺)聚合物(pcl-pamam)。
其中,丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)的質量是71.6mg(0.0056mmol);聚酰胺-胺型樹枝狀高分子(pamam)與丙烯酸酯封端的雙羥基聚己內酯(pcl-acrylate)的摩爾比為5:1;氯仿的總體積為7ml;冷石油醚與反應體系溶液的體積比為10:1;二氯甲烷的體積為1ml;去離子水的用量為二氯甲烷溶解液的質量的30倍。
實施例4:制備本發明所述的腫瘤靶向雙載藥納米載體
將實施例3制得的聚己內酯-聚(酰胺-胺)聚合物(pcl-pamam)溶于適量ph=7.4的磷酸鹽緩沖液中,調節ph=8,再加入雙嵌段聚乙二醇(peg),室溫下攪拌反應12h,得到聚己內酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)。
其中,所述的雙嵌段聚乙二醇是末端基團為馬來酰亞胺基(mal)和n-羥基丁二酰亞胺基(nhs)的雙嵌段聚乙二醇;聚己內酯-聚(酰胺-胺)聚合物(pcl-pamam)與雙嵌段聚乙二醇(peg)的摩爾比為1:5;聚己內酯-聚(酰胺-胺)聚合物(pcl-pamam)在反應體系中的濃度是8mmol/l;磷酸鹽緩沖液的體積為5ml。
將制得的聚己內酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)的溶解于重水中進行核磁氫譜表征。如圖3所示,化學位移在2.50ppm-2.86ppm處出現了亞甲基的h特征峰,為聚酰胺-胺型樹枝狀高分子(pamam)的特征峰,化學位移在3.67ppm處出現的亞甲基的h特征峰,為聚乙醇(peg)的特征峰。圖3核磁氫譜結果證明,本實施例制備得到了聚己內酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)。
將聚己內酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)溶于適量磷酸鹽緩沖液中,調節ph=6;將多肽t7溶于適量磷酸鹽緩沖液中,加入到該聚己內酯-聚(酰胺-胺)-聚乙二醇(pcl-pamam-peg)磷酸鹽緩沖液中,在常溫下攪拌反應2h,然后轉移到mwco10000超濾離心管中,以12000rpm超濾30min,去除未反應的聚合物和多肽,冷凍干燥24h后,制得本發明所述的腫瘤靶向雙載藥納米載體(pcl-pamam-peg-t7)。
其中,多肽t7與聚己內酯-聚乙烯亞胺-聚乙二醇(pcl-pei-peg)的質量比為1:1;多肽在反應體系中的濃度為0.5mg/ml。
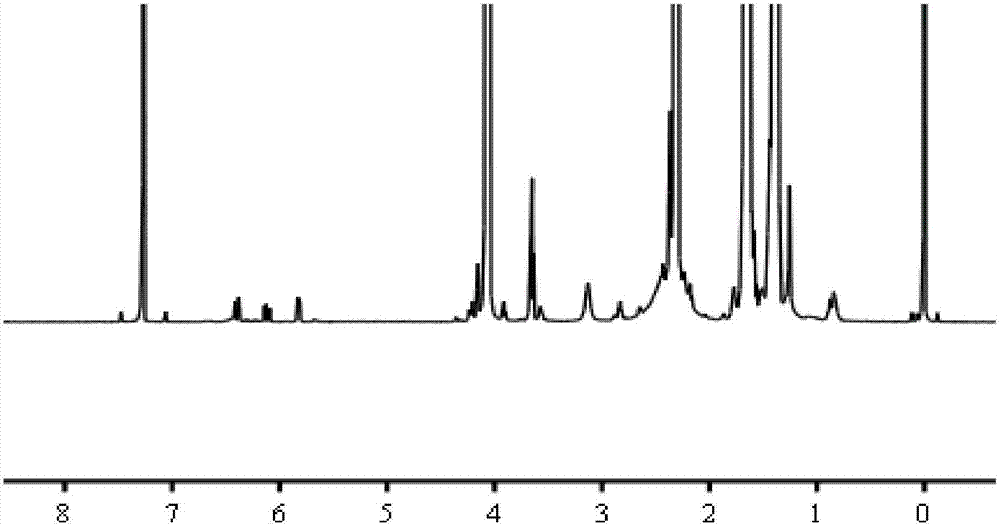
將本實施例制得的腫瘤靶向雙載藥納米載體溶解于重水中進行核磁氫譜表征。如圖4所示,圖4a的化學位移在6.7ppm處出現了peg上的mal基團特征峰,但圖4b中化學位移在6.7ppm處的mal基團特征峰消失了,而化學位移在3.5ppm處的存在尖銳的特征峰,證明聚乙二醇(peg)上的mal基團與t7上的巰基已成功連接。圖4核磁氫譜結果證明,本實施例制備得到了所述的腫瘤靶向雙載藥納米載體(pcl-pei-peg-t7)。
實施例5:本發明所述的腫瘤靶向雙載藥納米載體的性能測試
1、細胞毒性測試
取實施例4制得的腫瘤靶向雙載藥納米載體(pcl-pei-peg-t7),分別用pbs配制成0.01mg/ml、0.05mg/ml、0.1mg/ml、0.2mg/ml、0.3mg/ml、0.4mg/ml、0.5mg/ml的載體溶液。在96孔培養板中分別接種1×104個hela細胞/孔,培養過夜,吸去培養基后用pbs洗滌2次,然后分別加入上述濃度的載體溶液,每孔100μl,并以未接種細胞的孔為空白孔,未加入載體溶液的細胞孔為對照孔,37℃、5%co2培養4小時。培養結束后,采用酶標儀測定各孔在450nm處的od值,計算細胞存活率。實驗結果表明,各測試孔的細胞存活率均在80%以上,表明本發明制得的腫瘤靶向雙載藥納米載體(pcl-pei-peg-t7)對細胞無毒性作用,生物相容性好。
2、谷胱甘肽還原敏感性測試
取實施例4制得的腫瘤靶向雙載藥納米載體(pcl-pei-peg-t7),溶解于適量的水溶液中,平均分成六份,分別加入0.1mm、0.5mm、1mm、2mm、5mm、10mm的谷胱甘肽水溶液,在37℃水浴下攪拌反應15分鐘,反應結束后分別測定各納米載體溶液的粒徑。實驗結果表明,所加入谷胱甘肽水溶液的濃度大于1mm時,納米載體的粒徑發生明顯變化,表明納米載體中的聚己內酯二硫鍵被谷胱甘肽破壞,導致納米載體的粒徑發生變化。
3、腫瘤靶向性測試
將實施例4制得的腫瘤靶向雙載藥納米載體(pcl-pei-peg-t7)與帶有增強的綠色熒光蛋白(egfp)基因的質粒復溶于ph=7.4的磷酸鹽緩沖液中,室溫下渦旋60s,孵育,制得負載有綠色熒光蛋白(egfp)基因的納米載體(pcl-pei-peg-t7/egfp)。另取未連接多肽t7的納米載體(pcl-pei-peg),按照上述方法制備負載有綠色熒光蛋白(egfp)基因的納米載體(pcl-pei-peg/egfp)作為對照。
在96孔培養板中分別接種1×104個hela細胞/孔,培養過夜,吸去培養基后用pbs洗滌2次,然后分別加入0.2mg/ml上述載體溶液,每孔100μl,并以未接種細胞的孔為空白孔,未加入載體溶液的細胞孔為對照孔,37℃、5%co2培養4小時。培養結束后,采用激光共聚焦顯微鏡觀察。實驗結果表明,與未連接多肽t7的納米載體(pcl-pei-peg/egfp)相比,本發明的腫瘤靶向雙載藥納米載體(pcl-pei-peg-t7)能夠更好地轉染進入細胞,細胞具有更強的綠色熒光信號表達。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!