從含鋰溶液中經濟地提取鋰的方法與流程
本申請是申請日為2011年7月8日,申請號為201180039418.8,發明名稱為“從含鋰溶液中經濟地提取鋰的方法”的發明專利申請的分案申請。
本發明涉及從含鋰溶液中提取鋰的方法。
背景技術:
目前鋰的應用擴展到了各種工業,包括可再充電電池、玻璃、陶瓷、合金、潤滑劑和制藥工業。鋰可再充電電池作為混合動力和電動汽車的主要能源近來受到關注,并且預期用于汽車的鋰可再充電電池的市場會持續增長到用于手機和筆記本的傳統小型電池市場的大約100倍。
此外,趨向更嚴格環境規則的全球性運動可能不僅擴展鋰的應用到混合動力和電動汽車產業,還擴展到電子、化學和能源領域。因此,預期對鋰的國內和國外需求都會顯著地增加。
鋰的主要來源可為礦物、鹽水和海水。雖然例如鋰輝石、透鋰長石和鋰云母等礦物包含大約1%至1.5%的相對大量的鋰,但是其提取涉及復雜的工藝,例如浮選、高溫煅燒、粉碎、酸混合、提取、純化、濃縮和沉淀。這些工藝需要高的能量消耗,被認為不符合成本效益,并且在鋰提取中酸的使用還會引起環境污染。
已報道大約2.5×1011噸的鋰溶于海水中。雖然大多數技術包括插入含吸收劑的提取裝置到海水中,以便在有選擇地吸收鋰之后通過用酸處理來提取鋰,但由于包含在海水中的鋰的濃度不超過0.17ppm,所以從海水中直接提取鋰的效率非常低,并且非常不經濟。
由于上述缺點,目前從天然鹽湖生產的鹽水中提取鋰,但是例如mg、ca、b、na、k、so4的鹽也溶于鹽水中。
此外,包含在鹽水中的鋰的濃度為約0.3g/l至1.5g/l,并且包含在鹽水中的鋰通常以具有約13g/l的溶解度的碳酸鋰的形態提取。即使假設包含在鹽水中的鋰完全轉變成碳酸鋰,鹽水中的碳酸鋰的濃度限于1.59~7.95g/l(li2co3的分子量為74,并且鋰的原子量為7。如果鋰的濃度乘以5.3(74÷14≒5.3),則可估計碳酸鋰的濃度)。由于多數情況下碳酸鋰的濃度低于碳酸鋰的溶解度,提取的碳酸鋰再次溶解,因此存在鋰提取的收率極低的問題。
通常,為從鹽水中包含的鋰中提取碳酸鋰,將從天然鹽湖中泵出的鹽水儲存在蒸發塘中,然后經過長時間的室外自然蒸發,例如約一年,以數十倍地濃縮鋰。然后,將例如鎂、鈣、硼的雜質進行沉淀以去除,所述方法需要大于溶解度的碳酸鋰的量以進行沉淀。
例如,中國專利公開號1626443記載了提取鋰的方法,其中,在太陽熱能下蒸發和濃縮鹽水,然后將濃縮液進行反復的電滲析,以便獲得包含濃縮的鋰并具有低含量鎂的鹽水。
這種傳統方法需要蒸發和濃縮鹽水,費時且不具生產性,尤其在雨季更是如此。此外,當鋰與其它雜質以鹽的形態沉淀時,鋰的損失不可避免。
技術實現要素:
技術問題
根據本發明的實施方式,可提供通過使用具有低溶解度的磷酸鋰而從鹽水中以高提取產率經濟地提取高純度磷酸鋰的方法,該方法不需要長時間的鹽水蒸發和濃縮工藝。
技術方案
根據本發明的實施方式,提供了通過向溶液中加入磷供應材料以從溶解的鋰中沉淀磷酸鋰從而從含鋰溶液中經濟地提取鋰的方法。
在本發明的一個實施方式中,所述磷供應材料可為選自由磷、磷酸、磷酸鹽及其混合物組成的組中的一種。
在本發明的一個實施方式中,所述磷酸鋰的濃度可為0.39g/l或更大。
在本發明的一個實施方式中,所述含鋰溶液中鋰的濃度可為0.1g/l或更大。更具體地,濃度可為0.2g/l或更大,或0.5g/l或更大。然而由于高濃縮鋰需要大量的時間,60g/l或更高的濃度可能不經濟。
在本發明的一個實施方式中,所述方法可進一步包括通過過濾從所述含鋰溶液中沉淀的磷酸鋰而提取磷酸鋰的步驟。
在本發明的一個實施方式中,所述含鋰溶液可為鹽水。
在本發明的一個實施方式中,所述鹽水可含有包括鎂、硼、鈣或其混合物的雜質。
在本發明的一個實施方式中,在通過在所述鹽水中加入磷供應材料而從溶解的鋰中沉淀磷酸鋰以前,所述方法可進一步包括通過在所述鹽水中加入羥基離子而沉淀并去除在所述鹽水中的包括鎂、硼、鈣或其混合物的雜質的步驟。
在本發明的一個實施方式中,所述通過加入磷供應材料而從溶解的鋰中沉淀磷酸鋰的步驟可在室溫或更高溫度下進行。
在本發明的一個實施方式中,所述羥基離子可為氫氧化鈉負離子。
在本發明的一個實施方式中,所述通過在所述鹽水中加入羥基離子以沉淀和去除所述鹽水中的包括鎂、硼、鈣或其混合物的雜質的步驟可為通過在所述鹽水中加入羥基離子以沉淀和去除所述鹽水中的包括鎂、硼和鈣的雜質的步驟。
在本發明的一個實施方式中,所述通過在所述鹽水中加入羥基離子而沉淀和去除所述鹽水中的包括鎂、硼和鈣的雜質的步驟可進一步包括以下步驟:(a)通過在所述鹽水中加入羥基離子而從所述鎂生產氫氧化鎂;(b)通過共沉淀鎂和硼而吸收所述氫氧化鎂中的硼以提取鎂和硼;和(c)通過調節去除鎂和硼的濾出液的ph為至少12而沉淀鈣。
在本發明的一個實施方式中,所述通過在所述鹽水中加入羥基離子而從所述鎂生產氫氧化鎂的步驟可為在保持所述鹽水的ph在8.5至10.5的同時通過加入羥基離子而從所述鎂生產氫氧化鎂的步驟。通過共沉淀鎂和硼而吸收所述氫氧化鎂中的硼以提取鎂和硼的步驟可通過在包含氫氧化鎂且具有8.5至10.5的ph的鹽水中共沉淀鎂和硼而吸收所述氫氧化鎂中的硼以提取鎂和硼來進行。通過在所述鹽水中加入羥基離子而保持所述鹽水的ph在8.5至10.5的同時通過在鹽水中加入羥基離子而從所述鎂生產氫氧化鎂的步驟,和在包含氫氧化鎂且具有8.5至10.5的ph的鹽水中通過共沉淀鎂和硼而吸收所述氫氧化鎂中的硼以提取鎂和硼的步驟可同時進行。
在本發明的另一個實施方式中,所述通過加入磷供應材料而從溶解的鋰中沉淀磷酸鋰的步驟之后可為過濾所述沉淀的磷酸鋰并將其以高純粉末的形態提取的步驟。
在本發明的另一個實施方式中,所述通過調節去除鎂和硼的濾出液的ph到至少12而沉淀鈣的步驟可為通過加入羥基離子、碳酸離子或其混合物而從鈣中沉淀氫氧化鈣或碳酸鈣的步驟。
發明的有益效果
根據本發明的一個實施方式,不需要長時間的鹽水蒸發和濃縮處理,通過使用具有低溶解度的磷酸鋰進行沉淀,溶解于所述鹽水中的鋰可以以高提取率經濟地提取為鋰。
附圖說明
圖1為描述根據鹽水的ph的氫氧化鎂的表面電荷變化的圖。
圖2為描述相對于naoh的加入量在所述濾出液中鎂離子的濃度變化的圖。
圖3為描述相對于naoh的加入量在所述濾出液中硼離子的濃度變化的圖。
圖4為描述相對于naoh的加入量在所述濾出液中鋰離子的濃度變化的圖。
圖5為描述相對于naoh的加入量在所述濾出液中鈣離子的濃度變化的圖。
圖6為描述當從鋰沉淀磷酸鋰時相對于反應時間的鋰的濃度的圖。
圖7為描述當從鋰沉淀磷酸鋰時相對于反應時間和溫度的鋰的濃度的圖。
圖8為描述當從鋰沉淀碳酸鋰時相對于反應時間在所述濾出液中磷酸鋰的濃度的圖。
具體實施方式
下面將參照下列附圖更詳細地描述本發明的一個實施方式的特征。
根據本發明的一個實施方式,可提供通過加入磷供應材料到溶液中以從溶解的鋰中沉淀磷酸鋰而非碳酸鋰從而從含鋰溶液中經濟和有效地提取鋰的方法。
由于碳酸鋰(li2co3)的溶解度大約為13g/l,其可相對大量地溶于水中。因為0.5g/l至1.5g/l的極小量的鋰的溶解濃度,難于從含鋰溶液,例如鹽水中提取鋰。即使通過向所述含鋰溶液中加入碳酸鈉來生產碳酸鋰,其大多數也會再溶解。
然而,磷酸鋰(li3po4)的溶解度大約為0.39g/l,相對低于碳酸鋰的溶解度。因此,可能提取溶解于例如鹽水的含鋰溶液中的甚至0.5g/l或1.5g/l的小量的鋰,其可通過在含鋰溶液中加入磷供應材料沉淀和分離成固體狀態的磷酸鋰。
在本發明的一個實施方式中,含鋰溶液中鋰的濃度可為0.1g/l或更大。更具體地,濃度可為0.2g/l或更大、或0.5g/l或更大。然而,由于鋰的高濃縮需要大量的時間,60g/l或更大的濃度可能不經濟。
將選自由磷、磷酸、磷酸鹽及其混合物組成的組中的所述磷供應材料加入到含鋰溶液中以生產磷酸鋰。此外,為了使磷酸鋰以固體狀態沉淀而不再次溶解,所述濃度(即含鋰溶液中的溶解濃度)應為0.39g/l或更大。
在磷供應材料為能夠改變所述含鋰溶液(例如磷酸)的ph的化合物的情況下,一旦溶液的ph下降,可同時使用羥離子以防止沉淀的磷酸鋰再次溶解。
所述磷酸鹽可為,例如但不限于,磷酸鉀、磷酸鈉和磷酸銨。具體地,所述銨可為(nr4)3po4,其中r獨立地為氫、重氫、取代或未取代的c1至c10烷基,但不限于此。
更具體地,所述磷酸鹽可為,例如但不限于,磷酸二氫鉀、磷酸氫二鉀、磷酸三鉀、磷酸二氫鈉、磷酸氫二鈉、磷酸三鈉、磷酸鋁、磷酸鋅、聚磷酸銨、六偏磷酸鈉、磷酸一鈣、磷酸二鈣和磷酸三鈣。
所述磷供應材料可溶于水。在所述磷供應材料可溶于水的情況下,與包含在含鋰溶液中的鋰的反應可容易地發生。
所述沉淀的磷酸鋰可通過過濾所述含鋰溶液而提取。
此外,通過加入磷供應材料到溶液中以從溶解的鋰中沉淀磷酸鋰而從含鋰溶液經濟地提取鋰的方法可在室溫下進行。更具體地,該溫度可大于20℃、30℃、50℃或90℃。
本發明中,術語“室溫”不限于確定的溫度,其解釋為沒有應用外部能量的溫度。因此,所述室溫可根據時間和位置而變化。
[去除雜質沉淀物的步驟]
根據本發明的一個實施方式,可包含通過在含鋰溶液(例如鹽水)中加入羥基離子而去除鹽水中包含鎂、硼或鈣的雜質,然后進行沉淀的步驟。
羥基離子可為,例如但不限于,氫氧化鈉、氫氧化鉀和氫氧化銨。具體地,所述銨可為(nr4)3po4,其中r獨立地為氫、重氫、取代或未取代的c1-c10烷基,但不限制于此。更具體地,所述氫氧化物可為氫氧化鈉的陰離子。
更具體地,由于氫氧化物鹽的陽離子具有高溶解度,在提取鋰的過程中所述羥基離子可為作為副產物得到的氫氧化物鹽的陰離子。
在本發明的一個實施方式中,通過在含鋰溶液(例如鹽水和下文中假設為鹽水的溶液)中加入羥基離子而沉淀和去除鹽水中包含鎂、硼或鈣的雜質的步驟可為通過在鹽水中加入羥基離子而沉淀和去除鹽水中包含鎂、硼和鈣的雜質的步驟。
在本發明的一個實施方式中,通過在所述鹽水中加入羥基離子而沉淀和去除所述鹽水中包含鎂、硼或鈣的雜質的步驟可進一步包括步驟:(a)通過在所述鹽水中加入羥基離子而從所述鎂中生產氫氧化鎂;(b)通過共沉淀鎂和硼而吸收所述氫氧化鎂中的硼以提取鎂和硼;和(c)通過調節去除鎂和硼的濾出液的ph至至少12而沉淀鈣。
根據鎂的量,通過在所述鹽水中加入羥基離子而從所述鎂中生產氫氧化鎂的步驟(a),和通過共沉積鎂和硼而吸收所述氫氧化鎂中的硼以提取鎂和硼的步驟(b)可單獨或同時進行。
換句話說,如果生產足夠量的氫氧化鎂,并且所生產的氫氧化鎂能夠吸收大多數的硼,步驟(a)和步驟(b)可同時進行,但是如果生產的鎂的量不充足,上述步驟可分別進行。
在本發明的一個實施方式中,例如,通過加入羥基離子(例如naoh)到包含鎂、硼和鈣的含鋰鹽水中,所述鎂可生產為氫氧化鎂。
具有加入的羥基離子(例如naoh)的鹽水的ph可調節到8.5至10.5,然后,通過吸收所述氫氧化鎂中的硼可以共沉淀鎂和硼。
所述步驟可同時進行。
為了提高所述鹽水的ph到8.5至10.5的范圍內,通過加入羥基離子(例如naoh)可使溶解于鹽水中的鎂沉淀為氫氧化鎂。氫氧化鎂的特征在于具有0.009g/l的低溶解度,并具有在具有8或更大ph的堿性溶液中易于沉淀的趨勢。
此外,通過保持鹽水的ph在8.5至10.5之間,硼(例如硼離子)可在生產的氫氧化鎂的表面被吸收以共沉淀鎂和硼。
在這方面,所述氫氧化鎂的表面電荷可被利用。
通常,氫氧化鎂的表面電荷受溶液ph的巨大影響。當氫氧化鎂的表面電荷是正的時,以負離子形態存在的硼離子,例如h2bo3-或hbo32-在氫氧化鎂中被吸收,并且溶解在含鋰溶液中的鎂和硼可通過同時提取而被去除。然而,當氫氧化鎂的表面電荷是負的時,帶負電荷的硼離子不能在氫氧化鎂中被吸收。
如果鹽水的ph低于8.5,由于相對低的ph導致由溶解于鹽水中的鎂離子沉積的氫氧化鎂的量不足,鎂的去除效率將下降。另一方面,如表1所示,如果所述ph超過10.5,氫氧化鎂的表面電荷將為負電荷,由此其上不能吸收硼離子。因此,鹽水中存在的帶正電荷的鋰離子的吸收將導致鋰的大量損失。
為了通過沉淀同時提取鎂和硼,可以分階段向鹽水中加入羥基離子(例如naoh),這樣可以保持鹽水的ph在8.5至10.5之間。
向具有幾乎中性ph的鹽水中加入足夠量的羥基離子(例如naoh)以調節ph在8.5至10.5的范圍內。這允許在氫氧化鎂的表面電荷上吸收硼(例如硼離子)以共沉淀溶解于鹽水中的大多數鎂和硼。
為了在大部分鎂和硼沉積后再次共沉淀在濾出液中存在的剩余的鎂和硼,可加入另外的羥基離子(例如naoh)到濾出液中以調節ph至8.5和10.5之間,然后沉淀剩余的鎂和硼。
由于如果立刻加入大量的羥基離子來沉淀溶解于鹽水中的鎂和硼,鹽水的ph不可能保持在8.5和10.5之間,并且因此鎂和硼的共沉淀效率可能下降,導致鋰的損失,因此優選分階段加入羥基離子(例如naoh)。
為了從鹽水中分離吸收了硼的沉淀的氫氧化鎂,進行過濾以同時提取鎂和硼,并獲得產生的濾出液。
可通過加羥基離子或碳酸鹽離子(例如naoh、碳酸鹽或其混合物)到鎂和硼被提取的濾出液中以調節ph至12或更高來沉淀鈣。
根據使用的羥基離子或碳酸離子的類型,可沉淀氫氧化鈣或堿式碳酸鹽。
如果省略從鹽水中分離吸收了硼的沉淀的氫氧化鎂的過濾步驟,并且調節ph至12或更高以除去鈣,由于鹽水的ph偏離8.5至10.5的范圍,氫氧化鎂的表面電荷將轉變成負的。在這種情況下,氫氧化鎂中吸收的硼將被釋放,作為替代,正鋰離子將被吸收,同時導致鋰的損失和硼提取率的降低。
當ph為12或更高時,具有非常低的溶解度的氫氧化鈣和碳酸鈣易于沉淀。因此,優選保持濾出液的ph為12或更高。
在本發明的一個實施方式中,例如,可加入堿和碳酸鹽的混合物。
所述堿選自由naoh、koh、ca(oh)2、nh4oh、r4noh·5h2o及其混合物組成的組中,其中,r獨立地為c1~c10烷基,例如甲基、乙基、丙基或丁基。
因為由堿(例如naoh)的加入提供的oh-在氫氧化鈣的產生中被用盡,加入大量的堿(例如naoh)以便保持含鋰溶液的ph水平到至少12。當單獨加入碳酸鈣或與堿(例如naoh)結合加入時,即使堿的量可能相對減少,也可經濟地保持ph到至少12。
所述碳酸鹽選自由na2co3、k2co3及其混合物組成的具有高溶解度的組中,并且包含在碳酸鹽中的鈉和鉀溶解于濾出液中。從剩余的濾出液中分離沉淀的氫氧化鈣或碳酸鈣,然后提取鈣。
[沉淀磷酸鋰的步驟]
磷供應材料可加入到雜質被去除的剩余的濾出液中以從鹽水含有的鋰中沉淀磷酸鋰。
從含鋰的鹽水中沉淀磷酸鋰的步驟可在室溫或更高、或在40℃或更高的溫度下進行。更具體地,所述步驟可在50℃或更高、60℃或更高、70℃或更高、80℃或更高、或90℃或更高的溫度下進行。
所述磷供應材料可選自由磷、磷酸、磷酸鹽及其混合物組成的組中。
為了使以固體狀態沉淀的磷酸鋰不被再次溶解,濃度(即在含鋰溶液中的溶解濃度)應為0.39g/l或更大。
所述磷酸鹽可為,例如但不限于,磷酸鉀、磷酸鈉和磷酸銨。具體地,所述銨可為(nr4)3po4,其中r獨立地為氫、重氫、取代或未取代的c1-c10烷基,但不限于此。
更具體地,所述磷酸鹽可為,例如但不限于,磷酸二氫鉀、磷酸氫二鉀、磷酸三鉀、磷酸二氫鈉、磷酸氫二鈉、磷酸三鈉、磷酸鋁、磷酸鋅、聚磷酸銨、六偏磷酸鈉、磷酸一鈣、磷酸二鈣和磷酸三鈣。
所述磷供應材料可為水溶性。在磷供應材料為水溶性的情況下,與包含在所述含鋰溶液中的鋰的反應可容易地發生。
此外,在加入磷供應材料后,在室溫下或在40~200℃、50~200℃、60~200℃、70~200℃、80~200℃或90~200℃的溫度范圍內煅燒濾出液10至15分鐘。
雖然為了生產磷酸鋰的目的,延長煅燒時間和提高溫度是有利的,但是如果煅燒時間超過15分鐘或者如果煅燒溫度超過200℃,磷酸鋰的生產率會達到飽和。
[提取磷酸鋰的步驟]
在由溶解于鹽水中的鋰沉淀磷酸鋰后,可進行提取從濾出液過濾的沉淀的磷酸鋰的步驟。
經過這種過濾,所述提取的磷酸鋰可被清洗以獲得高純度的磷酸鋰粉末。
下面的實施例涉及優選的實施方式,且不應解釋為對本發明范圍的限制,本發明將通過下列實施例進行進一步的說明。
[實施例1]
向包含鎂離子20,000ppm、硼離子900ppm、鈣離子350ppm和鋰離子900ppm的鹽水中加入naoh以沉淀氫氧化鎂。在調節鹽水的ph的同時,測量沉淀的氫氧化鎂的表面電荷。結果顯示于圖1中。
如圖1所示,當加入到鹽水中的naoh的ph范圍是8.5至10.5時,所述氫氧化鎂的表面電荷保持為正電荷。因此,具有負電荷的硼離子易于被吸收在氫氧化鎂上,并且防止帶正電荷的鋰離子被吸收。這使鋰的損失最小化,并且有效地從鹽水中同時提取鎂和硼。
[實施例2]
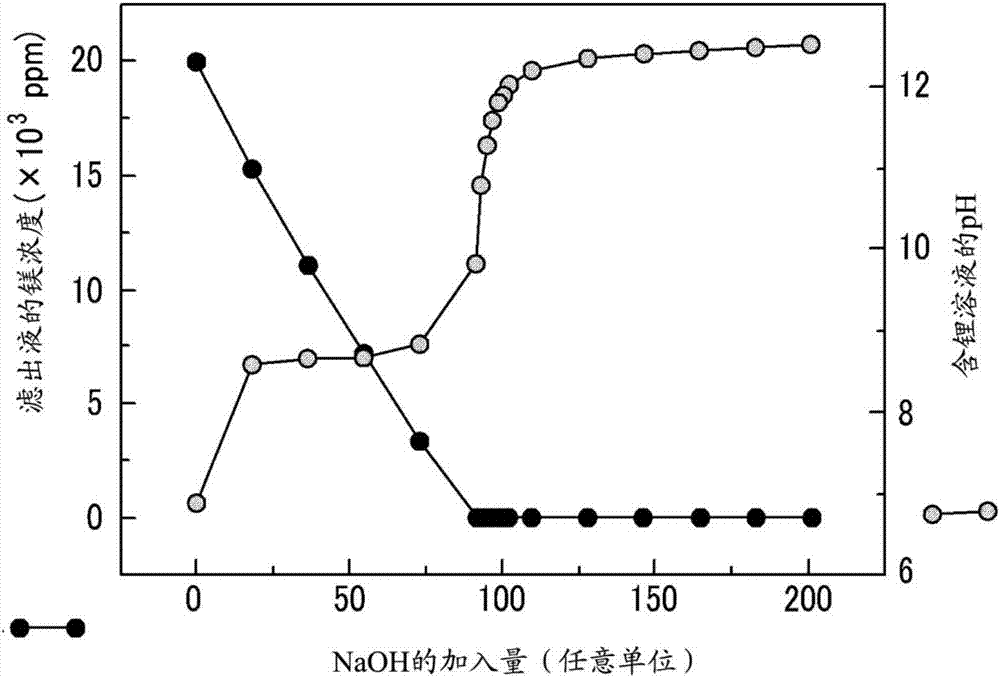
在改變ph的同時,從包含鎂離子20,000ppm、硼離子900ppm、鈣離子350ppm和鋰離子900ppm的鹽水中沉淀氫氧化鎂。然后,進行過濾以從鹽水中分離沉淀的氫氧化鎂。收集濾出液以測量鎂、硼和鋰的量。結果分別顯示于圖2、3和4中。
如圖2所示,因為oh-離子用于產生氫氧化鎂,開始時加入的naoh的量的增加對鹽水的ph無顯著地影響。然而,naoh的量的持續增加逐漸降低濾出液中鎂的量,并且由于oh-離子增加,一旦鹽水的ph達到9.8,鎂的量就會降低至4ppm。這表明溶解在鹽水中的99.8%的鎂離子被提取。
此外,如圖3所示,隨著加入的naoh的量的增加,溶解在鹽水中的硼離子的量首先減小。這可通過開始時naoh的加入可顯著地影響ph變化,并且從具有10.5或更低ph值的鹽水中沉淀的氫氧化鎂的表面電荷為正電荷的事實來解釋。因此,濾出液中存在的帶負電荷的硼離子當其在氫氧化鎂的表面被吸收的同時而被沉淀。
如圖4所示,濾出液中存在的鋰離子的量最初不受加入的naoh的量的影響。這可通過由于開始時氫氧化鎂的表面電荷具有正電荷,所以含鋰溶液中存在的帶正電荷鋰離子不在氫氧化鎂中被吸收的事實來解釋。然而,如果加入過量的naoh,鹽水的ph就會超過10.5。然后,氫氧化鎂的表面電荷轉變成負電荷,并且帶負電荷的硼離子不被吸收到表面。結果,存在于濾出液中的硼離子的濃度顯著增加。相反,當鋰離子被吸收到氫氧化鎂的表面時,存在于濾出液中的帶正電荷的鋰離子的濃度迅速下降。
因此,這些結果表明,必須控制加入的naoh的量以保持鹽水的ph在8.5和10.5之間,以便使從鹽水中鋰的損失最小化的同時,同時提取鎂和硼。
[實施例3]
向包含鎂離子20,000ppm、硼離子900ppm、鈣離子350ppm和鋰離子900ppm的鹽水中加入naoh以從包含鈣離子的溶液中沉淀氫氧化鈣。然后,進行過濾以從鹽水分離沉淀的氫氧化鈣。收集產生的濾出液以測量鈣的量。結果顯示于圖5中。
如圖5所示,當加入的naoh的量增加時,濾出液中鈣的量逐漸降低。當鹽水的ph達到12時,鈣的量降低到6.5ppm,并且溶解在鹽水中的98%的鈣離子被提取。因此,優選地提高含鋰溶液的ph到至少12,以便提高鹽水中的鈣離子的提取率。
然而,當鹽水的ph開始時過早地調節到至少12時,沉淀的氫氧化鎂的表面電荷具有負電荷。這阻止了硼離子的吸收,并且由于帶正電荷的鋰離子的吸收導致了鋰的損失。通過加入naoh來提取鈣之前,調節鹽水的ph至8.5和10.5之間,以便沉淀具有正電荷的氫氧化鎂以阻止鋰離子的吸收。一旦硼離子被吸收,就進行鎂和硼的同時提取。然后,將鎂和硼已被提取的剩余的濾出液的ph調節到至少12以從鈣沉淀氫氧化鈣。
[實施例4]
從鹽水中去除包含鎂、鈣和硼的雜質,并且向其中溶解的鋰離子的濃度為0.917g/l的剩余的濾出液中加入7.217g/l的磷酸鈉。在提高溫度至90℃的同時,保持所述濾出液進行反應15至60分鐘。
一旦反應完成,通過過濾分離沉淀的磷酸鋰,并且收集剩余的濾出液以測量鋰的濃度。結果顯示于圖6中。
如圖6所示,當磷酸鈉加到鹽水中時,濾出液中鋰的濃度首先顯著減小。反應15分鐘之后,濾出液中鋰的濃度達到小于50mg/l。這表明溶解于鹽水中的超過95%的鋰沉淀并分離為磷酸鋰。
由于磷酸鋰的溶解度大約為0.39g/l,顯著低于碳酸鋰的溶解度,所以在鹽水中加入例如磷酸鈉的含磷的材料而從少量的溶解在鹽水中的鋰中以固體形態沉淀磷酸鋰。此外,從圖7中可看出,如果煅燒溫度超過90℃,則在反應10分鐘后,鋰的提取率超過90%,并且在反應15分鐘后,提取率大于95%。
[對比例1]
從鹽水中去除包含鎂、鈣和硼的雜質,并且向其中溶解的鋰離子的濃度為0.917g/l的剩余的濾出液中加入7g/l的磷酸鈉。在提高溫度至90℃的同時,保持所述濾出液進行反應15至60分鐘。
一旦反應完成,通過過濾分離沉淀的碳酸鋰,并且收集剩余的濾出液以測量鋰的濃度。結果顯示于圖8中。
如圖8所示,即使碳酸鈉加入到含鋰溶液并且反應15至60分鐘,濾出液中鋰的濃度幾乎與反應前鹽水中鋰的濃度相同。
換句話說,由于碳酸鋰大約13g/l的高溶解度,其可大量溶解于水中。因此,提取以碳酸鋰的形態溶解于鹽水中的少量鋰將極其困難,除非通過鹽水的蒸發和濃縮提高碳酸鋰沉淀的量。
通過用具有低溶解度的磷酸鋰沉淀溶解在鹽水中的鋰,不需要鹽水的蒸發及濃縮工藝,并且可能使鋰的損失最小化的同時,以高提取率經濟地提取鋰。
在上述說明書中,已經說明了本發明的具體的實施方式。然而,本領域技術人員將認識到在不背離如在上述討論的各種實施方式中提出的本發明的精神和范圍的情況下,可做出各種修改和變化。因此,應認為說明書和附圖為說明性而非限制性意義,并且所有這類變化應包含在本發明的范圍內。各種益處、優點、問題的解決方案、以及任何可導致任何益處、優點或解決方案出現或變得更顯著的要素不應被解釋為如上所述的關鍵的、必需的或實質性的特征或要素。
- 還沒有人留言評論。精彩留言會獲得點贊!