從除鎂鹵水中提取鋰并制備電池級(jí)碳酸鋰的方法與流程
本發(fā)明涉及鹵水資源利用領(lǐng)域,具體涉及利用反應(yīng)-分離耦合技術(shù)分離、提取除鎂后鹽湖鹵水中鋰資源并生產(chǎn)電池級(jí)碳酸鋰的工藝。
背景技術(shù):
鹽湖通常是指湖水含鹽量大于50g·l-1的湖泊,湖中含有大量的cl-、so42-、hco3-、co32-、na+、k+、mg+、li+離子,含鹽量超過24.7‰,是生產(chǎn)多種工業(yè)、農(nóng)業(yè)產(chǎn)品的重要原料。隨著鋰在傳統(tǒng)應(yīng)用領(lǐng)域的用量不斷增長的同時(shí),人們也在持續(xù)開發(fā)新的應(yīng)用領(lǐng)域,對(duì)鋰資源的需求也日益增長。鋰作為一種新型能源和戰(zhàn)略資源,在21世紀(jì)備受關(guān)注。中國鹽湖鋰資源約占鋰資源工業(yè)總儲(chǔ)量的85%左右,這一強(qiáng)勢注定鹽湖鹵水提鋰將成為鋰鹽研究和生產(chǎn)的主要方向。
我國的鋰鹽湖資源主要分布在青海和西藏兩省,富鋰鹽湖鹵水中的鋰常以微量形式的鉀、鈣、鈉、鎂等堿金屬、堿土金屬陽離子及氯根、硫酸根和硼酸根的陰離子共存。鋰與堿金屬、堿土金屬離子的化學(xué)性質(zhì)非常相近,使得直接從中分離提取鋰十分困難(余疆江,鄭綿平,伍倩.富鋰鹽湖提鋰工藝研究進(jìn)展[j].化工進(jìn)展,2013,1:13-21)。縱觀國內(nèi)外從鹽湖鹵水中提取鋰鹽的工藝技術(shù)方法,歸納起來主要有沉淀法、萃取法、離子交換吸附法、碳化法、煅燒浸取法、許氏法和電滲析法等(劉元會(huì),鄧天龍.國內(nèi)外從鹽湖鹵水中提鋰工藝技術(shù)研究進(jìn)展[j].世界科技研究與發(fā)展,2006,5:69-75)。雖然有如此多的研究成果,但真正能夠在我國鹽湖鹵水提鋰領(lǐng)域走向工業(yè)化的技術(shù)屈指可數(shù)(馮躍華.我國鹽湖鹵水提鋰工程化現(xiàn)狀及存在問題[j].武漢工程大學(xué)學(xué)報(bào),2013,5:9-14)。
沉淀法是一種工藝簡單、成本較低的提取方法,但我國鹽湖多為高鎂/鋰比型鹽湖,而此法主要適宜于從低鎂/鋰比的鹽湖鹵水中提鋰,大量鎂鹽存在嚴(yán)重影響鋰的提取,增大提鋰的難度,最終影響鹽湖鋰產(chǎn)業(yè)發(fā)展進(jìn)程(付燁,鐘輝.沉淀法分離高鎂鋰比鹽湖鹵水的研究現(xiàn)狀[j].礦產(chǎn)綜合利用,2010,2:30-33)。萃取法能分離堿金屬和堿土金屬,以tbp為萃取劑、mibk為稀釋劑和協(xié)萃劑、fecl3為共萃劑組成的萃取體系tbp-mibk-fecl3萃取率超過88%(祝茂忠.溶劑萃取法提取鹽湖鹵水中鋰的研究[j].化工礦物與加工,2016,8:27-30+36),但反應(yīng)成本偏高,而且對(duì)設(shè)備有腐蝕性,萃取劑的回收也比較困難。吸附法適用于離子濃度低的鹽湖鹵水直接提鋰,li1.6mn1.6o4的理論離子交換能力是所有鋰錳氧化物吸附劑中最大的,可達(dá)72.9mg/g,酸洗過程中,鋰的脫除率在90%以上,錳的溶損率~5%(楊珊珊,阮慧敏,等.尖晶石型鋰錳氧化物離子篩的制備方法及構(gòu)效性能分析[j].化工進(jìn)展,2015,06:1690-1698),但由于處理鹵水量大,其水耗、樹脂消耗、動(dòng)力消耗相應(yīng)增大,特別是在淡水資源比較貧乏的地區(qū)受到一定程度的限制。鹽析法設(shè)備腐蝕和固體夾帶很嚴(yán)重,以上方法僅在實(shí)驗(yàn)室取得了一定效果,未能很好地實(shí)現(xiàn)工業(yè)化。煅燒法雖然已工業(yè)化,但存在能耗高,煅燒不完全,設(shè)備腐蝕等問題(楊建元,夏康明.一種生產(chǎn)高純鎂鹽、碳酸鋰、鹽酸和氯化銨的方法[p].國家發(fā)明專利:cn1724373,2006)。碳化法易于規(guī)模化提鋰,具有連續(xù)化、生產(chǎn)成本低、產(chǎn)品質(zhì)量好等優(yōu)點(diǎn),但二氧化碳?xì)庠粗萍s這種方法的發(fā)展(王寶才.我國鹵水鋰資源及開發(fā)技術(shù)進(jìn)展[j].化工礦物與加工,2000,10:13-15.)。
中國專利公開號(hào)cn105152193a從鹵水中提取鎂、鋰同時(shí)生產(chǎn)水滑石的工業(yè)方法,并沒有對(duì)碳酸鋰的制備進(jìn)行研究,制備鎂鋁水滑石后的母液含有多種離子,尤其鈉離子含量高,不能直接用于碳酸鋰等產(chǎn)品的生產(chǎn)。
中國專利公開號(hào)cn105036159a一種高鋰鹽湖鹵水制備碳酸鋰的方法,在制備碳酸鋰時(shí)加入了添加劑、絡(luò)合劑和沉淀劑,其中絡(luò)合劑為edta或者酒石酸,加入的添加劑為碳酸鋰晶體,該方法因加入了碳酸鋰,增加了生產(chǎn)成本。
中國專利公開號(hào)cn105152191a一種利用高鎂鋰比鹽湖鹵水制備碳酸鋰的方法,在制備了鎂鋁水滑石后的母液中,又加入了酸調(diào)ph去除了母液中的co32-,之后多步操作加酸去co32-,最后在制備碳酸鋰時(shí)又加入了碳酸鹽,在制備過程中浪費(fèi)了碳酸鹽。
本發(fā)明是以除鎂后的鹽湖鹵水為原料(見專利:cn105152193a,2015),利用反應(yīng)-分離耦合技術(shù)對(duì)溶液中的鋰、鈉離子進(jìn)行分離、提取,并制備得到電池級(jí)碳酸鋰,所得產(chǎn)品符合青海省地方標(biāo)準(zhǔn)db63/t1113-2012對(duì)電池級(jí)碳酸鋰的要求。db63/t1113-2012中的碳酸鋰是采用直接以鹵水為原料,利用離子選擇性分離裝置進(jìn)行鎂鋰分離、再制備電池級(jí)碳酸鋰的方法。
在鹽湖提鋰過程中,除鎂后的鹵水中鈉/鋰質(zhì)量比大于35,且鈉離子與鋰離子都為一價(jià)陽離子,鋰、鈉的分離也很困難。因此,我們針對(duì)高鎂鋰比鹽湖鹵水除鎂后的高鈉溶液體系,采用制備鋰鋁復(fù)合氫氧化物的方法進(jìn)行提鋰。本發(fā)明是由高鈉鹵水制備鋰鋁復(fù)合氫氧化物,將得到的鋰鋁復(fù)合金屬氫氧化物用酸溶解,得到li+、al3+的混合溶液制備碳酸鋰,使得鹽湖資源的提取與功能化利用相結(jié)合,提高鋰資源提取率與利用率。
技術(shù)實(shí)現(xiàn)要素:
本發(fā)明的目的是提供一種以除鎂后鹽湖鹵水作為原料提取鋰并制備電池級(jí)碳酸鋰的方法。
本發(fā)明的技術(shù)方案是:以除鎂后鹽湖鹵水作為原料,先加入鋁鹽制備鋰鋁復(fù)合金屬氫氧化物固體,使鋰進(jìn)入固相,而鈉仍留在溶液中,從而將鋰、鈉離子有效分離。再將得到的鋰鋁復(fù)合氫氧化物用酸溶解,得到含有鋰離子、鋁離子的溶液,利用電滲析法濃縮鋰,然后通過沉淀反應(yīng),制備得到電池級(jí)碳酸鋰。并且達(dá)到青海省地方標(biāo)準(zhǔn)db63/t1113-2012,見《鹵水電池級(jí)碳酸鋰》。
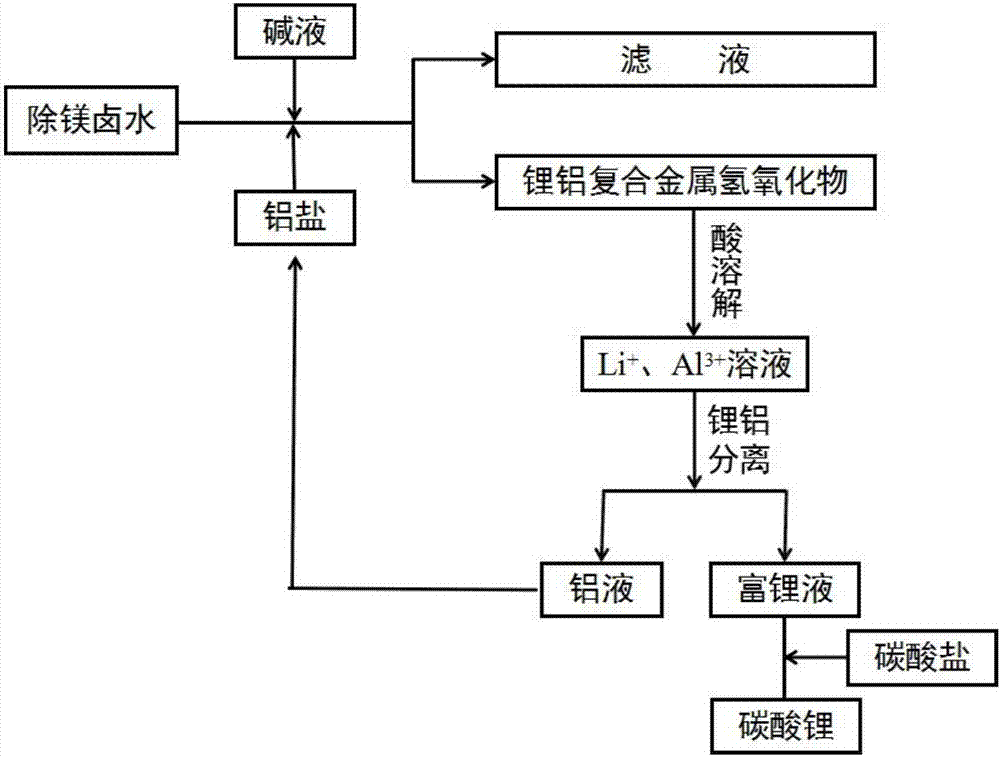
一種涉及利用反應(yīng)-分離耦合技術(shù)分離、提取鹽湖鹵水中鋰資源并生產(chǎn)電池級(jí)碳酸鋰的工藝,其反應(yīng)流程如圖1所示;具體步驟為:
a.向鹵水中加入鋁鹽配制混合鹽溶液a,使其中的鋁鹽與鋰鹽的摩爾濃度比為0.1~2:1;
所述的鹵水中各金屬離子的質(zhì)量含量分別為[li+]=0.05~1g/l,[mg2+]=0.0005~0.1g/l,[k+]=1~5g/l,[na+]=15~90g/l;其中鎂/鋰質(zhì)量比為0.01~0.1,該鹵水是經(jīng)過除鎂后的鹵水,是采用cn105152193a中介紹的方法,經(jīng)過mg、li反應(yīng)-分離后得到的高鈉鹵水溶液。
所述的鋁鹽為硝酸鋁、硫酸鋁、氯化鋁水溶液中的一種。
b.用堿和碳酸鹽配制與混合鹽溶液a體積相當(dāng)?shù)幕旌蠅A溶液b,且其中氫氧根的摩爾濃度是混合鹽溶液a中鋰和鋁離子摩爾濃度之和的1~1.6倍,碳酸根的摩爾濃度是混合鹽溶液a中鋁離子摩爾濃度的0~2倍;
所述的堿是氫氧化鈉或氫氧化鉀,碳酸鹽是碳酸鈉或碳酸鉀。
c.將混合鹽溶液a和混合堿溶液b同時(shí)倒入膠體磨,以1000-5000轉(zhuǎn)/分鐘的轉(zhuǎn)速旋轉(zhuǎn)1-10分鐘,形成鋰鋁復(fù)合金屬氫氧化物晶核;將晶核溶液轉(zhuǎn)移到晶化反應(yīng)器,在60℃~90℃下攪拌反應(yīng)12~48h;
較優(yōu)的條件是:轉(zhuǎn)速3000~4000轉(zhuǎn)/分鐘的轉(zhuǎn)速旋轉(zhuǎn)3~5分鐘。在晶化反應(yīng)器中于80~90℃下攪拌反應(yīng)12~24小時(shí)。
d.減壓過濾使固液分離,得到鋰鋁復(fù)合金屬氫氧化物濾餅;在60~80℃干燥6-12h,得到白色固體產(chǎn)品,其化學(xué)式為[lial2(oh)6]2co3·nh2o,n=1~10,鋰收率大于90%;
e.取步驟d得到的鋰鋁復(fù)合金屬氫氧化物,按20~208g/l的比例加入酸溶液中,在25~50℃下攪拌10~180分鐘得到含鋰、鋁離子的溶液,其中鋰離子濃度為1~6g/l;
較優(yōu)的條件是:鋰鋁復(fù)合金屬氫氧化物按80~140g/l濃度加入酸溶液中,在25~35℃下攪拌50~100分鐘。
所述的酸溶液是硝酸、鹽酸、硫酸溶液中的一種,其濃度為1~10mol/l;
f.將步驟e得到的溶液在電滲析裝置中進(jìn)行鋰離子富集,根據(jù)鋰、鋁離子化合價(jià)和離子半徑的不同,當(dāng)鋰、鋁離子的溶液通過具有選擇性的分離膜時(shí),鋰離子通過、鋁離子被隔離,從而實(shí)現(xiàn)了鋰離子、鋁離子分離的目的,當(dāng)鋰鹽室中鋰離子濃度>20g/l時(shí),將鋰鹽室中的溶液轉(zhuǎn)移出來,并將含鋁離子的溶液返回到步驟a中循環(huán)利用;電滲析的具體方法參見專利:cn1626443a。
g..在80~95℃下,向步驟f鋰鹽室轉(zhuǎn)移出來的溶液加入碳酸鹽固體,使其中碳酸鹽與鋰離子的摩爾比是0.75~1.5∶1,攪拌30~120分鐘,固液分離,過濾,用去離子水洗3~5次,在100~180℃下干燥,得到電池級(jí)碳酸鋰;
所述的碳酸鹽是碳酸鈉或碳酸鉀。所述的碳酸鹽與鋰離子較優(yōu)的摩爾比是0.75~1∶1;攪拌60~100分鐘。
cn102976367a中介紹鹵水電池級(jí)碳酸鋰的執(zhí)行標(biāo)準(zhǔn)是db63/t1113-2012,如表1所示
表1
本發(fā)明具有如下顯著效果:
(1)利用反應(yīng)-分離耦合技術(shù),以生產(chǎn)鋰鋁復(fù)合氫氧化物的方法使鋰進(jìn)入固相被提取出來,而鈉仍留在溶液里,實(shí)現(xiàn)了高鈉溶液中鋰的有效提取;
(2)以形成鋰鋁復(fù)合氫氧化物固體的方式提取鹽湖鹵水中的鋰,反應(yīng)條件溫和,設(shè)備簡單,操作簡便,鋰損失量小,鋰收率大于90%。而且能用于生產(chǎn)高純碳酸鋰產(chǎn)品,適合對(duì)鹽湖鹵水鋰資源的規(guī)模化、高效利用。
(3)提取鋰后的含有鋁離子的溶液可以作為反應(yīng)用的鋁原料繼續(xù)使用,實(shí)現(xiàn)了資源循環(huán)利用,顯著提高資源利用率。
附圖說明
圖1是電滲析裝置示意圖
圖2是從除鎂鹽湖鹵水中提取、分離鋰資源并生產(chǎn)電池級(jí)碳酸鋰的反應(yīng)流程圖
具體實(shí)施方式:
下面實(shí)施例所用鹵水取自東臺(tái)吉乃爾鹽湖除鎂后的鹵水,其組成見表2:
表2
實(shí)施例1
a.取250ml除鎂后的高鈉鹵水,其中鈉鋰質(zhì)量比約為48,加入alcl3·6h2o11.741g得到混合鹽溶液a;
b.稱取naoh4.3767g,na2co35.1548g,溶解于去離子水中,250ml容量瓶定容,得到混合堿溶液b;
c.將混合鹽溶液a和混合堿溶液b同時(shí)倒入膠體磨,以3000r/min的轉(zhuǎn)速旋轉(zhuǎn)3分鐘,形成鎂摻雜鋰鋁復(fù)合氫氧化物晶核;將晶核溶液轉(zhuǎn)移到反應(yīng)器,在80℃動(dòng)態(tài)攪拌晶化12h,進(jìn)行生長;
d.固液分離,過濾得到鋰鋁復(fù)合氫氧化物濾餅,鋰鋁復(fù)合氫氧化物濾餅在70℃干燥12h,得到白色固體產(chǎn)品,其化學(xué)式為[lial2(oh)6]2co3·3h2o,鋰收率大于90%;且固體產(chǎn)品中鈉質(zhì)量含量<0.001%,從而實(shí)現(xiàn)了從高鈉溶液中提取鋰,使鋰、鈉分離;
e.取步驟d得到的鋰鋁復(fù)合金屬氫氧化物按104g/l的比例加入到240ml的5mol/l硝酸中,在25℃下攪拌30min進(jìn)行溶解,得到鋰、鋁離子的溶液,其中鋰離子濃度約為3.3g/l;
f.將步驟e中的溶液以電滲析裝置進(jìn)行鋰離子富集,鋰離子、鋁離子分離,當(dāng)鋰濃度達(dá)到25g/l時(shí),轉(zhuǎn)移出來,并將含鋁離子的溶液返回到步驟a中循環(huán)利用;
g.取20ml步驟f中的含鋰離子溶液在95℃下,加入0.054mol碳酸鈉固體,攪拌60min,固液分離,過濾,用去離子水洗5次,在100℃下干燥,得到電池級(jí)碳酸鋰,其分析數(shù)據(jù)見表3:
表3.
實(shí)施例2
a.取250ml除鎂后的高鈉鹵水,其中鈉鋰質(zhì)量比約為48,加入al(no3)3·9h2o18.243g得到混合鹽溶液a;
b.稱取naoh4.3766g,na2co35.1548g,溶解于去離子水中,250ml容量瓶定容,得到混合堿溶液b;
c.將混合鹽溶液a和混合堿溶液b同時(shí)倒入膠體磨,以3000r/min的轉(zhuǎn)速旋轉(zhuǎn)3分鐘,形成鎂摻雜鋰鋁復(fù)合氫氧化物晶核;將晶核溶液轉(zhuǎn)移到反應(yīng)器,在80℃動(dòng)態(tài)攪拌晶化12h,進(jìn)行生長;
d.固液分離,過濾得到鋰鋁復(fù)合氫氧化物濾餅,鋰鋁復(fù)合氫氧化物濾餅在70℃干燥12h,得到白色固體產(chǎn)品,其化學(xué)式為[lial2(oh)6]2co3·3h2o,鋰收率大于90%;且固體產(chǎn)品中鈉質(zhì)量含量<0.001%,從而實(shí)現(xiàn)了從高鈉溶液中提取鋰,使鋰、鈉分離;
e.取步驟d得到的鋰鋁復(fù)合金屬氫氧化物按104g/l的比例加入到240ml的5mol/l鹽酸中,在25℃下攪拌30min進(jìn)行溶解,得到鋰、鋁離子的溶液,其中鋰離子濃度約為3.3g/l;
f.將步驟e中的溶液以電滲析裝置進(jìn)行鋰離子富集,鋰離子、鋁離子分離,當(dāng)鋰濃度達(dá)到25g/l時(shí),轉(zhuǎn)移出來,并將含鋁離子的溶液返回到步驟a中循環(huán)利用;
g.取20ml步驟f中的含鋰離子溶液在95℃下,加入0.054mol碳酸鉀固體,攪拌60min,固液分離,過濾,用去離子水洗5次,在100℃下干燥,得到電池級(jí)碳酸鋰,其分析數(shù)據(jù)見表4:
表4
實(shí)施例3
a.取250ml除鎂后的高鈉鹵水,其中鈉鋰質(zhì)量比約為48,加入al2(so4)3·18h2o32.396g得到混合鹽溶液a;
b.稱取naoh4.3769g,na2co35.1548g,溶解于去離子水中,250ml容量瓶定容,得到混合堿溶液b;
c.將混合鹽溶液a和混合堿溶液b同時(shí)倒入膠體磨,以3000r/min的轉(zhuǎn)速旋轉(zhuǎn)3分鐘,形成鎂摻雜鋰鋁復(fù)合氫氧化物晶核;將晶核溶液轉(zhuǎn)移到反應(yīng)器,在80℃動(dòng)態(tài)攪拌晶化12h,進(jìn)行生長;
d.固液分離,過濾得到鋰鋁復(fù)合氫氧化物濾餅,鋰鋁復(fù)合氫氧化物濾餅在70℃干燥12h,得到白色固體產(chǎn)品,其化學(xué)式為[lial2(oh)6]2co3·3h2o,鋰收率大于90%;且固體產(chǎn)品中鈉質(zhì)量含量<0.001%,從而實(shí)現(xiàn)了從高鈉溶液中提取鋰,使鋰、鈉分離;
e.取步驟d得到的鋰鋁復(fù)合金屬氫氧化物按104g/l的比例加入到240ml的2.5mol/l硫酸中,在25℃下攪拌30min進(jìn)行溶解,得到鋰、鋁離子的溶液,其中鋰離子濃度約為3.3g/l;
f.將步驟e中的溶液以電滲析裝置進(jìn)行鋰離子富集,鋰離子、鋁離子分離,當(dāng)鋰濃度達(dá)到25g/l時(shí),轉(zhuǎn)移出來,并將含鋁離子的溶液返回到步驟a中循環(huán)利用;
g.取20ml步驟f中的含鋰離子溶液在95℃下,加入0.054mol碳酸鈉固體,攪拌60min,固液分離,過濾,用去離子水洗5次,在100℃下干燥,得到電池級(jí)碳酸鋰,其分析數(shù)據(jù)見表5:
表5.
實(shí)施例4
a.取250ml除鎂后的高鈉鹵水,其中鈉鋰質(zhì)量比約為48,加入alcl3·6h2o11.741g得到混合鹽溶液a;
b.稱取naoh4.3767g溶解于去離子水中,250ml容量瓶定容,得到混合堿溶液b;
c.將混合鹽溶液a和混合堿溶液b同時(shí)倒入膠體磨,以3000r/min的轉(zhuǎn)速旋轉(zhuǎn)3分鐘,形成鎂摻雜鋰鋁復(fù)合氫氧化物晶核;將晶核溶液轉(zhuǎn)移到反應(yīng)器,在80℃動(dòng)態(tài)攪拌晶化12h,進(jìn)行生長;
d.固液分離,過濾得到鋰鋁復(fù)合氫氧化物濾餅,鋰鋁復(fù)合氫氧化物濾餅在70℃干燥12h,得到白色固體產(chǎn)品,其化學(xué)式為[lial2(oh)6]2co3·3h2o,鋰收率大于90%;且固體產(chǎn)品中鈉質(zhì)量含量<0.001%,從而實(shí)現(xiàn)了從高鈉溶液中提取鋰,使鋰、鈉分離;
e.取步驟d得到的鋰鋁復(fù)合金屬氫氧化物按20g/l的比例加入到1200ml的1mol/l硝酸中,在25℃下攪拌120min進(jìn)行溶解,得到鋰、鋁離子的溶液,其中鋰離子濃度約為1g/l;
f.將步驟e中的溶液以電滲析裝置進(jìn)行鋰離子富集,鋰離子、鋁離子分離,當(dāng)鋰濃度達(dá)到25g/l時(shí),轉(zhuǎn)移出來,并將含鋁離子的溶液返回到步驟a中循環(huán)利用;
g.取20ml步驟f中的含鋰離子溶液在95℃下,加入0.054mol碳酸鈉固體,攪拌60min,固液分離,過濾,用去離子水洗5次,在100℃下干燥,得到電池級(jí)碳酸鋰,其分析數(shù)據(jù)見表6:
表6.
- 還沒有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 一種改性石墨烯增強(qiáng)鎂基金屬材料及其制備方法與流程
- 一種硼酸鎂修飾的石墨烯復(fù)合物極壓抗磨劑的制備及含有該抗磨劑的節(jié)能環(huán)保發(fā)動(dòng)機(jī)油的制造方法與工藝
- 一種石墨烯和BNNT協(xié)同強(qiáng)韌化鎂黃長石骨支架的方法與流程
- 一種石墨烯增強(qiáng)的含長周期結(jié)構(gòu)鎂基復(fù)合材料及其制備方法與流程
- 從除鎂鹵水中提取鋰并制備電池級(jí)碳酸鋰的方法與流程
- 一種石墨烯增強(qiáng)鎂基復(fù)合材料的制備方法與流程
- 一種鎂基石墨烯復(fù)合材料的制備方法與流程
- 石墨烯薄膜基光能電池、光能手機(jī)的制造方法與工藝
- 一種石墨烯和準(zhǔn)晶復(fù)合強(qiáng)化的鎂基復(fù)合材料及其制備方法與流程