視網膜組織的制備方法與流程
[技術領域]
本發明涉及用于由多能干細胞制備視網膜細胞或視網膜組織的方法。
[
背景技術:
]
作為由多能干細胞制備諸如視網膜組織的神經組織的方法,已經報道了用于制備神經組織的方法,所述方法包括在無血清培養基中形成均勻的多能干細胞聚集體,懸浮培養所述聚集體,酌情在存在分化誘導因子等的條件下在用于分化誘導的培養基中懸浮培養所述聚集體,從而誘導多能干細胞向目的神經細胞的分化(專利文獻1和非專利文獻1)。例如,已知用于由多能干細胞得到多層視網膜組織的方法(非專利文獻2和專利文獻2),和用于獲得多層視網膜組織的方法,所述方法包括在含有wnt信號轉導途徑抑制物質的無血清培養基中形成均勻的多能干細胞聚集體,然后將其在存在基膜制劑的條件下懸浮培養,然后將其在含血清培養基中懸浮培養(非專利文獻3和專利文獻3)。另外,還已經報道了用于誘導多能干細胞向下丘腦組織分化的方法(專利文獻4和非專利文獻4)和誘導多能干細胞向神經前體細胞分化的方法(非專利文獻5和6)。
在存在飼養細胞的條件下并且加入用于維持未分化狀態的因子,培養作為這些制備方法的起始材料的多能干細胞,特別是在靈長類多能干細胞的情形中,從而維持未分化狀態。近年來,在維持未分化狀態的培養中已經取得了一些改進,并且已經報道了在不存在飼養細胞(無飼養細胞)的條件下加入用于維持未分化狀態的因子培養靈長類多能干細胞的方法(非專利文獻7,非專利文獻8和非專利文獻9)。需要使用通過該方法進行無飼養細胞培養的多能干細胞作為起始材料的制備視網膜細胞或視網膜組織的穩定方法。
[文獻列表]
[專利文獻]
[專利文獻1]wo2009/148170
[專利文獻2]wo2011/055855
[專利文獻3]wo2013/077425
[專利文獻4]wo2013/065763
[非專利文獻]
[非專利文獻1]cellstemcell,3,519-32(2008)
[非專利文獻2]nature,472,51-56(2011)
[非專利文獻3]cellstemcell,10(6),771-775(2012)
[非專利文獻4]nature,480,57-62(2011)
[非專利文獻5]naturebiotechnology,27(3),275-80(2009)
[非專利文獻6]procnatlacadsciusa,110(50),20284-9(2013)
[非專利文獻7]naturemethods,8,424-429(2011)
[非專利文獻8]scientificreports,4,3594(2014)
[非專利文獻9]invitrocelldevbiolanim.,46,247-58(2010)
[發明概述]
[發明要解決的問題]
本發明要解決的問題是提供一種用于由在不存在飼養細胞的條件下制備或培養的保持未分化狀態的多能干細胞制備視網膜細胞或視網膜組織的方法。
[解決問題的方式]
本發明人已經進行了深入的研究,嘗試解決前述問題,并且發現通過在不存在飼養細胞的條件下培養多能干細胞(特別是人ips細胞)同時維持未分化狀態,并且將得到的多能干細胞在含有sonichedgehog信號轉導途徑激活物質的培養基中進行懸浮培養,從而形成細胞聚集體,可以高效地形成具有光滑表面和致密內部并且維持未分化狀態的球形細胞聚集體。另外,本發明人已經發現,通過使用這種高質量的細胞聚集體,可以高效地誘導視網膜細胞或視網膜組織,這導致了本發明的完成。
即,本發明涉及下述各項:
[1]用于制備視網膜細胞或視網膜組織的方法,所述方法包括下述步驟(1)-(3):
(1)第一步,在不存在飼養細胞的條件下在含有用于維持未分化狀態的因子的培養基中培養人多能干細胞,
(2)第二步,在存在sonichedgehog信號轉導途徑激活物質的條件下懸浮培養第一步中得到的多能干細胞,從而形成細胞聚集體,和
(3)第三步,在存在bmp信號轉導途徑激活物質的條件下懸浮培養第二步中得到的聚集體,從而得到包含視網膜細胞或視網膜組織的聚集體。
[2][1]的制備方法,其中,在第二步中,將在第一步中得到的細胞分散,并且將分散的細胞進行懸浮培養。
[3][1]或[2]的制備方法,其中所述用于維持未分化狀態的因子是fgf信號轉導途徑激活物質。
[4][3]的制備方法,其中所述fgf信號轉導途徑激活物質是bfgf。
[5][1]-[4]中任一項的制備方法,其中,在第二步中,所述培養基中所述sonichedgehog信號轉導途徑激活物質的濃度是與10nm至700nm的sag的sonichedgehog信號轉導活性相對應的濃度。
[6][1]-[5]中任一項的制備方法,其中所述sonichedgehog信號轉導途徑激活物質是sag、purmorphamine或shh。
[7][1]-[6]中任一項的制備方法,其中所述bmp信號轉導途徑激活物質是選自由bmp2、bmp4、bmp7和gdf7組成的組的一種或多種蛋白。
[8][6]的制備方法,其中所述bmp信號轉導途徑激活物質是bmp4。
[9][1]-[8]中任一項的制備方法,其中,在第三步中,在第二步開始后第2天與第9天之間向所述培養基中添加所述bmp信號轉導途徑激活物質。
[10][1]-[9]中任一項的制備方法,其中,在第三步中,在包含濃度不超過與700nmsag的sonichedgehog信號轉導活性相對應的濃度的sonichedgehog信號轉導途徑激活物質的培養基中培養所述聚集體。
[11][1]-[10]中任一項的制備方法,其中第一步通過貼壁培養方法進行。
[12][1]-[11]中任一項的制備方法,其中所述多能干細胞是誘導的多能干細胞。
[13][1]-[12]中任一項的制備方法,其中在第二步中形成均勻的聚集體。
[14][1]-[13]中任一項的制備方法,其中在第三步中得到的聚集體包含一種或多種選自由下述各項組成的組的細胞:視網膜祖先細胞,神經視網膜祖先細胞,感光前體細胞,感光細胞,視桿感光細胞,視錐感光細胞,水平細胞,無長突細胞,中間神經元,神經節細胞,視網膜色素上皮細胞,和睫狀邊緣區細胞。
[15][1]-[14]中任一項的制備方法,其中所述懸浮培養在不存在基膜制劑的條件下進行。
[16]用于評價測試物質的毒性或功效的試劑,所述試劑包含通過[1]-[15]中任一項的方法制備的視網膜細胞或視網膜組織。
[17]用于評價測試物質的毒性或功效的方法,所述方法包括使所述物質與通過[1]-[15]中任一項的方法制備的視網膜細胞或視網膜組織接觸,并且檢測所述物質對所述細胞或組織的影響。
[18]用于治療由于視網膜組織紊亂導致的疾病的藥物,其包含通過[1]-[15]中任一項的方法制備的視網膜細胞或視網膜組織。
[19][18]的藥物,其中所述視網膜細胞是視網膜祖先細胞和/或視網膜層專有的神經元。
[20]用于治療由于視網膜組織紊亂導致的疾病的方法,所述方法包括向需要移植的受試者移植有效量的通過[1]-[15]中任一項的方法制備的視網膜細胞或視網膜組織。
[21]通過[1]-[15]中任一項的方法制備的視網膜細胞或視網膜組織,其用于治療由于視網膜組織紊亂導致的疾病。
[22]包含通過[1]-[15]中任一項的方法制備的視網膜細胞或視網膜組織作為活性成分的藥物組合物。
[發明效果]
按照本發明,可以由在不存在飼養細胞的條件下培養的多能干細胞高效地產生高質量的細胞聚集體,以及視網膜細胞和視網膜組織。
[附圖簡述]
圖1顯示比較例1和實施例1的培養條件以及聚集體的亮視野圖像(a-d)。
圖2顯示實施例1的培養條件以及聚集體針對視網膜組織標記(chx10,rx)的免疫組織化學染色圖像(a-d)。
圖3顯示實施例2的培養條件和聚集體的亮視野圖像(a-d)。
圖4顯示實施例2的培養條件(無bmp4處理)以及定量聚集體形態水平的圖表。
圖5顯示實施例3的培養條件以及聚集體針對視網膜組織標記(chx10,rx)的免疫組織化學染色圖像(a-d)。
圖6顯示在實施例4的培養條件下產生的視網膜組織針對視網膜組織標記的免疫染色圖像。
圖7顯示在實施例5的培養條件下產生的視網膜組織針對視網膜組織標記的免疫染色圖像。
圖8顯示在實施例6的培養條件下產生的聚集體的亮視野圖像(a-c)以及針對視網膜組織標記(chx10)的免疫染色圖像(d-f)。
圖9顯示在實施例7的培養條件下產生的聚集體的亮視野圖像(a-d)以及針對視網膜組織標記(chx10)的免疫染色圖像(e)。
圖10顯示在實施例8的培養條件下產生的聚集體的亮視野圖像(a,b)以及針對視網膜組織標記(chxl0,rx)的免疫染色圖像(c,d)。
[實施方案描述]
1.定義
在本發明中,“干細胞”意指具有分化潛能和保持分化潛能的增殖能力(特別是自我更新的能力)的未分化的細胞。干細胞依據分化潛能包括多種亞群,諸如多能干細胞(pluripotentstemcell),專能干細胞(multipotentstemcell),單能干細胞等。多能干細胞是指能夠在體外培養并且具有分化成屬于三個胚層(外胚層、中胚層、內胚層)和/或來源于胚外組織的組織的任意細胞譜系的潛能(多能性)的干細胞。專能干細胞意指具有分化成多種類型的組織或細胞但不是所有種類的組織或細胞的潛能的干細胞。單能干細胞意指具有分化成特定的組織或細胞的潛能的干細胞。
多能干細胞可以由受精卵、克隆胚胎、生殖干細胞、組織中的干細胞、體細胞等誘導。多能干細胞的實例包括胚胎干細胞(es細胞),eg細胞(胚胎生殖細胞),誘導的多能干細胞(ips細胞)等。由間質干細胞(msc)得到的muse細胞(多系分化應激持久細胞(multi-lineagedifferentiatingstressenduringcell))和由生殖細胞(例如,睪丸)產生的gs細胞也包括在多能干細胞中。胚胎干細胞最先在1981年建立,并且自1989年起還已經用于產生敲除小鼠。在1998年,建立了人胚胎干細胞,其也用于再生藥物。可以通過在飼養細胞上或在含有lif的培養基中培養內細胞團而產生es細胞。es細胞的制備方法記載在,例如,wo96/22362,wo02/101057,us5,843,780,us6,200,806,us6,280,718等中。胚胎干細胞可從給定的機構得到,或可以購買商購產品。例如,人胚胎干細胞,khes-1,khes-2和khes-3,可從京都大學前沿醫學科學研究院(kyotouniversity’sinstituteforfrontiermedicalsciences)得到。作為小鼠胚胎干細胞的eb5可從incorporatedadministrativeagencyriken得到,并且作為小鼠胚胎干細胞的d3細胞系可從atcc得到。
作為es細胞中的一種的核移植es細胞(ntes細胞)可以由通過將體細胞的細胞核移植到無核卵中產生的克隆胚胎建立。
eg細胞可以通過在含有mscf、lif和bfgf的培養基中培養原始生殖細胞而產生(cell,70:841-847,1992)。
本發明中的“誘導的多能干細胞”是通過已知的方法等使體細胞重新編程而被誘導具有多能性的細胞。具體地,可以提及通過表達多種基因的組合使分化的體細胞(諸如成纖維細胞、外周血單核細胞等)重新編程而被誘導具有多能性的細胞,所述多種基因選自由包括下述各項的重新編程基因組成的組:oct3/4,sox2,klf4,myc(c-myc,n-myc,l-myc),glisl,nanog,sall4,lin28,esrrb等。優選的重新編程因子的組合的實例包括:(1)oct3/4,sox2,klf4,和myc(c-myc或l-myc),和(2)oct3/4,sox2,klf4,lin28和l-myc(stemcells,2013;31:458-466)。
誘導的多能干細胞由yamanaka等人在2006年在小鼠細胞中建立(cell,2006,126(4),pp.663-676)。在2007年,還由人成纖維細胞建立了誘導的多能干細胞,并且具有與胚胎干細胞相似的多能性和自我更新能力(cell,2007,131(5),pp.861-872;science,2007,318(5858),pp.1917-1920;nat.biotechnol.,2008,26(1),pp.101-106)。除了基于通過基因表達的直接重新編程的制備方法之外,還可以通過添加化合物等由體細胞得到誘導的多能干細胞(science,2013,341,pp.651-654)。
還可以獲得建立的誘導的多能干細胞,并且,例如,由京都大學建立的人誘導的多能細胞系,諸如201b7細胞,201b7-ff細胞,253g1細胞,253g4細胞,1201c1細胞,1205d1細胞,1210b2細胞或1231a3細胞等可從京都大學和ipsacademiajapan,inc.獲得。作為建立的誘導的多能干細胞,例如,由京都大學建立的ff-i01細胞和ff-i14細胞可從京都大學獲得。
盡管用于獲得誘導的多能干細胞的體細胞沒有特別限制,但是可以提及組織來源的成纖維細胞、血液譜系細胞(例如,外周血單核細胞、t細胞)、肝細胞、胰腺細胞、腸上皮細胞、平滑肌細胞等。
當通過表達一些種類的基因進行重新編程產生誘導的多能干細胞時,對基因表達的方式沒有特別限制。前述方式的實例包括使用病毒載體(例如,反轉錄病毒載體,慢病毒載體,仙臺病毒(sendaivirus)載體,腺病毒載體,腺伴隨病毒載體)的感染法,使用質粒載體(例如,質粒載體,附加型載體)的基因轉移法(例如,磷酸鈣法,脂轉染法,retronectin法,電穿孔法),使用rna載體的基因轉移法(例如,磷酸鈣法,脂轉染法,電穿孔法),直接注射蛋白的方法等。
誘導的多能干細胞可以在存在飼養細胞的條件下或在不存在飼養細胞的條件下(無飼養細胞)產生。當在存在飼養細胞的條件下產生時,所述誘導的多能干細胞可以在存在用于維持未分化狀態的因子的條件下通過已知的方法產生。盡管用于在不存在飼養細胞的條件下產生誘導的多能干細胞的培養基沒有特別限制,但是可以使用已知的用于胚胎干細胞和/或誘導的多能干細胞的維持培養基和用于在無飼養細胞的條件下建立誘導的多能干細胞的培養基。用于在無飼養細胞的條件下建立誘導的多能干細胞的培養基的實例包括無飼養細胞培養基,諸如essential8培養基,tesr培養基,mtesr培養基,mtesr-e8培養基,stemfit培養基等。例如,可以在不存在飼養細胞的條件下,用仙臺病毒(sendaivirus)載體向體細胞中基因轉移oct3/4、sox2、klf4和myc4個因子而產生誘導的多能干細胞。
用于本發明的多能干細胞優選是es細胞或誘導的多能干細胞,更優選是誘導的多能干細胞。
作為專能干細胞,可以提及組織干細胞(還稱為組織中的干細胞、組織特異性干細胞或體干細胞),諸如造血干細胞、神經干細胞、視網膜干細胞、間充質干細胞等。
可以例如,通過使用同源重組技術產生遺傳上修飾的多能干細胞。染色體上要被修飾的基因的實例包括細胞標記基因、組織相容性抗原基因、與神經細胞紊亂導致的疾病相關的基因等。染色體上的靶基因可以使用以下各項中記載的方法進行修飾:manipulatingthemouseembryo,alaboratorymanual(操作小鼠胚胎,實驗室手冊),第二版,coldspringharborlaboratorypress(1994);genetargeting,apracticalapproach(基因靶向,實踐方法),irlpressatoxforduniversitypress(1993);biomanualseries8,genetargeting,makingofmutantmouseusingescell(基因靶向,使用es細胞產生突變體小鼠),yodoshaco.,ltd.(1995);等等。
具體而言,例如,分離包含要被修飾的靶基因(例如,細胞標記基因、組織相容性抗原基因、疾病相關的基因等)的基因組dna,并且使用該分離的基因組dna產生用于該靶基因同源重組的靶向載體。將所產生的靶向載體引入到干細胞中,并且選擇表現出在所述靶基因與所述靶向載體之間的同源重組的細胞,由此可以產生在染色體中具有所述修飾的基因的干細胞。
用于分離包含靶基因的基因組dna的方法的實例包括以下各項中記載的已知方法:molecularcloning,alaboratorymanual(分子克隆,實驗室手冊),第二版,coldspringharborlaboratorypress(1989),currentprotocolsinmolecularbiology(現代分子生物學流程),johnwiley&sons(1987-1997)等。包含靶基因的基因組基因也可以使用基因組dna文庫篩選系統(由genomesystems制造)、通用基因組步量試劑盒(universalgenomewalkerkits)(由clontech制造)等分離。也可以使用編碼靶蛋白的多核苷酸替代基因組dna。所述多核苷酸可以通過用pcr法擴增相對應的多核苷酸而得到。
用于靶基因同源重組的靶向載體的產生和同源重組子的有效選擇可以按照以下各項中記載的方法進行:genetargeting,apracticalapproach(基因靶向,實踐方法),irlpressatoxforduniversitypress(1993);biomanualseries8,genetargeting,makingofmutantmouseusingescell(基因靶向,使用es細胞產生突變體小鼠),yodoshaco.,ltd.(1995);等等。作為所述靶向載體,可以使用替換類型或插入類型中的任一種。作為所述選擇方法,可以使用諸如陽性選擇、啟動子選擇、陰性選擇、聚腺苷酸(polya)選擇等的方法。
用于從所選的細胞系中選擇需要的同源重組子的方法的實例包括用于基因組dna的dna雜交法(southernhybridizationmethod)、pcr法等。
本發明中的“哺乳動物”包括嚙齒類、有蹄類、食肉類、靈長類動物等。嚙齒類包括小鼠、大鼠、倉鼠、豚鼠等。有蹄類包括豬、牛、山羊、馬、綿羊等、食肉類包括狗、貓等。本發明中的“靈長類”是指屬于靈長類的哺乳動物,并且靈長類包括原猴亞目(prosimian),如狐猴(lemur),懶猴(loris),tupai等,和類人猿亞目(anthropoidea),如猴,類人猿(ape),人等。
用于本發明的多能干細胞是人多能干細胞,更優選是人誘導的多能干細胞(ips細胞)或人胚胎干細胞(es細胞)。
本發明中的“懸浮培養”或“懸浮培養法”是指在維持細胞或細胞聚集體懸浮在培養基中的狀態的同時進行培養和進行所述培養的方法。即,懸浮培養在細胞或細胞聚集體不粘附在培養容器等上的條件下進行,并且在允許粘附到培養容器等上的條件下進行的培養(貼壁培養或貼壁培養法)不包括在懸浮培養的范疇內。在這一情形中,細胞粘附意指在細胞或細胞聚集體與培養容器之間形成強的細胞-基質間接合。更具體地,懸浮培養是指在細胞或細胞聚集體與培養容器之間不形成強的細胞-基質間接合的條件下的培養,并且貼壁培養是指在細胞或細胞聚集體與培養容器等之間形成強的細胞-基質間接合的條件下的培養。
在懸浮培養的細胞聚集體中,形成平面的細胞-細胞粘附。在懸浮培養的細胞聚集體中,幾乎不形成與培養容器等的細胞-基質間接合,并且即使形成與培養容器等的細胞-基質間接合,其貢獻也是小的。在一些實施方案中,在聚集體內部存在內源性細胞-基質間接合,但是幾乎不形成與培養容器等的細胞-基質間接合,即使形成與培養容器等的細胞-基質間接合,其貢獻也是小的。
平面細胞-細胞粘附(平面附著)意指一個細胞經由平面與另一個細胞連接。更具體地,平面細胞-細胞粘附意指,例如,一個細胞不少于1%,優選不少于3%,更優選不少于5%的表面積粘附到另一個細胞的表面上。細胞的表面可以通過用對膜染色的試劑(例如,dii)染色、細胞粘附分子(例如,e-鈣粘蛋白和n-鈣粘蛋白)的免疫染色而觀察到。
進行懸浮培養時使用的細胞培養容器沒有特別限制,只要其能夠使得能夠“懸浮培養”即可,并且本領域普通技術人員能夠適當地確定此類細胞培養容器。此類細胞培養容器的實例包括燒瓶、組織培養瓶、培養平皿(平皿)、培養皿、組織培養皿、多聯培養皿、微量平板、微孔平板、微孔、多聯平板、多孔平板、室載玻片、碗(schale)、管、托盤、培養袋、錐形瓶(erlenmeyerflask)、旋轉燒瓶、搖瓶等。為了能夠允許懸浮培養,這些培養容器優選是非細胞粘附性的。可用的非細胞粘附性的培養容器包括表面沒有進行改善細胞粘附性的人工處理(例如,使用諸如基膜制劑、層粘連蛋白、觸覺蛋白(entactin)、膠原蛋白、明膠等的細胞外基質等進行的表面處理或用諸如聚賴氨酸、聚鳥氨酸等的聚合物進行的包被處理或正電荷處理等)以及類似處理的培養皿。作為非細胞粘附性培養容器,可以使用表面已被人工處理以減小對細胞的粘附性(例如,使用mpc聚合物等的超親水處理、蛋白低吸附性處理等)以及類似處理的培養容器。可以使用旋轉燒瓶、搖瓶等進行轉管(roller)培養。培養容器的培養表面可以是平底的或可以具有凹陷和凸出。
用于貼壁培養的培養容器沒有特別限制,只要可以進行“貼壁培養”即可,并且本領域普通技術人員能夠依據培養規模、培養條件和培養時間適當地選擇合適的培養容器。此類培養容器的實例包括燒瓶、組織培養瓶、培養平皿(平皿)、組織培養皿、多聯培養皿、微量平板、微孔平板、多聯平板、多孔平板、室載玻片、碗(schale)、管、托盤、培養袋、微載體、珠子、疊板、旋轉燒瓶和搖瓶。為了能夠允許貼壁培養,這些培養容器優選是細胞粘附性的。細胞粘附性的培養容器包括對表面進行人工處理以改善細胞粘附性的培養容器,并且具體是表面處理的培養容器,或可以提及內部用涂層劑涂覆的培養容器。涂層劑的實例包括細胞外基質,如層粘連蛋白[包括層粘連蛋白α5β1γ1(以下為層粘連蛋白511),層粘連蛋白α1β1γ1(以下為層粘連蛋白111)等和層粘連蛋白片段(層粘連蛋白511e8等)],觸覺蛋白,膠原蛋白,明膠,玻連蛋白,synthemax(corningincorporated),基質膠(matrigel)等,或聚合物,諸如聚賴氨酸,聚鳥氨酸等。所述表面處理的培養容器的實例包括通過正電荷處理等進行表面處理的培養容器。
在本發明中用于培養細胞的培養基可以由通常用于培養動物細胞的培養基作為基礎培養基而制備。所述基礎培養基的實例包括可以用于培養動物細胞的培養基,諸如bme培養基,bgjb培養基,cmrl1066培養基,glasgowmem(gmem)培養基,改良的mem鋅選擇培養基,imdm培養基,medium199培養基,eaglemem培養基,αmem培養基,dmem培養基,f-12培養基,dmem/f-12培養基,imdm/f12培養基,ham培養基,rpmi1640培養基,費希爾培養基(fischer’smedium),以及它們的混合培養基等。
本發明中的“無血清培養基”表示不含未調節的或未純化的血清的培養基。在本發明中,含有純化的血液來源的組分和動物組織來源的組分(例如,生長因子)的培養基也包括在無血清培養基中,除非其中含有未調節的或未純化的血清。
無血清培養基可以含有血清代替物。血清代替物的實例包括適當地含有以下物質的那些:白蛋白,轉鐵蛋白,脂肪酸,膠原蛋白前體,痕量元素,2-巰基乙醇或3’硫醇甘油,或它們的等效物等。此種血清代替物可以通過例如wo98/30679中所述的方法制備。此外,血清代替物可以是市售的產品。此種市售血清代替物的實例包括knockouttm血清替代品(knockouttmserumreplacement,lifetechnologies,現為thermofisher:下文中有時也被稱為ksr),化學成分確定的脂質濃縮物(由lifetechnologies生產),和glutamaxtm(由lifetechnologies生產),b27(由lifetechnologies生產),n2補充劑(由lifetechnologies生產)。
用于懸浮培養的無血清培養基可以適當地含有脂肪酸或脂質,氨基酸(例如,非必需氨基酸),維生素,生長因子,細胞因子,抗氧化劑,2-巰基乙醇,丙酮酸,緩沖劑,無機鹽等。
為避免復雜的制備,補充有適當量(例如,約0.5%-約30%,優選約1-約20%)的市售的ksr(由lifetechnologies生產)的無血清培養基可以用作所述無血清培養基(例如,補充有10%ksr、1x化學成分確定的脂質濃縮物(cdlc)和450μm1-一硫代甘油的f-12培養基和imdm培養基的1∶1混合物的培養基)。關于與ksr相當的產品,可以提及jp-a-2001-508302中公開的培養基。
本發明中的“含血清培養基”表示含有未調節的或未純化的血清的培養基。所述培養基可以含有脂肪酸、脂質,氨基酸(例如,非必需氨基酸),維生素,生長因子,細胞因子,抗氧化劑,2-巰基乙醇,1-一硫代甘油,丙酮酸,緩沖劑,無機鹽等。例如,血清培養基可以用在維持由本發明產生的神經組織(例如,視網膜組織)的步驟中(也被稱為成熟培養)。
在本發明中,培養優選地在無外源物質(xeno-free)的條件下進行。“無外源物質”意指消除源自與要培養的細胞不同的物種的成分的條件。
在本發明中,“含有物質x的培養基”和“在存在物質x的條件下”表示補充有外源物質x的培養基或含有外源物質x的培養基,或在存在外源物質x的條件下。即,當培養基中存在的細胞或組織內源性表達、分泌或產生物質x時,內源性物質x與外源性物質x區分,并且,理解無內源性物質x的培養基落在“含有物質x的培養基”的范疇之外(甚至當其包含內源性物質x時)。
例如,“含有sonichedgehog信號轉導途徑激活物質的培養基”是補充有外源性sonichedgehog信號轉導途徑激活物質的培養基或包含外源性sonichedgehog信號轉導途徑激活物質的培養基。
在本發明中,飼養細胞是指在培養干細胞時共存的除干細胞之外的細胞。用于培養多能干細胞同時保持未分化狀態的飼養細胞的實例包括小鼠成纖維細胞(mef等)、人成纖維細胞、snl細胞等。關于飼養細胞,優選經歷生長抑制處理的飼養細胞。生長抑制處理的實例包括用生長抑制劑(例如,絲裂霉素c)、γ輻射、uv輻照等處理。用于培養多能干細胞同時保持未分化狀態的飼養細胞通過分泌激素因子(優選用于維持未分化狀態的因子)或產生用于細胞粘附的構架(細胞外基底)而有助于維持多能干細胞的未分化。
在本發明中,不存在飼養細胞(無飼養細胞)意指在不存在飼養細胞的條件下培養。不存在飼養細胞意指,例如,無飼養細胞添加的條件,或基本上無飼養細胞的條件(例如,飼養細胞數目相對于細胞總數的比例不大于3%)。
在本發明中,細胞的“聚集體”是指由分散在培養基中的細胞組裝形成的團塊,其中細胞彼此粘附。細胞團塊、胚狀體、球體、球狀體也包含在所述細胞聚集體中。優選地,在細胞的聚集體中形成平面細胞-細胞粘附。在一些實施方案中,在一些或全部的聚集體中,細胞有時形成細胞-細胞接合和/或細胞粘附,例如,粘附接合。本發明中的“聚集體”特別包括:在上文提及的本發明[1]的第二步中產生的聚集體,其由在開始懸浮培養時分散的細胞形成,和在上文提及的本發明[1]的第三步中產生的聚集體,其包含由多能干細胞分化的誘導的視網膜細胞,并且所述“聚集體”還包括在上文提及的本發明[1]的第二步開始時(即,在懸浮培養開始時)已經形成的聚集體。在第二步中形成的細胞聚集體包含“胚狀體(eb)”。
在本發明中,“均勻的聚集體”意指在培養多個聚集體時,每個聚集體的尺寸一致,并且在通過最大直徑的長度評價所述聚集體的尺寸時,最大直徑的長度變化小。更具體地,這意味著全部聚集體群體中不少于75%的聚集體在所述聚集體群體中最大直徑的平均值±100%、優選平均值±50%、更優選平均值±20%內。
在本發明中,“形成均勻的細胞聚集體”意指,當匯聚細胞形成細胞聚集體并且懸浮培養所述細胞聚集體時,“迅速聚集給定數量的分散的細胞”從而形成尺寸均勻的細胞聚集體。
分散是指通過諸如酶處理、物理處理等的分散處理將細胞或組織分成小細胞塊(不少于2個細胞,并且不多于100個細胞,優選不多于50個細胞)或單個細胞。給定數量的分散的細胞是特定數量的細胞塊或單個細胞的集合。
分散多能干細胞的方法的實例包括機械分散處理、細胞分散液處理和細胞保護劑添加處理。這些處理可以聯合進行。優選地,進行細胞分散處理,然后進行機械分散處理。
關于機械分散處理的方法,可以提及吹吸處理或通過刮刀刮片操作。
關于用于細胞分散液處理的細胞分散液,可以提及包含諸如胰蛋白酶、膠原蛋白酶、透明質酸酶、彈性蛋白酶、鏈霉蛋白酶、dna酶、木瓜蛋白酶等中的任一種酶和諸如乙二胺四乙酸等的螯合劑的溶液。還可以使用商購的細胞分散液,諸如trypleselect(由lifetechnologies生產)和trypleexpress(由lifetechnologies生產)。
當分散多能干細胞時,可以通過用細胞保護劑處理而抑制多能干細胞的細胞死亡。關于用于細胞保護劑處理的要使用的細胞保護劑,可以提及fgf信號轉導途徑激活物質、肝素、igf信號轉導途徑激活物質、血清和血清代替物。為了抑制由分散引起的細胞死亡(特別是人多能干細胞的細胞死亡),可以在分散時添加rho相關卷曲螺旋激酶(rock)抑制物質或肌球蛋白抑制物質。關于rock抑制物質,可以提及y-27632、法舒地爾(fasudil)(ha1077)、h-1152等。關于肌球蛋白抑制物質。可以提及blebbistatin。關于優選的細胞保護劑,可以提及rock抑制物質。
例如,用于分散多能干細胞的方法包括,例如,包括在存在rock抑制物質作為細胞保護劑的條件下,用細胞分散液(trypleselect)處理多能干細胞的集落,并且通過吹吸進一步將其分散的方法。
在本發明的制備方法中,優選地通過迅速匯集多能干細胞而形成多能干細胞聚集體。當以這樣的方式形成多能干細胞聚集體時,可以以良好的重現性在由所形成的聚集體誘導和分化的細胞中形成上皮樣結構。形成聚集體的實驗操作的實例包括涉及使用具有小孔的平板(例如,當以平底方式計算時,具有基底面積為約0.1-2.0cm2的孔的平板)、微孔等將細胞保持在小空間內的方法,涉及通過用小離心管短時間離心而使細胞聚集的方法。關于具有小孔的平板,例如,可以提及24孔平板(當以平底方式計算時,面積約為1.88cm2)、48孔平板(當以平底方式計算時,面積約為1.0cm2)、96孔平板(當以平底方式計算時,面積約為0.35cm2,內徑約為6-8mm)和384孔平板。優選96孔平板。關于具有小孔的平板的形狀,例如,從上方看孔時底表面的形狀為多邊形、長方形、橢圓形、真正的圓形,優選是真正的圓形。關于從側孔觀察孔時具有小孔的平板的形狀,底表面的形狀可以是平底結構或具有高外部周長和低內部凹陷的結構。底表面的形狀包括,例如,u型底、v型底、m型底,優選u型底或v型底,更優選v型底。關于具有小孔的平板,也可以使用在底表面上具有凹凸或齒狀(dent)的細胞培養平皿(例如,60mm-150mm的平皿,培養瓶)。具有小孔的平板的底表面優選是非細胞粘附性底表面,優選前述非細胞粘附性涂覆的底表面。
多能干細胞聚集體或包含多能干細胞的細胞群的聚集體的形成以及它們的均勻性可以基于聚集體塊的尺寸和其中的細胞數目、宏觀形態、通過組織染色分析的微觀形態和它們的同質性等來確定。另外,可以基于聚集體的宏觀形態、通過組織染色分析的微觀形態及其均勻性、分化和未分化標記的表達及其均勻性、分化標記表達的控制及其同步性、聚集體之間的分化效率的重現性等確定聚集體中上皮樣結構的形成及其均勻性。
在本發明中,“組織”是指細胞群結構,其具有這樣的構造,其中具有均勻的形態或性質的一種細胞,或具有不同形態和性質的多種類型的細胞在空間上以給定模式排列。
在本發明中,“神經組織”是指由神經細胞組成的組織,包括處在發育階段或成人階段的大腦、中腦、小腦、脊髓、視網膜、周圍神經、前腦、后腦、端腦、間腦等。神經組織有時形成具有層結構的上皮結構(神經上皮),并且細胞聚集體中神經上皮的量可以通過使用光學顯微鏡的亮視野觀察進行評價。
在本發明中,“神經細胞”是指來源于外胚層的組織中除表皮譜系細胞之外的細胞。即,其包括諸如神經前體細胞、神經元(神經元細胞)、神經膠質、神經干細胞、神經元前體細胞、神經膠質前體細胞等的細胞。神經細胞還包括組成下文提及的視網膜組織(視網膜細胞)、視網膜祖先細胞、視網膜層專有的神經元、神經視網膜細胞和視網膜色素上皮細胞的細胞。神經細胞可以通過使用巢蛋白、tuj1、psa-ncam、n-鈣粘蛋白等作為標記進行鑒定。
神經元(或神經元細胞)是形成神經回路并且對信號轉導有貢獻的功能細胞,并且可以通過使用不成熟神經元標記(諸如tuj1,dcx,huc/d等)和/或成熟神經元細胞標記(諸如map2,neun等)的表達作為指標進行鑒定。
關于神經膠質,可以提及星形膠質細胞、少突膠質細胞、müller膠質等。關于星形膠質細胞標記,可以提及gfap;關于少突膠質細胞標記,可以提及o4,并且關于müller膠質標記,可以提及cralbp等。
神經干細胞是具有向神經元和膠質細胞的分化潛能(多能性)和維持多能性的增殖能力(有時稱為自我更新能力)的細胞。關于神經干細胞標記,可以提及巢蛋白、sox2、musashi、hes家族、cd133等;然而,這些標記通常是關于祖先細胞/前體細胞的標記,并且不被認為是神經干細胞-特異性的標記。神經干細胞的數量可以通過神經球測定、克隆測定等評估。
神經元前體細胞是具有增殖能力的細胞,其產生神經元,并且不產生膠質細胞。關于神經元前體細胞標記,可以提及tbr2、tα1等。備選地,不成熟的神經元標記(tuj1,dcx,huc/d)-陽性的和生長標記(ki67,ph3,mcm)-陽性的細胞也可以被鑒定為神經元前體細胞。
神經膠質前體細胞是具有增殖能力的細胞,其產生神經膠質細胞,并且不產生神經元。
神經前體細胞是前體細胞的集合,包括神經干細胞、神經元前體細胞和神經膠質前體細胞,并且具有增殖能力和神經元-與神經膠質-產生能力。神經前體細胞可以用巢蛋白、glast、sox2、soxl、musashi、pax6等作為標記鑒定。備選地,神經細胞標記-陽性的和生長標記(ki67,ph3,mcm)-陽性的細胞也可以被鑒定為神經前體細胞。
在本發明中,“視網膜組織”意指這樣的組織,其中在體內組成各個視網膜層的一種類型的或至少兩種或更多種類型的細胞在空間上按層排列,所述細胞諸如感光細胞、感光前體細胞、視桿感光細胞、視錐感光細胞、中間神經元、水平細胞、雙極細胞、無長突細胞、視網膜神經節細胞(神經節細胞)、視網膜色素上皮細胞(rpe)、睫狀邊緣區細胞、它們的祖先/前體細胞以及視網膜祖先細胞等。由每個細胞組成的視網膜層可以通過已知的方法,例如,通過細胞標記表達的存在或不存在或其水平等驗證。
本發明中的“視網膜層”表示構成視網膜的每個層。其具體實例包括視網膜色素上皮層,光感受器層,外界膜,外核層,外網織層,內核層,內網織層,神經節細胞層,神經纖維層和內界膜。
本發明中的“視網膜祖先細胞”是指能夠分化成任何成熟的視網膜細胞(包括感光細胞,水平細胞,雙極細胞,無長突細胞,視網膜神經節細胞和視網膜色素上皮細胞等)的祖先細胞。
在本發明中,“神經視網膜祖先細胞”是指能夠分化成多種成熟的視網膜細胞(包括感光細胞,水平細胞,雙極細胞,無長突細胞,視網膜神經節細胞等)中的任一種的祖先細胞。通常,神經視網膜祖先細胞不分化成視網膜色素上皮細胞。
感光前體細胞、水平細胞前體細胞、雙極細胞前體細胞、無長突細胞前體細胞、視網膜神經節細胞前體細胞和視網膜色素上皮前體細胞分別是指確定分化成感光細胞、水平細胞、雙極細胞、無長突細胞、視網膜神經節細胞和視網膜色素上皮細胞的前體細胞。
在本發明中,“視網膜層專有的神經元”是構成視網膜層的細胞并且為視網膜層所專有的神經元細胞(神經元)。視網膜層專有的神經元的實例包括雙極細胞,視網膜神經節細胞,無長突細胞,水平細胞,感光細胞,視網膜色素上皮細胞,視桿細胞和視錐細胞。
本發明中的“視網膜細胞”包括前述視網膜祖先細胞和視網膜層專有的神經元。
視網膜細胞標記的實例包括在視網膜祖先細胞中表達的rx(還稱作rax)、pax6和chx10,在下丘腦神經元的前體細胞中表達而在視網膜祖先細胞中不表達的nkx2.1,在下丘腦神經上皮中表達而在視網膜中不表達的sox1,在感光細胞的前體細胞中表達的crx、blimp1等,等等。視網膜層專有的神經元的標記的實例包括在雙極細胞中表達的chx10、pkcα和l7,在視網膜神經節細胞中表達的tuji和brn3,在無長突細胞表達中的鈣視網膜蛋白,在水平細胞表達中的鈣結合蛋白,在成熟的感光細胞中表達的視紫質(rhodopsin)和恢復蛋白,在視桿細胞中表達的nrl和視紫質,在視錐細胞中表達的rxr-γ和s-視蛋白,在視網膜色素上皮細胞中表達的rpe65和mitf,在睫狀邊緣區中表達的rdh10和ssea1等。
2.制備視網膜細胞或視網膜組織的方法
本發明的制備方法是用于制備視網膜細胞或視網膜組織的方法,所述方法包括下述步驟(1)-(3):
(1)第一步,在不存在飼養細胞的條件下在含有用于維持未分化狀態的因子的培養基中培養人多能干細胞,
(2)第二步,在存在sonichedgehog信號轉導途徑激活物質的條件下懸浮培養第一步中得到的多能干細胞,從而形成細胞聚集體,和
(3)第三步,在存在或不存在分化誘導因子的條件下懸浮培養第二步中得到的聚集體,從而得到包含視網膜細胞或視網膜組織的聚集體。
在步驟(1)中,在不存在飼養細胞的條件下在含有用于維持未分化狀態的因子的培養基中培養人多能干細胞。
關于步驟(1)中的人多能干細胞,可以提及人誘導的多能干細胞或人胚胎干細胞(es細胞)。
誘導的多能干細胞的制備方法沒有特別限制,并且其可以通過本領域普通技術人員公知的方法產生,如上文提及的。在無飼養細胞的條件下進行制備誘導的多能干細胞的步驟(即,使體細胞重新編程建立多能干細胞的步驟)也是合乎需要的。
盡管胚胎干細胞(es細胞)的制備方法沒有特別限制,并且可以通過本領域普通技術人員公知的方法制備,如上文提及的,在無飼養細胞的條件下制備胚胎干細胞(es細胞)的步驟也是合乎需要的。
用于得到步驟(1)中所用的多能干細胞的維持培養或擴增培養可以通過本領域普通技術人員公知的方法進行,如上文提及的。盡管上文提及的多能干細胞的維持培養和擴增培養可以通過貼壁培養或懸浮培養進行,但是其優選地通過貼壁培養進行。盡管上文提及的多能干細胞的維持培養和擴增培養可以在存在飼養細胞的條件下或在無飼養細胞的條件下進行,但是其優選在無飼養細胞的條件下進行。
在步驟(1)中不存在飼養細胞(無飼養細胞)意指基本上沒有飼養細胞的條件(例如,飼養細胞數目相對于細胞總數的比例不大于3%)。優選地,步驟(1)在無飼養細胞的條件下進行。
用于步驟(1)的培養基沒有特別限制,只要其是能夠允許在無飼養細胞條件下培養多能干細胞培養以維持未分化狀態的培養基(無飼養細胞培養基)即可。優選地,為了允許培養以維持未分化狀態的培養,其包含用于維持未分化狀態的因子。例如,其是包含用于維持未分化狀態的因子并且不含tgfβ家族信號轉導途徑抑制物質和sonichedgehog信號轉導途徑激活物質的培養基。
用于維持未分化狀態的因子沒有特別限制,只要其是具有抑制多能干細胞分化的作用的物質即可。在致敏的(primed)多能干細胞(例如,人es細胞,人ips細胞)的情形中,本領域普通技術人員廣泛應用的用于維持未分化狀態的因子的實例包括fgf信號轉導途徑激活物質、tgfβ家族信號轉導途徑激活物質、胰島素等。關于fgf信號轉導途徑激活物質,可以特別提及成纖維細胞生長因子(例如,bfgf,fgf4,fgf8)。關于tgfβ家族信號轉導途徑激活物質,可以提及tgfβ信號轉導途徑激活物質,nodal/激活蛋白信號轉導途徑激活物質。關于tgfβ信號轉導途徑激活物質,可以提及tgfβ1、tgfβ2。關于nodal/激活蛋白信號轉導途徑激活物質,可以提及nodal、激活蛋白a、激活蛋白b。當培養人多能干細胞(人es細胞,人ips細胞)時,步驟(1)的培養基優選包含bfgf作為用于維持未分化狀態的因子。
要用于本發明的維持未分化狀態的因子通常是用于維持哺乳動物未分化狀態的因子。所述哺乳動物例如是上文提及的那些。由于用于維持未分化狀態的因子可以在哺乳動物物種之間具有交叉反應性,因此也可以使用用于維持任何哺乳動物未分化狀態的因子,只要能夠維持要培養的多能干細胞的未分化狀態即可。優選地,使用用于維持與要培養的細胞是同一物種的哺乳動物的未分化狀態的因子。例如,對于人多能干細胞的培養,使用用于維持未分化狀態的人因子(例如,bfgf,fgf4,fgf8,egf,nodal,激活蛋白a,激活蛋白b,tgfβ1,tgfβ2等)。此處,“人蛋白x”意指蛋白x具有在人體內天然表達的蛋白x的氨基酸序列。
要用于本發明的維持未分化狀態的因子優選是分離的。“分離的”意指已經進行了去除除想要的成分或細胞之外的因子的操作,并且所述成分或細胞不再以天然存在的狀態存在。因此,“分離的蛋白x”不包括由培養的細胞或組織產生的和包含在細胞或組織中或在培養基中的內源性蛋白x。“分離的蛋白x”的純度(蛋白x重量占總蛋白重量的百分數)通常不小于70%,優選不小于80%,更優選不小于90%,還優選不小于99%,進一步優選為100%。因此,在一個實施方案中,本發明包括提供分離的用于維持未分化狀態的因子的步驟。在一個實施方案中,其包括向步驟(1)中使用的培養基中外源添加分離的用于維持未分化狀態的因子的步驟。備選地,可以在步驟(1)中使用的培養基中預先添加用于維持未分化狀態的因子。
在步驟(1)中使用的培養基中用于維持未分化狀態的因子的濃度是能夠維持要培養的多能干細胞的未分化狀態的濃度,并且可以由本領域普通技術人員適當地確定。例如,當在不存在飼養細胞的條件下使用bfgf作為用于維持未分化狀態的因子時,其濃度通常為約4ng-500ng/ml,優選10ng-200ng/ml,更優選約30ng-150ng/ml。
關于無飼養細胞的培養基,已經開發了多種合成的培養基,并且是可商購獲得的,例如,可以提及essential8培養基。essential8培養基是包含下述各項作為添加劑的dmem/f12培養基:l-抗壞血酸-2-磷酸鎂(64mg/l),硒酸鈉(sodiumselenium)(14μg/1),胰島素(19.4mg/1),nahco3(543mg/l),轉鐵蛋白(10.7mg/l),bfgf(100ng/ml),和tgfβ家族信號轉導途徑激活物質(tgfβ1(2ng/ml)或nodal(100ng/ml))(naturemethods,8,424-429(2011))。可商購的無飼養細胞培養基的實例包括essential8(由lifetechnologies制造),s-培養基(由dspharmabiomedical制造),stempro(由lifetechnologies制造),hesf9(procnatlacadsciusa.2008年9月9日;105(36):13409-14),mtesr1(由stemcelltechnologies制造),mtesr2(由stemcelltechnologies制造),和tesr-e8(由stemcelltechnologies制造)。除了這些之外,可以提及stemfit(由ajinomotoco.,inc.制造)作為無飼養細胞的培養基。本發明可以通過在上文提及的步驟(1)中使用這些而便利地進行。
盡管用于貼壁培養的培養容器沒有特別限制,只要能夠進行“貼壁培養”即可,但是優選細胞粘附性培養容器。細胞粘附性培養容器包括表面已經經過人工處理以提高細胞粘附性的培養容器,并且具體地,可以提及上文提及的表面處理的培養容器,內部用涂層劑涂覆的培養容器。涂層劑的實例包括細胞外基質,如層粘連蛋白[包括層粘連蛋白α5β1γ1(以下為層粘連蛋白511),層粘連蛋白α1β1γ1(以下為層粘連蛋白111)等和層粘連蛋白片段(層粘連蛋白511e8等)],觸覺蛋白,膠原蛋白,明膠,玻連蛋白,synthemax(corningincorporated),基質膠(matrigel)等,或聚合物,諸如聚賴氨酸,聚鳥氨酸等,以及類似的物質。還可以使用表面經過正電荷處理等處理的培養容器。優選的是層粘連蛋白,更優選的是層粘連蛋白511e-8。層粘連蛋白511e-8可以是商購產品(例如,imatrix-511,nippi)。
盡管用于步驟(1)的培養基可以是含血清培養基或無血清培養基,但是優選是無血清培養基,以避免化學上不確定的成分的污染。
為了避免化學上不確定的成分的污染,用于步驟(1)的培養基可以是成分為化學上確定的培養基。
在步驟(1)中,多能干細胞可以在懸浮培養和貼壁培養的任一條件下培養,優選進行貼壁培養。
對于步驟(1)中在無飼養細胞的條件下培養多能干細胞,可以使用前文提及的無飼養細胞培養基作為培養基。
對于步驟(1)中在無飼養細胞的條件下培養多能干細胞,可以使用適當的基質作為構架,用于給多能干細胞提供替代飼養細胞的構架。多能干細胞在表面用作為構架的基質涂覆的細胞容器中進行貼壁培養。
關于可以用作構架的基質,可以提及層粘連蛋白(natbiotechnol28,611-615(2010)),層粘連蛋白片段(natcommun3,1236(2012)),基膜制劑(natbiotechnol19,971-974(2001)),明膠,膠原蛋白,硫酸乙酰肝素蛋白聚糖,觸覺蛋白,玻連蛋白等。
“層粘連蛋白”是由α、β、γ鏈組成的異三聚體分子,并且是包含具有不同亞基鏈組成的異構體的細胞外基質蛋白。具體地,基于具有5種α鏈、4種β鏈和3種γ鏈的異三聚體組合,層粘連蛋白具有約15種異構體。層粘連蛋白的名稱通過組合α鏈(α1-α5)、β鏈(β1-β4)和γ鏈(γ1-γ4)各自的數目而確定。例如,具有α5鏈、β1鏈、γ1鏈的組合的層粘連蛋白稱為層粘連蛋白511。在本發明中,優選使用層粘連蛋白511(natbiotechnol28,611-615(2010))。
用于本發明的層粘連蛋白通常是哺乳動物層粘連蛋白。關于哺乳動物,可以提及上文提及的那些。為了獲得無外源物質(xeno-free)的條件,優選使用與要培養的細胞是相同物種的哺乳動物的層粘連蛋白。例如,使用人層粘連蛋白(優選地,人層粘連蛋白511)培養人多能干細胞。
本發明中使用的層粘連蛋白片段沒有特別限制,只要其具有與多能干細胞的粘附性并且允許在無飼養細胞的條件下維持培養多能干細胞即可,并且其優選是e8片段。在通過用彈性蛋白酶消化層粘連蛋白511得到的多個片段中,層粘連蛋白e8片段被鑒定為具有強細胞粘附活性的片段(emboj.,3:1463-1468,1984,j.cellbiol.,105:589-598,1987)。在本發明中,優選使用層粘連蛋白511的e8片段(natcommun3,1236(2012),scientificreports4,3549(2014))。用于本發明的層粘連蛋白e8片段不需要是層粘連蛋白的彈性蛋白酶消化產物,并且可以是重組的。為了避免不確定成分的污染,在本發明中優選使用重組的層粘連蛋白片段。層粘連蛋白511的e8片段可商購獲得,并且,例如,可以從nippi,inc.等購買。
用于本發明的層粘連蛋白或層粘連蛋白片段優選是分離的。
本發明中的“基膜制劑”是指這樣的制劑,即,當將能夠形成基膜的目的細胞涂布在其上并培養時,包含具有與上皮細胞的那些功能類似的控制細胞形態、分化、生長、移動性、功能表達等的功能的基膜組成成分的制劑。例如,當進行進一步的貼壁培養時,通過本發明制備的神經細胞和神經組織可以分散并在存在基膜制劑的條件下培養。此處,“基膜組成成分”是指在動物組織中的上皮細胞層與間質細胞層等之間存在的薄膜形式的胞外基質分子。例如,基膜制劑可以通過用能夠溶解細胞的脂質的溶液、堿溶液等從支持物上去除能夠形成基膜的細胞而產生,所述細胞通過基膜粘附在所述支持物上。基膜制劑的實例包括可作為基膜制劑商購獲得的產品(例如,matrigeltm(由corningincorporated制造:以下有時稱為基質膠(matrigel))),geltrextm(由lifetechnologies制造),和已知為基膜成分的細胞外基質(例如,層粘連蛋白,iv型膠原蛋白,硫酸乙酰肝素蛋白聚糖,觸覺蛋白等)。
matrigeltm是從engelbrethholmswarn(ehs)小鼠肉瘤提取的基膜制劑。matrigeltm的主要成分是iv型膠原蛋白、層粘連蛋白、硫酸乙酰肝素蛋白聚糖和觸覺蛋白。除了這些之外,包含tgf-β、fgf、組織纖溶酶原激活物和由ehs腫瘤天然產生的生長因子。matrigeltm的“生長因子減少的產品”具有比常規matrigeltm低的生長因子濃度,并且其標準濃度為:<0.5ng/ml的egf,<0.2ng/ml的ngf,<5pg/ml的pdgf,5ng/ml的igf1,和1.7ng/ml的tgfβ。
為了避免不確定的成分的污染,在本發明中優選使用分離的層粘連蛋白或層粘連蛋白片段。
優選地,在步驟(1)中在無飼養細胞的條件下培養多能干細胞時,將人多能干細胞在表面用分離的層粘連蛋白511或層粘連蛋白511的e8片段(更優選地,層粘連蛋白511的e8片段)涂覆的細胞容器中以粘附狀態培養。
盡管步驟(1)中培養多能干細胞的時間期沒有特別限制,只要可以實現提高步驟(2)中形成的聚集體的質量的效果即可,其通常為0.5-144小時,優選2-96小時,更優選6-48小時,進一步優選12-48小時,進一步更優選18-28小時(例如,24小時)。即,第一步在步驟(2)開始前0.5-144小時(優選18-28小時)開始,并且步驟(2)在步驟(1)結束時繼續進行。
在步驟(1)中,可以酌情更換培養基,并且一個實施方案具體包括涉及每1-2天更換培養基的方法。此處,例如,培養基可以更換為不含下述細胞保護劑或抑制細胞死亡的試劑(如rock抑制劑等)的培養基。
可以適當地確定步驟(1)中的培養條件,如培養溫度和co2濃度。例如,盡管培養溫度為約30℃-約40℃,但是優選約37℃。例如,co2濃度為約1%-約10%,優選約5%。
在一個優選的實施方案中,在不存在飼養細胞的條件下,和在包含bfgf的無血清培養基中,以粘附狀態培養人多能干細胞(例如,人ips細胞)。優選地,在表面用層粘連蛋白511、層粘連蛋白511的e8片段或玻連蛋白涂覆的細胞容器中進行貼壁培養。貼壁培養優選地使用essential8、tesr培養基、mtesr培養基、mtesr-e8培養基或stemfit培養基、更優選essential8或stemfit培養基作為無飼養細胞的培養基進行。
在一個優選的實施方案中,在不存在飼養細胞的條件下,和在包含bfgf的無血清培養基中,懸浮培養人多能干細胞(例如,人ips細胞)。在懸浮培養中,人多能干細胞可以形成人多能干細胞聚集體。
解釋步驟(2),其中步驟(1)得到的多能干細胞在存在sonichedgehog信號轉導途徑激活物質的條件下懸浮培養,從而形成多能干細胞的細胞聚集體。
用于步驟(2)的培養基沒有特別限制,只要其在上文提及的定義部分有記載即可。用于步驟(2)的培養基可以是含血清培養基或無血清培養基。為了避免化學上不確定成分的污染,在本發明中優選使用無血清培養基。例如,可以使用無wnt信號轉導途徑抑制物質的無血清培養基。例如,為了避免復雜的制備,優選使用補充了適量的商購血清代替物(如ksr等)的無血清培養基(例如,補充了10%ksr、450μm1-一硫代甘油和1x化學成分確定的脂質濃縮物的imdm與f-12的1∶1混合物的培養基,或補充了5%-20%ksr、neaa、丙酮酸、2巰基乙醇的gmem培養基)。在人es細胞的情形中,要添加到無血清培養基中的ksr的量通常為約1%至約30%,優選約2%至約20%。
關于聚集體的形成,首先進行步驟(1)得到的多能干細胞的分散操作。通過分散操作得到的“分散的細胞”是指其中例如不少于70%的細胞是單細胞并且不多于30%的細胞是2-50個細胞的團塊的狀態。優選地,關于分散的細胞,可以提及其中不少于80%的細胞是單細胞并且不多于20%的細胞是2-50個細胞的團塊的狀態。分散的細胞是指幾乎沒有細胞的相互粘附(例如,平面附著)的狀態。在該實施方案的一部分中,分散的細胞是指幾乎不含細胞-細胞接合(例如,粘附連接)的狀態。
步驟(1)得到的多能干細胞的分散操作可以包含上文提及的機械分散處理、細胞分散液處理和細胞保護劑添加處理。這些處理可以聯合進行。優選地,細胞分散液處理與細胞保護劑添加處理同時進行,然后進行機械分散處理。
關于用于細胞保護劑添加處理的細胞保護劑,可以提及fgf信號轉導途徑激活物質,肝素,igf信號轉導途徑激活物質,血清,和血清代替物。此外,為了抑制由分散誘導的多能干細胞的細胞死亡(特別地,人多能干細胞的細胞死亡)并且保護細胞,可以添加rho相關卷曲螺旋激酶(rock)抑制劑或肌球蛋白抑制劑。為了抑制由分散誘導的多能干細胞(特別是人多能干細胞)的細胞死亡,可以在第二步培養開始時添加rho相關卷曲螺旋激酶(rock)抑制物質或肌球蛋白抑制劑。關于rock抑制物質,可以提及y-27632、fasudil(ha1077)、h-1152等。關于肌球蛋白抑制劑,可以提及blebbistatin。
關于用于細胞分散處理的細胞分散液,可以提及包含諸如胰蛋白酶、膠原蛋白酶、透明質酸酶、彈性蛋白酶、鏈霉蛋白酶、dna酶、木瓜蛋白酶等中的任一種酶和諸如乙二胺四乙酸等的螯合劑的溶液。也可以使用商購的細胞分散液,諸如trypleselect(由lifetechnologies制造)和trypleexpress(由lifetechnologies制造)。
關于機械分散處理方法,可以提及吹吸處理或刮刀的刮擦。
將分散的細胞懸浮在上文提及的培養基中。
然后,將分散的多能干細胞的混懸液接種在上文提及的培養容器中,將分散的多能干細胞在不與所述培養容器粘附的條件下培養,由此多個細胞聚集在一起形成聚集體。
在這種情形中,可以通過將分散的多能干細胞接種在比較大的培養容器中,如10cm平皿中,在一個培養容器中同時形成多個細胞聚集體。然而,在這種情形中,聚集體的尺寸不同。因此,例如,將給定量的分散的多能干細胞放置在多孔平板(u型底、v型底)(如96孔微量平板)的每個孔中,并且進行靜置培養,由此在每個孔中細胞快速凝聚形成一個聚集體。從多個孔中回收聚集體,由此可以得到均勻的聚集體群。
步驟(2)中多能干細胞的濃度可以適當地設置,從而更均勻有效地形成細胞聚集體。例如,當使用96孔微孔平板懸浮培養人細胞(例如,步驟(1)中得到的人ips細胞)時,向孔中添加制備得到每孔約1x103至約1x105個細胞、優選約3x103至約5x104個細胞、更優選約4x103至約2x104個細胞、進一步優選約4x103至約1.6x104個細胞、進一步更優選約8x103至約1.2x104個細胞的液體,并且將平板靜置以形成聚集體。
可以適當地確定步驟(2)的培養條件,諸如培養溫度、co2濃度等。例如,培養溫度為約30℃至約40℃,優選約37℃。例如,co2濃度為約1%至約10%,優選約5%。
在步驟(2)中,當進行培養基更換操作時,例如,可以提及不丟棄已有的培養基添加新鮮培養基的操作(培養基添加操作),棄掉約一半量的已有的培養基(已有的培養基體積的約30-90%,例如,40-60%)并且添加約一半量的新鮮培養基(已有的培養基體積的約30-90%,例如,約40-60%)的操作(一半培養基更換操作),和棄掉約全部量的已有的培養基(不少于已有的培養基的量的90%)并且添加約全部量的新鮮培養基(不少于已有的培養基的量的90%)的操作(完全培養基更換操作)。
當在特定時間點添加特定成分(例如,分化誘導因子)時,例如,可以進行這樣的操作:計算終濃度,棄掉約一半量的已有的培養基,并且添加約一半量的新鮮培養基(一半培養基更換操作),所述新鮮培養基包含濃度高于所述終濃度(具體地,所述終濃度的1.5倍-3.0倍,例如,約為終濃度的2倍)的特定成分。
當在特定時間點保持已有的培養基中包含的特定成分的濃度時,例如,可以進行這樣的操作:棄掉約一半量的已有的培養基,并且添加約一半量的新鮮培養基,所述新鮮培養基包含濃度與已有的培養基中相同的特定成分。
當通過在特定時間點稀釋而降低已有的培養基中包含的成分的濃度時,例如,可以每天多次進行培養基更換操作,優選在1小時內進行多次(例如,2-3次)。此外,當通過在特定時間點的稀釋降低已有的培養基中包含的成分的濃度時,可以將細胞或聚集體轉移到另一個培養容器中。
盡管用于培養基更換操作的工具沒有特別限制,例如,可以提及移液管、微量移液管(pipetman)、多通道微量移液管(multichannelpipetman)、連續的分配器等。例如,當使用96孔平板作為培養容器時,可以使用多通道微量移液管(multichannelpipetman)。
形成細胞聚集體所需要的懸浮培養的時間期可以依據要用的多能干細胞適當地確定,以使細胞可以均勻地聚集。為了形成均勻的細胞聚集體,理想地是其盡可能短。用于分散的細胞以形成細胞聚集體的步驟可以分成聚集細胞的步驟和由所聚集的細胞形成細胞聚集體的步驟。在人多能干細胞(例如,人ips細胞)的情形中,在接種分散的細胞(即,在懸浮培養開始時)以使細胞聚集的步驟中,優選地在約24小時內,更優選在約12小時內,形成聚集的細胞。在人多能干細胞(例如,人ips細胞)的情形中,從接種分散的細胞的時間點(即,在懸浮培養開始的時間)到形成聚集體的時間期,例如,優選在約72小時內,更優選在約48小時內形成聚集體。細胞聚集體形成的時間期可以通過控制使細胞聚集的工具、離心條件等而適當地調節。
可以基于聚集體的尺寸和細胞數目、宏觀形態、組織染色分析的微觀形態和其均勻性、分化-和未分化-標記的表達及其均勻性、分化標記表達的控制及其同步性、聚集體之間的分化效率的重現性等,確定細胞聚集體的形成及其均勻性。
在聚集體形成后,聚集體可以按原樣繼續培養。步驟(2)中懸浮培養的時間期通常為約12小時-6天,優選約12小時-48小時。
用于步驟(2)的培養基包含sonichedgehog信號轉導途徑激活物質。在步驟(1)中,多能干細胞在無飼養細胞的條件下進行維持培養;并且在第二步中,將在第一步中得到的多能干細胞在包含sonichedgehog信號轉導途徑激活物質的培養基(優選是無血清培養基)中懸浮培養,從而提高聚集體的質量,并且能夠以高效率形成球形的、表面平滑的、未塌陷的、內部致密的維持未分化特性的細胞聚集體。
sonichedgehog(以下有時表示為shh)信號轉導途徑激活物質是能夠提高由shh介導的增強信號轉導的物質。shh信號轉導途徑激活物質的實例包括屬于hedgehog家族的蛋白(例如,shh和ihh),shh受體,shh受體激動劑,purmorphamine(pma;9-環己基-n-[4-(4-嗎啉基)苯基]-2-(1-萘基氧基)-9h-嘌呤-6-胺),sag(平滑的激動劑;n-甲基-n’-(3-吡啶基芐基)-n’-(3-氯代苯并[b]噻吩-2-羰基)-1,4-二氨基環己烷)等。關于shh信號轉導途徑激活物質,例如,優選的是sag,purmorphamine(pma)和shh蛋白(genbank登錄號:nm_000193,np_000184),并且更優選sag。培養基中shh信號轉導途徑激活物質的濃度可以適當地確定,以落在能夠實現前述效果的范圍內。sag通常以1-2000nm、優選10nm-1000nm、優選10nm-700nm、30nm-700nm、50nm-700nm、更優選100nm-600nm、進一步優選100nm-500nm的濃度使用。當使用不同于sag的shh信號轉導途徑激活物質時,其理想地以賦予與上文提及的濃度的sag的活性相當的shh信號轉導促進活性的濃度使用。在pma的情形中,例如,濃度通常對應于0.002-20μm,優選0.02-2μm,更優選約0.2μm;并且在shh蛋白的情形中,例如,濃度通常對應于約10-1000ng/ml,優選約10-300ng/ml。
培養基中sonichedgehog信號轉導途徑激活物質的濃度在步驟(2)期間可能變化。例如,提供sonichedgehog信號轉導途徑激活物質以落在上文提及的步驟(2)開始時的范圍之內,并且濃度可以以每2-4天40-60%的比例逐漸或逐步地降低。
向培養基中添加sonichedgehog信號轉導途徑激活物質的時間沒有特別限制,只要可以提供上文提及的效果即可,但是越早添加能夠獲得更高的效果。sonichedgehog信號轉導途徑激活物質通常在自步驟(2)開始時3天內、優選在2天內、更優選在1天內、并且進一步優選地在步驟(2)開始時添加到培養基中。
在優選的實施方案中,在步驟(2)中,在步驟(1)中得到的人多能干細胞(例如,人ips細胞)在包含sonichedgehog信號轉導途徑激活物質(例如,sag,shh蛋白,pma)的無血清培養基中進行懸浮培養,從而形成聚集體。sonichedgehog信號轉導途徑激活物質優選在懸浮培養開始時就包含在培養基中。還可以向培養基中添加rock抑制物質(例如,y-27632)。培養的時間期是12小時-6天,優選12小時-48小時。形成的聚集體優選是均勻的聚集體。
例如,將在步驟(1)中得到的人多能干細胞(例如,人ips細胞)回收,分散成單細胞或接近單細胞的狀態,懸浮在包含sonichedgehog信號轉導途徑激活物質(例如,sag,shh蛋白,pma)的無血清培養基中,并且進行懸浮培養。所述無血清培養基可以包含rock抑制物質(例如,y-27632)。將人多能干細胞(例如,ips細胞)的混懸液接種在上文提及的培養容器中,并且在多能干細胞不與培養容器粘附的條件下培養分散的多能干細胞,由此組裝多個多能干細胞形成聚集體。培養的時間期是12小時-6天,優選12小時-48小時。形成的聚集體優選是均勻的聚集體。
通過以這種方式進行步驟(2),形成步驟(1)中得到的多能干細胞的聚集體或由其衍生的細胞。本發明還提供制備所述聚集體的方法。與通過在步驟(2)中不進行利用sonichedgehog信號轉導途徑激活物質的處理形成的聚集體相比,步驟(2)中得到的聚集體具有更高的質量。具體而言,可以得到具有高比例的球形細胞聚集體的聚集體群,所述球形細胞聚集體具有平滑的表面、致密的內部、和未塌陷的形狀。在一個實施方案中,當自第二步開始起第6天隨機選擇聚集體(例如,不少于100個聚集體)時,例如,未塌陷的聚集體和/或非囊性聚集體的比例總數不小于30%,優選不小于50%。
步驟(2)中得到的聚集體具有向多種分化細胞和分化組織分化的潛能。在一個實施方案中,步驟(2)中得到的聚集體具有向神經細胞(例如,視網膜細胞)或神經組織(例如,視網膜組織)分化的潛能。在一個實施方案中,通過使用步驟(1)中得到的并且在步驟(2)中具有向至少神經細胞或神經組織(優選地,視網膜組織,視網膜祖先細胞,或視網膜層專有的神經元)分化的潛能的干細胞(優選地,具有向至少神經細胞或神經組織(優選地,視網膜組織,視網膜祖先細胞,或視網膜層專有的神經元)分化的潛能的oct3/4陽性的干細胞),可以得到包含具有向至少神經細胞或神經組織(優選地,視網膜組織,視網膜祖先細胞,或視網膜層專有的神經元)分化的潛能的干細胞(例如,oct3/4陽性的干細胞)的聚集體。通過在適當的分化條件下培養步驟(2)中得到的聚集體,可以高效地誘導多種分化的細胞和分化的組織(例如,神經細胞,諸如視網膜細胞等,神經組織,諸如視網膜組織等)。
在一個實施方案中,在步驟(2)中得到的聚集體包含與在步驟(1)中得到的多能干細胞與神經細胞或神經組織(優選地,視網膜細胞或視網膜組織)之間的中間階段的細胞相對應的細胞。這些細胞表達多能性狀態標記oct3/4、外胚層標記(sox1,sox2,n-鈣粘蛋白,tp63)、神經外胚層標記(sox1,sox2,巢蛋白,n-鈣粘蛋白,otx2)和前文提及的神經細胞標記中的任一種。即,在一個實施方案中,在步驟(2)中得到的聚集體包含表達多能性狀態標記oct3/4、外胚層標記(sox1,sox2,n-鈣粘蛋白,tp63)、神經外胚層標記(sox1,sox2,巢蛋白,n-鈣粘蛋白,otx2)和前文提及的神經細胞標記中的任一種的細胞的混合物。即,在步驟(2)中得到的聚集體包含具有向至少神經細胞或神經組織(優選地,視網膜細胞或視網膜組織)分化的潛能的干細胞,和/或神經細胞或神經組織(優選地,視網膜細胞或視網膜組織)的祖先/前體細胞。另外,所述祖先/前體細胞特征在于,當將它們在已知的適當培養條件下培養時,它們表現出表達前文提及的神經細胞標記(優選地,視網膜細胞標記)的能力(competence)。因此,在一個實施方案中,在步驟(2)中得到的聚集體包含具有向至少神經細胞或神經組織(優選地,視網膜細胞或視網膜組織)分化的潛能的oct3/4陽性干細胞,和/或神經細胞或神經組織(優選地,視網膜細胞或視網膜組織)的祖先/前體細胞。在步驟(2)中得到的聚集體中包含的一部分細胞可以表達前文提及的神經組織標記。在一個實施方案中,在步驟(2)中得到的聚集體可以包含不少于總細胞的50%(例如,不少于70%)的比例的oct3/4陽性細胞。
在步驟(2)中,當進行培養基更換操作時,例如,可以提及不丟棄已有的培養基添加新鮮培養基的操作(培養基添加操作),棄掉約一半量的已有的培養基(已有的培養基體積的約30-90%,例如,約40-60%)并且添加約一半量的新鮮培養基(已有的培養基體積的約30-90%,例如,約40-60%)的操作(一半培養基更換操作),和棄掉約全部量的已有的培養基(不少于已有的培養基的量的90%)并且添加約全部量的新鮮培養基(不少于已有的培養基的量的90%)的操作(完全培養基更換操作)。
當在特定時間點添加特定成分(例如,分化誘導因子)時,例如,可以進行這樣的操作:計算終濃度,棄掉約一半量的已有的培養基,并且添加約一半量的新鮮培養基(一半培養基更換操作),所述新鮮培養基包含濃度高于所述終濃度(具體地,所述終濃度的1.5-3.0倍,例如,約為終濃度的2倍)的特定成分。
當在特定時間點保持已有的培養基中包含的特定成分的濃度時,例如,可以進行這樣的操作:棄掉約一半量的已有的培養基,并且添加約一半量的新鮮培養基,所述新鮮培養基包含濃度與已有的培養基中相同的特定成分。
當通過在特定時間點的稀釋而降低已有的培養基中包含的成分的濃度時,例如,可以每天多次進行培養基更換操作,優選在1小時內進行多次(例如,2-3次)。此外,當通過在特定時間點的稀釋降低已有的培養基中包含的成分的濃度時,可以將細胞或聚集體轉移到另一個培養容器中。
盡管用于培養基更換操作的工具沒有特別限制,例如,可以提及移液管、微量移液管(pipetman)、多通道微量移液管(multichannelpipetman)、連續的分配器等。例如,當使用96孔平板作為培養容器時,可以使用多通道微量移液管(multichannelpipetman)。
解釋步驟(3),其中由步驟(2)中得到的聚集體誘導包含視網膜細胞或視網膜組織的聚集體。
將步驟(2)中得到的聚集體在存在或不存在(優選在存在)適當的分化誘導因子的條件下懸浮培養,由此可以得到包含視網膜細胞或視網膜組織的聚集體。
關于通過懸浮培養誘導細胞聚集體成為視網膜細胞或視網膜組織的方法,已經報道了多種方法。例如,已知在nature,472,51-56(2011),cellstemcell,10(6),771-775(2012)等中記載的方法,但是所述方法不限于這些。
關于在不存在分化誘導因子的條件下制備視網膜細胞或視網膜組織的方法,可以提供及這樣的方法,其包括在含血清的培養基或無血清培養基中誘導步驟(2)中得到的聚集體自發分化為包括視網膜細胞的神經細胞。關于前文提及的含血清培養基或無血清培養基,可以提及不含用于維持未分化狀態的因子的血清培養基或無血清培養基。在向神經細胞的分化過程中產生的視網膜細胞可以進行選擇和分離。對于選擇和分離,可以使用facs或macs。另外,也可以使用容易產生視網膜的多能干細胞作為步驟(1)中的起始材料。
優選地,將步驟(2)中得到的聚集體在存在分化誘導因子的條件下進行懸浮培養,從而產生包含視網膜細胞或視網膜組織的聚集體。
此處所用的分化誘導因子沒有特別限制,只要其是具有誘導向視網膜細胞或視網膜組織分化的能力的因子即可。其實例包括bmp信號轉導激活物質,基膜制劑,wnt信號轉導途徑抑制物質,tgfβ家族信號轉導途徑抑制物質等。對分化誘導因子的反應隨細胞的種類和分化狀態(能力或潛能)而不同,并且分化誘導因子的作用甚至在分化誘導過程中可能改變,這取決于分化誘導因子的濃度和加入的時機。此外,已知分化誘導因子表現出相似效果的最佳濃度隨動物物種而不同,并且,例如,已知在小鼠細胞與人細胞之間,人細胞的最佳濃度通常較高(特別是在外胚層、內胚層中)。關于多能干細胞向特定細胞或組織的分化誘導的方法存在多個報道,并且可以選擇適于目的細胞或組織的分化誘導因子或分化誘導方法。
優選地,使用bmp信號轉導途徑激活物質作為分化誘導因子。即,將步驟(2)中得到的聚集體在存在bmp信號轉導途徑激活物質的條件下懸浮培養,以產生包含視網膜細胞或視網膜組織的聚集體。
bmp信號轉導途徑激活物質是能夠增強由bmp介導的信號轉導的物質。bmp信號轉導途徑激活物質的實例包括bmp蛋白如bmp2,bmp4或bmp7等,gdf蛋白如gdf7等,抗-bmp受體抗體,bmp部分肽等。bmp2蛋白,bmp4蛋白和bmp7蛋白可獲自,例如,r&dsystems,而gdf7蛋白可獲自,例如,wakopurechemicalindustries,ltd。所述bmp信號轉導途徑激活物質優選是bmp4。
用于本發明的分化誘導因子(例如,bmp4)通常是哺乳動物分化誘導因子。哺乳動物的實例包括上文提及的那些。由于分化誘導因子可能在哺乳動物物種之間具有交叉反應性,也可以使用任意哺乳動物的分化誘導因子,只要可以實現培養的多能干細胞的分化誘導即可。優選地,使用與培養的細胞相同物種的哺乳動物分化誘導因子。例如,當誘導人多能干細胞向視網膜組織或視網膜細胞分化時,優選使用人分化誘導因子(例如,bmp4)。
用于本發明的分化誘導因子(例如,bmp4)優選是分離的。因此,在一個實施方案中,本發明包括提供分離的分化誘導因子(例如,bmp4)的步驟。并且,在一個實施方案中,本發明包括向用于步驟(3)的培養基中外源添加分離的分化誘導因子(例如,bmp4)的步驟。
在一個實施方案中,用于步驟(3)的培養基是補充了分化誘導因子(例如,bmp4)的無血清培養基或含血清培養基(優選無血清培養基)。所述培養基可以包含或可以不包含基膜制劑。關于基膜制劑,可以使用上文提及的那些。當添加基膜制劑時,其濃度例如為使用基質膠時的體積濃度的0.1-10%,更優選為0.5%-2%。為避免化學上不確定物質的污染,不添加基膜制劑。
用于所述培養基的無血清培養基或含血清培養基沒有特別限制,只要其是上文提及的即可。為了避免復雜的制備,例如,優選使用補充了適量的商購血清代替物(如ksr等)的無血清培養基(例如,補充了10%ksr、450μm1-一硫代甘油和1x化學成分確定的脂質濃縮物的imdm與f-12的1∶1混合物的培養基或補充了5%-20%ksr、neaa、丙酮酸、2巰基乙醇的gmem培養基)。在人es細胞的情形中,要添加到無血清培養基中的ksr的量通常為約1%至約20%,優選約2%至約20%。
關于要用于步驟(3)的培養基(優選是無血清培養基),可以直接使用步驟(2)所用的培養基(優選是無血清培養基)或可以用新鮮培養基(優選是無血清培養基)替換。當步驟(2)中所用的不含分化誘導因子(例如,bmp4)的無血清培養基直接用于步驟(3)時,可以向所述培養基中添加分化誘導因子(例如,bmp4)。
在一個實施方案中,當添加到步驟(2)的培養基中的shh信號轉導途徑激活物質的濃度比較低(例如,對于sag,不大于700nm,并且對于其他shh信號轉導途徑激活物質,以賦予與上文提及的濃度的sag相當或比其更低的shh信號轉導促進活性的濃度)時,培養基更換不是必要的,并且可以向步驟(2)中所用的培養基中添加分化誘導因子(例如,bmp4)。另一方面,當shh信號轉導途徑激活物質的濃度比較高(例如,對于sag,超過700nm或不小于1000nm,并且對于其他shh信號轉導途徑激活物質,以賦予與上文提及的濃度的sag相當的shh信號轉導促進活性的濃度)時,需要將培養基更換為含有分化誘導因子(例如,bmp4)的新鮮培養基,以抑制在加入分化誘導因子時殘留的shh信號轉導途徑激活物質的影響。
在優選的實施方案中,當相對于sag的shh信號轉導促進活性計算時,在用于步驟(3)的培養基中的shh信號轉導途徑激活物質的濃度不大于700nm,優選不大于300nm,更優選不大于10nm,進一步優選不大于0.1nm,進一步優選不含shh信號轉導途徑激活物質。“不含shh信號轉導途徑激活物質”的培養基還包括基本上不含shh信號轉導途徑激活物質的培養基,例如,不含處在對向視網膜細胞或視網膜組織的選擇性分化施加不利影響的濃度的shh信號轉導途徑激活物質的培養基。“不含shh信號轉導途徑激活物質”的培養基還包括基本上沒有補充shh信號轉導途徑激活物質的培養基,例如,沒有補充處在對向視網膜細胞或視網膜組織的選擇性分化施加不利影響的濃度的shh信號轉導途徑激活物質的培養基。
培養基中分化誘導因子(例如,bmp信號轉導途徑激活物質)的濃度可以是可以誘導多能干細胞或由其衍生的細胞的聚集體向視網膜細胞分化的濃度。例如,在人bmp4的情形中,將其以約0.01nm至約1μm,優選約0.1nm至約100nm,更優選約1nm至約10nm,進一步優選約1.5nm(55ng/ml)的濃度添加到培養基中。當使用不同于bmp4的bmp信號轉導途徑激活物質時,其理想地以施加與上文提及的濃度的bmp4相當的bmp信號轉導促進活性的濃度使用。
培養基中分化誘導因子(例如,bmp4)的濃度在步驟(3)期間可以變化。例如,在步驟(3)開始時提供分化誘導因子(例如,bmp4)落在上文提及的范圍內,并且濃度以每2-4天40-60%的比例逐漸或逐步地降低。
分化誘導因子(例如,bmp4)可以在自步驟(2)的懸浮培養起始時約24小時或以后加入,并且也可以在自懸浮培養起始時數天內(例如,15天內)加入到培養基中。優選地,分化誘導因子(例如,bmp4)在自懸浮培養起始第1天至第15天內、更優選第1天至第9天內、更優選第3天至第8天內、仍然更優選地第3天至第6天內加入到培養基中。
向培養基中加入分化誘導因子(例如,bmp4)并且開始將聚集體向視網膜細胞的誘導分化后,向所述培養基中加入分化誘導因子(例如,bmp4)不是必需的,并且培養基可以更換為分別不含分化誘導因子(例如,bmp4)的無血清培養基或含血清培養基。在一個實施方案中,在開始將聚集體向神經細胞的分化誘導后,通過將培養基更換為分別不含分化誘導因子(例如,bmp4)的無血清培養基或含血清培養基,培養基中分化誘導因子(例如,bmp4)的濃度以每2-4天40-60%的比例逐漸或逐步降低。結果,分化誘導因子(例如,bmp4)的濃度可以逐步被稀釋,并且分化誘導因子作用的效果和持續時間可以得到限制。
在具體的實施方案中,在開始懸浮培養后(即,在前述步驟(2)開始后)第1-9天、優選第2-8天、進一步優選第3天或第4天,培養基可以被部分或完全更換為包含bmp4的培養基,以調節bmp4的終濃度至約1-10nm,并且可以將細胞在存在bmp4的條件下培養約1-12天,優選2-9天,更優選2-5天。為了將bmp4的濃度保持在相同水平,可以將培養基用包含bmp4的培養基部分或完全更換一次或兩次。備選地,如上文提及的,bmp4的濃度也可以逐步減小。
其中已經開始向視網膜細胞分化的誘導的細胞可以通過例如檢測所述細胞中視網膜祖先細胞標記基因(例如,rx基因(別名rax),pax6基因,chx10基因)的表達而證實。將通過使用在rx基因座中敲入了熒光報告蛋白基因(如gfp等)的多能干細胞在步驟(2)中形成的聚集體在存在向視網膜細胞分化誘導需要的濃度的分化誘導因子(例如,bmp4)的條件下懸浮培養,并且檢測由所表達的熒光受體蛋白發射的熒光,由此可以證實向視網膜細胞分化誘導開始的時間點。作為步驟(3)的一個實施方案,在包含向視網膜細胞分化誘導需要的濃度的分化誘導因子(例如,bmp4)的無血清培養基或含血清培養基中懸浮培養步驟(2)中形成的聚集體的步驟,直到開始出現表達視網膜祖先細胞標記基因(例如,rx基因,pax6基因,chx10基因)的細胞,由此得到包含視網膜祖先細胞的細胞聚集體。
在步驟(3)中,當進行培養基更換操作時,例如,可以提及培養基添加操作,一半培養基更換操作和完全培養基更換操作。
當在特定時間點加入特定的成分(例如,分化誘導因子)時,例如,可以進行這樣的操作:計算終濃度,棄掉約一半量的已有的培養基,并且添加約一半量的新鮮培養基(一半培養基更換操作),所述新鮮培養基包含濃度高于所述終濃度(具體地,所述終濃度的1.5-3.0倍,例如,約為終濃度的2倍)的特定成分。
當在特定時間點保持已有的培養基中包含的特定成分的濃度時,例如,可以進行這樣的操作:棄掉約一半量的已有的培養基,并且添加約一半量的新鮮培養基,所述新鮮培養基包含濃度與已有的培養基中相同的特定成分。
當通過在特定時間點的稀釋而降低已有的培養基中包含的成分的濃度時,例如,可以每天多次進行培養基更換操作,優選在1小時內進行多次(例如,2-3次)。此外,當通過在特定時間點的稀釋降低已有的培養基中包含的成分的濃度時,可以將細胞或聚集體轉移到另一個培養容器中。
盡管用于培養基更換操作的工具沒有特別限制,例如,可以提及移液管、微量移液管(pipetman)、多通道微量移液管(multichannelpipetman)、連續的分配器等。例如,當使用96孔平板作為培養容器時,可以使用多通道微量移液管(multichannelpipetman)。
可以適當地確定步驟(3)中的培養條件,如培養溫度和co2濃度等。例如,培養溫度為約30℃-約40℃,優選約37℃。例如,co2濃度為約1%-約10%,優選約5%。
通過這樣的培養,誘導形成步驟(2)中得到的聚集體的細胞向視網膜祖先細胞分化,由此可以得到包含視網膜祖先細胞的聚集體。本發明還提供制備此類包含視網膜祖先細胞的聚集體的方法。得到包含視網膜祖先細胞的聚集體的事實可以通過例如檢測所述聚集體中表達rax、pax6或chx10(它們是視網膜祖先細胞標記)的細胞的存在而證實。步驟(3)的一個實施方案是在包含處于向視網膜細胞分化誘導所需要的濃度的bmp信號轉導途徑激活物質(例如,bmp4)的無血清培養基或含血清培養基中懸浮培養步驟(2)中形成的聚集體的步驟,直到開始出現表達rx基因的細胞,由此得到包含視網膜祖先細胞的聚集體。在一個實施方案中,進行步驟(3)的培養直到聚集體中包含的不少于20%(優選地,不少于30%,不少于40%,不少于50%,不少于60%)的細胞表達rx。
得到的包含視網膜祖先細胞的聚集體可以按其原樣作為用于評價毒性或功效的試劑使用。將包含視網膜祖先細胞的聚集體進行分散處理(例如,胰蛋白酶/edta處理或木瓜蛋白酶處理),并且使用facs或macs對得到的細胞進行選擇,由此也可以得到高純度的視網膜祖先細胞。
此外,可以將包含視網膜組織的聚集體繼續在無血清培養基或含血清培養基中培養,以使視網膜組織中包含的視網膜細胞(例如,視網膜祖先細胞)進一步分化,由此可以產生神經上皮結構樣視網膜組織。
用于所述培養基的無血清培養基或含血清培養基沒有特別限制,只要其是上文提及的即可。例如,可以提及作為補充了10%胎牛血清、n2補充物、100μm牛磺酸和500nm視黃酸的dmem-f12培養基的含血清培養基或補充了適量的商購得到的血清代替物如ksr等的無血清培養基(例如,補充了10%ksr、450μm1-一硫代甘油和1x化學上明確的脂質濃縮物的imdm和f-12的1∶1混合物的培養基)等。
盡管從視網膜祖先細胞誘導視網膜組織的培養時間期隨目的視網膜層專有的神經元而不同,但是,例如,該時間期為約7天至約200天。
視網膜組織覆蓋著聚集體的表面存在。在懸浮培養結束后,可以將聚集體用固定劑(如多聚甲醛溶液等)固定,并且制備冷凍切片,隨后可以通過免疫染色等證實具有層結構的視網膜組織的形成。由于視網膜組織的各個層由不同的細胞(感光細胞、水平細胞、雙極細胞、無長突細胞、視網膜神經節細胞)構成,層結構的形成可以使用針對在這些細胞中表達的前述標記的抗體通過免疫染色證實。在一個實施方案中,視網膜組織是rx-或chx10-陽性神經上皮結構。
存在于聚集體表面上的視網膜組織可以使用鑷子等從所述聚集體上物理切下。在這一情形中,由于可以在每個聚集體表面上形成除視網膜組織之外的神經組織,從所述聚集體上切下的一部分神經組織可以通過下文提及的免疫染色等進行驗證,由此可以證實所述組織是視網膜組織。
在一個實施方案中,步驟(3)中得到的聚集體包含視網膜組織,并且基本上不含非神經頭部外胚層。在包含視網膜組織且基本上不含非神經頭部外胚層的聚集體中,例如,在前述聚集體冷凍切片的免疫染色圖像中,在其外側觀察到rx-陽性組織,沒有觀察到rx-陰性組織。
步驟(3)的一個實施方案是在包含處于向視網膜細胞分化誘導需要的濃度的bmp信號轉導途徑激活物質的無血清培養基或含血清培養基中懸浮培養步驟(2)中形成的聚集體的步驟,直到開始出現表達rx基因的細胞,從而產生包含視網膜祖先細胞的聚集體,并且隨后在無血清培養基或含血清培養基中懸浮培養包含所述視網膜祖先細胞的聚集體,直到形成視網膜組織,由此得到包含視網膜組織的聚集體。當隨后在無血清培養基或含血清培養基中懸浮培養包含所述視網膜祖先細胞的聚集體直到形成視網膜組織時,通過將所述培養基更換為分別不含bmp信號轉導途徑激活物質的無血清培養基或含血清培養基,培養基中誘導視網膜祖先細胞的bmp信號轉導途徑激活物質的濃度可以以每2-4天40-60%的比例逐漸或逐步降低。在一個實施方案中,進行包含視網膜祖先細胞的聚集體的懸浮培養,直到所述聚集體中所包含的不少于20%(優選地,不少于30%,不少于40%,不少于50%,不少于60%)的細胞表達chx10。
在步驟(3)的一個實施方案中,步驟(2)中得到的聚集體或通過上文提及的方法懸浮培養步驟(2)中得到的聚集體而得到的聚集體可以進行貼壁培養以形成粘附的聚集體。在包含處于向視網膜細胞分化誘導所需要的濃度的分化誘導因子(例如,bmp4)的無血清培養基或含血清培養基中以粘附狀態培養粘附的聚集體,直到開始出現表達rx基因的細胞,從而產生包含視網膜祖先細胞的粘附的聚集體。將包含所述視網膜祖先細胞的聚集體在無血清培養基或含血清培養基中以粘附狀態培養,直到形成視網膜組織,由此得到包含視網膜組織的粘附的聚集體。在一個實施方案中,進行包含視網膜祖先細胞的粘附的聚集體的貼壁培養,直到不少于10%(優選地,不少于20%,不少于30%,不少于40%,不少于50%)的所述細胞表達chx10。
通過本發明的方法,可以高效地從多能干細胞得到視網膜細胞和視網膜組織。由于通過本發明的方法得到的視網膜組織包含每個視網膜層專有的神經元(神經元細胞),因此也可能得到組成視網膜組織的各個細胞,諸如感光細胞、水平細胞、雙極細胞、無長突細胞、視網膜神經節細胞或它們的祖先/前體細胞等。由獲得的視網膜組織獲得什么細胞可以通過本身已知的方法(例如,細胞標記物的表達)來確認。
獲得的含有視網膜組織的聚集體也可以直接按原樣地用作用于評估毒性或功效的試劑。將包含視網膜組織的聚集體進行分散處理(例如,胰蛋白酶/edta處理),并且使用facs或macs,對得到的細胞進行選擇,由此也可以獲得高純度的視網膜組織-組成細胞,例如,高純度的感光細胞。
可以通過下述步驟(a)和步驟(b)由通過本發明的制備方法得到的包含視網膜組織的細胞聚集體產生睫狀邊緣區樣結構。
睫狀邊緣區樣結構是指與睫狀邊緣區相似的結構。“睫狀邊緣區(cmz)”的實例包括在體內在視網膜中的視網膜組織(具體地,神經視網膜)和視網膜色素上皮的邊緣區中存在的組織,其是包含視網膜組織干細胞(視網膜干細胞)的區域。睫狀邊緣區還稱為睫狀邊緣或視網膜邊緣,并且睫狀邊緣區、睫狀邊緣和視網膜邊緣是同等的組織。已知睫狀邊緣區在供應視網膜祖先細胞或向視網膜組織的分化細胞、維持視網膜組織結構等中起重要作用。睫狀邊緣區的標記基因的實例包括rdh10基因(陽性)、otx1基因(陽性)、zicl基因(陽性)等。
步驟(a)包括在分別包含wnt信號途徑激活物質和/或fgf信號途徑抑制物質的無血清培養基或含血清培養基中培養通過本發明的制備方法2得到的包含視網膜組織的細胞聚集體持續僅在表達rpe65基因的細胞出現之前的時間期,在所述細胞聚集體中chx10陽性細胞以占所述視網膜組織20%以上且100%以下的比例存在。
此處關于步驟(a)優選的培養,可以提及懸浮培養。
關于用于步驟(a)的無血清培養基,可以提及作為補充了n2或ksr的基礎培養基的無血清培養基。更具體地,可以提及作為補充了n2補充劑(n2,由lifetechnologies制造)的dmem/f-12培養基的無血清培養基。關于含血清的培養基,可以提及作為補充了胎牛血清的基礎培養基的含血清培養基。
可以適當設置步驟(a)的培養條件,諸如培養溫度、co2濃度。例如,培養溫度在約30℃至約40℃的范圍內,優選地,例如,大致約37℃。例如,co2濃度在約1%至約10%的范圍內,優選地,例如,大致約5%。
在步驟(a)中,當在培養基中培養上文提及的“包含視網膜組織的細胞聚集體”時,要包含在無血清培養基或含血清培養基中的wnt信號轉導途徑激活物質沒有特別限制,只要其能夠增強由wnt介導的信號轉導即可。wnt信號轉導途徑激活物質的具體實例包括屬于wnt家族的蛋白(例如,wnt1,wnt3a,wnt7a),wnt受體,wnt受體激動劑,gsk3抑制劑(例如,6-溴靛玉紅-3’-肟(6-bromoindirubin-3’-oxime,bio),chir99021,kenpaullone)等。
在常見的wnt信號轉導途徑激活物質諸如chir99021的情形中,例如,步驟(a)中包含在無血清培養基或含血清培養基中的wnt信號轉導途徑激活物質的濃度在約0.1μm至約100μm的范圍內,優選地,例如,在約1μm至約30μm的范圍內,更優選地,例如,為約3μm。
當在培養基中培養上文提及的“包含視網膜組織的細胞聚集體”時,步驟(a)中包含在無血清培養基或含血清培養基中的fgf信號轉導途徑抑制物質沒有特別限制,只要其能夠抑制由fgf介導的信號轉導即可。fgf信號轉導途徑抑制物質的實例包括fgf受體,fgf受體抑制劑(例如,su-5402,azd4547,bgj398),map激酶級聯抑制物質(例如,mek抑制劑,mapk抑制劑,erk抑制劑),pi3激酶抑制劑,akt抑制劑等。
步驟(a)中包含在無血清培養基或含血清培養基中的fgf信號轉導途徑抑制物質的濃度僅需要是可以誘導聚集體向睫狀邊緣區樣結構分化的濃度。例如,在su-5402的情形中,將其添加到培養基中至約0.1μm至約100μm、優選地約1μm至約30μm、更優選地約5μm的濃度。
步驟(a)中“培養持續僅在表達rpe65基因的細胞出現之前的時間期”意指在表達rpe65基因的細胞出現之前的全部時間期內或部分時間期內培養。即,在此時間期內,培養系統中的前述“包含視網膜組織的細胞聚集體”由基本上不表達rpe65基因的細胞組成的時間期(任意時間期)的全部或部分內的培養。通過使用這樣的培養,可以得到其中沒有出現表達rpe65基因的細胞的細胞聚集體。
為了確定所述特定的時間期,使用前述“包含視網膜組織的細胞聚集體”作為樣品,并且可以通過一般的遺傳改造方法或生物化學方法測量存在或不存在樣品中包含的rpe65基因的表達或其水平。具體地,例如,可以通過使用針對rpe65蛋白的抗體使前述“包含視網膜組織的細胞聚集體”的冷凍切片進行免疫染色法檢驗存在或不存在rpe65基因的表達或其水平。
關于步驟(a)中“在表達rpe65基因的細胞出現之前的時間期”,例如,可以提及這樣的時間期,在所述時間期內,與在分別包含wnt信號轉導途徑激活物質和/或fgf信號轉導途徑抑制物質的無血清培養基或含血清培養基中開始培養前述細胞聚集體的時刻相比,在上述視網膜組織中存在的chx10陽性細胞的比例降低,并且落入30%至0%的范圍內。關于“其中沒有出現表達rpe65基因的細胞的細胞聚集體”,可以提及這樣的細胞聚集體,其中在前述視網膜組織中存在占所述組織的30%至0%比例的chx10陽性細胞。
盡管步驟(a)中“在表達rpe65基因的細胞出現之前的時間期”的天數隨wnt信號轉導途徑激活物質和/或fgf信號轉導途徑抑制物質的種類、無血清培養基或含血清培養基的種類、其他培養條件等而變化,但是,例如,其在14天內。更具體地,當使用無血清培養基(例如,作為補充了n2的基礎培養基的無血清培養基)時,例如,上述時間期優選地在10天內,更優選地,例如,3天至6天。當使用含血清培養基(例如,作為補充了胎牛血清的含血清培養基)時,例如,前述時間期優選地在12天內,更優選地,例如,6天至9天。
然后,關于步驟(b),將通過上述培養得到的“其中沒有出現表達rpe65基因的細胞的細胞聚集體”在分別不含wnt信號轉導途徑激活物質的無血清培養基或含血清培養基中培養。
關于步驟(b)中優選的培養,可以提及懸浮培養。
關于步驟(b)中的無血清培養基,可以提及作為補充了n2或ksr的基礎培養基的培養基。關于含血清培養基,可以提及作為補充了胎牛血清的基礎培養基的培養基。更具體地,可以提及作為補充了胎牛血清的dmem/f-12培養基的含血清培養基。
步驟(b)中上述無血清培養基或含血清培養基可以包含已知的生長因子、添加劑和促進生長的化學物質等。已知的生長因子的實例包括egf,fgf,igf,胰島素等。促進生長的添加劑的實例包括n2補充劑(lifetechnologies),b27補充劑(lifetechnologies),ksr等。促進生長的化學物質的實例包括類視黃醇(例如,視黃酸)和牛磺酸。
例如,步驟(b)中的培養的優選的時間期是這樣的培養時間期,在所述時間期內,與在分別不含wnt信號轉導途徑激活物質的無血清培養基或含血清培養基中開始培養前述細胞聚集體的時刻相比,在前述視網膜組織中存在的chx10陽性細胞的比例增加,并且達到30%以上。
可以適當地設定步驟(b)中的培養條件,諸如培養溫度、co2濃度等。例如,培養溫度在約30℃至約40℃的范圍內,優選地,例如,大致約37℃。例如,co2濃度在約1%至約10%的范圍內,優選地,例如,大致約5%。
盡管步驟(b)中直到得到“包含睫狀邊緣區樣結構的細胞聚集體”的上述培養天數隨無血清培養基或含血清培養基的種類、其他培養條件等而變化,但是,例如,其在100天之內。例如,上述培養天數優選地為20天至70天,更優選地,例如,30天至60天。
在通過前述步驟(a)、(b)制備的“包含睫狀邊緣區樣結構的細胞聚集體”中,在同一細胞聚集體中,鄰近所述睫狀邊緣區樣結構存在視網膜色素上皮和視網膜組織(具體地,神經視網膜)。所述結構可以通過顯微鏡觀察等證實。具體地,例如,可以通過顯微鏡觀察證實睫狀邊緣區樣結構的存在,其作為具有厚視網膜側和薄視網膜色素上皮側的上皮結構存在,其在具有高透明度的視網膜組織與表現出色素沉著的視網膜色素上皮之間形成。另外,可以通過免疫染色聚集體的冷凍切片鑒定rdh10陽性、otxl陽性或zicl陽性細胞而證實睫狀邊緣區樣結構的存在。
可以通過下述步驟(c)由通過本發明的制備方法和類似方法得到的包含視網膜組織的細胞聚集體產生視網膜色素上皮細胞。視網膜色素上皮片層(sheet)可以通過下述步驟(d)由通過下述步驟(c)得到的視網膜色素上皮細胞產生。
本發明中的“視網膜色素上皮細胞”意指在體內在視網膜中神經視網膜組織外側存在的上皮細胞。其是否是視網膜色素上皮細胞可以由本領域普通技術人員基于例如細胞標記(rpe65(成熟的視網膜色素上皮細胞),mitf(幼態的或成熟的視網膜色素上皮細胞)等)的表達、黑素顆粒的存在、多邊形特征性細胞形態等而驗證。
首先,在步驟(c)中,將通過本發明的制備方法2得到的包含視網膜組織的細胞聚集體在不含bmp信號轉導途徑激活物質但是包含wnt信號轉導途徑激活物質的無血清培養基或含血清培養基中懸浮培養,從而產生包含視網膜色素上皮細胞的聚集體。
關于用于步驟(c)的無血清培養基,可以提及作為補充了n2或ksr的基礎培養基的無血清培養基。更具體地,可以提及作為補充了n2補充劑(lifetechnologies)的dmem/f-12培養基的無血清培養基。關于含血清培養基,可以提及作為補充了胎牛血清的基礎培養基的含血清培養基。
除了前述wnt信號轉導途徑激活物質之外,用于步驟(c)的無血清培養基還可以包含前述nodal/激活蛋白信號轉導途徑激活物質和/或前述fgf信號轉導途徑抑制物質。
例如,步驟(c)中優選的培養是懸浮培養。
解釋步驟(d),其中將在步驟(c)中得到的聚集體分散并且將得到的細胞以粘附狀態培養。
在步驟(c)開始后60天內,優選地在30天內,更優選地3天內,進行步驟(d)。
關于步驟(d)中用于貼壁培養的無血清培養基或含血清培養基,可以提及前述培養基。為了避免復雜的制備,優選使用補充了適量商購血清代替物(如ksr等)的無血清培養基(例如,補充了1/2xn2補充劑、1/2xb27補充劑和100μm2-巰基乙醇的dmem/f-12和neurobasal的1∶1混合物的培養基)。在來源于人ips細胞的細胞的情形中,例如,要添加到無血清培養基中的ksr的量通常為約1%至約20%,優選約2%至約20%。
在步驟(d)中,優選地在包含rock抑制物質的前述無血清培養基或含血清培養基中培養細胞。
在步驟(d)中,更優選地在進一步包含選自由下述組成的組的一種或多種物質的無血清培養基或含血清培養基中培養細胞:wnt信號轉導途徑激活物質,fgf信號轉導途徑抑制物質,激活蛋白信號轉導途徑激活物質和bmp信號轉導途徑激活物質。
激活蛋白信號轉導途徑激活物質是能夠增強由激活蛋白介導的信號的物質。激活蛋白信號轉導途徑激活物質的實例包括屬于激活蛋白家族的蛋白(例如,激活蛋白a,激活蛋白b,激活蛋白c,激活蛋白ab等),激活蛋白受體,和激活蛋白受體激動劑。
用于步驟(d)的激活蛋白信號轉導途徑激活物質的濃度可以是任意濃度,只要可以有效地形成均勻的視網膜色素上皮細胞片層即可。例如,加入重組的人/小鼠/大鼠激活蛋白a(r&dsystems,#338-ac)至約1ng/ml至約10μg/ml、優選地約10ng/ml至約1μg/ml、更優選地約100ng/ml的濃度。
例如,在步驟(d)開始起18天內,優選地在第6天,添加激活蛋白信號轉導途徑激活物質。
在步驟(d)中,優選地在表面用培養基底處理的培養容器上進行貼壁培養。關于步驟(d)中用于處理培養容器的培養基底,可以提及能夠允許聚集體來源的細胞的貼壁培養和視網膜色素上皮片層形成的細胞培養基底。
3.用于評價毒性和功效的方法
由于通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)可作為用于疾病研究或藥物發現的材料用于篩選治療由于視網膜組織或視網膜細胞的紊亂導致的疾病的藥物,或用于毒性評價,其可以用作評價測試物質的毒性或功效的試劑。例如,由患有由于視網膜組織紊亂導致的疾病、特別是遺傳病的人患者產生ips細胞,并且使用該ips細胞,通過本發明的方法產生視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)。所述視網膜組織或視網膜細胞可以在體外重現引起患者的疾病的視網膜組織紊亂。因此,本發明提供用于評價測試物質的毒性或功效的方法,所述方法包括使所述測試物質與通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)接觸,并且檢測所述物質對所述細胞或組織的影響。
例如,在存在或不存在(陰性對照)測試物質的條件下,培養通過本發明的制備方法產生的具有特定紊亂(例如,遺傳性紊亂)的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)。然后,將用測試物質處理的所述視網膜組織或視網膜細胞的紊亂的嚴重性與陰性對照的進行比較。結果,可以選擇減輕紊亂的嚴重性的測試物質作為用于治療由所述紊亂導致的疾病的藥物的候選物質。例如,可以尋找改善通過本發明的制備方法產生的視網膜細胞的生理活性(例如,存活促進或成熟)的測試物質作為藥物產品的候選物質。備選地,按照本發明的制備方法,通過誘導由體細胞制備的誘導的多能干細胞的分化制備視網膜細胞,所述體細胞具有引起特定紊亂諸如伴有視網膜中的紊亂等的疾病的基因突變。
可以基于添加了測試物質的視網膜細胞是否表現出前述紊亂作為指標,尋找有效作為所述紊亂的治療藥或預防藥的測試物質的候選物。
對于毒性評價,將通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)在存在或不存在(陰性對照)測試物質的條件下培養。然后,將對用所述測試物質處理的視網膜組織或視網膜細胞的毒性嚴重性與陰性對照的毒性嚴重性比較。結果,與陰性對照相比,可以判斷表現出毒性的測試物質是對視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)具有毒性的物質。
即,本發明包括評價毒性的方法,所述方法包括下述步驟:
(步驟1)在測試物質的存在下,在存活培養條件下,培養通過本發明的制備方法產生的視網膜組織或視網膜細胞達給定的時間,并且測量細胞損傷的嚴重性的步驟,
(步驟2)在不存在測試物質或存在陽性對照時,在存活培養條件下,培養通過本發明的制備方法產生的視網膜組織或視網膜細胞達給定的時間,并且測量細胞損傷的嚴重性的步驟,
(步驟3)基于(步驟1)和(步驟2)中測量的結果的差異,評價步驟1中測試物質的毒性的步驟。
用于本文時,“在不存在測試物質時”包括僅添加培養基或用于溶解所述測試物質的溶劑,而不添加測試物質。另外,“陽性對照”意指具有毒性的已知化合物。
測量細胞損傷嚴重性的方法的實例包括測量存活細胞數量的方法,例如,測量細胞內atp的量的方法,通過細胞染色(例如,核染色)和形態觀察測量存活細胞數量的方法等。
在步驟3中,關于評價測試物質的毒性的方法,比較步驟1中的測量值和步驟2中陰性對照的測量值,并且當步驟1中細胞損傷的嚴重性高時,可以判斷所述測試物質具有毒性。另外,比較步驟1中的測量值與步驟2中陽性對照的測量值,并且當步驟1中細胞損傷的嚴重性相同或更高時,可以判斷所述測試物質具有毒性。
4.藥物組合物
本發明提供包含有效量的通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)的藥物組合物。
所述藥物組合物包含有效量的通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)和藥用載體。
關于藥用載體,可以使用生理水性溶劑(鹽水,緩沖液,無血清培養基等)。必要時,在移植治療中,包含要移植的組織或細胞的藥物可以包含常規使用的防腐劑、穩定劑、還原劑、等滲劑等。
本發明的藥物組合物可以通過將由本發明的制備方法1或2產生的視網膜組織或視網膜細胞懸浮在適當的生理水性溶劑中制成混懸劑。必要時,所述組合物可以添加冷凍保護劑,冷凍保藏,使用時解凍,用緩沖液洗滌,并且用于移植治療。
通過本發明的制備方法得到的視網膜組織也可以用鑷子等切成適當的尺寸,以產生片層制劑。
通過本發明的制備方法得到的細胞也可以在步驟(3)中進行貼壁培養用于分化誘導,從而形成片層樣細胞,產生片層制劑。
本發明的藥物組合物可以用作由于神經組織或神經細胞(例如,視網膜組織,視網膜祖先細胞,視網膜層專有的神經元)的紊亂導致的疾病的治療藥。
5.治療藥
通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)可用于由于視網膜組織或視網膜細胞的紊亂導致的疾病的移植治療。因此,本發明提供用于治療由于視網膜組織或視網膜細胞的紊亂導致的疾病的藥物,其包含通過本發明的制備方法產生的視網膜組織或視網膜細胞(例如,感光細胞,視網膜祖先細胞,視網膜層專有的神經元)。通過本發明的制備方法產生的視網膜組織或視網膜細胞(包括視網膜祖先細胞,視網膜層專有的神經元)可以用作治療由于視網膜組織或視網膜細胞的紊亂導致的疾病的藥物或用于補充視網膜組織的損傷狀態中相對應的損傷位點。由于視網膜組織或視網膜細胞的紊亂導致的疾病和視網膜組織的損傷狀態可以通過向具有由于視網膜組織或視網膜細胞的紊亂導致的疾病或視網膜組織的損傷狀態的患者(其需要移植)移植通過本發明的制備方法產生的視網膜組織或視網膜細胞進行治療,從而補充視網膜細胞或紊亂的視網膜組織本身。由于視網膜組織或視網膜細胞的紊亂導致的疾病的實例包括視網膜變性(retinaldenaturation)、視網膜色素性變性(pigmentarydegenerationoftheretina)、年齡相關黃斑變性(age-relatedmaculardegeneration)、有機汞中毒(organicmercurypoisoning)、氯喹視網膜病變(chloroquineretinopathy)、青光眼(glaucoma)、糖尿病視網膜病變(diabeticretinopathy)、新生兒視網膜病變(retinopathyofnewbornbabies)等。
在移植治療中,由于組織相容性抗原的差異導致的排異通常構成問題。然而,該問題可以通過使用由移植接受體的體細胞建立的多能干細胞(例如,誘導的多能干細胞)而解決。即,在優選的實施方案中,由接受體的體細胞建立的多能干細胞(例如,誘導的多能干細胞)用作本發明的方法中的多能干細胞,并且產生對于所述接受體在免疫上是自身的神經組織或神經細胞并移植到所述接受體中。
另外,可以從由與接受體免疫相容的(例如,在hla型和mhc型方面相容)其他人的體細胞建立多能干細胞(例如,誘導的多能干細胞)產生同種異體神經組織或神經細胞,并且移植到所述接受體中。
[實施例]
在下文通過參考實施例和藥理學實施例詳細解釋本發明,所述實施例不應該解釋為限制性的。
比較例1:在步驟2中不使用shh信號轉導途徑激活物質由人ips細胞分化的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,在無飼養細胞的條件下培養人ips細胞(1231a3株,獲自京都大學(kyotouniversity))。關于無飼養細胞的培養基,使用stemfit培養基(ak03,由ajinomotoco.,inc.制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
關于具體的維持培養操作,首先將亞匯合(subconfluent)的人ips細胞(1231a3株)用pbs洗滌,并且使用trypleselect(由lifetechnologies制造)分散成單個細胞。然后,將前述分散成單個細胞的人ips細胞接種在用層粘連蛋白511-e8包被的塑料培養皿中,并且在存在y27632(rock抑制物質,10μm)的條件下,在stemfit培養基中進行無飼養細胞的培養。當使用6孔平板(由iwaki制造,對于細胞培養,培養面積為9.4em2)作為前述塑料培養皿時,將關于前述分散成單個細胞的人ips細胞的鋪板細胞數目調整為6x103。接種后一天,將全部量的培養基更換為不含y27632的stemfit培養基。然后,1-2天一次,將全部量的培養基更換為不含y27632的stemfit培養基。之后,接種后6天,細胞培養至亞匯合(60%的培養面積被細胞覆蓋)。
通過使用trypleselect(lifetechnologies),將上述亞匯合的人ips細胞用細胞分散液處理,并且通過吹吸操作進一步分散成單個細胞。然后,將上述分散成單個細胞的人ips細胞以1.2×104個細胞/孔懸浮在非細胞粘附性的96孔培養板(primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中,并且在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),向上述無血清培養基中加入y27632(終濃度為20μm)。到懸浮培養開始后第2天,形成細胞聚集體(步驟2結束,并且步驟3開始)。在懸浮培養開始后第3天,加入不含y27632的無血清培養基(50μl)。
在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632但包含或不包含人重組bmp4(由r&d制備)的培養基,以將外源性人重組bmp4的濃度調整為1.5nm(55ng/ml,圖1b)或產生不含外源性人重組bmp4的培養基(圖1a)。關于一半培養基更換操作,棄掉培養容器中一半體積的培養基,即75μl,加入上述新鮮的無血清培養基(75μl)調整總培養基量至150μl。然后,將一半量的培養基更換為上述不含y27632和人重組bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第19天,將這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察(圖1a,b)。結果,發現在涉及添加人重組bmp4的條件下(圖1b)和在不涉及添加的條件下(圖1a),都有不少于90%的細胞聚集體塌陷,并且神經組織形成效率差。
實施例1:通過在步驟2中使用shh轉導途徑激活物質,由在步驟1中使用stemfit作為無飼養細胞培養基培養的人ips細胞制備的細胞聚集體、神經組織和視網膜組織的形成的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,在無飼養細胞的條件下培養人ips細胞(1231a3株,獲自京都大學(kyotouniversity))。關于無飼養細胞的培養基,使用stemfit培養基(ak03,由ajinomotoco.,inc.制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。維持培養按照比較例1中所述的方法進行。
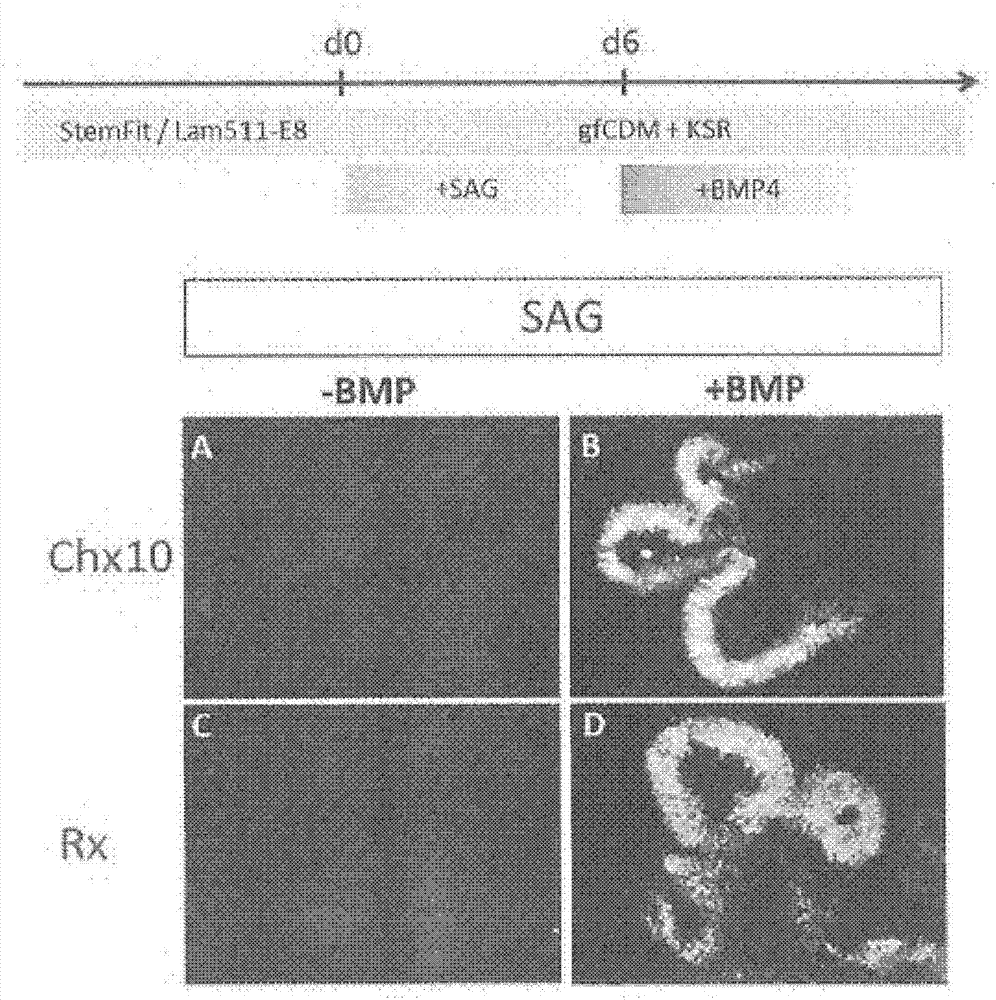
通過使用trypleselect(lifetechnologies),將這樣制備的亞匯合的人ips細胞用細胞分散液處理,并且通過吹吸操作進一步分散成單個細胞。然后,將上述分散成單個細胞的人ips細胞以1.2×104個細胞/孔懸浮在非粘附性96孔培養板(primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中,并且在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),向上述無血清培養基中加入y27632(終濃度為20μm)和作為shh信號轉導途徑激活物質的sag(300nm)。到懸浮培養開始后第2天,形成細胞聚集體(步驟2結束,步驟3開始)。在懸浮培養開始后第3天,加入不含y27632和sag的無血清培養基(50μl)。在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632但包含或不包含人重組bmp4(由r&d制備)的培養基,以將外源性人重組bmp4的濃度調整為1.5nm(55ng/ml,圖1d)或產生不含外源性人重組bmp4的培養基(圖1c)。關于一半培養基更換操作,棄掉培養容器中一半體積的培養基,即75μl,加入上述新鮮的無血清培養基(75μl)調整總培養基量至150μl。然后,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第19天,將這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察(圖1c,d)。結果,發現在涉及添加人重組bmp4的條件下(圖1d)和在不涉及其添加的條件下(圖1c),細胞聚集體都得到維持,并且觀察到神經上皮結構。即,發現加入shh信號轉導途徑激活物質提供良好的聚集體形狀并且提高神經組織形成的效率(圖1a-d)。從該結果,發現通過在步驟2的懸浮培養開始時添加shh信號轉導途徑激活物質,可以由進行無飼養細胞培養的人ips細胞有效地產生神經組織。
將上述在開始懸浮培養后第19天的細胞聚集體分別用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,由exalpha制備,綿羊)(其是一種視網膜組織標記)或rx(抗-rx抗體,由takara制備,豚鼠)(其是一種視網膜組織標記)免疫染色。在判斷上述標記在免疫染色分析中是否是陽性時,將高于背景熒光強度不少于2倍的熒光強度視為是陽性的。結果,發現在涉及在懸浮培養的第0天添加shh信號轉導途徑激活物質和在懸浮培養的第6天不添加bmp信號轉導途徑激活物質的條件下,總細胞中rx-陽性細胞的比例低于3%,并且chx10-陽性細胞的比例也低于3%(圖2a,c)。另一方面,發現在涉及在懸浮培養的第0天添加shh信號轉導途徑激活物質并且在懸浮培養的第6天添加bmp信號轉導途徑激活物質的條件下,總細胞中rx-陽性細胞的比例不低于60%,并且chx10-陽性細胞的比例也不低于60%(圖2b,d)。此外,從連續切片分析來看,表明在具有高比例(不低于95%)的chx10-陽性細胞的神經組織中,rx也是強陽性的(圖2b,d)。從這些結果,發現通過在步驟2懸浮培養開始時添加shh信號轉導途徑激活物質并且在步驟3的懸浮培養期間添加作為分化誘導物質的bmp信號轉導途徑激活物質,能夠由無飼養細胞培養的人ips細胞(以下有時稱為無飼養細胞的人ips細胞)有效地產生視網膜組織。
實施例2:在步驟1中使用essential8作為無飼養細胞培養基并且在開始懸浮培養時使用shh轉導途徑激活物質由人ips細胞產生神經組織的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,在無飼養細胞的條件下培養人ips細胞(1231a3株,獲自京都大學(kyotouniversity))。關于無飼養細胞的培養基,使用essential8培養基(由lifetechnologies制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
關于具體的維持培養操作,首先將亞匯合的人ips細胞(1231a3株)用pbs洗滌,并且使用trypleselect(由lifetechnologies制造)分散成單個細胞。然后,將前述分散成單個細胞的人ips細胞接種在用層粘連蛋白511-e8包被的塑料培養皿中,并且在存在y27632(rock抑制物質,10μm)的條件下,在essential8培養基中進行無飼養細胞的培養。當使用6孔平板(由iwaki制造,對于細胞培養,培養面積為9.4cm2)作為上述塑料培養皿時,將關于上述分散成單個細胞的人ips細胞的鋪板細胞數目調整為6x103。接種后一天,將全部量的培養基更換為不含y27632的essential8培養基。然后,1-2天一次,將全部量的培養基更換為不含y27632的essential8培養基。之后,接種后6天,細胞培養至亞匯合(60%的培養面積被細胞覆蓋)。
通過使用trypleselect(lifetechnologies),將這樣制備的亞匯合的人ips細胞用細胞分散液處理,并且通過吹吸操作進一步分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.2×104個細胞/孔懸浮在非細胞粘附性的96孔培養板(primesurface96v型底平板,由sumitomobakelite制造)中的100μl無血清培養基中。然后,將細胞在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),使用補充了y27632(終濃度為20μm)的無血清培養基(圖3a-d)。這些中,在特定條件下,使用補充了y27632(終濃度為20μm)和作為shh信號轉導途徑激活物質的sag(300nm)的無血清培養基(圖3c,d)。到懸浮培養開始后第2天,在具有和不具有sag添加的兩種條件下都形成細胞聚集體(步驟2結束,并且步驟3開始)。在懸浮培養開始后第3天,添加不含y27632和sag的無血清培養基(50μl)。在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632和sag但包含或不包含人重組bmp4(由r&d制備)的培養基,以將外源性人重組bmp4的終濃度設定為1.5nm(圖3b,d)或產生不含外源性人重組bmp4的培養基(圖3a,c)。然后,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基,每2-4天更換一次。將在懸浮培養開始后第18天的這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察(圖3a-d)。結果,發現在懸浮培養開始時不添加sag并且在懸浮培養過程中不添加bmp4的條件(條件1,圖3a)和在懸浮培養開始時不添加sag并且在懸浮培養過程中添加bmp4的條件(條件2,圖3b)下,都有不少于80%的細胞聚集體塌陷,并且神經組織形成效率差。另一方面,發現在懸浮培養開始時添加sag并且在懸浮培養過程中不添加bmp4的條件下(條件3,圖3c),和在懸浮培養開始時添加sag并且在懸浮培養過程中添加bmp4的條件下(條件4,圖3d),細胞聚集體得以維持,并且有效地形成神經上皮結構。
此外,在懸浮培養開始后第18天,觀察到多種聚集體的形狀,并且分類為良好的形狀(圖4,黑色條,良好的聚集體,包含多個神經上皮)、中等水平的形狀(圖4,灰色條,良好的聚集體但是神經上皮比例低)和差的形狀(圖4,白色條,聚集體塌陷,不含神經上皮)并定量。結果,在條件1(圖3a),良好的形狀的比例低于3%,并且差的形狀的比例為71%(圖4,對照)。相反,在條件3(圖3c),良好的形狀的比例為93%,并且差的形狀的比例為6%(圖4,sag)。
從這些結果,發現關于在essential8培養基中培養的無飼養細胞的人ips細胞,通過在懸浮培養開始時添加shh信號轉導途徑激活物質提高神經組織形成的效率。
實施例3:通過在步驟1中使用essential8作為無飼養細胞培養基并且在開始懸浮培養時使用shh轉導途徑激活物質由人ips細胞產生視網膜組織的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,在無飼養細胞的條件下培養人ips細胞(201b7株,獲自京都大學(kyotouniversity))。關于無飼養細胞的培養基,使用essential8培養基(由lifetechnologies制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
關于具體的維持培養操作,首先將亞匯合的人ips細胞(201b7株)用pbs洗滌,并且使用trypleselect(由lifetechnologies制造)分散成單個細胞。然后,將上述分散成單個細胞的人ips細胞接種在用層粘連蛋白511-e8包被的塑料培養皿中,并且在存在y27632(rock抑制物質,10μm)的條件下,在essential8培養基中進行無飼養細胞的培養。當使用6孔平板(由iwaki制造,用于細胞培養,培養面積為9.4cm2)作為上述塑料培養皿時,將關于上述分散成單個細胞的人ips細胞的鋪板細胞數目調整為6x103。接種后一天,將全部量的培養基更換為不含y27632的essential8培養基。然后,1-2天一次,將全部量的培養基更換為不含y27632的essential8培養基。之后,接種后6天,細胞培養至亞匯合(60%的培養面積被細胞覆蓋)。
通過使用trypleselect(由lifetechnologies制造),將這樣制備的亞匯合的人ips細胞用細胞分散液處理,并且通過吹吸操作進一步分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.2×104個細胞/孔懸浮在非細胞粘附性的96孔培養板(primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中。然后,將細胞在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),使用補充了sag(終濃度為300μm)(作為shh信號轉導途徑激活物質)和y27632(20μm)的無血清培養基(圖5a-d)。到懸浮培養開始后第2天,形成細胞聚集體。在懸浮培養開始后第3天,加入不含y27632和sag的無血清培養基(50μl)。在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632和sag但包含或不包含人重組bmp4(由r&d制備)的培養基,以將外源性人重組bmp4的濃度調整為1.5nm(55ng/ml)。然后,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第18天,將這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察。結果,發現形成了神經上皮。
將在開始懸浮培養后第18天的細胞聚集體用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,exalpha,綿羊)(其是一種視網膜組織標記)或rx(抗-rx抗體,由takara制備,豚鼠)(其是一種視網膜組織標記)免疫染色。結果,發現在涉及在懸浮培養的第0天添加shh信號轉導途徑激活物質并且在懸浮培養的第6天不添加bmp信號轉導途徑激活物質的條件下,總細胞中rx-陽性細胞的比例不大于3%,并且chx10-陽性細胞的比例也不大于3%(圖5a,c)。另一方面,發現在涉及在懸浮培養的第0天添加shh信號轉導途徑激活物質并且在懸浮培養的第6天添加bmp信號轉導途徑激活物質的條件下,總細胞中rx-陽性細胞的比例不低于40%,并且chx10-陽性細胞的比例也不低于40%(圖5b,d)。此外,連續切片分析表明,在具有高比例(不低于95%)的chx10-陽性細胞的神經組織中,rx也是強陽性的(圖5b,d)。從這些結果,發現通過在步驟2懸浮培養開始時添加shh信號轉導途徑激活物質并且在步驟3的懸浮培養期間添加作為分化誘導物質的bmp信號轉導途徑激活物質,能夠由無飼養細胞的人ips細胞有效地產生視網膜組織。
實施例4:通過在步驟2中使用shh轉導途徑激活物質并且在步驟3中使用bmp4由人ips細胞產生視網膜組織的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,將人ips細胞(1231a3株,獲自京都大學(kyotouniversity))進行無飼養細胞培養。關于無飼養細胞的培養基,使用stemfit培養基(ak03,由ajinomotoco.,inc.制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
關于具體的維持培養操作,首先將亞匯合的人ips細胞(1231a3株)用pbs洗滌,并且使用trypleselect(由lifetechnologies制造)分散成單個細胞。然后,將上述分散成單個細胞的人ips細胞接種在用層粘連蛋白511-e8包被的塑料培養皿中,并且在存在y27632(rock途徑抑制物質,10μm)的條件下,在stemfit培養基中進行無飼養細胞的培養。當使用6孔平板(由iwaki制造,用于細胞培養,培養面積為9.4cm2)作為上述塑料培養皿時,將關于上述分散成單個細胞的人ips細胞的鋪板細胞數目調整為6x103。接種后一天,將培養基更換為不含y27632的stemfit培養基。然后,1-2天一次,將培養基更換為不含y27632的stemfit培養基。之后,接種后6天,細胞培養至亞匯合(60%的培養面積被細胞覆蓋)。
通過使用trypleselect(lifetechnologies),將上述亞匯合的人ips細胞分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.2×104個細胞/孔懸浮在非細胞粘附性的96孔培養板(primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中,并且在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),向上述無血清培養基中加入y27632(終濃度為20μm)和sag(終濃度為300nm)。到懸浮培養開始后第2天,形成細胞聚集體(步驟2結束,步驟3開始)。
此處,關于步驟3,培養在下述條件1和條件2下進行。
在條件1下(+bmp,d3),在開始懸浮培養后第3天添加不含y27632和sag但是包含人重組bmp4(由r&d制備)的培養基(50μl),以使外源性人重組bmp4的終濃度調整為1.5nm(總培養基量為150μl)。在懸浮培養開始后第6天,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基。
在條件2下(+bmp,d6),在開始懸浮培養后第3天添加不含y27632、sag和人重組bmp4的無血清培養基(50μl)。在懸浮培養開始后第6天,將一半量的培養基更換為上述不含y27632和sag但是包含人重組bmp4(由r&d制備)的培養基,以使外源性人重組bmp4的終濃度調整為1.5nm。
在條件1和條件2下開始細胞的懸浮培養后第6天或以后,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第18天,在倒置顯微鏡下觀察形狀。發現在條件1和條件2下,細胞聚集體得以維持,并且形成神經組織。
將在懸浮培養開始后第18天的這樣制備的細胞聚集體(其通過由無飼養細胞的ips細胞作為起始材料在步驟2中添加sag產生)用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,exalpha,綿羊)(其是一種視網膜組織標記)或rx(抗-rx抗體,由takara制備,豚鼠)(其是一種視網膜組織標記)免疫染色。在倒置熒光顯微鏡下觀察這些免疫染色的切片。結果,發現對于在條件1和條件2下的細胞二者,總細胞中rx-陽性細胞的比例為約40%,chx10-陽性細胞的比例也為約40%(圖6)。此外,從連續切片分析來看,發現在具有高比例的chx10-陽性細胞(約95%)的神經組織中,rx也是強陽性的。從這些結果,發現通過在步驟2添加sag并且在步驟3開始懸浮培養后第3天或第6天的懸浮培養過程中添加作為分化誘導物質的bmp信號轉導途徑激活物質,能夠由無飼養細胞的人ips細胞有效地產生視網膜組織。
實施例5:通過在步驟2中使用600nmshh轉導途徑激活物質并且在步驟3中使用bmp4由人ips細胞產生視網膜組織的實施例
使用trypleselect(lifetechnologies)將按照實施例4中所述的方法制備的無飼養細胞的人ips細胞(1231a3株)分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.2×104個細胞/孔懸浮在非細胞粘附性的96孔培養板(primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中,并且在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),向上述無血清培養基中添加y27632(終濃度為20μm)和sag(終濃度為600nm)。到懸浮培養開始后第2天,形成細胞聚集體(步驟2結束,步驟3開始)。
此處,關于步驟3,培養在下述條件1和條件2下進行。
在條件1下(+bmp,d3),在開始懸浮培養后第3天添加不含y27632和sag但是包含人重組bmp4(由r&d制備)的培養基(50μl),以使外源性人重組bmp4的終濃度調整為1.5nm(總培養基量為150μl)。在懸浮培養開始后第6天,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基。
在條件2下(+bmp,d6),在開始懸浮培養后第3天添加不含y27632、sag和人重組bmp4的無血清培養基(50μl)。在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632但是包含人重組bmp4(由r&d制備)的培養基,以使外源性人重組bmp4的終濃度調整為1.5nm。
在條件1和條件2下開始細胞的懸浮培養后第6天或以后,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第18天,在倒置顯微鏡下觀察形狀。發現在條件1和條件2下,細胞聚集體得以維持,并且形成神經組織。
將在懸浮培養開始后第18天的這樣制備的細胞聚集體(其通過由無飼養細胞的ips細胞作為起始材料在步驟2中添加sag產生)用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,exalpha,綿羊)(其是一種視網膜組織標記)或rx(抗-rx抗體,由takara制備,豚鼠)(其是一種視網膜組織標記)免疫染色。在倒置熒光顯微鏡下觀察這些免疫染色的切片。結果,發現對于在條件1和條件2下的細胞二者,總細胞中rx-陽性細胞的比例為約40%,并且chx10-陽性細胞的比例也為約40%(圖7)。此外,從連續切片分析來看,提示在具有高比例的chx10-陽性細胞(約95%)的神經組織中,rx也是強陽性的。從這些結果,發現通過在步驟2添加600nmsag并且在步驟3開始懸浮培養后第3天或第6天添加作為分化誘導物質的bmp信號轉導途徑激活物質,能夠由無飼養細胞的人ips細胞有效地產生視網膜組織。
實施例6:通過在步驟2中使用sag、purmorphamine或重組shh蛋白作為sonichedgehog信號轉導途徑激活物質由人ips細胞產生視網膜組織的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,在無飼養細胞的條件下培養人ips細胞(201b7株,獲自京都大學(kyotouniversity))。關于無飼養細胞的培養基,使用stemfit培養基(ak03;由ajinomotoco.,inc.制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
關于具體的維持培養操作,首先將亞匯合的人ips細胞(201b7株)用pbs洗滌,并且使用trypleselect(由lifetechnologies制造)分散成單個細胞。然后,將上述分散成單個細胞的人ips細胞接種在用層粘連蛋白511-e8包被的塑料培養皿中,并且在存在y27632(rock途徑抑制物質,10μm)的條件下,在stemfit培養基中進行無飼養細胞的培養。當使用6孔平板(由iwaki制造,用于細胞培養,培養面積為9.4cm2)作為上述塑料培養皿時,將關于上述分散成單個細胞的人ips細胞的鋪板細胞數目調整為1.3x104。接種后一天,將全部量的培養基更換為不含y27632的stemfit培養基。然后,1-2天一次,將全部量的培養基更換為不含y27632的stemfit培養基。之后,接種后6天,細胞培養至亞匯合(60%的培養面積被細胞覆蓋)。
通過使用trypleselect(由lifetechnologies制造),將這樣制備的亞匯合的人ips細胞用細胞分散液處理,通過吹吸操作進一步分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.0×104個細胞/孔懸浮在非細胞粘附性的96孔培養板(sumilonspheroidv型底平板primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中。然后,將細胞在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),使用補充了y27632(終濃度為20μm)并進一步補充了sag(終濃度為30nm)、purmorphamine(由wako制造,終濃度為0.2μm)或人重組shh(由r&d制造,重組n-端,終濃度為50ng/ml)(作為shh信號轉導途徑激活物質)的上述無血清培養基(圖8)。在懸浮培養開始后第2天,形成細胞聚集體。在懸浮培養開始后第3天,加入不含y27632、sag,purmorphamine和重組shh但是包含人重組bmp4的培養基(50μl),以將外源性人重組bmp4的終濃度調整為1.5nm(55ng/ml)。在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632、sag、purmorphamine、重組shh和人重組bmp4的無血清培養基。然后,將一半量的培養基更換為上述不含y27632、sag和人重組bmp4的無血清培養基,每2-4天更換一次。將在懸浮培養開始后第18天的這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察。結果,發現形成了神經上皮。
將在開始懸浮培養后第18天的細胞聚集體用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,exalpha,綿羊)(其是一種視網膜組織標記)免疫染色。結果,發現在涉及在懸浮培養的第0天添加sag、pma或shh作為shh信號轉導途徑激活物質和在懸浮培養的第3天添加bmp4的條件下,總細胞中chx10-陽性細胞的比例不大于30%(圖8,d-f)。從這些結果,發現通過在步驟2開始懸浮培養時添加sag、purmorphamine和重組shh中的任一種作為shh信號轉導途徑激活物質,并且在步驟3的懸浮培養過程中添加bmp信號轉導途徑激活物質作為分化誘導物質,能夠由無飼養細胞培養的人ips細胞有效地產生視網膜組織。
實施例7:通過在步驟2中使用sag、purmorphamine或重組shh蛋白作為sonichedgehog信號轉導途徑激活物質并且在步驟3中使用bmp4由人ips細胞產生視網膜組織的實施例
按照“scientificreports,4,3594(2014)”中所述的方法,在無飼養細胞的條件下培養人ips細胞(1231a3株,獲自京都大學(kyotouniversity))。關于無飼養細胞的培養基,使用stemfit培養基(ak03;由ajinomotoco.,inc.制造),并且關于無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
通過使用trypleselect(由lifetechnologies制造),將按照實施例6所述的方法制備的亞匯合的人ips細胞用細胞分散液處理,通過吹吸操作進一步分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.0x104個細胞/孔懸浮在非粘附性96孔培養板(sumilonspheroidv型底平板primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中。然后,將細胞在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),使用補充了y27632(終濃度為20μm)并進一步補充了sag(終濃度為30nm)、purmorphamine(pma,由wako制造,終濃度為0.2μm)或人重組shh(由r&d制造,重組n-端,終濃度為300ng/ml)(作為shh信號轉導途徑激活物質)的上述無血清培養基或不含shh信號轉導途徑激活物質的無血清培養基(圖9)。在懸浮培養開始后第2天,細胞聚集體形成。在懸浮培養開始后第3天,加入不含y27632、sag、purmorphamine和shh蛋白但是包含人重組bmp4(r&d)的培養基(50μl),以將外源性人重組bmp4的終濃度調整為1.5nm(55ng/ml)。在開始懸浮培養后第6天,將一半量的培養基更換為不含y27632、sag、purmorphamine、shh蛋白和人重組bmp4的無血清培養基。然后,將一半量的培養基更換為上述不含y27632、sag、purmorphamine、重組shh和人重組bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第18天,將這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察。結果,發現在步驟2不添加外源性shh信號轉導途徑激活物質的條件下,細胞聚集體不生長并且沒有形成神經上皮(圖9:對照),而在步驟2添加sag、pma或重組shh蛋白的條件下,細胞聚集體生長并且形成了神經上皮(圖9:sag,pma,shh)。
將在開始懸浮培養后第18天的細胞聚集體用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,exalpha,綿羊)(其是一種視網膜組織標記)免疫染色。結果,發現在涉及在懸浮培養的第0天添加pma,和在懸浮培養的第3天添加bmp4的條件下,總細胞中chx10-陽性細胞的比例不大于60%(圖9,下部的圖pma)。另外,發現甚至在懸浮培養的第0天添加sag或shh的條件下,細胞聚集體包含chx10-陽性細胞。從這些結果,發現通過在步驟2懸浮培養開始時添加sag、purmorphamine和重組shh中的任一種作為shh信號轉導途徑激活物質并且在步驟3的懸浮培養過程中添加bmp信號轉導途徑激活物質作為分化誘導物質,可以由無飼養細胞的人ips細胞產生視網膜組織。
實施例8:通過在懸浮培養開始時使用shh信號轉導途徑激活物質并且在步驟3中使用bmp4使由仙臺病毒建立的人ips細胞進行無飼養細胞的培養產生視網膜組織的實施例
使用商購的仙臺病毒載體(4種因子:oct3/4,sox2,klf4,c-myc,由dnavec(現在的idpharma)制造的cytotune試劑盒)、stemfit培養基(ak03;由ajinomotoco.,inc.制造)和層粘連蛋白511-e8(由nippi,inc.制造),并且基于lifetechnologies的公布流程(ips2.0仙臺重新編程試劑盒(sendaireprogrammingkit),publicationnumberman0009378,revision1.0)和京都大學(kyotouniversity)的公布的流程(在無飼養細胞的條件下建立·維持培養人ips細胞,cira_ff-ipsc_orotocol_jp_v140310,http://www.cira.kyoto-u.ac.jp/j/research/protocol.html)中所述的方法,建立人ips細胞(dspc-3株,由sumitomodainipponpharmaco.,ltd.建立)。
按照scientificreports,4,3594(2014)中所述的方法,將人ips細胞(dspc-3株)進行無飼養細胞培養。作為無飼養細胞的培養基,使用stemfit培養基(由ajinomotoco.,inc.制造),并且作為無飼養細胞的構架,使用層粘連蛋白511-e8(由nippi,inc.制造)。
關于具體的維持培養操作,首先將亞匯合的人ips細胞用pbs洗滌,并且通過使用trypleselect(由lifetechnologies制造)分散成單個細胞。然后,將上述分散成單個細胞的人ips細胞接種在用層粘連蛋白511-e8包被的塑料培養皿中,并且在存在y27632(rock途徑抑制物質,10μm)的條件下,在stemfit培養基中進行無飼養細胞的培養。當使用6孔平板(由iwaki制造,對于細胞培養,培養面積為9.4cm2)作為上述塑料培養皿時,將關于上述分散成單個細胞的人ips細胞的鋪板細胞數目調整為1.3x104。接種后一天,將全部量的培養基更換為不含y27632的stemfit培養基。然后,1-2天一次,將全部量的培養基更換為不含y27632的stemfit培養基。之后,接種后6天,細胞培養至亞匯合(60%的培養面積被細胞覆蓋)。
通過使用trypleselect(由lifetechnologies制造),將這樣制備的亞匯合的人ips細胞用細胞分散液處理,通過吹吸操作進一步分散成單個細胞,并且將上述分散成單個細胞的人ips細胞以1.2x104個細胞/孔懸浮在非細胞粘附性的96孔培養板(sumilonspheroidv型底平板primesurface96v型底平板,sumitomobakelite)中的100μl無血清培養基中。然后,將細胞在37℃,5%co2進行懸浮培養。關于用于此的無血清培養基(gfcdm+ksr),使用作為補充了10%ksr、450μm1-一硫代甘油、1x化學成分確定的脂質濃縮物的f-12培養基與imdm培養基的1∶1混合物的無血清培養基。在懸浮培養開始時(在懸浮培養開始后的第0天,步驟2開始),使用補充了y27632(終濃度為20μm)并進一步補充了作為外源性shh信號轉導途徑激活物質的sag(終濃度為300nm)或沒有補充sag(終濃度為0nm)的上述無血清培養基(圖10)。在懸浮培養開始后第2天,形成細胞聚集體。在懸浮培養開始后第3天,加入不含y27632和sag但是包含或不包含人重組bmp4的培養基(50μl),以將外源性人重組bmp4的終濃度調整為1.5nm(55ng/ml)或0nm。在懸浮培養開始后第6天,將一半量的培養基更換為不含y27632、sag和bmp4的無血清培養基。然后,將一半量的培養基更換為上述不含y27632、sag和bmp4的無血清培養基,每2-4天更換一次。在懸浮培養開始后第22天,將這樣制備的細胞聚集體在倒置顯微鏡(biorevo,由keyence制造)下進行亮視野觀察。結果,發現在不添加shh信號轉導途徑激活物質的條件下,細胞聚集體的形成效率低(圖10,對照)。另一方面,發現在懸浮培養開始時添加sag的條件下,細胞聚集體得以維持,并且形成神經上皮(圖10,sag300nm)。
將在開始懸浮培養后第22天的細胞聚集體用4%多聚甲醛固定,產生冷凍切片。將這些冷凍切邊針對chx10(抗-chx10抗體,exalpha,綿羊)(其是一種視網膜組織標記)或rx(抗-rx抗體,由takara制造,豚鼠)(其是一種視網膜組織標記)免疫染色。結果,發現在涉及在懸浮培養的第0天添加sag并且在懸浮培養的第3天添加bmp4的條件下,總細胞中rx-陽性細胞的比例為約10%,并且總細胞中chx10-陽性細胞的比例也為約10%(圖10)。此外,從連續切片分析來看,發現在chx10-陽性細胞的神經組織中,rx也是強陽性的(圖10)。從這些結果,可以證實通過在步驟2中的懸浮培養開始時添加shh信號轉導途徑激活物質和在步驟3中的懸浮培養過程中添加bmp信號轉導途徑激活物質作為分化誘導物質,也可以由使用仙臺病毒建立的不含飼養細胞的人ips細胞產生視網膜組織。
[工業實用性]
根據本發明的制備方法,可以在不存在飼養細胞的條件下誘導多能干細胞向視網膜細胞分化,從而產生視網膜組織。本發明的制備方法是有用的,原因在于其能夠產生用作藥物產品候選化合物和其他化學物質的毒性和功效評價的材料、用于視網膜移植治療的移植材料的應用測試或治療的視網膜組織。
本文引用的任何公布中公開的內容,包括專利、專利申請的說明書和科學文獻,通過引用以它們在本文中公開的程度完全結合在本文中。
本申請是基于在日本提交的專利申請號2014-217868(申請日期:2014年10月24日),其內容完全結合在本文中。
- 還沒有人留言評論。精彩留言會獲得點贊!