一種融合蛋白質及其在檢測沙門氏菌中的應用的制作方法
本發明屬于生物技術領域,具體涉及一種融合蛋白質及其在檢測沙門氏菌中的應用。
背景技術:
沙門氏菌是一種世界范圍內非常常見的食源性致病菌。根據WHO/FDA等機構發布的信息,每年由沙門氏菌引起的食物中毒病例總是名列榜首,嚴重威脅著人體健康、造成巨大的經濟損失。因此,包括我國在內的絕大部分國家,都做出食物中不可檢出沙門氏菌的規定。
目前,包括我國在內的很多國家對沙門氏菌的檢測仍采用傳統的培養方法,報告結果需4-7天才可得出,步驟繁瑣、耗時耗力,不利于對沙門氏菌進行有效地預防和控制,因此,人們都在致力于建立一套方便、迅捷、特異性強的沙門氏菌檢測系統。如今,基本形成了PCR、ELISA、生物傳感器等三種基本類型的快速檢測系統。
技術實現要素:
本發明的目的是提供一種融合蛋白質及其在檢測沙門氏菌中的應用。
本發明提供了一種蛋白質,是如下(a1)或(a2):
(a1)由序列表中序列1自N末端第1至120位氨基酸殘基組成的蛋白質;
(a2)將(a1)經過一個或幾個氨基酸殘基的取代和/或缺失和/或添加且可以與靶標分子結合的由(a1)衍生的蛋白質。
本發明還保護所述蛋白質的應用,為如下(b1)-(b6)中任一種:
(b1)檢測靶標分子;
(b2)制備用于檢測靶標分子的試劑盒;
(b3)結合靶標分子;
(b4)制備用于結合靶標分子的試劑盒;
(b5)富集靶標分子;
(b6)制備用于富集靶標分子的試劑盒。
所述靶標分子為序列表中序列3的自5′端第22-33位核苷酸所示的DNA分子。
本發明還保護含有所述蛋白質的試劑盒;所述試劑盒的用途為如下(d1)或(d2)或(d3):
(d1)檢測靶標分子;
(d2)結合靶標分子;
(d3)富集靶標分子。
所述靶標分子為序列表中序列3的自5′端第22-33位核苷酸所示DNA的分子。
本發明還保護一種融合蛋白,包括結合區段和標記區段;所述結合區段如序列表中序列1自N末端第1至120位氨基酸殘基所示。
所述融合蛋白的標記區段可為現有技術中使用的任何可發揮標記功能的蛋白。
所述融合蛋白的標記區段具體可如序列表中序列1自N末端第139至322位氨基酸殘基所示。
所述融合蛋白還包括His標簽,所述His標簽如序列表中序列1自N末端第330至335位氨基酸殘基所示。
所述融合蛋白具體為由序列表中序列1自N末端第1至335位氨基酸殘基組成的蛋白質。
本發明還保護所述融合蛋白的應用,為如下(c1)或(c2):
(c1)檢測靶標分子;
(c2)制備用于檢測靶標分子的試劑盒。
所述靶標分子為如序列表中序列3的自5′端第22-33位核苷酸所示DNA分子。
本發明還保護含有所述融合蛋白的試劑盒;所述試劑盒的用途為檢測靶標分子;
所述靶標分子為如序列表中序列3的自5′端第22-33位核苷酸所示DNA分子。
本發明還保護一種用于檢測沙門氏菌的試劑盒,包括權所述融合蛋白和特異引物對;
所述特異引物對由引物F和引物R組成;
所述引物F為如下(e1)或(e2);
(e1)序列表的序列7所示的單鏈DNA分子;
(e2)將序列7經過一個或幾個核苷酸的取代和/或缺失和/或添加且與序列7具有相同功能的DNA分子;
所述引物R為如下(e3)或(e4);
(e3)序列表的序列8所示的單鏈DNA分子;
(e4)將序列8經過一個或幾個核苷酸的取代和/或缺失和/或添加且與序列8具有相同功能的DNA分子。
本發明還保護一種用于檢測沙門氏菌的試劑盒;包括所述融合蛋白、生物素標記的特異引物對和鏈霉親合素標記磁珠;
所述特異引物對由引物F和引物R組成;
所述引物F為如下(e1)或(e2);
(e1)序列表的序列7所示的單鏈DNA分子;
(e2)將序列7經過一個或幾個核苷酸的取代和/或缺失和/或添加且與序列7具有相同功能的DNA分子;
所述引物R為如下(e3)或(e4);
(e3)序列表的序列8所示的單鏈DNA分子;
(e4)將序列8經過一個或幾個核苷酸的取代和/或缺失和/或添加且與序列8具有相同功能的DNA分子。
所述試劑盒還包括沖洗液A、沖洗液B和沖洗液C。
本發明還保護一種檢測沙門氏菌的方法,包括如下步驟(f1)-(f5):
(f1)采用生物素標記的特異引物對模板進行PCR擴增,得到PCR擴增產物;
(f2)將步驟(f1)得到的PCR擴增產物與鏈霉親合素標記的磁珠共孵育;
(f3)完成步驟(f2)后,收集磁珠,與所述融合蛋白共孵育;
(f4)完成步驟(f3)后,收集磁珠檢測熒光信號;
所述模板為待測樣本的基因組DNA或培養待測樣本得到的菌液;
所述特異引物對由引物F和引物R組成;
所述引物F為如下(e1)或(e2);
(e1)序列表的序列7所示的單鏈DNA分子;
(e2)將序列7經過一個或幾個核苷酸的取代和/或缺失和/或添加且與序列7具有相同功能的DNA分子;
所述引物R為如下(e3)或(e4);
(e3)序列表的序列8所示的單鏈DNA分子;
(e4)將序列8經過一個或幾個核苷酸的取代和/或缺失和/或添加且與序列8具有相同功能的DNA分子。
所述方法中,步驟(f1)PCR擴增的反應體系具體可為10mmol/L dNTPs 2μL,5×PCR buffer 10μL,Fast pfu DNA polymerase 1μL,引物F 1μL,引物R 1μL,模板DNA 1μL,H2O 34μL,總體積50μL。
所述反應體系中,引物F的濃度為10μM,引物R的濃度為10μM。
所述步驟(f1)中,PCR擴增的反應程序具體可為:95℃預變性5min,95℃變性30s,55℃退火30s,72℃延伸45s,共35個循環,最后72℃延伸5min,10℃保存。
所述步驟(f2)中,共孵育的時間為30min。
所述方法中,還包括如下步驟:完成步驟(f2)后,收集磁珠,使用沖洗液A沖洗(具體可沖洗兩次),然后加入沖洗液B并孵育30min,然后收集磁珠。
所述步驟(f3)中,共孵育的時間為30min。
所述步驟(f3)中,所述融合蛋白以蛋白質溶液的形式加入到共孵育體系中,融合蛋白在蛋白質溶液中的初始濃度為100nM;每5μL磁珠加入100μL蛋白質溶液。
所述方法中,還包括如下步驟:完成步驟(f3)后,收集磁珠,先用沖洗液C沖洗(具體可沖洗兩次),然后用沖洗液B沖洗(具體可沖洗一次),然后用100μL沖洗液A重懸。
所述方法中,所述檢測熒光信號具體為檢測460/40nm熒光信號。
以上任一所述沖洗液A的配置方法為:0.1M Tris-HCl、100μM ZnCl2、0.1M NaCl,余量為水,pH為8.4。
以上任一所述沖洗液B的配置方法為:0.1M Tris-HCl、100μM ZnCl2、0.1M NaCl、2g/mL脫脂奶粉、1mM Biotin,余量為水,pH為8.4。
以上任一所述沖洗液C的配置方法為:0.1M Tris-HCl、100μM ZnCl2、0.1M NaCl、2g/mL脫脂奶粉、1mM Biotin,余量為水,0.1%(體積百分比)tween20,pH為8.4。
以上任一所述待測樣本具體可為沙門氏菌或大腸桿菌。
本發明設計合成了一種融合蛋白,本發明可以用于沙門氏菌的檢測,具備方便、迅捷、特異性強的優點,對沙門氏菌的有效地預防和控制有重要意義。
附圖說明
圖1為實施例1中蛋白純化結果。
圖2為實施例2中應用AF-Gluc蛋白檢測靶標分子檢測結果。
圖3為實施例3中特異性檢測結果。
圖4為實施例4中靈敏度檢測結果。
具體實施方式
以下的實施例便于更好地理解本發明,但并不限定本發明。下述實施例中的實驗方法,如無特殊說明,均為常規方法。下述實施例中所用的試驗材料,如無特殊說明,均為自常規生化試劑商店購買得到的。以下實施例中的定量試驗,均設置三次重復實驗,結果取平均值。
pET-21a(+)載體:Novagen公司,產品目錄號:69740-3。
大腸桿菌BL21(DE3):博邁德公司,產品目錄號:BC201-01。
非變性鎳柱結合緩沖液I:0.1M Tris-HCl、0.1M NaCl、0.01M Imidazole、0.5mM EDTA,余量為水,pH為8.4。
非變性鎳柱洗脫緩沖液II:0.1M Tris-HCl、0.1M NaCl、0.5M Imidazole、0.5mM EDTA,余量為水,pH為8.4。
20%非變性鎳柱洗脫緩沖液:非變性鎳柱結合緩沖液I和非變性鎳柱洗脫緩沖液II的混合溶液,非變性鎳柱結合緩沖液I和非變性鎳柱洗脫緩沖液II的體積比為80∶20。
80%非變性鎳柱洗脫緩沖液:非變性鎳柱結合緩沖液I和非變性鎳柱洗脫緩沖液II的混合溶液,非變性鎳柱結合緩沖液I和非變性鎳柱洗脫緩沖液II的體積比為20∶80。
沖洗液A:0.1M Tris-HCl、100μM ZnCl2、0.1M NaCl,余量為水,pH為8.4。
沖洗液B:0.1M Tris-HCl、100μM ZnCl2、0.1M NaCl、2g/mL脫脂奶粉、1mM Biotin,余量為水,pH為8.4。
沖洗液C:0.1M Tris-HCl、100μM ZnCl2、0.1M NaCl、2g/mL脫脂奶粉、1mM Biotin,余量為水,0.1%(體積百分比)tween20,pH為8.4。
鏈霉親合素標記磁珠:上海翊圣生物科技有限公司。
沙門氏菌:中國普通微生物菌種保藏管理中心,編號:1.10754。
實施例1、AF-Gluc蛋白的獲得
1、將序列表的序列2所示的雙鏈DNA分子插入pET-21a(+)載體的Nde I和Hind III酶切位點之間,得到重組質粒pET-AF-Gluc。根據測序結果,對重組質粒pET-AF-Gluc進行結構描述如下:將pET-21a(+)載體的Nde I和Hind III酶切位點之間的小片段取代為了序列表的序列2所示的DNA分子。
序列表的序列2所示的雙鏈DNA分子編碼序列表的序列1所示的蛋白質。將序列表的序列1所示的蛋白質命名為AF-Gluc蛋白,由335個氨基酸殘基組成。將編碼AF-Gluc融合蛋白的基因命名為AF-Gluc基因。AF-Gluc蛋白的預期分子量約為37kDa。
AF-Gluc蛋白分為三個功能區。功能區A為與靶序列的結合區,如序列表的序列1第1至120位氨基酸殘基所示;功能區B為熒光素酶,如序列表的序列1第139至322位氨基酸殘基所示;功能區C為His標簽,如序列表的序列1第330至335位氨基酸殘基所示。
2、將重組質粒pET-AF-Gluc導入大腸桿菌BL21(DE3),得到重組菌,命名為重組菌BL21-pET-AF-Gluc。
3、將重組菌BL21-pET-AF-Gluc接種至含有100μg/ml氨芐霉素的液體LB培養基,37℃、200rpm振蕩培養至OD600nm值達到0.6-0.8,然后加入IPTG和ZnCl2(IPTG在培養體系中的濃度為0.5mM、ZnCl2在培養體系中的濃度為100μM),然后18℃、200rpm振蕩培養16小時。
4、完成步驟3后,5000rpm離心15分鐘,收集菌體。
5、取步驟4得到的菌體,用非變性鎳柱結合緩沖液I重懸,超聲波破碎(40w的功率;每超聲5s間歇5s,30個循環),然后12000rpm離心15min,收集上清液,即為含有AF-Gluc蛋白的粗酶液。
6、采用鎳柱親和層析對步驟5得到的粗酶液進行純化。
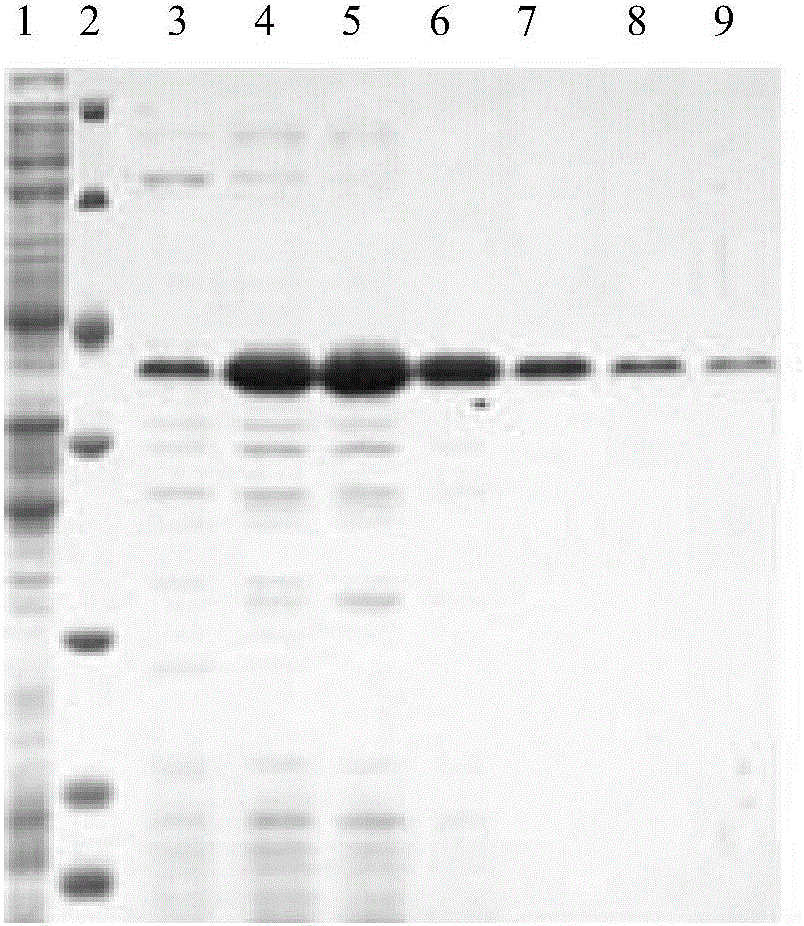
采用Amersham公司的AKTA FPLC系統和1ml裝量的HiTrap chelating HP column(鎳柱)。先上樣10ml步驟5得到的粗酶液,然后用10ml 20%非變性鎳柱洗脫緩沖液進行洗滌,然后用30ml 80%非變性鎳柱洗脫緩沖液進行洗脫,整個過程中流速為1ml/min。分別收集上樣時的過柱后溶液(穿透液)和洗脫時的過柱后溶液(洗脫液以每管1ml進行連續收集),進行SDS-PAGE。結果如圖1所示。圖1中,泳道2為標準蛋白maker,泳道1為穿透液,泳道3-9依次對應前7管收集的洗脫液(純化后的AF-Gluc蛋白),蛋白大小為37kDa左右。
實施例2、應用AF-Gluc蛋白檢測靶標分子
一、制備模板
1、分別合成序列表的序列3所示的單鏈DNA分子和序列表的序列4所示的單鏈DNA分子,然后將兩條單鏈DNA分子進行退火,得到的雙鏈DNA分子即為靶標分子。
序列表的序列3:GAAGCGCTCGCATTGTGGGCGCCAAGAGAAAAAGATGTCATTAACCTTGT;
序列表的序列4:ACAAGGTTAATGACATCTTTTTCTCTTGGCGCCCACAATGCGAGCGCTTC;
退火前,對序列3所示的單鏈DNA分子的5’末端進行生物素標記。
2、分別合成序列表的序列5所示的單鏈DNA分子和序列表的序列6所示的單鏈DNA分子,然后將兩條單鏈DNA分子進行退火,得到的雙鏈DNA分子即為對照分子。
序列表的序列5:GGTGTTAAGGTTCTGTTTGCTCTGATTTGCATTGCGGTTGCAGAAGCTAAG;
序列表的序列6:CTTAGCTTCTGCAACCGCAATGCAAATCAGAGCAAACAGAACCTTAACACC;
退火前,序列5所示的單鏈DNA分子的5’末端進行生物素標記。
二、應用AF-Gluc蛋白檢測靶標分子
1、分組處理
實驗組I:將100μL ddH2O與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組II:將100μL含靶標分子的DNA溶液與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組III:將100μL含對照分子的DNA溶液與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組IV:將50μL含靶標分子的DNA溶液、50μL含對照分子的DNA溶液與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
含靶標分子的DNA溶液中,靶標分子的濃度為100nM。含對照分子的DNA溶液中,對照分子的濃度為100nM。
2、完成步驟1后,收集磁珠,使用沖洗液A沖洗2次。
3、完成步驟2后,取所述磁珠,與沖洗液B孵育30min。
4、完成步驟3后,收集磁珠,加入100μL實施例1純化好的AF-Gluc蛋白溶液,共同孵育30min;AF-Gluc蛋白溶液中,AF-Gluc蛋白的濃度為100nM。
5、完成步驟4后,收集磁珠,先用沖洗液C沖洗兩次,然后用沖洗液B沖洗一次。
6、完成步驟5后,收集磁珠,用100μL沖洗液A重懸,加入黑色96酶標板中,在460/40nm酶標儀檢測熒光讀數。
結果如圖2所示。圖2中,1為實驗組I的相對熒光數值,2為實驗組II的相對熒光數值,3為實驗組III的相對熒光數值,4為實驗組IV的相對熒光數值。結果表明,實驗組I和實驗組III的熒光信號均非常微弱,實驗組II和實驗組IV的熒光信號均非常明顯,只有在加入了靶標分子的實驗組中,檢測出了非常明顯的熒光信號,其余組別信號均非常微弱,在加入靶標分子和對照分子的實驗組也檢測到明顯的熒光信號,表明AF-Gluc蛋白檢測靶標分子不受到體系中存在的其他分子干擾。
實施例3、特異性
待測樣本為:沙門氏菌、大腸桿菌BL21(DE3)。
1、針對沙門氏菌設計合成如下兩條引物(5’→3’):
F(序列表的序列7):GAAGCGCTCGCATTGTGGGCG;
R(序列表的序列8):ACAAGGTTAATGACATC;
將引物F的5’進行生物素標記。
2、提取各待測樣本的基因組DNA,以基因組DNA為模板,采用F和R組成的引物對進行PCR擴增,擴增產物純化后得到雙鏈DNA。
PCR反應體系:10mmol/L dNTPs 2μL,5×PCR buffer 10μL,Fast pfu DNA polymerase 1μL,引物F 1μL,引物R 1μL,模板DNA 1μL,H2O 34μL,總體積50μL。在反應體系中,引物F的濃度為10μM,引物R的濃度為10μM。
PCR反應程序:95℃預變性5min,95℃變性30s,55℃退火30s,72℃延伸45s,共35個循環,最后72℃延伸5min,10℃保存。
3、按照如下步驟依次操作進行檢測:
(1)設置如下四個實驗組:
實驗組I:將100μL沙門氏菌基因組DNA擴增純化后的雙鏈DNA與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min;
實驗組II:將100μL大腸桿菌BL21(DE3)基因組DNA擴增純化后的雙鏈DNA與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組III:將50μL沙門氏菌基因組DNA擴增純化后的雙鏈DNA、50μL大腸桿菌BL21(DE3)基因組DNA擴增純化后的雙鏈DNA與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組IV:將100μL無菌水與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
以上各組DNA擴增純化后的雙鏈DNA均以DNA溶液的形式加入到實驗體系中,雙鏈DNA在DNA溶液中的初始濃度均為100nM。
(2)使用磁力分選器分離磁珠2min,使用移液器將EP管中液體吸走,注意避免接觸磁珠,盡量吸凈。使用沖洗液A沖洗2次。
(3)加入沖洗液B與磁珠孵育30min,磁力分選,吸凈液體。
(4)加入100μL實施例1純化好的AF-Gluc蛋白溶液與磁珠共同孵育30min;AF-Gluc蛋白溶液中,AF-Gluc蛋白的濃度為100nM。
(5)使用沖洗液C沖洗兩次,使用沖洗液B沖洗一次,最終用100μL沖洗液A重懸磁珠,加入黑色96酶標板中,在460/40nm酶標儀檢測熒光讀數。
結果如圖3所示。圖3中,縱坐標為相對熒光數值;1為實驗組I的相對熒光數值,2為實驗組II的相對熒光數值,3為實驗組III的相對熒光數值,4為實驗組IV的相對熒光數值。結果表明,只有實驗組I和實驗組III檢測出了非常明顯的熒光信號,另外2組別信號均非常微弱,本方法具有特異性。
實施例4、靈敏度
1、將沙門氏菌接種于LB液體培養基中,37℃培養24小時,將菌液進行稀釋,得到5μL菌液A和5μL菌液B;5μL菌液A中沙門氏菌的含量為1CFU,5μL菌液B中沙門氏菌的含量為10CFU。
2、分別以菌液A和菌液B為模板,采用F和R組成的引物對進行PCR擴增,得到擴增產物。
F(序列表的序列7)(5’→3’):GAAGCGCTCGCATTGTGGGCG;
R(序列表的序列8)(5’→3’):ACAAGGTTAATGACATC;
將引物F用生物素標記。
PCR反應體系:10mmol/L dNTPs 2μL,5×PCR buffer 10μL,Fast pfu DNA polymerase 1μL,引物F 1μL,引物R 1μL,菌液A或菌液B 5μL,H2O 30μL,總體積50μL。在反應體系中,引物F的濃度為10μM,引物R的濃度為10μM。
PCR反應程序:95℃預變性5min,95℃變性30s,55℃退火30s,72℃延伸45s,共35個循環,最后72℃延伸5min,10℃保存。
3、按照如下步驟依次操作進行檢測:
(1)設置如下三個實驗組:
實驗組I:將50μL無菌水與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組II:將50μL以菌液A為模板得到的擴增產物與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
實驗組III:將50μL以菌液B為模板得到的擴增產物與5μL鏈霉親合素標記磁珠在1.5mL EP管中混合后室溫孵育30min。
(2)使用磁力分選器分離磁珠2min,使用移液器將EP管中液體吸走,注意避免接觸磁珠,盡量吸凈。使用沖洗液A沖洗2次。
(3)加入沖洗液B與磁珠孵育30min,磁力分選,吸凈液體。
(4)加入100μL實施例1純化好的AF-Gluc蛋白溶液與磁珠共同孵育30min;AF-Gluc蛋白溶液中,AF-Gluc蛋白的濃度為100nM。
(5)使用沖洗液C沖洗兩次,使用沖洗液B沖洗一次,最終用100μL沖洗液A重懸磁珠,加入黑色96酶標板中,在460/40nm酶標儀檢測熒光讀數。
結果如圖4所示。圖4中,縱坐標為相對熒光數值;1為實驗組I的相對熒光數值,2為實驗組II的相對熒光數值,3為實驗組III的相對熒光數值;結果表明,當待測菌含量低至1CFU時,使用本方法也可以檢測到。
- 還沒有人留言評論。精彩留言會獲得點贊!