防治甘薯蔓割病的尖孢鐮刀菌甘薯專化型非致病突變菌株的制作方法
本發(fā)明具體涉及一種防治甘薯蔓割病的尖孢鐮刀菌甘薯專化型非致病突變菌株。
背景技術(shù):
甘薯蔓割病是由尖孢鐮刀菌甘薯專化型fusariumoxysporumf.sp.batatas引起的甘薯維管束真菌病害。此病在我國主要分布在東南沿海各省,其中在浙江、福建危害最為嚴(yán)重,一般能使甘薯減產(chǎn)10%~20%,重者達(dá)50%。現(xiàn)有甘薯生產(chǎn)上采用最為主要的防治手段就是選育抗病品種,但是實際育種中總是難以將優(yōu)良的生產(chǎn)性狀與抗病性狀相結(jié)合,如在福建連城大規(guī)模種植的“90日早”、“巖薯7-3”不抗薯割病,需要采用藥劑等其他措施進(jìn)行甘薯蔓割病的防治。隨著人們對食品和環(huán)境安全要求的提高,生物防治作為一種綠色安全的措施越來越受到人們的重視,因而,探索甘薯蔓割病的生物防治技術(shù)有利于促進(jìn)甘薯產(chǎn)業(yè)的發(fā)展。
現(xiàn)階段尖孢鐮刀菌生防因子種類包括真菌(木霉trichoderma、叢枝菌根真菌arbuscularmycorrhizae、非致病尖孢鐮刀菌nonpathogenicfusariumoxysporum、淡紫擬青霉paecilomyceslilacinus),細(xì)菌(假單胞桿菌pseudomonas、芽胞桿菌bacillus)、植物提取物、放線菌等。由于非致病型鐮刀菌菌株和致病菌株需要相似的生態(tài)條件,有相似的定殖行為和營養(yǎng)需求,可與致病型菌株產(chǎn)生更強的競爭作用,因而鐮刀菌非致病菌株是防效最好、最穩(wěn)定的生防因子之一。
技術(shù)實現(xiàn)要素:
本發(fā)明要解決的技術(shù)問題,在于提供一種防治甘薯蔓割病的尖孢鐮刀菌甘薯專化型非致病突變菌株。
本發(fā)明是這樣實現(xiàn)的:一種防治甘薯蔓割病的尖孢鐮刀菌甘薯專化型非致病突變菌株,所述菌株為尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4(fusariumoxysporumf.sp.batatas),于2016年08月29日保藏于中國典型培養(yǎng)物保藏中心,保藏編號為cctccm2016435。
本發(fā)明的優(yōu)點在于:對甘薯蔓割病具有生物防治效果,在pda培養(yǎng)基上表現(xiàn)出對致病菌營養(yǎng)空間競爭的拮抗效果,此生防菌株處理過甘薯后,能顯著降低蔓割病的發(fā)病率;在t-dna中加入了gfp綠色熒光蛋白標(biāo)記基因,便于生防菌的環(huán)境行為監(jiān)測;本發(fā)明為從自然環(huán)境中分離生防菌存在的問題提供了解決的方法,也為其它作物上尖孢鐮刀菌引起病害的生防菌開發(fā)提供借鑒。
附圖說明
下面參照附圖結(jié)合實施例對本發(fā)明作進(jìn)一步的說明。
圖1是本發(fā)明中pcambia1300-ptrpc-hph-gfp用ecori和sali酶切后的電泳圖。
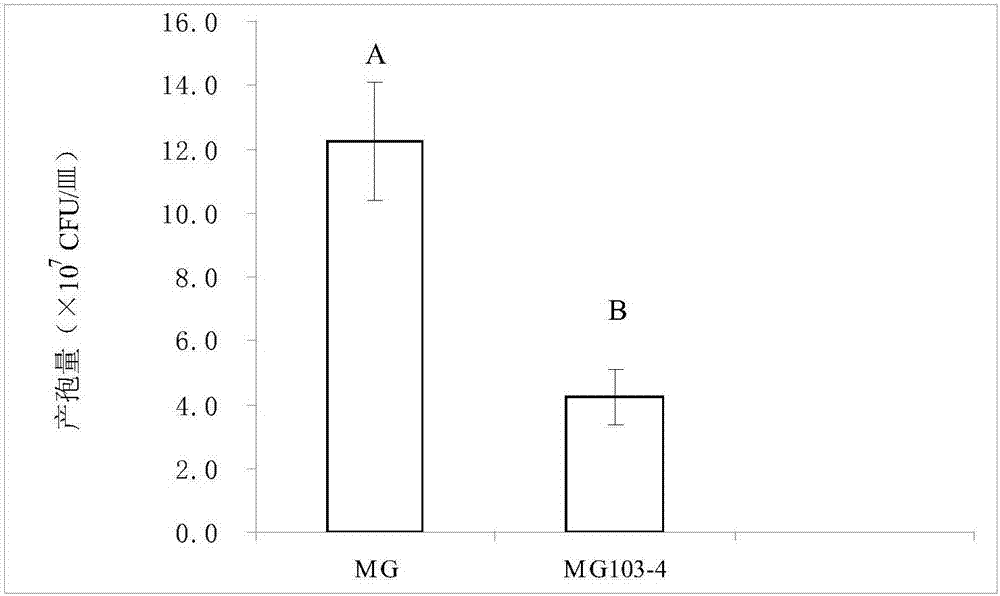
圖2是本發(fā)明中尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的產(chǎn)孢能力的示意圖。
mg—尖孢鐮刀菌甘薯專化型菌株mg
mg50-5—尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4
具體實施方式
菌株保藏
尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4(fusariumoxysporumf.sp.batatasmg103-4),于2016年08月29日保藏于中國典型培養(yǎng)物保藏中心(cctcc),地址為湖北省武漢市武昌區(qū)八一路珞珈山,保藏編號為cctccm2016435
供試菌株:尖孢鐮刀菌甘薯專化型菌株mg(fusariumoxysporumf.sp.batatasmg),于2016年08月29日保藏于中國典型培養(yǎng)物保藏中心(cctcc),地址為湖北省武漢市武昌區(qū)八一路珞珈山,保藏編號為cctccm2016432。
尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的具體制備方法如下:
1.1試驗材料
甘薯品種新種花(蔓割病敏感型)由本研究室保存種植,pct74(上海北諾生物科技有限公司),pcambia1300(北京華越洋生物科技有限公司),pvok21由中國農(nóng)業(yè)大學(xué)惠贈,pmd18-t購自takara-寶生物工程(大連)有限公司;所有限制性內(nèi)切酶bstxi,sali,xhoi和ecori均購自takara-寶生物工程(大連)有限公司,潮霉素b購自roche公司,特美汀購自上海前塵生物科技有限公司,乙酰丁香酮、mes、混合纖維微孔濾膜均購自生工生物工程(上海)股份有限公司,其余農(nóng)桿菌轉(zhuǎn)化用藥品均購自國藥集團(tuán)化學(xué)試劑有限公司。
1.2構(gòu)建雙元熒光載體pcambia1300-ptrpc-hph-gfp
首先用ecori和sali兩種限制性內(nèi)切酶分別酶切質(zhì)粒pct74和pcambia1300,回收獲得sali-ptoxa-gfp-nos-ecori和sali-pcambia1300-ecori,兩個片段相連接后構(gòu)建完成載體pcambia1300-gfp;然后用xhoi和bstxi兩種限制性內(nèi)切酶酶切質(zhì)粒pcambia1300-gfp(去除camv35s-hph片段),并且以質(zhì)粒pkov21為模板(用真菌中常用的ptrpc啟動子啟動潮霉素b抗性基因表達(dá)),pcr擴(kuò)增ptrpc-hph片段,在片段首尾分別加入xhoi和bstxi酶切位點,引物為hphrc-f-xhoi和ptrpcrc-r-bstxi。
hphrc-f-xhoi:5′-ctcgagctatttctttgccctcggac-3′(如seqidno:1所示);
ptrpcrc-r-bstxi:
5′-ccaacatggtgggtcgacagaagatgatattgaagg-3′(如seqidno:2所示)。
反應(yīng)體系:總體積50μl,2×gcbufferi25μl,dntpmixture(2.5mmol/leach)8μl,引物hphrc-f-xhoi(10μmol/l)1.25μl,引物ptrpcrc-r-bstxi(10μmol/l)1.25μl,模板pkov21(體系中質(zhì)粒終濃度為0.1-10ng)1.5μl,lataq0.5μl,用ddh2o補齊50μl,其中,試劑均購自takara-寶生物工程(大連)有限公司。
反應(yīng)程序:第一步94℃預(yù)變性1min;第二步94℃變性30s,57℃退火30s,72℃延伸2min,第二步30個循環(huán);第三步72℃延伸10min。
pcr產(chǎn)物通過連接反應(yīng)插入pmd18-t載體后,獲得pmd18-ptrpc-hph并送往鉑尚生物技術(shù)有限公司測序,pmd18-ptrpc-hph序列如seqidno:3所示,進(jìn)行序列比對,測序結(jié)果正確后,用xhoi和bstxi酶切pmd18-ptrpc-hph質(zhì)粒并回收獲得bstxi-ptrpc-hph-xhoi片段。最后將pcambia1300-gfp骨架與bstxi-ptrpc-hph-xhoi片段連接獲得pcambia1300-ptrpc-hph-gfp載體。
在pcambia1300-ptrpc-hph-gfp質(zhì)粒構(gòu)建完成后,首先對pcambia1300-ptrpc-hph-gfp質(zhì)粒進(jìn)行ecori和sali酶切初步確定sali-ptoxa-gfp-nos-ecori片段已經(jīng)連入pcambia1300-ptrpc-hph骨架中(見圖1,其中標(biāo)識1代表marker標(biāo)準(zhǔn)分子量,標(biāo)識2是pcambia1300-ptrpc-hph-gfp質(zhì)粒經(jīng)酶切驗證的條帶),又進(jìn)行pcr擴(kuò)增ptrpc-hph片段(具體見1.2的試驗方法)和gfp片段。
pcr擴(kuò)增gfp片段的反應(yīng)程序和反應(yīng)體系如下:
引物p28:5′-tagtggactgattggaatgcatggaggagt-3′;
引物p29:5′-gatagaacccatggcctatattcattcaat-3′。
反應(yīng)體系:總體積20μl,試劑均購自takara-寶生物工程(大連)有限公司):10×pcrbufferi2μl,dntpmixture(2.5mmol/leach)1.6μl,引物p28(10μmol/l)0.5μl,引物p29(10μmol/l)0.5μl,模板為pcambia1300-ptrpc-hph-gfp(體系中質(zhì)粒終濃度為0.1-10ng)1μl,rtaq0.2μl,用ddh2o補齊50μl。
反應(yīng)程序:第一步94℃預(yù)變性4min;第二步94℃變性30s,57℃退火30s,72℃延伸1.5min,第二步35個循環(huán);第三步72℃延伸10min。
兩個pcr產(chǎn)物通過1%瓊脂糖凝膠電泳及凝膠圖像分析系統(tǒng)檢測,ptrpc-hph的pcr產(chǎn)物大小為1392bp,gfp的pcr產(chǎn)物大小為417bp,回收目的片段送往鉑尚生物技術(shù)有限公司測序,并進(jìn)行序列比對,gfp的pcr產(chǎn)物序列如seqidno:4所示,確定已經(jīng)將ptrpc-hph片段和gfp導(dǎo)入到載體pcambia1300中。
1.3農(nóng)桿菌轉(zhuǎn)化、轉(zhuǎn)化情況檢測和轉(zhuǎn)化子單孢分離保存
尖孢鐮刀菌農(nóng)桿菌轉(zhuǎn)化過程和使用的培養(yǎng)基參照文獻(xiàn)(khangch,parksy,rhohs,etal.filamentousfungi(magnaporthegriseaandfusariumoxysporum)//agrobacteriumprotocols[m].totowa:humanapress,2007,403-420.)的方法略作改動,改動之處如下:
將尖孢鐮刀菌甘薯專化型菌株mg在pda固體培養(yǎng)基(1l培養(yǎng)基中含有200g馬鈴薯,15g葡萄糖,15g瓊脂粉)純化培養(yǎng)7d后,加入無菌水將分生孢子刮洗出來用2層無菌擦鏡紙過濾,并用im液體培養(yǎng)基(見表1)將分生孢子濃度調(diào)整到1×106cfu/ml,得尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液,備用。將轉(zhuǎn)入pcambia1300-ptrpc-hph-gfp載體的農(nóng)桿菌agl-1在mm液體培養(yǎng)基中(見表1)28℃,250r/min搖培2d后,用含200μmol/l乙酰丁香酮的im液體培養(yǎng)基將菌液濃度調(diào)整為od600=0.15,接著搖培6h(od600約為0.6),得農(nóng)桿菌液。將混合纖維微孔濾膜放置在含有200μmol/l乙酰丁香酮的cm固體培養(yǎng)基(見表1)上,之后將100μl尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液和100μl農(nóng)桿菌液混勻涂布在混合纖維微孔濾膜上,25℃,暗培養(yǎng)2d。共培養(yǎng)后將混合纖維微孔濾膜用刀劃成小塊分散擺放到篩選培養(yǎng)基(含潮霉素b濃度100μg/ml,特美汀濃度200μg/ml的pda培養(yǎng)基)上,28℃暗培養(yǎng),得轉(zhuǎn)化子。轉(zhuǎn)化過程所用各種菌均放置在隔水式恒溫培養(yǎng)箱gnp-9080型中培養(yǎng)。在篩選培養(yǎng)基上培養(yǎng)3d后,將轉(zhuǎn)化子整皿放置在bd-bgc1藍(lán)光切膠儀中,在藍(lán)色激發(fā)光下觀察菌落顏色。對于能發(fā)出綠色熒光的菌落挑取其孢子進(jìn)行單孢純化,將單孢形成的菌落再轉(zhuǎn)移到放置無菌濾紙片的篩選培養(yǎng)基上。待菌落長到?jīng)]過濾紙后再將菌落放在藍(lán)光下觀察菌落顏色,若菌落依然發(fā)出綠色熒光,則將濾紙片放入無菌信封中保存。
表1農(nóng)桿菌轉(zhuǎn)化所需試劑及培養(yǎng)基配方表
構(gòu)建好的pcambia1300-ptrpc-hph-gfp載體通過agl-1農(nóng)桿菌轉(zhuǎn)化入尖孢鐮刀菌甘薯專化型菌株mg,經(jīng)過潮霉素抗性篩選3d后長出的轉(zhuǎn)化子在藍(lán)色激發(fā)光下會發(fā)出綠色熒光,說明帶gfp綠色熒光蛋白標(biāo)記基因的t-dna已成功整合入尖孢鐮刀菌甘薯專化型基因組。轉(zhuǎn)化過程中一張5cm直徑混合纖維微孔濾膜上約涂布1×106個分生孢子,最終每張膜約長出10個轉(zhuǎn)化子,將發(fā)出綠色熒光的菌落挑取少量孢子單孢分離并濾紙片保存后,最終獲得了711個純化培養(yǎng)的尖孢鐮刀菌甘薯專化型突變體。
1.4尖孢鐮刀菌甘薯專化型非致病突變體的篩選(致病力初步檢測)
生產(chǎn)上用5×105cfu/ml尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液做致病力測定可以很好地區(qū)分不同抗性水平的甘薯,因此文中所有的尖孢鐮刀菌甘薯專化型菌株mg和轉(zhuǎn)化子接菌甘薯試驗都是采用5×105cfu/ml的孢子懸浮液濃度。配制好尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液和轉(zhuǎn)化子孢子懸浮液后,在田間剪取健康的新種花主莖頂部約20cm莖段,將傷口朝下浸泡入孢子懸浮液中20min后棄菌液,將莖段插入清水中培養(yǎng)(在賽福冷光源植物氣候箱中,溫度28℃,光周期16l:8d),以尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液處理后新種花出現(xiàn)4級以上典型發(fā)病癥狀為準(zhǔn)開始統(tǒng)計發(fā)病情況(在合適條件下接種尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液5d即可發(fā)病至4級,7d后死亡),以尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液和清水處理為對照,單個菌株處理10個莖段,3次重復(fù)。
蔓割病病情分級標(biāo)準(zhǔn):以株為單位,0(0.0)級:無病;1(0.1)級:地上部生長正常,莖基部維管束變褐在3cm左右;2(0.2)級:地上部基本正常,莖基部維管束變褐在1/4左右;3(0.5)級:莖基部葉片變黃,維管束變褐在1/2以上;4(0.8)級:植株葉片多數(shù)變黃枯死,莖部維管束變褐?jǐn)U展及頂芽;5(1.0)級:全株枯死。
病情指數(shù)=(0.1×n1+0.2×n2+0.5×n3+0.8×n4+1.0×n5)/n×100。
n為各級病株數(shù);n為參試總株數(shù)。當(dāng)病情指數(shù)為0.0~20.5,植株表現(xiàn)高抗反應(yīng)時,認(rèn)定為突變體是非致病突變體。
對尖孢鐮刀菌甘薯專化型711個突變體進(jìn)行致病力檢測試驗,獲得了40個致病力下降的突變體。對40個致病力下降的突變體非致病突變體的穩(wěn)定性檢測,包括平板轉(zhuǎn)接穩(wěn)定性和非致病性的穩(wěn)定性檢測,非致病突變體在pda固體培養(yǎng)基上至少轉(zhuǎn)接6代后,觀察菌落形態(tài)并放置在藍(lán)光下觀察是否能發(fā)出綠色熒光。性狀穩(wěn)定的突變體再接種新種花進(jìn)行致病力重復(fù)檢測,每次檢測10株,3次重復(fù)。最終得到尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4,且尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4致病力即病情指數(shù)為13.03,相對于野生型尖孢鐮刀菌甘薯專化型菌株mg的病情指數(shù)95.03顯著降低,新種花外觀未表現(xiàn)出發(fā)病癥狀。
1.5非致病突變體安全性檢測
將以尖孢鐮刀菌甘薯專化型菌株mg和尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4均配制成濃度約為2.67×106cfu/ml的孢子懸浮液,分別取150ml與400ml滅菌土壤混勻裝盆,設(shè)置清水拌土對照。將田間采集的健康“新種花”莖段移栽至盆里,每盆10株,3次重復(fù)。將處理過的盆栽放在冷光源培養(yǎng)箱中培養(yǎng),條件設(shè)置為溫度28℃,濕度95%,光周期16l:8d。
由于上述步驟1.4的致病力初步檢測是僅用以無菌水為介質(zhì)的突變體孢子懸浮液處理新種花20min,而真正的生物防治菌株需要長時間在土壤中作用于甘薯植株。因此試驗又進(jìn)一步以尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4孢子懸浮液拌營養(yǎng)土的方式接菌新種花以確定其安全性。以尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液拌土和無菌水拌土為對照,結(jié)果顯示相同培養(yǎng)條件下尖孢鐮刀菌甘薯專化型菌株mg處理的新種花在7d后發(fā)病在4級以上,無綠葉接近死亡,而尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4處理的新種花和水處理一樣未表現(xiàn)出發(fā)病癥狀,病情指數(shù)顯著降低,相當(dāng)于甘薯高抗品種對于尖孢鐮刀菌甘薯專化型菌株mg的抗性反應(yīng)水平,結(jié)果進(jìn)一步證實了尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4這個突變體致病力喪失,持續(xù)接觸新種花依舊不會致病。
1.6轉(zhuǎn)化子產(chǎn)孢情況檢測
將單孢分離純化后的轉(zhuǎn)化子尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4在pda培養(yǎng)基上于28℃活化培養(yǎng)10~14d,在培養(yǎng)皿里加入無菌水用涂布器將分生孢子刮洗出來。刮洗液用2層無菌擦鏡紙過濾制成孢子懸浮液,用血球計數(shù)板進(jìn)行孢子計數(shù),計算1皿(直徑為6cm)轉(zhuǎn)化子中所有的孢子數(shù)。試驗重復(fù)3次,每次3皿。
實驗結(jié)果如下:
在pda培養(yǎng)基上,無論是尖孢鐮刀菌甘薯專化型菌株mg,還是非致病突變體尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4,正面菌絲質(zhì)地都呈現(xiàn)毛氈狀,背面色素分布深淺以及輪紋各不相同,并隨著不同培養(yǎng)時間批次有所差別。尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的分生孢子產(chǎn)量也顯著下降(見圖2)。另外,尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的孢子形態(tài)相對于野生型尖孢鐮刀菌甘薯專化型菌株mg并沒有發(fā)生顯著變化。
1.7生防效果檢測
1.7.1對峙培養(yǎng)試驗將28℃暗培養(yǎng)5d的尖孢鐮刀菌甘薯專化型菌株mg和尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的菌餅的邊緣用直徑為0.5cm的打孔器打孔,將尖孢鐮刀菌甘薯專化型菌株mg和尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的菌餅分別對稱放置在pda培養(yǎng)基上距邊緣約直徑1/4處,28℃暗培養(yǎng),試驗重復(fù)3次。
1.7.2生防效果盆栽試驗將尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4孢子配置濃度成5×105cfu/ml的孢子懸浮液,將田間剪取的健康新種花主莖頂部20cm莖段傷口朝下浸泡其中,分別浸泡2、4、8、16、24h后取出,扦插于事先準(zhǔn)備好的含菌盆缽中(每盆約400ml的無菌營養(yǎng)土與150ml2.67×106cfu/ml濃度的尖孢鐮刀菌甘薯專化型菌株mg孢子懸浮液均勻混合),每處理10株,重復(fù)3次,以清水浸苗扦插于相同尖孢鐮刀菌甘薯專化型菌株mg孢子濃度的土壤和無菌土為對照。將處理過的盆栽放在冷光源培養(yǎng)箱中培養(yǎng),條件設(shè)置為溫度28℃,濕度95%,光周期16l:8d。
對峙培養(yǎng)結(jié)果:
尖孢鐮刀菌甘薯專化型菌株mg和尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4在對峙培養(yǎng)5d后可以看到每一皿的兩菌落在培養(yǎng)皿中間出現(xiàn)明顯的呈直線菌落分界,菌絲間沒有互相融合,說明尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4與尖孢鐮刀菌甘薯專化型菌株mg存在營養(yǎng)競爭和空間競爭,菌絲擴(kuò)展速度相當(dāng)。但是,相對于尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4而言,尖孢鐮刀菌甘薯專化型菌株mg菌落更厚更稠密,生長勢要更好。
表2不同預(yù)處理時長對甘薯蔓割病的防治效果
注:mg指代尖孢鐮刀菌甘薯專化型菌株,mg55-7指代尖孢鐮刀菌甘薯專化型非致病突變菌株mg55-7;病情指數(shù)列和防治效果列的不同大寫字母表示差異極顯著(p<0.01)
生防效果盆栽試驗結(jié)果:
非致病突變體尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4在處理新種花2h后,對蔓割病具有防治效果,隨著處理時間的延長,尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4的生防效果也逐漸明顯,處理16h后,生防效果趨于穩(wěn)定,在處理24h后,生防效果達(dá)到了86.98%(見表2)。
本發(fā)明通過構(gòu)建尖孢鐮刀菌甘薯專化型的t-dna插入突變體庫,篩選出非致病突變體作為生防資源,最終獲得了針對甘薯蔓割病的生防菌株尖孢鐮刀菌甘薯專化型非致病突變菌株mg103-4。由于是直接對尖孢鐮刀菌甘薯專化型進(jìn)行改造,因此獲得的生防菌理論上與病原菌生態(tài)位重疊性最好,施用后環(huán)境適應(yīng)性最好,營養(yǎng)空間競爭也最為激烈。其次,由于t-dna插入位置可以通過tail-pcr進(jìn)行定位,因此可以明確了解非致病突變體的遺傳背景。再次,本發(fā)明還在t-dna中加入了gfp綠色熒光蛋白標(biāo)記基因,便于生防菌的環(huán)境行為監(jiān)測。本發(fā)明為從自然環(huán)境中分離生防菌存在的問題提供了解決的方法,也為其它作物上尖孢鐮刀菌引起病害的生防菌開發(fā)提供借鑒。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一株促進(jìn)鐵皮石斛生長的尖孢鐮刀菌及其應(yīng)用的制造方法與工藝
- 防治甘薯蔓割病的尖孢鐮刀菌甘薯專化型非致病突變菌株的制造方法與工藝
- 嗜酸性尖鐮孢菌株及其生產(chǎn)和使用方法與流程
- 痰液中醋酸鐮孢氨酸C和雙甲硫基膠霉毒素的高效液相色譜?串聯(lián)質(zhì)譜同時檢測方法與流程
- 三孢布拉霉負(fù)菌crgA基因及其克隆和應(yīng)用的制造方法與工藝
- 裂解鐮孢毒素的多肽變體、包含所述多肽變體的添加劑和所述添加劑的用途,以及用于裂解鐮孢毒素的方法與流程
- 一種peg介導(dǎo)的尖孢鐮刀菌芝麻專化型原生質(zhì)體遺傳轉(zhuǎn)化的方法
- 一種尖孢鐮刀菌及其在降解連作障礙自毒物質(zhì)中的應(yīng)用的制作方法
- 一種多功能農(nóng)用折疊式鐮刀的制作方法與工藝
- 一種電子鐮刀的制作方法與工藝
- 一種通過固體發(fā)酵鐮孢菌Fusarium sp.產(chǎn)生新抗菌劑sambacide的方法與流程
- 一株尖孢鐮刀菌及其在鐵皮石斛栽培中的應(yīng)用的制造方法與工藝
- 一株促進(jìn)鐵皮石斛生長的尖孢鐮刀菌及其應(yīng)用的制造方法與工藝
- 防治甘薯蔓割病的尖孢鐮刀菌甘薯專化型非致病突變菌株的制造方法與工藝
- 一種用于采收中藥材的鐮刀的制造方法與工藝
- 嗜酸性尖鐮孢菌株及其生產(chǎn)和使用方法與流程
- 痰液中醋酸鐮孢氨酸C和雙甲硫基膠霉毒素的高效液相色譜?串聯(lián)質(zhì)譜同時檢測方法與流程
- 一種大白菜根腫菌生理小種的單孢分離方法與流程