利用β?葡萄糖苷酶提高菇渣產氫和產糖的方法及其應用與流程
本發明屬于微生物發酵領域,特別涉及一種利用β-葡萄糖苷酶提高菇渣產氫和產糖的方法及其應用。
背景技術:
隨著人類社會的進步,作為人類賴以生存和發展的物質基礎,能源的需求量也日益劇增。目前世界上的能源供應大部分都是化石能源,但是由于其不可再生、儲量有限和環境污染問題制約著人類社會的進步。能源和環境危機將可再生能源推向了研究熱潮,希望其可以替代化石能源,支撐人類社會對能源的需求。以可木質纖維素為原料,利用微生物或者其他手段將其轉化為可以直接利用的生物乙醇或者氫氣,由于可再生性和環境友好性被人們寄予厚望,受到眾多研究者的重視。實現木質纖維素高效轉化的第一步是將聚合形式的纖維素和半纖維素分解為可發酵性的糖,同時也是生物質能源化的限速步驟,該過程通常利用纖維素酶進行,但是由于酶的生產成本高,利用微生物直接轉化木質纖維素的方法受到大家的青睞。提高微生物的降解效率和轉化效率可以有效降低生物質能源的生產成本,加速生物能源的工業化進程。
原材料和酶的成本在生物燃料生產中占據較大比重,因此如何選擇所使用的原材料和酶以降低生物燃料的成本是研究人員的研究方向。以農業廢棄物——菇渣為原料,利用聯合加工工藝直接進行微生物的轉化,可以大幅降低原料成本和酶的生產成本,同時還可以解決廢棄菇渣對環境的污染問題,對生物燃料的生產具有重要的意義。
技術實現要素:
本發明的首要目的在于克服現有技術的缺點與不足,提供一種利用β-葡萄糖苷酶提高菇渣產氫和產糖的方法。該方法以菇渣為原料,僅僅通過洗滌粉碎等前期處理,利用嗜熱厭氧梭菌(Clostridium thermocellum)厭氧發酵過程中添加β-葡萄糖苷酶和低濃度的表面活性劑提高菇渣的發酵產氫和生物糖化效率。
本發明的另一目的在于提供所述利用β-葡萄糖苷酶提高菇渣產氫和產糖方法的應用。
本發明的目的通過下述技術方案實現:一種利用β-葡萄糖苷酶提高菇渣產氫和產糖的方法,包括以下步驟:在發酵培養基中接種嗜熱厭氧梭菌,并添加物質A進行厭氧發酵,提高產氫和生物糖化效率;物質A為β-葡萄糖苷酶和表面活性劑中的一種或兩種。
所述的物質A優選為β-葡萄糖苷酶、或是β-葡萄糖苷酶和表面活性劑的組合。
所述的表面活性劑優選為Triton X-100。
所述的表面活性劑的濃度優選為125g/L。
所述的表面活性劑的添加時間優選為發酵第82h添加。
所述的表面活性劑的添加量優選為按終濃度為質量(g)體積(ml)比0.25%計算。
所述的表面活性劑優選通過如下操作步驟得到:將表面活性劑溶液裝入能密封的容器中密封,抽真空、充惰性氣體及滅菌。
所述的能密封的容器優選為血清瓶。
所述的惰性氣體優選為氮氣。
所述的充惰性氣體的具體操作優選為:充0.01MPa氮氣3次。
所述的滅菌的條件優選為:115℃滅菌20min。
所述的β-葡萄糖苷酶為嗜熱厭氧梭菌本身的β-葡萄糖苷酶。
所述的β-葡萄糖苷酶的添加時間為:發酵第0h和/或發酵第82h時添加,優選為0h添加后82h再補加一次。
所述的β-葡萄糖苷酶的添加量優選為按1g菇渣配比10~11Uβ-葡萄糖苷酶計算;更優選為每50mL厭氧發酵體系中含30Uβ-葡萄糖苷酶。
所述的β-葡萄糖苷酶優選通過如下制備方法制備得到:對嗜熱厭氧梭菌的β-葡萄糖苷酶基因進行克隆,再將該β-葡萄糖苷酶基因重組到表達載體中,將得到的重組表達載體轉化入宿主細胞進行表達,得到β-葡萄糖苷酶。
所述的克隆的步驟優選如下:以嗜熱厭氧梭菌的DNA或cDNA為模板,通過以下引物進行PCR,得到β-葡萄糖苷酶基因;
引物1:5`-CAGTCCATGGCAAAGATAAC-3`;
引物2:5`-CGAGCTCGAAACCGTTGTTTTTGATTAC-3`。
所述的表達載體優選為原核表達載體;更優選為pET-30a載體。
所述的宿主細胞優選為原核宿主細胞;更優選為大腸桿菌BL21。
所述的發酵培養基為以菇渣為碳源的培養基。
所述的發酵培養基的組成為A液、B液、C液、D液和E液按體積比40:2:1:1:1混合得到,pH值約為7.0,其中:
A液中含有60g/L的菇渣作為碳源;B液中含有檸檬酸鉀50g/L、一水檸檬酸31.25g/L、硫酸鈉25g/L、磷酸二氫鉀25g/L和碳酸氫鈉62.5g/L;C液中含有氯化銨75g/L、尿素250g/L和酵母抽提物50g/L;D液中含有六水氯化鎂50g/L、氯化亞鐵四水合物5g/L、二水氯化鈣10g/L和L-半胱氨酸鹽酸鹽一水物50g/L;E液中含有二鹽酸吡哆胺1g/L、對氨基苯甲酸0.2g/L、D-生物素0.1g/L、維生素B12 0.1g/L和維生素B1 0.2g/L;A液、B液、C液、D液、和E液中的溶劑為去離子水。
所述的菇渣優選通過如下方法制備得到:將菇類生產后的廢棄物用清水洗滌至中性后烘干至恒重,粉碎得到,菇類生產后的廢棄物包括菇類的培養基以及被廢棄的菇體。
所述的粉碎的程度為能過200目篩。
所述的嗜熱厭氧梭菌為能夠直接降解纖維素的嗜熱厭氧梭菌,優選為嗜熱厭氧梭菌ATCC 27405。
所述的嗜熱厭氧梭菌為處于對數生長期的嗜熱厭氧梭菌,接種體積量優選為相當于發酵培養基體積的10%。
所述的處于對數生長期的嗜熱厭氧梭菌通過如下步驟制備得到:將嗜熱厭氧梭菌在種子液培養基中經活化和擴大培養,得到處于對數生長期的嗜熱厭氧梭菌。
所述的種子液培養基組成為:A1液、B液、C液、D液和E液按體積比40:2:1:1:1混合得到,其中:
A1液中含有3g/L的纖維素作為碳源;B液中含有檸檬酸鉀50g/L、一水檸檬酸31.25g/L、硫酸鈉25g/L、磷酸二氫鉀25g/L和碳酸氫鈉62.5g/L;C液中含有氯化銨75g/L、尿素250g/L和酵母抽提物50g/L;D液中含有六水氯化鎂50g/L、氯化亞鐵四水合物5g/L、二水氯化鈣10g/L和L-半胱氨酸鹽酸鹽一水物50g/L;E液中含有二鹽酸吡哆胺1g/L、對氨基苯甲酸0.2g/L、D-生物素0.1g/L、維生素B12 0.1g/L和維生素B1 0.2g/L;A1液、B液、C液、D液、和E液中的溶劑為去離子水。
所述的活化的條件優選為:在西林瓶中加入種子液培養基,再接種嗜熱厭氧梭菌,于55~60℃搖床培養48~72h。
所述的放大的條件優選為:在血清瓶中加入種子培養基培養48~72h,再接種經活化后的嗜熱厭氧梭菌,于55~60℃搖床培養48~72h或OD600=1.1~1.3。
所述的厭氧發酵優選通過如下操作步驟實現:在能密封的發酵容器中加入發酵培養基,密封,抽真空,充惰性氣體,滅菌,再接種嗜熱厭氧梭菌進行厭氧發酵。
所述的發酵的溫度優選為55℃,搖床轉速優選為150rpm,發酵的時間優選為168h收集氫氣或發酵液。
所述的能密封的容器優選為血清瓶。
所述的惰性氣體優選為氮氣。
所述的充惰性氣體的具體操作優選為:充0.01MPa氮氣3次。
所述的滅菌的條件優選為:115℃滅菌20min。
所述的利用β-葡萄糖苷酶提高菇渣產氫和產糖的方法在微生物發酵領域中的應用。
所述的微生物發酵領域中的應用是指嗜熱厭氧梭菌轉化菇渣、甘蔗渣中的應用。
本發明相對于現有技術具有如下的優點及效果:
(1)本發明發酵使用的原料為農業生產后的廢棄物——菇渣,具有較高的總纖維素(纖維素及半纖維素)含量,不需要經過復雜的酸堿預處理即可直接被微生物水解和利用,進行氫氣或生物糖化的發酵,顯著降低了生產成本,解決廢棄菇渣所造成的環境污染問題,實現菇渣變廢為寶,具有可行性,具有極其廣闊的應用推廣前景。
(2)本發明通過嗜熱厭氧梭菌的集成生物工藝進行生物制氫或糖化省去了酶解糖化過程酶的生產成本,可以有效降低投資費用和生產成本。
(3)本發明通過添加β-葡萄糖苷酶可以顯著提高氫氣的產量;共同添加β-葡萄糖苷酶和表面活性劑可以顯著提高還原糖的積累量和底物的利用率以及生產效率,降低生產成本,是一種高效環境友好型的產氫和生物糖化耦合工藝。
附圖說明
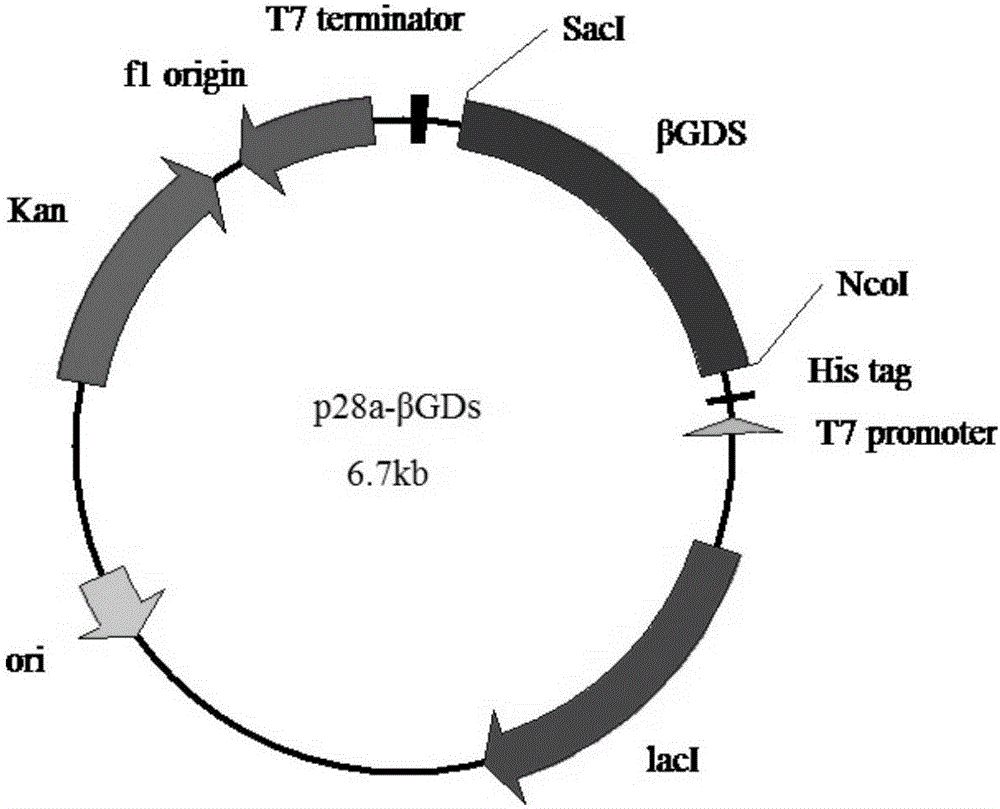
圖1為β-葡萄糖苷酶的表達載體圖譜。
圖2為β-葡萄糖苷酶誘導表達后的SDS-PAGE檢測,其中,泳道1為蛋白Marker;泳道2為誘導前BL21總蛋白;泳道3為誘導后BL21總蛋白。
圖3為是否添加β-葡萄糖苷酶對嗜熱厭氧梭菌產氫的差異,其中,CK:不添加β-葡萄糖苷酶產氫;A:0h添加β-葡萄糖苷酶產氫;B:0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶產氫;C:82h添加β-葡萄糖苷酶產氫。
圖4為是否添加β-葡萄糖苷酶和表面活性劑對嗜熱厭氧梭菌產糖的差異,其中,CK:82h只添加β-葡萄糖苷酶產糖;CK-T:82h添加表面活性劑產糖;A:0h添加β-葡萄糖苷酶同時82h添加表面活性劑產糖;B:0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶和表面活性劑產糖;C:82h添加β-葡萄糖苷酶同時82h添加表面活性劑產糖。
具體實施方式
下面結合實施例對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
實施例1利用β-葡萄糖苷酶提高菇渣產氫和產糖的方法
1、β-葡萄糖苷酶的克隆方法:
(1)嗜熱厭氧梭菌菌體的獲得:將-80℃保存的嗜熱厭氧梭菌(ATCC 27405)經10mL西林瓶于55~60℃搖床(150rpm)活化48~72h,接著在100ml的血清瓶于55~60℃搖床(150rpm)放大培養48~72h(OD600=1.1~1.3)后8000rpm離心10min收集菌體。其中,活化和放大的培養基采用種子培養基,種子培養基主要成份為A1、B、C、D和E液(pH值約為7.0),5種成分按40:2:1:1:1(v/v)用無菌注射器混合,溶劑為去離子水,A1液以3g/L的纖維素作為碳源;B液:檸檬酸三鉀鹽50g/L、一水檸檬酸31.25g/L、硫酸鈉25g/L、磷酸二氫鉀25g/L、碳酸氫鈉62.5g/L;C液:氯化銨75g/L、尿素250g/L、酵母抽提物50g/L;D液:六水氯化鎂50g/L、四水氯化亞鐵5g/L、二水氯化鈣10g/L、L-半胱氨酸鹽酸鹽一水物50g/L;E液:二鹽酸吡哆胺1g/L、對氨基苯甲酸0.2g/L、D-生物素0.1g/L、維生素B12 0.1g/L、維生素B1 0.2g/L。
(2)嗜熱厭氧梭菌基因組的提取:利用收集到的菌體提取嗜熱厭氧梭菌的基因組,參考OMEGA公司的細菌基因組提取試劑盒(貨號:D3350-01)提取嗜熱厭氧梭菌的基因組,提取方法和步驟參考公司提供的說明書進行操作。
(3)嗜熱厭氧梭菌β-葡萄糖苷酶的PCR擴增與鑒定:根據NCBI已經報道的嗜熱厭氧梭菌β-葡萄糖苷酶序列(>gi|40664:361-1707)設計PCR引物(引物1和引物2),以上述提取的DNA模板在PCR儀(BIOER公司)進行PCR擴增,反應所用的引物、組分和擴增條件如下:
引物1:5`-CAGTCCATGGCAAAGATAAC-3`
引物2:5`-CGAGCTCGAAACCGTTGTTTTTGATTAC-3`
PCR擴增體系(25μL)組成如下:
擴增條件:94℃變性5min,再用94℃1min、52.8℃1min、72℃2min進行30個循環,最后72℃10min。再用瓊脂糖凝膠電泳檢測,結果顯示擴增得到大小約1350bp的片段,用多功能DNA純化回收試劑盒(離心柱型)(OMEGA)回收,把回收片段亞克隆到pMD-18T(TaKaRa公司產品)中,連接產物轉化到用CaCl2法處理的大腸桿菌DH5α,在含氨芐青霉素(終濃度為100μg/ml)的LB固體平板上過夜培養,挑取平板上生長的菌落,通過菌落PCR驗證陽性克隆。將驗證陽性的克隆子接入LB液體培養基(含100μg/ml氨芐青霉素)中過夜培養,用高純質粒小量制備試劑盒(離心柱型)(OMEGA)提取質粒,經NcoⅠ和SacⅠ酶切再進一步進行驗證,測序(上海生工生物工程有限公司)。測序結果顯示所擴增得到的片段大小為1347bp,通過其編碼的氨基酸序列在Genebank數據庫中用Blast程序進行同源檢索,檢索結果表明與該片段為嗜熱厭氧梭菌的β-葡萄糖苷酶。
2、β-葡萄糖苷酶的誘導表達方法:
(1)β-葡萄糖苷酶表達菌株的構建:由于β-葡萄糖苷酶基因克隆時已經在其兩端添加上了NcoⅠ和SacⅠ酶切位點,因此用限制性內切酶NcoⅠ和SacⅠ酶切連接上β-葡萄糖苷酶基因的pMD-18T(TaKaRa公司)載體,回收1350bp左右的片段即可,同時用限制性內切酶NcoⅠ和SacⅠ酶切pET-30a(Invitrogen)載體,回收載體片段,將回收的兩個片段用T4連接酶在16℃連接4h,連接產物轉化大腸桿菌DH5α,通過質粒提取和PCR篩選陽性克隆,并進行測序鑒定,篩選鑒定出重組質粒,命名為p28a-βGDs(如圖1所示)。提取重組質粒p30a-βGDs,轉化到用CaCl2法處理的大腸桿菌BL21,在含卡那霉素(50μg/ml)的LB固體平板上過夜培養,挑取平板上生長的菌落,通過菌落PCR驗證陽性克隆。
(2)β-葡萄糖苷酶的誘導表達:將上述驗證正確的陽性克隆子接種于5ml含卡那霉素(50μg/ml)的LB培養基中,37℃、150rpm振蕩培養過夜后按1%(v/v)的接種量轉接至400ml的LB培養基中,37℃、220rpm震蕩培養至菌體OD值達到0.6,添加IPTG(IPTG的終濃度為1mM)進行誘導,繼續培養3h后離心收集菌體,用超聲波(300W,打4s停5s破碎40min)進行破碎后,10000rpm離心收集上清作為酶液。將未誘導的菌體上清和誘導后菌體的上清進行SDS-PAGE驗證,結果如圖2所示,說明β-葡萄糖苷酶誘導表達成功。
3、β-葡萄糖苷酶的酶活測定:
(1)對硝基苯酚標準曲線的繪制:將購買的對硝基苯酚(阿拉丁)配制成不同濃度(0-200μM)后用酶標儀(Thermo Fisher)測定OD405的吸光值,做出對硝基苯酚濃度和OD之間的標準曲線。
(2)酶解底物對硝基苯基-β-D-吡喃半乳糖苷體系的配置:將購買的對硝基苯基β-D-吡喃半乳糖苷(阿拉丁)用pH 6.0、0.1M的磷酸緩沖液配制成50mM的母液,使用時用pH6.0、0.1M的磷酸緩沖液稀釋成5mM的工作濃度。
(3)酶活性的測定:取5-10μL稀釋后的酶液(上述β-葡萄糖苷酶的誘導表達獲得的酶液),用5mM的對硝基苯基β-D-吡喃半乳糖苷體系補足至100μl,于50℃反應15min,加200μL濃度為1M的碳酸鈉終止液,利用酶標儀測定OD405的吸光值,將經沸水滅活的相同稀釋度的酶液按上述方法處理做空白對照,根據釋放出對硝基苯酚的量計算酶的活性(每分鐘分解對硝基苯基-β-D-吡喃半乳糖苷產生1μmol對硝基苯酚定義為1個酶活單位U),得到的酶活是為17.21U/ml。
4、利用β-葡萄糖苷酶提高菇渣發酵產氫的方法:
(1)嗜熱厭氧梭菌種子液的制備:將-80℃保存的嗜熱厭氧梭菌((ATCC27405)經10mL西林瓶于55~60℃搖床(150rpm)活化48~72h,接著在100ml的血清瓶于55~60℃搖床(150rpm)放大培養48~72h,OD600為1.1~1.3,得到種子液,其中,活化和放大的培養基采用種子培養基,種子培養基的主要成份為A、B、C、D和E液,5種成分按40:2:1:1:1(v/v)用無菌注射器混合,溶劑為去離子水。A液以3g/L的纖維素作為碳源;B液:檸檬酸三鉀鹽50g/L、一水檸檬酸31.25g/L、硫酸鈉25g/L、磷酸二氫鉀25g/L、碳酸氫鈉62.5g/L;C液:氯化銨75g/L、尿素250g/L、酵母抽提物50g/L;D液:六水氯化鎂50g/L、四水氯化亞鐵5g/L、二水氯化鈣10g/L、L-半胱氨酸鹽酸鹽一水物50g/L;E液:二鹽酸吡哆胺1g/L、對氨基苯甲酸0.2g/L、D-生物素0.1g/L、維生素B12 0.1g/L、維生素B1 0.2g/L。
(2)發酵培養基的制備及滅菌:發酵培養基中添加60g/L的菇渣為碳源替代種子培養基中A液中的3g/L纖維素,其他成分和用量同種子培養基,得到發酵培養基,其中,菇渣的制備方法為:將菇類生產后的廢棄物用清水洗滌至中性后烘干至恒重,粉碎過200目篩。將43.25毫升的發酵培養基裝入100ml血清瓶中,用膠塞和鋁蓋密封并重復抽真空和充0.01MPa的氮氣3次,最后在115℃下滅菌20min;
(3)β-葡萄糖苷酶添加促進菇渣發酵產氫:將步驟(1)制備好的種子液按終體積10%(v/v)的接種量(即5ml)注射入上述發酵培養基中,同時添加30U的無菌β-葡萄糖苷酶(體積為1.75mL)進行嗜熱厭氧發酵,發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定氫氣的產量為51.72mM;測得葡萄糖產量為0.15g/L,木糖產量為0.11g/L,纖維二塘的產量為0.03g/L(測定方法參考:Cheng J,Zhu M.A novel anaerobic co-culture system for bio-hydrogen production from sugarcane bagasse[J].Bioresource technology,2013,144:623-631)。
效果實施例1β-葡萄糖苷酶添加時間對菇渣發酵產氫的影響
(1)嗜熱厭氧梭菌種子液的制備同實施例1。
(2)發酵培養基的制備及滅菌同實施例1。
(3)添加β-葡萄糖苷酶促進菇渣的微生物產氫發酵:將制備好的種子液按終體積10%(v/v)的接種量(即5ml)注射入上述的45ml、43.25ml、41.5ml發酵培養基中,以不添加酶為空白對照,設置3個對比試驗,終體積為50ml,其中:
①不添加β-葡萄糖苷酶產氫:將制備好的種子液按10%(v/v)的接種量注射入上述45ml發酵培養基中,發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定氫氣的產量為40.07mM;
②0h添加β-葡萄糖苷酶產氫:同實施例1;
③0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶產氫:在發酵初始階段添加30U的無菌β-葡萄糖苷酶并在82h繼續補加30U的無菌β-葡萄糖苷酶,發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定氫氣的產量為55.96mM;
④82h添加β-葡萄糖苷酶產氫:在接種開始發酵后的82h添加30U的無菌β-葡萄糖苷酶發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定氫氣的產量為54.65mM。
結果如圖3所示,可以看出0h添加β-葡萄糖苷酶氫氣的產量(51.72mM),相對于不添加酶的氫氣產量(40.07mM)相比提高了29%;0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶的氫氣產量(55.96mM),與不添加酶的氫氣產量相比提高了40%;只在82h添加β-葡萄糖苷酶的氫氣產量(54.65mM),與不添加酶的氫氣產量相比提高了36%。結果可以說明:0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖苷酶最有利于提高氫氣的產量;0h添加β-葡萄糖苷酶的氫氣產量低于82h添加β-葡萄糖苷酶的氫氣產量,說明添加β-葡萄糖苷酶的時間晚于接種的時間更有利于提高氫氣的產量;三組實驗與對照相比,氫氣的產量均有明顯的提高,說明添加β-葡萄糖苷酶可以顯著提高熱纖梭菌的氫氣產量。
效果實施例2利用β-葡萄糖苷酶和表面活性劑提高菇渣生物糖化效率的方法
(1)嗜熱厭氧梭菌種子液的制備同實施例1。
(2)發酵培養基的制備及滅菌同實施例1。
(3)表面活性劑溶液的配制及滅菌:配制125g/L的Triton X-100水溶液;將裝有表面活性劑(Triton X-100)的血清瓶用膠塞和鋁蓋密封并重復抽真空和充0.01MPa的氮氣3次,最后在115℃下滅菌20min。
(4)利用β-葡萄糖苷酶和表面活性劑進行微生物還原糖生產的方法:將制備好的種子液按終體積10%(v/v)的接種量(即5mL)注射入上述發酵培養基(每個血清瓶含44ml或43.25ml或42.25ml或40.5ml的發酵培養基)中,以只在82h添加β-葡萄糖苷酶為空白對照,設置4個對比試驗,終體積為50ml,其中:
①只在82h添加β-葡萄糖苷酶進行產糖:將制備好的種子液按10%(v/v)的接種量注射入上述43.25ml發酵培養基中,發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,用HPLC的方法測定發酵液中葡萄糖含量為0.11g/L,木糖為0.05g/L,纖維二糖為0.04g/L;
②82h添加表面活性劑產糖:將制備好的種子液按10%(v/v)的接種量注射入上述44ml發酵培養基中,發酵溫度為55℃,搖床轉速為150rpm,發酵82h時添加1ml的表面活性劑溶液(Triton X-100,125g/L),繼續發酵至168h后終止發酵,測定發酵液中葡萄糖含量為2.58g/L,木糖為1.15g/L,纖維二糖為0.22g/L;
③0h添加β-葡萄糖苷酶并在82h添加表面活性劑產糖:將上述制備好的種子液按10%(v/v)的接種量注射入上述42.25ml的發酵培養基中,在發酵初始階段添加30U的無菌β-葡萄糖苷酶,并在82h添加1ml的表面活性劑溶液(Triton X-100,125g/L),發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定發酵液中葡萄糖含量為2.81g/L,木糖為1.23g/L,纖維二糖為0.25g/L;
④0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶和表面活性劑產糖:
在發酵初始階段添加30U的無菌β-葡萄糖苷酶并在82h補加30U的無菌β-葡萄糖苷酶,同時添加1ml的表面活性劑溶液(Triton X-100,125g/L),發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定發酵液中葡萄糖含量為3.38g/L,木糖為1.46g/L,纖維二糖為0.20g/L;
⑤82h添加β-葡萄糖糖苷酶和表面活性劑產糖:在發酵開始后的82h添加30U的無菌β-葡萄糖苷酶并添加1ml的表面活性劑溶液(Triton X-100,125g/L),發酵溫度為55℃,搖床轉速為150rpm,發酵168h后終止發酵,測定發酵液中葡萄糖含量為3.42g/L,木糖為1.41g/L,纖維二糖為0.22g/L。
結果如圖4所示,0h添加β-葡萄糖苷酶并在82h添加表面活性劑的還原糖總量與82h添加表面活性劑相比提高了9%;0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶和表面活性劑的還原糖總量與82h添加表面活性劑相比提高了提高了28%,82h添加β-葡萄糖苷酶并在82h添加表面活性劑的還原糖總量與82h添加表面活性劑相比提高了28%,與0h添加β-葡萄糖苷酶并在82h補加β-葡萄糖糖苷酶和表面活性劑的還原糖總量相當。說明了β-葡萄糖苷酶與表面活性劑共同添加對還原糖產量的提高具有明顯的促進作用,并且β-葡萄糖苷酶與表面活性劑同時添加對還原糖的積累效果較好,可以顯著提高還原糖的積累量。
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其他的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!