含連續季碳中心環丙烷氨基磷酸酯類化合物的合成方法與流程
本發明屬于醫藥化工合成技術領域,具體涉及一種含連續季碳中心環丙烷氨基磷酸酯類化合物的合成方法。
背景技術:
氨基酸是生物功能大分子蛋白質的基本組成單元,是構成動物營養所需蛋白質的基本物質,也是很多藥物、生物活性分子及天然產物的重要結構單元。作為氨基酸的含磷類似物,氨基磷酸酯在抗菌、抗植物病毒、調節植物生長活性等方面引起科學家的廣泛關注(F Tanaka,K Kinoshita,A Ryuji Tanimura,I Fujii,J.Am.Chem.Soc.1996,118,2332-2339)。由于剛性的環丙烷結構砌塊能有效地改善分子的物理、化學性質及生物活性,環丙烷氨基磷酸酯結構也存在于藥物及功能活性分子,如NS3-蛋白酶抑制劑。一般多采用環丙烷類化合物直接構建同時含N、P的化合物,對底物的選擇具有較大的局限性。僅有幾篇文獻同時構建含N、P的三元環結構與連續季碳中心,并在構建此結構時大多使用了價格昂貴的過渡金屬催化或是構建步驟復雜(Andrey V.Chemagin,Nikolai V.Yashin,Yuri K.Grishin,Synthesis.2010,19,259-266;Manfred Regitz,Wolfgang Welter,Alfons Hartmann,Chemische Berichte.1979,112,2509-27;Heydt,Heinrich,Liebigs Annalen der Chemie,1980,4,590-599;Fei Du,Liyang Yin,Yanqiang Ning,Yungui Peng,Advanced Synthesis&Catalysis,2016,358,2280-2285)。
N-對甲苯磺酰基酮腙具有種類豐富、價格便宜、無毒、易儲存等特點,包括作為砜基源可以進一步合成相關藥物分子,如anti-HIV-1,SR 33805oxalate。用其構建結構復雜且功能多樣性的分子已引起了大家的極大興趣,(J.R.Fulton,V.K.Aggarwal,J.de Vicente,Eur.J.Org.Chem.2005,1479–1492;J.Barluenga,C.Angew.Chem.Int.Ed.2011,50,7486–7500;Angew.Chem.2011,123,7626–7640;Z.Shao,H.Zhang,Chem.Soc.Rev.2012,41,560–572;H.Jiang,W.Fu,H.Chen,Chem.Eur.J.2012,18,11884–11888;Q.Xiao,Y.Zhang,J.Wang,Acc.Chem.Res.2013,46,236–247;Y.Xia,Y.Zhang,J.Wang,ACS Catal.2013,3,2586–2598)。但是目前還沒有利用N-對甲苯磺酰基酮腙為原料直接合成含連續季碳中心環丙烷氨基磷酸酯衍生物的報道。
技術實現要素:
為了解決以上現有技術的缺點和不足之處,本發明的首要目的在于提供一種含連續季碳中心環丙烷氨基磷酸酯類化合物的合成方法。
本發明的再一目的在于提供一種通過上述方法合成得到的含連續季碳中心環丙烷氨基磷酸酯類化合物。
本發明目的通過以下技術方案實現:
一種含連續季碳中心環丙烷氨基磷酸酯類化合物的合成方法,包括如下步驟:
在反應器中,加入N-對甲苯磺酰腙類化合物、相轉移催化劑、堿和有機溶劑,先在惰性氣氛保護下室溫攪拌一段時間后再加入氨基烯磷酸酯類化合物并升溫至60~100℃攪拌反應10~24小時,反應結束后冷卻至室溫,產物經分離純化,得到所述含連續季碳中心環丙烷氨基磷酸酯類化合物;
所述的N-對甲苯磺酰腙類化合物為其中,Ts表示對甲苯磺酰基,R1包括苯基、對氟苯基、對氯苯基、對溴苯基、對甲基苯基、對甲氧基苯基,吡啶基、呋喃基、噻吩基、萘環等;R2包括氫、甲基、乙基、丙基、異丙基、叔丁基、苯并五元環、苯并六元環、苯并七元環等。
所述N-對甲苯磺酰腙類化合物與乙酰氨基烯磷酸酯的摩爾比優選為(0.5~4):1。
所述相轉移催化劑優選為四丁基溴化銨、四丁基氯化銨、四丁基碘化銨、四丁基氟化銨、四丁基硫氫酸銨、芐基三乙基氯化銨、芐基三甲基氯化銨和四丁基溴化膦中的一種或兩種以上。
所述堿優選為叔丁醇鉀、叔丁醇鋰、碳酸鉀、甲醇鈉、乙醇鈉和碳酸銫中的一種或兩種以上;堿的加入量與乙酰氨基烯磷酸酯的摩爾比為(0.5~4):1。
所述的有機溶劑優選為二甲基亞砜、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、甲苯、甲醇、乙腈或1,4-二氧六環。
優選地,所述的惰性氣氛是指氮氣、氬氣或氦氣氣氛。
優選地,所述氨基烯磷酸酯類化合物的結構式為式中,R3和R4為相同或者不相同的-H、-Me(甲基)、-Ac(乙酰基)、-Boc(叔丁氧羰基)、-Piv(叔丁酯基)等;R5可以是-Me、-Et、-Bu等。(其制備方法可參照文獻Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276)。
優選地,所述的分離純化步驟包括萃取、干燥、過濾、減壓蒸除溶劑及柱層析分離純化步驟。
所述的萃取優選加水后用乙酸乙酯進行萃取,取有機相;所述的干燥優選用無水硫酸鎂進行干燥;所述的柱層析分離純化優選以體積比為(0~10):1的石油醚:乙酸乙酯的混合溶劑或正已烷為洗脫液的柱層析提純。
一種含連續季碳中心環丙烷氨基磷酸酯類化合物,通過上述方法合成得到。
本發明的原理是以N-對甲苯磺酰腙類化合物和乙酰氨基烯磷酸酯為原料,在堿的促進作用下,發生分子間的環化反應生成含連續季碳中心環丙烷氨基磷酸酯類化合物。
本發明合成方法所涉及的反應方程式如下式所示:
本發明的合成方法具有如下優點及有益效果:
(1)本發明的合成方法原料易得、價格低廉、原子經濟性高、操作安全簡單、無過渡金屬參與、環境友好;
(2)本發明的合成方法對官能團適應性好、對底物適應性廣,具有良好的工業應用前景。
附圖說明
圖1~3分別是實施例11所得產物1的氫譜圖、碳譜圖和磷譜圖;
圖4~6分別是實施例11所得產物2的氫譜圖、碳譜圖和磷譜圖;
圖7~9分別是實施例12所得產物1的氫譜圖、碳譜圖和磷譜圖;
圖10~12分別是實施例12所得產物2的氫譜圖、碳譜圖和磷譜圖;
圖13~15分別是實施例13所得產物1的氫譜圖、碳譜圖和磷譜圖;
圖16~18分別是實施例13所得產物2的氫譜圖、碳譜圖和磷譜圖。
具體實施方式
下面結合實施例及附圖對本發明作進一步詳細的描述,但本發明的實施方式不限于此。
實施例1
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾叔丁醇鉀,0.02毫摩爾芐基三乙基氯化銨(Benzyltriethylammonium chloride,TEBAC)和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率62%。
實施例2
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸鈉,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率72%。
實施例3
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率85%。
實施例4
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲醇,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率51%。
實施例5
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升1,4-二氧六環,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率71%。
實施例6
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升DMF,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率77%。
實施例7
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TBAI和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在90攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率78%。
實施例8
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在60攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率67%。
實施例9
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在80攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率68%。
實施例10
在反應管中加入0.2毫摩爾苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在100攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率73%。
實施例11
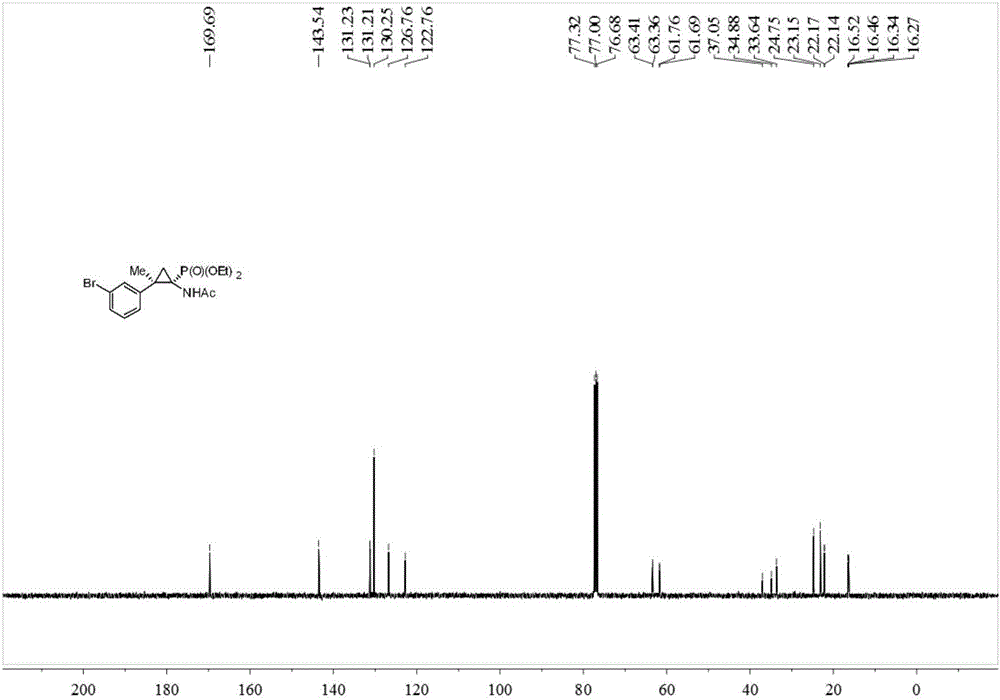
在反應管中加入0.2毫摩爾間溴苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在100攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率78%。所得目標產物為兩種非對應異構體產物1和產物2。所得產物1的氫譜圖、碳譜圖和磷譜圖分別如圖1、圖2和圖3所示;所得產物2的氫譜圖、碳譜圖和磷譜圖分別如圖4、圖5和圖6所示。
所得產物1的結構表征數據如下所示:
1H NMR(400MHz,CDCl3)δ7.41–7.33(m,2H),7.23–7.11(m,2H),5.06(s,1H),4.24–4.09(m,4H),1.92(ddd,J=19.8,12.9,6.5Hz,2H),1.70(s,3H),1.60(s,3H),1.37(t,J=7.1Hz,3H),1.28(t,J=7.1Hz,3H).
13C NMR(100MHz,CDCl3)δ169.7,143.5,131.2,131.2,130.3,126.8,122.8,77.3,77.0,76.7,63.4,63.4,61.8,61.7,37.1,34.9,33.6,24.8,23.2,22.2,22.1,16.5,16.5,16.3,16.3.
31P NMR(162MHz,CDCl3)δ23.2.
IR(KBr):3264,2982,2926,1763,1675,1538,1370,1235,1026,963,754cm-1.
HRMS-ESI(m/z):Calcd for C16H23BrNO4P,[M+Na]+:426.0440;found,426.0442.
根據以上數據推斷所得產物1的結構如下所示:
所得產物2的結構表征數據如下所示:
1H NMR(400MHz,CDCl3)δ7.59(d,J=6.6Hz,2H),7.36(dd,J=27.0,8.2Hz,3H),7.15(t,J=7.8Hz,1H),3.72(d,J=85.5Hz,4H),2.10(dd,J=14.4,6.6Hz,2H),2.04(s,3H),1.44(s,3H),1.11(t,J=6.4Hz,3H),1.05(d,J=5.9Hz,3H).
13C NMR(100MHz,CDCl3)δ171.2,144.4,144.4,132.3,129.6,129.4,128.0,121.6,77.3,77.0,76.7,62.3,62.1,62.0,38.5,36.4,33.7,24.0,23.6,23.1,16.1,16.0,16.0,15.9.
31P NMR(162MHz,CDCl3)δ20.9.
IR(KBr):3264,2982,2926,1763,1675,1538,1370,1235,1026,963,754cm-1.
HRMS-ESI(m/z):Calcd for C16H23BrNO4P,[M+Na]+:426.0440;found,426.0446.
根據以上數據推斷所得產物2的結構如下所示:
實施例12
在反應管中加入0.2毫摩爾對碘苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在100攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率74%。所得目標產物為兩種非對應異構體產物1和產物2。所得產物1的氫譜圖、碳譜圖和磷譜圖分別如圖7、圖8和圖9所示;所得產物2的氫譜圖、碳譜圖和磷譜圖分別如圖10、圖11和圖12所示。
所得產物1的結構表征數據如下所示:
1H NMR(400MHz,CDCl3)δ7.66(d,J=8.4Hz,2H),6.96(d,J=8.4Hz,2H),4.97(s,1H),4.16(ddd,J=17.6,12.1,4.9Hz,4H),1.95–1.86(m,2H),1.70(s,3H),1.61(s,3H),1.37(t,J=7.0Hz,3H),1.29(t,J=7.0Hz,3H).
13C NMR(100MHz,CDCl3)δ169.7,141.0,137.9,130.1,92.5,77.4,77.3,76.7,63.5,63.4,61.7,61.7,37.0,34.9,33.6,24.7,23.3,22.2,22.2,16.6,16.5,16.4,16.3.
31P NMR(162MHz,CDCl3)δ23.4.
IR(KBr):3268,2980,2924,1676,1538,1379,1236,1026,960,756cm-1.
HRMS-ESI(m/z):Calcd for C16H23INO4P,[M+Na]+:474.0302;found,474.0306.
根據以上數據推斷所得產物1的結構如下所示:
所得產物2的結構表征數據如下所示:
1H NMR(400MHz,CDCl3)δ7.59(d,J=8.3Hz,2H),7.19(d,J=7.9Hz,2H),4.07–3.62(m,4H),3.53(s,1H),2.38(s,1H),2.06(d,J=5.9Hz,1H),2.02(s,3H),1.41(s,3H),1.10(t,J=6.6Hz,3H),1.00(t,J=6.3Hz,3H).
13C NMR(100MHz,CDCl3)δ170.9,141.9,141.8,136.9,131.4,91.9,77.3,77.0,76.7,62.4,62.3,62.0,61.9,38.5,36.3,33.6,24.0,23.5,23.3,16.1,16.1,16.0,15.9.
31P NMR(162MHz,CDCl3)δ20.8.
IR(KBr):3254,2923,2855,1679,1537,1377,1276,1028,963,756cm-1.
HRMS-ESI(m/z):Calcd for C16H23INO4P,[M+Na]+:474.0302;found,474.0305.
根據以上數據推斷所得產物2的結構如下所示:
實施例13
在反應管中加入0.2毫摩爾對氯苯乙酮對甲苯磺酰腙、0.2毫摩爾碳酸銫,0.02毫摩爾TEBAC和2毫升甲苯,在惰性氣氛保護下室溫轉速600rpm攪拌反應2小時,停止攪拌。加入0.1毫摩爾乙酰氨基烯磷酸酯(Nicolas Lefevre,Jean-Louis Brayer,Benoit Folleas,Sylvain Darses,Organic Letters,2013,15,4274–4276),在100攝氏度下轉速600rpm下攪拌反應12小時后,停止加熱及攪拌,冷卻至室溫。加入4mL水,用乙酸乙酯萃取3次,合并有機相并使用0.5g無水硫酸鎂干燥,過濾,減壓蒸去溶劑,再通過柱層析分離純化,得到目標產物,所用的柱層析洗脫液為體積比為10:1的石油醚:乙酸乙酯混合溶劑,產率78%。所得目標產物為兩種非對應異構體產物1和產物2。所得產物1的氫譜圖、碳譜圖和磷譜圖分別如圖13、圖14和圖15所示;所得產物2的氫譜圖、碳譜圖和磷譜圖分別如圖16、圖17和圖18所示。
所得產物1的結構表征數據如下所示:
1H NMR(400MHz,CDCl3)δ7.31(d,J=6.8Hz,2H),7.17(d,J=6.8Hz,2H),5.09(s,1H),4.18(ddd,J=16.7,11.6,4.7Hz,4H),1.98–1.88(m,2H),1.72(s,3H),1.62(s,3H),1.38(t,J=6.9Hz,3H),1.31(t,J=6.9Hz,3H).
13C NMR(100MHz,CDCl3)δ169.7,139.7,132.8,129.4,128.8,77.3,77.0,76.7,63.3,61.6,37.0,34.9,33.4,24.8,23.1,22.2,16.5,16.4,16.3,16.2.
31P NMR(162MHz,CDCl3)δ23.4.
IR(KBr):3267,2984,2928,1681,1541,1376,1236,1024,963,750cm-1.
HRMS-ESI(m/z):Calcd for C16H23ClNO4P,[M+Na]+:382.0946;found,382.0949.
根據以上數據推斷所得產物1的結構如下所示:
所得產物2的結構表征數據如下所示:
1H NMR(400MHz,CDCl3)δ7.36(d,J=8.0Hz,2H),7.22(d,J=8.5Hz,2H),3.80(dd,J=20.3,13.4Hz,4H),3.51(s,1H),2.12–2.02(m,2H),2.01(s,3H),1.40(s,3H),1.09(t,J=6.0Hz,3H),0.98(s,3H).
13C NMR(100MHz,CDCl3)δ171.1,140.6,140.6,132.3,130.6,127.9,77.3,77.0,76.7,62.4,62.0,38.5,36.3,33.4,24.1,23.6,23.2,16.1,16.0,16.0,15.9.
31P NMR(162MHz,CDCl3)δ20.9.
IR(KBr):3259,2983,2928,1682,1541,1375,1223,1026,964,753cm-1.
HRMS-ESI(m/z):Calcd for C16H23ClNO4P,[M+Na]+:382.0945;found,382.0949.
根據以上數據推斷所得產物2的結構如下所示:
上述實施例為本發明較佳的實施方式,但本發明的實施方式并不受上述實施例的限制,其它的任何未背離本發明的精神實質與原理下所作的改變、修飾、替代、組合、簡化,均應為等效的置換方式,都包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!