修飾肽的展示的制作方法
本申請(qǐng)是申請(qǐng)?zhí)枮?011800454742、申請(qǐng)日為2011年07月29日、名稱為“修飾肽的展示”的發(fā)明專利申請(qǐng)的分案申請(qǐng)。
本發(fā)明涉及一種展示翻譯后修飾肽的展示系統(tǒng)。
背景技術(shù):
在許多情況下,人們利用大型化合物庫(kù)來(lái)篩選和鑒定具有所需活性或特性的化合物,從而尋找新的化合物。組合肽庫(kù)技術(shù)是發(fā)現(xiàn)和研制藥物的寶貴資源。人們已經(jīng)證明,在這種篩選中,采用在噬菌體或其它病毒顆粒上展示重組肽庫(kù)尤其有用。為了探索人類許多疾病新的治療方法,許多研究團(tuán)體正在努力從肽庫(kù)開(kāi)發(fā)具有生物活性的肽。
噬菌體展示肽庫(kù)技術(shù)已經(jīng)在探索許多人類疾病新的治療方法中得到了廣泛的應(yīng)用。在絲狀噬菌體上展示的肽庫(kù)已經(jīng)作為一種篩選資源,用于鑒定與任何給定靶結(jié)合,從而顯示有藥理效用的肽。隨后,可以采用傳統(tǒng)合成化學(xué)方法大量合成出如此鑒定出來(lái)的肽。
噬菌體m13是絲狀噬菌體科的一種帶單鏈(ss)dna基因組的無(wú)包膜絲狀大腸桿菌噬菌體。核衣殼由具有不同拷貝數(shù)的四種噬菌體蛋白組成:pviii的拷貝數(shù)是大約2700,而piii、pvi和pix的拷貝數(shù)是5。除t4、t7、fd和λ(lambda)等之外,m13噬菌體也已經(jīng)成功用于噬菌體展示,在生物技術(shù)篩選方法中得到應(yīng)用。在這種篩選方法中,將隨機(jī)肽庫(kù)在噬菌體m13的核衣殼表面上展示,以研究不同噬菌體與結(jié)合配體(蛋白質(zhì)-蛋白質(zhì)、蛋白質(zhì)-dna等)的相互作用。通常,合成寡核苷酸被克隆到核衣殼蛋白的編碼基因內(nèi),從而,將人們感興趣的肽(或不同肽的庫(kù))在噬菌體m13核衣殼的表面上展示,用于后續(xù)的結(jié)合研究。
噬菌體展示方法通常涉及到將隨機(jī)寡核苷酸插入到噬菌體基因組內(nèi),這樣,它們可以引導(dǎo)細(xì)菌宿主表達(dá)與噬菌體外殼蛋白融合的肽庫(kù)(如絲狀噬菌體piii、pvi或pviii)。這種方法的優(yōu)點(diǎn)是可以在較小的噬菌體中,處理包含高達(dá)1015個(gè)不同個(gè)體的庫(kù),以及展示肽與編碼其的遺傳信息的物理連鎖也是這種技術(shù)的一個(gè)優(yōu)點(diǎn)。
基礎(chǔ)噬菌體展示技術(shù)已經(jīng)擴(kuò)展到包括從可復(fù)制基因包(如真核病毒、細(xì)菌及酵母細(xì)胞)展示而不是噬菌體展示的肽庫(kù)。可復(fù)制基因包展示技術(shù)的原理和戰(zhàn)略與噬菌體非常相似,也就是說(shuō),將核酸編碼的展示肽插入到可復(fù)制基因包的基因組內(nèi),在待篩選肽和暴露在細(xì)胞或病毒表面的內(nèi)源性蛋白之間產(chǎn)生融合蛋白。融合蛋白的表達(dá)及轉(zhuǎn)運(yùn)到細(xì)胞表面,使得肽在細(xì)胞或病毒表面得到展示。
某些團(tuán)體試圖通過(guò)肽的二級(jí)結(jié)構(gòu)增加庫(kù)的多樣性,通過(guò)化學(xué)反應(yīng)得到了構(gòu)象限制的肽。
ep1187914b1公開(kāi)了一種結(jié)構(gòu)限制的肽庫(kù),包括利用半胱氨酸殘基之間的二硫鍵穩(wěn)定的多個(gè)環(huán)肽。
wo2009/098450a2公開(kāi)了一種噬菌體顆粒,展示了經(jīng)連接化合物連接的二硫化物穩(wěn)定的雙環(huán)肽。
us2009/0137424a1公開(kāi)了展示多肽的噬菌體的翻譯后修飾,所述多肽包含非天然氨基酸,為疊氮-炔烴[3+2]環(huán)加成反應(yīng)和施陶丁格(staudinger)修飾提供靶。
ep2048155a1描述了縮酚酸肽天然化合物的生物合成。采用類atp-grasp酶對(duì)5-50個(gè)氨基酸之間的前體肽序列進(jìn)行修飾。例如,在大腸桿菌中引入核酸分子,得到縮酚酸肽天然化合物,如microviridin。
oman等人(naturechemicalbiology6:9-18(2010))對(duì)幾種核糖體肽的天然產(chǎn)品合成進(jìn)行了綜述。前體肽由前導(dǎo)肽進(jìn)行翻譯后加工得到的。這些前導(dǎo)肽幫助折疊前體肽,穩(wěn)定前體肽防止其降解,并在宿主內(nèi)部生物合成期間,保持前體在分泌和蛋白質(zhì)水解的合適時(shí)間之前沒(méi)有活性。
人們迫切需要利用肽庫(kù)技術(shù)開(kāi)發(fā)新的靶向肽。因此,本發(fā)明的目的是提供改進(jìn)的篩選用結(jié)構(gòu)限制的肽庫(kù)。
技術(shù)實(shí)現(xiàn)要素:
通過(guò)提供具有權(quán)利要求所述特點(diǎn)的實(shí)施例,得到解決這種技術(shù)問(wèn)題的方案。于是,本發(fā)明通過(guò)翻譯后修飾(ptm)酶的酶促加工,很容易建立大型的多環(huán)肽庫(kù)。
本發(fā)明提供了一種展示肽的可復(fù)制基因包,所述肽在氨基酸側(cè)鏈的兩個(gè)雜原子之間具有至少一個(gè)分子內(nèi)環(huán)鍵,包括分子內(nèi)異肽鍵、酯鍵或羊毛硫氨酸鍵。
本發(fā)明所述的可復(fù)制基因包優(yōu)選選自由噬菌體顆粒、細(xì)菌、酵母、真菌、微生物孢子和核糖體組成的組。
特別地,所述可復(fù)制基因包選自由m13噬菌體、t4噬菌體、t7噬菌體、fd噬菌體和λ噬菌體組成的組。
根據(jù)本發(fā)明具體的一個(gè)方面,所述肽是包含前導(dǎo)肽和核心肽的前體肽。
所述前導(dǎo)肽優(yōu)選包括天然核糖體肽的前導(dǎo)肽。
并且,所述核心肽優(yōu)選源自天然核糖體肽。
特別地,所述環(huán)鍵連接兩個(gè)選自由c、n、o和s的原子組成的組。
在一個(gè)優(yōu)選的實(shí)施例中,所述環(huán)鍵連接兩個(gè)選自由c、n、o和s的不同原子組成的組。
根據(jù)一個(gè)優(yōu)選實(shí)施例,所述肽包括多環(huán)結(jié)構(gòu)。
所述肽優(yōu)選包括一隨機(jī)序列。
根據(jù)本發(fā)明的另一個(gè)方面,提供了一種制備展示肽的可復(fù)制基因包的方法,所述肽在氨基酸側(cè)鏈中具有至少一個(gè)分子內(nèi)環(huán)鍵,如本發(fā)明所述可復(fù)制基因包,所述方法包括:
a)提供編碼肽的核酸序列;
b)將所述核酸序列連接到可復(fù)制基因包的基因內(nèi);
c)在所述可復(fù)制基因包的表面上展示對(duì)應(yīng)的初級(jí)肽序列,得到初級(jí)包;及
d)采用翻譯后修飾(ptm)酶酶促加工所述初級(jí)包,得到展示所述肽環(huán)狀結(jié)構(gòu)的成熟包。
在一個(gè)具體的實(shí)施例中,所述方法在氨基酸側(cè)鏈的兩個(gè)雜原子之間提供一個(gè)分子內(nèi)環(huán)鍵。
本發(fā)明優(yōu)選的方法進(jìn)一步包括構(gòu)建一種肽來(lái)阻斷肽的剪切。
優(yōu)選的ptm酶選自由以下酶組成的組:羧酸酯-胺連接酶、環(huán)化酶、脫氫酶、脫羧酶、差向異構(gòu)酶、羥化酶、肽酶、脫水酶、轉(zhuǎn)移酶、酯酶、氧合酶和異構(gòu)酶,尤其是羊毛硫氨酸鍵形成酶、溶細(xì)胞素形成酶、藍(lán)細(xì)菌素(cyanobactin)形成酶、硫肽形成酶、芋螺肽形成酶、microviridin(microviridin)形成酶、環(huán)肽形成酶、細(xì)菌素形成酶和枯草菌素(subtilosin)形成酶。
根據(jù)一個(gè)具體的實(shí)施例,所述加工在前導(dǎo)肽,優(yōu)選在前導(dǎo)肽的存在下進(jìn)行。
根據(jù)本發(fā)明,進(jìn)一步提供一種采用本發(fā)明所述方法可以獲得的或獲得的可復(fù)制基因包。
根據(jù)本發(fā)明的另一個(gè)方面,提供了一種建立展示肽的可復(fù)制基因包的文庫(kù)的方法,所述肽在氨基酸側(cè)鏈中具有至少一個(gè)分子內(nèi)環(huán)鍵(如本發(fā)明的可復(fù)制基因包),所述方法包括:
a)提供編碼肽變體的核酸序列集;
b)將所述核酸序列集連接到可復(fù)制基因包的基因內(nèi);
c)在所述可復(fù)制基因包表面上展示對(duì)應(yīng)的初級(jí)肽序列,得到初級(jí)庫(kù);及
d)采用ptm酶對(duì)所述初級(jí)庫(kù)進(jìn)行酶促加工,得到展示所述肽變體環(huán)狀結(jié)構(gòu)的成熟庫(kù)。
根據(jù)本發(fā)明的另一個(gè)方面,提供了一可復(fù)制基因包的文庫(kù),所述文庫(kù)采用本發(fā)明所述方法建立,包括制備所述可復(fù)制基因包的方法和建立所述可復(fù)制基因包文庫(kù)的方法。
根據(jù)本發(fā)明的另一個(gè)方面,提供了一可復(fù)制基因包的文庫(kù),如本發(fā)明所述的那些文庫(kù),其中所述包展示各種肽序列。
另外,根據(jù)本發(fā)明的另一個(gè)方面,提供了一種采用ptm酶翻譯后修飾肽庫(kù)而得到展示多環(huán)肽結(jié)構(gòu)的成熟庫(kù)的方法。
特別地,采用一酶,所述酶能夠在選自c、n、o和s的兩個(gè)相同或不同原子之間提供共價(jià)鍵。
因此,根據(jù)本發(fā)明,進(jìn)一步提供了使用ptm酶加工肽庫(kù),以在肽變體中納入多環(huán)結(jié)構(gòu)的用途。
附圖說(shuō)明
圖1:序列。與mvde(圖1a,seqidno.2)融合的piii基因序列;翻譯的氨基酸序列(圖1b,seqidno.3);噬菌體蛋白piii,粗體字母指的是mvde前體肽,下劃線字母指的是核心肽;
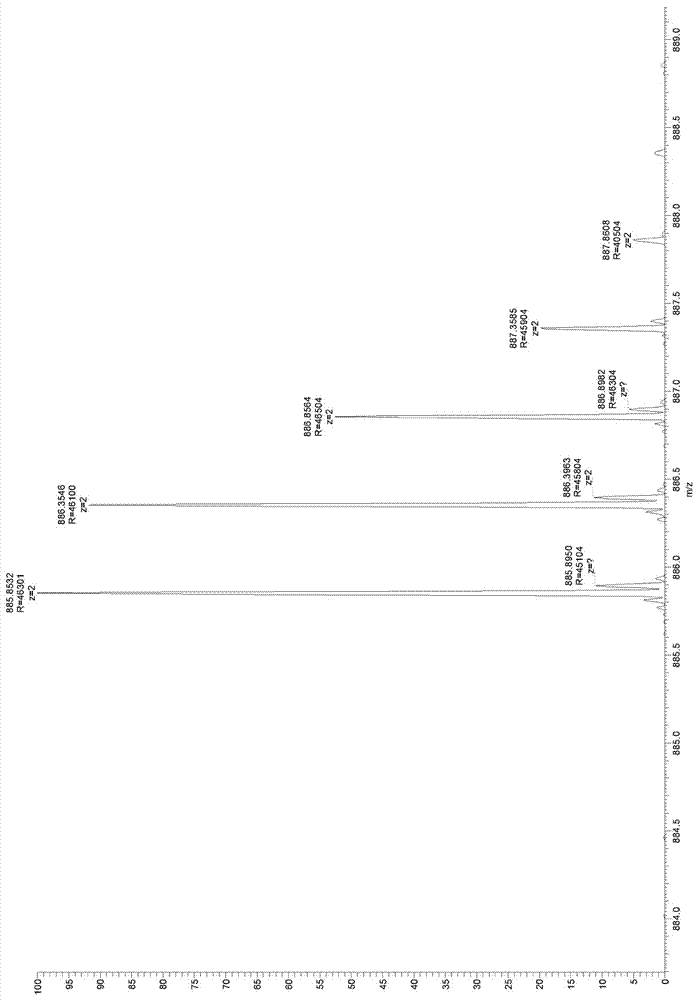
圖2:糜蛋白酶處理的參考肽microviridink的高分辨率質(zhì)譜圖(ftms);圖中所示質(zhì)量885.8532da與microviridink的理論質(zhì)量(885.85019da)相符。
圖3:sds-page分離的糜蛋白酶酶切樣品帶的高分辨率質(zhì)譜圖(ftms);樣品指的是ptm酶處理的m13kecmmvde噬菌體;檢測(cè)得到的雙電荷質(zhì)量m/z885.8540da與肽microviridink的理論質(zhì)量相符,以及與測(cè)得的參考肽microviridink的質(zhì)量(圖1)相符;質(zhì)量準(zhǔn)確度是5ppm。
具體實(shí)施方式
因此,本發(fā)明涉及一種基于可復(fù)制基因包的肽展示系統(tǒng),所述可復(fù)制基因包展示具有特異性分子內(nèi)環(huán)狀結(jié)構(gòu)的肽。肽的代謝工程優(yōu)于化學(xué)交聯(lián),例如,構(gòu)建二硫鍵,因?yàn)樗秒s原子作為雜環(huán)的橋墩(bridgepiers)。從而,通過(guò)代謝處理提供各種肽的初級(jí)結(jié)構(gòu)和二級(jí)結(jié)構(gòu)作為一個(gè)庫(kù),以用于專門特異性地選擇攜帶所需結(jié)合基序(bindingmotifs)的合適的肽。
此處所使用的詞語(yǔ)“可復(fù)制基因包”指的是原核或真核基因包,包括細(xì)胞、孢子、酵母、細(xì)菌、病毒、噬菌體、核糖體和多核糖體。優(yōu)選的可復(fù)制基因包是噬菌體。肽在可復(fù)制基因包上展示,即它們與位于可復(fù)制基因包外表面上的基團(tuán)或分子相連。可復(fù)制基因包是可篩選的單位,其包括與編碼肽的核酸分子相連的待篩選肽。該核酸分子通常可在體內(nèi)復(fù)制,如作為載體,或在體外復(fù)制,如通過(guò)pcr、轉(zhuǎn)錄和翻譯進(jìn)行復(fù)制。體內(nèi)復(fù)制可以是自主進(jìn)行的,如細(xì)胞,可以是在宿主因子的幫助下進(jìn)行的,如病毒,或在宿主和輔助病毒的幫助下進(jìn)行,如噬粒。在可復(fù)制基因包的基因組內(nèi)引入待展示的編碼異源肽的核酸分子,形成與通常表達(dá)在可復(fù)制基因包外表面的自體蛋白融合的融合蛋白,從而形成展示各種肽的可復(fù)制基因包。融合蛋白表達(dá)、運(yùn)輸?shù)酵獗砻婕敖M裝,從而在可復(fù)制基因包的外表面展示肽。根據(jù)本發(fā)明采用的展示系統(tǒng)通常指的是肽的集合,根據(jù)所需特點(diǎn),如物理特點(diǎn)、化學(xué)特點(diǎn)或功能特點(diǎn)進(jìn)行選擇的肽的集合可以進(jìn)入該展示系統(tǒng),因此,很容易分離或回收編碼所選肽的核酸。這種展示系統(tǒng)優(yōu)選提供合適的生物系統(tǒng)中的肽的所有組成成分,有時(shí)稱為生物展示系統(tǒng),特別是可復(fù)制基因包。與體外展示系統(tǒng)相反的是,所述生物系統(tǒng)通常采用病毒或細(xì)胞表達(dá)系統(tǒng),如在轉(zhuǎn)化細(xì)胞、侵染細(xì)胞、轉(zhuǎn)染細(xì)胞或轉(zhuǎn)導(dǎo)細(xì)胞中表達(dá)核酸庫(kù),以及在可復(fù)制基因包的表面上展示編碼肽。
本發(fā)明使用的詞語(yǔ)“肽”指的是包含5個(gè)或更多個(gè)氨基酸,通常至少是10個(gè),優(yōu)選至少是20個(gè),更優(yōu)選至少是30個(gè),更優(yōu)選至少是40個(gè),更優(yōu)選至少是50個(gè),更優(yōu)選至少是60、70、80、90或100個(gè)氨基酸的肽或多肽。詞語(yǔ)“肽”還可以指分子量更高的多肽,如蛋白質(zhì)。
本發(fā)明使用的詞語(yǔ)“分子內(nèi)環(huán)鍵”指的是通過(guò)分子內(nèi)異肽鍵構(gòu)成的二級(jí)結(jié)構(gòu),所述異肽鍵利用肽序列中氨基酸側(cè)鏈之間的共價(jià)鍵,如不包括分子外(外部)結(jié)構(gòu)。該詞語(yǔ)特別指的是那些通過(guò)翻譯后酶加工得到的環(huán)和多環(huán),所述酶加工優(yōu)選不包括化學(xué)加工,如二硫鍵形成,如通過(guò)還原反應(yīng)、環(huán)加成或施陶丁格(staudinger)反應(yīng)。特別地,所述環(huán)是包括至少兩個(gè)“雜原子”的雜環(huán),雜原子是n、o或s等雜原子或在選自由c、n、o和s組成的組中的兩個(gè)不同原子之間形成共價(jià)鍵的原子。特別是包括c-n、c-o、c-s、n-n、n-o、n-s、o-o、o-s和s-s鍵,在合適的化學(xué)意義上來(lái)說(shuō),包括雙鍵。此類鍵合的任何橋墩被稱為“雜原子”,并被視為“雜環(huán)”橋墩,特別是那些通過(guò)翻譯后修飾或代謝處理得到的雜環(huán)。
此處使用的詞語(yǔ)“多環(huán)”或“多環(huán)結(jié)構(gòu)”指的是至少雙環(huán)結(jié)構(gòu),優(yōu)選是具有至少三個(gè)環(huán)鍵,更優(yōu)選至少四個(gè)環(huán)鍵,甚至更優(yōu)選至少五個(gè)環(huán)鍵的結(jié)構(gòu)。根據(jù)本發(fā)明采用的肽的長(zhǎng)度,可以實(shí)現(xiàn)更復(fù)雜的二級(jí)肽結(jié)構(gòu)。
此處使用的詞語(yǔ)“前體肽”指的是包括支持肽的翻譯后酶加工(成熟)的元素的肽,如操作上,與核心肽連接的信號(hào)和/或前導(dǎo)序列。前體肽的羧基端通常編碼酶修飾的序列,即“核心序列”。雖然前導(dǎo)物通常是在修飾后從成熟羧基端剪切掉得到較短的肽產(chǎn)物而得到的,但是,本發(fā)明展示的優(yōu)選前體肽,即使在核心肽成熟后,仍然包括前體元素,如信號(hào)或前導(dǎo)序列。因此,構(gòu)建優(yōu)選的展示系統(tǒng)或構(gòu)建體,以在成熟加工之前和/或之后阻斷核心肽的剪切。通過(guò)突變而防止剪切或通過(guò)跨剪切點(diǎn)建立合適的橋,可影響剪切。
本發(fā)明使用的詞語(yǔ)“前導(dǎo)”或“前導(dǎo)序列”指的是翻譯后修飾(ptm)酶的識(shí)別基序。根據(jù)本發(fā)明一優(yōu)選的方面,所述肽采用可復(fù)制基因包上整合的前導(dǎo)序列進(jìn)行展示,例如前體肽的形式,或者前導(dǎo)可作為獨(dú)立的實(shí)體提供,例如,根據(jù)本發(fā)明作為與可復(fù)制基因包無(wú)關(guān)的獨(dú)立肽,如添加劑或通過(guò)輔助展示系統(tǒng),所述輔助展示系統(tǒng)以展示前導(dǎo)序列或各種前導(dǎo)序列突變體的生物或體外展示系統(tǒng)為基礎(chǔ),充當(dāng)ptm酶促作用的支持。
在本發(fā)明中,詞語(yǔ)“天然核糖體肽”也稱為“核糖體肽天然產(chǎn)物”,指的是結(jié)構(gòu)多樣、具有生物活性的核糖體合成肽,最常見(jiàn)的長(zhǎng)度是大約100個(gè)氨基酸,所述肽由各種酶通過(guò)催化大量不同化學(xué)基序的結(jié)構(gòu)進(jìn)行翻譯后修飾。這一類肽中,有許多帶高變序列的(前體)肽。初級(jí)肽(primarypeptides)可作為加工途徑的底物,因此,每個(gè)途徑都有許多不同的成熟肽。這一類的成員在微生物學(xué)、環(huán)境、醫(yī)學(xué)和科技方面具有可能比較重要的作用。通常,天然核糖體肽的前體肽包含相對(duì)保守的前導(dǎo)序列,所述序列通過(guò)修飾酶和/或輸出機(jī)器(exportmachinery)至少部分負(fù)責(zé)識(shí)別。這些生物合成機(jī)制對(duì)于細(xì)菌核糖體肽天然產(chǎn)品來(lái)說(shuō)幾乎是普遍的,并且在其它生物,如古細(xì)菌、真菌、植物和動(dòng)物的類似肽的生物合成中也常常發(fā)現(xiàn)。
根據(jù)本發(fā)明,優(yōu)選采用的核糖體肽包括microviridins、乳鏈球菌素、硫肽(thiopeptides)、芋螺肽、小菌素、溶細(xì)胞素、羊毛硫抗生素、藍(lán)細(xì)菌素(cyanobactins)、鵝膏毒素/毒傘七肽類(phallotoxins)、環(huán)肽和(環(huán))細(xì)菌素,或它們功能上相當(dāng)?shù)淖凅w。
詞語(yǔ)“隨機(jī)化”或“隨機(jī)序列”指的是預(yù)定區(qū)域內(nèi)特異性核苷酸或氨基酸序列修飾,例如,在代謝處理時(shí),或位于改變雜環(huán)三維-結(jié)構(gòu)的橋墩之間形成新的雜環(huán)橋墩。修飾通常造成氨基酸的隨機(jī)插入、交換或刪除。要取代或插入氨基酸,應(yīng)采用本領(lǐng)域熟悉的方法及本專利申請(qǐng)中公開(kāi)的方法,隨機(jī)或半隨機(jī)選擇氨基酸或使用所有天然氨基酸或合成氨基酸。隨機(jī)化將得到編碼各種肽序列的核酸集。隨機(jī)化優(yōu)選采用天然氨基酸。在特定的實(shí)施例中,避免使用非天然氨基酸。
此處使用的詞語(yǔ)“集”指的是以序列多樣性表征的核酸或氨基酸序列集合。集中的各個(gè)成員具有共同的特征,如支架內(nèi)具有共同的核心結(jié)構(gòu),和/或共同的功能,如特異性結(jié)合或生物活性。在集中,通常存在核酸或氨基酸序列的“變體”,如各種肽序列,它們是通過(guò)突變方法,如通過(guò)隨機(jī)化技術(shù)由母序列衍生得到的。此處使用的詞語(yǔ)“庫(kù)”指的是異質(zhì)的肽或核酸序列的混合物。所述庫(kù)由多個(gè)成員組成,每個(gè)成員具有單個(gè)肽或核酸序列。在這方面,“庫(kù)”是“集”的同義詞。庫(kù)成員之間的序列差異造成庫(kù)具有多樣性。
此處使用的母分子“功能相當(dāng)?shù)淖凅w”或“功能活性變體”指的是通過(guò)插入、刪除或替換序列中或序列任一個(gè)遠(yuǎn)端或兩個(gè)遠(yuǎn)端中的一個(gè)或多個(gè)氨基酸或核苷酸,并對(duì)該序列進(jìn)行不會(huì)影響(特別是損害)其活性的修飾而所得到的序列。對(duì)選定配體具有特異性的配體結(jié)合肽的情形,根據(jù)本發(fā)明所使用的功能活性肽變體將仍然具有預(yù)定的結(jié)合特異性,雖然這一點(diǎn)可能會(huì)改變,如改變對(duì)特定抗原表位的精細(xì)特異性、親和性、親合力、kon或koff率等。在優(yōu)選的實(shí)施例中,功能活性變體a)是肽的生物活性片段,所述功能活性片段包括至少50%所述肽序列,優(yōu)選至少70%,更優(yōu)選至少80%,更優(yōu)選至少90%,甚至更優(yōu)選至少95%及最優(yōu)選至少97%、98%或99%;b)是通過(guò)至少替換、添加和/或刪除肽的一個(gè)氨基酸而衍生得到的,其中所述功能活性變體與所述肽的序列一致性是至少50%,優(yōu)選至少60%,更優(yōu)選至少70%,更優(yōu)選至少80%,更優(yōu)選至少90%,甚至更優(yōu)選至少95%和最優(yōu)選至少97%、98%或99%。所述功能活性變體可通過(guò)改變肽或核苷酸序列中的序列而得到,其中,當(dāng)與本發(fā)明一起使用時(shí),所述序列改變保留了未變動(dòng)的肽或核苷酸序列的功能。此種序列改變包括但不限于,(保守)替換、添加、刪除、突變和插入。
如果包括變體(但不是原序列)的多肽或核苷酸序列的肽制劑的活性是本發(fā)明使用的肽的生物活性的至少10%,優(yōu)選至少25%,更優(yōu)選至少50%,甚至更優(yōu)選至少70%,更優(yōu)選至少80%,尤其是至少90%,尤其至少95%,最優(yōu)選至少99%,則稱所述變體具有功能活性。其中,本發(fā)明使用的肽包括沒(méi)有發(fā)生序列改變的肽或核苷酸序列(即原多肽或原核苷酸序列)。
保守替換是那些在其側(cè)鏈和化學(xué)性質(zhì)方面相關(guān)的氨基酸家族內(nèi)發(fā)生的替換。這些氨基酸家族的實(shí)例有具有堿性側(cè)鏈的氨基酸、具有酸性側(cè)鏈的氨基酸、具有非極性脂肪族側(cè)鏈的氨基酸、具有非極性芳香烴鍘鏈的氨基酸、具有不帶電極性側(cè)鏈的氨基酸、具有小側(cè)鏈的氨基酸及具有大側(cè)鏈的氨基酸等。
在本發(fā)明的另一個(gè)實(shí)施例中,上文定義的肽或核苷酸序列可以采用各種化學(xué)方法進(jìn)行修飾,得到具有與(上文定義的片段或變體)所述肽活性基本相同,及任選具有其它所需性質(zhì)的衍生物。
此處使用的“同源物”或“功能同源物”指的是母核酸、肽、多肽或蛋白質(zhì)的變體,在其初級(jí)、二級(jí)或三級(jí)結(jié)構(gòu)中的對(duì)應(yīng)位點(diǎn)具有相同的或保守的殘基。該詞語(yǔ)還可擴(kuò)大到指編碼同源肽的兩個(gè)或多個(gè)核苷酸序列。特別是,同源化合物與其全長(zhǎng)的天然序列或其任何片段的氨基酸序列的一致性通常是至少大約50%。同源化合物與天然化合物的氨基酸序列一致性,或是與全長(zhǎng)化合物任何其它特別定義的片段的氨基酸序列一致性,優(yōu)選是至少大約55%,更優(yōu)選是至少大約60%,更優(yōu)選是至少大約65%,更優(yōu)選是至少大約70%,更優(yōu)選是至少大約75%,更優(yōu)選是至少大約80%,更優(yōu)選是至少大約85%,更優(yōu)選是至少大約90%,更優(yōu)選是至少大約95%。當(dāng)此類同源物作為生物活性肽的功能得到證明時(shí),所述同源物被稱為“功能同源物”。
本發(fā)明所述“同源核苷酸序列”指的是在核苷酸序列上與預(yù)期的核苷酸序列相關(guān)但并不相同,并且基本上執(zhí)行相同功能的核苷酸序列。這也包括其核苷酸組成的變化,這些變化包括因遺傳密碼的簡(jiǎn)并性而出現(xiàn)的變化,從而所述核苷酸序列基本上執(zhí)行相同的功能。
相對(duì)于鑒定的肽序列,此處的“氨基酸序列一致性的百分?jǐn)?shù)(%)”定義為在比對(duì)序列和引入缺口后,如果必要的話,為了實(shí)現(xiàn)最大的序列一致性,而任何保守取代并不視為序列一致性的一部分時(shí),候選序列中與特定多肽序列中氨基酸殘基一致的百分?jǐn)?shù)。本領(lǐng)域技術(shù)人員能夠確定衡量比對(duì)的合適參數(shù),包括待比較序列的全部長(zhǎng)度實(shí)現(xiàn)最大對(duì)齊所需的任何算法。
此處使用的詞語(yǔ)“翻譯后修飾酶”或“ptm酶”指的是參與翻譯肽的結(jié)構(gòu)變化的酶,例如,特別是作為加工機(jī)器的一部分,在生物活性肽的生物合成中修飾天然核糖體肽。這類酶包括幾種類型的酶,包括羧酸酯-胺連接酶、環(huán)化酶、脫氫酶、環(huán)化脫水酶、脫羧酶、差向異構(gòu)酶、羥化酶、肽酶、脫水酶、轉(zhuǎn)移酶、酯酶、氧合酶和異構(gòu)酶,尤其是羊毛硫氨酸鍵形成酶、溶細(xì)胞素形成酶、藍(lán)細(xì)菌素(cyanobactin)形成酶、硫肽形成酶、芋螺肽形成酶、microviridin形成酶、環(huán)肽形成酶、細(xì)菌素形成酶和枯草菌素(subtilosin)形成酶。
酶的進(jìn)一步說(shuō)明如下。
特別地,采用了羊毛硫氨酸鍵形成酶。willey和vanderdonkannu在rev.microbiol2007年的第61卷第477-501頁(yè)中(willeyandvanderdonkannu.rev.microbiol.2007.61:477-501),將羊毛硫抗生素定義為含羊毛硫氨酸的抗生素。分子內(nèi)鍵被稱為羊毛硫氨酸或甲基羊毛硫氨酸鍵,它們均來(lái)自于不同氨基酸側(cè)鏈的翻譯后修飾。絲氨酸和蘇氨酸的羥基脫水,分別得到2,3-雙脫氫丙氨酸(dha)或(z)-2,3-雙脫氫酪氨酸(dhb)。然后,半胱氨酸殘基立體定向分子內(nèi)加成到dha或dhb上,形成羊毛硫氨酸或甲基羊毛硫氨酸鍵。目前,已知的幾種翻譯后修飾酶及其基因如下:已經(jīng)證明,lanb型脫水酶具有催化絲氨酸和蘇氨酸脫水步驟的酶的c-端。lanc型環(huán)化酶催化半胱氨酸巰基加成。lanc是環(huán)化酶的組分,它是一種鋅金屬蛋白酶,它結(jié)合的金屬被認(rèn)為用于活化親核加成反應(yīng)的巰底物。lanm型融合脫水酶和環(huán)化酶:它的作用是在羊毛硫抗生素合成期間負(fù)責(zé)前體-肽的脫水和環(huán)化。land氧化脫羧酶類型的酶:這種酶從表皮素c-端內(nèi)消旋-羊毛硫氨酸的半胱氨酸殘基催化脫除兩個(gè)還原當(dāng)量(reducingequivalents),形成--c==c--雙鍵。lanp類肽酶剪切掉羊毛硫抗生素上的前導(dǎo)肽。lant類肽酶與abc轉(zhuǎn)運(yùn)體融合;作為分泌過(guò)程的一部分,前體肽的剪切通過(guò)轉(zhuǎn)運(yùn)體調(diào)節(jié)。ltnm和ltnj類脫水酶和脫氫酶參與d-丙氨酸的形成。在肉桂霉素生物合成期間,cinx羥基化天門冬酰胺。
小菌素:(duquesne等人在natprodrep2007年8月第24(4)卷第708-734頁(yè)(duquesneetal[natprodrep.2007aug;24(4):708-34]))大多數(shù)是通過(guò)腸細(xì)菌產(chǎn)生的,并且分為三類:i類、iia類和iib類。涉及的ptm酶及其基因是:mcbb類絲氨酸和半胱氨酸脫水酶(環(huán)化脫水酶)、mcbc類黃素依賴性脫氫酶(氧化還原酶)、參與抗菌素小菌素b17蛋白水解過(guò)程的tlde蛋白酶、pmba(tldd)小菌素加工肽酶2類、參與小菌素mccc7/c51生物合成的mccb類修飾酶、n-氨基丙醇基的mccd類轉(zhuǎn)移酶(mccc7/c51)、參與小菌素j25加工和成熟的mcjb和mcjc、參與小菌素e492修飾的mcec類糖基轉(zhuǎn)移酶、mced腸菌素酯酶、mcei乙酰轉(zhuǎn)移酶。
優(yōu)選采用其它溶細(xì)胞素形成酶。鏈球菌溶血素(mitchell等人在jbiolchem雜志2009年5月8日第284(19)卷第13004-13012頁(yè))(mitchelletal,jbiolchem.2009may8;284(19):13004-12)是由肉毒桿菌得到的翻譯后修飾肽。具體的ptm酶有:脫氫酶sagb以及絲氨酸和半胱氨酸脫水酶(環(huán)化脫水酶)sagc。這兩種酶均參與噻唑及(甲基)-惡唑的形成。
藍(lán)細(xì)菌素(schmidt等人在美國(guó)procnatlacadsci2005年5月17日第102(20)卷第7315-7320頁(yè))(schmidtetalprocnatlacadsciusa.2005may17;102(20):7315-20)是從不同藍(lán)藻屬中分離得到的含雜環(huán)的環(huán)狀肽。根據(jù)優(yōu)選的實(shí)施例,可以采用藍(lán)細(xì)菌素形成酶,如剪切前體肽的枯草菌素類絲氨酸蛋白酶肽酶pata、絲氨酸和半胱氨酸脫水酶(環(huán)化脫水酶)patd及脫氫酶patg(氧化還原酶)。
硫肽(morris等人在jamchemsoc雜志2009年4月29日第131(16)第5946-5955)(morrisetaljamchemsoc.2009apr29;131(16):5946-552009)是一類含雜環(huán)的翻譯后修飾肽,在大環(huán)連接處具有特征的三-和四取代吡啶環(huán)。參與的ptm酶是參與吡啶環(huán)形成的tpdb脫水酶,參與吡啶環(huán)形成的tpdc脫水酶、參與噻唑啉形成的tpdg半胱氨酸脫水酶(環(huán)化脫水酶)、參與噻唑啉至形成噻唑的tpde脫氫酶(氧化還原酶)、tpdh肽酶、tpdi自由基sam蛋白、糞卟啉原iii氧化酶、tpdj1p450單加氧酶、tpdj2p450單加氧酶、參與碳甲基化的tpdl自由基sam蛋白、tpdm氧甲基轉(zhuǎn)移酶、tpdn脫胺還原酶、tpdo環(huán)化脫水酶、tpdp脫水酶、tpdqp450單加氧酶、tpdt氮甲基轉(zhuǎn)移酶及tpdu自由基sam蛋白。
優(yōu)選還采用芋螺肽形成酶。芋螺肽(buczek等人在cell.mol.lifesci.2005年第62卷第3067-3079頁(yè))(buczeketalcell.mol.lifesci.62(2005)3067-3079)是一類由芋螺得到的翻譯后修飾肽。據(jù)估計(jì),此類芋螺肽構(gòu)成了100,000種不同的肽。具體的ptm酶有:底物特異性內(nèi)切蛋白酶tex31、特異性蛋白質(zhì)二硫鍵異構(gòu)酶mrpdi、維生素k-依賴性羧化酶(accno:af382823)。生物化學(xué)實(shí)驗(yàn)表明,下述酶反應(yīng)參與了芋螺毒素的形成:脯氨酸、纈氨酸、賴氨酸羥基化,通過(guò)特異性單加氧酶進(jìn)行的蛋白質(zhì)酰胺化反應(yīng),通過(guò)特異性溴代過(guò)氧化物酶進(jìn)行的色氨酸溴化形成6-溴色氨酸,通過(guò)差向異構(gòu)酶進(jìn)行的trp、leu、phe、val的差向異構(gòu)化。此外,參與芋螺毒素生物合成的還有谷氨酰胺酰基環(huán)化酶、酪氨酰磺基轉(zhuǎn)移酶及o-糖基轉(zhuǎn)移酶。
鵝膏毒素/毒傘七肽類(walton等人在biopolymers2010年5月26日[epubaheadofprint];hallen等人在美國(guó)procnatlacadsci2007年10月27日第104(48)第19097-19101頁(yè))(waltonetalbiopolymers.2010may26.[epubaheadofprint],hallenetalprocnatlacadsciusa.2007nov27;104(48):19097-101)是從擔(dān)子菌綱鵝膏屬分離得到的翻譯后修飾肽。特別有名的ptm酶是絲氨酸蛋白酶pop1。從生物化學(xué)實(shí)驗(yàn)可以推導(dǎo)出,環(huán)化酶、羥化酶及參與色氨酸-半胱氨酸錐蟲(chóng)胱甘肽(tryptathione)交聯(lián)的酶參與了鵝膏毒素/毒傘七肽類的形成。
特別優(yōu)選的是microviridin形成酶。microviridins(philmus等人2008年的文獻(xiàn),見(jiàn)上;ziemert等人在angewchemintedengl2008年第47(40)第7756-7759頁(yè))(philmusetal.,2008seeabove,ziemertetal.,angewchemintedengl.2008;47(40):7756-9):microviridins是一類從不同的藍(lán)藻屬中分離的三環(huán)肽。人們已經(jīng)對(duì)參與microviridins成熟的ptm酶進(jìn)行了生化特性表征。具體的ptm酶有乙酰轉(zhuǎn)移酶mvdb、參與酰胺鍵形成且與rimkatp-結(jié)合蛋白類似的環(huán)化蛋白mvdc、atp抓握連接酶、參與二酯鍵形成且與rimkatp-結(jié)合蛋白和atp抓握連接酶類似的環(huán)化蛋白mvdd。
環(huán)肽(saska等人在jbiolchem雜志2007年10月5日第282(40)卷第29721-29728頁(yè))(saskaetaljbiolchem.2007oct5;282(40):29721-8)是從堇菜科、茜草科和葫蘆科植物中分離的一類翻譯后修飾肽。表征的ptm酶是參與環(huán)肽形成的兩種肽酶:nbvpe1a和nbvpe1b。
圓形細(xì)菌素(maqueda等人在femsmicrobiolrev2008年1月第32(1)卷第2-22頁(yè))(maquedaetalfemsmicrobiolrev.2008jan;32(1):2-22)屬于從革蘭氏陽(yáng)性細(xì)菌分離得到的一類翻譯后修飾肽。雖然,對(duì)于負(fù)責(zé)圓形(圓)細(xì)菌素形成的酶進(jìn)行編碼的基因操縱子來(lái)說(shuō),人們已經(jīng)對(duì)其進(jìn)行了分離和說(shuō)明,但是,利用候選酶催化的生化步驟進(jìn)行鑒定的工作并沒(méi)有完成。根據(jù)生物實(shí)驗(yàn)已經(jīng)推導(dǎo)出,催化頭-尾環(huán)化的肽酶參與了圓形細(xì)菌素的形成。l-丙氨酸向d-丙氨酸的差向異構(gòu)化由特異性差向異構(gòu)酶催化。優(yōu)選的還有枯草菌素形成酶,如fe-s氧化還原酶alba、zn-依賴性肽酶albf和第二zn-依賴性肽酶albe。
優(yōu)選的還有枯草菌素形成酶,如fe-s氧化還原酶albaap011541.1、zn-依賴性肽酶albfap011541.1和zn-依賴性肽酶albeap011541.1。
在優(yōu)選的ptm酶中,還有從前導(dǎo)肽剪切肽產(chǎn)物的蛋白酶。通常,ptm酶修飾包含前導(dǎo)序列的前體肽,所述前導(dǎo)序列至少部分負(fù)責(zé)利用修飾酶和/或輸出機(jī)器進(jìn)行識(shí)別。然而,前導(dǎo)也可以作為獨(dú)立的實(shí)體(如添加劑)提供,或采用含前導(dǎo)序列的共表達(dá)載體共表達(dá)。然后,肽和前導(dǎo)可以在同一重組宿主內(nèi)共表達(dá),并且翻譯后修飾所述肽。或者,前導(dǎo)和酶可作為重組宿主細(xì)胞培養(yǎng)液的添加劑提供,然后,宿主能夠表達(dá)成熟的肽。ptm酶通常修飾半胱氨酸、絲氨酸和蘇氨酸殘基,而且也修飾天門冬酰胺或谷氨酰胺的羧基,例如,形成雜環(huán)單元,如通過(guò)翻譯后加工形成噻唑和惡唑單元。因此,ptm酶可作為單個(gè)蛋白質(zhì)或單個(gè)-亞單位酶,以及包含至少兩種、三種或四種不同酶的蛋白酶復(fù)合物,以支持雜環(huán)化。特別地,根據(jù)本發(fā)明,可以采用參與雜環(huán)核糖體肽生物合成的基因或基因簇,包括其功能活性變體或同源物。優(yōu)選采用天然酶,例如,天然來(lái)源酶,如來(lái)源于生物體裂解物。特別地,優(yōu)選采用來(lái)源于細(xì)菌的酶,如來(lái)源于細(xì)菌裂解物。或者,可以采用重組酶。根據(jù)另一個(gè)優(yōu)選的實(shí)施例,采用底物特異性或酶活性被更改而構(gòu)建的改善的酶或酶變體,優(yōu)選包括天然來(lái)源酶的催化片段。
根據(jù)本發(fā)明,這是第一次可能提供由展示系統(tǒng)展示的肽的代謝加工,包括生物或體外展示,所述肽如天然核糖體肽或其功能活性變體或同源物。
結(jié)果證明,代謝的修飾加工、酶加工可以應(yīng)用于展示肽的可復(fù)制基因包及應(yīng)用于通常的肽庫(kù)。這樣會(huì)導(dǎo)致分子內(nèi)交聯(lián),得到肽的(多)-環(huán)架構(gòu)。線性肽的許多次級(jí)代謝產(chǎn)物是初始更大前體肽的衍生物。真核系統(tǒng)中的前體肽可以進(jìn)一步細(xì)分功能上不同的段:在n-端,經(jīng)加工形成成熟的次級(jí)代謝產(chǎn)物的核心肽,以及標(biāo)明前體肽c-端的任選識(shí)別序列緊跟在信號(hào)肽和前導(dǎo)肽后面。所述不同的段的預(yù)期作用如下:信號(hào)肽引導(dǎo)轉(zhuǎn)運(yùn)至特定的亞細(xì)胞區(qū)室,信號(hào)肽是翻譯后修飾(ptm)酶的識(shí)別基序。核心肽是經(jīng)加工而成為成熟的次級(jí)代謝產(chǎn)物的段,而識(shí)別序列是核心肽段后在c-端的任何延伸。通常,這類次級(jí)代謝產(chǎn)物的產(chǎn)生涉及五個(gè)步驟。首先,采用核糖體和轉(zhuǎn)運(yùn)trna翻譯前體肽的信使mrna編碼。然后,由上述段組成的前體肽,通過(guò)翻譯后修飾核心段的專門ptm酶識(shí)別,導(dǎo)致形成(多)-環(huán)架構(gòu)的分子交聯(lián)。蛋白酶剪切掉前導(dǎo)肽,從而將前導(dǎo)肽段與核心肽段分離。最后,轉(zhuǎn)運(yùn)蛋白將成熟的次級(jí)代謝產(chǎn)物移動(dòng)到膜上。根據(jù)本發(fā)明,特定的突變可以阻斷前導(dǎo)物的剪切,對(duì)于展示前體肽是有利的。
本發(fā)明尤其涉及可復(fù)制基因包,其在氨基酸側(cè)鏈內(nèi),特別是在氨基酸側(cè)鏈的兩個(gè)雜原子之間含有至少一個(gè)分子內(nèi)環(huán)鍵的肽的展示,以及制備所述基因包的方法,包括:
a)提供編碼肽的核酸序列;
b)將所述核酸序列連接到可復(fù)制基因包的基因內(nèi);
c)在所述可復(fù)制基因包的表面上展示對(duì)應(yīng)的初級(jí)肽序列,得到初級(jí)包;及
d)采用翻譯后修飾(ptm)酶酶促加工所述初級(jí)包,得到展示所述肽環(huán)狀結(jié)構(gòu)的成熟包。
本發(fā)明的可復(fù)制基因包優(yōu)選以庫(kù)的成員提供,所述庫(kù)的成員展示各種肽,亦稱為肽庫(kù)。因此,本發(fā)明還提供一種制備單獨(dú)肽庫(kù)的方法,所述肽庫(kù)包含展示各種肽結(jié)構(gòu)的可復(fù)制基因包集合。
制備這種庫(kù)的優(yōu)選方法包括:
a)提供編碼肽變體的核酸序列集;
b)將所述核酸序列集連接到可復(fù)制基因包的基因內(nèi);
c)在所述可復(fù)制基因包表面上展示對(duì)應(yīng)的初級(jí)肽序列,得到初級(jí)庫(kù);及
d)采用ptm酶對(duì)所述初級(jí)庫(kù)進(jìn)行酶促加工,得到展示所述肽變體環(huán)狀結(jié)構(gòu)的成熟庫(kù)。
因此,編碼各種肽的核酸序列集可以連接到可復(fù)制基因包的基因內(nèi)。
為了將肽錨定到絲狀噬菌體表面,采用將大多數(shù)基因與噬菌體外殼蛋白基因融合。優(yōu)選與基因iii、基因viii、基因vi、基因vii和基因ix及它們的片段融合。此外,還在噬菌體λ上實(shí)現(xiàn)了噬菌體展示。此時(shí),基因v蛋白、基因j蛋白和基因d蛋白均非常適合用于本發(fā)明的目的。除了采用基因融合外,外源肽或蛋白質(zhì),包括噬菌體上展示的標(biāo)簽及與待展示肽融合的標(biāo)簽結(jié)合配體已經(jīng)通過(guò)相關(guān)區(qū)域與噬菌體表面連接,以實(shí)現(xiàn)非共價(jià)展示,還有包含用于共價(jià)展示的連接化合物的展示系統(tǒng)。
優(yōu)選天然核糖體肽作為支架,用于制備在特異性位點(diǎn)具有不同修飾的變體集。母體結(jié)構(gòu),如核糖體肽支架的變體,優(yōu)選分組形成肽庫(kù),其可以用于根據(jù)預(yù)定的功能選擇庫(kù)的成員。因此,支架序列優(yōu)選是隨機(jī)的,例如,通過(guò)突變方法。根據(jù)優(yōu)選的戰(zhàn)略,使肽序列中特異性位置發(fā)生突變,為雜環(huán)雜原子橋提供新的橋墩。或者,突變位置位于現(xiàn)有橋墩旁邊,從而,在產(chǎn)生多樣性的同時(shí),保持(多)環(huán)肽結(jié)構(gòu)。
根據(jù)優(yōu)選的實(shí)施例,結(jié)合主體(agent)的環(huán)狀區(qū)或末端區(qū),如母體肽序列,優(yōu)選發(fā)生突變或修飾而產(chǎn)生庫(kù),所述母體肽序列包括位于一個(gè)或多個(gè)環(huán)或端點(diǎn)內(nèi)的可能貢獻(xiàn)出配體結(jié)合點(diǎn)的位置。突變方法優(yōu)選采用隨機(jī)、半隨機(jī)突變,或者尤其是定點(diǎn)隨機(jī)突變,從而,得到隨機(jī)序列,尤其是刪除、交換或引入隨機(jī)產(chǎn)生的插入。或者,優(yōu)選采用組合方法。可以采用任何已知的突變方法,其中包括盒式誘變。在某些情況下,隨機(jī)選擇位置和氨基酸,例如,采用任何可能的氨基酸或選擇優(yōu)選的氨基酸,對(duì)序列進(jìn)行隨機(jī)化,或者采用簡(jiǎn)單的規(guī)則改變氨基酸。例如,優(yōu)選對(duì)特定氨基酸(如丙氨酸)的所有殘基進(jìn)行突變,稱為氨基酸或丙氨酸掃描。為了篩選更高水平的序列多樣性,此類方法可與更精密的構(gòu)建方法聯(lián)合作為選擇法來(lái)使用。
任何類型的肽庫(kù)可采用ptm酶進(jìn)行代謝加工和成熟化。從而,所述庫(kù)通過(guò)肽的三維限制結(jié)構(gòu)得到改善。這增加了高親合性和/或高特異性結(jié)合劑的機(jī)會(huì)。
特別地,初級(jí)庫(kù)可來(lái)源于作為支架的天然核糖體肽。然而,根據(jù)另一個(gè)優(yōu)選的實(shí)施例,任何傳統(tǒng)的肽庫(kù)可以采用ptm酶加工。特別地,任何隨機(jī)肽庫(kù)的次級(jí)代謝產(chǎn)物可以采用體內(nèi)或體外展示技術(shù)制備。
特別地,利用本發(fā)明所述ptm酶進(jìn)行的肽庫(kù)成熟可應(yīng)用于許多展示系統(tǒng),這些展示系統(tǒng)與核酸的編碼功能以及肽的物理、化學(xué)和/或功能特點(diǎn)聯(lián)系在一起,例如,生物展示系統(tǒng),包括病毒,如噬菌體、腺病毒或桿狀病毒展示、酵母展示、真菌展示、孢子展示、細(xì)菌展示或核糖體展示,而且還可應(yīng)用于體外展示系統(tǒng),包括固定肽展示、乳液區(qū)室化和展示、質(zhì)粒展示、共價(jià)展示、固相展示、微矩陣展示等。
通常,本發(fā)明所述肽庫(kù)包括至少106個(gè)庫(kù)成員,更優(yōu)選至少107個(gè)庫(kù)成員,更優(yōu)選至少108個(gè)庫(kù)成員,更優(yōu)選至少109個(gè)庫(kù)成員,更優(yōu)選至少1010個(gè)庫(kù)成員,更優(yōu)選至少1011個(gè)庫(kù)成員,高達(dá)1012個(gè)庫(kù)成員,甚至更高數(shù)量的庫(kù)成員也是可行的。
包含8個(gè)單體單元(8-mer)隨機(jī)肽序列的庫(kù)的理論多樣性是2.6×1010個(gè)成員。為了構(gòu)建這種庫(kù),在基因多樣性方面,需要1.1×1012個(gè)成員的轉(zhuǎn)化子。為了避免構(gòu)建全面肽庫(kù)時(shí)的實(shí)驗(yàn)限制,可以采用限制的氨基酸集用于隨機(jī)化,或在結(jié)構(gòu)支架內(nèi)采用隨機(jī)化。環(huán)狀結(jié)構(gòu)通常在蛋白質(zhì)-蛋白質(zhì)或蛋白質(zhì)-肽相互作用的分子識(shí)別中起著十分重要的作用,因此,根據(jù)本發(fā)明,優(yōu)選為肽庫(kù)制備候選支架,優(yōu)選采用雜環(huán)的環(huán)狀結(jié)構(gòu)。除一個(gè)或多個(gè)酶環(huán)化預(yù)定的橋墩之外,為優(yōu)選的庫(kù)設(shè)計(jì)提供隨機(jī)化。例如,在優(yōu)選使用的microviridink內(nèi),隨機(jī)化的優(yōu)選位置是在一個(gè)或多個(gè)橋墩位置旁邊,即t4、k6、s9、d10、e12和e13旁邊。其它氨基酸可視為是必不可少的,因此,如果合適的話,可以選擇不進(jìn)行突變。
根據(jù)一個(gè)具體的實(shí)施例,利用化學(xué)加工而包括二級(jí)肽結(jié)構(gòu)(如二硫橋)的限制性肽庫(kù)可作為采用本發(fā)明所述ptm酶進(jìn)行加工的一級(jí)肽庫(kù)使用。因此,采用ptm酶進(jìn)行肽庫(kù)的酶促成熟可增加肽庫(kù)的形態(tài)特點(diǎn)(topographiccharacteristics)和多樣性。
在適合酶活性的條件下,肽庫(kù)或肽集通常與一個(gè)或多個(gè)ptm酶結(jié)合。適合ptm酶活性的條件是本領(lǐng)域技術(shù)人員熟知的,或者是本領(lǐng)域技術(shù)人員很容易確定的。如果需要的話,例如,通過(guò)評(píng)估系列ph、酶濃度、溫度條件下酶的活性,和/或改變?cè)试S庫(kù)或集與酶反應(yīng)的時(shí)間,可以確定或優(yōu)化合適的條件。例如,在某些實(shí)施例中,如源自突變體阿氏浮絲藻(planktothrixagardhii)nivacya126/8(philmus等人在chembiochem(2008年)第3066-3073頁(yè))(philmusetal.chembiochem(2008)3066-3073)的裂解產(chǎn)物,酶與肽的比例(摩爾/摩爾比)至少是1:100,000,優(yōu)選是至少1:10,000,更優(yōu)選是至少1:1,000,或至少是1:100,或至少是1:10,或高達(dá)1:1(酶:肽,摩爾/摩爾)。優(yōu)選的范圍是大約0.01%到大約5%(酶和肽之比,w/w)。在一個(gè)實(shí)施例中,酶的濃度是至少0.01ng/ml,優(yōu)選至少0.1ng/ml或至少0.5ng/ml。將混合物在適合酶活性的溫度條件下培養(yǎng),例如,在范圍20℃到大約40℃條件下,或在室溫,優(yōu)選培養(yǎng)30分鐘至24小時(shí),特別優(yōu)選培養(yǎng)1小時(shí)。
例如,可以使用單種酶,任何所需的不同酶的組合,或任何生物制劑、生物提取物,或具有酶活性的生物均勻混合物。并不一定需要采用已知的酶。可以單獨(dú)使用或組合使用的酶的合適例子包括,羧酸酯-胺連接酶、環(huán)化酶、脫氫酶、環(huán)化脫水酶、羊毛硫氨酸鍵形成酶、脫羧酶、差向異構(gòu)酶、羥化酶、肽酶、脫水酶、轉(zhuǎn)移酶、酯酶、氧酶和異構(gòu)酶。優(yōu)選的ptm酶來(lái)源于生物或是純化的酶制劑。在優(yōu)選的實(shí)施例中,采用細(xì)胞裂解物或源自細(xì)胞裂解物的酶,如刪除了mvde基因而無(wú)法得到microviridin的突變體阿氏浮絲藻cya126/8mvde菌株的裂解物(如2010年7月28日在dsmz保藏的菌株阿氏浮絲藻nivacya126/8,保藏號(hào):dsm23872),或可以使用任何其它提供ptm酶的合適的菌株。
本發(fā)明優(yōu)選采用的實(shí)例是mvdb(保藏號(hào):acc54548.1)、mvdc(保藏號(hào):acc54549.1)、mvdd(保藏號(hào):acc54550.1)或它們的同源物,如mdnb(保藏號(hào)caq16122.1)和mdnc(保藏號(hào)caq16123.1)。
具有酶活性的合適的生物提取物、同源物及制劑包括含有機(jī)溶劑的含水提取物、裂解物等。
根據(jù)本發(fā)明具體的實(shí)例,克隆mvde基因,將藍(lán)藻彈性蛋白酶抑制劑microviridin的前體肽編碼到噬菌體m13genepiii內(nèi)。然后,使這種突變噬菌體在其宿主大腸桿菌中增殖,對(duì)m13突變基因組進(jìn)行測(cè)序,證明存在mvde與基因piii融合。隨后,免疫化學(xué)分析表明,突變蛋白piii在聚丙烯酰胺凝膠電泳中的遷移速度與野生型piii不同,表明其與野生型piii相比存在物理擴(kuò)展。這兩個(gè)實(shí)驗(yàn)均證明,microviridin的前體肽mvde在噬菌體m13的表面上展示。microviridin是具有生物活性的次級(jí)代謝產(chǎn)物,是由不同的藍(lán)細(xì)菌,如浮絲藻屬(planktothrixspp.)產(chǎn)生的。它是一種n-端乙酰化的三環(huán)肽(14個(gè)單體單元),并具有氨基酸序列乙酸-ygntmkypsdweey(seqidno.1)(前體肽mvde保藏號(hào)eu438895.1)。
它是核糖體衍生生物合成的,包括采用ptm酶進(jìn)行翻譯后修飾。philmus等人(2008,參考上文)鑒定了負(fù)責(zé)microviridin生物合成的基因簇。philmus等人(參考上文)提供的突變阿氏浮絲藻cya126/8deltamvde菌株無(wú)法通過(guò)刪除mvde基因得到microviridin。細(xì)胞裂解物是從microviridin缺乏菌株得到的,并與m13突變噬菌體顆粒培養(yǎng)。隨后,對(duì)裂解物處理的突變噬菌體顆粒進(jìn)行免疫化學(xué)分析,結(jié)果表明,裂解物處理的piii蛋白的遷移速度不同,表明展示的mvde前體肽存在截短。這一點(diǎn)與核糖體衍生的次級(jí)代謝產(chǎn)物的的成熟步驟一致,因?yàn)榍皩?dǎo)片段從核心肽被釋放出來(lái)。因此,證明了在噬菌體核衣殼上展示的mvde前體肽成功成熟化了。采用質(zhì)譜測(cè)定法,可以證明加工mvde前體肽得到的三環(huán)microviridin的乙酰化物理證據(jù),所述mvde前體肽在噬菌體表面展示。采用聚丙烯酰胺凝膠電泳法分離和鑒定裂解物處理和截?cái)嗟膒iii-mvde蛋白。將對(duì)應(yīng)的帶與凝膠分離之后,提取該蛋白,并用糜蛋白酶酶切,得到能夠采用質(zhì)譜法分析的肽片段。在對(duì)分離蛋白質(zhì)進(jìn)行質(zhì)量分析后,檢測(cè)質(zhì)量,所得質(zhì)量與乙酰化三環(huán)microviridin的質(zhì)量相同。這些實(shí)驗(yàn)提供了具體的證據(jù),證明了存在在噬菌體表面加工核糖體衍生的翻譯后修飾次級(jí)代謝產(chǎn)物的可能性。
代謝加工后,可以分析具有合適肽結(jié)構(gòu)的庫(kù)成員。優(yōu)選擴(kuò)大或增加編碼選定肽的核酸的拷貝數(shù),以獲得足量的核酸或肽,用于又一輪的選擇或用于制備另一個(gè)庫(kù),如用于進(jìn)一步酶加工,以進(jìn)一步進(jìn)行特定的隨機(jī)化,如用于精化特異性或親合力成熟的用途。例如,可以采用噬菌體擴(kuò)增、細(xì)胞生長(zhǎng)或pcr技術(shù)。在一個(gè)優(yōu)選的實(shí)施例中,所述展示系統(tǒng)是噬菌體展示,而所述擴(kuò)增是通過(guò)大腸桿菌表達(dá)。
采用可以將具有所需活性的肽與不具有所需活性的肽區(qū)分開(kāi)來(lái)并進(jìn)行選擇的結(jié)合篩選方法或生物活性篩選方法,從本發(fā)明的肽庫(kù)中選擇配體結(jié)合肽。通常,要將感興趣的可復(fù)制基因包從大量的非結(jié)合包中分離出來(lái),需要進(jìn)行一輪或多輪選擇。可以采用合適的肽活性分析測(cè)定,選擇用于進(jìn)一步鑒定庫(kù)成員。例如,可以采用合適的結(jié)合分析方法,如elisa、淘選法,評(píng)估配體結(jié)合的一般功能。例如,通過(guò)淘選可以選擇和回收結(jié)合靶配體的肽。可以采用本領(lǐng)域熟悉的方法進(jìn)行淘選。
優(yōu)選地,采用被稱為生物淘選的親和性選擇方法完成篩選噬菌體-展示肽庫(kù)。生物淘選通常包括將靶與肽庫(kù)一同培養(yǎng)、洗掉未結(jié)合的噬菌體、洗脫剩余的結(jié)合噬菌體以及擴(kuò)增洗脫的噬菌體,用于隨后的篩選回合。在經(jīng)過(guò)幾輪生物淘選后,可以富集靶-噬菌體結(jié)合體,并分離單個(gè)噬菌體,及進(jìn)行測(cè)序,以顯示任何富集的結(jié)合基序。
當(dāng)采用噬菌體展示系統(tǒng)時(shí),優(yōu)選采用噬菌體elisa測(cè)試結(jié)合的效果。可以按照任何合適的程序進(jìn)行噬菌體elisa測(cè)試。在一個(gè)實(shí)例中,為了鑒定展示配體結(jié)合肽的噬菌體,通過(guò)elisa與選擇的配體結(jié)合,可以篩選每輪選擇得到的噬菌體種群。根據(jù)常用的程序,可以測(cè)試可溶的肽與配體結(jié)合的情況,例如,采用試劑,如針對(duì)c-或n-端的標(biāo)簽,采用elisa進(jìn)行測(cè)試。通過(guò)pcr產(chǎn)物的凝膠電泳法或通過(guò)載體dna的測(cè)序,還可以評(píng)估選定噬菌體的多樣性。
根據(jù)靶應(yīng)用,還可以基于催化或酶抑制活性選擇特定的肽,采用酶活性分析方法可以測(cè)定其催化或酶抑制活性。根據(jù)要求的抗菌、抗真菌或生物活性,如抑制劑或輔因子活性,如采用合適的基于細(xì)胞分析方法的酶抑制劑或增強(qiáng)子活性,開(kāi)展進(jìn)一步的生物試驗(yàn)來(lái)篩選合適的肽。
合適的配體靶優(yōu)選從微生物的(如細(xì)菌的、真菌的、寄生的或病毒的)結(jié)構(gòu)或表位中選擇,還可以從人類的或動(dòng)物的細(xì)胞(包括蛋白質(zhì),特別是酶、酶的輔因子、受體、生長(zhǎng)因子、dna結(jié)合蛋白質(zhì)、核酸、脂類和糖類)的結(jié)構(gòu)或表位中選擇。
結(jié)合肽或編碼肽的dna可以與可復(fù)制基因包分離并進(jìn)行鑒定。然后,根據(jù)應(yīng)用的形式,采用標(biāo)準(zhǔn)分子生物學(xué)技術(shù)合成或結(jié)合前導(dǎo)肽,構(gòu)建編碼肽融合的構(gòu)建體。采用合適的方法制備肽或肽融合構(gòu)建體,如采用重組表達(dá)技術(shù),如通過(guò)重組細(xì)菌或酵母細(xì)胞表達(dá)。
本發(fā)明鑒定和提供的肽可作為前導(dǎo)物,用于開(kāi)發(fā)治療或診斷試劑,或可操作用于靶定獨(dú)特的分子實(shí)體,用于特異性和差異性給藥。尤其優(yōu)選的應(yīng)用是生物靶的模擬表位領(lǐng)域,如用作抑制劑,如抗菌、抗真菌、抗寄生蟲(chóng)、抗病毒、酶抑制劑和抗生素,或用于開(kāi)發(fā)疫苗。還可以進(jìn)一步應(yīng)用于采用配體結(jié)合單元的工業(yè)、分析或環(huán)境應(yīng)用。
包括本發(fā)明所述肽的藥物組合物,通常進(jìn)一步包括至少一種本領(lǐng)域技術(shù)人員熟悉的藥學(xué)上可以接受的賦形劑。所述藥物組合物可以進(jìn)一步包括至少一種其它生物活性劑。合適的試劑是本領(lǐng)域技術(shù)人員熟知的。根據(jù)本發(fā)明,優(yōu)選的肽組合物可包括穩(wěn)定分子,如白蛋白或聚乙二醇,或鹽。優(yōu)選地,采用的是那些保持肽的所需生物活性,并且不會(huì)造成任何不希望存在的毒性影響的添加劑。
此處描述的實(shí)例是對(duì)本發(fā)明的說(shuō)明,并不構(gòu)成對(duì)本發(fā)明的限制。根據(jù)本發(fā)明,對(duì)本發(fā)明的各種實(shí)施例進(jìn)行了描述。對(duì)此處描述和闡明的技術(shù)的許多改動(dòng)和變化并不背離本發(fā)明的精神和范圍。因此,應(yīng)該理解的是,此處給出的實(shí)例僅僅是說(shuō)明性的,并不會(huì)限制本發(fā)明的范圍。
實(shí)例
實(shí)例1:microviridin的噬菌體展示
氯霉素乙酰轉(zhuǎn)移酶(cat)基因克隆到噬菌體m13的基因組內(nèi)
噬菌體m13的基因組dna購(gòu)自newenglandbiolabs,gmbh。采用限制性內(nèi)切酶hindiii(fermentasgmbh)與1μgdna在37℃培養(yǎng)1小時(shí)。按照生產(chǎn)商的建議,采用克列諾片段(fermentasgmbh)與酶切的dna在37℃培養(yǎng)20分鐘。在培養(yǎng)之后,采用qiagengmbh的pcr純化試劑盒提純樣品。采用nanodroptechnologies,inc的nd-1000分光光度計(jì)定量測(cè)定純化的dna。
采用質(zhì)粒dnapacyc184(newenglandbiolabsgmbh)作為擴(kuò)增cat基因的模板dna,采用購(gòu)自mwgeurofinsgmbh)的特異性寡核苷酸cat+和cat-和dna聚合酶(finnzymesoy,遵照生產(chǎn)商的建議,通過(guò)聚合酶鏈?zhǔn)椒磻?yīng)(pcr)進(jìn)行擴(kuò)增。在pcr終止后,在采用溴化乙錠(sigma-aldrichgmbh)染色的瓊脂糖凝膠(0.8%)上負(fù)載樣品和分離樣品。在終止后,通過(guò)紫外光使擴(kuò)增帶可視化,并采用凝膠提取試劑盒(qiagengmbh)從凝膠中分離和純化擴(kuò)增帶。采用nanodroptechnologies,inc的nd-1000分光光度計(jì)定量測(cè)定純化的dna。
采用t4dna連接酶(fermentasgmbh)連接等摩爾量的擴(kuò)增的catdna和噬菌體m13dna。采用genepulser(bioradgmbh),使用預(yù)裝在該裝置上的大腸桿菌標(biāo)準(zhǔn)電擊轉(zhuǎn)化程序,對(duì)一份等分大腸桿菌k12菌株2738(newenglandbiolabs)樣品進(jìn)行電擊轉(zhuǎn)化。全部樣品倒(plateout)在加入12.5μg/ml氯霉素(sigma-aldrichgmbh)的lb-瓊脂平板上,并在37℃培養(yǎng)一個(gè)晚上。在培養(yǎng)后,單菌落接種到50ml液體lb培養(yǎng)液中,其中添加12.5μg/ml氯霉素,并在37℃劇烈搖動(dòng)下培養(yǎng)一個(gè)晚上。在培養(yǎng)后,采用dupont,inc的sorvallrc5b離心分離機(jī)對(duì)懸浮液離心分離。采用genejet質(zhì)粒小量提取試劑盒(plasmidminiprepkit)(fermentasgmbh)分離顆粒中的dna。采用特異性寡核苷酸m13cm+和mwgeurofinsgmbh應(yīng)用的大熒光染料終止劑(bigdyeterminator)技術(shù),通過(guò)dna測(cè)序證實(shí)了cat基因成功地融合到了噬菌體m13的基因組內(nèi)。
隨后,噬菌體被稱為m13kecm。dna采用限制性核酸內(nèi)切酶eco52i和acc65i(fermentasgmbh)進(jìn)行雙酶切。在終止后,采用pcr純化試劑盒(qiagengmbh)純化樣品,并采用光譜法對(duì)dna進(jìn)行定量。
寡核苷酸mvde+和mvde-用于擴(kuò)增mvde基因,采用dna聚合酶(finnzymesoy)和來(lái)自藍(lán)細(xì)菌阿氏浮絲藻(planktothrixagardhii)cya126/8(planktothrixagardhiinivacya126/8,dsmz保藏日期:28.07.2010,dsm23872)的dna模板,遵照生產(chǎn)商的建議利用pcr進(jìn)行擴(kuò)增。寡核苷酸mvde+在5`端帶有6bp的延伸,產(chǎn)生一個(gè)acc65i的框內(nèi)限制識(shí)別序列,而寡核苷酸mvde-在5`端帶有6bp延伸,產(chǎn)生一個(gè)eco52i的框內(nèi)限制識(shí)別序列。因此,采用寡核苷酸mvde+和mvde-進(jìn)行pcr得到的擴(kuò)增子攜帶了引入的eco52i和acc65i的限制性識(shí)別序列。在pcr終止后,在采用溴化乙錠染色的瓊脂糖凝膠(3%)上負(fù)載樣品和分離樣品。在終止后,通過(guò)紫外光使擴(kuò)增帶可視化,并采用凝膠提取試劑盒(qiagengmbh)從凝膠中分離和純化。純化的dna采用nanodroptechnologies,inc的nd-1000分光光度計(jì)定量測(cè)定。1μgpcr產(chǎn)物用限制性核酸內(nèi)切酶acc65i和eco52i(fermentasgmbh)進(jìn)行雙酶切。在培養(yǎng)之后,采用pcr純化試劑盒(qiagengmbh)提純樣品。采用nd-1000分光光度計(jì)(nanodroptechnologies,inc)定量測(cè)定純化的dna。
等摩爾量的雙酶切的mvdedna和噬菌體m13kecmdna采用t4dna連接酶(fermentasgmbh)連接。采用genepulser(bioradgmbh),使用預(yù)裝在該裝置上的大腸桿菌標(biāo)準(zhǔn)電擊轉(zhuǎn)化程序,對(duì)一份等分大腸桿菌k12菌株2738(newenglandbiolabsgmbh)樣品進(jìn)行電擊轉(zhuǎn)化。全部樣品倒在加入了12.5μg/ml氯霉素(sigma-aldrichgmbh)的lb-瓊脂平板上,并在37℃培養(yǎng)一個(gè)晚上。在培養(yǎng)后,單菌落接種到50ml液體lb培養(yǎng)液中,其中添加12.5μg/ml氯霉素,并在37℃劇烈搖動(dòng)下培養(yǎng)一個(gè)晚上。在培養(yǎng)后,在dupont,inc的sorvallrc5b離心分離機(jī)中,在4℃、10.000rpm條件下對(duì)懸浮液離心分離10分鐘。采用fermentasgmbh的genejet質(zhì)粒小量提取試劑盒分離顆粒dna。
采用特異性寡核苷酸m13ke+和mwgeurofinsgmbh應(yīng)用的大熒光染料終止劑(bigdyeterminator)技術(shù),通過(guò)dna測(cè)序證實(shí)了mvde基因成功地框內(nèi)融合到了噬菌體m13kecm的piii基因內(nèi)。
序列如圖1所示:與mvde融合的piii基因序列,(圖1a);噬菌體蛋白piii的翻譯氨基酸序列(圖1b):粗體字母指的是mvde前體肽,下劃線字母指的是核心肽。
噬菌體m13kecmmvde混合(bulk)擴(kuò)增
隨后,噬菌體被稱為m13kecmmvde。采用genepulser(bioradgmbh),使用預(yù)裝在該裝置上的大腸桿菌標(biāo)準(zhǔn)電擊轉(zhuǎn)化程序,對(duì)100ngdna進(jìn)行大腸桿菌k12菌株2738(newenglandbiolabs)電擊轉(zhuǎn)化。全部樣品倒到加入了12.5μg/ml氯霉素的lb-瓊脂平板上,并在37℃培養(yǎng)一個(gè)晚上。在培養(yǎng)后,單菌落接種到3ml液體lb培養(yǎng)液中,其中添加了12.5μg/ml氯霉素,并在37℃劇烈搖動(dòng)下培養(yǎng)一個(gè)晚上。在培養(yǎng)后,300μl懸浮液注種到300ml液體lb中,其中添加了12.5μg/ml氯霉素,劇烈搖動(dòng),在37℃培養(yǎng)4.5h。在培養(yǎng)后,懸浮液在dupont,inc的sorvallrc5b離心分離機(jī)中于4℃離心分離10分鐘,然后,將上清液轉(zhuǎn)移到新的桶(bucket)內(nèi),并在相同的條件下再進(jìn)行離心分離。然后,將上清液(280ml)轉(zhuǎn)移到新的桶內(nèi),加入45mlpeg-nacl緩沖液(20%(w/v)聚乙二醇-8000)、2.5mnacl(sigma-aldrichgmbh),劇烈混合,并在4℃培養(yǎng)一個(gè)晚上。樣品在sorvallrc5b離心分離機(jī)(dupont,inc.)中在4℃、10.000rpm條件下離心分離15分鐘。離心分離后,完全去掉上清液,將白色沉淀物在2mltbs緩沖液(50mmtris-hclph7.5、150mmnacl,sigma-aldrichgmbh)中重新懸浮,并在4℃貯存。
類似地,得到大量噬菌體m13kecm,并在4℃貯存。
噬菌體顆粒的聚丙烯酰胺凝膠電泳(page)
所有的page分析采用miniproteancell(bioradgmbh)和6%的凝膠強(qiáng)度開(kāi)展。遵照生產(chǎn)商提供的指南,將總共10μl噬菌體樣品m13kecm(陰性對(duì)照)和m13kecmmvde上樣(load)到凝膠上并進(jìn)行分離。結(jié)束后,遵照生產(chǎn)商建議的半干印跡程序,將凝膠印跡到pvdf膜(bioradgmbh)上。采用newenglandbiolabsgmbh提供的噬菌體m13的piii蛋白的一級(jí)抗體,對(duì)膜開(kāi)展免疫化學(xué)分析。在膜顯影后,可以清晰看到噬菌體m13kecm的piii帶和噬菌體m13kecmmvde的piii帶之間的大小差別,表明噬菌體m13kecmmvde中的piii出現(xiàn)了大小擴(kuò)展。
噬菌體m13kecmmvde的裂解物處理
將150ml藍(lán)細(xì)菌阿氏浮絲藻cya126/8delmvde(philmus等人在2008年的chembiochem第9(18)卷第3066-3073頁(yè))(philmusetal(2008)chembiochem.9(18):3066-73)的突變株離心分離,并用te緩沖液(10mmedta,ph8,1mmtris-hcl,ph8,sigma-aldrichgmbh)洗滌3次。在最后一次離心分離后,將細(xì)胞顆粒在1ml20mmtris-hclph8.3中重新懸浮,并新加入β-巰基乙醇,使其最終濃度達(dá)到10mm,兩種試劑都是購(gòu)自sigma-aldrichgmbh。接下來(lái)的所有步驟均在冰上進(jìn)行。將懸浮液轉(zhuǎn)移到細(xì)胞裂解容器(parrinstrumentgmbh)中,并施加110bar的壓力,然后,使懸浮液通過(guò)閥門。進(jìn)行三個(gè)這樣的循環(huán),完成后,將懸浮液在dupont,inc的sorvallrc5b離心分離機(jī)中于10.000rpm、4℃條件下離心分離10分鐘。將上清液轉(zhuǎn)移到新管中,并保持在冰上,以供下一步應(yīng)用。
將100μl噬菌體m13kecmmvde懸浮液與500μl上述裂解物混合,并在22℃培養(yǎng)1小時(shí)。結(jié)束后,采用1/6體積的peg/nacl緩沖液處理懸浮液,并在4℃培養(yǎng)1個(gè)晚上。樣品在dupont,inc的sorvallrc5b離心分離機(jī)中于10.000rpm、4℃條件下離心分離15分鐘。離心分離后,將上清液全部去掉,并將綠色沉淀物在1mltbs緩沖溶液(50mmtris-hclph7.5,150mmnacl)中重新懸浮,并于4℃貯存。在上述步驟后,進(jìn)行第二次洗滌步驟。最后,將顆粒在40μltbs中重新懸浮。遵照生產(chǎn)商提供的指南,將總共30μl未進(jìn)行裂解物處理的噬菌體樣品m13kecmmvde(陰性對(duì)照)和經(jīng)裂解物處理的m13kecmmvde負(fù)載到凝膠上并進(jìn)行分離。結(jié)束后,遵照生產(chǎn)商建議的半干印跡程序,將凝膠印跡到pvdf膜(bioradgmbh)上。采用newenglandbiolabsgmbh的噬菌體m13的piii蛋白一級(jí)抗體,對(duì)膜開(kāi)展免疫化學(xué)分析。在膜顯影后,可以清晰看到未采用裂解物處理的噬菌體m13kecmmvde的piii帶和采用裂解物處理的噬菌體m13kecmmvde的piii帶之間的大小差別,表明噬菌體m13kecmmvde的piii大小被截短。對(duì)這種大小差別的詮釋是,在噬菌體衣殼上展示的前體肽成功進(jìn)行翻譯后修飾后,其差別應(yīng)該是短了35個(gè)氨基酸。
按照上文所述,重復(fù)sdspage,而凝膠用于考馬斯亮染色(bioradgmbh)。裂解物處理的噬菌體m13kecmmvde的piii蛋白帶被分離并用于質(zhì)譜分析。由proteomfactorygmbh進(jìn)行質(zhì)譜分析。加入100mmtris-hcl(sigmaaldrich)洗滌蛋白帶20分鐘,倒掉,然后加入100mmtris-hcl、10mmcacl2(sigmaaldrich)、80%乙腈(vwrinternational)(v/v),ph為8.0,洗滌蛋白帶20分鐘。重復(fù)洗滌步驟兩次之后,去掉上清液,200ng糜蛋白酶加入到20μl100mmtris-hcl、10mmcacl2、5%acn(v/v),ph為8.0中,然后加到蛋白帶中在25℃酶解一個(gè)晚上。采用1體積2%的甲酸酸化溶液,并培養(yǎng)30分鐘。采用kosol等(2009年eur.j.phycol第44卷第49-62頁(yè))(2009eur.j.phycol.44:49-62)描述的梯度,通過(guò)高效液相色譜法儀(hewlett&packardinc.)將microviridink純物質(zhì)(philmus等2008年,參考上文)(philmusetal2008,ref.above)從菌株阿氏浮絲藻cya126/8中分離出來(lái)。
大約10ng純肽與200ng糜蛋白酶在20μl100mmtris-hcl、10mmcacl2、5%乙腈(v/v),ph8.0的溶液中于25℃培養(yǎng)一個(gè)晚上。培養(yǎng)后,采用1體積2%的甲酸酸化溶液,并培養(yǎng)30分鐘。對(duì)20μl的兩種樣品進(jìn)行高分辨率nanolc-esi-ms(thermoft-icrms)分析,其中采用50分鐘內(nèi)的nanolc梯度儀(agilent1100nanolc系統(tǒng)),使用溶劑a(0.1%甲酸/5%乙腈/94.9%ddh2o)和溶劑b(甲酸/99.9%乙腈),程序從5%b開(kāi)始梯度增加至40%b。ms數(shù)據(jù)的質(zhì)量準(zhǔn)確度是優(yōu)于5ppm,msms數(shù)據(jù)的準(zhǔn)確度優(yōu)于0.5da。利用分析的蛋白質(zhì)的氨基酸序列自定義數(shù)據(jù)庫(kù),通過(guò)mascotserver對(duì)ms數(shù)據(jù)進(jìn)行分析。
理論質(zhì)量計(jì)算:microviridink的單一同位素質(zhì)量是1771.70038da(philmus等人,2008年)(philmusetal2008),結(jié)果雙電荷質(zhì)量m/z為885.85019da。
結(jié)果如圖2(參照)和圖3(m13kecmmvde)所示。
說(shuō)明:
采用hplc分離乙酰化三環(huán)肽microviridink,并且糜蛋白酶處理大約10ng純肽,然后采用ftms測(cè)定。檢測(cè)到的質(zhì)量是885.8532da,與microviridink的理論計(jì)算質(zhì)量值885.85019da非常相符。因此,采用糜蛋白酶處理純microviridin并不會(huì)剪切肽,這一點(diǎn)與microviridink的環(huán)狀性質(zhì)相符。
第二次ftms測(cè)定中所用的樣品代表的是分離的噬菌體m13kecmmvde的piii蛋白。噬菌體m13kecmmvde展示n-端與mvde前體蛋白融合的piii蛋白,而所述噬菌體采用阿氏浮絲藻nivacya126/8delmvde的細(xì)胞裂解物處理。這樣處理的噬菌體m13kecmmvde用于sdspage分離,并將代表修飾的piii-mvde蛋白的蛋白帶從凝膠中分離和提取出來(lái)。通過(guò)裂解物中的ptm酶成功加工展示的piii-mvde之后,產(chǎn)生的三環(huán)microviridink預(yù)計(jì)與piii蛋白的n-端相連。microviridink的c-端氨基酸是酪氨酸。由于糜蛋白酶是一種蛋白水解酶,其優(yōu)先剪切酰胺鍵,其中所述酰胺鍵的羧基端是酪氨酸,因此,它在microviridink后被準(zhǔn)確地剪切,并將其從噬菌體蛋白piii中釋放出來(lái)。事實(shí)上,圖3所示質(zhì)譜表明,在5ppm的質(zhì)量準(zhǔn)確度范圍之內(nèi),質(zhì)量與圖2所示參考質(zhì)量相同。這一點(diǎn)證明了采用包含在阿氏浮絲藻nivacya126/8delmvde裂解物中的ptm酶,展示的前體肽mvde被ptm酶完整地翻譯后修飾,同時(shí),連接和展示到噬菌體m13kecmmvde上。
此處的數(shù)據(jù)表明,可以產(chǎn)生翻譯后修飾的肽(microviridin)成員,同時(shí),該成員與病毒的核衣殼蛋白物理連接。
實(shí)例2:創(chuàng)建肽庫(kù)
microviridink是帶有氨基酸序列y1g2n3t4m5k6y7p8s9d10w11e12e13y14(參見(jiàn)seqidno.1)的三環(huán)肽,其中參與分子內(nèi)交聯(lián)的氨基酸殘基是t4、k6、s9、d10、e12和e13。因此,位置1、2、3、5、7、8、11、14被認(rèn)為是可以變化的,優(yōu)選用于隨機(jī)化,而不干擾橋的數(shù)量和橋的模式。位置1、2、3、5、7、8、11、14處的氨基酸殘基的隨機(jī)化是通過(guò)加工(elaboration)固相合成(mwgeurofinsgmbh)得到的寡核苷酸混合物完成的。
寡核苷酸序列如下:(nnk)n.act.nnk.aag.nnk.nnk.tcc.gat.nnk.gaa.gaa.(nnk)n(seqidno.4)。通常利用還原的遺傳密碼,通過(guò)隨機(jī)化文庫(kù)寡核苷酸dna,將多樣性引入到噬菌體展示的肽庫(kù)中。例如,在文庫(kù)dna構(gòu)建中,采用簡(jiǎn)并密碼子nnk(其中n是腺嘌呤、胸腺嘧啶、鳥(niǎo)嘌呤和胞嘧啶核苷酸混合中的25%;k是胸腺嘧啶和鳥(niǎo)嘌呤核苷酸混合中的50%)。三聯(lián)體,如編碼t4可能是acc、acg、aca。k6以及在其它位置9、10、12和13可能采用同樣的戰(zhàn)略,k6可采用另外的三聯(lián)體aaa。此外,通過(guò)加入(nnk)n三聯(lián)體(n=gatc,k=gt,n是0-100之間的整數(shù)),加工5`端和3`端的不同三聯(lián)體數(shù)量的延伸。遵照建立的操作規(guī)程(如sambrockandrussel2001,molecularcloning,3rdeditioncshlpress),將寡核苷酸融合到piii的基因編碼內(nèi)。噬菌體上展示的前體mvde肽的翻譯后修飾還可以采用純化的酶完成,如mvdb(保藏號(hào):acc54548.1)、mvdc(保藏號(hào):acc54549.1)、mvdd(保藏號(hào):acc54550.1)或它們的同源物,如mdnb(保藏號(hào)caq16122.1)和mdnc(保藏號(hào)caq16123.1)。
oman和vanderdonk(2010年)(natchembiol.的2010年1月版第6(1)卷第9-18頁(yè))(natchembiol.2010jan;6(1):9-18)中描述的翻譯后修飾肽主要可以細(xì)分為兩類:一類是由microviridin、乳鏈球菌素、硫鏈絲菌肽、芋螺毒素等成員構(gòu)成的,它們的共同特征是,前體肽的c-端氨基酸也是完全加工的核心肽的c-端氨基酸。第二類的成員,如海洋環(huán)肽(patellamides)、鵝膏菌素等,具有共同的特征,它們都是前體肽蛋白水解酶切得到的。對(duì)于提到的第一類成員,可以將其前體肽與病毒的核衣殼蛋白連接,并使用生產(chǎn)者生物裂解物或采用專用純化ptm酶對(duì)其進(jìn)行處理后,進(jìn)行展示,并且使其與病毒連接,因?yàn)樵诤诵碾呐c前體肽的c-端氨基酸分離時(shí),它們的生物合成并不涉及這一步驟。因此,在其生物合成的所有步驟期間,對(duì)于所有一類ptm肽的代表來(lái)說(shuō),病毒表面上展示的遺傳信息和結(jié)構(gòu)之間的物理連鎖均得到維持。
sequencelisting
<110>g·克里斯蒂安森
<120>修飾肽的展示
<130>ch001ep
<160>4
<170>patentinversion3.3
<210>1
<211>14
<212>prt
<213>浮游藍(lán)絲藻屬(planktothrix)
<400>1
tyrglyasnthrmetlystyrproserasptrpgluglutyr
1510
<210>2
<211>764
<212>dna
<213>人工序列
<220>
<223>修飾的噬菌體
<400>2
aaacgggttagatctcccctcgaaaagcaagctgataaaccgatacaattaaaggctcct60
tttggagccttttttttggagattttcaacgtgaaaaaattattattcgcaattccttta120
gtggaacctttctattctcactcgatgtccaaaaatgttaaagtctctgcgcccaaagca180
gtccccttctttgctcgtttcttagcagagcaagccgtggaagctaacaattctaattct240
gctccttacggtaatactatgaagtatccttccgattgggaagaatattcggccgaaact300
gttgaaagttgtttagcaaaatcccatacagaaaattcatttattaacgtctggaaagac360
gacaaaactttagatcgttacgctaactatgagggctgtctgtggaatgctacaggcgtt420
gtagtttgtactggtgacgcaactcagtgttacggtacatgggttcctattgggcttgct480
atccctgaaaatgagggtggtggctctgagggtggcggttctgagggtggaggttctgag540
ggtggcggtactaaacatcctgactacggtgatacacctatcccgggctatactttatca600
accctctcgacggcacgtatcctcctggtactgagcaaaacctcgctaatctaatccttc660
tcttgaggagtctcagcctcttaatactttcatgtttcagaataatatgttccacaaata720
ggcagggggcttaaactgtttatacggtatcctgtttactccaa764
<210>3
<211>244
<212>prt
<213>人工序列
<220>
<223>修飾的噬菌體
<400>3
lysargvalargserproleuglulysglnalaasplysproilegln
151015
leulysalapropheglyalaphepheleugluilepheasnvallys
202530
lysleuleuphealaileproleuvalgluprophetyrserhisser
354045
metserlysasnvallysvalseralaprolysalavalprophephe
505560
alaargpheleualagluglnalavalglualaasnasnserasnser
65707580
alaprotyrglyasnthrmetlystyrproserasptrpgluglutyr
859095
seralagluthrvalglusercysleualalysserhisthrgluasn
100105110
serpheileasnvaltrplysaspasplysthrleuaspargtyrala
115120125
asntyrgluglycysleutrpasnalathrglyvalvalvalcysthr
130135140
glyaspalathrglncystyrglythrtrpvalproileglyleuala
145150155160
ileprogluasngluglyglyglysergluglyglyglyserglugly
165170175
glyglysergluglyglyglythrlyshisproasptyrglyaspthr
180185190
proileproglytyrthrtyrileasnproleuaspglythrtyrpro
195200205
proglythrgluglnasnleualaasnleuileleuleuleuargser
210215220
leuserleuleuileleusercyspheargileilecysserthrasn
225230235240
argglnglyala
<210>4
<211>36
<212>dna
<213>人工序列
<220>
<223>隨機(jī)化的肽
<220>
<221>misc_feature
<222>(1)...(2)
<223>n=a或c或g或t
<220>
<221>misc_feature
<222>(3)...(3)
<223>k=g或t
<220>
<221>misc_feature
<222>(7)...(8)
<223>n=a或c或g或t
<220>
<221>misc_feature
<222>(9)...(9)
<223>k=g或t
<220>
<221>misc_feature
<222>(13)...(14)
<223>n=a或c或g或t
<220>
<221>misc_feature
<222>(15)...(15)
<223>k=g或t
<220>
<221>misc_feature
<222>(16)...(17)
<223>n=a或c或g或t
<220>
<221>misc_feature
<222>(18)...(18)
<223>k=g或t
<220>
<221>misc_feature
<222>(25)...(26)
<223>n=a或c或g或t
<220>
<221>misc_feature
<222>(27)...(27)
<223>k=g或t
<220>
<221>misc_feature
<222>(34)...(35)
<223>n=a或c或g或t
<220>
<221>misc_feature
<222>(36)...(36)
<223>k=g或t
<400>4
nnkactnnkaagnnknnktccgatnnkgaagaannk36
- 還沒(méi)有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 附載蟾毒靈的多肽修飾的聚甲基丙烯酸寡聚乙二醇酯-聚己內(nèi)酯納米制劑的制作方法
- 一種硫辛酸修飾的納米多肽載體及其制備方法和應(yīng)用
- 附載蟾毒靈的多肽修飾的聚甲基丙烯酸寡聚乙二醇酯-聚己內(nèi)酯納米制劑的制作方法
- 多肽修飾的聚(甲基丙烯酸寡聚乙二醇酯-co-蟾毒靈)納米制劑及其制備方法
- 八肽修飾的地塞米松,其制備,納米結(jié)構(gòu)和應(yīng)用
- 末端側(cè)鏈-尾鏈連接手性二酸修飾多肽化合物及合成方法
- 羥乙基淀粉修飾的促紅細(xì)胞生成素模擬肽及其制備和應(yīng)用
- 靶向性多肽修飾的鐵蛋白納米顆粒裝載卟啉二聚體鹽復(fù)合物及其用途和制備方法
- Ge11多肽修飾的冬凌草甲素-納米硒復(fù)合物及其制備方法和應(yīng)用
- 一種用redv多肽修飾的雙親梳型基因載體及制備方法