 技術(shù)領(lǐng)域
技術(shù)領(lǐng)域:
本發(fā)明涉及微生物檢測
技術(shù)領(lǐng)域:
,具體說是涉及一種快速、可視化并且可實(shí)時定量檢測流感病毒的逆轉(zhuǎn)錄環(huán)介導(dǎo)等溫?cái)U(kuò)增試劑盒及其應(yīng)用。
背景技術(shù):
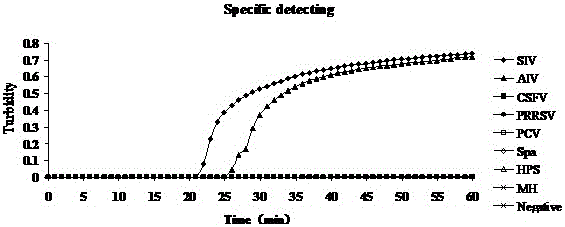
:流感病毒可引起人、禽、豬、馬、蝙蝠等多種動物感染和發(fā)病,是人流感、禽流感、豬流感、馬流感等人與動物疫病的病原。流感病毒對外界抵抗力不強(qiáng)。動物流感病毒通常不感染人,人流感病毒通常不感染動物,但是豬比較例外,豬既可以感染人流感病毒,也可以感染禽流感病毒,但它們主要感染的還是豬流感病毒。少數(shù)動物流感病毒適應(yīng)人后,可以引起人流感大流行。豬流感是一種急性、傳染性呼吸道疾病,其特征為疾病突發(fā),高熱,精神沉郁,食欲廢絕,呼吸困難,陣發(fā)性咳嗽。禽流感病毒(AIV)屬甲型流感病毒,引起禽類的一種從呼吸系統(tǒng)到嚴(yán)重全身敗血癥等多種癥狀的傳染病。禽流感容易在鳥類間流行,過去在民間稱為“雞瘟”,國際獸疫局將其定為甲類傳染病。禽流感1994年、1997年、1999年和2003年分別在澳大利亞、意大利、中國香港、荷蘭等地暴發(fā),2005年則主要在東南亞和歐洲暴發(fā)。近年來,隨著集約化養(yǎng)殖規(guī)模的不斷擴(kuò)大,流感對養(yǎng)殖業(yè)構(gòu)成了較大的威脅。此外,高致病性禽流感在人流感和禽流感之間發(fā)揮著關(guān)鍵性作用,具有重大的公共衛(wèi)生意義,自1918年首次報(bào)道以來,流感一直受到人們的廣泛關(guān)注。目前,流感病毒的檢測技術(shù)主要有常規(guī)方法和分子生物學(xué)方法。常規(guī)方法是病毒的分離鑒定,其結(jié)果準(zhǔn)確可靠,但常規(guī)鑒定方法存在操作復(fù)雜,需要復(fù)雜的儀器設(shè)備,所需時間長的缺點(diǎn),不利于流感的快速診斷。分子生物學(xué)的方法是通過逆轉(zhuǎn)錄聚合酶鏈?zhǔn)椒磻?yīng)(RT-PCR)方法檢測流感病毒的特異性基因,雖然RT-PCR方法較常規(guī)方法快速準(zhǔn)確,但需要昂貴的儀器設(shè)備,成本較高,在結(jié)果判定上需要進(jìn)行瓊脂糖凝膠電泳,容易造成實(shí)驗(yàn)室污染導(dǎo)致出現(xiàn)假陽性結(jié)果。技術(shù)實(shí)現(xiàn)要素:本發(fā)明的目的是提供一種為快速、準(zhǔn)確并且實(shí)時檢測流感病毒的方法,提供一種快速、可視化并且可實(shí)時定量檢測流感病毒的逆轉(zhuǎn)錄環(huán)介導(dǎo)等溫?cái)U(kuò)增試劑盒。為實(shí)現(xiàn)本發(fā)明目的所使用的技術(shù)方案為:一種流感病毒逆轉(zhuǎn)錄環(huán)介導(dǎo)等溫?cái)U(kuò)增試劑盒,該試劑盒包括RT-LAMP引物、2×反應(yīng)緩沖液、酶混合物EM、熒光目視檢測試劑、超純水和流感病毒RNA模板,所述的RT-LAMP引物包括外引物F3與B3、內(nèi)引物FIP與BIP;其中引物的序列分別為:F3TCTGGAGGGGTGAAAATGGAB3GTGCAACTGATCCCCTCAGFIPGCCCTCTGGGCAGCTGTTTGCGAAGGACAAGGGTTGCTTABIPAAGTCGAAACCCAGGAAACGCTAATGAGTGCTGACCGTGC;所述的2×反應(yīng)緩沖液包括Tris-HCL、KCL、MgSO4、(NH4)2SO4、Tween20、Betaine和dNTPs。以上所述的流感病毒RNA模板是使用病毒基因組DNA/RNA提取試劑盒提取的流感病毒RNA。以上所述的熒光目視檢測試劑采用鈣黃綠素?zé)晒庠噭瑹晒庠噭┰诜磻?yīng)前加入。以上所述的2×反應(yīng)緩沖液包括Tris-HCL35-50mM、KCL15-35mM、MgSO415-20mM、(NH4)2SO415-25mM、Tween200.4-0.8℅、Betaine1.5-3.0M和dNTPs2.5-4mM,其配制方法在pH為8.7條件下,將上述溶劑混合均勻獲得。一種流感病毒逆轉(zhuǎn)錄環(huán)介導(dǎo)等溫?cái)U(kuò)增試劑盒的應(yīng)用,用于檢測流感病毒以及疑似流感病變組織是否感染流感病毒,具體檢測步驟包括:(1)RT-LAMP引物的設(shè)計(jì)與合成(2)流感病毒RNA模板的提取(3)RT-LAMP反應(yīng)體系建立(4)RT-LAMP檢測方法。以上所述的RT-LAMP反應(yīng)體系建立以25μl計(jì),2×反應(yīng)緩沖液12.5μLEM1μLFIP40pmolBIP40pmolF35pmolB35pmol流感病毒RNA5μL超純水補(bǔ)足25μL。以上所述的RT-LAMP檢測方法是采用特異性檢測、敏感性檢測和熒光可視化檢測的方法。以上所述的RT-LAMP檢測方法采用LoopampLA-320C實(shí)時濁度儀進(jìn)行密閉全程監(jiān)控,反應(yīng)溫度為63℃、反應(yīng)在20-25分鐘間出現(xiàn)擴(kuò)增。本發(fā)明的實(shí)質(zhì)性特點(diǎn)和顯著的進(jìn)步是:1)特異性強(qiáng)本發(fā)明的RT-LAMP檢測方法特異性檢測出流感病毒,而所檢測的陰性對照病毒、陰性對照支原體和水對照均無陽性結(jié)果出來,與RT-PCR檢測結(jié)果一致。且操作簡便、快速獲得檢測結(jié)果、無需昂貴復(fù)雜的儀器,普通RT-PCR法需先進(jìn)行反轉(zhuǎn)錄(RT),然后再以RT產(chǎn)物為模板進(jìn)行PCR反應(yīng),使用了兩個反應(yīng)程序,而RT-LAMP方法可在一個反應(yīng)管內(nèi)同時完成兩個反應(yīng)程序,一個小時即可完成擴(kuò)增。2)靈敏度高提取的流感病毒RNA原始濃度為6.8ng/μL,普通RT-PCR檢測試劑盒的檢測限約為6.8×10-2ng/μL,而使用本發(fā)明檢測方法,檢測限約為6.8×10-3ng/μL,敏感性是普通RT-PCR方法的10倍。3)迅速獲得結(jié)果普通的RT-PCR整個過程在24小時左右才能得出結(jié)果,目前多數(shù)建立的RT-LAMP反應(yīng)方法在反應(yīng)結(jié)束后,須采用瓊脂糖凝膠電泳紫外線分析顯像來判定結(jié)果,從病毒基因組DNA/RNA提取到獲取試驗(yàn)結(jié)果,需要5-6小時左右。本發(fā)明提供的RT-LAMP檢測方法反應(yīng)在20分鐘左右出現(xiàn)擴(kuò)增,60分鐘內(nèi)即可完成擴(kuò)增,且結(jié)果判讀方式簡便:依據(jù)反應(yīng)管濁度值的變化情況即可判讀結(jié)果,擴(kuò)增反應(yīng)結(jié)束即可獲得試驗(yàn)結(jié)果,不需要再進(jìn)行瓊脂糖凝膠電泳紫外線顯像分析或者反應(yīng)結(jié)束后加入熒光染料來判讀結(jié)果,從病毒基因組DNA/RNA提取到獲得最終結(jié)果可在2-3小時內(nèi)完成。4)不造成污染目前RT-LAMP方法用于直接觀察的熒光染料為反應(yīng)后加入,而本發(fā)明的熒光染料是在反應(yīng)前加入的鈣黃綠素商用染料(非syber-green),檢測過程不需要開蓋,能有效避免氣溶膠污染實(shí)驗(yàn)環(huán)境。此外,本發(fā)明的RT-LAMP檢測方法在結(jié)果判定上,直接通過濁度儀檢測反應(yīng)管的濁度值來判定結(jié)果,可不進(jìn)行熒光染料法檢測結(jié)果或者進(jìn)行瓊脂糖凝膠電泳檢測結(jié)果,不需要開蓋,能有效避免污染。5)可實(shí)時定量本發(fā)明利用Tubidimeterreal-timeLA-320C濁度儀來實(shí)時分析RT-LAMP反應(yīng)過程,不同的標(biāo)準(zhǔn)樣品的濃度對應(yīng)的濁度值的時間繪制成的標(biāo)準(zhǔn)曲線,代入標(biāo)準(zhǔn)曲線方程,即可求出各時間的流感病毒拷貝數(shù),達(dá)到定量檢測產(chǎn)物的目的。附圖說明圖1是本發(fā)明RT-LAMP方法特異性檢測結(jié)果;其中試驗(yàn)病毒有豬流感病毒(SIV)和禽流感病毒(AIV);對照毒株有:豬瘟病毒(CSFV)、豬繁殖障礙與呼吸綜合征病毒(PRRSV)、圓環(huán)病毒2型(PCV2)、巴氏桿菌(Pm)、副豬嗜血桿菌(HPS)、豬支原體(MH),滅菌超純水作為陰性對照(Negative)。結(jié)果顯示,只有流感病毒反應(yīng)管出現(xiàn)濁度的上升曲線,6個對照反應(yīng)管和陰性對照反應(yīng)管均無擴(kuò)增。圖2是使用本發(fā)明RT-LAMP方法進(jìn)行的流感病毒敏感性檢測結(jié)果,圖3是普通RT-PCR檢測方法進(jìn)行的流感病毒敏感性檢測結(jié)果;其中1:6.8ng/μL;2:6.8×10-1ng/μL;3:6.8×10-2ng/μL;4:6.8×10-3ng/μL;5:6.8×10-4ng/μL;6:6.8×10-5ng/μL;7:6.8×10-6ng/μL;8:6.8×10-7ng/μL。流感病毒原始RNA的起始濃度為6.8ng/μL,經(jīng)10倍倍比連續(xù)稀釋后,進(jìn)行RT-LAMP和RT-PCR擴(kuò)增,結(jié)果顯示本發(fā)明的RT-LAMP法檢測限約為6.8×10-3ng/μL,而RT-PCR檢測限約為6.8×10-2ng/μL。圖4是加入熒光染料后肉眼觀察結(jié)果:左管為以流感病毒基因組RNA為模板的反應(yīng)情況,為陽性結(jié)果,右管為陰性對照的反應(yīng)情況,為陰性結(jié)果。圖5是本發(fā)明定量檢測流感病毒的標(biāo)準(zhǔn)曲線:利用不同的標(biāo)準(zhǔn)樣品的濃度對應(yīng)的濁度值對時間繪制成的標(biāo)準(zhǔn)曲線,代入標(biāo)準(zhǔn)曲線方程,即可進(jìn)行定量。具體實(shí)施方式1、材料的準(zhǔn)備豬流感病毒(SIV)、禽流感病毒(AIV)由廣西大學(xué)動物科學(xué)技術(shù)學(xué)院饋贈,對照毒株包括豬瘟病毒、豬繁殖障礙與呼吸綜合征病毒、豬圓環(huán)病毒2型,對照細(xì)菌包括巴氏桿菌、副豬嗜血桿菌、豬支原體,為市售疫苗毒株,或?yàn)閺V西獸醫(yī)研究所分離鑒定和保存。LAMP法RNA擴(kuò)增試劑盒購自北京藍(lán)譜生物科技有限公司,貨號SLP246,病毒基因組DNA/RNA提取試劑盒購自康為世紀(jì)生物科技有限公司,貨號CW0548。2、RT-LAMP引物的設(shè)計(jì)與合成根據(jù)GenBank中的流感病毒編碼非結(jié)構(gòu)蛋白NP1的基因序列,利用RT-LAMP法引物輔助設(shè)計(jì)軟件PrimerExplorerV4軟件設(shè)計(jì)一套RT-LAMP引物,其中F3、B3為外引物,F(xiàn)IP、BIP為內(nèi)引物,其中F3TCTGGAGGGGTGAAAATGGAB3GTGCAACTGATCCCCTCAGFIPGCCCTCTGGGCAGCTGTTTGCGAAGGACAAGGGTTGCTTABIPAAGTCGAAACCCAGGAAACGCTAATGAGTGCTGACCGTGC;3、病毒DNA/RNA提取或細(xì)菌基因組DNA提取使用病毒基因組DNA/RNA提取試劑盒,提取流感病毒RNA以及對照病毒毒株的病毒基因組DNA/RNA,或者疑似流感病變組織的RNA,使用細(xì)菌基因組提取試劑盒(北京康為試劑,貨號CW0552)提取對照菌株的基因組DNA。4、RT-LAMP反應(yīng)體系建立按照試劑盒說明書,按25μl體系配置:2×反應(yīng)緩沖液12.5μLEM1μLFIP40pmolBIP40pmolF35pmolB35pmol流感病毒RNA5μL超純水補(bǔ)足25μL。RT-LAMP反應(yīng)在以實(shí)時濁度儀(LA-320C,日本榮研公司)進(jìn)行密閉全程監(jiān)控的形式監(jiān)測本方法的檢出情況,濁度儀實(shí)時監(jiān)控?cái)U(kuò)增情況,可繪制標(biāo)準(zhǔn)曲線,通過獲得未知樣品達(dá)到0.1濁度值對應(yīng)的時間值,即可從標(biāo)準(zhǔn)曲線上計(jì)算出該樣品的起始拷貝數(shù),反應(yīng)溫度為63℃。5、RT-LAMP檢測方法1)特異性檢測使用病毒基因組DNA/RNA提取試劑盒分別提取流感病毒、豬繁殖障礙與呼吸綜合征病毒、圓環(huán)病毒2型的基因組DNA/RNA。使用細(xì)菌基因組DNA提取試劑盒提取巴氏桿菌、副豬嗜血桿菌、豬支原體的基因組DNA,作為RT-LAMP反應(yīng)的模板,同時進(jìn)行各毒株和菌株的RT-LAMP擴(kuò)增,同時以水作為陰性對照,檢驗(yàn)RT-LAMP方法的特異性。2)敏感性檢測測定流感病毒RNA的起始濃度,用RNA-FreeWater連續(xù)10倍倍比稀釋成8個稀釋度,以各RNA稀釋度作為模板,同時進(jìn)行RT-LAMP擴(kuò)增和RT-PCR擴(kuò)增,對比兩種檢測方法的敏感性。3)熒光可視化檢測根據(jù)濁度儀監(jiān)控優(yōu)化的條件,在反應(yīng)前加入鈣黃綠素商用染料,63℃下反應(yīng)60分鐘后,在紫外燈下觀察,不采用瓊脂糖凝膠電泳紫外線分析顯像,避免開蓋跑電泳觀察造成的氣溶膠污染實(shí)驗(yàn)室。實(shí)施例1RT-LAMP檢測方法的特異性結(jié)果結(jié)果如圖1所示,流感病毒反應(yīng)管在20分鐘左右出現(xiàn)濁度的上升曲線,為陽性結(jié)果,6株對照毒株反應(yīng)管和陰性對照反應(yīng)管曲線均無擴(kuò)增情況出現(xiàn),為陰性結(jié)果。實(shí)施例2RT-LAMP檢測方法的敏感性結(jié)果流感病毒原始RNA的起始濃度為6.8ng/μL,經(jīng)10倍倍比連續(xù)稀釋后,進(jìn)行RT-LAMP和RT-PCR擴(kuò)增,結(jié)果如圖2和圖3所示,結(jié)果顯示本發(fā)明的RT-LAMP法檢測限約為6.8×10-3ng/μL,而普通RT-PCR法檢測限為6.8×10-2ng/μL。實(shí)施例3RT-LAMP檢測方法的熒光可視化檢測結(jié)果根據(jù)濁度儀監(jiān)控優(yōu)化的條件,反應(yīng)前加入熒光染料,63℃反應(yīng)60分鐘后,在紫外燈下觀察,圖4為觀察結(jié)果,左管為以流感病毒為模板的反應(yīng)情況,為陽性結(jié)果,右管為陰性對照,為陰性結(jié)果。試驗(yàn)結(jié)果表明,本發(fā)明建立的RT-LAMP方法方便基層使用,只需使用試劑盒配合本方法設(shè)計(jì)的RT-LAMP引物,加入樣品后,用低廉的水浴鍋來保持63℃60分鐘,即可快速觀察結(jié)果,且無需開蓋,避免了污染。實(shí)施例4RT-LAMP檢測流感病毒定量標(biāo)準(zhǔn)曲線的繪制以流感病毒RNA為模板,用RNA-FreeWater進(jìn)行連續(xù)10倍倍比稀釋,各稀釋度溶液作為標(biāo)準(zhǔn)樣品,進(jìn)行RT-LAMP擴(kuò)增。設(shè)置對照:濃度為0.68×101ng/μL、0.68×100ng/μL、0.68×10-1ng/μL、0.68×10-2ng/μL標(biāo)準(zhǔn)樣品各一個,因?yàn)闃?biāo)準(zhǔn)樣品濃度的負(fù)對數(shù)值與其擴(kuò)增濁度值為0.1的時間值成線性關(guān)系,可以將濁度儀捕捉到的值與時間(如表1)做成標(biāo)準(zhǔn)曲線,獲得標(biāo)準(zhǔn)曲線方程,y=0.3014x-8.1342,如圖5所示。從標(biāo)準(zhǔn)曲線方程來看相關(guān)系數(shù)R2為0.9945,呈良好的線性關(guān)系。以時間為X值,可求出Y值即濃度的負(fù)次方數(shù),則濃度為10-y,再乘以基數(shù)0.68,即為0.68×10-yng/μL。如某試驗(yàn)樣品達(dá)到濁度值為0.1的時間為30分鐘時,帶入所建立的標(biāo)準(zhǔn)曲線方程,求出Y等于0.9078,則濃度為10-0.9078,再乘以基數(shù)0.68,即為該樣品的濃度0.68×10-0.9078ng/μL,從而達(dá)到定量的效果。表1時間(min)23.926.929.933.9標(biāo)準(zhǔn)值(-LOG)-1012<110>廣西壯族自治區(qū)獸醫(yī)研究所<120>一種流感病毒逆轉(zhuǎn)錄環(huán)介導(dǎo)等溫?cái)U(kuò)增試劑盒及其應(yīng)用<160>4<210>1<211>20<212>DNA<213>人工序列<400>1TCTGGAGGGGTGAAAATGGA<210>2<211>19<212>DNA<213>人工序列<400>2GTGCAACTGATCCCCTCAG<210>3<211>40<212>DNA<213>人工序列<400>3GCCCTCTGGGCAGCTGTTTGCGAAGGACAAGGGTTGCTTA<210>4<211>40<212>DNA<213>人工序列<400>4AAGTCGAAACCCAGGAAACGCTAATGAGTGCTGACCGTGC當(dāng)前第1頁1 2 3
