預(yù)示間充質(zhì)干細胞定向分化潛能的標志物、試劑及試劑盒的制作方法
本發(fā)明屬于干細胞領(lǐng)域,涉及預(yù)示間充質(zhì)干細胞定向分化潛能的標志物、試劑及試劑盒。
背景技術(shù):
間充質(zhì)干細胞(mesenchymal stem cells,MSCs)是一種多潛能成體干細胞,在人體發(fā)生、發(fā)育過程中存在于許多種組織中。20世紀70年代中期,F(xiàn)riedenstein等人[Friedenstein A J,Gorskaja J F,Kulagina N N.Fibroblast precursors in normal and irradiated mouse hematopoietic organs.Exp Hematol,1976,4(5):267-274]從骨髓中獲得了少數(shù)能貼壁生長的細胞,這些細胞能分化為成骨或軟骨樣的沉著物,該發(fā)現(xiàn)被認為首次證實了MSCs的存在。目前,已經(jīng)從成人的多種間充質(zhì)組織中分離得到MSCs,這些細胞在體外可以擴增并且可以分化為骨、軟骨、骨髓基質(zhì)、肌腱、韌帶、脂肪等多種結(jié)締組織細胞,以及骨骼肌細胞、神經(jīng)細胞和神經(jīng)膠質(zhì)細胞等等[Reyes M,Lund T,Lenvik T,et al.Purification and ex vivo expansion ofpostnatal human marrow mesodermal progenitor cells.Blood,2001,98:2615-2625]。而且,不論是自體的還是同種異源的MSCs一般都不會引起宿主的免疫反應(yīng)[Barry F P,Murphy J M.Mesenchymal stem cells:clinical applications and biological characterization.Int J Biochem Cell Biol,2004,36(4):568-584]。因此,MSCs可以作為組織工程的種子細胞,用于組織構(gòu)建以治療一些機體無法自然修復(fù)的組織細胞損傷,有著良好的臨床應(yīng)用前景。
MSCs的分化潛能有大量研究報道。一方面,體外實驗顯示在特定培養(yǎng)條件下,MSCs可分化為中胚層起源的成骨細胞、軟骨細胞、脂肪細胞、骨骼肌細胞、心肌細胞;內(nèi)胚層起源的肝細胞、胰島β細胞;外胚層起源的視網(wǎng)膜細胞、神經(jīng)細胞和神經(jīng)膠質(zhì)細胞等。另一方面,動物實驗和臨床表明,將全骨髓或初步純化的骨髓MSCs移植入損傷或轉(zhuǎn)基因動物及病人體內(nèi),骨髓干細胞可遷移并分化為骨骼肌細胞、心肌細胞、肝細胞、膽管細胞、表皮細胞、消化管細胞、肺泡細胞、胰島β細胞、腎細胞、神經(jīng)細胞和神經(jīng)膠質(zhì)細胞等[Grove J E,Bruscia E,Krause D S.Plasticity ofbone marrow-derived stem cells.Stem Cells,2004,22(4):487-500]。
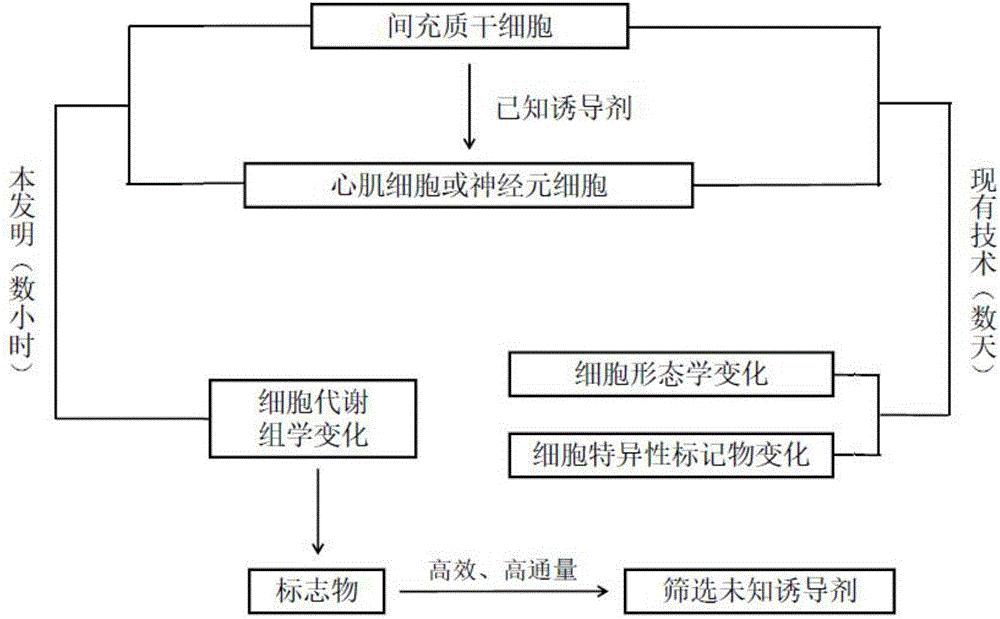
由于MSCs的增殖能力和定向誘導(dǎo)分化潛能,使其在矯形外科、心血管和神經(jīng)系統(tǒng)等疾病的治療中均顯示出良好的應(yīng)用前景。研究者試圖篩選出能體外誘導(dǎo)MSCs定向分化的誘導(dǎo)試劑,以有效控制MSCs的分化方向,獲得目標細胞或組織。目前,通常是用待篩選試劑對MSCs體外處理后,培養(yǎng)若干天,通過鑒別培養(yǎng)出的細胞是否具有靶細胞的生物學(xué)特點,確定該試劑是否具有誘導(dǎo)MSCs定向分化為目標細胞的能力。這種方法的缺點在于篩選時間長,篩選效率低,不適合高通量篩選。
細胞代謝組學(xué)可鑒定生化反應(yīng)的產(chǎn)物-內(nèi)源性小分子,揭示一個活細胞中所運轉(zhuǎn)的不同通路之間的聯(lián)系,并可反映和評價健康和病理機體之間的生化差異,反過來可為藥物干預(yù)提供一個方向。細胞代謝組學(xué)分析可定性、定量地描述胞內(nèi)調(diào)控的最終產(chǎn)物,這些產(chǎn)物是生物系統(tǒng)對遺傳因素或外界環(huán)境改變的最終應(yīng)答。細胞代謝組學(xué)研究表明,在強大的細胞代謝網(wǎng)絡(luò)中,生化途徑的能動行為可由一個高度互聯(lián)的調(diào)節(jié)系統(tǒng)來控制。目前細胞代謝組學(xué)已經(jīng)在多種領(lǐng)域得到應(yīng)用,如毒理學(xué)[Predicting human developmental toxicity ofpharmaceuticals using human embryonic stem cells and metabolomics,Toxicol Appl Pharmacol.2010;247(1):18-27]、藥效評價[Metabolic profiling of HepG2cells incubated with S(-)and R(+)enantiomers of anti-coagulating drug warfarin.Metabolomics,2011,7(3):353-362]、細胞培養(yǎng)監(jiān)測[Metabolomics:a valuable tool for stem cell monitoring in regenerative medicine.Journal of the Royal Society Interface,2012,9(73):1713-24]、新藥研究[Pharmacometabolomics of docetaxel-treated human MCF7breast cancer cells provides evidence of varying cellular responses at high and low doses.Breast Cancer Research and Treatment,2010,120(3):613-626]、生物制藥生產(chǎn)[LC-MS-based metabolic characterization of high monoclonal antibody-producing Chinese hamster ovary cells.Biotechnology and Bioengineering,2012,109(12):3103–3111]等。與其他方法相比,體外細胞代謝組學(xué)表現(xiàn)出更多的優(yōu)勢,如容易控制實驗變化、高度重現(xiàn)性、低成本、結(jié)果更易解釋等。
如果能通過細胞代謝組學(xué)的方法發(fā)現(xiàn)MSCs在誘導(dǎo)分化前、后胞內(nèi)代謝物的差異,尋找到可以預(yù)測MSCs定向分化潛能的標志物,就有可能在MSCs經(jīng)誘導(dǎo)試劑處理后迅速得知該誘導(dǎo)試劑的定向誘導(dǎo)效果,而不用培養(yǎng)數(shù)天后通過細胞生物學(xué)特點才能得出結(jié)論,必然可以提高篩選定向分化誘導(dǎo)試劑的效率,實現(xiàn)高通量篩選。
技術(shù)實現(xiàn)要素:
本發(fā)明旨在提供一種預(yù)示間充質(zhì)干細胞定向分化潛能的標志物、試劑及試劑盒,以即時預(yù)測經(jīng)定向誘導(dǎo)處理的MSCs是否具備定向分化為目標細胞的能力,不用培養(yǎng)數(shù)天后通過細胞生物學(xué)特點才能得出結(jié)論,進而提高篩選定向分化誘導(dǎo)試劑的效率,實現(xiàn)高通量篩選。
技術(shù)方案公布如下:
一組用于預(yù)示間充質(zhì)干細胞定向分化為心肌樣細胞的潛能的標志物,由α-酮戊二酸、磷酸二羥丙酮、天冬酰胺和花生四烯酸組成。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一種用于預(yù)示間充質(zhì)干細胞定向分化為心肌樣細胞的潛能的試劑,含有上述的標志物。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一種用于預(yù)示間充質(zhì)干細胞定向分化為心肌樣細胞的潛能的試劑盒,含有上述的標志物。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一種篩選能誘導(dǎo)間充質(zhì)干細胞分化為心肌樣細胞的誘導(dǎo)劑的方法:測定該誘導(dǎo)劑誘導(dǎo)處理后的間充質(zhì)干細胞中α-酮戊二酸、磷酸二羥丙酮、天冬酰胺和花生四烯酸的含量,并與未經(jīng)誘導(dǎo)處理的間充質(zhì)干細胞比較,需同時滿足α-酮戊二酸上調(diào)≥4.3倍、磷酸二羥丙酮上調(diào)≥3.6倍、天冬酰胺上調(diào)≥1.7倍、花生四烯酸上調(diào)≥2.1倍。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一組用于預(yù)示間充質(zhì)干細胞定向分化為神經(jīng)元樣細胞的潛能的標志物,由苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸組成。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一種用于預(yù)示間充質(zhì)干細胞定向分化為神經(jīng)元樣細胞的潛能的試劑,含有上述的標志物。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一種用于預(yù)示間充質(zhì)干細胞定向分化為神經(jīng)元樣細胞的潛能的試劑盒,含有上述標志物。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
一種篩選能誘導(dǎo)間充質(zhì)干細胞分化為神經(jīng)元樣細胞的誘導(dǎo)劑的方法:測定該誘導(dǎo)劑誘導(dǎo)處理后的間充質(zhì)干細胞中苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸的含量,并與未經(jīng)誘導(dǎo)處理的間充質(zhì)干細胞比較,需同時滿足苯丙氨酸上調(diào)≥3.7倍、半胱氨酸上調(diào)≥3.2倍、磷酸烯醇式丙酮酸上調(diào)≥2.5倍、草酰乙酸上調(diào)≥3.4倍。
進一步地,所述間充質(zhì)干細胞為骨髓間充質(zhì)干細胞。
發(fā)明效果:
本發(fā)明創(chuàng)造提供的標志物α-酮戊二酸、磷酸二羥丙酮、天冬酰胺和花生四烯酸可以聯(lián)合作為預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為心肌細胞的潛能的標志物,準確性高,效率高;本發(fā)明標志物苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸可以聯(lián)合作為預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為神經(jīng)元樣細胞的潛能的標志物,準確性高,效率高。
附圖說明
圖1為本發(fā)明標志物發(fā)現(xiàn)和驗證方法邏輯框圖。
具體實施方式
下面結(jié)合具體實施例介紹本發(fā)明的技術(shù)方案。下述實施例中未特別強調(diào)的實驗材料均為常規(guī)實驗材料,無特別要求,都是本領(lǐng)域技術(shù)人員容易獲得的常規(guī)材料。
實施例1:預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為心肌細胞的潛能的標志物發(fā)現(xiàn)
一、實驗依據(jù)(誘導(dǎo)劑:5-氮雜胞苷、血管緊張素Ⅱ、二甲基亞砜)
5-氮雜胞苷[李雪等,5-氮雜胞苷誘導(dǎo)大鼠骨髓間充質(zhì)干細胞分化為心肌細胞的實驗研究,心臟雜志2004,15(6)]、血管緊張素Ⅱ[石靜寶等,不同濃度血管緊張素Ⅱ誘導(dǎo)骨髓間充質(zhì)干細胞向心肌細胞的定向分化,中國組織工程研究第18卷第50期]、二甲基亞砜[孫龍云,二甲基亞砜誘導(dǎo)骨髓間充質(zhì)干細胞向心肌細胞的分化,中國組織工程研究第20卷第1期]是本領(lǐng)域公認的可以誘導(dǎo)骨髓間充質(zhì)干細胞BMSCs定向分化為心肌細胞的誘導(dǎo)劑。因此,本實施例選擇這三種物質(zhì)作為誘導(dǎo)劑,通過細胞代謝組學(xué)的方法測定BMSCs誘導(dǎo)前后的差異代謝物,尋找可以預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為心肌細胞的潛能的標志物。
二、實驗方法
1、BMSCs的分離培養(yǎng)
將大鼠移至無菌操作間內(nèi),用無菌器械剝離出四肢長骨,保留骨骺端。用含有雙抗(青霉素105U/L,鏈霉素100mg/L)的D-Hank’s液沖洗大鼠長骨兩次。另取一套無菌器械去除長骨骨骺端顯露骨髓腔,以IMDM培養(yǎng)基(含體積分數(shù)10%胎牛血清)反復(fù)沖洗骨髓腔,收集沖洗液經(jīng)無菌濾膜過濾,取一滴細胞懸液加入10μL 0.04%錐蟲藍混勻,血細胞計數(shù)板計數(shù)活細胞,然后調(diào)整接種細胞濃度為1×104L-1,接種于無菌培養(yǎng)瓶中,置于37℃、體積分數(shù)5%CO2的恒溫培養(yǎng)箱中培養(yǎng)。12h后半量換液,輕柔操作,仔細觀察細胞貼壁情況,至24h完全更換培養(yǎng)基。此后每隔2d換液,當貼壁細胞均勻鋪滿瓶底90%時,即進行傳代。
2、BMSCs的分組和體外誘導(dǎo)
A:5-氮雜胞苷體外誘導(dǎo)。將生長良好、形態(tài)均一的第2代大鼠骨髓間充質(zhì)干細胞培養(yǎng)48h后,去除培養(yǎng)基,PBS洗滌2次以除凈殘余生長培養(yǎng)基,分為添加10μmol/L誘導(dǎo)劑5-氮雜胞苷的5-氮雜胞苷誘導(dǎo)組和不加誘導(dǎo)劑的空白對照A組。5-氮雜胞苷誘導(dǎo)組、空白對照A組分別設(shè)23個重復(fù),其中3個重復(fù)誘導(dǎo)24h后,去除誘導(dǎo)培養(yǎng)基,加入不含誘導(dǎo)劑的普通培養(yǎng)基繼續(xù)培養(yǎng)4周,用于傳統(tǒng)指標的觀察,以確保5-氮雜胞苷可以成功誘導(dǎo)骨髓間充質(zhì)干細胞分化為心肌樣細胞。剩余20個重復(fù)分別編號為5-AT 1~20和Blank A 1~20,誘導(dǎo)培養(yǎng)24h后對細胞進行處理用于代謝分析,處理及分析方法見下。
B:血管緊張素Ⅱ體外誘導(dǎo)。將生長良好、形態(tài)均一的第2代大鼠骨髓間充質(zhì)干細胞培養(yǎng)48h后,去除培養(yǎng)基,PBS洗滌2次以除凈殘余生長培養(yǎng)基,分為添加0.2μmol/L誘導(dǎo)劑血管緊張素Ⅱ的血管緊張素Ⅱ誘導(dǎo)組和不加誘導(dǎo)劑的空白對照B組。血管緊張素Ⅱ誘導(dǎo)組、空白對照B組分別設(shè)23個重復(fù),其中3個重復(fù)誘導(dǎo)24h后,去除誘導(dǎo)培養(yǎng)基,加入不含誘導(dǎo)劑的普通培養(yǎng)基繼續(xù)培養(yǎng)4周,用于傳統(tǒng)指標的觀察,以確保血管緊張素Ⅱ可以成功誘導(dǎo)骨髓間充質(zhì)干細胞分化為心肌樣細胞。剩余20個重復(fù)分別編號為ANT 1~20和Blank B 1~20,誘導(dǎo)培養(yǎng)24h后對細胞進行處理用于代謝分析,處理及分析方法見下。
C:二甲基亞砜體外誘導(dǎo)。將生長良好、形態(tài)均一的第2代大鼠骨髓間充質(zhì)干細胞培養(yǎng)48h后,去除培養(yǎng)基,PBS洗滌2次以除凈殘余生長培養(yǎng)基,分為添加1.0%誘導(dǎo)劑二甲基亞砜的二甲基亞砜誘導(dǎo)組和不加誘導(dǎo)劑的空白對照C組。二甲基亞砜誘導(dǎo)組、空白對照C組分別設(shè)23個重復(fù),其中3個重復(fù)誘導(dǎo)24h后,去除誘導(dǎo)培養(yǎng)基,加入不含誘導(dǎo)劑的普通培養(yǎng)基繼續(xù)培養(yǎng)4周,用于傳統(tǒng)指標的觀察,以確保二甲基亞砜可以成功誘導(dǎo)骨髓間充質(zhì)干細胞分化為心肌樣細胞。剩余20個重復(fù)分別編號為DMSO 1~20和Blank C 1~20,誘導(dǎo)培養(yǎng)24h后對細胞進行處理用于代謝分析,處理及分析方法見下。
訓(xùn)練集:5-AT 1~20和Blank A 1~20、ANT 1~20和Blank B 1~20、DMSO 1~20和Blank C1~20共同組成訓(xùn)練集。
3、細胞樣品的取出和前處理
各誘導(dǎo)組和空白組誘導(dǎo)培養(yǎng)24h后將細胞消化制成不含誘導(dǎo)劑的單細胞懸液,調(diào)整細胞濃度為1×106個/mL,轉(zhuǎn)到凍存管中(每管1.5mL),加入100μL血清和100μLDMSO,最終放在-80℃冰箱保存。
將凍存在-80℃的細胞樣品取出來,迅速放在37℃溫水中恒溫解凍,25℃條件下3000rpm離心5min;將上清的培養(yǎng)基去掉,沉淀加入1mL的PBS溶液搖晃潤洗30s使之懸浮,同樣采取上述條件離心后,棄去上清液;上述沉淀再次加入1.5mL的PBS搖晃30s懸浮后,再經(jīng)過上述條件離心后,去掉上清PBS溶液;加入-80℃甲醇0.5mL,對細胞樣品進行破碎提取;將樣品放在-80℃冰箱30min,取出使之溶化,置超聲儀中超聲1min;再于4℃條件10000rpm離心10min,取上清,氮氣常溫吹干樣品,置-80℃冰箱保存;進樣前30min將樣品取出,以100μL的10%乙腈復(fù)溶后,4℃條件10000rpm離心10min,取上清進樣分析。
4、細胞樣品LC-MS分析條件
色譜系統(tǒng):Waters Acquity HPLC/Q-TOF;
色譜柱:Phenomenex Luna C18(4.6mm×150mm×3μm);
流動相:A相為水(含5mM己胺,乙酸調(diào)節(jié)pH至5.5);B相為乙腈-水(乙腈和水體積比為8:2;水中含20mM乙酸銨,氨水調(diào)節(jié)pH至8.5);
梯度條件:0-20min,10-25%B;20-35min,25-95%B;35-40min,95%B;40-45min,95-10%B;45-50min,10%B;
流速:0.8mL/min;柱溫:35℃;
MS條件:Q-TOF/MS ESI離子源,負離子模式,掃描范圍m/z 50-1500;毛細管電壓3.0kV,錐孔電壓35kV,離子源溫度100℃,干燥氣溫度為350℃,流速800L/h,錐孔氣流量50L/h。
5、誘導(dǎo)組與空白對照組差異代謝物的篩選
定性分析。將LC-MS得到的數(shù)據(jù)導(dǎo)入SIMCA軟件(version 13.0.2,Umetrics)進行多元統(tǒng)計分析。通過建立OPLS-DA模型,尋找誘導(dǎo)組(包括樣品5-AT 1~20、ANT 1~20和DMSO1~20,共60個樣品)和空白對照組(包括樣品Blank A 1~20、Blank B 1~20和Blank C 1~20,共60個樣品)之間代謝輪廓貢獻較大(VIP>1.0且p<0.01)的代謝物,然后將這些代謝物的分子量數(shù)據(jù)提交至在線數(shù)據(jù)庫KEGG(http://wwwkeg.com)、METLIN(http://www.metlin.scipps.edu)、HMDB(http://www.hmdb.ca)搜尋,解析化合物質(zhì)譜,對化合物進行結(jié)構(gòu)鑒定,最終通過這些化合物標準品確證差異代謝物的結(jié)構(gòu)。
定量分析。通過Q-q-Q質(zhì)譜對差異代謝物定量分析,統(tǒng)計誘導(dǎo)組中差異代謝物相對于空白對照組的變化倍數(shù)。
6、用測試集驗證標志物
測試集樣品的制備:按照訓(xùn)練集樣品的制備方法,制備測試集樣品,包括誘導(dǎo)組5-AT31~90、ANT 31~90、DMSO 31~90和空白對照組Blank A 31~90、Blank B 31~90和Blank C31~90,共180個誘導(dǎo)樣品和180個空白對照樣品。
用上述差異代謝物區(qū)分誘導(dǎo)樣品和空白樣品的能力,得到可以用于區(qū)分誘導(dǎo)樣品和空白對照樣品進而用于預(yù)示骨髓間充質(zhì)干細胞定向分化為心肌細胞的潛能的標志物。
三、實驗結(jié)果
1、原代骨髓間充質(zhì)干細胞形態(tài)
骨髓懸液中原代細胞呈懸浮狀態(tài),大小不一,數(shù)目較多,并混有大量紅細胞;接種24h后,可見有少部分細胞貼壁,多呈類圓形或紡錘形,換液后去除未貼壁的細胞。此后每隔2d換液,貼壁細胞逐漸伸出突起,呈扁平三角形或多邊形,核大而飽滿。10d后細胞胞體呈現(xiàn)典型的成纖維細胞狀,核圓形或橢圓形,位于細胞中心,多數(shù)細胞排布規(guī)則呈放射狀生長。14d左右細胞集落融合超過90%時即可傳代。傳代后的細胞生長迅速,排列較為一致。
2、體外誘導(dǎo)四周后形態(tài)學(xué)和標記物變化
2.1形態(tài)學(xué)變化
第2代骨髓間充質(zhì)干細胞經(jīng)5-氮雜胞苷、血管緊張素Ⅱ、二甲基亞砜誘導(dǎo)后,細胞形態(tài)漸漸出現(xiàn)與空白對照A、B、C組不同的形態(tài)。各誘導(dǎo)組的骨髓間充質(zhì)干細胞誘導(dǎo)7d時形態(tài)轉(zhuǎn)變成類長柱形,28d時細胞體積變小,細胞呈片狀生長,排列一致,呈心肌樣特征。對照組未見類似上述改變,隨換液和傳代次數(shù)增多,對照組中細胞大部分為梭形。
2.2免疫細胞化學(xué)變化
各誘導(dǎo)組的骨髓間充質(zhì)干細胞誘導(dǎo)28d時,心肌特異性標記物cTnT、cTnI均呈陽性表達,空白對照A、B、C組心肌特異性標記物cTnT、cTnI均呈陰性表達。
各組心肌特異性抗原陽性細胞百分比見下表。
結(jié)果表明,5-氮雜胞苷、血管緊張素Ⅱ、二甲基亞砜可以有效誘導(dǎo)骨髓間充質(zhì)干細胞體外分化成心肌細胞,為有效誘導(dǎo)劑。
3、誘導(dǎo)組與空白對照組差異代謝物的篩選
通過定性和定量結(jié)果發(fā)現(xiàn):與空白對照組相比,誘導(dǎo)組中α-酮戊二酸上調(diào)4.3~4.9倍,磷酸二羥丙酮上調(diào)3.6~4.4倍,天冬酰胺上調(diào)1.7~2.4倍,花生四烯酸上調(diào)2.1~2.7倍。
4、測試集驗證結(jié)果
從測試集中,隨機選擇30個空白對照樣品,測定其中α-酮戊二酸、磷酸二羥丙酮、天冬酰胺和花生四烯酸的含量各自取均值作為空白參考值。其余測試集樣品隨機分析,且分析人員不知道其分析的樣品是誘導(dǎo)樣品還是空白對照樣品,如果該樣品與空白參考值相比同時符合下述條件即歸為誘導(dǎo)樣品,否則為空白對照樣品:α-酮戊二酸上調(diào)≥4.3倍、磷酸二羥丙酮上調(diào)≥3.6倍、天冬酰胺上調(diào)≥1.7倍、花生四烯酸上調(diào)≥2.1倍。
結(jié)果發(fā)現(xiàn),該方法準確性非常高,能準確區(qū)分150個樣品為誘導(dǎo)樣品還是空白對照樣品,準確率100%,證明α-酮戊二酸、磷酸二羥丙酮、天冬酰胺和花生四烯酸可以聯(lián)合作為預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為心肌細胞的潛能的標志物。
該實施例表明:α-酮戊二酸、磷酸二羥丙酮、天冬酰胺和花生四烯酸聯(lián)合預(yù)示價值非常高,可以作為預(yù)示BMSCs定向分化為心肌細胞的潛能的標志物,用于高通量篩選可以誘導(dǎo)BMSCs定向分化為心肌細胞的誘導(dǎo)劑,效率高,不需等待數(shù)周才能獲知誘導(dǎo)結(jié)果。
發(fā)明人還考察了BMSCs不同培養(yǎng)基(含15%胎牛血清的DMEM培養(yǎng)液)對標志物結(jié)果的影響,結(jié)果證明不同培養(yǎng)基并不影響上述結(jié)果。
實施例2:預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為神經(jīng)細胞的潛能的標志物發(fā)現(xiàn)
一、實驗依據(jù)(誘導(dǎo)劑:紅景天苷、全反式維甲酸、甲鈷胺)
紅景天苷[張全偉等,紅景天苷體外誘導(dǎo)大鼠骨髓間充質(zhì)干細胞分化為神經(jīng)元樣細胞,中國組織工程研究第16卷第14期]、全反式維甲酸[張全偉等,紅景天苷體外誘導(dǎo)大鼠骨髓間充質(zhì)干細胞分化為神經(jīng)元樣細胞,中國組織工程研究第16卷第14期]、甲鈷胺[羊明智等,甲鈷胺體外誘導(dǎo)大鼠骨髓間充質(zhì)干細胞向神經(jīng)元樣細胞分化,中國組織工程研究第17卷第32期]是本領(lǐng)域公認的可以誘導(dǎo)骨髓間充質(zhì)干細胞BMSCs定向分化為神經(jīng)元細胞的誘導(dǎo)劑。因此,本實施例選擇這三種物質(zhì)作為誘導(dǎo)劑,通過細胞代謝組學(xué)的方法測定BMSCs誘導(dǎo)前后的差異代謝物,尋找可以預(yù)示BMSCs定向分化為神經(jīng)元樣細胞的潛能的標志物。
二、實驗方法
1、BMSCs的分離培養(yǎng)
將大鼠移至無菌操作間內(nèi),用無菌器械剝離出四肢長骨,保留骨骺端。用含有雙抗(青霉素105U/L,鏈霉素100mg/L)的D-Hank’s液沖洗大鼠長骨兩次。另取一套無菌器械去除長骨骨骺端顯露骨髓腔,以IMDM培養(yǎng)基(含體積分數(shù)10%胎牛血清)反復(fù)沖洗骨髓腔,收集沖洗液經(jīng)無菌濾膜過濾,取一滴細胞懸液加入10μL 0.04%錐蟲藍混勻,血細胞計數(shù)板計數(shù)活細胞,然后調(diào)整接種細胞濃度為1×104L-1,接種于無菌培養(yǎng)瓶中,置于37℃、體積分數(shù)5%CO2的恒溫培養(yǎng)箱中培養(yǎng)。12h后半量換液,輕柔操作,仔細觀察細胞貼壁情況,至24h完全更換培養(yǎng)基。此后每隔2d換液,當貼壁細胞均勻鋪滿瓶底90%時,即進行傳代。
2、BMSCs的分組和體外誘導(dǎo)
A:紅景天苷體外誘導(dǎo)。將生長良好、形態(tài)均一的第2代大鼠骨髓間充質(zhì)干細胞培養(yǎng)48h后,去除培養(yǎng)基,PBS洗滌2次以除凈殘余生長培養(yǎng)基,分為添加20mg/L誘導(dǎo)劑紅景天苷的紅景天苷誘導(dǎo)組和不加誘導(dǎo)劑的空白對照D組。紅景天苷誘導(dǎo)組、空白對照D組分別設(shè)23個重復(fù),其中3個重復(fù)誘導(dǎo)24h后,去除誘導(dǎo)培養(yǎng)基,加入不含誘導(dǎo)劑的普通培養(yǎng)基繼續(xù)培養(yǎng)6天,用于傳統(tǒng)指標的觀察,以確保紅景天苷可以成功誘導(dǎo)骨髓間充質(zhì)干細胞分化為神經(jīng)元樣細胞。剩余20個重復(fù)分別編號為HJTG 1~20和Blank D 1~20,誘導(dǎo)培養(yǎng)24h后對細胞進行處理用于代謝分析,處理及分析方法見下。
B:全反式維甲酸體外誘導(dǎo)。將生長良好、形態(tài)均一的第2代大鼠骨髓間充質(zhì)干細胞培養(yǎng)48h后,去除培養(yǎng)基,PBS洗滌2次以除凈殘余生長培養(yǎng)基,分為添加5μg/L誘導(dǎo)劑維甲酸的維甲酸誘導(dǎo)組和不加誘導(dǎo)劑的空白對照E組。維甲酸誘導(dǎo)組、空白對照E組分別設(shè)23個重復(fù),其中3個重復(fù)誘導(dǎo)24h后,去除誘導(dǎo)培養(yǎng)基,加入不含誘導(dǎo)劑的普通培養(yǎng)基繼續(xù)培養(yǎng)6天,用于傳統(tǒng)指標的觀察,以確保維甲酸可以成功誘導(dǎo)骨髓間充質(zhì)干細胞分化為神經(jīng)元樣細胞。剩余20個重復(fù)分別編號為WJS 1~20和Blank E 1~20,誘導(dǎo)培養(yǎng)24h后對細胞進行處理用于代謝分析,處理及分析方法見下。
C:甲鈷胺體外誘導(dǎo)。將生長良好、形態(tài)均一的第2代大鼠骨髓間充質(zhì)干細胞培養(yǎng)48h后,去除培養(yǎng)基,PBS洗滌2次以除凈殘余生長培養(yǎng)基,分為添加100mg/L誘導(dǎo)劑甲鈷胺的甲鈷胺誘導(dǎo)組和不加誘導(dǎo)劑的空白對照F組。甲鈷胺誘導(dǎo)組、空白對照F組分別設(shè)23個重復(fù),其中3個重復(fù)誘導(dǎo)24h后,去除誘導(dǎo)培養(yǎng)基,加入不含誘導(dǎo)劑的普通培養(yǎng)基繼續(xù)培養(yǎng)6天,用于傳統(tǒng)指標的觀察,以確保甲鈷胺可以成功誘導(dǎo)骨髓間充質(zhì)干細胞分化為神經(jīng)元樣細胞。剩余20個重復(fù)分別編號為JKA 1~20和Blank F 1~20,誘導(dǎo)培養(yǎng)24h后對細胞進行處理用于代謝分析,處理及分析方法見下。
訓(xùn)練集:HJTG 1~20和Blank D 1~20、WJS 1~20和Blank E 1~20、JKA 1~20和Blank F 1~20共同組成訓(xùn)練集。
3、細胞樣品的取出和前處理
各誘導(dǎo)組和空白組誘導(dǎo)培養(yǎng)24h后將細胞消化制成不含誘導(dǎo)劑的單細胞懸液,調(diào)整細胞濃度為1×106個/mL,轉(zhuǎn)到凍存管中(每管1.5mL),加入100μL血清和100μLDMSO,最終放在-80℃冰箱保存。
將凍存在-80℃的細胞樣品取出來,迅速放在37℃溫水中恒溫解凍,25℃條件下3000rpm離心5min;將上清的培養(yǎng)基去掉,沉淀加入1mL的PBS溶液搖晃潤洗30s使之懸浮,同樣采取上述條件離心后,棄去上清液;上述沉淀再次加入1.5mL的PBS搖晃30s懸浮后,再經(jīng)過上述條件離心后,去掉上清PBS溶液;加入-80℃甲醇0.5mL,對細胞樣品進行破碎提取;將樣品放在-80℃冰箱30min,取出使之溶化,置超聲儀中超聲1min;再于4℃條件10000rpm離心10min,取上清,氮氣常溫吹干樣品,置-80℃冰箱保存;進樣前30min將樣品取出,以100μL的10%乙腈復(fù)溶后,4℃條件10000rpm離心10min,取上清進樣分析。
4、細胞樣品LC-MS分析條件
色譜系統(tǒng):Waters Acquity HPLC/Q-TOF;
色譜柱:Phenomenex Luna C18(4.6mm×150mm×3μm);
流動相:A相為水(含5mM己胺,乙酸調(diào)節(jié)pH至5.5);B相為乙腈-水(乙腈和水體積比為8:2;水中含20mM乙酸銨,氨水調(diào)節(jié)pH至8.5);
梯度條件:0-20min,10-25%B;20-35min,25-95%B;35-40min,95%B;40-45min,95-10%B;45-50min,10%B;
流速:0.8mL/min;柱溫:35℃;
MS條件:Q-TOF/MS ESI離子源,負離子模式,掃描范圍m/z 50-1500;毛細管電壓3.0kV,錐孔電壓35kV,離子源溫度100℃,干燥氣溫度為350℃,流速800L/h,錐孔氣流量50L/h。
5、誘導(dǎo)組與空白對照組差異代謝物的篩選
定性分析。將LC-MS得到的數(shù)據(jù)導(dǎo)入SIMCA軟件(version 13.0.2,Umetrics)進行多元統(tǒng)計分析。通過建立OPLS-DA模型,尋找誘導(dǎo)組(包括樣品HJTG 1~20、WJS 1~20和JKA1~20,共60個樣品)和空白對照組(包括樣品Blank D 1~20、Blank E 1~20和Blank F 1~20,共60個樣品)之間代謝輪廓貢獻較大(VIP>1.0且p<0.01)的代謝物,然后將這些代謝物的分子量數(shù)據(jù)提交至在線數(shù)據(jù)庫KEGG(http://wwwkeg.com)、METLIN(http://www.metlin.scipps.edu)、HMDB(http://www.hmdb.ca)搜尋,解析化合物質(zhì)譜,對化合物進行結(jié)構(gòu)鑒定,最終通過這些化合物標準品確證差異代謝物的結(jié)構(gòu)。
定量分析。通過Q-q-Q質(zhì)譜對差異代謝物定量分析,統(tǒng)計誘導(dǎo)組中上述差異代謝物相對于空白對照組的變化倍數(shù)。
6、用測試集驗證標志物
測試集樣品的制備:按照訓(xùn)練集樣品的制備方法,制備測試集樣品,包括誘導(dǎo)組HJTG31~90、WJS 31~90、JKA 31~90和空白對照組Blank D 31~90、Blank E 31~90和Blank F 31~90,共180個誘導(dǎo)樣品和180個空白對照樣品。
用上述差異代謝物區(qū)分誘導(dǎo)樣品和空白樣品的能力,得到可以用于區(qū)分誘導(dǎo)樣品和空白樣品進而用于預(yù)示骨髓間充質(zhì)干細胞定向分化為神經(jīng)元樣細胞的潛能的標志物。
三、實驗結(jié)果
1、原代骨髓間充質(zhì)干細胞形態(tài)
骨髓懸液中原代細胞呈懸浮狀態(tài),大小不一,數(shù)目較多,并混有大量紅細胞;接種24h后,可見有少部分細胞貼壁,多呈類圓形或紡錘形,換液后去除未貼壁的細胞。此后每隔2d換液,貼壁細胞逐漸伸出突起,呈扁平三角形或多邊形,核大而飽滿。10d后細胞胞體呈現(xiàn)典型的成纖維細胞狀,核圓形或橢圓形,位于細胞中心,多數(shù)細胞排布規(guī)則呈放射狀生長。14d左右細胞集落融合超過90%時即可傳代。傳代后的細胞生長迅速,排列較為一致。
2、體外誘導(dǎo)四周后形態(tài)學(xué)和標記物變化
2.1形態(tài)學(xué)變化
利用免疫熒光法標記細胞骨架β-Tubulin觀察誘導(dǎo)前后細胞的形態(tài)結(jié)構(gòu)。第2代骨髓間充質(zhì)干細胞經(jīng)紅景天苷、全反式維甲酸、甲鈷胺誘導(dǎo)后,細胞形態(tài)漸漸出現(xiàn)與空白對照D、E、F組不同的形態(tài)。空白對照組BMSCs形態(tài)多呈多角形或紡錘形,紅景天苷、全反式維甲酸、甲鈷胺誘導(dǎo)12h時可見部分細胞胞體變大,有突起形成,24h后大多數(shù)細胞胞體普遍增大、可見2個以上不等的突起形成,誘導(dǎo)6d后形成典型的神經(jīng)樣細胞,胞體變小、突起細長。
2.2免疫細胞化學(xué)變化
各誘導(dǎo)組的骨髓間充質(zhì)干細胞誘導(dǎo)6d時,神經(jīng)細胞特異性標志分子NSE和β-Tubulin均呈陽性表達,空白對照D、E、F組NSE和β-Tubulin均呈陰性表達。陽性率見下表。
結(jié)果表明,紅景天苷、全反式維甲酸、甲鈷胺可以有效誘導(dǎo)骨髓間充質(zhì)干細胞體外分化成神經(jīng)元樣細胞,為有效誘導(dǎo)劑。
3、誘導(dǎo)組與空白對照組差異代謝物的篩選
通過定性和定量結(jié)果發(fā)現(xiàn):與空白對照組相比,誘導(dǎo)組中苯丙氨酸上調(diào)3.7~4.3倍,半胱氨酸上調(diào)3.2~3.9倍,磷酸烯醇式丙酮酸上調(diào)2.5~2.9倍,草酰乙酸上調(diào)3.4~3.8倍。
4、測試集驗證結(jié)果
從測試集中,選擇30個空白對照樣品,測定其中苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸的含量各自取均值作為空白參考值。其余測試集樣品隨機分析,且分析人員不知道其分析的樣品是誘導(dǎo)樣品還是空白對照樣品,如果該樣品與空白參考值相比同時符合下述條件即歸為誘導(dǎo)樣品,否則為空白對照樣品:苯丙氨酸上調(diào)≥3.7倍、半胱氨酸上調(diào)≥3.2倍、磷酸烯醇式丙酮酸上調(diào)≥2.5倍、草酰乙酸上調(diào)≥3.4倍。
結(jié)果發(fā)現(xiàn),該方法準確性非常高,能準確區(qū)分150個樣品為誘導(dǎo)樣品還是空白對照樣品,準確率100%,苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸可以聯(lián)合作為預(yù)示骨髓間充質(zhì)干細胞BMSCs定向分化為神經(jīng)元樣細胞的潛能的標志物。
該實施例表明:苯丙氨酸、半胱氨酸、磷酸烯醇式丙酮酸和草酰乙酸聯(lián)合預(yù)示價值非常高,可以作為預(yù)示BMSCs定向分化為神經(jīng)元樣細胞的潛能的標志物,用于高通量篩選可以誘導(dǎo)BMSCs定向分化為神經(jīng)細胞的誘導(dǎo)劑,效率高,不需等待數(shù)天才能獲知誘導(dǎo)結(jié)果。
發(fā)明人還考察了BMSCs不同培養(yǎng)基(含15%胎牛血清的DMEM培養(yǎng)液)對標志物結(jié)果的影響,結(jié)果證明不同培養(yǎng)基并不影響上述結(jié)果。
上述具體實施例僅用于解釋本發(fā)明的技術(shù)方案,本領(lǐng)域技術(shù)人員應(yīng)當明白,本發(fā)明的保護范圍并不受限于上述具體實施例。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種胚胎干細胞分化間充質(zhì)干細胞的方法
- 抗人髓系相關(guān)分化標志蛋白的單克隆抗體fma1及其應(yīng)用的制作方法
- 用于對重質(zhì)的塑料富集的分化物進行處理的方法和設(shè)備的制作方法
- 一組模擬髓樣分化蛋白-2的多肽及其應(yīng)用的制作方法
- 一種間充質(zhì)干細胞的定向分化誘導(dǎo)方法
- 一種調(diào)控干細胞分化及促進體內(nèi)骨生成的鈦合金表面改性方法
- 間充質(zhì)干細胞的成骨分化的制作方法
- 一種功能化聚酰胺-胺樹狀大分子的納米復(fù)合物的應(yīng)用的制作方法
- 一種用于誘導(dǎo)分化間充質(zhì)干細胞的培養(yǎng)基及其方法
- S1p在制備抑制骨髓間充質(zhì)干細胞凋亡藥物上的應(yīng)用的制作方法
- 一種睪丸間質(zhì)干細胞分離培養(yǎng)分化方法與流程
- 促進間充質(zhì)干細胞分化的微納米拓撲結(jié)構(gòu)制備及分化方法與流程
- 一種促進間充質(zhì)干細胞半月板分化的方法與流程
- 一種用于誘導(dǎo)間充質(zhì)干細胞分化成神經(jīng)細胞的培養(yǎng)基的制作方法與工藝
- 一種促進間充質(zhì)干細胞軟骨組織分化的方法與流程
- 一種調(diào)控間充質(zhì)干細胞定向分化的方法與流程
- 一種穩(wěn)定間充質(zhì)干細胞來源軟骨組織表型的方法與流程
- 一種臍帶間充質(zhì)干細胞成骨分化誘導(dǎo)及檢測的試劑盒的制造方法與工藝
- 包含源于正分化成軟骨細胞之干細胞的外排體的用于軟骨細胞分化誘導(dǎo)或軟骨組織再生的組合物的制造方法與工藝
- 牙源性間充質(zhì)干細胞實現(xiàn)軟骨再生的方法與制造工藝