溝葉結縷草中一個新的耐鹽基因ZmPDI及其植物表達載體和應用的制作方法
本發明屬于分子生物學領域,涉及鹽生植物溝葉結縷草耐鹽基因ZmPDI及其植物表達載體和應用。
背景技術:
鹽脅迫是影響植物生長發育、產量及品質的重要環境因子。因此,植物抗逆新品種選育及抗逆機理研究成為近些年的熱點;雜交、輻射誘變等育種常規技術由于周期長、效率低,不足以滿足目前抗逆育種的要求;為了加快抗逆育種進程,快速高效的基因工程技術逐漸受到社會的關注,優異抗逆基因的開發顯得至關重要;已有研究表明,轉高效抗逆調控基因的分子育種對提高植物抗逆性有積極作用。
蛋白二硫鍵異構酶PDI(protein disulfide isomerase)屬硫氧還蛋白亞家族成員,是內質網中一種重要的折疊催化劑,它能催化蛋白形成二硫鍵(氧化活性)和催化錯誤配對二硫鍵的重排(異構酶活性),促進蛋白的正確折疊,同時具有分子伴侶作用,在緩解內質網應激過程中發揮重要作用;研究發現,水稻蛋白二硫鍵異構酶PDI的功能缺失加劇了內質網應激,表現出粉狀胚乳的特征 (Han et al., 2012);PDI基因沉默引起高溫脅迫下水稻結實率的大幅度降低,耐熱性顯著下降 (劉光快 等,2013);最近研究發現,擬南芥中一個PDI家族成員AtPDI6突變誘導了葉綠體中D1蛋白的合成,緩解了強光脅迫下的光抑制現象 (Wittenberg et al., 2014);大麥中PDI同源基因HvPDIL5-1的功能缺失,提高了大麥抗黃花葉病的能力 (Yang et al., 2014)。然而,PDI 調控植物耐鹽性的研究尚無報道。
本課題組前期通過酵母文庫篩選從鹽生植物溝葉結縷草中獲得一個新的耐鹽候選基因ZmPDI,異源轉化酵母顯著提高耐鹽性,然而在植物中是否同樣具有耐鹽功能尚不清楚;因此,本發明的動因就是:將溝葉結縷草ZmPDI構建到植物表達載體中,通過農桿菌介導的方法進行遺傳轉化,獲得具有耐鹽特性的新種質;本專利對于優良作物新品種的培育及在生產中的廣泛應用,具有重要意義。
技術實現要素:
針對背景技術提出的培育耐鹽新種質的問題,本發明的目的在于提供一個新的鹽生植物溝葉結縷草耐鹽基因ZmPDI。
本發明的另一目的在于該耐鹽基因ZmPDI的植物表達載體。
本發明所構建的植物表達載體可直接用于農桿菌介導的植物遺傳轉化,創制耐鹽新種質,可用于植物品種改良。
本發明的目的可以通過以下技術方案實現:
溝葉結縷草耐鹽基因ZmPDI,該基因的序列為SEQ ID NO. 1;
含有本發明所述的溝葉結縷草耐鹽基因ZmPDI的植物表達載體,由所述的溝葉結縷草耐鹽基因ZmPDI與植物表達載體構成;
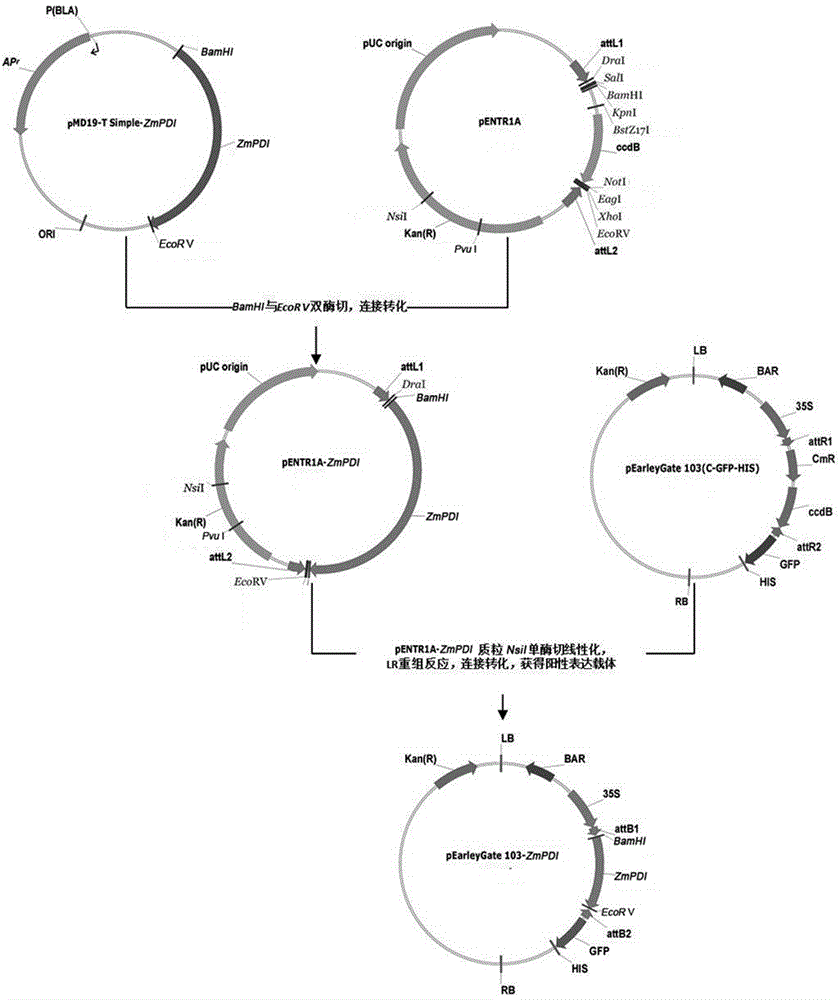
所述的含有溝葉結縷草耐鹽基因ZmPDI的植物表達載體,優選為BamHⅠ和EcoRⅤ雙酶切ZmPDI后插入到gateway入門載體pENTR1A后與pEarleyGate103表達載體質粒進行重組反應得到。
本發明所述的含有溝葉結縷草耐鹽基因ZmPDI的植物表達載體的構建方法,包括如下步驟。
(1)ZmPDI基因全長的克隆:設計引物ZmPDI-F: SEQ ID NO.2和ZmPDI-R: SEQ ID NO.3,以溝葉結縷草cDNA為模板,進行PCR反應,PCR產物連接到pMD19-T Simple載體,轉化TOP10感受態細胞,提取陽性質粒測序獲得全長序列SEQ ID NO. 1。
(2)pENTR1A-ZmPDI質粒構建:設計引物ZmPDI-BamHⅠ-F: SEQ ID NO.4和ZmPDI-EcoRⅤ-R: SEQ ID NO.5,以步驟(1)的陽性質粒為模板,用高保真酶進行PCR反應,獲得在上游和下游分別引入BamHⅠ和EcoRⅤ酶切位點的ZmPDI基因,PCR產物連接到pMD19-T Simple載體,轉化TOP10感受態細胞,提取陽性質粒pMD19-T Simple-ZmPDI;BamHⅠ和EcoRⅤ分別對陽性質粒pMD19-T Simple-ZmPDI和pENTR1A進行雙酶切,取酶切后的ZmPDI片段與BamHⅠ和EcoRⅤ雙酶切的pENTR1A連接,連接產物轉化TOP10感受態細胞;37 ℃過夜培養,挑取陽性單克隆擴大培養,提取質粒pENTR1A-ZmPDI。
(3)提取的陽性質粒pENTR1A-ZmPDI經NsiⅠ單酶切線性化后與pEarleyGate103載體質粒進行LR重組反應,轉化,提取陽性質粒,電泳檢測并測序驗證為SEQ ID NO. 1,植物表達載體pEarleyGate103-ZmPDI構建成功。
本發明所述的溝葉結縷草耐鹽基因ZmPDI在創建耐鹽新種質中的應用。
本發明所述的植物表達載體在創建耐鹽新種質中的應用。
本發明的有益效果:
1.本發明提供的溝葉結縷草ZmPDI是一個新的耐鹽基因,該基因可提高植物耐鹽性;
2.本發明構建的溝葉結縷草ZmPDI植物表達載體為首次報道,可直接用于農桿菌介導的遺傳轉化,創造耐鹽新種質,提高植物的耐鹽性,可進行植物品種改良。
附圖說明
圖1 ZmPDI瓊脂糖凝膠電泳分析
M:DNA Marker
1:ZmPDI;
2:pMD19-T Simple-ZmPDI 質粒BamHⅠ和EcoRⅤ雙酶切
3:pEarleyGate103-ZmPDI 表達載體電泳檢測圖
圖2 pEarleyGate103- ZmPDI表達載體構建圖
圖3野生型(WT)與轉基因擬南芥(ZmPDI)PCR鑒定
圖4野生型與轉基因擬南芥耐鹽性評價
具體實施方式
實施例1 溝葉結縷草ZmPDI的克隆(圖1)。
選用溝葉結縷草(Zoysia matrella)作為材料,選取健康的草皮塊,置于裝滿石英砂的杯中,于1/2 Hongland營養液水培20天后,轉入到含300mM NaCl的1/2 Hongland營養液中處理7d,取0.1g幼嫩葉片,參照Trizol RNA提取試劑盒(TaKaRa)說明書方法,提取葉片總RNA,按照M-MLV反轉錄試劑盒(TaKaRa)取1 μg總RNA反轉錄成cDNA,用RNase消化cDNA產物,設計引物擴增ZmPDI;
上游引物ZmPDI-F: 5′-ATGGCGATCCACTCCAGGGT-3′(SEQ ID NO.2);
下游引物ZmPDI-R: 5′-GAGCTCATCCTTGACGGCCT-3′(SEQ ID NO.3)。
以提取的葉片cDNA為模板,進行PCR反應,20 μL反應體系:2×RCR Mix 10 μL,ZmPDI-F、ZmPDI-R引物各1.0 μL(10 μmol·L-1),cDNA模板 1μL,ddH2O 7 μL;反應程序:95 ℃預變性4 min,然后94 ℃解鏈30 sec,60 ℃退火30 sec,72 ℃延伸1 min 30 sec,反應30個循環,72 ℃延伸10 min;PCR產物用凝膠回收試劑盒(AXYGEN)回收純化,用T4DNA連接酶(TaKaRa)連接到pMD19-T Simple載體(TaKaRa),轉化TOP10感受態細胞,提取陽性質粒經序列測定為SEQ ID NO.1。
實施例2 植物表達載體pEarleyGate103-ZmPDI的構建(圖2)。
設計引物進行PCR反應,在目的基因ZmPDI的上游和下游分別引入酶切位點BamHⅠ和EcoRⅤ,PCR產物連接到pMD19-T Simple載體,轉化TOP10感受態細胞,提取陽性質粒,BamHⅠ和EcoRⅤ雙酶切的ZmPDI片段與BamHⅠ和EcoRⅤ雙酶切的pENTR1A連接,轉化,提取的陽性質粒經NsiⅠ單酶切線性化后與pEarleyGate103載體質粒進行LR重組反應(Invitrogen),轉化,提取陽性質粒,電泳檢測并測序驗證為SEQ ID NO.1;
上游引物ZmPDI-BamHⅠ-F:5′- GGATCCGGATGGCGATCCACTCCAGGGT -3′(SEQ ID NO.4);
下游引物ZmPDI-EcoRⅤ-R:5′- GATATCTGAGCTCATCCTTGACGGCCT -3′(SEQ ID NO.5)。
①以實施例1中的陽性質粒為模板,用高保真酶(PrimeSTARTM HS DNA Polymerase,TaKaRa)進行PCR反應,25 μL反應體系:10×HS RCR Buffer 2.5 μL,ZmPDI-BamHⅠ-F、ZmPDI-EcoRⅤ-R引物各1.0 μL (10 μmol·L-1),dNTP mix 2.0 μL (2.5 mmol·L-1),PrimeSTARTM HS DNA Polymerase 0.2 μL,質粒模板 1 μL,ddH2O 17.3 μL;反應程序:95 ℃預變性4 min,然后94 ℃解鏈30 sec,60 ℃退火30 sec,72 ℃延伸1 min 30 sec,反應30個循環,72 ℃延伸10 min;PCR產物用凝膠回收試劑盒(AXYGEN, USA)回收,連接到pMD19-T Simple載體,轉化TOP10感受態細胞,提取陽性質粒pMD19-T Simple-ZmPDI。
②取gateway入門載體pENTR1A (Invitrogen) 和pMD19-T Simple-ZmPDI用BamHⅠ和EcoRⅤ雙酶切,雙酶切體系(40 μL):10×K Buffer 4 μL,質粒pENTR1A或pMD19-T Simple-ZmPDI15 μL,BamHⅠ 2 μL,EcoRⅤ 2 μL,ddH2O 17 μL;37 ℃反應2 h;雙酶切產物進行瓊脂糖凝膠電泳分析,用凝膠回收試劑盒(AXYGEN)回收質粒pENTR1A大片段和pMD19-T Simple-ZmPDI小片段。用TaKaRa連接體系連接兩個回收的產物,反應體系(5 μL):Solution 2.5 μL,pENTR1A大片段0.5 μL,pMD19-T Simple-ZmPDI小片段2 μL;16 ℃連接2h,連接產物轉化TOP10感受態細胞;37 ℃過夜培養,挑取陽性單克隆擴大培養,提取質粒pENTR1A-ZmPDI。
③取質粒pENTR1A-ZmPDI用NsiⅠ單酶切,酶切體系(40 μL):10×FD Buffer 4 μL,0.1% BSA 4 μL,質粒pENTR1A-ZmPDI 15 μL,NsiⅠ2 μL,ddH2O 15 μL;37 ℃反應5 min,65℃反應15 min,用凝膠回收試劑盒(AXYGEN)回收質粒pENTR1A-NsiⅠ片段;將回收的片段與pEarleyGate103載體質粒進行LR重組反應,反應體系(5 μL):pENTR1A-ZmPDI大片段3 μL,pEarleyGate103質粒1 μL,LR ClonaseTMⅡ enzyme mix 1 μL;25 ℃反應1 h,加入1 μL Proteinase K,37 ℃反應10 min;重組產物轉化TOP10感受態細胞,37 ℃過夜培養,挑取陽性單克隆擴大培養,提取質粒pEarleyGate103-ZmPDI,電泳和測序驗證為SEQ ID NO.1;植物表達載體pEarleyGate103-ZmPDI的構建成功。
實施例3 植物表達載體pEarleyGate103-ZmPDI遺傳轉化擬南芥及其耐鹽性鑒定。
①農桿菌菌株EHA105感受態制備及凍融法轉化:從YEB(50 μg/mL 利福平)平板上挑取EHA105單菌落,接種于50 mL 含50 μg/mL 利福平的YEB液體培養基中,220 rpm,28℃培養至OD值0.6,而后冰浴菌液30 min,離心收集菌體,懸浮于2 mL預冷的的100mM CaCl2(20%甘油)溶液中,200 μL/管分裝,待用;取5 μL pEarleyGate103-ZmPDI載體質粒,加入100 μL 感受態細胞,冰浴30 min,液氮冷凍5 min,37℃ 5 min,加入800 μL YEB 液體培養基,28℃ 200 rpm預培養3 h,菌液涂板于YEB(50 μg/mL 利福平 + 50 μg/mL卡那霉素)固體培養基上,28℃ 暗培養2天,挑取單克隆檢測,選取陽性克隆搖菌,用于擬南芥花序轉化。
②擬南芥花序浸染及種子采收:將陽性單克隆接到50 mL 的YEB(50 μg/mL 利福平 + 50 μg/mL卡那霉素)液體培養基中,培養36小時,5000 rpm離心20分鐘,然后用轉化液(5%蔗糖+500uL/L的Silwet L-77)劇烈懸浮沉淀至完全懸起;將擬南芥地上部分直接浸泡于上述懸浮液中1分鐘,然后用保鮮膜完全包裹植株以保濕,放回培養室培養24小時,打開保鮮膜,待種子成熟時采收。
③種子消毒于播種:將種子放入5mL的離心管中,加入50%巴斯消毒液,添加0.1%的Triton X-100搖晃15分鐘,然后在超凈臺中用無菌水洗5次,而后直接把種子倒在滅菌過的濾紙上,吹干種子(放置1小時),輕輕敲擊濾紙將干種子均勻撒播到篩選培養基(1/2MS + 20mg/L 草胺磷 + 25mg/L氨芐青霉素)篩選培養10天,然后將抗性苗移栽到土中,用透明的蓋子覆蓋幼苗1周以保濕。
④耐鹽評價:待抗性苗7~8片葉,提取擬南芥葉片DNA,PCR(引物ZmPDI-F和ZmPDI-R)鑒定(圖3);經PCR鑒定的T1代轉基因苗繼續生長,采收T2代種子。對野生型和T2代抗性轉基因擬南芥置于鹽處理(0mM和200mM NaCl+MS培養基)生長14天,發現3個轉ZmPDI基因擬南芥的生長明顯優于野生型擬南芥(圖4),耐鹽性顯著提高。
綜上所述,本發明構建了含有耐鹽基因的植物表達載體pEarleyGate103-ZmPDI,其中ZmPDI首次報道;所構建的載體可導入植物中,提高植物的耐鹽特性。
<110> 江蘇省中國科學院植物研究所
<120> 溝葉結縷草中一個新的耐鹽基因ZmPDI及其植物表達載體和應用
<160> 5
<210> 1
<211> 1530
<212> DNA
<213> 溝葉結縷草(Zoysia matrella)
<220>
<223> 溝葉結縷草耐鹽基因ZmPDI核苷酸序列
<400> 1
atggcgatccactccagggtctggatctcgctgctgctcgcgctcgccgtcgcgctctgc 60
gcgcgggcggaggaggccgcgggcgaggaggccgtgctcaccctcgacgtcgacaacttc 120
gacgacgccgtcgccaagcaccccttcatggtcatcgagttctacgccccctggtgtgga 180
cactgcaagaaactcgctccagagtacgagaaggcagcccagtcgcttagcaagcatgac 240
ccaccgatcgttcttgccaaggttgacgccaacgaggagaagaacaggccgttggctacc 300
aagtacgagatccaggggttcccaaccctcaagatcttcaggaaccagggcaagaacgtt 360
caggagtacaagggccccagggaggctgagggaattgttgagtacctgaagaagcaggtc 420
ggacctgcttccactgagatcaagtctcccgaagatgcggcaacccttatcgatgacaag 480
aagatctacattgttggtatcttcacagagttcagcggcactgagttcacaaacttcatg 540
gaggttgctgagaagctgcgctccgactatgactttggccacactctgcacgccaaccat 600
ctcccacgtggtgatgcagcagttgagaggccattggtcaggctgttgaagccatttgac 660
gagcttgttgttgacagcaaggacttcgatgttgctgctctggagaagtttattgatgct 720
agcagcaccccaagaattgtcactttcgacaagaaccctgataaccacccttacctcttg 780
aagtacttccaaagcacagttcctaaggctatgctattcttgaacttctccactggacca 840
tttgaatcgttcaagtctgcttactacggagctgcagacgagtttaaggacaaggaagtc 900
aagttccttattggtgacattgaggccagccagggtgctttccagtactttggtctgaaa 960
gaggatcaagcaccccttatcgtcattcaggatggtgattccaagaagtttttgaaggag 1020
cgggttgagcctgaccagattgttgcttggttgaaggactactttgatggtaaattgaca 1080
ccgttcaagaagtctgagcctattcctgagaccaacaatgagcctgttaaggtggttgtc 1140
tctgacagccttgatgacatggtgttcaaatctggaaagaatgttcttattgaattctat 1200
gcgccctggtgtggacactgcaagaagttggcgccaatcttggaggaggctgccaccact 1260
cttcaaagcgatgaggatgttgtcattgctaagatggacgccactgcgaatgatgtgccc 1320
agcgaatttgatgtccagggataccccaccatgtaccttgtcactcctagtggaaagatg 1380
actgcctatgatggtggcaggacagccgatgacattgtggacttcatcaagaagaacaag 1440
gagactgctggacagtcgacaacagagaaggtggctgagaaggtagccgagaaggtggaa 1500
gctaccactgaggccgtcaaggatgagctc 1530
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<220>
<221> PCR反應擴增ZmPDI基因用上游引物ZmPDI-F
<400> 2
atggcgatcc actccagggt 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<220>
<221> PCR反應擴增ZmPDI基因用下游引物 ZmPDI-R
<400> 3
gagctcatcc ttgacggcct 20
<210> 4
<211> 28
<212> DNA
<213> 人工序列
<220>
<221> PCR反應擴增ZmPDI基因引入BamH I酶切位點用上游引物ZmPDI-BamH I-F
<400> 4
ggatccggat ggcgatccac tccagggt 28
<210> 5
<211> 27
<212> DNA
<213> 人工序列
<220>
<221> PCR反應擴增ZmPDI基因引入EcoR V酶切位點用下游引物ZmPDI-EcoR V-R
<400> 5
gatatctgag ctcatccttg acggcct 27
- 還沒有人留言評論。精彩留言會獲得點贊!