一種9?取代?N?(2?氯芐基)嘌呤?6?胺類衍生物及其制備方法和應用與流程
本發明屬于藥物化學領域,具體涉及一種用于抗炎的9-取代-N-(2-氯芐基)嘌呤-6-胺類衍生物及其制備方法和應用。
背景技術:
炎癥(inflammation)是機體對病原體刺激所發生的防御反應,以血管反應為中心,伴隨實質和間質細胞的再生以修復受損組織。通常情況下,炎癥是一個自限性過程,隨著致炎因素消失,促炎反應介質與抗炎反應介質達到平衡,炎癥消退,但在某些特殊情況下,致炎因素持續性低強度刺激,使炎癥反應持續進行,轉為慢性炎癥(chronic inflammation),這種持續存在、無法消退的炎癥也稱為非可控性炎癥(non-resolving inflammation)。適度的炎癥反應對機體起保護作用,而慢性非可控性炎癥對機體造成的損傷則遠甚于致炎因素本身機體產生炎癥,會引起物質代謝障礙,細胞變性和壞死。近年來,研究發現機體炎癥在某些因素的影響下,還會誘發心血管疾病和癌癥等嚴重危害人們健康的疾病。
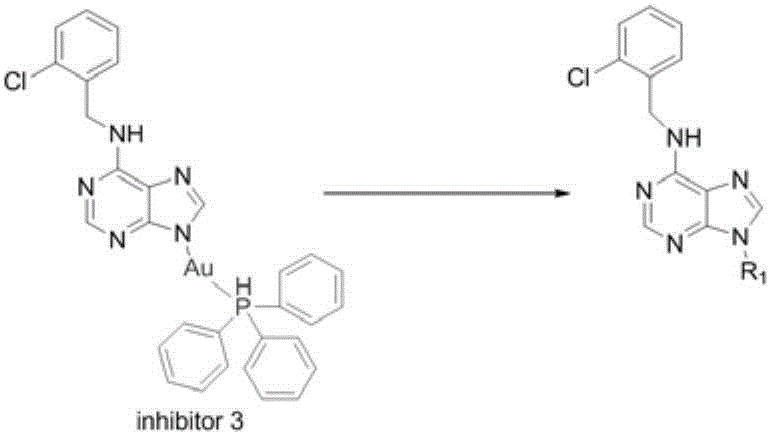
6-芐基嘌呤化合物絡合金離子(inhibitor 3)具有很強的抗炎活性,能夠顯著降低由LPS誘導的巨噬細胞產生的多種炎癥因子的表達量,包括TNF-α、IL-1β等,產生的抗炎效果可以達到目前臨床上使用的吲哚美辛水平。但對化合物inhibitor 3進行結構分析后,發現inhibitor 3存在一些不足之處,具體如下:由于inhibitor 3含有金離子,使得藥物生產成本增加,加重了患者的治療負擔;如果長期服用,會導致體內金元素的堆積,誘發藥物的副作用,限制了其對慢性炎癥的治療;化合物含有重金屬元素,改變嘌呤化合物的極性,導致化合物在體內的溶解性和生物學利用度不高。基于上述的分析,可以對inhibitor 3進行有針對性的設計和結構優化(見圖1),以期待得到一種高效和廉價的抗炎效果好的化合物。
技術實現要素:
本發明提供了一種9-取代-N-(2-氯芐基)嘌呤-6-胺類衍生物及其制備方法和應用,該9-取代-N-(2-氯芐基)嘌呤-6-胺類衍生物具有較好的抗炎活性,具有作為抗炎藥物的潛力。
一種9-取代-N-(2-氯芐基)嘌呤-6-胺類衍生物,結構如式(I)所示:
式(I)中,R選自氫原子、C1~C4烷基、取代或者未取代的芐基中的一種,其中,芐基上的取代基獨立地選自鹵素、-CF3、C1~C4烷氧基、C1~C4烷基和硝基中的一個或者多個;
R4為取代或者未取代的苯基或者芐基,其中,苯基或者芐基上的取代基為鹵素或者甲氧基中的一個或者多個。
試驗結果表明,同6-芐基嘌呤化合物絡合金離子(inhibitor 3)相比,本發明的9-取代-N-(2-氯芐基)嘌呤-6-胺衍生物對炎癥因子的抑制率更高,具有更好的抗炎活性,具有作為抗炎藥物的潛力。
作為優選,所述的R4為其中表示連接位置。
即所述的9-取代-N-(2-氯芐基)嘌呤-6-胺類衍生物的結構如下:
作為優選,所述的9-取代-N-(2-氯芐基)嘌呤-6-胺衍生物,結構如式(Ⅱ)~(Ⅳ)中的一種所示:
式(II)中,R1獨立地選自H、-CH3;
式(III)中,R2獨立地選自F、Cl、-C(CH3)3、異丁基、-CF3、-OCH3和-NO2中的一個或者多個。
作為優選,式(II)所示的化合物為L1~L2中的一種,式(III)所示的化合物為L3~L10中的一種,取代基的種類和位置如具體實施方式中的表1所示。
作為進一步的優選,所述的9-取代-N-(2-氯芐基)嘌呤-6-胺衍生物為下列具體化合物
中的一種:
N-(2-氯芐基)-9-甲基-9H-嘌呤-6-胺,化學結構如下:
N-(2-氯芐基)-9-(4-氯芐基)-9H-嘌呤-6-胺,化學結構如下:
N-(2-氯芐基)-9-(3,5-二甲氧基芐基)-9H-嘌呤-6-胺,化學結構如下:
本發明還提供了一種所述的9-取代-N-(2-氯芐基)嘌呤-6-胺衍生物的制備方法,包括以下步驟
步驟1:6-氯嘌呤為原料與鄰氯芐胺取代反應制得N-(2-氯芐基)-9H-嘌呤-6-胺。
步驟2:所述步驟1中制得的N-(2-氯芐基)-9H-嘌呤-6-胺為中間體經過取代反應引入9位取代基。
進一步地說,具體包括如下步驟:
步驟1:稱取80mg 6-氯嘌呤于25mL圓底燒瓶中并加入5mL正丁醇,超聲溶解,然后加入147mg 2-氯芐胺,2-氯芐胺與6-氯嘌呤的摩爾比為2:1,并加入50μL三乙胺作為催化劑。在110℃油浴加熱回流攪拌5h,取反應液進行TLC跑板,紫外熒光下觀察反應完全,冷卻,抽濾得固體,重結晶得到6-(2-氯芐胺基)嘌呤。
步驟2:稱取90mg 6-(2-氯芐胺基)嘌呤以及L2-L9對應的不同結構的鹵代烴于適量的圓底燒瓶中,鹵代烴與6-(2-氯芐胺基)嘌呤的摩爾比為2:1,量取適量溶劑乙腈,并加入80mg碳酸鉀作為催化劑。在80℃油浴加熱回流攪拌24h,進行減壓旋干。加入適量水,所得固體抽濾取出,液體用乙酸乙酯萃取后旋干制沙,合并所有固體,利用柱層析進行純化。所述的R選自甲基取代或者未取代的芐基。
結構如式(I)~(Ⅲ)共合成了10個化合物,L1-10,抗炎活性L1最好
本發明還提供了一種所述的9-取代-N-(2-氯芐基)嘌呤-6-胺類衍生物在制備抗炎藥物中的應用。
作為優選,所述的抗炎藥物包含治療有效量的9-取代-N-(2-氯芐基)嘌呤-6-胺衍生物和藥用輔料。
所述的抗炎藥物的劑型為注射劑、片劑、膠囊劑、氣霧劑、栓劑、膜劑、滴丸劑、軟膏劑、控釋劑、緩釋劑或納米制劑。
同現有技術相比,本發明的有益效果體現在:
本發明的9-取代-N-(2-氯芐基)嘌呤-6-胺衍生物對試驗用細胞有一定抑制作用,表現出一定的抗炎活性。合成的化合物L1、L4對炎癥因子的抑制率普遍高于陽性對照藥6-芐基嘌呤化合物絡合金離子(inhibitor 3),所以這類化合物具有較好的抗炎作用。
附圖說明
圖1為現有技術中對6-芐基嘌呤化合物絡合金離子(inhibitor 3)的結構進行優化的方式;
圖2為本發明所有目標化合物毒性檢測的示意圖;
圖3為本發明所有目標化合物作用于抑制炎癥因子的抑制率的示意圖;
圖4為本發明所有目標化合物作用于抑制炎癥因子的抑制率的示意圖;
圖5為本發明所有目標化合物作用于NO的抑制率的示意圖;
圖6為本發明所有目標化合物作用于抑制COX和iNOS的示意圖。
具體實施方式
下面將結合附圖和實施例對本發明做進一步的描述。應當注意的是,下述實施例中描述的技術特征或者技術特征的組合不應當被認為是孤立的,它們可以被相互組合從而達到更好的技術效果。
一、化合物的合成
實施例1~2 L1-L2的合成
步驟1:稱取80mg 6-氯嘌呤于25mL圓底燒瓶中并加入5mL正丁醇,超聲溶解,然后加入147mg 2-氯芐胺,2-氯芐胺與6-氯嘌呤的摩爾比為2:1,并加入50μL三乙胺作為催化劑。在110℃油浴加熱回流攪拌5h,進行TLC跑板監測,紫外熒光下觀察反應完全,冷卻,抽濾得固體,重結晶得到6-(2-氯芐胺基)嘌呤。
步驟2:稱取90mg 6-(2-氯芐胺基)嘌呤與氯代甲烷于適量的圓底燒瓶中,氯代甲烷與6-(2-氯芐胺基)嘌呤的摩爾比為2:1,量取適量溶劑乙腈,并加入80mg碳酸鉀作為催化劑。在80℃油浴加熱回流攪拌24h,進行減壓旋干。加入適量水,所得固體抽濾取出,液體用乙酸乙酯萃取后旋干制沙,合并所有固體,利用柱層析進行純化得到L1-L2化合物的純品。產物結構和分子量見表1。
反應式如下:
實施例3~10 L3-L10的合成
步驟1:稱取80mg 6-氯嘌呤于25mL圓底燒瓶中并加入5mL正丁醇,超聲溶解,然后加入147mg 2-氯芐胺,2-氯芐胺與6-氯嘌呤的摩爾比為2:1,并加入50μL三乙胺作為催化劑。在110℃油浴加熱回流攪拌5h,取反應液進行TLC跑板,紫外熒光下觀察反應完全,冷卻,抽濾得固體重結晶得到6-(2-氯芐胺基)嘌呤。
步驟2:稱取90mg 6-(2-氯芐胺基)嘌呤以及L3-L10對應的不同結構的鹵代烴于適量的圓底燒瓶中,鹵代烴與6-(2-氯芐胺基)嘌呤的摩爾比為2:1,量取適量溶劑乙腈,并加入80mg碳酸鉀作為催化劑。在80℃油浴加熱回流攪拌24h,進行減壓旋干。加入適量水,所得固體抽濾取出液體用乙酸乙酯萃取后旋干制沙,合并所有固體,利用柱層析進行純化。產物結構和分子量見表1。
反應式如下:
R=F、Cl、-C(CH3)3、-CF3、-OCH3或-NO2
實施例11 W1的合成
稱取1mmol的6-氯嘌呤以及2mmol的對氟芐胺于25mL圓底燒瓶中,其兩種原料的摩爾比為1:2,并加入5mL溶劑正丁醇,并加入50μL的三乙胺作為催化劑,在110℃油浴加熱回流攪拌5h,取反應液進行TLC跑板,紫外熒光下觀察反應完全,冷卻,抽濾,重結晶得到W1產物結構和分子量見表2。
反應式如下:
實施例12-18 W2-W8的合成
稱取1mmol的6-氯嘌呤以及2mmol的W2-W8對應的苯胺類化合物于25mL圓底燒瓶中,其兩種原料的摩爾比為1:2,并加入5mL溶劑正丁醇,并加入50μL的三乙胺作為催化劑,在110℃油浴加熱回流攪拌5h,取反應液進行TLC跑板,紫外熒光下觀察反應完全,冷卻,抽濾,重結晶得到W2-W8。產物結構和分子量見表2。
反應式如下:
R=F、Cl、OH、-OCH3;其中,表示取代位置
實施例19-20 W9-W10的合成
稱取1mmol的6-氯嘌呤以及2mmol的W9-W10對應的胺類化合物于25mL圓底燒瓶中,其兩種原料的摩爾比為1:2,并加入5mL溶劑正丁醇,并加入50μl的三乙胺作為催化劑,在110℃油浴加熱回流攪拌5h,取反應液進行TLC跑板,紫外熒光下觀察反應完全,冷卻,抽濾,重結晶得到W9-W10。
反應式如下:
其中,表示取代位置
表1 化合物L1-L10的結構及物理數據
表2 化合物W1-W10的結構及物理數據
化合物L1-L10、W1-W10的ESI-MS,1H-NMR和13C-NMR數據
N-(2-chlorobenzyl)-9H-purin-6-amine(L1)
White powder,Yield:85.6%,Mp:156.1-158.9℃,ESI-MS[M+H]+:260.2,1H-NMR(600MHz,DMSO-d6):δ(ppm):12.987(m,1H,9-Purine-H),8.140-8.157(m,3H,2,8-Purine-H+NH),7.432-7.439(m,1H,3'-2-Cl-Ph-H),7.252-7.283(m,3H,4',5',6'-2-Cl-Ph-H),4.760(s,2H,CH2).13C-NMR(600MHz,DMSO-d6):152.343,139.107,131.711,129.020,128.226,127.970,127.052.
N-(2-chlorobenzyl)-9-methyl-9H-purin-6-amine(L2)
White powder,Yield:50.5%;Mp:120.1-123.2℃;ESI-MS[M+H]+:274.3;1H-NMR(600MHz,CD3Cl):δ(ppm):8.414(s,1H,2-Purine-H),7.752(s,1H,8-P urine-H),7.473-7.487(m,1H,3-Ph-H),7.370-7.385(m,1H,6-Ph-H),7.201-7.260(m,2H,4,5-Ph-H),6.474(s,1H,NH),4.975(s,2H,CH2),4.226(s,3H,9-CH3).13C-N MR(600MHz,CD3Cl):δ(ppm):154.828,153.181,139.476,136.192,133.816,129.689128.912,127.083,120.112,38.954,15.722.
N-(2-chlorobenzyl)-9-(4-fluorobenzyl)-9H-purin-6-amine(L3)
Light Yellow powder,Yield:45.2%;Mp:150.1-152.9℃;ESI-MS[M+H]+:368.2;1H-NMR(600MHz,CD3Cl):δ(ppm):8.435(s,1H,2-Purine-H),7.678(s,1H,8-Purine-H),7.493-7.502(m,1H,3'-2-Cl-Ph-H),7.363-7.366(m,1H,6'-2-Cl-Ph-H),7.260-7.286(m,2H,4',5'-2-Cl-Ph-H),7.193-7.213(m,2H,2',6'-4-F-Ph-H),7.013-7.041(m,2H,3',5'-4-F-Ph-H),6.459(s,1H,NH),5.319(s,2H,9-CH2),4.926(s,2H,NHCH2).13C-NMR(600MHz,CD3Cl):163.612,161.971,154.872,139.684,136.095,133.853,131.658,129.956,129.756,128.974,127.100,116.235,46.635,32.075,29.507.
9-(4-(tert-butyl)benzyl)-N-(2-chlorobenzyl)-9H-purin-6-amine(L4)
Yellow powder,Yield:45.2%;Mp:140.1-142.8℃;ESI-MS[M+H]+:406.2;1H-NMR(600MHz,CD3Cl):δ(ppm):8.440(s,1H,2-purine-H),7.673(s,1H,8-pur ine-H),7.192-7.484(m,8H,Ph-H),6.465(s,1H,NH),5.434(s,2H,9'-CH2),4.966(s,2H,N-CH2),1.257(s,9H,CH3).13C-NMR(600MHz,CD3Cl):154.916,153.709,139.803,139.671,133.894,130.029,130.723,129.747,129.035,128.039,127.126,126.196,46.752.
N-(2-chlorobenzyl)-9-(4-chlorobenzyl)-9H-purin-6-amine(L5)
Green powder,Yield:56.2%;Mp:149.2-152.8℃;ESI-MS[M+H]+:384.6;1H-NMR(600MHz,CD3Cl):δ(ppm):8.412(s,1H,2-Purine-H),7.672(s,1H,8-Pur ine-H),7.474-7.484(m,1H,3'-2-Cl-Ph-H),7.335-7.365(m,1H,6'-2-Cl-Ph-H),7.302-7.326(m,2H,4',5'-2-Cl-Ph-H),7.183-7.236(m,4H,2',3',5',6'-4-Cl-Ph-H),6.456(s,1H,NH),5.316(s,2H,9-CH2),4.964(s,2H,N-CH2).13C-NMR(600MHz,CD3C l):154.891,153.652,145.231,139.710,136.027,133.176,130.419,129.394,129.099,128.721,128.929,127.142,125.915,46.651,29.835.
N-(2-chlorobenzyl)-9-(3-nitrobenzyl)-9H-purin-6-amine(L6)
Yellow powder,Yield:46.9%;Mp:160.8-162.7℃;ESI-MS[M+H]+:395.1;1H-NMR(600MHz,CD3Cl):δ(ppm):8.425(s,1H,2-Purine-H),8.177(s,1H,2'-3-NO2Ph-H),8.163(m,1H,4'-3-NO2Ph-H),7.744(s,1H,8-Purine-H),7.599-7.612(m,1H,2'-2-Cl-Ph-H),7.481-7.536(m,2H,5',6'-3-NO2Ph-H),7.360-7.375(m,1H,6'-2-Cl-Ph-H),7.199-7.215(m,2H,4',5'-2-Cl-Ph-H),6.456(s,1H,NH),5.316(s,2H,9-CH2),4.964(s,2H,N-CH2).13C-NMR(600MHz,CD3Cl):154.921,153.728,148.732,139.484,137.947,135.928,130.332,130.032,129.724,129.014,123.527,122.730,46.501.
N-(2-chlorobenzyl)-9-(4-methoxybenzyl)-9H-purin-6-amine(L7)
Light Yellow powder,Yield:47.3%;Mp:164.3-166.9℃;ESI-MS[M+H]+:380.7;1H-NMR(600MHz,CD3Cl):δ(ppm):8.445(s,1H,2-Purine-H),7.675(s,1H,8-Purine-H),7.498-7.513(m,1H,3'-2-Cl-Ph-H),7.362-7.373(m,1H,6'-2-Cl-Ph-H),7.210-7.289(m,2H,4',5'-2-Cl-Ph-H),7.191-7.248(m,2H,2,6'-4-OCH3-Ph-H),6.860-6.886(m,2H,3',5'-4-OCH3-Ph-H),6.350(s,1H,NH),5.277(s,2H,9-C H2),4.615(s,2H,NHCH2),3.801(s,3H,OCH3).13C-NMR(600MHz,CD3Cl):159.831,154.802,154.402,139.833,133.864,129.974,129.721,137.102,114.547,55.426,46.922.
N-(2-chlorobenzyl)-9-(3,5-dimethoxybenzyl)-9H-purin-6-amine(L8)
White powder,Yield:45.6%;Mp:175.2-178.1℃;ESI-MS[M+H]+:410.1;1H-NMR(600MHz,CD3Cl):δ(ppm):8.432(s,1H,2-Purine-H),7.665(s,1H,8-Pu rine-H),7.464-7.578(m,1H,3'-2-Cl-Ph-H),7.352-7.365(m,1H,6'-2-Cl-Ph-H),7.174-7.210(m,2H,4',5'-2-Cl-Ph-H),6.515-6.525(m,1H,4'-3,5-OCH3-Ph-H),6.404(s,2H,2',6'-3,5-OCH3-Ph-H),6.388(s,1H,NH),5.268(s,2H,9-CH2),4.905(s,2H,N-CH2),3.737(s,6H,OCH3).13C-NMR(600MHz,CD3Cl):161.441,154.862,153.439,139.934,137.936,136.123,133.822,129.914,129.694,128.943,127.033,106.022,100.132,55.512,47.313.
N-(2-chlorobenzyl)-9-(4-(trifluoromethyl)benzyl)-9H-purin-6-amine(L9)
White powder,Yield:81.3%;Mp:170.7-172.5℃;ESI-MS[M+H]+:418.3;1H-NMR(600MHz,CD3Cl):δ(ppm):8.343(s,1H,2-Purine-H),7.874(s,1H,8-Pur ine-H),7.593-7.606(d,2H,3',5'-4-CF3-Ph-H,J=7.8Hz),7.480-7.495(m,1H,3'-2-Cl-Ph-H),7.369-7.383(m,3H,4',5',6'-2-Cl-Ph-H),7.191-7.229(m,2H,2',6'-4-CF3-Ph-H),6.251(s,1H,NH),5.464(s,2H,9-CH2),4.872(s,2H,N-CH2).13C-NMR(600MH z,CD3Cl):154.922,153.714,139.805,139.676,133.892,130.203,129.735,129.034,128.034,127.143,126.204,46.745.
N-(2-chlorobenzyl)-9-(3-methoxybenzyl)-9H-purin-6-amine(L10)
White powder,Yield:47.3%;Mp:145.2-147.1℃;ESI-MS[M+H]+:380.4;1H-NMR(600MHz,CD3Cl):δ(ppm):8.423(s,1H,2-Purine-H),7.654(s,1H,8-Purine-H),7.489-7.532(m,1H,3'-2-Cl-Ph-H),7.384-7.396(m,1H,6'-2-Cl-Ph-H),7.195-7.213(m,2H,4',5'-2-Cl-Ph-H),6.819-6.855(m,4H,2',4',5',6'-3-OCH3-Ph-H),6.591(s,1H,NH),5.834(s,2H,9-CH2),4.956(s,2H,N-CH2),3.873(s,3H,-OCH3).13C-NMR(600MHz,CD3Cl):160.223,154.821,153.452,139.953,137.251,136.121,133.833,130.237,129.492,129.751,128.954,127.106,120.130,113.823,55.243,47.244,42.446.
N-(4-fluorobenzyl)-9H-purin-6-amine(W1)
Yellow powder,Yield:80.1%;Mp:155.2-157.1℃;ESI-MS[M+H]+:244.2;1H-NMR(600MHz,DMSO-d6):δ(ppm):12.961(s,1H,9-Purine-H),8.653(s,1H,2-Purine-H),8.093(s,1H,8-Purine-H),7.285-7.337(d,2H,2,6-Ph-H,J=8.0Hz),7.124-7.243(d,2H,3,5-Ph-H,J=8.0Hz),6.721(s,1H,NH),5.901(s,2H,N-CH2).13C-N MR(600MHz,DMSO-d6):154.787,152.314,151.236,139.154,128.546,126.784,119.414,43.024.
N-(3-methoxyphenyl)-9H-purin-6-amine(W2)
Yellow powder,Yield/%:76.5;Mp:146.2-149.1℃;ESI-MS[M+H]+:242.3;1H-NMR(600MHz,DMSO-d6):δ(ppm):10.891(s,1H,9-Purine-H),8.621(s,1H,2-Purine-H),8.232(s,1H,8-Purine-H),7.209-7.232(m,1H,6-Ph-H),7.120-7.134(m,2H,4,5-Ph-H),6.825-6.825(m,1H,2-Ph-H),6.571(s,1H,NH),3.762(s,3H,CH3).13C-NMR(600MHz,DMSO-d6):162.121,152.914,150.346,143.734,141.236,129.456,119.224,109.523,108.455,100.235,56.348.
N-(3-chlorophenyl)-9H-purin-6-amine(W3)
Green powder,Yield:86.2%;Mp:135.1-137.9℃;ESI-MS[M+H]+:246.7;1H-NMR(600MHz,DMSO-d6):δ(ppm):10.842(s,1H,9-Purine-H),8.622(s,1H,2-Purine-H),7.802(s,1H,8-Purine-H),7.509-7.472(m,1H,6-Ph-H),7.220-7.324(d,2H,4,5-Ph-H),6.927-7.125(d,1H,2-Ph-H),6.651(s,1H,NH).13C-NMR(600MHz,DMSO-d6):153.965,152.673,144.984,139.761,136.128,131.245,121.786,118.745,117.563.
N-(4-chloro-3-fluorophenyl)-9H-purin-6-amine(W4)
White powder,Yield:73.9%;Mp:135.1-138.2℃;ESI-MS[M+H]+:264.6;1H-NMR(600MHz,DMSO-d6):δ(ppm):10.636(s,1H,9-Purine-H),8.552(s,1H,2-Purine-H),7.792(s,1H,8-Purine-H),7.420-7.424(m,1H,6-Ph-H),7.217-7.255(m,1H,5-Ph-H),7.127-7.225(m,1H,2-Ph-H),6.672(s,1H,NH).13C-NMR(600MHz,D MSO-d6):164.39,151.93,150.73,144.96,139.83,131.49,118.18,109.84,107.39.N-(4-chlorophenyl)-9H-purin-6-amine(W5)
White powder,Yield:73.9%;Mp:156.7-158.2℃;ESI-MS[M+H]+:246.2;1H-NMR(600 MHz,DMSO-d6):δ(ppm):12.531(s,1H,9-Purine-H),8.141(s,1H,2-Purine-H),7.562(s,1H,8-Purine-H),7.485-7.524(d,2H,2,6-Ph-H,J=7.6Hz),6.934-7.143(d,2H,3,5-Ph-H,J=8.0Hz),6.456(s,1H,NH).13C-NMR(600MHz,DM SO-d6):153.965,152.674,144.984,139.763,136.124,131,245,121.784,118.741,117.568.
N-(furan-2-ylmethyl)-9H-purin-6-amine(W6)
White powder,Yield:76.4%;Mp:162.2-164.8℃;ESI-MS[M+H]+:216.2;1H-NMR(600 MHz,DMSO-d6):δ(ppm):12.942(s,1H,9-Purine-H),8.113-8.202(s,3H,2,8-Purine-H+NH),7.538(s,1H,4'-Furan-H),6.358(s,1H,3'-Furan-H),6.230(s,1H,2'-Furan-H),4.694(s,2H,N-CH2).13C-NMR(600MHz,DMSO-d6):154.846,152.795,151.592,146.713,143.575,137.414,119.723,113.454,107.232,39.734.
N-(4-methoxyphenyl)-9H-purin-6-amine(W7)
Grey powder,Yield:74.8%;Mp:161.9-164.2℃;ESI-MS[M+H]+:242.2;1H-NMR(600 MHz,DMSO-d6):δ(ppm):11.291(s,1H,9-Purine-H),8.742(s,1H,2-Purine-H),8.033(s,1H,8-Purine-H),7.585-7.624(d,2H,2,6-Ph-H,J=8.0Hz),7.034-7.123(d,2H,3,5-Ph-H,J=8.0Hz),6.744(s,1H,NH),3.963(s,3H,-CH3).13C-N MR(600MHz,DMSO-d6):153.756,153.746,149.243,136.794,133.722,129.563,122.135,119.233,114.483,60.235.
N-((4-((9H-purin-6-yl)amino)phenyl)sulfonyl)acetamide(W8)
Grey powder,Yield:74.3%;Mp:200.1-202.7℃;ESI-MS[M+H]+:333.4;1H-NMR(600MHz,DMSO-d6):δ(ppm):12.052(s,1H,9-Purine-H),11.461(s,1H,NH-C=O),8.843(s,1H,2-Purine-H),8.731(s,1H,8-Purine-H),7.475-7.524(d,2H,3,5-Ph-H,J=8.0Hz),7.204-7.243(d,2H,2,6-Ph-H,J=7.8Hz),6.632(s,1H,NH),1.923(s,3H,-CH3).13C-NMR(600MHz,DMSO-d6):172.095,154.283,152.863,144.264,143.791,139.855,129.986,119.778,111.793,28.372.
4-((9H-purin-6-yl)amino)phenol(W9)
White powder,Yield:77.3%;Mp:156.1-157.3℃;ESI-MS[M+H]+:228.1;1H-NMR(600MHz,DMSO-d6):δ(ppm):12.091(s,1H,9-Purine-H),8.782(s,1H,2-Purine-H),7.892(s,1H,8-Purine-H),7.285-7.324(d,2H,2,6-Ph-H,J=7.6Hz),6.934-7.143(d,2H,3,5-Ph-H,J=8.0Hz),6.561(s,1H,NH),5.534(s,1H,OH).13C-NMR(600MHz,DMSO-d6):153.236,151.837,143.924,140.713,138.242,131.232,129.652,123.522,119.235.
6-(pyrrolidin-1-yl)-9H-purine(W10)
White powder,Yield:85.2%;Mp:162.1-164.2℃;ESI-MS[M+H]+:190.2;1H-NMR(600MHz,DMSO-d6):δ(ppm):13.241(s,1H,9-Purine-H),8.742(s,1H,2-Purine-H),8.121(s,1H,8-Purine-H),3.786(m,4H,N-CH2+N-CH2),1.879(m,4H,CH2CH2).13C-NMR(600MHz,DMSO-d6):159.122,155.124,153.527,149.238,138.955,127.944,125.734,117.684,60.235,42.824.
本發明所合成目標化合物的性狀及其溶解性如下:
化合物L1-2,L8-10,W4-6,W9-10為白色固體。L3,L7為淺黃色,W1-2,L4,L6為黃色,L5,W3為綠色,W7-8為灰色。易溶于DMSO、DMF中。
本發明所合成的化合物,進行質譜測試,正極均顯示了[M+1]+,且信號較強,本發明所合成的化合物,進行1H-NMR和13C-NMR測試,從1H-NMR和13C-NMR圖譜上可以清楚的看到化合物的氫信號及其所處的化學位移。
二、化合物抗炎活性數據
1、合成化合物細胞毒性測試
(1)細胞鋪板:1)計算實驗所需細胞的密度,小心地吸取培養瓶中的培養液,接著加入一定量的PBS液把培養液洗干凈,再用胰酶溶液(0.25%)溶解貼壁生長細胞3min,然后往培養基中加入10%的血清,用來中止胰酶繼續消化細胞,吹打瓶壁使得貼壁生長的細胞脫離進入并且均勻地分散于培養液中,在培養瓶中加入1640培養液,并將細胞稀釋至所需的密度44000cells/mL;2)按每個孔的濃度90μl/well的標準,將所配好的細胞溶液均勻地加入到96孔酶標孔中,用無菌的PBS填充邊緣孔;3)取出96孔酶標培養板,按照要求合理地設置好實驗組和對照組。其中以inhibitor3作為陽性對照藥,實驗組各組使用一種化合物,每種化合物分別設成9個相同的濃度梯度,每個梯度濃度設置三個復孔,作為重復實驗,保證實驗的準確性和可靠性,對照組中的每一個孔則直接接種100μl細胞懸液,不加入任何物質,可以檢測實驗是否受到污染;4)最后合適的條件下培養細胞,具體要求是在5%CO2,37℃的條件下,孵育24h。
(2)加入測試化合物:1)將所合成的測試化合物和陽性對照物均溶解于100%的DMSO中配置成濃度為200x的溶液;2)用移液槍準確地吸取上述配置好的溶液7μl到含有133μl的完全培養基中(即稀釋20倍,最后得到為10x的溶液);3)吸取上述稀釋后的溶液10μL均勻地加入到96孔酶標板中(最后得到為1x的溶液),4)最后在合適的條件下培養細胞,具體要求是在5%CO2,37℃的條件下,孵育24h。
(3)、結果測定:1)將步驟(2)中,經過24h孵育的96孔酶標板取出,按要求先放置在室溫下30min,備用;2)根據先前計算好的量,向每孔加入30μl的Cell Titer-Glo試劑并且搖晃10min用來誘導細胞并且促使細胞溶解作用;3)放置在室溫2min后,使得熒光信號達到穩定的狀態;4)用酶聯免疫的方法檢測波長在570nm處各孔的吸光值,并且準確地記錄下結果。最后按照給出的公式,計算出化合物的抑制率。具體的公式如下:抑制率(%)=(對照孔OD值-實驗孔OD值)/對照孔OD值X100%。
實驗結果:圖2為本發明所有目標化合物毒性檢測的示意圖。從圖2可以看出:合成的化合物毒性均普遍低于陽性對照藥inhibitor 3。
2、ELISA法檢測TNF-α和IL-1β含量
操作方法:
1)配制肉湯——刺激小鼠產生大量巨噬細胞
稱取牛肉膏0.15g,蛋白胨0.5g,NaCl 0.25g,可溶性淀粉3g,將肉湯煮至透明,降至室溫才可以腹腔注射。
2)給小鼠注射肉湯2mL,三天后提細胞(此期間可以將化合物配制好,用DMSO溶解)。
3)提細胞鋪板:小鼠摘眼,放血減少腹腔中紅細胞,后斷髓處死,身體用75%酒精消毒,仰位定在泡沫上,固定頭,四肢,尾。在胸廓正中線中位處,用彎鑷夾起隔膜,用注射器向腹腔內注射RPMI-1640培養基(不含FBS)3~4ml,輕揉腹部,使巨噬細胞與培養基混勻。用彎鑷夾起中間隔膜,用手術剪(豎直方向拿),剪開隔膜,用移液槍將腹腔內液體吸起,移入15ml離心管內,離心1100r,5min,棄上清。向已離心的細胞內加入含有FBS的培養基約2ml,反復輕輕吹打成細胞懸液。細胞計數(20μL/孔),將細胞分到六孔板1ml上培養(5×105/孔)于37℃,5%CO2培養。4~6h后,取出用PBS洗,換液。
4)加10μmol濃度的合成化合物1μl,30min后加入LPS(0.5μg/ul)1μl刺激,分為三組:同種類藥+LPS,LPS(刺激組),con(對照組,只有細胞與DMSO)。
5)上述處理完畢后再放入培養箱中進行孵育>24h。
檢測方法:
(1)包被:取出經過孵化后的培養基,加入40μl的一抗(capure antibody),1mL的coating buffer(10X),用移液槍吹打均勻混勻,加入到ELISA板中,每個孔均加入100μl,用保鮮膜對ELISA板進行包埋,在4℃的條件下過夜。在此期間配置PBST:將500μl的吐溫20溶解于1000mL的PBS溶液之中。
(2)加入AD進行封閉:將過夜培養之后的培養基倒掉,用PBST洗三次,每個孔加入250μl的量,每次用移液槍吹打1~2min,最后一次將培養基倒過來,輕輕在紙上拍干,按每孔200μl的量加入AD溶液,加完之后,用保鮮膜包好,在搖床上封閉1h。當培養基封閉完之后,繼續用PBST溶液洗三次,每次依舊加入250μl的量,用移液槍輕輕吹打1~2min。在進行上述封閉的過程中,可以將上清液拿出解凍。
(3)加樣:按照每孔100μl的量加入一定的混合溶液,其中樣品占5%,AD占95%,用保鮮膜繼續包好,并且在搖床上孵育2h。
(4)加入二抗:取出二抗40μl,AD100mL,充分混勻之后,按照每孔100μl的量,加入到上述的ELISA板中,繼續用保鮮膜進行包好,放在搖床上繼續孵育1h。
(5)加入酶:取出ELISA板后,用PBST洗三次,每孔加入250μl的量,每次用移液槍吹打1~2min,加入HRP酶,每孔的量為100μl,繼續用保鮮膜進行包好,然后放在搖床上繼續孵育1h。
(6)加入顯色劑:用PBST洗三次,每孔加入250μl的量,每次用移液槍吹打1~2min,在避光的條件下,按照每孔100μl的量加入顯色劑TMP,顯色至藍色即可。
(7)終止反應:取出ELISA板后,向每個孔加入50μl加入濃度為2mol/L的H2SO4。
(8)測OD值:在波長為450nm的條件下,測定對炎癥因子的吸光度,根據公式計算。
實驗結果:圖3為本發明所有目標化合物作用于抑制炎癥因子的抑制率的示意圖。從圖3可以看出:合成的化合物L1,L4,W2,W4對炎癥因子的抑制率高于陽性對照藥inhibitor 3,所以這幾種化合物具有較好的抗炎作用。
通過比較目標化合物和陽性對照藥可以發現:化合物L1,L4,W2,W4對炎癥因子TNF-a和IL-6的抑制率達到都超過了50%,最高為80%左右,初步推斷2、9-二取代嘌呤衍生物對抗炎藥物的研發有一定的潛力。4個優選化合物抗炎活性的進一步研究
通過第一部分化合物在10μM濃度下對LPS誘導的TNF-α和IL-1β含量抑制作用的初篩結果,得到化合物L1,L4,W2和W4對炎癥因子TNF-α和IL-1β具有較強的抑制作用。因此,本部分將選取這4個化合物進一步研究其抗炎活性。
3、ELISA法檢測TNF-α、IL-1β、PGE2和IL-6的含量
具體的實驗操作步驟如下:
(1)、包被:取出經過孵化后的培養基,加入40μl的一抗(capure antibody),1mL的coating buffer(10X),用移液槍吹打均勻混勻,加入到ELISA板中,每個孔均加入100μl,用保鮮膜對ELISA板進行包埋,在4℃的條件下過夜。在此期間配置PBST:將500μl的吐溫20溶解于1000mL的PBS溶液之中。
(2)、加入AD進行封閉:將過夜培養之后的培養基倒掉,用PBST洗三次,每個孔加入250μl的量,每次用移液槍吹打1~2min,最后一次將培養基倒過來,輕輕在紙上拍干,按每孔200μl的量加入AD溶液,加完之后,用保鮮膜包好,在搖床上封閉1h。當培養基封閉完之后,繼續用PBST溶液洗三次,每次依舊加入250μl的量,用移液槍輕輕吹打1~2min。在進行上述封閉的過程中,可以將上清液拿出解凍。
(3)、加樣:按照每孔100μl的量加入一定的混合溶液,其中樣品占5%,AD占95%,用保鮮膜繼續包好,并且在搖床上孵育2h。
(4)、加入二抗:取出二抗40μl,AD100mL,充分混勻之后,按照每孔100μl的量,加入到上述的ELISA板中,繼續用保鮮膜進行包好,放在搖床上繼續孵育1h。
(5)、加入酶:取出ELISA板后,用PBST洗三次,每孔加入250μl的量,每次用移液槍吹打1~2min,加入HRP酶,每孔的量為100μl,繼續用保鮮膜進行包好,然后放在搖床上繼續孵育1h。
(6)、加入顯色劑:用PBST洗三次,每孔加入250μl的量,每次用移液槍吹打1~2min,在避光的條件下,按照每孔100μl的量加入顯色劑TMP,顯色至藍色即可。
(7)、終止反應:取出ELISA板后,向每個孔加入50μl加入濃度為2mol/L的H2SO4。
(8)、測OD值:在波長為450nm的條件下,測定對炎癥因子的吸光度,根據公式計算。
實驗結果:圖4為本發明所有目標化合物作用于抑制炎癥因子的抑制率的示意圖。從圖4可以看出:合成的化合物L1,L4,W2和W4對幾種炎癥因子的抑制率普遍接近或高于陽性對照藥inhibitor 3,且有一定劑量依賴性,所以這類化合物具有較好的抗炎作用。
通過比較目標化合物和陽性對照藥可以發現:化合物L1,L4,W2和W4對幾種炎癥因子抑制率普遍接近或高于陽性對照藥inhibitor 3,初步推斷2,9-二取代嘌呤衍生物對抗炎藥物的研發有一定的潛力。
4、NO含量的測定
具體的實驗操作步驟如下:
(1)RAW264.7細胞培養:細胞株購買于中國科學院上海分院的細胞庫,培養條件:雙抗生素(鏈霉素和青霉素)和10%的胎牛血清的DMEM完全培養基中,并放在37℃,5%CO2培養環境中培養。
(2)Griess法檢測NO的含量:取對數期的RAW264.7細胞進行實驗操作,加入LPS,培養30min,加入藥物2.5,5,10,20μmol,繼續培養過夜。取細胞培養液,離心(6000rpm,5min),取10μl細胞上清液,加入Griess試劑(2%對氨基苯磺酰胺用5%H3PO4配制,0.2%的奈乙烯二胺)100μl與之混勻,室溫避光靜置10min,用酶標儀于540nm波長處測定吸光度值,計算樣品中的NO含量。
抑制NO含量結果:圖5為本發明所有目標化合物作用于NO的抑制率的示意圖。從圖5可以看出:合成的化合物合成的化合物L1,L4,W2和W4對幾種炎癥因子的抑制率普遍接近或高于陽性對照藥inhibitor 3,且有一定劑量依賴性,所以這類化合物具有較好的抗炎作用。
通過比較目標化合物和陽性對照藥可以發現:化合物L1,L4,W2和W4對幾種炎癥因子的抑制率普遍接近或高于陽性對照藥inhibitor 3,且有一定劑量依賴性,初步推斷2,9-二取代嘌呤衍生物對抗炎藥物的研發有一定的潛力。
5、RT-PCR的測定
具體的實驗操作步驟如下:
(1)、RNA含量的測定:利用TRIzol方法提取RNA,根據計算加入和適量的TRIzol試劑,混合后靜置5min,按TRIzol:氯仿=5:1的量加入氯仿,靜置3min,然后在12000rpm,4℃離心15min,吸取含有RNA水層進入新的離心管;按TRIzol:異丙醇=1:2的量加入異丙醇,靜置10min,然后12000rpm,4℃離心10min,留沉淀,棄上清;按TRIzol:75%的乙醇(DEPC配置),離心,小心棄去上清。
(2)、RNA濃度和純度的測定:分別用瓊脂糖凝膠電泳和分光光度計檢測所提取RNA的完整性和濃度。
(3)、RT-PCR:
反應體系:
引物序列:qmCOX2(74bp):
Forward Primer5'TGAGCAACTATTCCAAACCAGC3'
Reverse Primer5'GCACGTAGTCTTCGATCACTATC3'
qmGAPDH(149bp):
Forward Primer5'TATGTCGTGGAGTCTACTGGT 3'
Reverse Primer 5'GAGTTGTCATATTTCTCGTGG 3'
qmiNOS(127bp):
Forward Primer5'GTTCTCAGCCCAACAATACAAGA3'
Reverse Primer 5'GTGGACGGGTCGATGTCAC 3'
實驗結果:圖6為本發明所有目標化合物作用于抑制COX和iNOS的示意圖。從圖6可以看出:合成的化合物L1,L4,W2和W4對COX和iNOS的抑制率普遍接近或高于陽性對照藥inhibitor 3,且有一定劑量依賴性,所以這類化合物具有較好的抗炎作用。
通過比較目標化合物和陽性對照藥可以發現:化合物L1,L4,W2和W4對幾種炎癥因子的抑制率普遍接近或高于陽性對照藥inhibitor 3,且有一定劑量依賴性,初步推斷2,9-二取代嘌呤衍生物對抗炎藥物的研發有一定的潛力。
化合物的抗炎活性實驗總結
所合成的20個6,9-二取代嘌呤衍生物先在10μM的濃度條件下,用ELISA法檢測其對TNF-α和IL-1β的抑制作用,初篩選出具有良好抗炎活性的化合物。我們發現化合物L1、L4、W2和W4對炎癥因子顯示出較好的抑制作用,于是開始對這4個化合物進行深入的抗炎活性研究。抗炎活性的深入研究主要體現在以下三個方面,首先是化合物檢測濃度的增加,檢測濃度范圍從10μM,增加到5,2.5μM,探討化合物濃度對抗炎活性的影響。化合物L1、L4、W2和W4濃度與抑制作用呈線性關系,即隨著化合物的濃度增加,其抗炎能力增強。其次是炎癥因子種類的增多,從初篩的兩種炎癥因子(TNF-α和IL-1β)增加到包括IL-6、PGE2和NO在內的五種炎癥因子。化合物L1、L4、W2和W4對這五種炎癥因子均具有抑制作用。最后是檢測水平的增加,從初篩單純考慮炎癥因子水平到深入研究考慮炎癥相關mRNA水平的變化。化合物L1、L4、W2和W4能夠在mRNA水平上,抑制COX-2和iNOS,從而起到抗炎作用。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 含取代芐氧基的醚類化合物作為制備抗腫瘤藥物的應用的制造方法與工藝
- 2-氯-3-(甲基硫烷基)-N-(1-甲基-1H-四唑-5-基)-4-(三氟甲基)苯甲酰胺或其鹽在耐受HPPD抑制劑除草劑的轉基因作物植物的區域中防治不想要的植物的用途的制造方法與工藝
- 一種制備(R)?4?(2?(芐基(甲基)氨基)?羥乙基)苯?1,2?二醇的方法與制造工藝
- 堿式氯化鎂的制備方法與制造工藝
- 一種9?取代?N?(2?氯芐基)嘌呤?6?胺類衍生物及其制備方法和應用與制造工藝
- 烷基二甲基芐基氯化銨的生產工藝的制造方法與工藝
- 一種芐基甲苯的制備方法與制造工藝
- 一種改性堿式氯化鎂的制備方法及其應用與制造工藝
- 一種乙基氯化物生產工藝的制造方法與工藝
- 一種芐基三苯基氯化磷的回流裝置的制造方法
- 6-氯-n-(4-(6-氯煙酰胺)芐基)煙酰胺及其制備和應用
- 一種溴己新藥物中間體n-甲基-n-鄰硝基芐基環己胺的合成方法
- N-甲基-n-((3r,4r)-4-甲基-1-芐基-3-哌啶基)-7h-吡咯并[2,3-d]嘧啶-4-胺的一種結 ...的制作方法
- 6-氯-N-(取代芐基)-1H-吡咯并[2,3-b]吡啶-2-酰胺化合物及其制備方法和應用
- 一種醫藥中間體nα-z-s-芐基-l-半胱氨酸-4-硝基苯酯的合成方法
- 一種單糖甲苷的芐基化方法
- 2-(5-溴-2-甲基芐基)-5-(4-氟苯基)噻吩的制備方法
- 用于制備(2-甲基-1-(3-甲基芐基)-1H-苯并[d]咪唑-5-基)(哌啶-5-基)甲酮的方法
- (r)-1-芐基-3-甲基-1,2,3,6-四氫哌啶的合成方法
- 一種2,3-環氧丙基三甲基氯化銨開環聚合的方法
- 6-氯-n-(4-(6-氯煙酰胺)芐基)煙酰胺及其制備和應用
- 一種(Z)-3-芐基烷基氨-2-苯氧基-α,β-不飽和丙烯酰芳胺及其制備方法
- 一種氯化銨中和反應釜的制作方法
- 8-芐基-2,8-二氮雜雙環[4,3,0]-壬烷的制備方法
- 9-(2’-芳基芐基)-3,6-二氨基咔唑化合物及其制備方法
- 6-氯-N-(取代芐基)-1H-吡咯并[2,3-b]吡啶-2-酰胺化合物及其制備方法和應用
- 一種(3r,4r)-(1-芐基-4-甲基哌啶-3-基)甲胺-l-二對甲苯甲酰酒石酸鹽的制備方法
- 一種線型雙嵌段帶芐锍基及活性氯原子側基功能大分子的合成方法
- 一種醫藥中間體nα-z-s-芐基-l-半胱氨酸-4-硝基苯酯的合成方法
- 包括n-[3-氯-4-(3-氟芐氧基)苯基]-6-[5({[2-(甲基磺酰基)乙基]氨基}甲基)-2-呋喃 ...的制作方法