一種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑及其制備方法與流程
本發明屬于藥物化學領域,具體涉及一種含硒類化合物及其制備技術。
背景技術:
作為一種主要的翻譯后修飾,賴氨酸側鏈酰基化及其去酰基化已在近年證明能有效地調節細胞內被修飾蛋白質的結構和功能[1-3]。細胞內蛋白賴氨酸側鏈酰基化及去酰基化是一個動態過程,其中的酰基可以是較小的乙酰基(acetyl)也可以是較龐大的丁二酰基(succinyl)或十四酰基(myristoyl)。需要指出的是,根據現有的知識,酰基化可以是酶催化的過程(比如被乙酰轉移酶家族成員(protein lysine acetyltransferases)所催化)[4]也可以是非酶催化的過程[5],而去酰基化是酶催化的過程,即被蛋白酰基賴氨酸去酰化酶家族成員(protein acyl-lysine deacylases)所催化[6-8]。
Sirtuin代表一類細胞內蛋白酰基賴氨酸去酰化酶[7,8]。Sirtuin能催化NAD+和酰基賴氨酸的縮合,形成去酰化的產物以及煙酰胺(nicotinamide)和2’-O-AADPR。現有研究表明,除了組蛋白(histones),sirtuin也接受其它細胞內蛋白質作為天然底物[9]。從細菌到人類的各種活性生物體中均已發現了sirtuin[10]。酵母中的沉默信息調節蛋白2(Sir2)是所發現的首例sirtuin;它的蛋白乙酰賴氨酸去乙酰催化活性是在2000年被發現的[11]。迄今為止,哺乳類動物和人體中已發現了7個sirtuin,即SIRT1,SIRT2,SIRT3,SIRT4,SIRT5,SIRT6,SIRT7。SIRT1,SIRT2和SIRT3均能有效地催化去除較小的乙酰基(acetyl)和較龐大的十四酰基(myristoyl);SIRT5能有效地催化去除丁二酰基(succinyl);SIRT6能有效地催化去除十四酰基(myristoyl)[1,7]。
Sirtuin催化的去酰化反應已被證明能有效地調節一些非常重要的生命過程,比如基因轉錄,細胞凋亡,DNA損傷修復,代謝[12-14],并且該去酰化反應的抑制被認為是當今發展針對一些人類疾病(比如癌癥和代謝疾病)的一個重要新型策略[15-17]。Sirtuin抑制劑也應能幫助更進一步探索抑制sirtuin催化的去酰化反應的治療潛力。
現有的sirtuin抑制劑主要由兩大途徑獲得[7,15,18]:化合物庫篩選(包括虛擬篩選)和sirtuin催化機制導向的設計。后者是由我們課題組(在美國Akron大學期間)和John M.Denu教授課題組(美國Wisconsin大學Madison分校)所開拓的一個重要領域[19,20]。到目前為止,多種sirtuin催化機制導向的抑制劑所賴以發揮sirtuin抑制功效的催化機制導向的sirtuin抑制彈頭已被發現[7,18];但是在所有的彈頭當中,目前只有硫脲彈頭能被sirtuin催化形成一個絕對不能夠被繼續催化轉化的中間體(即化學穩定的異硫脲中間體);而其它的彈頭被sirtuin催化形成的中間體仍然能夠緩慢地被sirtuin繼續催化轉化形成終產物,以至于削弱對于sirtuin的抑制功效。然而,硫的極化度和親核性相對于硒來說都較小,所以硫脲彈頭在sirtuin催化下與NAD+的親核取代反應的能力比硒脲要差,并且硫脲的抗氧化能力也比硒脲的要弱。
參考文獻:
1.Choudhary,C.;Weinert,B.T.;Nishida,Y.;Verdin,E.;Mann,M.Nat.Rev.Mol.Cell Biol.2014,15,536-550.
2.Bernal,V.;-Cerezo,S.;Gallego-Jara,J.;Ecija-Conesa,A.;de Diego,T.;Iborra,J.L.;Cánovas,M.New Biotechnol.2014,31,586-595.
3.Ringel,A.E.;Roman,C.;Wolberger,C.Protein Sci.2014,23,1686-1697.
4.Aka,J.A.;Kim,G.W.;Yang,X.J.Handbook of Experimental Pharmacology 2011,(206),1-12.
5.Wagner,G.R.;Payne,R.M.J.Biol.Chem.2013,288,29036-29045.
6.Seto,E.;Yoshida,M.Cold Spring Harb.Perspect.Biol.2014,6,a018713.
7.Chen,B.;Zang,W.;Wang,J.;Huang,Y.;He,Y.;Yan,L.;Liu,J.;Zheng W.Chem.Soc.Rev.2015,44,5246-5264.
8.Bheda,P.;Jing,H.;Wolberger,C.;Lin,H.Annu.Rev.Biochem.2016,85,405-429.
9.Martínez-Redondo,P.;Vaquero,A.Genes Cancer 2013,4,148-163.
10.Greiss,S.;Gartner,A.Mol.Cells 2009,28,407-415.
11.Imai,S.;Armstrong,C.M.;Kaeberlein,M.;Guarente,L.Nature 2000,403,795-800.
12.Dai,Y.;Faller,D.V.Transl.Oncogenomics 2008,3,53-65.
13.Choi,J.E.;Mostoslavsky,R.Curr.Opin.Genet.Dev.2014,26,24-32.
14.Sebastián,C.;Mostoslavsky,R.Semin Cell Dev Biol.2015,43,33-42.
15.Hu,J.;Jing,H.;Lin,H.Future Med Chem.2014,6,945-966.
16.Imai,S.;Guarente,L.Trends Pharmacol Sci.2010,31,212-220.
17.Min,S.W.;Sohn,P.D.;Cho,S.H.;Swanson,R.A.;Gan,L.Front Aging Neurosci.2013,5,53.
18.Zheng,W.Mini Rev Med Chem.2013,13,132-154.
19.Fatkins,D.G.;Monnot,A.D.;Zheng,W.Bioorg.Med.Chem.Lett.2006,16,3651-3656.
20.Smith,B.C.;Denu,J.M.Biochemistry.2007,46,14478-14486.
技術實現要素:
本發明的目的在于提供一種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑及其制備方法。本發明中的sirtuin抑制劑將含有硒脲類抑制彈頭,以提高之前報道的含有硫脲類抑制彈頭的sirtuin抑制劑的抑制強度及抗氧化能力。采用的具體技術方案如下:
第一種 含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑,其特征在于具有下列結構通式(I):
R1是任何烷基、芳基或者芳烷基;X是O或者S或者NH;Y是C=O或者C=S;Z是O或者NH或者CH2;R2是H或者任何烷基、芳基或者芳烷基;R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3;
所述結構通式(I)中:
R1-X-Y是具有任何氨基酸序列的肽,氨基酸數目1-15;其中X是一個氨基酸中與氨基直接相連的碳,Y是羰基;
Z-R2是具有任何氨基酸序列的肽,氨基酸數目1-15;其中Z是NH;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3;
所述結構通式(I)中:
R1是H或者任何烷基、芳基或者芳烷基;X是H或者任何烷基、芳基或者芳烷基;
Y是任何烷基、芳基或者芳烷基;
Z是O或者NH或者CH2;
R2是H或者任何烷基、芳基或者芳烷基;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
第二種 含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑,其特征在于具有下列結構通式(II):
X是任何烷基、芳基或者芳烷基;
Y是任何烷基、芳基或者芳烷基;
Z是–C(=O)-NH–或者–C(=O)-O–或者–NH-C(=O)-NH–或者–O-C(=O)-NH–或者
–O-C(=O)-O–或者–NH-C(=O)–或者–O-C(=O)–或者–NH-C(=O)-O–或者–S–或者–S-S–或
者
–C=C–或者當直接連接在芳環上時,連接點是鄰位或者間位或者對位;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3;
所述結構通式(II)中:
X是–C(=O)–或者–C(=S)–或者–NH-C(=O)–或者–NH-C(=S)–或者–O-C(=O)–或者
–S-C(=O)–或者–S-C(=S)–;
Y是NH或者O或者S;
Z是–C(=O)-NH–或者–C(=O)-O–或者–NH-C(=O)-NH–或者–O-C(=O)-NH–或者
–O-C(=O)-O–或者–NH-C(=O)–或者–O-C(=O)–或者–NH-C(=O)-O–或者–S–或者–S-S–或
者
–C=C–或者當直接連接在芳環上時,連接點是鄰位或者間位或者對位;
X和Z之間的連接為任何烷基、芳基或者芳烷基;
Y和Z之間的連接為任何烷基、芳基或者芳烷基;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
所述結構通式(II)中:
X是具有任何氨基酸序列的肽,氨基酸數目1-15;
Y是具有任何氨基酸序列的肽,氨基酸數目1-15;
Z是–C(=O)-NH–或者–C(=O)-O–或者–NH-C(=O)-NH–或者–O-C(=O)-NH–或者
–O-C(=O)-O–或者–NH-C(=O)–或者–O-C(=O)–或者–NH-C(=O)-O–或者–S–或者–S-S–或
者
–C=C–或者當直接連接在芳環上時,連接點是鄰位或者間位或者對位;
X和Z之間的連接為直接或者通過任何烷基、芳基或者芳烷基連接到X肽的N端或者X
肽中任何一個氨基酸的側鏈;Y和Z之間的連接為直接或者通過任何烷基、芳基或者芳烷基連接到Y肽的C端或者Y;
肽中任何一個氨基酸的側鏈;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
第三種 含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑,其特征在于具有下列結構通式(III):
X是–C(=O)–或者–C(=S)–或者–NH-C(=O)–或者–NH-C(=S)–或者–O-C(=O)–或者
–S-C(=O)–或者–S-C(=S)–或者任何一個氨基酸;
Y是NH或者O或者S或者任何一個氨基酸;
X和Y的連接:
通過一個具有任何氨基酸序列的肽,氨基酸數目1-20;連接方式:X端
接該肽的N端,Y端接該肽的C端;或者X端接該肽的C端,Y端接該肽的N端;或者X端接該肽的N端,
Y端接該肽中的一個氨基酸側鏈;或者X端接該肽的C端,Y端接該肽中的一個氨基酸
側鏈;
或者Y端接該肽的N端,X端接該肽中的一個氨基酸側鏈;或者Y端接該肽的C端,X
端接
該肽中的一個氨基酸側鏈;或者X端接該肽中的一個氨基酸側鏈,Y端接該肽中的另一
個氨基酸側鏈;
R3是甲基(CH3)或者CH2CH2COOH或者或者CH2-(CH)10-CH3或者
CH2-(CH)11-CH3或者CH2-(CH)12-CH3或者CH2-(CH)13-CH3或者CH2-(CH)14-CH3。
所述第一種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑的制備方法,其特征在于:將結構通式(IV)的化合物(或者其鹽酸鹽)與結構通式(V)的化合物反應而得:所述的結構通式(IV)為結構通式(V)為
R1,X,Y,Z,R2,R3的定義與權利要求1至3項中的一致,反應時反應物中所有敏感基團需要被預先保護,等反應結束后統一去除保護基團。
所述第二種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑的制備方法,其特征在于通過將結構通式(VI)的化合物或者其鹽酸鹽與結構通式(V)的化合物反應制備而得;
所述的結構通式(VI)為所述的結構通式(V)為X,Y,Z,R3的定義與權利要求4至6項中的一致,反應時反應物中所有敏感基團需要被預先保護,等反應結束后統一去除保護基團。
所述第三種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑的制備方法,其特征在于:通過將結構通式(VII)的化合物或者其鹽酸鹽與結構通式(V)的化合物反應而得;
所述的結構通式(VII)為所述的結構通式(V)為X,Y,R3的定義與權利要求第7項中的一致,反應時反應物中所有敏感基團需要被預先保護,等反應結束后統一去除保護基團。
所述三種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑在發展所有sirtuin催化活性抑制劑中的用途。
所述三種含有硒脲類sirtuin抑制彈頭的sirtuin抑制劑所發展出的所有sirtuin催化活性抑制劑在治療癌癥,神經退行性疾病,代謝疾病中的運用。
本發明具有有益效果。因為硒比硫有著更高的極化度以至于更強的親核性,所以硒脲彈頭比之前報道的硫脲彈頭更容易進行sirtuin催化的第一步與NAD+的親核取代反應,以及比硫脲彈頭具有更強的抗氧化能力,所以本發明的含有硒脲類sirtuin抑制彈頭的抑制劑比之前報道的含有硫脲類sirtuin抑制彈頭的抑制劑具有更強的sirtuin抑制功效及抗氧化能力。本發明的含有硒脲類sirtuin抑制彈頭的抑制劑可用于發展新型的治療人類疾病的藥物,具體地,在治療癌癥、神經退行性疾病、代謝疾病中能得到很好的應用。
附圖說明
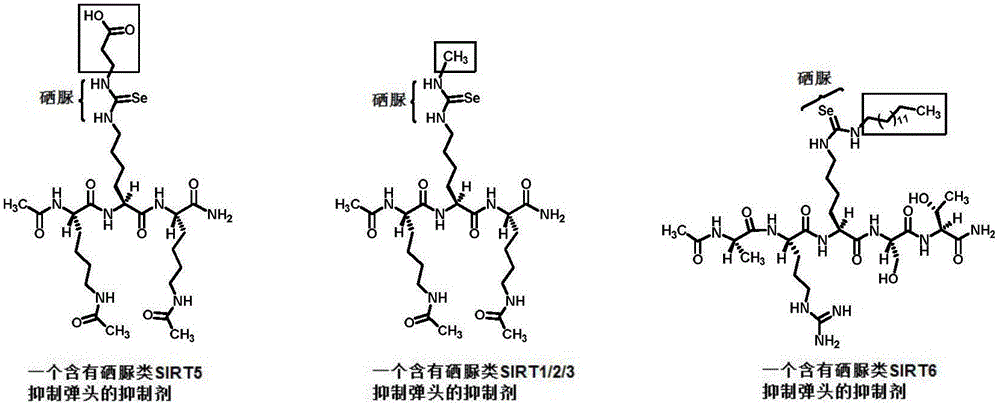
圖1中從左到右分別為含有硒脲類SIRT5,SIRT1/2/3,SIRT6抑制彈頭的三個抑制劑。
圖2為本發明的硒脲類SIRT5抑制劑的合成方案。
圖3為本發明的硒脲類SIRT1/2/3抑制劑的合成方案。
圖4為本發明的硒脲類SIRT6抑制劑的合成方案。
圖5為本發明的另一個硒脲類SIRT5抑制劑的合成方案。
具體實施例
下面結合附圖和具體實施例對本發明的技術方案做進一步的詳細說明。需要指出的是,本發明人課題組在之前的工作中(參見:Zang,W.;Hao,Y.;Wang,Z.;Zheng,W.Bioorg.Med.Chem.Lett.2015,25,3319-3324;Liu,J.;Zheng,W.Org.Biomol.Chem.2016,14,5928-5935)運用了圖1中的肽骨架將硫脲類的抑制彈頭裝入以評估各個彈頭的sirtuin抑制強度,所示的三個彈頭的硫脲版是我們之前所發現的最強的硫脲類SIRT5,SIRT1/2/3,SIRT6抑制彈頭,所以這些同樣的肽骨架也被用于裝入硒脲類sirtuin抑制彈頭以評估它們對于sirtuin的抑制強度,如圖1所示。
實施例1.一個含有硒脲類SIRT5抑制彈頭的抑制劑(圖1)的化學合成。該化合物的合成過程如圖2所示,具體步驟如下:
步驟一.3mmol H3COOC(CH2)2NHCHO溶于15ml的DCM中,加3.6mmol伯吉斯試劑,回流反應2h,生成黃色液體;加10ml的DCM稀釋,用10ml蒸餾水分液兩次,棄水層;5ml的飽和食鹽水分液,保留有機層。往有機層中加入無水硫酸鈉干燥,經過濾,旋蒸,得到產物一。
步驟二.將產物一充分溶解于30ml的四氫呋喃(THF)中,加入三乙胺及0.48g硒粉加熱回流至充分反應,生成深黃色液體;對所述深黃色液體使用硅藻土過濾,得濾液,經旋蒸、稀鹽酸酸化后,再加乙酸乙酯萃取兩次,得有機層;對有機層繼續用蒸餾水洗去過量的酸后,再用飽和食鹽水分離掉過量的水,用無水硫酸鈉干燥,過濾取有機層并經旋蒸后,得產物二。所述步驟二為無水無氧反應。
步驟三.稱取0.02mmol賴氨酸三聚體,加三乙胺調pH到7,再加入2.8l三乙胺。同時取5μl的產物二溶于250μlDMF和65 l水的混和溶劑中。所配制的兩個溶液混合后,先在零下80攝氏度存放4.5min,然后在4攝氏度反應2h,之后用冰乙醚沉降得到產物三。
步驟四.將產物三溶解于甲醇125μl和超純水42μl的混合溶劑中,加入2.1mg氫氧化鋰一水合物(LiOH·H2O),混合均勻,放置在零下80攝氏度4.5min以減緩初始反應速率,然后在4攝氏度環境下充分反應,鹽酸酸化后進行冰乙醚沉降處理并使用高效液相色譜法(HPLC)純化,得到硒脲類SIRT5抑制彈頭及含有它的硒脲類SIRT5抑制劑。
實施例2.一個含有硒脲類SIRT1/2/3抑制彈頭的抑制劑(圖1)的化學合成。該化合物的合成過程如圖3所示,具體步驟如下:
步驟一.2mmol CH3NHCHO溶于6ml的DCM中,加3mmol伯吉斯試劑,回流反應2h;加5ml的DCM稀釋,用5ml蒸餾水分液兩次,棄水層;2ml飽和食鹽水分液,保留有機層。有機層中加入無水硫酸鈉干燥,經過濾,旋蒸,得到產物一。
步驟二.將產物一充分溶解于24ml四氫呋喃(THF)中,加入三乙胺及0.72g硒粉加熱回流5h,生成粗品;對所述粗品使用硅藻土過濾,得濾液,經旋整、稀鹽酸酸化后,再加乙酸乙酯萃取兩次,得有機層;對有機層繼續用蒸餾水洗去過量的酸后,再用飽和食鹽水分離掉過量的水,用無水硫酸鈉干燥,過濾取有機層并經旋蒸后,得產物二。所述步驟二為無水無氧反應。
步驟三.稱取0.02mmol賴氨酸三聚體,加三乙胺調pH到7,再加入2.8 l三乙胺。同時取5μl的產物二溶于250μlDMF和65l水的混和溶劑中。所配制的兩個溶液混合后,先在零下80攝氏度存放5min,然后在4攝氏度反應2h,之后用冰乙醚沉降產物并使用高效液相色譜法(HPLC)純化,得到硒脲類SIRT1/2/3抑制彈頭及含有它的硒脲類SIRT1/2/3抑制劑。
實施例3.一個含有硒脲類SIRT6抑制彈頭的抑制劑(圖1)的化學合成。該化合物的合成過程如圖4所示。
步驟一.通過固相多肽合成(SPPS)的方法,側鏈完全保護的五肽被接在MBHA樹脂上。
步驟二.經1%的TFA/DMF溶液處理,中間位置的賴氨酸側鏈被選擇性地脫保護釋放出游離的氨基。
步驟1a.1mmol H3C(CH2)11NHCHO溶于10ml的DCM,加1.6mmol伯吉斯試劑,回流反應3h;加5ml的DCM稀釋,用15ml蒸餾水分液兩次,棄水層;10ml飽和食鹽水分液,保留有機層;有機層中加入無水硫酸鈉干燥,經過濾,旋蒸,得到產物一。
步驟1b.將產物一充分溶解于15ml四氫呋喃(THF)中,加入0.97ml三乙胺及0.24g硒粉加熱回流至充分反應,生成粗品;對所述粗品使用硅藻土過濾,得濾液,經旋蒸、稀鹽酸酸化后,再加乙酸乙酯萃取兩次,得有機層;對有機層繼續用蒸餾水洗去過量的酸后,再用飽和食鹽水分離掉過量的水,用無水硫酸鈉干燥,過濾取有機層并經旋蒸后,得產物二。所述步驟1b為無水無氧反應。
步驟三.取5μl的產物二溶于250μl DMF和65l水的混和溶劑中,然后將此溶液與步驟二得到的樹脂混合,先在零下80攝氏度存放5.5min,之后在4攝氏度反應2h,然后樹脂用DMF和DCM洗滌,并用真空泵干燥,得到仍連接在樹脂上的含有硒脲類SIRT6抑制彈頭的側鏈完全保護的五肽。
步驟四.步驟三得到的干燥樹脂與TFA/DCM/H2O的混合溶劑混勻,在室溫反應4h后過濾,濾液經旋蒸濃縮后用冰乙醚沉降產物并使用高效液相色譜法(HPLC)純化,得到硒脲類SIRT6抑制彈頭及含有它的硒脲類SIRT6抑制劑。
實施例4.另一個含有硒脲類SIRT5抑制彈頭的抑制劑的化學合成。該化合物的合成如圖5所示,具體過程如下:
步驟一.3mmol H3COOC(CH2)2NHCHO溶于15ml的DCM中,加3.6mmol伯吉斯試劑,回流反應2h,生成黃色液體;加10ml的DCM稀釋,用10ml蒸餾水分液兩次,棄水層;5ml飽和食鹽水分液,保留有機層;有機層中加入無水硫酸鈉干燥,經過濾,旋蒸,得到產物一。
步驟二.將產物一充分溶解于30ml四氫呋喃(THF)中,加入三乙胺及0.48g硒粉加熱回流至充分反應,生成深黃色液體;對所述深黃色液體使用硅藻土過濾,得濾液,經旋蒸、稀鹽酸酸化后,再加乙酸乙酯萃取兩次,得有機層;對有機層繼續用蒸餾水洗去過量的酸后,再用飽和食鹽水分離掉過量的水,用無水硫酸鈉干燥,過濾取有機層并經旋蒸后,得產物二。所述步驟二為無水無氧反應。
步驟三.取5μl的產物二溶于250μl DMF和65 l水的混合溶劑中,然后將此溶液與0.02mmol如圖5所示的環肽混合,先在零下80攝氏度存放4.5min,之后在4攝氏度反應2h,旋蒸后得到產物三。
步驟四.產物三與TFA/DCM/H2O的混合溶劑混勻,在室溫反應4h后旋蒸濃縮,之后用冰乙醚沉降產物并使用高效液相色譜法(HPLC)純化,得到產物四。
步驟五.產物四然后溶解于甲醇125μl和超純水42μl的混合溶劑中,加入2.1mg氫氧化鋰一水合物(LiOH·H2O),混合均勻,放置在零下80攝氏度4.5min以減緩初始反應速率,然后在4攝氏度環境下充分反應,鹽酸酸化后進行冰乙醚沉降處理并使用高效液相色譜法(HPLC)純化,得到最終產物即另一個含有硒脲類SIRT5抑制彈頭的抑制劑。
- 還沒有人留言評論。精彩留言會獲得點贊!