一種基于四芳基卟啉鐵催化合成(E)?β?硝基苯乙烯衍生物的方法與流程
本發明涉及一種α,β-不飽和硝基烯烴衍生物的合成方法,特別涉及一種苯乙烯類化合物在含四芳基卟啉鐵(iii)、碘化銨和叔丁基過氧化氫的體系中一鍋反應,高產率高選擇性合成反式α,β-不飽和硝基苯乙烯烴衍生物的方法,屬于有機合成領域。
背景技術:
α,β-不飽和硝基烯烴是一類具有生物活性的化合物。例如,不飽和的硝基脂肪酸是一類新的內源性抗炎介質;不飽和硝基油酸能防止鼠腎缺血和再灌注損傷。同時α,β-不飽和硝基烯烴是一類重要的藥物及有機中間體化合物,很容易轉化成多種不同的化合物,在很多領域都有著重要的作用。例如,β-硝基苯乙烯是用于制備幾種苯乙胺和殺真菌的中間體(《化學文摘》(chemicalabstracts),vol.118,no.38576k)。α,β-不飽和硝基烯烴還被廣泛用于一些反應中的michael受體,如醛、酮與硝基烯烴的不對稱michael反應,吲哚、吡咯與硝基烯烴的立體選擇性的friedel-crafts烷基化反應;硝基烯烴與硝基烷烴之間的不對稱michael加成;硝基烯烴的不對稱生物還原等等。
因此,基于硝基烯烴的重要性,硝基烯烴衍生物的合成方法數十年前就被研究者們關注。早在數十年前就已經報道了以硝基化合物作為硝基源用于合成硝基烯烴的經典方案。如較早報道的亨利反應,是在堿性條件下,將醛或酮與硝基烷烴進行縮合反應得到硝基烯烴衍生物(如反應1),但是亨利反應存在反應條件相對苛刻,反應收率相對較低,且產生大量的廢堿液等問題。后續報道了一些改進的亨利反應,如硝基甲烷與醛類化合物通過henry縮合可得到β-硝基醇,β-硝基醇再經dcc/cucl或三氟乙酸酐/三乙胺脫水,或者也可以經mscl/et3或p2脫水得到α,β-不飽和硝基烯烴。又如brch2no2與醛在碘化鈉的催化下制得1-溴-1-硝基烷-2-醇,1-溴-1-硝基烷-2-醇再經二碘化釤β-消除制得α,β-不飽和硝基烯烴。又如β-硝基醇酰化后在回流的苯溶液中用碳酸鈉處理可得到收率不錯的α,β-不飽和硝基烯烴,但這些反應需要多步,收率也不是很高。如中國專利(cn106083597a)公開了一種共軛硝基烯烴的合成方法,在二胺存在的條件下,利用脂肪醛與硝基烷烴的硝基進行羥醛縮合反應,反應過程中通過添加酸來進行的共軛硝基烯烴的消去反應(如反應2);該方法通過二胺作為硝基羥醛縮合反應的催化劑,降低副反應生成,提高產物收率,但該反應步驟多,有大量酸性廢液產生,污染環境。中國專利(cn104710315a)公開了一種α,β-不飽和硝基烯烴化合物的綠色合成方法(如反應3),其利用功能化離子液體與水作為催化體系,芳香醛和硝基烷烴進行微波加熱反應,可以使反應條件溫和,提高反應收率;但是該方法利用的離子液體成本高,難以工業化應用。
另外,一些合成α,β-不飽和硝基烯烴的新方法陸續報道。如報道比較早的是用亞硝酸鹽和碘將烯烴硝化成α,β-不飽和硝基烯烴及一系改善硝化條件的研究工作[(hassner等人,j.org.chem.,1969,34(9),p.2628-2632.)、(tetr.lett.,1985,26(9),p.1193-1196)、(chemistryletters,1986,p.1747-1748)]。這些反應由于采用了大量的碘,過量碘在后處理過程中相當麻煩,且降低了產物的收率。意大利的薩寶集團公司在中國申請的專利(cn1438977a)公開了以苯乙烯衍生物為原料,過氧化物存在下的無機亞硝酸鹽和碘的混合物為硝化試劑合成硝基苯乙烯化合物;該方法由于使用了氧化劑大大減少硝化烯烴過程中碘的使用量,從而在一定程度上提高了產物的收率,簡化工藝步驟,但是這些方法都采用亞硝酸鹽作為硝化試劑,對環境和人體危害大。目前,還有一些利用含氮氧化物作為硝化試劑,以烯類化合物在金屬鎳氧化物催化下直接進行硝基化反應,得到硝基烯烴衍生物(如反應4),該方法采用氣液反應方式,反應效率低,且會產生有毒氣體,產率收率也不高。
反應1:
反應2:
反應3:
反應4:
技術實現要素:
針對現有技術中合成α,β-不飽和硝基烯烴的方法存在的缺陷,本發明的目的是在于提供一種在溫和反應條件下高產率合成具有高e立體選擇性的α,β-不飽和硝基烯烴的方法。
為了實現上述技術目的,本發明提供了一種基于四芳基卟啉鐵催化合成(e)-β-硝基苯乙烯衍生物的方法,該方法是將式1結構苯乙烯衍生物在含四芳基卟啉鐵(iii)、碘化銨和叔丁基過氧化氫的體系中一鍋反應,生成式2結構(e)-β-硝基苯乙烯衍生物;
其中,
r和r1獨立選自氫、烷基、烷氧基、鹵代烷基、鹵素、乙酰氧基或烯基。
優選的所述苯乙烯衍生物為苯乙烯、對甲基苯乙烯、對甲氧基苯乙烯、對異丁基苯乙烯、對氯甲基苯乙烯、對氟苯乙烯、對溴苯乙烯、對氯苯乙烯、對乙酰氧乙烯、間甲基苯乙烯、間溴苯乙烯、鄰氯苯乙烯、鄰溴苯乙烯、2,5-二甲基苯乙烯或1,2-二乙烯基苯。如
本發明的苯乙烯類化合物進行烯烴的硝基化反應時,苯環上的取代基烯烴的對硝化反應效率影響不是很明顯,如具有給電子基團的苯環(-ch3、-och3、-tbu、-ch2cl)和具有吸電子基團的苯環(-f、-cl、-br和ch3coo-)硝化反應可以順利進行,可以得到相近的硝化效率。
優選的方案,反應條件為:在空氣或保護氣氛條件下,反應溫度為100℃~130℃,反應時間為3~9h。最佳的反應溫度為105℃~125℃,反應時間為4~8h。
優選的方案,烯類化合物、碘化銨和叔丁基過氧化氫的摩爾比為1:(1~2):(4~8)。進一步優選的方案,烯類化合物、碘化銨和叔丁基過氧化氫的摩爾比為1:(1.5~2):(6~8)。
本發明的碘化銨是作為硝基源,碘化銨在過氧化物叔丁基過氧化氫的氧化作用下生成硝基自由基,為α,β-不飽和硝基烯烴衍生物提供硝基取代基。大量實驗表明,采用溴化銨和氯化銨可以實現對烯烴的硝化反應,但是硝化效率并不是很高,而采用碘化銨時,硝化效率可以達到80%以上。
優選的方案,所述體系包含乙腈和/或乙醇溶劑。溶劑的極性對烯烴的硝化也具有一定的影響,如在乙腈和乙醇中,硝化反應可以順利進行,而采用水、dmf、dec、甲苯等作為反應溶劑,得不到α,β-不飽和硝基烯烴衍生物或者收率相當低。乙腈是本發明方法中最佳的反應溶劑,反應效果相對其它反應溶劑要高出很多。
優選的方案,所述四芳基卟啉鐵(iii)為四苯基卟啉氯化鐵(如tppfecl)和/或雙(四苯基卟啉)鐵(iii)((tppfe)2o)。四芳基卟啉鐵(iii)烯類的硝基化反應具有特殊的催化活性,而其他三價鐵鹽、二價鐵鹽對該反應均不具備催化作用,且其他四芳基金屬卟啉化合物也均不具備催化活性,如四芳基金屬卟啉銅、四芳基金屬卟啉鈷等。四芳基卟啉鐵(iii)也可以是四苯基卟啉氯化鐵的衍生物,其苯環上可以含取代基,如常規的氨基、硝基、烷基、烷氧基、鹵素等。
較優選的方案,所述四芳基卟啉氯化鐵的用量為烯類化合物摩爾量的3~9%。更優選為4~7%。催化劑用量增加,硝化反應效果明顯降低。
本發明由烯烴化合物合成α,β-不飽和硝基烯烴衍生物的反應機理如下,以nh4i、tbhp、tppfecl的乙腈溶液為反應體系,通過式1烯類化合物為底物(r和r2為氫,r1為苯)合成式2結構(e)-β-硝基苯乙烯衍生物,以此為例對反應機理進行具體說明:首先,tbhp在一定溫度條件下分解生成氧及羥基等自由基,季銨陽離子被氧自由基氧化成二氧化氮自由基,二氧化氮自由基在tppfecl催化介質轉移作用下對烯類化合物進行自由基加成反應,得到活潑中間體a,中間體a捕獲羥基自由基,得到中間體b,中間體b進行順式消除,得到高e式立體選擇的α,β-不飽和硝基烯烴衍生物。反應過程中tppfecl主要起到轉移自由基作用,可以形成非穩定中間體,但最終還是以tppfecl存在,起到催化作用。反應機理方程式如下:
本發明通過以下反應對本發明的乙烯硝化反應的機理進行了驗證,說明該反應機理的合理性。在苯乙烯的硝化反應過程中添加tempo或bht自由基捕獲劑(反應1),發現幾乎得不到反應產物,說明該反應涉及到自由基反應機理。接下來,采用中間體2-硝基-1-羥基乙基苯(b)在nh4i和tbhp及tppfecl混合體系中或在不含tppfecl的nh4i和tbhp混合體系中反應(反應2),均能得到目標產物,說明催化劑對消除反應幾乎不受影響。同時設計了逐步反應實驗,第一步反應是在沒有底物烯烴的情況下,nh4i和tbhp在tppfecl催化劑條件下(a)與不用tppfecl催化劑條件下(b)混合30分鐘,然后分別加入tempo,通過gc-ms可以檢測到兩個反應均有tempo-硝基自由基類似物生成,說明tppfecl催化劑的作用并不是催化自由基生成(如反應3(a)和(b));第二步反應是在(反應3(a))反應生成的含有tempo-硝基自由基類似物混合物分成兩份,一份中加入苯乙烯底物和tppfecl催化劑(d),另一份加苯乙烯,但不加催化劑(c),加熱攪拌反應6小時,結果在加入了催化劑fetppcl的反應中可以獲得硝基苯乙烯2a(反應4(c)和(d)),說明tppfecl催化劑主要是起到催化自由基與苯乙烯反應的作用。
相對現有技術,本發明的技術方案帶來的有益技術效果:
1)本發明的技術方案首次采用含四芳基卟啉鐵(iii)、鹵化銨鹽和叔丁基過氧化氫反應體系對烯類化合物進行硝化反應,實現了烯類化合物一鍋反應生成(e)-β-硝基苯乙烯衍生物,相對現有技術,大大簡化了工藝步驟,有利于工業化生產。
2)本發明的技術方案首次采用無機鹵化銨鹽作為烯烴類化合物的直接硝基源,相比現有技術中的含氮氧化物、亞硝酸鹽及有機硝類化合物,具有成本低、安全、環保等優點。
3)本發明的技術方案首次利用四芳基卟啉鐵(iii)作為烯類化合物的硝化反應試劑,能夠在溫和條件下實現各種烯烴類化合物的硝基化反應,且獲得較高的產率及高立體選擇性。
4)本發明的技術方案實現了α,β-不飽和硝基烯烴衍生物的一鍋法合成,且目標產物易于分離提純,簡化了工藝步驟,有利于工業化生產。
附圖說明
【圖1】為實施例1的目標產物的核磁氫譜圖;
【圖2】為實施例1的目標產物的核磁碳譜圖;
【圖3】為實施例2的目標產物的核磁氫譜圖;
【圖4】為實施例2的目標產物的核磁碳譜圖。
具體實施方式
以下實施旨在進一步說明本發明內容,而不是限制本發明權利要求的保護范圍。
以下實施例中采用的所有溶劑、金屬卟啉、氧化劑、銨鹽和烯烴都是從商業來源購買的。
所有的目標化合物采用gc-ms和nmr(1h和13c)光譜數據表征。
nmr型號為brukerav400mhz,相對位移采用ppm表示,以三甲基硅烷的相對位移ppm=0為基準。
氘代溶劑中殘留氯仿的1h相對位移ppm=7.26,13c相對位移ppm=77.00。
gc-ms型號為shimadzugc-ms(qp-2010),采用的檢測器為fid檢測器。
所有的硝化反應在帶有螺紋端的密封管(25ml)中進行。
除非另有說明,所有液體試劑中都加入分子篩除水保存。
以下實施例中的目標產物的收率均按立體選擇性為e式結構的目標產物進行計算,反應的立體選擇性幾乎為100%。
實施例1~15
實施例1~15均按以下反應方程式反應:
具體操作步驟為:將烯烴(0.5mmol),nh4i(1.5當量,0.75mmol,108mg),tbhp(70%的h2o,6.0當量,3.0mmol,384mg),tppfecl(苯乙烯摩爾量的3~5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和tppfecl,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
實施例1
烯烴:
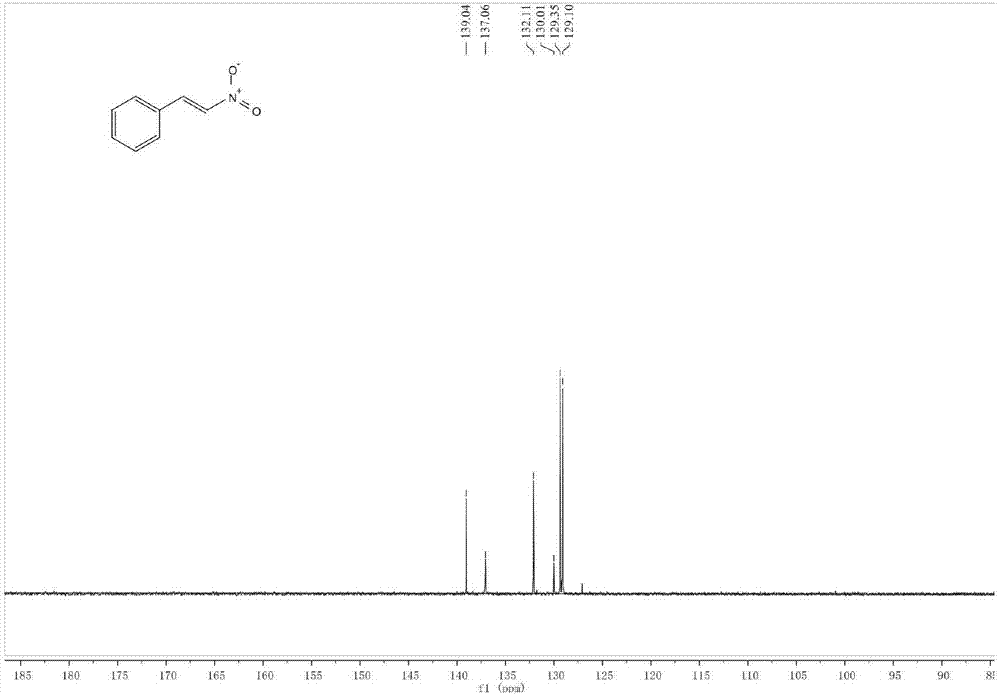
yellowsolid:82%(61mg).1hnmr(400mhz,cdcl3)δ8.01(d,j=13.7hz,1h),7.63–7.53(m,3h),7.47(tdd,j=8.5,5.2,3.6hz,3h).13cnmr(101mhz,cdcl3)δ139.04,137.06,132.11,130.01,129.35,129.10.gc-ms(m/z):149.+.
實施例2
烯烴:
yellowsolid:77%(63mg).1hnmr(400mhz,cdcl3)δ7.96(d,j=13.6hz,1h),7.55(d,j=13.6hz,1h),7.43(d,j=8.1hz,2h),7.25(d,j=8.2hz,2h),2.40(s,3h).13cnmr(101mhz,cdcl3)δ143.04,139.08,136.17,130.06,129.12,127.17,21.56.gc-ms(m/z):163.
實施例3
烯烴:
yellowsolid:73%(65mg).1hnmr(400mhz,cdcl3)δ7.97(d,j=13.6hz,1h),7.51(dd,j=11.2,5.8hz,3h),6.96(d,j=8.8hz,2h),3.87(s,3h).13cnmr(101mhz,cdcl3)δ162.93,139.00,135.03,131.14,122.54,114.98,55.51.gc-ms(m/z):179.
實施例4
烯烴:
yellowsolid;isolatedyield:58%(60mg).1hnmr(400mhz,cdcl3)δ7.99(d,j=13.6hz,1h),7.58(d,j=13.6hz,1h),7.48(d,j=2.0hz,4h),1.34(s,9h).13cnmr(101mhz,cdcl3)δ156.08,138.98,136.32,129.03,127.17,126.35,35.05,30.94.gc-ms(m/z):203.
實施例5
烯烴:
yellowsolid:70%(69mg).1hnmr(400mhz,cdcl3)δ7.98(d,j=13.7hz,1h),7.56(dd,j=16.0,10.9hz,3h),7.47(d,j=8.2hz,2h),4.60(s,2h).13cnmr(101mhz,cdcl3)δ141.45,138.16,137.40,129.98,129.41(d,j=3.1hz),45.22.gc-ms(m/z):197.
實施例6
烯烴:
yellowsolid:65%(54mg).1hnmr(400mhz,cdcl3)δ7.98(d,j=13.7hz,1h),7.55(t,j=12.0hz,3h),7.15(t,j=8.0hz,2h).13cnmr(101mhz,cdcl3)δ164.92,137.81,136.83,131.26(d,j=8.9hz),126.29(d,j=3.6hz),116.78(d,j=22.2hz)..gc-ms(m/z):167.
實施例7
烯烴:
yellowsolid:56%(51mg).1hnmr(400mhz,cdcl3)δ7.95(d,j=13.7hz,1h),7.56(d,j=13.7hz,1h),7.51–7.46(m,2h),7.45–7.37(m,2h).13cnmr(101mhz,cdcl3)δ138.21,137.63,137.33,130.22,129.66,128.45.gc-ms(m/z):183.
實施例8
烯烴:
yellowsolid:58%(67mg).1hnmr(400mhz,cdcl3)δ7.95(d,j=13.7hz,1h),7.58(t,j=10.4hz,3h),7.42(d,j=8.5hz,2h).13cnmr(101mhz,cdcl3)δ137.75,137.47,132.74,130.36,128.94,126.78.gc-ms(m/z):228。
實施例9
烯烴:
yellowsolid:61%(63mg).1hnmr(400mhz,cdcl3)δ7.98(d,j=13.7hz,1h),7.56(dd,j=11.1,7.8hz,3h),7.20(d,j=8.6hz,2h),2.32(s,3h).13cnmr(101mhz,cdcl3)δ168.84,153.45,137.96,137.07,130.37127.60,122.71,21.08.gc-ms(m/z):207。
實施例10
烯烴:
yellowsolid:53%(49mg).1hnmr(400mhz,cdcl3)δ8.40(d,j=13.7hz,1h),7.62–7.56(m,2h),7.50(dd,j=8.0,1.2hz,1h),7.43(td,j=7.8,1.6hz,1h),7.34(t,j=8.1hz,1h).13cnmr(101mhz,cdcl3)δ138.81,136.01,135.08,132.81,130.72,128.57,128.49,127.45.gc-ms(m/z):183.
實施例11
烯烴:
yellowsolid:47%(54mg).1hnmr(400mhz,cdcl3)δ8.38(d,j=13.6hz,1h),7.68(dd,j=7.8,1.3hz,1h),7.57(dd,j=7.6,1.7hz,1h),7.53(d,j=13.6hz,1h),7.41–7.31(m,2h).13cnmr(101mhz,cdcl3)δ138.79,137.54,133.96,132.90(,130.29,128.43,128.05,126.29.gc-ms(m/z):228
實施例12
烯烴:
yellowsolid:55%(45mg).1hnmr(400mhz,cdcl3)δ7.97(d,j=13.7hz,1h),7.57(d,j=13.7hz,1h),7.40–7.28(m,4h),2.40(s,3h).13cnmr(101mhz,cdcl3)δ139.20,139.17,136.86,132.96,129.93,129.65,129.20,126.31,21.18.gc-ms(m/z):163.
實施例13
烯烴:
yellowsolid:45%(51mg).1hnmr(400mhz,cdcl3)δ7.90(d,j=13.7hz,1h),7.67(t,j=1.7hz,1h),7.60(dd,j=8.0,2.7hz,1h),7.55(d,j=13.7hz,1h),7.47(d,j=7.8hz,1h),7.32(t,j=7.9hz,1h).13cnmr(101mhz,cdcl3)δ137.94,137.22,134.73,131.95,131.55,130.75,127.57,123.28.gc-ms(m/z):228
實施例14
烯烴:
yellowsolid:74%(82mg).1hnmr(400mhz,cdcl3)δ8.26(d,j=13.6hz,1h),7.50(d,j=13.6hz,1h),7.32(s,1h),7.22–7.14(m,2h),2.42(s,3h),2.34(s,3h).13cnmr(101mhz,cdcl3)δ137.22,136.77,136.21,136.17,132.79,131.17,128.57,127.69,20.72,19.28.gc-ms(m/z):163.
實施例15
烯烴:
yellowsolid:34%(30mg).1hnmr(400mhz,cdcl3)δ8.13(d,j=13.6hz,1h),7.98(s,1h),7.87(dd,j=8.2,6.0hz,3h),7.68(d,j=13.6hz,1h),7.62–7.51(m,3h).13cnmr(101mhz,cdcl3)δ139.14,137.05,134.83,133.06,132.22,129.28,128.77,128.33,127.88,127.46,127.21,123.24.gc-ms(m/z):175.
對比實驗組1:
對照實施例1~12均按以下反應方程式反應:
具體操作步驟為:將苯乙烯(0.5mmol),nh4i(1.5當量,0.75mmol,108mg),tbhp(70%的h2o,6.0當量,3.0mmol,384mg),催化劑(苯乙烯摩爾量的0~15%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和催化劑,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
表1不同催化劑及用量對應的目標產物的收率
從表1中可以看出,在標準反應條件下,四苯基卟啉氯化鐵和雙鐵四苯基卟啉反應具有較好的催化作用,可以獲得滿意的收率,特別是四苯基卟啉氯化鐵的產率高達82%。而采用其它的無機二價鐵鹽或三價鐵鹽都幾乎得不到目標產物。另外,四苯基卟啉氯化鐵催化劑的用量不宜過量使用,催化劑過量,產物收率明顯降低,而不加催化劑,明顯得不到目標產物,只能找到氧化產物。
對比實驗組2:
對照實施例13~21均按以下反應方程式反應:
具體操作步驟為:將苯乙烯(0.5mmol),nh4x(1.5當量,0.75mmol),tbhp(70%的h2o,6.0當量,3.0mmol,384mg),tppfecl(苯乙烯摩爾量的5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和催化劑,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
表2不同季銨鹽對應的目標產物的收率
從表2中可以看出,采用鹵素季銨鹽可以實現苯乙烯的硝基化反應,除此以外其他的季銨鹽以及氨水等都無法作為苯乙烯硝化反應的硝基源。此外從表2中還可以看出,碘化銨相對溴化銨及氯化銨具有更好的收率,碘化銨最適合作為苯乙烯硝基化試劑。
對比實驗組3:
對照實施例22~31均按以下反應方程式反應:
具體操作步驟為:將苯乙烯(0.5mmol),nh4i(1.5當量,0.75mmol,108mg),氧化劑(6.0當量,3.0mmol),tppfecl(苯乙烯摩爾量的5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和催化劑,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
表3不同氧化劑對應的目標產物的收率
從表3中可以看出,僅tbhp可以氧化碘化銨,實現苯乙烯的硝基化,且反應不受氣氛影響,在空氣中及在保護氣氛下都能獲得較好的收率。而其他常見的氧化劑如雙氧水、過硫酸鉀及二叔丁基過氧化物等無機有機過氧化物均難以實現苯乙烯的硝基化反應。
對比實驗組4:
對照實施例32~41均按以下反應方程式反應:
具體操作步驟為:將苯乙烯(0.5mmol),nh4i(1~2當量),氧化劑(4~7當量),tppfecl(苯乙烯摩爾量的5%)和乙腈(2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和催化劑,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
表4不同nh4i和tbhp比例對應的目標產物的收率
從表4中可以看出nh4i和tbhp的與底物苯乙烯的反應比例,對產物的收率有較大的影響,nh4i與苯乙烯的摩爾比例要達到1.5以上,同時,tbhp與nh4i的比例要達到4以上,才能達到最佳的反應效果,而在其它比例范圍內反應,雖然能順利得到目標產物,但是收率受到限制。
對比實驗組5:
對照實施例42~51均按以下反應方程式反應:
具體操作步驟為:將烯烴(0.5mmol),nh4i(1.5當量,0.75mmol,108mg),tbhp(70%的h2o,6.0當量,3.0mmol,384mg),tppfecl(3~5%)和溶劑(0~2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和tppfecl,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
表5不同溶劑及用量對應的目標產物的收率
對比實驗組6:
對照實施例52~59均按以下反應方程式反應:
具體操作步驟為:將烯烴(0.5mmol,50.2mg),nh4i(1.5當量,0.75mmol,108mg),tbhp(70%的h2o,6.0當量,3.0mmol,384mg),tppfecl(3~5%)和溶劑(2ml)加入到密封管中。首先加入乙腈,然后加入烯烴,nh4i和tppfecl,最后加入tbhp。將反應在120℃下劇烈攪拌6小時,并通過tlc監測。反應完成后,將混合物冷卻至室溫,然后過濾并用乙酸乙酯(ea)洗滌。最后,用旋轉蒸發器濃縮濾液,用石油醚(pe)/乙酸乙酯(ea)作為洗脫劑,采用硅膠(200-300目篩)進行柱色譜純化。
表6不同溶劑及用量反應氣氛對應的目標產物的收率
從表6中可以看出,只有在銨鹽存在條件下才能獲得目標化合物,環境氣氛或溶劑不參與提供n源。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一株具有催化合成槐定堿的菌株的制作方法與工藝
- 一種熒烷類化合物的合成方法及其催化劑與流程
- 一種一步合成芳烴的催化劑及其應用方法和制備方法與流程
- 一種含納米級催化劑的車用尿素的生產工藝的制作方法與工藝
- 一種引入催化劑優化合成雙嘧達莫的新工藝的制作方法與工藝
- 一種合成1,3?丙二醇的催化劑及其制備方法和應用與流程
- 一種基于四芳基卟啉鐵催化合成(E)?β?硝基苯乙烯衍生物的方法與流程
- 1,3?丁二烯合成用催化劑、1,3?丁二烯合成用催化劑的制造方法、1,3?丁二烯的制造裝置及1,3?丁二烯的制造方法與流程
- 大豆磷脂乙氧基化催化劑及大豆磷脂乙氧基化物的合成方法與制造工藝
- 一種錸催化劑及其催化合成2?甲基?1,4?萘醌的方法與制造工藝