制造必需脂肪酸的非人轉基因動物及其用途的制作方法
本申請要求35U.S.C.§119(e)規定的2014年3月21日提交的美國臨時申請No.61/968,754的權益,通過引用將其內容整體并入本文中。
技術領域
本文所述的各方面涉及用于改變動物(例如非人哺乳動物)中的多不飽和脂肪酸的含量的組合物和方法。本文還提供了可以將碳水化合物和/或飽和脂肪轉化為多不飽和脂肪酸的轉基因動物(例如,非人哺乳動物)及其用途。
背景技術:
伴隨著增高的ω-6(n-6)脂肪酸攝入和降低的ω-3(n-3)脂肪酸攝入的增高的飽和脂肪和碳水化合物的消費的全球趨勢與慢性的危及生命的疾病的升高的發病率相一致,表明我們的飲食結構的改變與當今的健康流行病之間的重要聯系(Leaf和Weber(1987)Am.J.Clin.Nutr.45:1048-1053;Cordain,L.等(2005)Am.J.Clin.Nutr.81:341-354)。在哺乳動物中,飽和脂肪可以很容易地由碳水化合物制造,并且在現代西方飲食中,飽和脂肪和碳水化合物都高度豐富(Institute of Medicine of the National Academies.Dietary fats:total fat and fatty acids.In:Dietary reference intakes for energy,carbohydrate,fiber,fat,fatty acids,cholesterol,protein,and amino acids(macronutrients).(2002)Washington,DC:The National Academy Press,pp.335-432);相反,ω-3脂肪酸不能被從頭合成,也不能由哺乳動物中的其它營養素轉化,因此必須從食物來源(例如,魚油)獲得。引文同上。
通常,哺乳動物容易通過飲食或者由葡萄糖或氨基酸的內源性合成獲得飽和脂肪酸(SFA)(Volpe和Vagelos(1976)Physiol.Rev.56,339-417),而單不飽和脂肪酸(MUFA)也可以由飲食獲得或通過硬脂酰輔酶A去飽和酶1(SCD-1)基因由SFA轉化(Paton和Ntambi(2009)Am.J.Physiol.Endocrinol.Metab.297:E28-37)。另一方面,n-6和n-3PUFA不能相互轉化或在哺乳動物中從頭合成,而主要通過飲食獲得(Leonard等(2004)Prog.Lipid Res.43:36-54;Gebauer等(2006)Am.J.Clin.Nutr.83,1526s-1535s)。在這一背景下,為了增加必需脂肪酸的組織含量,必須在飲食中加以補充,例如添加植物油(如玉米油、大豆油、紅花油等)以獲取n-6PUFA或添加魚油以獲取n-3PUFA。
對高脂飲食在代謝性疾病的發展中的作用已經進行了廣泛的研究(Kuller(1997)J.Am.Diet.Assoc.97:S9-15;Joint WHO/FAO Expert Consultation.(2003)Diet,Nutrition and the Prevention of Chronic Diseases(WHO technical report series 916).World Health Organization,Geneva.pp.81-94)。然而,來自于這些報告的結果的解釋往往沒有意識到不同類型的脂肪(包括飽和脂肪酸(SFA);單不飽和脂肪酸(MUFA);n-6多不飽和脂肪酸(PUFA)和n-3PUFA)能夠分別對研究結果造成不同的影響(Weisburger(1997)J.Am.Diet.Assoc.97,S16-23;Simopoulos(2008)Exp.Biol.Med.233,674-688)。此外,比較營養研究通常利用不同脂肪來源的飲食,引入了可以成為混淆因子的其它變量(Kang(2011)World.Rev.Nutr.Diet.102:22-29)。例如,在補充的油中除n-6脂肪酸或n-3脂肪酸之外的許多其它成分的存在使得難以解釋n-6脂肪酸或n-3脂肪酸的真實影響的實驗結果。由于忽視或未能分開特定脂肪的各自的影響,現有的研究往往給出不一致或矛盾的結論,引起了科學家之間的混亂,且公眾也是如此。因此,有必要可靠地定義可以用作食物來源以補充必需脂肪酸或用作實驗模型以研究與脂肪代謝相關的病癥的必需脂肪酸類型的來源和量。
技術實現要素:
本文所述的各方面的實施方式部分基于下述發現:來自低級生命形式(例如,線蟲)的δ12脂肪酸去飽和酶基因(fat-2)和n-3脂肪酸去飽和酶基因(fat-1)可以被優化并導入高級生命形式或基因組復雜的動物細胞(例如,哺乳動物細胞),以生成可以由飽和脂肪和/或碳水化合物制造必需的n-6脂肪酸和n-3脂肪酸的非人動物。根據該發現的一個方面,本發明人已成功地改造出攜帶經優化的來自作為線蟲的秀麗隱桿線蟲(Caenorhabditis elegans;C.elegans)的fat-2和fat-1的轉基因小鼠,從而使該轉基因小鼠(以下稱“ω小鼠”)可以由飽和脂肪和/或碳水化合物制造必需的n-6脂肪酸和n-3脂肪酸。進一步地,本發明人已經示出ω小鼠在身體組織中表現出均衡的n-6/n-3脂肪酸比值。例如,當維持缺乏必需脂肪酸的高脂飲食或高碳水化合物的無脂飲食時,ω小鼠表現出n-6脂肪酸和n-3脂肪酸的高的組織水平,比值為~1:1。此外,當野生型(不能制造必需脂肪酸)、fat-2轉基因型(只制造n-6脂肪酸而不制造n-3脂肪酸)和ω轉基因型(制造n-6脂肪酸和n-3脂肪酸)這三種基因型小鼠被飼喂相同的飲食,它們表現出與許多代謝疾病(例如,肝臟脂肪合成、腸道菌群和低度炎癥)相關的特征的獨特分布。該發現從而提供了可以內源合成必需的n-6脂肪酸和n-3脂肪酸的新的轉基因的非人動物模型,例如用于解決脂肪代謝和疾病,同時還提供了用于增高n-6和n-3這兩種必需脂肪酸的產量的創新技術。
因此,本文所述的某些方面提供了用于在動物或其細胞(即,除秀麗隱桿線蟲以外的細胞,例如但不限于哺乳動物細胞)中有效地改變多不飽和脂肪酸(PUFAs)例如n-6脂肪酸和n-3脂肪酸的含量的組合物和方法。在一些實施方式中,經優化的fat-2和/或fat-1核酸或氨基酸序列或它們的生物活性變體能夠可操作地連接至調控序列或者組成型激活的啟動子或組織特異性啟動子。調控序列不僅包括啟動子,還包括增強子或促進核酸表達的其它表達控制序列,例如多聚腺苷酸化信號。本文還描述了可以由飽和脂肪和/或碳水化合物制造n-6脂肪酸和/或n-3脂肪酸的工程化動物細胞(例如,體外的、體內的或離體的)、包含該細胞的轉基因非人動物、由這些轉基因非人動物獲得的食物產品(例如,肉或動物的其它可食用部分(例如,肝、腎、胸腺))以及使用它們的方法。
一方面,本文所提供的涉及非人轉基因動物,該非人轉基因動物具有包含可操作地連接至啟動子的第一外源和/或異源核酸分子的基因組,其中,第一外源和/或異源核酸分子包含編碼將飽和脂肪和/或碳水化合物轉化為ω-6(或n-6脂肪酸)的酶的核苷酸序列,其中,當在轉基因動物內表達第一外源和/或異源核酸分子時,轉基因動物由飽和脂肪和/或碳水化合物制造ω-6(或n-6脂肪酸)。在一些實施方式中,與野生動物中的含量相比,當表達第一外源和/或異源核酸分子時,轉基因動物中的n-6脂肪酸的含量增高。
在一些實施方式中,編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶的核苷酸序列可以衍生自能夠在細胞或動物內由碳水化合物和/或飽和脂肪從頭或在體內合成n-6脂肪酸的任何物種。例如,將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶可以衍生自無脊椎動物、昆蟲、蠕蟲、植物、細菌、真菌、魚、甲殼動物、軟體動物、線蟲、藍藻或海藻。
僅舉例來說,在一些實施方式中,將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶可以包括δ12脂肪酸去飽和酶或其生物活性變體。在一個實施方式中,編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自蠕蟲。在一個實施方式中,編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自秀麗隱桿線蟲。
在一些實施方式中,編碼δ12脂肪酸去飽和酶的核苷酸序列可以對應于野生型δ12脂肪酸去飽和酶。
在一些實施方式中,編碼δ12脂肪酸去飽和酶的核苷酸序列可以對應于與野生型δ12脂肪酸去飽和酶相比而言經修飾的δ12脂肪酸去飽和酶。例如,為了使異源基因在宿主中更高表達,可以基于相似基因或等效基因的宿主序列優化核苷酸序列的密碼子。在一個實施方式中,為了促進哺乳動物細胞或哺乳動物中的秀麗隱桿線蟲fat-2基因的表達,fat-2序列的密碼子可以基于哺乳動物去飽和酶序列進行優化。在一個實施方式中,fat-2的經優化的核苷酸序列以SEQ ID NO.1示出。
在一些實施方式中,第一外源和/或異源核酸分子可以包含編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列。δ12脂肪酸去飽和酶的生物活性變體是保留了將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸的野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的足夠的生物活性的變體。例如,δ12脂肪酸去飽和酶的生物活性變體可以包括保留了野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸的至少25%或更高的生物活性的該酶的突變或片段。例如,當δ12脂肪酸去飽和酶的片段可以將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸且該轉化是在相同條件下的野生型或經修飾的酶的效率的至少約25%或更高時,該δ12脂肪酸去飽和酶的片段是全長酶的生物活性變體。δ12脂肪酸去飽和酶的生物活性變體還可以包含一個或多個氨基酸取代(例如,酶序列中的1%、5%、10%、20%、25%或更多的氨基酸殘基可以用另一氨基酸殘基取代)。這些取代可以構成本領域已知的保守的氨基取代。在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的δ12脂肪酸去飽和酶(例如,SEQ ID NO.1)具有至少約70%或更高的一致性。
在一些實施方式中,當轉基因動物中的第一外源和/或異源核酸分子表達時,轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以大于1:1或更高。
在一些實施方式中,非人轉基因動物的基因組可以進一步包含第二外源和/或異源核酸分子。在一些實施方式中,第二外源和/或異源核酸分子可以包含編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列,其中,當轉基因動物中的第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子表達時,轉基因動物由飽和脂肪和/或碳水化合物制造n-3和n-6(其中的至少一些可以被轉化為n-3)。在一些實施方式中,與野生動物中的n-3脂肪酸含量相比,當第二外源和/或異源核酸分子表達時,轉基因動物中的n-3脂肪酸的含量增高。
在一些實施方式中,編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列可以衍生自能夠在細胞或動物內由n-6脂肪酸從頭或在體內合成n-3脂肪酸的任何物種。例如,將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶可以衍生自無脊椎動物、昆蟲、蠕蟲、植物、細菌、真菌、魚、甲殼動物、軟體動物、線蟲、藍藻或海藻。
僅舉例來說,在一些實施方式中,將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶可以包括n-3脂肪酸去飽和酶或其生物活性變體。在一個實施方式中,編碼n-3脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自蠕蟲。在一個實施方式中,編碼n-3脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自秀麗隱桿線蟲。
在一些實施方式中,編碼n-3脂肪酸去飽和酶的核苷酸序列可以對應于野生型n-3脂肪酸去飽和酶。
在一些實施方式中,編碼n-3脂肪酸去飽和酶的核苷酸序列可以對應于與野生型的n-3脂肪酸去飽和酶相比而言經修飾的n-3脂肪酸去飽和酶。如上文所討論的,為了使異源基因在宿主中更高表達,可以基于相似基因或等效基因的宿主序列優化核苷酸序列的密碼子。在一個實施方式中,為了促進哺乳動物細胞或哺乳動物中的秀麗隱桿線蟲fat-1基因的表達,fat-1基因的密碼子可以基于哺乳動物去飽和酶序列進行優化。在一個實施方式中,fat-1的經優化的核苷酸序列以SEQ ID NO.2示出。
在一些實施方式中,編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的第二外源和/或異源核酸分子的核苷酸序列是n-3脂肪酸去飽和酶或其生物活性變體。在這些實施方式中,n-3脂肪酸去飽和酶或其生物活性變體的表達可以使轉基因動物將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸。因此,攜帶第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子的轉基因動物可以由飽和脂肪和/或碳水化合物制造n-3脂肪酸和n-6脂肪酸(其中的至少一些可以被轉化為n-3脂肪酸)。
n-3脂肪酸去飽和酶的生物活性變體是保留了將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的野生型或經修飾的n-3脂肪酸去飽和酶(例如,SEQ ID NO.2)的足夠的生物活性的變體。例如,n-3脂肪酸去飽和酶的生物活性變體可以包括保留了野生型或經修飾的n-3脂肪酸去飽和酶(例如,SEQ ID NO.2)的將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的至少25%或更高的生物活性的該酶的突變或片段。例如,當n-3脂肪酸去飽和酶的片段將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸且該轉化是在相同條件下的野生型或經修飾的酶的效率的至少25%或更高時,該n-3脂肪酸去飽和酶的片段是全長酶的生物活性變體。n-3脂肪酸去飽和酶的生物活性變體還可以包含一個或多個氨基酸取代(例如,酶序列中的1%、5%、10%、20%、25%或更多的氨基酸殘基可以用另一氨基酸殘基取代)。這些取代可以構成本領域已知的保守的氨基酸取代。在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的n-3脂肪酸去飽和酶(例如,SEQ ID NO.2)具有至少約70%或更高的一致性。
在包含第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子的非人轉基因動物的一些實施方式中,當轉基因動物中的第一和/或異源核酸分子以及第二外源和/或異源核酸分子表達時,轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以是約1:1或更低。
待進行轉基因的“動物”是指在其體內不能從頭或在體內制造n-6和/或n-3的任何動物。在一些實施方式中,非人轉基因動物可以是脊椎動物。在一些實施方式中,非人轉基因動物可以是哺乳動物。在一些實施方式中,非人轉基因動物可以選自如下所組成的組:奶牛、小鼠、大鼠、豬、綿羊、山羊、兔、水牛、家禽、牲畜、魚、鹿或家畜。在一些實施方式中,轉基因動物是指大的動物(例如奶牛、豬、綿羊、山羊、兔、鹿、雞和其它家禽(例如鵝、鴨、雉雞和母野雞))和/或魚或者養殖或棲息于河流、湖泊、溪流或海洋中的其它可食用性動物。在一些實施方式中,轉基因動物是非人哺乳動物。在一些實施方式中,轉基因動物是魚。
轉基因動物、由其衍生的組織或細胞,在無需向它們飼喂可能會向系統中導入額外變量的不同脂肪源的情況下,使得人們能夠研究由n-6脂肪酸和/或n-3脂肪酸介導的細胞機制或生物條件。因此,在一些實施方式中,非人轉基因動物的基因組可以進一步包含基因修飾。基因修飾可以包括感興趣的基因的插入、缺失和/或突變。例如,感興趣的基因可以同與脂肪代謝相關的細胞機制或生物條件相關。在一些實施方式中,基因修飾可以包括宿主基因的修飾。在一些實施方式中,基因修飾可以包括異源基因的表達。例如,異源基因可以是與脂肪代謝通路相關的基因、治療基因(例如,化療劑或小分子的受體)或標記基因(例如,編碼熒光蛋白、例如綠色熒光蛋白(GFP)或增強型綠色熒光蛋白(EGFP)的序列)。異源基因可以與本文所述的第一外源和/或異源核酸分子和/或第二外源和/或異源核酸分子(例如,編碼fat-2和/或fat-1)共表達(借助于相同或單獨的表達載體)。
根據所使用的構建體是否包含組成型激活的啟動子或組織特異性啟動子(例如,在例如骨骼肌細胞、乳腺組織細胞、結腸組織細胞、神經元、視網膜細胞、胰細胞(例如,胰島細胞)等中激活的啟動子),本文所述的第一外源和/或異源核酸分子和/或第二外源和/或異源核酸分子(例如,編碼fat-2和/或fat-1基因)可以在動物體內普遍表達或以組織特異性方式表達。
本文所述的轉基因動物的細胞和組織可以包含改變的PUFA含量。例如,攜帶第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子(例如,編碼fat-2和fat-1基因)的轉基因動物的細胞和組織可以更令人滿意地被消費,因為與沒有這些基因的轉基因動物相比,它們被設計為具有含有高水平的n-3脂肪酸以及低水平的n-6脂肪酸的細胞或組織含量。因此,轉基因家畜或動物被作為食物加以消費(例如,被人類或哺乳動物消費),當轉基因家畜或動物被設計為表達將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的第一異源酶以及將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的第二異源酶(例如,分別由fat-2和fat-1基因編碼的去飽和酶)時,可以是更優秀或更健康的食物來源。
因此,本文所提供的另外的方面涉及由本文所述的非人轉基因動物的一個或多個實施方式獲得、衍生或加工的食物或食物產品,其中,非人轉基因動物攜帶將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的第一異源基因和將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的第二異源基因。在一個實施方式中,第一異源基因可以包含fat-2基因。在一個實施方式中,第二異源基因可以包含fat-1基因。食物或食物產品的非限制性實例可以包括但不限于:肉、奶、組織、肌腱、油、蛋、乳制品(例如,奶酪)和它們的任何組合。在一些實施方式中,在本文所述的食物產品中,n-6脂肪酸與ω-3脂肪酸的比值可以是約1:1或更低。
本文所述的食物或食物產品(例如,由攜帶fat-2和fat-1兩種基因的非人轉基因動物獲得、衍生或加工的食物或食物產品)可以被提供給健康的個體或者患有n-3脂肪酸缺乏的個體。與n-3脂肪酸缺乏相關的疾病或失調是本領域已知的,包括例如但不限于:肥胖、糖尿病、癌癥、心臟疾病、炎癥性疾病、神經退行性疾病、神經精神性疾病、骨關節炎、狼瘡、非酒精性脂肪性肝疾病、結腸炎和它們的任意組合。因此,本文還提供了治療與n-3脂肪酸缺乏相關的病癥(例如,疾病或失調)的治療方法。通過向被診斷為患有與n-3脂肪酸缺乏相關的病癥(例如,疾病或失調)或具有與n-3脂肪酸缺乏相關的病癥的風險的受試者給予本文所述的食物或食物產品(例如,由攜帶fat-2和fat-1兩種基因的非人轉基因動物獲得、衍生或加工的食物或食物產品),受試者中的n-3脂肪酸含量可以增加,或者受試者中的n-6脂肪酸與n-3脂肪酸的比值可以降低,從而治療受試者中的病癥。
進一步的方面提供了增高非人動物或由其衍生的食物產品中的n-3脂肪酸含量的方法。該方法包括用高碳水化合物和/或高飽和脂肪的飲食飼喂本文所述的非人轉基因動物(例如,本文所述的攜帶fat-2和fat-1兩種基因的轉基因動物),所述非人轉基因動物將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸和n-3脂肪酸。轉基因動物可以將來自其飲食的碳水化合物和/或飽和脂肪的至少一部分(例如,至少30%或更多)轉化為n-6脂肪酸和n-3脂肪酸。
在一些實施方式中,本文所述的飼喂至轉基因動物的飲食可以具有少于30%或更少的PUFA(例如,必需脂肪酸)。在一些實施方式中,飼喂至轉基因動物的飲食可以排除任何PUFA或必需脂肪酸。
在一些實施方式中,當用高碳水化合物和/或高飽和脂肪的飲食飼喂轉基因動物時,轉基因動物或由其衍生的食物產品中的n-6脂肪酸與ω-3脂肪酸的比值可以是約1或更少。在一些實施方式中,至少一部分n-6脂肪酸(例如由飲食中的碳水化合物和/或飽和脂肪轉化的n-6脂肪酸或直接來自飲食的n-6脂肪酸)不會被轉化為n-3脂肪酸。在一些實施方式中,基本上所有的n-6脂肪酸(例如由飲食中的碳水化合物和/或飽和脂肪轉化的n-6脂肪酸或直接來自飲食的n-6脂肪酸)轉化為n-3脂肪酸。
一方面,本文提供的是含有可操作地連接至啟動子的第一外源和/或異源核酸分子的轉基因構建體,其中,第一外源和/或異源核酸分子含有編碼δ12脂肪酸去飽和酶的核苷酸序列(例如,fat-2基因)或其生物活性變體,并且其中,當將轉基因構建體導入細胞中時,啟動子引導動物細胞中的第一外源和/或異源核酸分子的表達。例如,可以通過顯微注射將轉基因構建體導入細胞中。
在一些實施方式中,第一外源和/或異源核酸分子可以包含:(i)SEQ ID NO.1的核苷酸序列;或者(ii)作為SEQ ID NO.1的生物活性變體且與SEQ ID NO.1具有至少約70%的一致性的核苷酸序列。
在一些實施方式中,轉基因構建體可以進一步含有第二外源和/或異源核酸分子,第二外源和/或異源核酸分子含有編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列。在一些實施方式中,編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列可以是編碼n-3脂肪酸去飽和酶的核苷酸序列或其生物活性變體。
在一些實施方式中,第二外源和/或異源核酸分子可以包含:(i)SEQ ID NO.2的核苷酸序列;或者(ii)作為SEQ ID NO.2的生物活性變體且與SEQ ID NO.2具有至少約70%的一致性的核苷酸序列。
在第二外源和/或異源核酸分子存在于本文所述的轉基因構建體中的一些實施方式中,第二外源和/或異源核酸分子能夠可操作地連接至相同或不同的啟動子。當將轉基因構建體導入細胞中時,啟動子可以引導轉基因動物細胞中的第二外源和/或異源核酸的表達。
可以導入轉基因構建體的動物細胞的實例包括但不限于來自下述動物的動物細胞:奶牛、小鼠、大鼠、豬、綿羊、山羊、魚、水牛、兔、家禽、牲畜或家畜。
本文還提供了確定n-6脂肪酸和/或n-3脂肪酸對與脂肪代謝相關的病癥(例如,疾病或失調)的影響的方法。在一些實施方式中,該方法包括:(a)在本文所述的非人轉基因動物或者本文所述的由其衍生的細胞或組織中誘導與脂肪代謝相關的病癥(例如,疾病或失調)的至少一種表型;(b)用高碳水化合物和/或高飽和脂肪的組合物飼喂非人轉基因動物或者由其衍生的細胞或組織;(c)檢測來自(b)的非人轉基因動物的響應;以及(d)將非人轉基因動物的檢測到的響應與對照進行比較,其中,非人轉基因動物與對照之間的響應方面的不同確定了n-6脂肪酸和/或n-3脂肪酸對病癥的影響。
在一些實施方式中,與脂肪代謝相關的病癥(例如,疾病或失調)的表型可以通過修飾非人轉基因動物或者由其衍生的細胞或組織的基因組中的至少一個基因來誘導,其中,該基因與病癥相關。基因修飾可以包括例如感興趣基因的插入、缺失和/或突變。在一些實施方式中,與脂肪代謝相關的病癥(例如,疾病或失調)的表型可以通過將轉基因動物或者由其衍生的細胞或組織暴露至誘導該病癥的試劑來誘導。誘導病癥的試劑可以是蛋白質、肽、核酸、藥物、小分子、輻射或它們的任意組合。
在用高碳水化合物和/或高飽和脂肪的組合物飼喂本文所述的轉基因動物后,可以實施能夠用于檢測本文所述的非人轉基因動物的響應的各種測定法和/或分析。例如,非人轉基因動物的響應可以包括與基因組學、代謝組學、脂質組學或蛋白質組學相關的分析物的表達水平。
通過將非人轉基因動物的檢測到的響應與對照進行比較,可以確定n-6脂肪酸和/或n-3脂肪酸對所研究的病癥(例如,疾病或失調)的影響。在一些實施方式中,對照可以是飼喂低碳水化合物和/或低飽和脂肪的組合物的本文所述的非人轉基因動物或者由其衍生的細胞或組織。在一些實施方式中,對照可以是不能將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸和/或n-3脂肪酸的非人動物。在一些實施方式中,對照可以是野生型非人動物。
由下面的詳細描述、附圖和實施例,本發明的其它特征和優點將變得顯而易見。
附圖說明
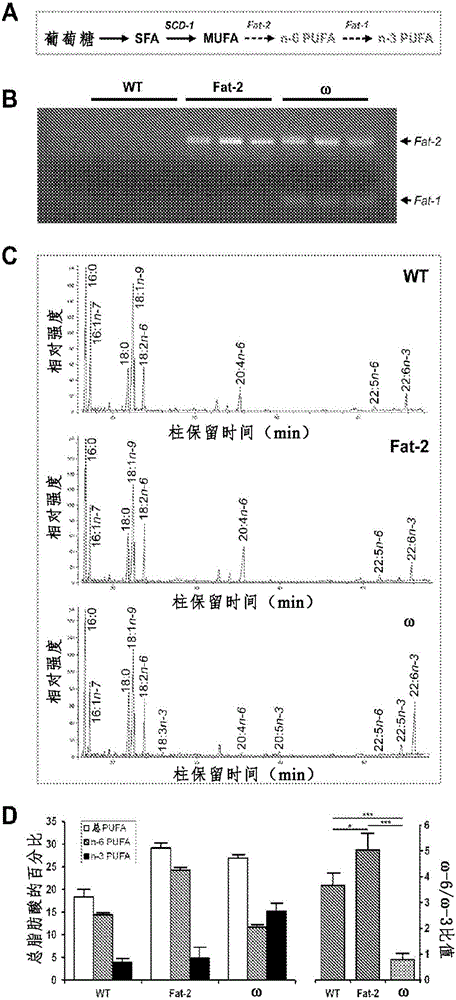
圖1A-圖1D示出了fat-2和ω轉基因小鼠的基因分型和表型的實驗數據以及必需脂肪酸的示意性的制造。圖1A是ω小鼠中的由非必需營養物轉化為必需脂肪酸的路線圖。在哺乳動物中,碳水化合物可以被轉化為飽和脂肪酸(SFA),而SFA可以通過硬脂酰輔酶A去飽和酶(SCD-1)轉化為單不飽和脂肪酸(MUFA)。fat-2和fat-1轉基因的引入使得哺乳動物能夠進一步分別將MUFA轉化為n-6多不飽和脂肪酸(PUFA)、將n-6PUFA轉化為n-3PUFA。圖1B通過PCR示出了野生型(WT)、fat-2和ω同窩小鼠中的fat-2和fat-1轉基因的表達。圖1C是部分的氣相色譜的示蹤,顯示出由野生型小鼠(WT,上欄)、fat-2轉基因小鼠(Fat-2,中欄)和ω轉基因小鼠(ω,下欄)的骨骼肌提取的總脂的脂肪酸分布。所有小鼠皆為10周齡雄性且飼喂相同的高SFA和高碳水化合物以及低n-6PUFA的飲食。圖1D是柱形圖,顯示出來自WT、fat-2和ω小鼠(左欄)的肌肉組織的PUFA的定量,以及各表型之間的n-6/n-3PUFA的比值的比較(右欄)。多種組織中的脂肪酸分布的顯著值見表1。數值表示為平均值±標準差(n=3只/組;*P<0.05,**P<0.01,***P<0.001)。
圖2A-圖2C是實驗數據,該實驗數據顯示出肝臟脂肪合成在fat-2小鼠中顯著增加,而在ω小鼠中下降。三組小鼠飼喂相同的高SFA和高碳水化合物以及低n-6PUFA的飲食約兩個月,然后使肝樣品接受分析。圖2A是示出由油紅O染色顯示脂質積累的圖像。圖2B是顯示出總的肝TG含量的測量結果的柱形圖(n=4;*P<0.05,***P<0.001)。圖2C顯示出通過PCR測定的SCD-1、FASN、ACC和GAPDH的肝表達(左欄),以及相對于GAPDH的定量的相對基因表達值(右欄)(n=3;*P<0.05,**P<0.01,***P<0.001)。
圖3A-圖3B是顯示出具有不同的組織脂肪酸分布的腸道菌群組成的變化的實驗數據。圖3A顯示出大腸桿菌的代表性的平板培養(左欄)和通過腸桿菌的qPCR進行的糞便細菌DNA的定量(右欄)的圖。圖3B顯示出雙歧桿菌的代表性的平板培養(左欄)和通過雙歧桿菌的qPCR進行的糞便細菌DNA的定量(右欄)的圖。數值表示為平均值±標準差(n=5;*P<0.05,**P<0.01,***P<0.001)。
圖4A-圖4B是顯示出具有不同的組織脂肪酸分布的三種表型之間的低度慢性炎癥的差異狀態的柱形圖。圖4A顯示出經多重測定法測量的關鍵炎性細胞因子的血漿水平(n=5;*P<0.05,**P<0.01)。圖4B顯示出通過鱟變形細胞裂解物測定法測量的LPS的血漿水平(n=5;*P<0.05,**P<0.01)。
圖5是顯示出含有fat-2構建體的pCAGGS質粒的示意圖,該質粒可以用于例如顯微注射,以產生Fat-2轉基因動物。
具體實施方式
本文所述的各方面的實施方式部分基于下述發現:來自低等生命形式(例如,線蟲)的δ12脂肪酸去飽和酶基因(fat-2)和n-3脂肪酸去飽和酶基因(fat-1)可以被優化并導入更高等生命形式或基因組學上復雜的動物細胞(例如,哺乳動物細胞)中,以制造可以由飽和脂肪和/或碳水化合物產生必需的n-6脂肪酸和/或n-3脂肪酸的非人動物。在本發現的一個方面,本發明人已成功地制造了可以從頭或在體內將碳水化合物和/或飽和脂肪轉化為必需的n-6脂肪酸的fat-2轉基因小鼠。在本發現的另一方面,本發明人還成功地工程化出轉基因小鼠以攜帶來自作為線蟲的秀麗隱桿線蟲(C.elegans)的經優化的fat-2和fat-1兩個基因,由此使該轉基因小鼠(以下稱“ω小鼠”)可以由飽和脂肪和/或碳水化合物制造必需的n-6脂肪酸和n-3脂肪酸。此外,本發明人已經表明ω小鼠在機體組織中表現出均衡的n-6/n-3脂肪酸比值。例如,當堅持用缺乏必需脂肪酸的高脂飲食或高碳水化合物的無脂飲食時,ω小鼠表現出n-6脂肪酸和n-3脂肪酸的高的組織水平,具有比值為~1:1。進一步地,當向三種基因型(野生型(不能制造必需脂肪酸)、fat-2轉基因(僅制造n-6脂肪酸而不制造n-3脂肪酸)和ω轉基因(制造n-6和n-3兩種脂肪酸))小鼠飼喂相同的飲食時,它們表現出與許多代謝疾病(例如,肝臟脂肪生成、腸道菌群和低度炎癥)相關的特征的獨特分布。該發現從而提供了可以內源合成必需的n-6脂肪酸和n-3脂肪酸的新的轉基因非人動物模型,例如,用于解決脂肪代謝和疾病,同時提供了用于增加n-6和n-3兩種必需脂肪酸的產量的創新技術。
因此,本文所述的某些方面提供了用于在動物或其細胞(即,除秀麗隱桿線蟲以外的細胞,例如但不限于哺乳動物細胞)中有效地改變多不飽和脂肪酸(PUFAs)(例如n-6脂肪酸和n-3脂肪酸)的含量的組合物和方法。在一些實施方式中,經優化的fat-2和/或fat-1核酸或氨基酸序列或其生物活性變體能夠可操作地連接至調控序列、組成型激活的啟動子或組織特異性啟動子。調控序列不僅涵蓋啟動子,還涵蓋增強子或其它表達控制序列,例如促進核酸表達的多聚腺苷酸化信號。本文還描述了可以由飽和脂肪和/或碳水化合物制造n-6脂肪酸和/或n-3脂肪酸的工程化的動物細胞(例如,體外、體內或離體)、包含該細胞的轉基因非人動物、從這些轉基因非人動物獲得的食物產品(例如,肉或動物的其它可食用部分(例如,肝、腎或胸腺))和使用它們的方法。
非人轉基因動物
本文所述的某些方面涉及可以由飽和脂肪、單不飽和脂肪和/或碳水化合物制造n-6脂肪酸的非人轉基因動物。例如,在一個方面,本文所述的是具有包含可操作地連接至啟動子的第一外源和/或異源核酸分子的基因組的非人轉基因動物,其中,第一外源和/或異源核酸分子含有編碼將飽和脂肪、單不飽和脂肪和/或碳水化合物轉化為ω-6(或n-6脂肪酸)的酶的核苷酸序列。當轉基因動物中的第一外源和/或異源核酸分子表達時,轉基因動物由飽和脂肪、單不飽和脂肪和/或碳水化合物制造ω-6(或n-6脂肪酸)。
在一些實施方式中,轉基因動物中的異源酶將飽和脂肪、單不飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的轉化效率可以是至少約30%或更多,包括例如至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多。在一些實施方式中,轉基因動物中的異源酶將飽和脂肪、單不飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的轉化效率可以是100%。
本文所使用的術語“飽和脂肪”是指含有大量飽和脂肪酸的甘油三酯。在一些實施方式中,飽和脂肪可以包括至少約50%或更多的飽和脂肪酸,包括例如至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多、包括高達100%。在一些實施方式中,飽和脂肪可以包含小于5%或更少(包括例如小于4%、小于3%、小于2%、小于1%、小于0.5%或更少)的多不飽和脂肪酸。在一些實施方式中,飽和脂肪不含任何多不飽和脂肪酸,例如n-3脂肪酸和/或n-6脂肪酸。在一些實施方式中,飽和脂肪可以包含單不飽和脂肪酸,例如,不超過總脂肪酸的50%。一般情況下,飽和脂肪酸在脂肪酸鏈的單個碳原子之間沒有雙鍵。也就是說,碳原子的鏈完全被氫原子“飽和”。有許多種天然存在的飽和脂肪酸,它們的區別主要在于碳原子數,例如,從3個碳原子(丙酸)至36個碳原子(三十六碳酸)。在一些實施方式中,飽和脂肪可以具有C8和C22之間的碳鏈長度。飽和脂肪酸的實例包括但不限于辛酸(C8)、癸酸(C10)、月桂酸(C12)、肉豆蔻酸(C14)、棕櫚酸(C16)以及它們的兩種或多種的組合。飽和脂肪的實例包括但不限于:椰子油、紅花油、葵花籽油和動物脂。飽和脂肪酸的另外的實例包括:棕櫚酸酯;硬脂酸酯;肉豆蔻酸酯;以及它們的包含選自羥基、酰氧基、芳氧基、氨基、巰基、磺酸基、硫酸基、膦酸基、磷酸基、二膦酸基、三膦酸基、多膦酸基、二磷酸基、三磷酸基、多磷酸基、磷脂酰基、核苷、低聚糖、多糖和多元醇中的一種或多種基團的無環、環狀、雜環和芳香酯衍生物。在室溫下,飽和脂肪可以是固體或液體。飽和脂肪可以是天然存在的或合成的。
本文所使用的術語“不飽和脂肪酸”是指沿著甘油三酯的碳骨架具有至少一個或多個雙鍵(包括例如至少兩個或多個)的甘油三酯。不飽和脂肪酸可以包括單不飽和脂肪酸(或單不飽和脂肪)或多不飽和脂肪酸。
本文所使用的術語“單不飽和脂肪酸”是指沿著其碳骨架僅具有一個“雙鍵”的不飽和脂肪酸。在一些實施方式中,雙鍵可以存在于第九個碳原子和第十個碳原子之間,如棕櫚酸(16:1)和油酸(18:1)。不飽和脂肪酸一般是沿著其碳骨架具有至少一個或多個雙鍵的脂肪酸。脂肪酸的結構可以用“X:Y”的符號系統來表示,其中,X是碳(C)原子的總數,且Y是雙鍵的數量。
本文所使用的術語“多不飽和脂肪酸”(或“PUFAs”)是指沿著碳骨架具有至少兩個雙鍵的不飽和脂肪酸。僅通過舉例的方式,對于亞油酸(18:2),雙鍵可以存在于第九個碳原子和第十個碳原子之間以及第十二個碳原子和第十三個碳原子之間;對于α-亞麻酸(18:3),雙鍵可以存在于第九個碳原子和第十個碳原子之間、第十二個碳原子和第十三個碳原子以及第十五個碳原子和第十六個碳原子之間。
“PUFAs”可以分為兩個主要的家族(取決于最靠近脂肪酸碳鏈的甲基端的第一個雙鍵的位置(n))。脂肪酸具有兩個末端:羧酸(-COOH)末端,一般認為它是鏈的起點,因此稱為“α”;以及甲基(CH3)末端,一般認為它是鏈的“尾部”,因此稱為“ω”。脂肪酸的命名方式由第一個雙鍵的位置決定,從甲基端(即歐米伽(ω-)或n-末端)開始計數。因此,“n-6脂肪酸”或“ω-6脂肪酸”具有從分子的ω(甲基)端的第六碳原子開始的第一個不飽和雙鍵,并且另外具有朝向分子的羧基端的一個或多個雙鍵。n-6脂肪酸的非限制性實例包括:亞油酸、γ-亞麻酸、十八碳三烯酸、二十碳二烯酸、二高-γ-亞麻酸、花生四烯酸、二十二碳二烯酸、二十二碳四烯酸、二十二碳五烯酸、二十四碳四烯酸、二十四碳五烯酸以及它們的兩種或多種的組合。
相比之下,“n-3脂肪酸”或“ω-3脂肪酸”具有從遠離分子的ω端的第三個碳原子開始的第一個不飽和雙鍵,并且另外具有朝向分子的羧基端的一個或多個雙鍵。n-3脂肪酸的非限制性實例包括:十六碳三烯酸、α-亞麻酸、十八碳四烯酸、二十碳三烯酸、二十碳四烯酸、二十碳五烯酸、二十一碳五烯酸、二十二碳五烯酸、二十二碳六烯酸、二十四碳五烯酸、二十四碳六烯酸以及它們的兩種或多種的組合。
本文所使用的術語“碳水化合物”也被稱為糖(sugars或saccharides),是指包含碳、氫和氧的分子或者由碳、氫和氧構成的分子,具有通式Cx(H2O)y。在一些實施方式中,x和y可以大于或等于3。在一些實施方式中,x和y可以分別為3、4、5、6、7、8、9、10或更多。整數x和y可以相同或不同。碳水化合物可以包括單糖、二糖、多糖以及它們的混合物。術語“單糖”一般是不能水解成為任何更簡單的碳水化合物的羥基醛或羥基酮。單糖的實例包括但不限于:己糖、右旋糖、葡萄糖、果糖和半乳糖。術語“二糖”是指通過糖苷鍵連接的兩個單糖。二糖的非限制性的實例包括但不限于:蔗糖、麥芽糖、纖維二糖和乳糖。術語“多糖”包括含有超過兩個單糖單元的糖。示例性的多糖可以包括但不限于:淀粉(例如,玉米淀粉)。該術語還包括低聚糖(例如但不限于,低聚果糖和甘露寡糖)。該碳水化合物可以是天然存在的或合成的。
在一些實施方式中,與野生型或非轉基因動物中的n-6脂肪酸含量相比,當含有編碼將飽和脂肪、單不飽和脂肪和/或碳水化合物轉化為ω-6(或n-6脂肪酸)的酶的核苷酸序列的第一外源和/或異源核酸分子表達時,轉基因動物中(例如,機體組織和/或細胞內)的n-6脂肪酸含量增加。在一些實施方式中,與在非轉基因動物或野生型動物(例如基因組不含編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶的第一外源和/或異源核酸分子的動物)中的n-6脂肪酸含量相比,n-6脂肪酸含量的增加可以是至少約30%或更高,包括至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多。在一些實施方式中,與非轉基因動物或野生型動物(例如,基因組不含編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶的第一外源和/或異源核酸分子的動物)中的n-6脂肪酸含量相比,n-6脂肪酸含量的增加可以是至少約1.1倍或更高,包括至少約2倍、至少約3倍、至少約4倍、至少約5倍、至少約6倍、至少約7倍、至少約8倍、至少約9倍、至少約10倍或更多。
在一些實施方式中,編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶的核苷酸序列可以衍生自在細胞或動物內能夠從頭或者在體內由碳水化合物和/或飽和脂肪合成n-6脂肪酸的任何物種。例如,將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶可以衍生自無脊椎動物、昆蟲、蠕蟲、植物(例如花生、大豆、油菜籽和亞麻籽)、細菌、真菌、魚、甲殼動物、軟體動物、線蟲、藍藻和海藻。
僅舉例來說,在一些實施方式中,將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶可以包括δ12脂肪酸去飽和酶或其生物活性變體。在一個實施方式中,編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自蠕蟲。在一個實施方式中,編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自秀麗隱桿線蟲。在一個實施方式中,編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自花生,Yu等J Genet Genomics.2008;35:679-85。在另一實施方式中,編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列可以衍生自真菌,Sakuradani等Eur J.Biochem.1999;261:812-20。
如本文使用且貫穿于本說明書的,術語“外源”涉及編碼并非天然存在于待進行轉基因的宿主中的感興趣的基因(例如,編碼fat-2和/或fat-1的核酸)的核苷酸序列在該宿主的基因組中的添加和/或并入。
如本文使用且貫穿于本說明書的,術語“異源”涉及導入不同的物種的宿主或細胞中的一個物種的核苷酸序列。異源核酸序列并不會在不同的物種的宿主或細胞中正常地表達或天然地表達。
在一些實施方式中,編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶(例如,δ12脂肪酸去飽和酶)的核苷酸序列可以對應于或衍生自將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的野生型酶(例如,野生型δ12脂肪酸去飽和酶)的核苷酸序列。在一些實施方式中,野生型δ12脂肪酸去飽和酶可以由野生型fat-2基因序列編碼。衍生自秀麗隱桿線蟲的示例性的野生型fat-2基因序列以SEQ ID NO.5表示。
在一些實施方式中,與相應的野生型酶(例如,δ12脂肪酸去飽和酶)的核苷酸序列相比,編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶(例如,δ12脂肪酸去飽和酶)的核苷酸序列可以是經修飾的核苷酸序列。如本文使用且貫穿于本說明書的,術語“修飾”涉及如下核苷酸序列,該核苷酸序列具有約1%或更多(包括約2%、約3%、約4%、約5%、約10%、約20%、約30%、約40%、約50%、約60%或以上)的不同于編碼感興趣的野生型基因(例如但不限于,δ12脂肪酸去飽和酶)的核苷酸序列的核苷酸且保留了感興趣的野生型基因(例如但不限于,δ12脂肪酸去飽和酶)的足夠的生物活性。例如,為了使待進行轉基因的宿主中的異源基因更高表達,編碼異源基因的核苷酸序列可以通過優化宿主細胞的密碼子使用而加以修飾。在一些實施方式中,當一個或多個天然存在的編碼氨基酸序列的密碼子被改變但仍然編碼相同的氨基酸序列時,該序列被優化以用于宿主細胞。僅舉例來說,編碼氨基酸殘基纈氨酸的表示為“GTT”的一個或多個密碼子可以用也編碼纈氨酸的CTG替換;編碼氨基酸殘基精氨酸的表示為“CGT”的一個或多個密碼子可以用也編碼精氨酸的CGC替換;等等。該密碼子被修飾以包括待向其中插入重組DNA的宿主所優選的密碼子。可以將經優化的序列并入本文所述的任何載體和細胞,并用于可以使用野生型序列(例如,如下文所述的fat-2基因和/或fat-1基因)的任何方法。在某些情況下(例如,在轉基因動物的制造中),密碼子經優化的序列的使用可能是期望的,例如,用于增加導入轉基因動物中的異源基因的表達。優化并不是核酸序列可以被修飾的唯一方法。
編碼δ12脂肪酸去飽和酶的序列可以包含至少一個經優化的密碼子。優化的密碼子的數目可以不同。在一些實施方式中,該數目足以改善表達的某些方面(例如,轉錄的拷貝數)或者足以提高序列的效用。在一些實施方式中,僅修飾一些密碼子(例如,1-5個)可以改善序列。在另外的實施方式中,大量的密碼子(例如,至少5個以及多達150個)可以被優化。在一些實施方式中,并且不論編碼δ12脂肪酸去飽和酶的序列的原始物種,核酸分子可以包含5-10個、10-15個、15-20個、20-25個、25-30個、30-35個、35-40個、40-45個、45-50個、50-55個、55-60個、60-65個、65-70個、70-75個、75-80個、80-85個、85-90個、90-95個、95-100個、100-105個、105-110個、110-115個、115-120個、120-125個、125-130個、130-135個、135-140個、140-145個、145-150個、10-125個、25-100個、30-90個、40-80個、50-70個或約60個經優化的密碼子。
此外,經優化的密碼子的位置可以不同。例如,對于秀麗隱桿線蟲fat-2基因(例如,如以SEQ ID NO.6所示,其中,ATG是密碼子1),經優化的密碼子可見于下述位置的一處或多處(例如,至少1處、至少2處、至少3處、至少4處、至少5處、至少6處、至少7處、至少8處、至少9處、至少10處、至少20處、至少30處、至少40處、至少50處、至少60處、至少70處、至少80處、至少90處、至少95處或更多,包括全部):位置4、12、14、16、19、22、24、30、38、41、44、48、53、56、59、63、65、74、76、80、85、92、93、95、97、109、111、113、114、117、119、121、124、126、127、129、130、131、133、134、145、146、156、157、168、161、164、169、172、176、183、184、186、188、191、199、209、215、221、238、241、242、243、244、249、253、263、267、271、272、274、275、278、281、284、306、307、315、316、320、321、323、328、333、337、342、344、348、352、354、355、360、362、364、366、375、376和377。當使用秀麗隱桿線蟲fat-2基因以外的去飽和酶編碼基因時,密碼子可以在這些相同位置的一處或多處(例如,至少1處、至少2處、至少3處、至少4處、至少5處、至少6處、至少7處、至少8處、至少9處、至少10處、至少20處、至少30處、至少40處、至少50處、至少60處、至少70處、至少80處、至少90處、至少95處或更多,包括全部)被優化。在同源基因(例如,植物或真菌的δ12去飽和酶基因)中,優化的位置可以是對應于上述列出的位置的一處或多處(例如,至少1處、至少2處、至少3處、至少4處、至少5處、至少6處、至少7處、至少8處、至少9處、至少10處、至少20處、至少30處、至少40處、至少50處、至少60處、至少70處、至少80處、至少90處、至少95處或更多,包括全部)的位置。
在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-2基因)具有至少約70%或更多(包括例如至少約80%、至少約90%、至少約95%或更多)的相似性。在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-2基因)具有約80%或更多的相似性。在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-2基因)具有約90%或更多的相似性。在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-2基因)具有約91%或更多的相似性。
在一些實施方式中,為了提高哺乳動物中的秀麗隱桿線蟲fat-2基因的表達,秀麗隱桿線蟲fat-2基因序列的密碼子可以基于哺乳動物去飽和酶序列進行優化。在一個實施方式中,fat-2的經優化的核苷酸序列以SEQ ID NO.1表示,其相應的氨基酸序列以SEQ ID NO.3表示。
在一些實施方式中,編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶的核苷酸序列可以對應于或衍生自δ-12去飽和酶的核苷酸序列。在一些實施方式中,δ-12去飽和酶可以衍生自菠菜(Spinacia oleracea)。在一個實施方式中,δ-12去飽和酶基因可通過以SEQ ID NO.7表示的菠菜FAD2mRNA序列進行編碼。
第一外源和/或異源核酸分子可以含有編碼δ12脂肪酸去飽和酶或其生物活性變體的核苷酸序列。術語“生物活性變體”是指具有基本上類似于實體或分子的生物活性的生物活性(功能上或結構上)的實體,其為所述實體或分子的功能衍生物。術語“生物活性變體”旨在包括分子的“片段”、“變體”、“類似物”或“化學衍生物”。分子的“片段”是指分子的任何多肽子集。例如具有如同野生型δ12脂肪酸去飽和酶的、將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的活性的δ12脂肪酸去飽和酶的片段也被涵蓋在內,以用于本文所述的各方面。分子的“變體”(例如,δ12脂肪酸去飽和酶的“變體”)是指在結構和功能上與整個分子或與其片段基本上相似的分子。如果兩個分子具有基本上類似的結構,和/或如果兩個分子具有類似的生物活性,則一個分子被稱作與另一分子“基本相似”。因此,假如兩個分子具有類似的活性,即使一個分子的結構沒有在另一分子中被發現,或者如果氨基酸殘基的序列或核苷酸序列不一致,根據在本文所使用的該術語,它們被認為是變體。分子的“類似物”(例如δ12脂肪酸去飽和酶的類似物)是指在功能上基本類似于整個分子或其片段的分子。如在本文所使用的,當分子含有通常不是該分子的一部分的額外的化學部分時,該分子被稱作是另一分子的“化學衍生物”。這樣的部分可以提高分子的表達水平、酶活性、溶解度、吸收、生物半衰期等。該部分可以選擇性地減少分子的毒性、消除或衰減分子的任何不期望的副作用等。可介導這種影響的部分公開于Remington's Pharmaceutical Sciences,18th edition,A.R.Gennaro,Ed.,MackPubl.,Easton,PA(l990)。
在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以是保留了本文所述的將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸的野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的足夠的生物活性的變體。在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以是保留了野生型或經修飾的δ12脂肪酸去飽和酶的足夠的生物活性的變體,以在治療上或臨床上有效(例如,在制造轉基因動物、治療患者、或者進行診斷或其它實驗室測試或檢測中,變體是有用的)。例如,δ12脂肪酸去飽和酶的生物活性變體可以包括保留了野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸的生物活性的至少約25%或更高(包括例如至少約30%、至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%、至少約98%、至少約99%或更多)的酶的突變體或片段。例如,當δ12脂肪酸去飽和酶的片段可以將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸,并且該轉化為野生型或經修飾的酶在相同條件下的效率的至少約25%或更高(包括例如至少約30%、至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%、至少約98%、至少約99%以及高至100%)時,δ12脂肪酸去飽和酶的片段是全長酶的生物活性變體。
δ12脂肪酸去飽和酶的生物活性變體還可以包含一個或多個氨基酸取代(例如,酶序列中的1%、5%、10%、20%、25%、30%、40%、50%、60%或更多的氨基酸殘基可以被另一氨基酸殘基所取代)。這些取代可以構成本領域已知的保守的氨基酸取代。
在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的核苷酸序列具有至少約50%或更高(包括例如至少約60%、至少約70%、至少約80%、至少約90%、至少約95%、至少約99%)的一致性。在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的核苷酸序列具有至少約70%的一致性。在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的核苷酸序列具有至少約90%的一致性。在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的核苷酸序列具有至少約95%的一致性。在一些實施方式中,δ12脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的δ12脂肪酸去飽和酶(例如,由SEQ ID NO.1編碼)的核苷酸序列具有至少約99%的一致性。
δ12脂肪酸去飽和酶(例如,fat-2)的生物活性變體的生物活性可以通過細胞或動物中的表達進行評估,例如,通過RNA分析、和/或酶測定法、和/或細胞或動物的脂肪酸組成的脂質分析。確定細胞或動物的脂肪酸組成的方法是本領域已知的。實施脂肪酸組成分析的示例性的方法是采用氣相色譜法,描述于Kang等,BMC Biochem 2005;6:5以及美國專利7,238,851,以引用的方式將其內容并入本文中。
因為功能性的δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)可以將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸,所以當將轉基因動物或由其衍生的細胞用含有碳水化合物和/或飽和脂肪的組合物飼喂時,攜帶異源δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)的轉基因動物或由該轉基因動物衍生的細胞的n-6脂肪酸含量普遍增加。例如,當轉基因動物和對照均飼喂包含碳水化合物和/或飽和脂肪的相同組合物時,與沒有轉基因的動物(對照)相比,具有δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性的變體)的異源表達的轉基因動物可以顯示出機體組織和/或細胞中的n-6脂肪酸含量增加至少30%或更多,包括例如至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或更多。在一些實施方式中,當轉基因動物和對照均飼喂包含碳水化合物和/或飽和脂肪的相同組合物時,與沒有轉基因的動物(對照)相比,具有δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)的異源表達的轉基因動物可以顯示出機體組織和/或細胞中的n-6脂肪酸含量方面的至少1.1倍或更高(包括例如至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍或更多)的增加。
在一些實施方式中,當轉基因動物中的第一外源和/或異源核酸分子表達時,具有δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)的異源表達的轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以大于1:1或更高。例如,轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以大于1.5:1、大于2:1、大于5:1、大于10:1、大于15:1或大于20:1或更高。
在一些實施方式中,非人轉基因動物的基因組可以進一步包含第二外源和/或異源核酸分子。第二外源和/或異源核酸分子可以含有編碼與飽和脂肪和/或碳水化合物的代謝相關的基因的核苷酸序列。與飽和脂肪和/或碳水化合物的代謝相關的基因的實例包括但不限于:n-3脂肪酸去飽和酶、脂肪酸合酶(FAS)和硬脂酰輔酶A去飽和酶1(SCD-1)以及它們的兩種或多種的組合。
在一些實施方式中,第二外源和/或異源核酸分子可以含有編碼將至少一種或多種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列。
在一些實施方式中,轉基因動物內的將至少一種或多種n-6脂肪酸轉化為一種或多種n-3脂肪酸的異源酶的轉化效率可以是至少約30%或更多,包括例如至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多。在一些實施方式中,轉基因動物內的異源酶將飽和脂肪、單不飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的轉化效率可以是100%。因此,當轉基因動物中的第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子表達時,轉基因動物可以由飽和脂肪和/或碳水化合物制造n-3脂肪酸和n-6脂肪酸(至少其部分或全部可以轉化為n-3脂肪酸)。
在一些實施方式中,與沒有第二外源和/或異源核酸分子的同一物種的動物(例如,野生型動物或具有本文所述的第一外源核酸分子的異源表達的轉基因動物)中的n-3脂肪酸的含量相比,當含有編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列的第二外源和/或異源核酸分子表達時,轉基因動物中(例如,機體組織和/或細胞中)的n-3脂肪酸含量增加。在一些實施方式中,與沒有第二外源和/或異源核酸分子的同一物種的動物(例如,野生型動物或具有本文所述的第一外源核酸分子的異源表達的轉基因動物)中的n-3脂肪酸的含量相比,n-3脂肪酸含量的增加可以是至少約30%或更高,包括至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多。在一些實施方式中,與沒有第二外源和/或異源核酸分子的同一物種的動物(例如,野生型動物或具有本文所述的第一外源核酸分子的異源表達的轉基因動物)中的n-3脂肪酸的含量相比,n-3脂肪酸含量的增加可以是至少約1.1倍或更高,包括至少約2倍、至少約3倍、至少約4倍、至少約5倍、至少約6倍、至少約7倍、至少約8倍、至少約9倍、至少約10倍或更多。
因此,本文所述的另一方面提供了可以由飽和脂肪和/或碳水化合物制造n-3脂肪酸的非人轉基因動物。在該方面,非人轉基因動物可以具有包含如下的基因組:(i)第一外源和/或異源核酸分子,該核酸分子編碼將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的酶(例如,由fat-2基因序列編碼的酶或其生物活性變體);以及(ii)第二外源和/或異源核酸分子,該核酸分子含有編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列。當轉基因動物內的第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子表達時,轉基因動物可以由飽和脂肪和/或碳水化合物制造n-3脂肪酸和任選的n-6脂肪酸(n-6脂肪酸的至少一部分或全部可以被轉化為n-3脂肪酸)。
在一些實施方式中,將n-6脂肪酸轉化為n-3脂肪酸的酶可以包括n-3脂肪酸去飽和酶或其生物活性變體。當第二外源和/或異源核酸分子表達時,使轉基因動物可以將n-6脂肪酸轉化為n-3脂肪酸。國際專利申請號WO 2005/077022和美國專利號7,238,851描述了可以將n-6脂肪酸轉化為n-3脂肪酸的轉基因動物、組合物及其制造方法、以及它們的用途,可在本文中用于本文所述的各方面的目的,將其各自的內容以引用的方式并入本文中。
在一些實施方式中,編碼n-3脂肪酸去飽和酶的核苷酸序列可以衍生自能夠在細胞或動物內由n-6脂肪酸從頭或在體內合成n-3脂肪酸的任何物種。例如,n-3脂肪酸去飽和酶可以衍生自:無脊椎動物、昆蟲、蠕蟲、植物(例如花生、大豆、油菜籽和亞麻籽)、細菌、真菌、魚、甲殼動物、軟體動物、線蟲、藍藻和海藻。
僅舉例來說,在一個實施方式中,編碼n-3脂肪酸去飽和酶的核苷酸序列可以衍生自蠕蟲。在一個實施方式中,編碼n-3脂肪酸去飽和酶的核苷酸序列可以衍生自秀麗隱桿線蟲。
在一些實施方式中,編碼n-3脂肪酸去飽和酶的核苷酸序列可以對應于或衍生自野生型n-3脂肪酸去飽和酶的核苷酸序列。在一些實施方式中,野生型n-3脂肪酸去飽和酶可以由野生型fat-1基因序列編碼。衍生自秀麗隱桿線蟲的示例性的野生型fat-1基因序列以SEQ ID NO.8表示。
在一些實施方式中,與相應的野生型n-3脂肪酸去飽和酶的核苷酸序列相比,編碼n-3脂肪酸去飽和酶的核苷酸序列可以是經修飾的核苷酸序列。例如,經修飾的n-3脂肪酸去飽和酶是具有約1%或更多(包括約2%、約3%、約4%、約5%、約10%、約20%、約30%、約40%、約50%、約60%或更多)不同于編碼野生型n-3脂肪酸去飽和酶的核苷酸序列的核苷酸的核苷酸序列并保留了野生型n-3脂肪酸去飽和酶的足夠的生物活性。如上文所討論的,為了使待進行轉基因的宿主中的異源基因更高表達,核苷酸序列的密碼子可以例如被優化用于宿主細胞。因此,編碼n-3脂肪酸去飽和酶的序列可以包含至少一個或多個經優化的密碼子。經優化的密碼子的數目可以不同。在一些實施方式中,該數目足以改善表達的某些方面(例如,轉錄的拷貝數)或者足以提高序列的效用。在一些實施方式中,僅修飾一些密碼子(例如,1-5個)可以改善序列。在另外的實施方式中,大量的密碼子(例如,至少5個以及多達150個)可以被優化。在一些實施方式中,并且不論編碼n-3脂肪酸去飽和酶的序列的原始物種,第二外源和/或異源核酸分子可以包含5-10個、10-15個、15-20個、20-25個、25-30個、30-35個、35-40個、40-45個、45-50個、50-55個、55-60個、60-65個、65-70個、70-75個、75-80個、80-85個、85-90個、90-95個、95-100個、100-105個、105-110個、110-115個、115-120個、120-125個、125-130個、130-135個、135-140個、140-145個、145-150個、10-125個、25-100個、30-90個、40-80個、50-70個或約60個經優化的密碼子。
此外,經優化的密碼子的位置可以不同。例如,對于秀麗隱桿線蟲fat-1基因(例如,如以SEQ ID NO.8所示,其中,ATG是密碼子1),經優化的密碼子可見于如下位置的一處或多處(例如,至少1處、至少2處、至少3處、至少4處、至少5處、至少6處、至少7處、至少8處、至少9處、至少10處、至少20處、至少30處、至少40處、至少50處、至少60處、至少70處、至少80處或更多,包括全部):位置6、9、18、20、22、24、28-30、33-36、47、49、52、54、58、60、61、64、67、69-71、73、77、79、81、86、89、92、94-95、100、101、105、106、112、115、118、124、127、128、131、146、151、154、161、163、164、169、178、187、188、195、197、200、202、206、210、214、217、221、223、225、227、228、232、234、241、245、255、271、280-282、284、285、301、303、310、312、327、362和370。當使用秀麗隱桿線蟲fat-1基因以外的去飽和酶編碼基因時,密碼子可以在這些相同位置的一處或多處(例如,至少1處、至少2處、至少3處、至少4處、至少5處、至少6處、至少7處、至少8處、至少9處、至少10處、至少20處、至少30處、至少40處、至少50處、至少60處、至少70處、至少80處或更多,包括全部)被優化。在同源基因(例如,植物或真菌的n-3去飽和酶基因)中,優化的位置可以對應于上述列出的位置的一處或多處(例如,至少1處、至少2處、至少3處、至少4處、至少5處、至少6處、至少7處、至少8處、至少9處、至少10處、至少20處、至少30處、至少40處、至少50處、至少60處、至少70處、至少80處或更多,包括全部)的位置。
在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-1基因)具有至少約70%或更多(包括例如至少約80%、至少約90%、至少約95%或更多)的相似性。在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿fat-1基因)具有約80%或更多的相似性。在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-1基因)具有約90%或更多的一致性。在一些實施方式中,經優化的序列可以與野生型序列(例如,秀麗隱桿線蟲fat-1基因)具有約91%或更多的相似性。
在一些實施方式中,為了提高哺乳動物中的秀麗隱桿線蟲fat-1基因的表達,秀麗隱桿線蟲fat-1基因序列的密碼子可以基于哺乳動物去飽和酶序列進行優化。在一個實施方式中,fat-1的經優化的核苷酸序列以SEQ ID NO.2表示,其相應的氨基酸序列以SEQ ID NO.4表示。
第二外源和/或異源核酸分子可以含有編碼n-3脂肪酸去飽和酶或其生物活性變體的核苷酸序列。術語“生物活性變體”與上述的定義相同,旨在包括分子的片段、變體、類似物或化學衍生物,例如,在n-3脂肪酸去飽和酶的背景下的分子的片段、變體、類似物或化學衍生物。
在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體可以是保留了本文所述的將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的足夠的生物活性的變體。在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體可以是保留了野生型或經修飾的n-3脂肪酸去飽和酶的足夠的生物活性的變體,以在治療上有效或在臨床上有效(例如,在制造轉基因動物、治療患者、或者進行診斷或其它實驗室測試或檢測中,變體是有用的)。例如,n-3脂肪酸去飽和酶的生物活性變體可以包括保留了野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的生物活性的至少約25%或更高(包括例如至少約30%、至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%、至少約98%、至少約99%以及高至100%)的酶的突變體或片段。例如,當n-3脂肪酸去飽和酶的片段能夠將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸,并且該轉化為野生型或經修飾的酶在相同條件下的效率的至少約25%或更高(包括例如至少約30%、至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%、至少約98%、至少約99%以及高至100%)時,n-3脂肪酸去飽和酶的片段是全長酶的生物活性變體。
n-3脂肪酸去飽和酶的生物活性變體還可以包含一個或多個氨基酸取代(例如,酶序列中的1%、5%、10%、20%、25%、30%、40%、50%、60%或更多的氨基酸殘基可以被另一氨基酸殘基所取代)。這些取代可以構成本領域已知的保守的氨基酸取代。
在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體可以與野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的核苷酸序列具有至少約50%或更高(包括例如至少約60%、至少約70%、至少約80%、至少約90%、至少約95%、至少約99%)的一致性。在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體與野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的核苷酸序列具有至少約70%的一致性。在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體與野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的核苷酸序列具有至少約90%的一致性。在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體與野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的核苷酸序列具有至少約95%的一致性。在一些實施方式中,n-3脂肪酸去飽和酶的生物活性變體與野生型或經修飾的n-3脂肪酸去飽和酶(例如,由SEQ ID NO.2編碼)的核苷酸序列具有至少約99%的一致性。
類似于fat-2,n-3脂肪酸去飽和酶(例如,fat-1)的生物活性變體的生物活性可以通過在細胞或動物中的表達進行評估,例如,通過使用本領域已知或上文所述的任何方法進行的RNA表達和/或酶檢測和/或細胞或動物的脂肪酸組成的脂質分析。
因為功能性的n-3脂肪酸去飽和酶(例如,由fat-1基因編碼的n-3脂肪酸去飽和酶或其生物活性變體)可以將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸,所以當將轉基因動物或由其衍生的細胞用含有碳水化合物和/或飽和脂肪的組合物飼喂時,攜帶異源δ12脂肪酸去飽和酶(例如,由fat-2基因編碼)和異源n-3脂肪酸去飽和酶(例如,由fat-1基因編碼的n-3脂肪酸去飽和酶或其生物活性變體)的轉基因動物或由其衍生的細胞的n-3脂肪酸含量普遍增加。例如,當轉基因動物和對照均飼喂包含碳水化合物和/或飽和脂肪的相同組合物時,與沒有n-3脂肪酸去飽和酶轉基因的動物(對照)相比,具有n-3脂肪酸去飽和酶(例如,由fat-1基因編碼的n-3脂肪酸去飽和酶或其生物活性變體)和δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)的異源表達的轉基因動物可以顯示出機體組織和/或細胞中的n-3脂肪酸含量增加至少30%或更多,包括例如至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%或更多。在一些實施方式中,當轉基因動物和對照均飼喂包含碳水化合物和/或飽和脂肪的相同組合物時,與沒有n-3脂肪酸去飽和酶轉基因的動物(對照)相比,具有n-3脂肪酸去飽和酶(例如,由fat-1基因編碼的n-3脂肪酸去飽和酶或其生物活性變體)和δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)的異源表達的轉基因動物可以顯示出機體組織和/或細胞中的n-3脂肪酸含量方面的至少1.1倍或更高(包括例如至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍或更多)的增加。
在一些實施方式中,當轉基因動物中的第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子進行異源表達時,具有n-3脂肪酸去飽和酶(例如,由fat-1基因編碼的n-3脂肪酸去飽和酶或其生物活性變體)和δ12脂肪酸去飽和酶(例如,由fat-2基因編碼的δ12脂肪酸去飽和酶或其生物活性變體)的異源表達的轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以低于2:1或更低。例如,轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以小于1:1或更低。在一些實施方式中,轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值可以小于0.9:1、小于0.8:1、小于0.7:1、小于0.6:1、小于0.5:1、小于0.4:1或更小。
如本文所使用且貫穿于本說明書的,術語“轉基因動物”是指在一些或所有的細胞中具有轉基因的動物,通過人為干預例如下文所述的方法,轉基因被導入轉基因動物或轉基因動物的祖先中。例如,在產前階段例如胚胎階段,可將轉基因導入轉基因動物的一個或多個細胞中。“轉基因”是被整合入宿主細胞的基因組中的DNA序列,轉基因動物發育自該宿主細胞。轉基因一般包括“感興趣的基因”。“感興趣的基因”是期望在宿主細胞中整合和/或表達的編碼蛋白質或其它分子(例如,酶)的核酸序列。例如,在本文所述的各方面的背景下,感興趣的基因包括例如δ12脂肪酸去飽和酶、n-3脂肪酸去飽和酶和/或它們的生物活性變體。
待進行轉基因的“動物”是指在其機體內不能從頭或在體內制造n-6脂肪酸和/或n-3脂肪酸的動物,或者是在其機體內不會從頭制造足夠量的n-6脂肪酸和/或n-3脂肪酸以產生期望或有益的效果(例如,營養值或治療效果)的動物。在一些實施方式中,待進行轉基因的轉基因動物是除秀麗隱桿線蟲以外的動物。例如,待進行轉基因的動物可以包括但不限于下述任何動物:被作為牲畜或用作食物來源的動物(例如,魚或其它水生動物(例如,魷魚、章魚、甲殼動物(例如,龍蝦、蟹、蝸牛和蝦)、或其它可食用的水生動物(例如,鰻魚)。如實施例中所示,當被遞送至動物細胞時,秀麗隱桿線蟲fat-2基因和/或fat-1基因可有效表達,根據本領域公知的方法,該基因、其變體以及其它的fat-1基因可以被用于制造轉基因小鼠或更大的轉基因動物(例如牛、豬、綿羊、鹿、山羊、兔或任何其它牲畜和家畜;任何可食用的鳥類(例如,雞、火雞、鵝、鴨或母野雞)和魚類(包括貝殼動物和甲殼動物)。在一些實施方式中,動物是非人動物。
在本文所述的各方面的一些實施方式中,非人轉基因動物可以是轉基因魚。例如,轉基因可以包括fat-2基因或其生物活性變體(例如,秀麗隱桿線蟲fat-2基因,其可以包含本文所述的至少一個經優化的密碼子)、或者fat-2基因和fat-1基因或它們的生物活性變體(例如秀麗隱桿線蟲fat-2基因,其可以包含本文所述的至少一個經優化的密碼子;以及秀麗隱桿線蟲fat-1基因,其也可以包含本文所述的至少一個經優化的密碼子)。轉基因魚的實例包括但不限于:鱈魚(或鱈形目鱈魚科的任何魚(例如,黑線鱈);比目魚(庸鰈屬的鰈魚的兩個種中的任一個種的通用名);鯡魚(鯡形目的數種魚的通用名,還包括鳳尾魚);鯖魚(鯖科中的進口食用魚的多個種的通用名);鮭魚(或鮭科的任何魚,包括鱒魚);鱸魚(或鱸科的任何魚);鰣魚(或鯡科的任何魚);鰩魚(或鰩科的任何魚);胡瓜魚(或胡瓜魚科的任何魚);鰨魚(或鰨科的任何魚);金槍魚(或鯖科的任何魚)和斑馬魚。
在一些實施方式中,轉基因魚可以具有包含可操作地連接至啟動子的第一外源和/或異源核酸分子的基因組,其中,第一外源和/或異源核酸分子含有(i)SEQ ID NO.1的核苷酸序列;或(ii)作為SEQ ID NO.1的生物活性變體且與SEQ ID NO.1具有至少約70%的一致性的核苷酸序列;其中,當轉基因魚中的第一外源和/或異源核酸分子表達時,轉基因魚由飽和脂肪和/或碳水化合物制造n-6脂肪酸。在一些實施方式中,轉基因魚的基因組可以進一步包含第二外源和/或異源的核酸分子,其中,第二外源和/或異源核酸分子含有編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列。當轉基因魚中的第一和第二外源和/或異源核酸分子表達時,轉基因魚由飽和脂肪和/或碳水化合物制造n-3脂肪酸和可選的n-6脂肪酸。在一些實施方式中,編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列可以是(i)SEQ ID NO.2的核苷酸序列;或(ii)作為SEQ ID NO.2的生物活性變體且與SEQ ID NO.2具有至少約70%的一致性的核苷酸序列。
在本文所述的各方面的一些實施方式中,非人轉基因動物可以是脊椎動物。在一些實施方式中,非人轉基因動物可以是哺乳動物。在一些實施方式中,哺乳動物是非人哺乳動物。在一些實施方式中,非人轉基因動物可以選自于由奶牛、小鼠、大鼠、豬、綿羊、山羊、鹿、兔、水牛、魚、家禽、牲畜或家畜所組成的組。
本文所述的各方面的轉基因動物、由其衍生的組織或細胞可以使人們能夠在無需給它們飼喂可能轉而向系統中引入額外變量的不同的脂肪來源時,研究由n-6脂肪酸和/或n-3脂肪酸介導的細胞機制或生物條件。因此,在一些實施方式中,本文所述的非人轉基因動物的基因組可以進一步包含基因修飾。基因修飾可以包括感興趣的基因的插入、缺失和/或突變。例如,感興趣的基因可能與受脂肪代謝影響的細胞機制或生物條件相關。這種感興趣的基因的實例包括但不限于:ob(肥胖)基因、瘦素受體基因、載脂蛋白(apo)E基因。
在一些實施方式中,本文所述的非人轉基因動物可以被進一步工程化以包含ob基因中的突變,從而創造瘦素缺乏的ob/ob或肥胖非人轉基因動物模型(例如,ob/ob或肥胖轉基因小鼠模型)。
在一些實施方式中,本文所述的非人轉基因動物可以被進一步工程化為瘦素受體基因中的點突變的純合子,從而創造瘦素受體活性缺乏的db/db非人轉基因動物模型(例如,db/db轉基因小鼠)。
在一些實施方式中,本文所述的非人轉基因動物可以被進一步工程化以敲除apoE,從而創造動脈粥樣硬化的apoE敲除的非人轉基因動物模型(例如,apoE敲除的轉基因小鼠模型)。
在一些實施方式中,基因修飾可以包括宿主基因的修飾。在一些實施方式中,基因修飾可以包括異源基因的表達。異源基因可以是例如與脂肪代謝通路相關的基因、治療基因(例如,小分子或化療劑的受體)或包含編碼改善檢測中的分子效用的多肽的序列的核酸分子(例如,編碼熒光蛋白(例如綠色熒光蛋白(GFP)或增強型綠色熒光蛋白(EGFP))、非熒光標記(例如β-半乳糖苷酶)或者本領域已知的任何其它可檢測標記的標記基因或序列。異源基因可以(通過相同或單獨的表達載體)與本文所述的第一外源和/或異源核酸分子和/或第二外源和/或異源核酸分子(例如,編碼fat-2和/或fat-1的核酸分子)共表達。
取決于所使用的構建體是否包含組成型激活的啟動子或組織特異性啟動子(例如,在如下中激活的啟動子,例如:骨骼肌細胞、乳腺組織細胞、結腸組織細胞、神經元、視網膜細胞、胰細胞(例如,胰島細胞)、其它內分泌細胞、內皮細胞、皮膚細胞、脂肪細胞、視網膜細胞等),本文所述的第一和/或第二外源和/或異源核酸分子(例如,編碼fat-2基因和/或fat-1基因的核酸分子)可以在動物機體內全面表達或以組織特異性的方式表達。
本文所述的各方面的轉基因動物的組織和細胞可以含有改變的PUFA含量。例如,攜帶第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子(例如,編碼fat-2基因和fat-1基因的核酸分子)的轉基因動物的細胞和組織對消費來說可能更期望費,因為它們被工程化以具有高水平的n-3脂肪酸和低水平的n-6脂肪酸的細胞或組織含量(與沒有這些轉基因的轉基因動物相比)。因此,當它們被工程化以表達將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的第一異源酶和將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的第二異源酶(例如,分別由fat-2基因和fat-1基因編碼的去飽和酶)時,作為食物被消費(例如,被人類或哺乳動物消費)的轉基因牲畜或任何動物可以是更出眾的或者更健康的食物來源。
本文所述的制作非人轉基因動物的示例性方法
制作轉基因動物的方法是本領域已知的,包括例如但不限于:(1)將基因顯微注射入受精卵細胞的原核;(2)通過逆轉錄病毒轉移DNA;(3)將此前暴露至外源DNA的胚胎干細胞和/或胚胎生殖細胞注射入囊胚的腔中;(4)體外受精過程中由精子介導的外源和/或異源DNA轉移;(5)脂質體介導的DNA向細胞和胚胎中的轉移;(6)DNA電穿孔入精子、卵或胚胎;(7)生物導彈;以及(8)用體細胞或胚胎細胞進行的核移植,上述方法被描述于Wheeler等,“Transgenic technology and Applications in Swine,”Theriogenology 56:1345-1370(2001);Wolf等,“Transgenic technology in farm animals–progress and perspectives”,Exp Physiol 85.6:615-625(2000),以引用的方式將其整體并入本文中。
例如,在一個實施方式中,fat-2轉基因構建體被施用至小鼠(例如,通過顯微注射),以創造fat-2轉基因小鼠。在轉基因小鼠被評估以顯示fat-2表型和基因型后,雜合的fat-2轉基因小鼠可以與野生型小鼠(例如,C57BL6野生型(WT)小鼠)回交許多世代(例如,~5代),然后與雜合的fat-1轉基因小鼠雜交。所產生的后代由WT小鼠、fat-1小鼠、fat-2小鼠和ω小鼠組成。WT小鼠并不表達fat-1或fat-2轉基因中的任一者。fat-2小鼠僅攜帶fat-2轉基因,而ω小鼠表達fat-1轉基因和fat-2轉基因。更多細節見實施例。
在一些實施式案中,如實施例所示,ω小鼠可以通過將包含fat-2轉基因和fat-1轉基因的構建體導入至野生型小鼠中來制造。
在另一實施方式中,可用于制造轉基因動物(例如但不限于,小鼠)的一種方法如下:雌性小鼠交配,并將由此產生的受精卵從其輸卵管中解剖出來。將卵存儲于適當的介質如M2培養基中(Hogan B.等Manipulating the Mouse Embryo,A Laboratory Manual,Cold Spring Harbor Laboratory(1986),以引用的方式將其內容并入本文)。通過本領域已知的方法從載體(例如,質粒pCEXV-α、質粒pCAGGS)中純化DNA或cDNA編碼基因、小基因(minigene)或重組底物。誘導型啟動子可以與DNA的編碼區融合,以提供實驗手段來調節轉基因的表達。可選或另外的是,組織特異性調控元件可以與編碼區融合,以使得轉基因能夠進行組織特異性表達。將處于適當的緩沖溶液中的DNA放入顯微注射針(可使用移液器由毛細管制造),并將待注射的卵放入凹玻片。將針插入卵的原核,并注射DNA溶液。然后將經注射的卵轉移至假孕小鼠(即,用適當的激素刺激以維持懷孕但實際上并沒有懷孕的小鼠)的輸卵管中,當卵進入子宮,植入并發育一段時間。這一原核DNA顯微注射是基因轉移的經典方法,并描述于Brem,“Transgenic animals.In Biotechnology,ed.Rehm,H.J.&Reed,G.,pp.745-832.VCH,Weinheim(1993);以及Hammer等,“Production of transgenic rabbits,sheep and pigs by microinjection”,Nature 315,680-683(1985),以引用的方式將其內容整體并入本文中。用于小鼠中的DNA顯微注射的基本方法描述于Rulicke等,“Germline transformation of mammals by pronuclear microinjection,”Experimental Physiology 85:589-601(2000),以引用的方式將其內容整體并入本文中。對于該方法而言,一些物種的特異性修飾是必要的,例如在胚胎回收、顯微注射過程、以及用于經注射的胚胎向接受者的轉移中(Brem,“Transgenic animals”.In Biotechnology,ed.Rehm,H.J.&Reed,G.,pp.745-832.VCH,Weinheim(1993),以引用的方式將其內容整體并入本文中)。DNA顯微注射不是將DNA插入卵細胞中的唯一方法,DNA顯微注射用于本文僅為示范的目的。
另外,重組逆轉錄病毒可以用于將本文所述的轉基因遞送至細胞,例如,卵母細胞、胚胎細胞或單細胞胚胎。因此,可將轉基因和任何相關的遺傳因子作為前病毒整合入宿主細胞的基因組中。然后可以使細胞能夠發育成轉基因動物。
在一些實施方式中,用于遞送轉基因(例如,fat-2和/或fat-1)的重組逆轉錄病毒可以是經修飾的慢病毒,從而能感染分裂和未分裂兩種細胞。重組逆轉錄病毒可以包含含有轉基因(例如,fat-2和/或fat-1)的經修飾的慢病毒基因組。此外,經修飾的慢病毒基因組可以缺乏病毒復制所需的蛋白質的內源基因,從而防止在轉基因動物中的復制。如本文所述,在重組逆轉錄病毒的制造過程中,在包裝細胞系中以反式(in trans)提供所需的蛋白質。
在一些實施方式中,轉基因被并入包含完整的逆轉錄病毒5′LTR和自我失活3′LTR的病毒構建體中。病毒構建體優選被導入包裝細胞系中,基于病毒構建體,將病毒基因組RNA包裝入具有期望的宿主特異性的病毒顆粒中。病毒顆粒集合并使得能夠感染宿主細胞。
創造轉基因動物尤其是如小鼠或大鼠的動物的方法,在本領域已成為常規,描述于例如:Ausubel等(eds)“Current Protocols in Molecular Biology”John Wiley&Sons,Inc.,in Hogan,B.,Manipulating the Mouse Embryo,(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1986);美國專利號5,614,396、5,487,992、5,464,764、5,387,742、5,347,075、5,298,422、5,288,846、5,221,778、5,175,384、5,175,383、4,873,191、4,870,009、4,736,866;以及Burke和Olson,Methods in Enzymology,194:251-270,1991;Capecchi,Science 244:1288-1292,1989;Davies等,Nucleic Acids Research,20(11)2693-2698,1992;Dickinson等,Human Molecular Genetics,2(8):1299-1302,1993;Duff和Lincoln,“Insertion of a pathogenic mutation into a yeast artificial chromosome containing the human APP gene and expression in ES cells”,Research Advances in Alzheimer's Disease and Related Disorders,1995;Huxley等,Genomics,9:742-7501991;Jakobovits等,Nature,362:255-261 1993;Lamb等,Nature Genetics,5:22-29,1993;Pearson和Choi,Proc.Natl.Acad.Sci.USA,1993,90:10578-82;Rothstein,Methods in Enzymology,194:281-301,1991;Schedl等,Nature,362:258-261,1993;Strauss等,Science,259:1904-1907,1993;WO 94/23049,WO93/14200,WO 94/06908and WO 94/28123也提供了信息。
本文所述的各方面并不限于特定的動物。在一些實施方式中,本文所述的各方面可以被施用至人和非人動物。例如,在一些實施方式中,嚙齒動物(例如,小鼠或大鼠)或靈長動物被提供作為動物模型,用于脂肪代謝的變化和化合物的篩選。
本文所述的某些方面提供了商業上有用的過表達本文所述的第一外源和/或異源核酸分子和/或第二外源和/或異源核酸分子(例如,編碼fat-2或fat-1相關的蛋白)的轉基因動物(例如,牲畜,如豬、奶牛或綿羊)。來自這種轉基因動物的肉可以具有期望的特性,例如較低的脂肪含量和較高的肌肉含量。可以利用任何適用于制造轉基因牲畜的技術。在一些實施方式中,利用了逆轉錄病毒載體感染(參見例如美國專利號6,080,912和WO/0030437,以引用的方式將其各自的內容整體并入本文。
類似的方法可以用于制造其它轉基因動物。轉基因創始動物可以被基于在其基因組中存在的轉基因和/或在轉基因動物的組織或細胞中的轉基因mRNA的表達來確認。例如,攜帶fat-2或fat-1相關的轉基因的轉基因創始動物可以隨后被用來培育攜帶轉基因的另外的動物。此外,攜帶轉基因的轉基因動物可以進一步被培育成為攜帶其它基因的其它轉基因動物。轉基因動物還包括如下動物,整個動物或該轉基因動物中的組織利用本文所述的同源重組宿主細胞制造。
本領域已知的任何技術都可用于將轉基因(如fat-2和/或fat-1基因)可表達地導入動物中以制造動物的哺乳動物系。這些技術包括但不限于:原核顯微注射(美國專利號4,873,191);逆轉錄病毒介導的向生殖系基因轉移[Van der Putten等,1985,Proc.Natl.Acad.Sci.,USA 82,6148-6152];在胚胎干細胞中的基因靶向,例如同源重組介導的基因靶向[Thompson等,1989,Cell 56,313-321;以及美國專利號5,614,396];胚胎的電穿孔[Lo,1983,Mol.Cell.Biol.3,1803-1814];以及精子介導的基因轉移[Nakanishi和Iritani,Mol.Reprod.Dev.36:258-261(1993);Maione,Mol.Reprod.Dev.59:406(1998);Lavitrano等Transplant.Proc.29:3508-3509(1997);Lavitrano等,Proc.Natl.Acad.Sci.USA 99:14230-5(2002);Lavitrano等,Mol.Reprod.Dev.64-284-91(2003))。類似的技術還被描述于美國專利號6,376,743;美國專利公開號20010044937、20020108132和20050229263。
在一些實施方式中,轉基因(例如,fat-2或fat-1基因)可以被整合入轉基因動物的細胞的基因組中。細胞可以是體細胞或生殖系細胞。在一些實施方式中,轉基因(例如,fat-2或fat-1基因)可以被整合入細胞的基因組中,轉基因動物由該細胞發育成,并且該轉基因仍然以轉基因動物的一種或多種細胞類型或者一種或多種組織保留在成熟動物的基因組中。
轉基因(例如,fat-2或fat-1基因)可在非人動物如哺乳動物中過表達。哺乳動物可以是例如:嚙齒動物如小鼠、倉鼠、豚鼠、兔或大鼠;靈長動物;豬;羊;牛;貓;犬等。在特定的實施方式中,轉基因動物可以是綿羊、山羊、馬、奶牛、公牛、豬、兔、豚鼠、倉鼠、大鼠、沙鼠、小鼠等。在其它實施方式中,轉基因動物可以是鳥。在一些實施方式中,轉基因動物是嵌合動物(即,由基因學上不同的細胞的混合物組成的動物)、鑲嵌動物(即,由具有不同遺傳來源或染色體組成的兩個或多個細胞系組成的動物,細胞系均衍生自同一合子)、未成熟的動物、胎兒、囊胚等。
含有fat-2或fat-1相關的轉基因的轉基因非人動物可以使用本領域已知的方法制備。一般來說,將fat-2或fat-1相關的轉基因導入靶細胞中,然后用來制備轉基因動物。fat-2或fat-1相關的轉基因可以被導入靶細胞中,舉例來說,多能細胞或全能細胞,例如胚胎干(ES)細胞(例如,鼠胚胎干細胞)或其它干細胞(例如,成人干細胞);生殖細胞(例如,原始生殖細胞、卵母細胞、卵細胞、精母細胞或精細胞);受精卵;合子;卵裂球;(分化或未分化的)胎兒或成體細胞等。在一些實施方式中,fat-2或fat-1相關的轉基因被導入動物(例如,嚙齒動物)的胚胎干細胞或生殖細胞中,以制備過表達fat-2或fat-1相關的轉基因的轉基因動物。
通過胚胎操作和顯微注射制造轉基因動物(特別是例如小鼠的動物)的方法描述于例如:Leder等的美國專利號4,736,866和4,870,009;Wagner等的美國專利號4,873,191;以及Hogan,B.,Manipulating the Mouse Embryo,(Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.,1986)。
胚胎干細胞可以按照公開的程序(參見例如,Teratocarcinomas和Embryonic Stem Cells:A Practical Approach,Robertson(ed.),IRL Press,Washington,D.C.(1987);Zjilstra等,Nature 342:435-38(1989);Schwartzberg等,Science 246:799-803(1989);美國專利號6,194,635、6,107,543和5,994,619;以引用的方式將其各自整體并入本文中)進行操作。分離原始生殖細胞的方法在本領域是公知的。例如,從有蹄動物分離原始生殖細胞的方法公開于美國專利號6,194,635(以引用的方式將該公開內容整體并入本文)。
轉基因(例如,fat-2或fat-1基因)可以通過任何合適的方法導入靶細胞。例如,fat-2或fat-1相關的轉基因可以通過如下導入細胞中:轉染(例如,磷酸鈣或DEAE-右旋糖酐介導的轉染)、脂質轉染、電穿孔、顯微注射(例如,通過直接注射裸的DNA)、生物導彈、用含有fat-2或fat-1相關的轉基因的病毒載體進行感染、細胞融合、染色體介導的基因轉移、微細胞介導的基因轉移、核移植等。fat-2或fat-1相關的轉基因可以通過電穿孔(參見例如,Wong和Neumann,Biochem.Biophys.Res.Commun.107:584-87(1982))和生物導彈(例如,基因槍;Johnston和Tang,Methods Cell Biol.43Pt A:353-65(1994);Fynan等,Proc.Natl.Acad.Sci.USA90:11478-82(1993))導入細胞。
在某些實施方式中,fat-2或fat-1相關的轉基因可以通過轉染或脂質轉染導入靶細胞。轉染或脂質轉染的合適的藥劑包括例如:磷酸鈣、DEAE-右旋糖酐、脂質體、lipfectamine、DIMRIE C、Superfect和雙甲苯喘定(Effectin;Qiagen)、unifectin、maxifectin、DOTMA、DOGS(Transfectam;雙十八烷基酰胺甘氨酰精胺)、DOPE(1,2-二油酰基-sn-丙三基-3-磷酸乙醇胺)、DOTAP(1,2-二油酰基-3-三甲銨丙烷)、DDAB(二甲基雙十八烷基溴化銨)、DHDEAB(N,N-雙正十六烷基-N,N-二羥乙基溴化銨)、HDEAB(N-正十六烷基-N,N-二羥乙基溴化銨)、聚凝胺、聚乙烯亞胺(PEI)等(參見例如,Banerjee等,Med.Chem.42:4292-99(1999);Godbey等,Gene Ther.6:1380-88(1999);Kichler等,Gene Ther.5:855-60(1998);Birchaa等,J.Pharm.183:195-207(1999);以引用的方式將其各自整體并入本文)。
在一些實施方式中,fat-2或fat-1相關的轉基因可以被顯微注射入受精卵母細胞的原核或ES細胞的核中。典型的方法是受精卵母細胞的顯微注射。通過標準的技術用編碼fat-2或fat-1相關的轉基因的核酸顯微注射受精卵母細胞。一般將經顯微注射的卵母細胞在體外培養直至得到“移植前胚胎”。這樣的移植前胚胎可以包含約16個至150個細胞。對于小鼠、兔、豬、奶牛等,用于培養受精卵母細胞至移植前階段的方法包括由如下描述的方法:Gordon等(Methods in Enzymology 101:414(1984));Hogan等(in Manipulating the Mouse Embryo,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.(1986));Hammer等(Nature315:680(1986));Gandolfi等(J.Reprod.Fert.81:23-28(1987));Rexroad等(J.Anim.Sci.66:947-53(1988));Eyestone等(J.Reprod.Fert.85:715-20(1989));Camous等(J.Reprod.Fert.72:779-85(1989));以及Heyman等(Theriogenology 27:5968(1989))(以引用的方式將這些參考文獻整體并入本文)。這樣的移植前胚胎可以隨后轉移至適當的(例如,假孕)雌性。取決于發育階段,當將fat-2或fat-1相關的轉基因或者含有fat-2或fat-1相關的轉基因的細胞導入胚胎時,可制造嵌合動物或鑲嵌動物。通過選擇育種方法,可以培育嵌合動物或鑲嵌動物以形成真正的生殖系轉基因動物。或者,可以將經顯微注射或轉染的胚胎干細胞注射入合適的囊胚中,然后將囊胚植入適當的培育雌性中(例如,假孕雌性)。
fat-2或fat-1相關的轉基因也可通過感染細胞而被導入細胞中或用含有突變基因的傳染性病毒而被導入合子細胞中。合適的病毒包括:逆轉錄病毒(一般參見Jaenisch,Proc.Natl.Acad.Sci.USA 73:1260-64(1976));缺陷或減毒的逆轉錄病毒載體(參見例如,U.S.Pat.No.4,980,286;Miller等,Meth.Enzymol.217:581-99(1993);Boesen等,Biotherapy 6:291-302(1994);將這些參考文獻整體并入本文);慢病毒載體(參見例如,Naldini等,Science 272:263-67(1996),以引用的方式整體并入本文);腺病毒或腺相關病毒(AAV)(參見例如,Ali等,Gene Therapy 1:367-84(1994);美國專利號4,797,368和5,139,941;Walsh等,Proc.Soc.Exp.Biol.Med.204:289-300(1993);Grimm等,Human Gene Therapy 10:2445-50(1999);以引用的方式將其公開內容整體并入本文)。
病毒載體可以被導入例如:胚胎干細胞、原始生殖細胞、卵母細胞、卵細胞、精母細胞、精細胞、受精卵、合子、卵裂球或任何其它合適的靶細胞。在示例性的實施方式中,可以使用轉導分裂細胞的逆轉錄病毒載體(例如,衍生自鼠白血病病毒的載體;參見例如,Miller和Baltimore,Mol.Cell.Biol.6:2895(1986))。攜帶感興趣的基因的重組逆轉錄病毒載體的制造通常以兩個階段實現。首先,fat-2或fat-1相關的轉基因可以被插入包含如下的逆轉錄病毒載體中:fat-2或fat-1相關的轉基因(包含可由病毒的長末端重復序列(LTRs)提供或者由內部的啟動子/增強子和相關剪接信號提供的啟動子和/或增強子元件)的高效表達所必需的序列;用于將病毒RNA高效包裝入傳染性病毒顆粒中所需的序列(例如,包裝信號(Psi)、tRNA引物結合位點(-PBS)、逆轉錄所需的3′調控序列(+PBS)以及病毒LTRs)。LTRs包含病毒基因組RNA結合所需的序列;逆轉錄酶和整合酶的功能所需的序列;以及參與引導基因組RNA表達以包裝成病毒顆粒的序列。
隨著重組載體的構建,載體DNA被導入包裝細胞系中。包裝細胞系以反式提供了用于將病毒基因組RNA包裝成具有期望的寄主范圍的病毒顆粒(例如,病毒編碼的核心(gag)、聚合酶(pol)和包膜(env)蛋白)的所需的病毒蛋白。寄主范圍部分地由病毒顆粒表面上表達的包膜基因產物的類型控制。包裝細胞系可以表達嗜同性、雙嗜性或嗜異性的包膜基因產物。或者,包裝細胞系可以缺乏編碼病毒包膜(env)蛋白的序列。在該情況下,包裝細胞系可以將病毒基因組包裝成缺乏膜相關蛋白(例如,env蛋白)的顆粒。為了制造含有使病毒能夠進入細胞的膜相關蛋白的病毒顆粒,含有逆轉錄病毒序列的包裝細胞系可以用編碼膜相關蛋白(例如,皰疹性口腔炎病毒(VSV)的G蛋白)的序列轉染。然后,經轉染的包裝細胞可以制造含有由經轉染的包裝細胞系表達的膜相關蛋白的病毒顆粒;這些含有衍生自被另一病毒的包膜蛋白的殼體包裹的一種病毒的病毒基因組RNA的病毒顆粒被稱為假型病毒顆粒。
未經歷配子發生的最后階段的卵母細胞通常會被逆轉錄病毒載體感染。然后,經注射的卵母細胞使得能夠伴隨減數分裂而完全成熟。減數分裂過程中的核包膜的破壞使得逆轉錄病毒載體的前病毒形式能夠整合入卵母細胞的基因組中。當使用成熟前的卵母細胞時,經注射的卵母細胞隨后在允許卵母細胞于體外受精前成熟的條件下在體外進行培養。卵母細胞可以在體內成熟,并且代替在體外成熟的卵母細胞使用。對于各種哺乳動物,超數排卵和收集體內成熟的卵母細胞(例如,處于中期2期的卵母細胞)的方法是已知的(例如,對于小鼠的超數排卵,參見Hogan等,in Manipulating the Mouse Embryo:A Laboratory Manual,2nd ed.,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,N.Y.(1994),pp.130-133;以引用的方式將其公開內容整體并入本文)。
在一些實施方式中,通過核轉移制備轉基因動物。術語“核轉移”或“核移植”是指制備轉基因動物的方法,其中,來自供體細胞的細胞核被移植入去核卵母細胞中。核轉移技術或核移植技術是本領域已知的(參見例如,Campbell等,Theriogenology 43:181(1995);Collas和Barnes,Mol.Reprod.Dev.38:264-67(1994);Keefer等,Biol.Reprod.50:935-39(1994);Sims等,Proc.Natl.Acad.Sci.USA 90:6143-47(1993);Prather等,Biol.Reprod.37:59-86(1988);Roble等,J.Anim.Sci.64:642-64(1987);國際專利公開WO 90/03432,WO 94/24274和WO 94/26884;美國專利號4,994,384和5,057,420;以引用的方式將其公開內容整體并入本文)。例如,轉基因胚胎的核、多能細胞、全能細胞、胚胎干細胞、生殖細胞、胎兒細胞或成體細胞(即,含有fat-2或fat-1相關的轉基因)可以被移植入去核卵母細胞中,此后將其各自培養至囊胚階段(本文所使用的術語“去核”是指核被移除的細胞、以及是指核在功能上被導致無效的細胞)。含有fat-2或fat-1相關的轉基因的核可以通過任何合適的方法被導入這些細胞中。然后,轉基因細胞可以通常在體外培養,以形成預植入胚胎,預植入胚胎可以植入合適的雌性中(例如,假孕的雌性)。
轉基因胚胎任選地可以接受或再接受另一輪的核移植。當原始的轉移核來自成體細胞(例如,成纖維細胞或其它高度分化細胞或終末分化細胞)以制造健康的轉基因動物時,額外輪核移植克隆可能是有用的。
制造表達fat-2或fat-1相關的轉基因的轉基因動物的其它方法包括使用雄性精細胞以將fat-2或fat-1相關的轉基因攜帶至卵。在一個實例中,fat-2或fat-1相關的轉基因可通過直接遞送而被在體內給予至雄性動物的睪丸。fat-2或fat-1相關的轉基因可以使用例如微量吸移管導入細精管、導入睪丸網、導入輸出管或輸入管。
在一些實施方式中,fat-2或fat-1相關的轉基因可以被離體導入雄性生殖細胞的基因組中。許多已知的基因遞送方法可用于將核酸序列攝入細胞中。將fat-2或fat-1相關的轉基因導入雄性生殖細胞中的合適的方法包括例如:脂質體、逆轉錄病毒載體、腺病毒載體、腺病毒增強基因遞送系統、或它們的組合。
將fat-2或fat-1相關的轉基因轉移入雄性生殖細胞中后,轉基因合子可以通過雌性動物與雄性動物繁殖而形成。轉基因合子可以通過例如通過自然交配(例如,由同一物種的雄性和雌性脊椎動物交配)形成、或通過體外或體內的人工手段形成。如本領技術人員所了解的,合適的人工手段包括但不限于:人工授精;體外受精(IVF);和/或其它人工生殖技術,例如胞漿內精子注射(ICSI)、帶下授精(SUZI)、部分帶剖開(PZD)等(參見例如,國際專利公開WO 00/09674,以引用的方式將其公開內容整體并入本文)。
可以使用各種各樣的方法來檢測靶細胞和/或轉基因動物中的fat-2或fat-1相關的轉基因的存在。由于轉基因摻入的頻率可能較低,所以雖然是可靠的,但是移植前胚胎中的轉基因整合的檢測可以是期望的。一方面,篩選胚胎以使得能夠鑒別用于植入以形成轉基因動物的含有fat-2或fat-1相關的轉基因的胚胎。例如,從移植前胚胎中移除一個或多個細胞。當使用胚胎的均等分裂時,通常不將胚胎培育超過桑椹期(32個細胞)。移植前胚胎的分裂(參見例如,Williams等,Theriogenology 22:521-31(1986))使得產生兩個“半胚胎”(半桑椹胚或半囊胚),在植入適當的雌性中后,其中的一個可以隨后發育,以在子宮內發育一段時間。雖然移植前胚胎的均等分裂是常見的,將理解的是,這樣的胚胎可以有意或無意地非均等分裂成為兩個半胚胎。從本質上講,未進行分析的胚胎中的一個通常有足夠的細胞數以在子宮內發育到足月。在一個具體的實施方式中,未進行分析的半胚胎如果顯示為轉基因的,可以被用來產生轉基因動物的克隆種群,例如通過胚胎分裂。
可對由移植前胚胎的分裂所形成的半胚胎之一進行分析以確定fat-2或fat-1相關的轉基因是否已被整合入生物體的基因組中。另外的半胚胎各自可以被保存以用于隨后植入受體雌性中,通常是同一物種的受體雌性。用于檢測在胚胎發育中處于早期的fat-2或fat-1相關的轉基因的典型方法利用了這些半胚胎連同等位基因特異性PCR,等位基因特異性PCR可以區分fat-2或fat-1相關的轉基因與內源轉基因(參見例如,McPherson等(eds)PCR2:A Practical Approach,Oxford University Press(1995);Cha等,PCR Methods Appl.2:14-20(1992);以引用的方式將其公開內容并入本文)。
在半胚胎被鑒別為轉基因半胚胎后,半胚胎任選地可以被克隆。這種胚胎克隆可以通過多種不同的方法進行。在一種克隆方法中,轉基因半胚胎可以在與用于培養個體卵母細胞至移植前階段的相同或類似的培養基中培養。這樣形成的“轉基因胚胎”(通常是轉基因桑椹胚)隨后可以被分裂為“轉基因半胚胎”,轉基因半胚胎可被植入受體雌性中以形成兩個轉基因非人動物的克隆種群。或者,所獲得的兩個轉基因半胚胎可被再次培養至移植前階段、分裂并再培養至轉基因胚胎階段。此過程可以被重復,直至獲得期望數目的具有相同的基因型的克隆轉基因胚胎。然后,這樣的轉基因胚胎可以被植入受體雌性中以產生轉基因非人動物的克隆種群。
除了用于檢測fat-2或fat-1相關的轉基因的存在的以上方法以外,還可采用其它方法。這樣的方法包括例如組織的子宮內和產后分析。子宮內分析可以通過多種技術進行。在一個實例中,在聽診器指引(echoscopic guidance)下進行羊膜腔的經陰道穿刺(參見例如,Bowgso等,Bet.Res.96:124-27(1975);Rumsey等,J.Anim.Sci.39:386-91(1974))。這涉及在妊娠期間恢復羊水。羊水中的大部分細胞是死亡的。然而,這樣的細胞含有可以接受對作為成功的轉基因的指示的fat-2或fat-1相關的轉基因進行分析(例如,通過PCR)的基因組DNA。或者,胎兒細胞可以通過絨毛膜穿刺恢復。該方法還可以經陰道并在聽診器指引下進行。在該方法中,針可以用于穿刺受體動物的胎盤,尤其是倚靠著陰道壁固定的胎盤結構(placentonal structures)。如果有必要,絨毛膜細胞可以從母體組織分離,并接受對作為成功的轉基因的指示的fat-2或fat-1相關的轉基因進行的PCR分析。
fat-2或fat-1相關的轉基因的存在還可以在出生后被檢測到。在這種情況下,fat-2或fat-1相關的轉基因的存在可以通過合適的組織活檢進行檢測,例如來自推定的轉基因動物的耳朵或尾巴。fat-2或fat-1相關的轉基因的存在還可以通過測定組織中的fat-2或fat-1相關的轉基因多肽的表達來進行檢測。
可以通過本領域技術人員已知的方法確定整合事件的位置和數目(參見例如,Ausubel等,同前;Sambrook等,同前)。例如,當期望關于病毒DNA向宿主基因組中整合的位點的信息時,可以利用從被感染的卵母細胞和/或由此制造的胚胎、后代和由其衍生的組織中提取的基因組DNA的PCR或DNA印跡分析。為了檢查宿主基因組中存在的整合位點的數量,所提取的基因組DNA通常可以用限制性酶消化,該限制性酶在載體序列內切割至少一次。如果所選擇的酶在載體序列內切割兩次,除了可以使用適當的探針檢測的具有新長度的兩個片段以外,還形成具有已知(即,可預測的)大小的條帶。
本文所述的非人轉基因動物的克隆還可以根據在如下中描述的方法制造:Wilmut等,Nature 385:810-813(1997);以及PCT國際公開號WO97/07668和WO 97/07669。舉例來說,來自轉基因動物的細胞(例如,體細胞)可以被分離和誘導以退出生長周期并進入G0期。然后,靜止細胞可以例如通過使用電脈沖被融合至來自分離出該靜止細胞的同一物種動物的去核卵母細胞。然后培養重構建的卵母細胞,以使該卵母細胞發育為桑椹胚或囊胚,然后轉移至假孕雌性飼養動物。該雌性飼養動物生育的后代是轉基因動物的克隆,細胞(例如體細胞)由該克隆分離。
制備轉基因動物的另外的方法被公開于例如:美國專利號5,633,076或6,080,912;以及國際專利公開WO 97/47739、WO 99/37143、WO 00/75300、WO 00/56932和WO 00/08132,以引用的方式將其公開內容整體并入本文。
在一個相關的方面,表達fat-2或fat-1相關的轉基因的非人轉基因動物可以是用于建立表達fat-2或fat-1相關的轉基因的細胞系的細胞的來源。例如,細胞系可以來源自表達同源、異源fat-2或fat-1相關的轉基因的小鼠。
本文所述的轉基因動物除了存在fat-2或fat-1相關的轉基因以外,可以具有其它的基因改變。例如,宿主的基因組可以被改變以影響編碼疾病相關基因或治療基因(包括標記基因)的內源基因的功能或者與所期望的應用一致的其它的基因改變。例如,雖然不需要本文所述的各方面的可操作性,本文所述的轉基因動物可具有除了fat-2和/或fat-1基因以外的內源基因(或者fat-2和/或fat-1基因)的改變,基因改變如上所述。
本文所述的轉基因動物的克隆還可以根據在如下中描述方法制造:Wilmut,I.等Nature 385:810-813(1997)和PCT國際公開號WO 97/07668和WO 97/07669。總之,來自轉基因動物的細胞(例如,體細胞)可以被分離和誘導以退出生長周期并進入G0期。然后,靜止細胞可以例如通過使用電脈沖被融合至來自分離出該靜止細胞的同一物種動物的去核卵母細胞。然后,培養重構建的卵母細胞,以使卵母細胞發育為桑椹胚和囊胚,然后轉移至假孕雌性飼養動物。這種雌性飼養動物生育的后代是轉基因動物的克隆,細胞(例如體細胞)由該克隆分離。
另一方面提供了分離自本文所述的轉基因動物的細胞群。例如,可將本文所述的轉基因動物用作細胞培養的細胞的來源。
用于制造本文所述的轉基因動物的轉基因構建體
在一個方面,本文提供的是含有可操作地連接至啟動子的第一外源和/或異源核酸分子的轉基因構建體,其中,第一外源和/或異源核酸分子含有編碼δ12脂肪酸去飽和酶(例如,fat-2)的核苷酸序列、或其生物活性變體的核苷酸序列,其中,該核苷酸序列并不對應于秀麗隱桿線蟲的野生型fat-2基因,并且其中,當將轉基因構建體導入細胞中時,啟動子指導動物細胞中的第一外源和/或異源核酸分子的表達。例如,可以通過顯微注射將轉基因構建體導入細胞中。
在一些實施方式中,第一外源和/或異源核酸分子可以包含:(i)SEQ ID NO.1的核苷酸序列;或(ii)作為SEQ ID NO.1的生物活性變體且與SEQ ID NO.1具有至少約70%或更多的一致性(包括例如,至少約80%、至少約90%、至少約95%或更多)的核苷酸序列。
在一些實施方式中,轉基因構建體可以進一步包含第二外源和/或異源核酸分子,第二外源和/或異源核酸分子含有編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列。在一些實施方式中,編碼將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核苷酸序列可以是編碼n-3脂肪酸去飽和酶的核苷酸序列或其生物活性變體的核苷酸序列,其中,核苷酸序列并不對應于秀麗隱桿線蟲的野生型fat-1基因。
在一些實施方式中,第二外源和/或異源核酸分子可以包含:(i)SEQ ID NO.2的核苷酸序列;或(ii)作為SEQ ID NO.2的生物活性變體且與SEQ ID NO.2具有至少約70%或更多的一致性(包括例如,至少約80%、至少約90%、至少約95%或更多)的核苷酸序列。
在第二外源和/或異源核酸分子存在于本文所述的轉基因構建體的一些實施方式中,第二外源和/或異源核酸分子能夠可操作地連接至相同的啟動子或不同的啟動子,其中,當將轉基因構建體導入細胞中時,所述的相同的啟動子或不同的啟動子指導轉基因動物細胞中的第二外源和/或異源核酸的表達。動物細胞的實例包括但不限于衍生自本文所述的任何動物的細胞,所述動物例如但不限于:奶牛、小鼠、大鼠、豬、綿羊、山羊、兔、水牛、魚、家禽、牲畜或家畜。
在一些實施方式中,轉基因構建體可以包含載體(例如,表達載體)。在一些實施方式中,載體可以是腺病毒載體。可以作為表達構建體使用的其它病毒載體包括衍生自如下病毒的載體,所述病毒例如:痘苗病毒(例如,痘病毒或修飾型痘苗病毒安卡拉株(MVA))、腺相關病毒(AAV)或皰疹病毒。這些病毒提供了與動物細胞(包括人細胞)關聯使用的多個引人注目的特性。例如,單純皰疹病毒(例如,HSV-1)可以被選擇用于遞送去飽和酶(例如,fat-1/fat-2或其同源物(或其生物活性變體,包括密碼子經優化的變體))至感興趣的細胞。
逆轉錄病毒、脂質體和質粒載體也是本領域公知的,并且也可以用于遞送編碼fat-2和/或fat-1的序列至細胞(例如,當希望融合編碼去飽和酶(例如,fat-1和/或fat-2)的序列至LacZ基因時,可以使用表達載體pUR278;LacZ編碼可檢測的標記物β-半乳糖苷酶(參見例如,Ruther等,EMBOJ.2:1791,1983))。
注意到的是,編碼去飽和酶的序列(例如fat-1和/或fat-2序列)或其生物活性變體(包括密碼子經優化的序列)也可以被融合至其它類型的異源序列,例如編碼另一治療基因的序列,或者當表達時提高融合蛋白的數量或質量(例如,溶解度或循環半衰期)的序列。例如,pGEX載體可以用來表達融合至谷胱甘肽S-轉移酶(GST)的去飽和酶。一般來說,這種融合蛋白是可溶的,并且可以通過吸附至谷胱甘肽瓊脂糖珠并隨后在游離谷胱甘肽的存在下洗脫而很容易地從裂解細胞純化。pGEX載體(Pharmacia Biotech公司;Smith和Johnson,Gene 67:31-40,1988)被設計為包含凝血酶或Xa因子蛋白酶切割位點,以使經克隆的目標基因產物可從GST部分釋放。其它的融合成員包括白蛋白和免疫球蛋白分子(例如,IgG、IgA、IgM或IgE)的區(例如,有或沒有鉸鏈區的Fc區)。其它有用的載體包括將麥芽糖E結合蛋白和蛋白A分別融合至n-3去飽和酶的pMAL(New England Biolabs,Beverly,MA)和pRIT5(Pharmacia,Piscataway,NJ)。
轉基因的表達可以由附加體系統充分延長,以使得不需要重新給予具有其轉基因的任何給定的表達載體。
或者,載體可以被設計為優選在特定位點的位置促進整合入宿主基因組中,這將有助于確保轉基因不會在細胞的生命期內丟失。無論以什么方式遞送,由宿主細胞施加的轉錄調控將促進組織特異性和調節轉基因表達。
因此,本文所述的核酸分子可以包含促進去飽和酶編碼序列整合入宿主基因組中。
取決于例如待轉化的宿主細胞的類型以及期望的蛋白質表達的水平,可對表達載體進行選擇或設計。例如,當宿主細胞是哺乳動物細胞時,表達載體可以包含病毒調控元件,如衍生自如下的啟動子:多瘤病毒、腺病毒2、巨細胞病毒和猿猴病毒40。這些調控元件也可用于非哺乳動物(例如,鳥或魚)細胞。所插入的核酸(即,待表達的序列;此處指去飽和酶,例如fat-1和/或fat-2)也可以被修飾以編碼在大腸桿菌中被優先使用的殘基(Wada等,Nucleic Acids Res.20:2111-2118,1992)。類似地,如果必要或期望的話,可以在除大腸桿菌(E.coli.)以外的生物中優先修飾密碼子。這樣的修飾(例如,摻入各種調控元件和密碼子優化)可以通過標準的重組技術實現。更普遍的是,表達載體可以被設計成在原核或真核細胞中表達蛋白質。例如,多肽可以在細菌細胞(例如,大腸桿菌)、真菌、酵母或昆蟲細胞中表達(例如,使用桿狀病毒表達載體)。例如,可將桿狀病毒(例如生長在草地貪夜蛾細胞中的苜蓿銀紋夜蛾核型多角體病毒(AcNPV))用作載體以表達fat-1和/或fat-2基因。而本發明并不限于此,當表達的主要目的是制造和純化n-3去飽和酶時,大腸桿菌、酵母和昆蟲細胞可以作為宿主細胞。如本文所指出的,本發明還涵蓋了在高等細胞中的n-3去飽和酶的表達,包括在廣泛范圍的不同類型的轉基因動物中的n-3去飽和酶的表達。
如上所述,當宿主細胞從多細胞動物獲得,或者宿主細胞是多細胞動物內的細胞時,用于表達去飽和酶的表達載體和核酸(例如,fat-1和/或fat-2核酸序列)還可以包含組織特異性啟動子。這樣的啟動子是本領域已知的,并且包括但不限于:肝特異性啟動子(例如,白蛋白;Miyatake等,J.Virol.71:5124-5132,1997)、肌肉特異性啟動子(例如,肌球蛋白輕鏈1(Shi等,Hum.Gene Ther.8:403-410,1997)或α-肌動蛋白)、胰腺特異啟動子(例如,胰島素或胰高血糖素啟動子)、神經特異性啟動子(例如,酪氨酸羥化酶啟動子或神經元特異性烯醇化酶啟動子)、內皮細胞特異性啟動子(例如,von Willebrandt;Ozaki等,Hum Gene Ther.7:1483-1490,1996)和平滑肌細胞特異性啟動子(例如,22a)。腫瘤特異性啟動子也被用于開發癌癥療法,包括用于B16黑色素瘤的酪氨酸激酶特異性啟動子(Diaz等,J.Virol.72:789-795,1998)、用于特定的乳腺癌的DF3/MUC1(Wen等,Cancer Res.53:641-651,1993;對于乳腺癌,還可以使用人芳香酶細胞色素p450(p450arom)的脂肪特異性啟動子區域(參見美國專利號5,446,143;Mahendroo等,J.Biol.Chem.268:19463-19470,1993;以及Simpson等,Clin.Chem.39:317-324,1993)。甲胎蛋白啟動子可用于引導肝癌中的表達(Chen等,Cancer Res.55:5283-5287,1995)。當組織特異性表達不需要或不期望時,去飽和酶(例如,fat-1和/或fat-2)編碼序列可以被置于組成型激活的啟動子(例如,β-肌動蛋白啟動子)的控制之下(例如,操作性地連接至該啟動子)。其它的組成型激活的啟動子在本領域已知并使用。
載體和其它核酸分子(例如,fat-1和/或fat-2cDNA本身)還可以包含限制轉基因的時序表達的序列。例如,通過例如在啟動子中包含cAMP應答元件(CRE)增強子并且用cAMP調節藥物處理被轉染或被感染的細胞(Suzuki等,Hum.Gene Ther.7:1883-1893,1996),轉基因可以通過可藥物誘導的啟動子控制。或者,阻遏子元件可以在藥物存在的情況下阻止轉錄(Hu等,Cancer Res.57:3339-3343,1997)。表達的空間調控也已經利用與ergl基因啟動子結合的電離輻射(放療)實現。本文還提供了包含這樣的調控序列的構建體。
本文所述的包含核酸分子的宿主細胞(包含表達載體)也在本文所述的各方面的范圍內。細胞可以是原核細胞或真核細胞。合適的原核細胞包括細菌細胞,而合適的真核細胞包括哺乳動物的細胞、鳥類的細胞和魚類的細胞。細胞系(包括已建立并保藏在公共的保藏機構中的細胞系)也可用作宿主細胞。可以使用這些細胞中的任何一種,尤其是在優化核酸序列的過程中。細胞可以被認為是健康的或患病的(例如,細胞可以被炎癥感染或可以是以不期望(例如,不期望地高)的速率轉化和/或增殖)。
δ12脂肪酸去飽和酶和/或n-3脂肪酸去飽和酶轉基因:“δ12脂肪酸去飽和酶轉基因”是指編碼將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸的酶的核酸或者其生物活性變體或片段。δ12脂肪酸去飽和酶轉基因可以是例如編碼功能酶或功能活性片段或酶的功能性衍生物的cDNA、mRNA、RNA、基因組DNA的一部分或其片段。示例性的δ12脂肪酸去飽和酶可以是全長fat-2轉基因或其功能活性片段或其功能性衍生物。
本文所使用的術語“n-3脂肪酸去飽和酶轉基因”是指編碼可以將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的酶的核酸、或如本文所定義的其生物活性變體。n-3脂肪酸去飽和酶轉基因可以是例如編碼功能酶或功能活性片段或酶的功能性衍生物的cDNA、mRNA、RNA、基因組DNA的一部分或片段。示例性的n-3脂肪酸去飽和酶可以是全長fat-1基因或其功能活性片段或其功能性衍生物。
術語“功能性衍生物”是指具有與全長(野生型)多肽相關的一個或多個功能(例如,制造必需脂肪酸的酶活性)的片段、同系物、衍生物或類似物。在一些實施方式中,δ12脂肪酸去飽和酶的功能性衍生物是全長(野生型)酶的片段、同系物、衍生物或類似物,以使功能性衍生物可以將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸。在一些實施方式中,n-3脂肪酸去飽和酶的功能衍生物是全長(野生型)酶的片段、同系物、衍生物或類似物,以使功能性衍生物可以將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸。
在一些實施方式中,δ12脂肪酸去飽和酶和/或n-3脂肪酸去飽和酶轉基因可以是來自在不同物種的宿主中表達的一個物種的同種異源轉基因。例如,同種異源fat-2或fat-1轉基因是指來自另一物種的相應基因;因此,如果鼠類是待進行轉基因的宿主,來自秀麗隱桿線蟲的fat-1基因或fat-2基因是同種異源基因。在一些實施方式中,δ12脂肪酸去飽和酶和/或n-3脂肪酸去飽和酶轉基因可以衍生自與轉基因動物相同的物種(例如,在魚中過表達的魚fat-2或fat-1相關的轉基因)。
含有編碼同種異源蛋白序列的各種基因片段的轉基因可以例如通過雜交或DNA測序很容易地被鑒別為來自轉基因動物以外的生物物種。在一些實施方式中,同種fat-2或fat-1相關的轉基因與秀麗隱桿線蟲fat-2或fat-1相關的轉基因具有至少75%、至少80%、至少85%、至少90或至少95%的一致性。本文在兩個或多個核酸或多肽序列的語境下所使用的術語“一致性”或“一致性百分比”是指使用下述的序列比較算法中的一種或通過目視檢查所測定的,當對最大對應進行比較和比對時的兩個或多個序列或者子序列相同或具有指定百分比的相同的核苷酸或氨基酸殘基。在兩個核酸或多肽的語境下所使用的短語“基本上一致”是指使用下述的序列比較算法中的一種或通過目視檢查所測定的,當對最大對應進行比較和比對時,兩個或多個序列或者子序列具有至少60%、通常80%、最常見90%-95%的核苷酸或氨基酸殘基一致性。兩個多肽序列是“基本上一致”的指征是一個多肽與針對第二多肽產生的抗體在免疫學上反應。
在一些實施方式中,fat-2或fat-1相關的酶與秀麗隱桿線蟲fat-2或fat-1相關的酶具有至少75%、至少80%、至少85%、至少90%或至少95%的相似性。本文在兩個或多個多肽序列的語境下所使用的術語“相似性”或“相似性百分比”是指使用下述的序列比較算法中的一種或通過目視檢查所測定的,當對最大對應進行比較和比對時,兩個或多個序列或者子序列相同或者具有指定百分比的相同的氨基酸殘基或其保守取代。舉例來說,當將對與第一序列所含數量相同數量的氨基酸進行比較或者當與已通過使用如下文所討論的本領域已知的計算機相似性程序進行比對的多肽比對物進行比較時,當第一氨基酸序列與第二氨基酸序列具有至少50%、60%、70%、75%、80%、90%或甚至95%一致性或相對于第二氨基酸序列保守取代至少50%、60%、70%、75%、80%、90%或甚至95%時,第一氨基酸序列可以被認為類似于第二氨基酸序列。
在多肽序列的語境下,術語“基本相似”是指在大約10-20個氨基酸殘基的比較窗口中,多肽含有與參比序列具有至少60%的序列一致性(或與參比序列具有70%或80%或85%的序列一致性、或最優選具有90%的一致性)的序列。在氨基酸序列的語境下,“基本一致”進一步包括氨基酸的保守取代。因此,例如在兩個多肽因一個或多個保守取代而不同的情況下,多肽基本上類似于第二多肽。
當描述多肽時,術語“保守取代”是指不會實質上改變多肽活性的多肽的氨基酸組成方面的變化。因此,特定氨基酸序列的“保守取代”是指對于多肽活性而言不重要的氨基酸的取代或用具有類似性質(例如,酸性、堿性、帶正電或帶負電、極性或非極性等)的其它氨基酸進行的氨基酸的取代,以使甚至關鍵氨基酸的取代也不會實質上改變活性。提供功能上類似的氨基酸的保守取代表是本領域公知的。例如,下述六組各自含有互為保守取代的氨基酸:1)丙氨酸(A)、絲氨酸(S)、蘇氨酸(T);2)天冬氨酸(D)、谷氨酸(E);3)天冬酰胺(N)、谷氨酰胺(Q);4)精氨酸(R)、賴氨酸(K);5)異亮氨酸(I)、亮氨酸(L)、甲硫氨酸(M)、纈氨酸(V);以及6)苯丙氨酸(F)、酪氨酸(Y)、色氨酸(W)(還參見Creighton,Proteins,W.H.Freeman and Company(1984))。此外,編碼序列中的改變、插入或刪除單一氨基酸或少量百分比的氨基酸的單個取代、缺失或插入也是“保守取代”。
對于序列比較,通常使一個序列充當參比序列,測試序列針對該序列進行比較。當使用序列比對算法時,測試序列和參比序列被輸入計算機中,如果有必要,子序列坐標被指定,并且序列算法程序參數被指定。然后基于指定的程序參數,序列比對算法計算出測試序列相對于參比序列的序列一致性百分比。
用于比較的序列的最佳比對可以通過如下施行:例如,通過Smith和Waterman的局部同源性算法(local homology algorithm)(Adv.Appl.Math.2:482(1981),以引用的方式并入本文);通過Needleman和Wunsch的同源性比對算法(J.Mol.Biol.48:443-53(1970),以引用的方式并入本文);通過Pearson和Lipman的相似性搜索方法(search for similarity method)(Proc.Natl.Acad.Sci.USA 85:2444-48(1988),以引用的方式并入本文);通過這些算法的計算機化實施(例如,Wisconsin Genetics Software Package中的GAP、BESTFIT、FASTA和TFASTA,Genetics Computer Group,575Science Dr.,Madison,Wis.);或者通過目視檢查(通常參見Ausubel等(eds.),Current Protocols in Molecular Biology,4th ed.,John Wiley and Sons,New York(1999))。
有用的算法的一個實例是PILEUP。PILEUP采用漸進的成對的比對由成組的相關序列創建多序列比對,以示出序列一致性百分比。PILEUP還繪制了顯示出用于創建比對的聚類關系的樹或樹形圖。PILEUP使用Feng和Doolittle(J.Mol.Evol.25:351-60(1987),以引用的方式并入本文)的簡化的漸進比對方法。所使用的方法類似于Higgins和Sharp(Comput.Appl.Biosci.5:151-53(1989),以引用的方式并入本文)描述的方法。該程序可以比對多至300個序列,各序列具有最大長度為5,000個核苷酸或氨基酸。多重比對過程起始于兩個最相似序列的成對比對,制造兩個經比對的序列的聚類。然后,該聚類與下一個最相關的序列或經比對的序列的聚類進行比對。序列的兩個聚類通過兩個單獨序列的成對比對的簡單擴展進行比對。最終的比對通過一系列的漸進的成對比對來實現。該程序通過指定序列比較區域的特定序列以及它們的氨基酸或核苷酸的坐標以及通過指定程序參數來運行。例如,可以將參比序列與其它的測試序列進行比較,以使用下列參數確定序列一致性百分比的關系:默認的空位權重(3.00)、默認的空位長度權重(0.10)和加權末端缺口。
適用于確定序列一致性百分比和序列相似性百分比的算法的另一實例是BLAST算法,該算法描述于Altschul等(J.Mol.Biol.215:403-410(1990),以引用的方式并入本文)(還參見Zhang等,Nucleic Acid Res.26:3986-90(1998);Altschul等,Nucleic Acid Res.25:3389-402(1997),以引用的方式并入本文)。用于執行BLAST分析的軟件是通過美國國家生物技術信息中心的互聯網網站公眾可得的。該算法涉及通過識別查詢序列中的長度W的短字串來首先識別高得分序列對(HSPs),當與數據庫序列中的相同長度的字串比對時,該高得分序列對匹配或滿足一些正值的閾值得分T。T被稱為鄰域字串得分閾值(neighborhood word score threshold)(Altschul等(1990),同前)。這些初始鄰域字串采樣數(hits)作為種子用于起始搜索以發現含有它們的較長HSPs。然后字串采樣數在兩個方向上沿各序列延伸,直至累積比對得分可被增加。在下述情況下,字串采樣數在各方向的延伸停止:累積比對得分由它達到的最大值下降數量X;由于一個或多個負得分余數比對(negative-scoring residue alignments)的積累,累積得分變為零或零以下;或者達到任一序列的末端。BLAST算法參數W、T和X決定比對的靈敏度和速度。BLAST程序使用下述缺省值:字串長(W)為11,BLOSUM62得分矩陣(參見Henikoff和Henikoff,Proc.Natl.Acad.Sci.USA 89:10915-9(1992),以引用的方式并入本文)比對(B)為50,期望值(E)為10,M=5,N=-4和雙鏈比較。
除了計算序列一致性百分比,BLAST算法還執行兩個序列之間的相似性的統計分析(參見例如,Karlin和Altschul,Proc.Natl.Acad.Sci.USA90:5873-77(1993),以引用的方式并入本文)。由BLAST算法提供的相似性的一個度量是最小概率和(P(N)),它提供了兩個核苷酸序列或兩個氨基酸序列之間的匹配隨機發生的概率的指示。例如,如果測試核酸與參比核酸的比較中的最小和概率小于約0.1、更典型地小于約0.01、且最典型地小于約0.001,則該核酸被認為類似于參比序列。
在一些實施方式中,fat-2或fat-1相關的轉基因由包含轉錄單位的表達構建體表達。“轉錄單位”是指如下多核苷酸序列,該多核苷酸序列包含:fat-2或fat-1相關的轉基因(例如,結構基因(外顯子))或其功能活性片段的、結構序列的有效轉錄所必需的順式作用連接的啟動子和其它順式作用序列、結構序列的適當的組織特異性轉錄和發育的轉錄所必需的遠端調控元件(視情況而定)以及用于有效的轉錄和翻譯的額外的順式序列(例如,多聚腺苷酸化位點、mRNA穩定性調控序列等)。表達載體中有用的調控序列或其它序列可以形成轉基因序列的一部分。如果沒有已經包含在內的話,這包含內含子序列和多聚腺苷酸化信號。啟動子和其它順式作用序列可操作地連接至結構基因。
在一些實施方式中,啟動子是組織特異性啟動子,例如,肌肉特異性啟動子、骨骼特異性的啟動子或器官特異性啟動子。示例性的肌肉特異性啟動子例如但不限于:心肌特異性的α-肌球蛋白重鏈、在骨骼肌中激活的肌球蛋白輕鏈2基因調控區(Shani,Nature 314:283-86(1985));以及在下丘腦激活的促性腺激素釋放激素基因調控區(Mason等,Science234:1372-78(1986))。在示例性的實施方式中,啟動子是在骨骼肌細胞中表達的MKC啟動子。在另一實施方式中,肌肉啟動子是平滑肌啟動子,例如但不限于SM22a,它指導血管平滑肌細胞中的表達。
在一些實施方式中,肌肉特異性啟動子是誘導型肌肉特異性啟動子。例如,δ12脂肪酸去飽和酶(例如,fat-2)和/或n-3脂肪酸去飽和酶(例如,fat-1)轉基因能夠可操作地連接至提供可操作性地連接的核酸的受調控表達或條件性表達(例如,組織特異性表達或誘導型表達)的一個或多個調控元件。本領域技術人員可以很容易地確定使期望組織中的轉基因能夠進行表達的適當的組織特異性啟動子或增強子。還可將各種誘導型啟動子或增強子的任一種包含于用于轉基因的可調控表達的載體中。“誘導型”啟動子是使基因表達能夠可控和細致調節的系統。參見,Miller和Whelan,Human Gene Therapy,8:803-815(1997)。本文所使用的短語“誘導型啟動子”或“誘導型系統”包括可以使用外部遞送的試劑來調節啟動子活性的系統。
這些系統包括例如:使用來自大腸桿菌的lac阻遏子作為轉錄調節器以調節來自荷載lac操縱子的哺乳動物細胞啟動子的轉錄的系統(Brown等Cell,49:603-612,1987);使用四環素阻遏子(tetR)的系統(Gossen和Bujard,Proc.Natl.Acad.Sci.USA 89:5547-5551,1992;Yao等,Human Gene Ther.9:1939-1950,1998;Shokelt等,Proc.Natl.Acad.Sci.USA92:6522-6526,1995)。其它的這樣的系統包括例如但不限于:FK506二聚體、使用castradiol的VP16或p65、RU486/米非司酮、二酚米樂甾酮或雷帕霉素(參見,Miller和Whelan,同上,圖2)。另一實例是蛻皮激素誘導型系統(參見例如,Karns等,MBC Biotechnology 1:11,2001)。誘導型系統可以由例如Invitrogen、Clontech和Ariad提供。優選與操縱子一起使用阻遏子的系統。
在沒有適當的刺激的情況下,一些誘導型啟動子引起幾乎沒有或檢測不到的表達水平(或沒有表達)。在沒有刺激的情況下,其它的誘導型啟動子引起可檢測的組成型表達。無論在沒有刺激的情況下的表達水平如何,在正確的刺激的存在下,來自任何誘導型啟動子的表達增加。這樣的誘導型系統包括例如:四環素誘導型系統(Gossen&Bizard,Proc.Natl.Acad.Sci.USA,89:5547-5551(1992);Gossen等,Science,268:1766-1769(1995);Clontech,Palo Alto,Calif.);由重金屬誘導的金屬硫蛋白啟動子;響應于蛻皮激素或相關激素如米樂甾酮的昆蟲甾體激素(No等,Proc.Natl.Acad.Sci.USA,93:3346-3351(1996);Yao等,Nature,366:476-479(1993);Invitrogen,Carlsbad,Calif.);由甾體例如糖皮質激素(glucocortocoid)和雌激素誘導的小鼠乳腺瘤病毒(MMTV)(Lee等,Nature,294:228-232(1981));以及由溫度變化誘導的熱休克啟動子。其它的實例系統包括可由經修飾的腺病毒載體中的抗孕激素例如米非司酮誘導的Gal4融合物(Burien等,Proc.Natl.Acad.Sci.USA,96:355-360(1999)。另一這樣的誘導型系統利用藥物雷帕霉素以誘導腺相關病毒載體中的含有FKBP12和FRAP的雷帕霉素結合結構域的轉錄激活因子的重組(Ye等,Science,283:88-91(1999))。其它的誘導型系統是本領域技術人員已知的,并且可以用于本文所述的方法中。
受調控的表達系統的另一實例是噬菌體P1的cre/loxP重組酶系統。對于cre/loxP重組酶系統的描述,參見例如,Lakso等PNAS 89:6232-6236(1992)。重組酶系統的另一實例是釀酒酵母(S.cerevisiae)的FLP重組酶系統(O'Gorman等Science 251:1351-1355(1991)。如果cre/loxP重組酶系統被用來調節轉基因的表達,需要含有編碼Cre重組酶和所選擇的蛋白質的轉基因的動物。這樣的動物可以通過構建“雙”轉基因動物(例如通過交配兩個轉基因動物,一個含有編碼所選擇的蛋白質的轉基因,另一個含有編碼重組酶的轉基因)來提供。
人們可以改造這些“誘導”系統,以使組成型激活的同種型的脂肪酸去飽和酶(例如,fat-2或fat-1相關的酶)通過加入外部試劑進行調節,但僅在特定的組織中表達。在本文中,這樣的啟動子系統被稱為“誘導型組織特異性啟動子”。因此,在一些實施方式中,脂肪酸去飽和酶轉基因(例如,fat-2和/或fat-1相關的轉基因)操作性地連接至在組織中調節轉基因表達的誘導型啟動子。這樣的系統可以被包含在可以被操作性地連接的一個或多個外源和/或異源DNA或轉基因。
在一個實施方式中,調控元件例如轉錄調控元件或增強子可以被包含于轉基因中。在一個實施方式中,“轉錄調控元件(transcriptional regulatory element)”或“TRE”被引入用于感興趣的基因的調控。如本文所使用的,TRE是多核苷酸序列,優選DNA序列,該序列調節(即,控制)通過RNA聚合酶的可操作地連接的多核苷酸序列的轉錄以形成RNA。如本文所使用的,在使TRE能夠發揮功能的宿主細胞中,TRE增加了可操作地連接的多核苷酸序列的轉錄。TRE包含可能或可能并非衍生自相同基因的增強子元件和/或pox啟動子元件。TRE的啟動子和增強子組件可以在感興趣的編碼序列的任何方向和/或距離處,并且包括上述的多聚體。如本文所討論的,TRE可以或可以不缺少沉默子元件。
在一些實施方式中,用于調節感興趣的基因的“增強子”可以被包含于本文所述的轉基因構建體中。增強子是本領域公知的術語,并且是衍生自增高可操作地連接至啟動子的基因的轉錄至如下程度的基因的多核苷酸序列,當可操作地連接至該基因時,增高程度大于受啟動子自身影響的轉錄激活,即,增高來自啟動子的轉錄。具有“增強子活性”是本領域公知的術語,并且其含義已經陳述,即,當增強子可操作地連接至基因時,增強子增高可操作地連接至啟動子的基因的轉錄至如下程度,該增高程度大于受啟動子自身影響的轉錄增高,即,增強子增高來自啟動子的轉錄。
調控元件例如TRE或增強子的活性一般取決于轉錄調控因子的存在和/或轉錄調控抑制因子的缺失。轉錄激活可以通過本領域已知的一些方法(并在下文中更詳細地描述)進行測量,但通常是通過檢測和/或量化在調控元件控制(即、可操作地連接至調控元件)下的編碼序列的mRNA或蛋白質產物來進行測量。正如本文所討論的,調控元件可以具有不同的長度和不同的序列組成。通過轉錄激活,預期轉錄可以高于靶細胞中的基礎水平而增加至少約2倍、優選至少約5倍、優選至少約10倍、更優選至少約20倍、更優選至少約50倍、更優選至少約100倍、甚至更優選至少約200倍、甚至更優選至少約400至約500倍、甚至更優選至少約1000倍。基礎水平一般是非靶細胞(如果有活性的話)中的活性的水平,或者如在靶細胞類型中所測試的缺少感興趣的TRE的報告子構建體的活性水平(如果有的話)。
轉基因還可以包含報告子基因,例如,報告子基因包括:β-半乳糖苷酶、熒光素酶、綠色熒光蛋白(GFP),氯霉素乙酰轉移酶(CAT)、堿性磷酸酶、辣根過氧化物酶等。在一個實施方式中,報告子基因被融合至fat-2或fat-1相關的基因。
在表達載體中有用的調控序列或其它序列可以形成轉基因序列的一部分。這包括但不限于(如果沒有已經包括的話):內含子序列、轉錄終止信號和多聚腺苷酸化信號。條件型調控序列能夠可操作地連接至轉基因以指導轉基因對特定細胞的表達。
非人轉基因動物或者由其衍生的細胞或組織的用途
因此,本文所提供的另一方面涉及由本文所述的非人轉基因動物的一個或多個實施方式獲得、衍生或加工的食物或食物產品,其中,非人轉基因動物攜帶將飽和脂肪和/或碳水化合物轉化為n-6脂肪酸的第一異源基因以及將至少一種n-6脂肪酸轉化為一種或多種n-3脂肪酸的第二異源基因。在一個實施方式中,第一異源基因可以含有fat-2基因。在一個實施方式中,第二異源基因可以含有fat-1基因。食物產品可以包括:肉、奶、蛋、組織、肌腱、油、乳制品(例如,奶酪)和它們的任何組合。在一些實施方式中,本文所述的食物產品中的n-6脂肪酸與ω-3脂肪酸的比值可以是約1:1或更低。
本文還提供了包含這些非人轉基因動物或者其組織或經加工部分的食物產品或膳食補充劑。食物產品可是非加工的(例如,在整個動物、或動物的整個部分(例如,關節、指節或器官)的情況下)或加工自經屠宰的動物或其部分(例如,由動物獲得的骨骼、脂肪、皮或油)。膳食補充劑的制備方法(例如,魚油膠囊)是本領域已知的,并可以被應用至本文所述的基因學上修飾的動物或轉基因動物,以制造膳食補充劑。因此,本文還描述了由本文所述的動物(例如,轉基因哺乳動物、鳥或魚)制造食物產品或膳食補充劑的方法。這些方法能夠以任何方式進行,包括任何目前已知的過程,并且來源是或包括如本文所述制造的非人轉基因動物(或其部分)。
正如所指出的,本文所述的核酸分子和/或轉基因構建體(包括其中的密碼子的使用已針對宿主進行了優化的核酸分子和/或轉基因構建體)可以用于制造非人轉基因動物。不希望受到限制,本文所述的核酸和/或轉基因構建體可以被用于對被養殖或者認為是食物來源的動物進行基因學上的修飾。轉基因動物可以使用本領域已知的技術制造。更具體地說,可以使用本文所述的方法來制造哺乳動物和魚。
在一些實施方式中,食物或食物產品(包括例如,膳食補充劑)可以衍生自轉基因魚或轉基因鳥,轉基因魚或轉基因鳥在基因學上修飾以表達編碼δ12脂肪酸去飽和酶(例如,fat-2)和n-3脂肪酸去飽和酶(例如,fat-1)或它們的生物活性變體的異源核酸序列。轉基因魚可以包括但不限于:鱈魚或鱈形目鱈魚科的任何魚;比目魚;鯡魚或鯡形目的任何魚;鯖魚或鯖科的任何魚;鮭魚或鮭科的任何魚,包括鱒魚;鱸魚或鱸科的任何魚;鰣魚或鯡科的任何魚;鰩魚或鰩科的任何魚;胡瓜魚或胡瓜魚科的任何魚;鰨魚或鰨科的任何魚;金槍魚或鯖科的任何魚;以及上文所述和本領域技術人員已知的其它魚,例如,斑馬魚。
獲得或衍生自本文所述的非人轉基因動物(例如,本文所述的攜帶fat-2和fat-1基因的非人轉基因動物)的食物或食物產品(包括例如,膳食補充劑)可以提供給健康個體或患有缺乏必須脂肪酸(例如,n-3脂肪酸)的個體。與缺乏n-3脂肪酸相關的疾病或失調是本領域已知的,包括例如:肥胖、糖尿病、癌癥、心臟疾病、炎癥性疾病、神經退行性疾病、神經精神疾病、骨關節炎、狼瘡、非酒精性脂肪肝疾病、結腸炎和它們的任意組合。因此,本文還提供了治療與缺乏n-3脂肪酸相關的病癥(例如,疾病或失調)的方法。通過向被診斷為患有缺乏n-3脂肪酸相關的病癥(例如,疾病或失調)或具有缺乏n-3脂肪酸相關的病癥的風險的受試者給予獲得或衍生自本文所述的非人轉基因動物(例如,攜帶fat-2和fat-1基因的非人轉基因動物)的食物或食物產品,與未給予本文所述的食物或食物產品的缺乏n-3脂肪酸的受試者相比,經治療的受試者的n-3脂肪酸含量可以增加例如至少約30%或以上,包括例如至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或以上。在一些實施方式中,與未給予本文所述的食物或食物產品的缺乏n-3脂肪酸的受試者相比,經治療的受試者中的n-3脂肪酸含量可以增加例如至少約1.1倍或以上,包括例如至少約1.5倍、至少約2倍、至少約3倍、至少約4倍、至少約5倍、至少約6倍、至少約7倍、至少約8倍、至少約9倍、至少10倍或以上。
在一些實施方式中,與未給予本文所述的食物或食物產品的缺乏n-3脂肪酸的受試者相比,經治療的受試者中的n-6脂肪酸與n-3脂肪酸的比值可以降低例如至少約10%或以上,包括例如至少約20%、至少約30%、至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或以上。
受試者可以是明顯健康的或者可以是已被診斷為患有下述疾病或失調、或具有下述疾病或失調的風險的受試者,例如患有癌癥(例如,乳腺癌、結腸癌、前列腺癌、肝癌、宮頸癌、肺癌、腦癌、皮膚癌、胃癌、頭頸癌、胰腺癌、血癌或卵巢癌)。因此,受試者可以是被診斷為患有神經退行性疾病(例如,阿爾茨海默病、帕金森病或亨丁頓舞蹈癥)的受試者。其它可治療或可預防的病癥包括心律失常、心血管疾病、癌癥、炎癥性疾病、自身免疫疾病、視網膜和大腦先兆畸形或畸形、糖尿病、肥胖、皮膚失調、腎臟疾病、潰瘍性結腸炎、克羅恩病、慢性阻塞性肺病。受試者還可以是已經接受移植物或計劃接受移植物的受試者,所述移植物包括生物器官、組織或細胞。該方法可以通過向受試者或移植物給予本文所述的核酸分子來實施。
本文的另一方面提供了增高動物(例如,非人動物)或由動物衍生的食物產品中的n-3脂肪酸含量的方法。該方法包括用高碳水化合物和/或高飽和脂肪的組合物或飲食飼喂本文所述的將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸和n-3脂肪酸的非人轉基因動物(例如,攜帶本文所述的fat-2和fat-1基因的轉基因動物)。因此,轉基因動物可以將至少一部分(例如,至少約30%或更多,包括例如,至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多、包括高達100%)來自飲食的碳水化合物和/或飽和脂肪轉化為n-3脂肪酸。
本文所使用的術語“高碳水化合物和/或高飽和脂肪的組合物或飲食”是指下述組合物或飲食,其中的至少約50%或更多(包括例如,至少約60%、至少約70%、至少約80%、至少約90%、至少約95%或更多、包括高達100%)的總卡路里是由碳水化合物、飽和脂肪或兩者的組合提供。在一些實施方式中,組合物或飲食可以進一步包含蛋白質、礦物質、維生素、纖維和它們的兩種或多種的組合。在一些實施方式中,高碳水化合物和/或高飽和脂肪的組合物或飲食可以是無脂肪的組合物或飲食。在這些實施方式中,碳水化合物能夠以提供總卡路里的約50%至約90%的量存在。在一些實施方式中,高碳水化合物和/或高飽和脂肪的組合物或飲食可以含有提供總卡路里的約40%-60%的量的碳水化合物,并且含有提供總卡路里的約20%-40%的量的飽和脂肪。
在一些實施方式中,高碳水化合物和/或高飽和脂肪的組合物或飲食可以是低PUFA組合物或飲食。在這些實施方式中,組合物或飲食可以含有提供總卡路里的小于30%或更低的量的PUFA(例如,必需脂肪酸)。在一些實施方式中,PUFAs能夠以一定量存在,所述PUFAs提供總卡路里的小于20%、小于10%、小于5%、小于1%或更低。在一些實施方式中,低PUFA組合物或飲食可以排除任何PUFA和必需脂肪酸。
在一些實施方式中,當用高碳水化合物和/或高飽和脂肪的組合物或飲食飼喂轉基因動物時,轉基因動物或由其衍生的食物產品中的n-6脂肪酸與n-3脂肪酸的比值可以是約1:1或更少,包括例如,約0.75:1或約0.5:1。
在一些實施方式中,n-6脂肪酸的至少一部分(例如,由飲食中的碳水化合物和/或飽和脂肪轉化的n-6脂肪酸、或者直接來自飲食的n-6脂肪酸)并不會轉化為n-3脂肪酸。在一些實施方式中,基本上所有的n-6脂肪酸(例如,由飲食中的碳水化合物和/或飽和脂肪轉化的n-6脂肪酸、或者直接來自飲食的n-6脂肪酸)轉化為n-3脂肪酸。
本文還提供了在與脂肪代謝相關的病癥(例如,疾病或失調)的條件下確定n-6脂肪酸和/或n-3脂肪酸的影響的方法。在一些實施方式中,該方法包括:(a)在本文所述的非人轉基因動物或者本文所述的由其衍生的細胞或組織中誘導與脂肪代謝相關的病癥(例如,疾病或失調)的至少一個表型;(b)用高碳水化合物和/或高飽和脂肪的組合物飼喂非人轉基因動物或者由其衍生的細胞或組織;(c)檢測來自(b)的非人轉基因動物、細胞或組織的響應;以及(d)將非人轉基因動物、細胞或組織的檢測到的響應與對照進行比較,其中,非人轉基因動物、細胞或組織與對照之間的響應方面的不同決定了n-6和/或n-3脂肪酸對病癥的影響。
在一些實施方式中,與脂肪代謝相關的病癥(例如,疾病或失調)的表型可以通過修飾非人轉基因動物或者由其衍生的細胞或組織的基因組中的至少一個基因進行誘導,其中,該基因與病癥相關。基因修飾可以包括例如感興趣的基因的插入、缺失和/或突變。在一些實施方式中,與脂肪代謝相關的病癥(例如,疾病或失調)的表型可以通過將轉基因動物或者由其衍生的細胞或組織暴露至誘導病癥的至少一個表型的試劑進行誘導。誘導病癥的試劑可以是蛋白質、肽、核酸、藥物、小分子、輻射或它們的任意組合。
在用高碳水化合物和/或高飽和脂肪的組合物飼喂本文所述的轉基因動物后,可以進行各種檢測和/或分析以測定本文所述的非人轉基因動物的響應。例如,非人轉基因動物的響應可以包括與基因組學、代謝組學、脂質組學或蛋白質組學相關的分析物的表達水平。
通過將非人轉基因動物的檢測到的響應與對照進行比較,可以確定n-6脂肪酸和/或n-3脂肪酸對所研究的病癥(例如,疾病或失調)的影響。在一些實施方式中,對照可以是未用高碳水化合物和/或高飽和脂肪的組合物飼喂的本文所述的非人轉基因動物或者由其衍生的細胞或組織。在一些實施方式中,對照可以是不能將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸或n-3脂肪酸的非人動物。在一些實施方式中,對照可以是野生型非人動物。
在一些實施方式中,本文所述的轉基因動物(例如,表達fat-2或fat-1相關的轉基因的轉基因動物)可以被培育成具有不同遺傳背景的動物,包括具有下述感興趣的表型的動物,例如:肥胖、糖尿病、血管生成缺陷、心血管缺陷。這種動物是本領域技術人員所已知的,并且例如可見于小鼠基因組數據庫中(Blake JA,Richardson JE,Bult CJ,Kadin JA,Eppig JT,and the members of the Mouse Genome Database Group.2003.MGD:The Mouse Genome Database.Nucleic Acids Res 31:193-195;Eppig JT,.Blake,JA,Burkhart DL,Goldsmith CW,Lutz CM,Smith CL.2002.Corralling conditional mutations:a unified resource for mouse phenotypes.Genesis 32:63-65)或橡樹嶺美國國家實驗室突變小鼠數據庫中。
在可選的實施方式中,本文所述的細胞和/或轉基因動物(例如,表達fat-2或fat-1相關的轉基因的細胞和/或轉基因動物)可用于分析以識別影響脂肪代謝的靶標,該靶標可反過來影響肌肉生長、血管新生、肥胖、胰島素敏感性和/或心血管功能。
一些方面還提供了用于識別與脂肪代謝功能相關的由fat-2或fat-1相關的酶調節的基因和基因產物、蛋白質、蛋白質產物、脂質或代謝物的方法,包括識別mRNAs、功能性RNAs,例如在本文所述的轉基因動物中差異化表達的微小RNAs和/或蛋白質。這種方法是本領域技術人員所已知的,并且可以包括下文所述的方法。
通過本文所述的方法識別的基因和基因產物對進一步表征而言是有用的,以用于檢測經識別的基因和基因產物對脂肪代謝的影響,脂肪代謝可能參與肌肉生長和生物學、以及血管新生、胰島素敏感性和脂肪塊減少/生長。
可將通過本文所述的方法識別的基因用于構建轉基因動物,例如基因敲除動物,例如具有外源和/或異源表達的動物,用于識別肌肉分泌因子或研究肌肉生長、血管新生、肥胖、胰島素敏感性和心血管功能。進一步地,轉基因動物(包括敲除的動物)可被培育成為本文所述的fat-2或fat-1轉基因小鼠。
可對通過本文所述的方法識別的基因的感興趣的特性進行計算或實驗分析。在一個實施方式中,將被識別為與脂肪代謝相關的基因在計算上篩選用于識別出作為分泌因子的基因的特征,即,擁有推定的信號序列并缺乏推定的跨膜結構域。感興趣的任何其它結構域或序列特征(例如,核酸或氨基酸序列)可用于從通過本文所述的方法識別的基因和基因產物中選擇基因和基因產物。
還可以將本文所述的轉基因動物模型和/或細胞(例如,表達fat-2或fat-1相關的轉基因的轉基因動物模型和/或細胞)用于檢測測試化合物(例如,藥物候選物)對測試動物或來自測試動物的樣品或樣本(例如,活檢物)中的參與肌肉發育、肌肉生長、肥胖、胰島素敏感性和心血管功能的脂肪代謝的功效。在某些情況下,有利的是可以測量從測試動物(無需宰殺轉基因動物)獲得的樣品、血液中的肌肉生長、肥胖、胰島素敏感性和心血管功能的標記物。
本文所述的各方面的實施方式可以在以下編號的段落中的任一個加以定義:
1.一種非人轉基因動物,所述非人轉基因動物具有含有可操作地連接至啟動子的第一外源和/或異源核酸分子的基因組,其中,所述第一外源和/或異源核酸分子包含:(i)SEQ ID NO.1的核苷酸序列;或(ii)作為SEQ ID NO.1的生物活性變體且與SEQ ID NO.1具有至少約70%的一致性的核苷酸序列,其中,當在所述轉基因動物中表達所述第一外源和/或異源核酸分子時,所述轉基因動物由飽和脂肪和/或碳水化合物制造n-6脂肪酸。
2.如段落1所述的非人轉基因動物,其中,所述基因組進一步含有第二外源和/或異源核酸分子,所述第二外源和/或異源核酸分子含有編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列,其中,當在所述轉基因動物中表達所述第一外源和/或異源核酸分子以及第二外源和/或異源核酸分子時,所述轉基因動物由飽和脂肪和/或碳水化合物制造n-3脂肪酸和任選的n-6脂肪酸。
3.如段落2所述的非人轉基因動物,其中,編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列的核苷酸序列是:(i)SEQ ID NO.2的核苷酸序列;或(ii)作為SEQ ID NO.2的生物活性變體且與SEQ ID NO.2具有至少約70%的一致性的核苷酸序列。
4.如段落1-3中任一段所述的非人轉基因動物,其中,所述轉基因動物中的n-6脂肪酸與n-3脂肪酸的比值為約1:1或更低。
5.如段落1-4中任一段所述的非人轉基因動物,其中,所述非人轉基因動物選自于由奶牛、小鼠、大鼠、豬、綿羊、山羊、魚、水牛、兔、家禽和牲畜所組成的組。
6.如段落1-5中任一段所述的非人轉基因動物,其中,所述基因組進一步包含與受脂肪代謝影響的病癥相關的基因修飾。
7.如段落6所述的非人轉基因動物,其中,所述基因修飾包括與受脂肪代謝影響的病癥相關的基因的插入、缺失和/或突變。
8.衍生自段落2-5中任一段所述的非人轉基因動物的食物產品。
9.如段落8所述的食物產品,其中,所述食物產品包括肉、奶、蛋、乳制品或它們的任意組合。
10.如段落8或9所述的食物產品,其中,所述食物產品中的n-6脂肪酸與n-3脂肪酸的比值為約1或更少。
11.增高動物或由其衍生的食物產品中的n-3脂肪酸含量的方法,所述方法包括:用高碳水化合物和/或高飽和脂肪的飲食飼喂段落2-7中任一段所述的非人轉基因動物,從而使所述轉基因動物將至少一部分碳水化合物和/或飽和脂肪轉化為n-3脂肪酸。
12.如段落11所述的方法,其中,所述高碳水化合物和/或高飽和脂肪的飲食將必需脂肪酸排除在外。
13.如段落11或12所述的方法,其中,將至少一部分碳水化合物和/或飽和脂肪轉化為n-6脂肪酸。
14.如段落11-13中任一段所述的方法,其中,所述轉基因動物或由其衍生的食物產品中的n-6脂肪酸與n-3脂肪酸的比值為約1或更少。
15.轉基因構建體,所述轉基因構建體包含可操作地連接至啟動子的第一外源和/或異源核酸分子,其中,所述第一外源和/或異源核酸分子包含:(i)SEQ ID NO.1的核苷酸序列;或(ii)作為SEQ ID NO.1的生物活性變體且與SEQ ID NO.1具有至少約70%的一致性的核苷酸序列,并且其中,所述啟動子至少指導動物細胞中的所述第一外源和/或異源核酸分子的表達。
16.如段落15所述的轉基因構建體,所述轉基因構建體進一步包含第二外源和/或異源核酸分子,所述第二外源和/或異源核酸分子含有編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列。
17.如段落16所述的轉基因構建體,其中,編碼將n-6脂肪酸轉化為n-3脂肪酸的酶的核苷酸序列是:(i)SEQ ID NO.2的核苷酸序列;或(ii)作為SEQ ID NO.2的生物活性變體且與SEQ ID NO.2具有至少約70%的一致性的核苷酸序列。
18.如段落16或17所述的轉基因構建體,其中,所述第二外源和/或異源核酸分子可操作地連接至相同的啟動子或不同的啟動子,其中,所述相同的啟動子或不同的啟動子指導轉基因動物細胞中的所述第二外源和/或異源核酸的表達。
19.如段落15-18中任一段所述的轉基因構建體,其中,轉基因動物細胞衍生自如下動物,所述動物選自于由奶牛、小鼠、大鼠、豬、綿羊、山羊、魚、水牛、兔、家禽和牲畜所組成的組。
20.一種治療與缺乏n-3脂肪酸相關的病癥的方法,所述方法包括向被診斷為患有與缺乏n-3脂肪酸相關的病癥或具有與缺乏n-3脂肪酸相關的病癥的風險的受試者給予段落8-10中任一段所述的食物產品,其中,所述食物產品的給予增高了受試者中的n-3脂肪酸的含量,從而治療所述病癥。
21.如段落20所述的方法,其中,所述病癥選自于由如下所組成的組:肥胖、糖尿病、癌癥、心臟疾病、炎癥性疾病、神經退行性疾病、神經精神疾病、骨關節炎、狼瘡、非酒精性脂肪肝疾病、結腸炎和它們的任意組合。
22.確定n-3脂肪酸對與脂肪代謝相關的病癥的影響的方法,所述方法包括:
a.在段落1-7中任一段所述的非人轉基因動物中誘導與脂肪代謝相關的病癥的至少一個表型;
b.用高碳水化合物和/或高飽和脂肪的飲食飼喂所述非人轉基因動物;
c.檢測來自(b)的所述非人轉基因動物的響應;以及
d.將所述非人轉基因動物的檢測到的響應與對照進行比較,
其中,所述非人轉基因動物與對照之間的響應方面的差異決定了n-3脂肪酸對所述病癥的影響。
23.如段落22所述的方法,其中,所述誘導包括對非人轉基因動物的基因組中的至少一個基因進行修飾,其中,所述的至少一個基因與所述病癥相關。
24.如段落23所述的方法,其中,通過插入、缺失和/或突變對所述基因組中的至少一個基因進行修飾。
25.如段落22-24中任一段所述的方法,其中,所述誘導包括向所述非人轉基因動物給予誘導所述病癥的試劑。
26.如段落22-25中任一段所述的方法,其中,所述對照是用低碳水化合物和/或低飽和脂肪的飲食飼喂的同類的非人轉基因動物。
27.如段落22-25中任一段所述的方法,其中,所述對照是不能將碳水化合物和/或飽和脂肪轉化為至少一種或多種n-3脂肪酸的非人動物。
28.如段落22-25中任一段所述的方法,其中,所述對照是野生型非人動物。
29.如段落22-28中任一段所述的方法,所述的非人轉基因動物的響應包括與基因組學、代謝組學、脂質組學或蛋白質組學相關的分析物的表達水平。
一些選擇的定義
除非本文進行了定義,本文所使用的術語具有它們的普通的含義,并可以在說明書的上下文中被進一步理解。
本文所使用的術語“可操作地連接”是指兩個以上的核酸(例如,DNA)片段之間的功能關系:例如,如果啟動子或增強子刺激適當的宿主細胞或其它表達系統中的序列的轉錄,則啟動子或增強子被可操作地連接至編碼序列。一般來說,可操作地連接的序列是連續的。然而,增強子不需要位于極其接近其所增強轉錄的編碼序列。進一步地,通過第二啟動子轉錄的因子反式調控的啟動子所轉錄的基因可以被稱為可操作連接至第二啟動子。在這種情況下,第一基因的轉錄被稱為操作性地連接至第一啟動子,并且也被稱為可操作地連接至第二啟動子。
本文所使用的術語“轉化效率”是指酶(例如,去飽和酶)可以將底物轉化為產物的效率和/或量。轉化效率是根據以下公式來測量:([產物量]/[原始底物量])*100。在一些實施方式中,產品可以包括直接產品和由其衍生的方法中的所有產品。
本文所使用的術語“δ12脂肪酸去飽和酶”是指如本文所定義的可以將碳水化合物和/或飽和脂肪轉化為n-6脂肪酸的酶或其生物活性變體。示例性的δ12脂肪酸去飽和酶是由fat-2基因或其生物活性變體編碼的酶,例如衍生自秀麗隱桿線蟲。
本文所使用的術語“n-3脂肪酸去飽和酶”是指如本文所定義的可以將n-6脂肪酸轉化為n-3脂肪酸的酶或其生物活性變體。示例性的n-3脂肪酸去飽和酶是由fat-1基因或其生物活性變體編碼的酶,例如衍生自秀麗隱桿線蟲。
本文所使用的術語“表達”是指衍生自核酸分子(例如,本文所述的第一外源和/或異源核酸分子和/或第二外源和/或異源核酸分子)的正義(mRNA)或反義RNA的轉錄和穩定積累。表達還可以指mRNA翻譯成為多肽。
術語“核酸”在本領域中是公知的。本文所使用的“核酸”一般是指DNA、RNA的分子(例如,鏈)、或其衍生物或類似物,包括核酸堿基。核酸堿基包括例如發現于DNA中的天然存在的嘌呤或嘧啶堿基(例如,腺嘌呤“A”、鳥嘌呤“G”、胸腺嘧啶“T”或胞嘧啶“C”)或發現于RNA中的天然存在的嘌呤或嘧啶堿基(例如,A、G、尿嘧啶“U”或C)。術語“核酸”涵蓋了作為術語“核酸”的亞屬的術語“寡核苷酸”和“多核苷酸”。術語“寡核苷酸”是指具有長度在約3個至約100個核酸堿基之間的分子。術語“多核苷酸”是指具有長度大于約100個核酸堿基的至少一個分子。術語“核酸”也指多核苷酸,例如脫氧核糖核酸(DNA),以及在適當的情況下的核糖核酸(RNA)。該術語也應被理解為包括由核苷酸類似物制造的RNA或DNA的等價物、類似物,并且當可應用于本文所述的實施方式時,包括單鏈(正義或反義)和雙鏈多核苷酸。術語“多核苷酸序列”和“核苷酸序列”也在本文互換使用。
本文所使用的術語“基因”是指含有編碼多肽的開放閱讀框的核酸,包含外顯子和(任選的)內含子序列。“基因”是指基因產物的編碼序列以及基因產物的非編碼區,包含基因產物的5'UTR和3'UTR區、內含子和啟動子。這些定義通常是指單鏈分子,但在具體的實施方式中還涵蓋部分、基本上或完全互補于單鏈分子的另一條鏈。因此,核酸可以涵蓋雙鏈分子、或包含含有分子的特定序列的一條或多條互補鏈或“互補物”的雙鏈分子。本文所使用的單鏈核酸可以通過前綴“ss”表示,雙鏈核酸通過前綴“ds”表示,而三鏈核酸通過前綴“is”表示。術語“基因”是指參與制造多肽鏈的DNA片段,含有編碼區之前和之后的區域以及單個編碼片段(外顯子)之間的中間序列(內含子)。“啟動子”是核酸序列的區域,在該處控制轉錄的起始和轉錄速率。啟動子可以包含調節蛋白和分子(例如,RNA聚合酶和其它的轉錄因子)可以結合的元件,以起始核酸序列的特異性轉錄。術語“增強子”是指參與核酸序列的轉錄激活的順式作用調控序列。增強子可以在任一方向上發揮功能,并可為啟動子的上游或下游。
術語“實體”是指任何結構的分子或分子的組合。
本文所使用的術語“受試者”是指人和非人動物。本文所使用的術語“非人動物”包括所有的脊椎動物,例如哺乳動物,如非人的靈長動物(特別是高等靈長動物)、綿羊、狗、嚙齒動物(例如,小鼠或大鼠)、豚鼠、山羊、豬、貓、兔、奶牛;以及非哺乳動物,例如雞、兩棲動物、爬行動物等。在一些實施方式中,非人動物是非人哺乳動物。在一個實施方式中,受試者是人。在另一實施方式中,受試者是作為疾病模型的實驗動物或動物替代物。該術語并不指明特定的年齡或性別。因此,旨在涵蓋成年受試者和新生兒受試者以及胎兒,無論是雄性或雌性。受試者的實例包括人、狗、貓、奶牛、山羊和小鼠。術語受試者進一步旨在包括轉基因物種。
術語“組織”旨在包括:完整的細胞;血液;血液制品,例如血漿和血清;骨骼;關節;肌肉;平滑肌和器官。
在本文中,術語“疾病”或“失調”可以互換使用,是指:機體狀態方面的任何變化或某些器官中的任何變化;中斷或干擾功能的表現;和/或對受折磨的人或者與患者接觸的人引起如下癥狀,例如不適、功能紊亂、痛苦或甚至死亡。疾病或失調也可以與如下有關:瘟熱、生病、微恙、痼疾(amlady)、失調、患病、染病、抱怨、不適(inderdisposion)、病變。
本文所使用的術語“治療”包括減少或減輕與不適當的增殖(例如癌癥)有關的病癥、疾病或失調的至少一種不利影響或癥狀。
在本文中,本文所使用的術語“給予”和“引入/導入”可以互換使用,是指通過如下方法或途徑將藥劑放置入受試者中,所述方法或途經使得藥劑至少部分定位于期望的位點。藥劑可以通過引起受試者中的有效治療任何適當的途徑給予。
在本文中,本文所使用的術語“啟動子”或“啟動子區域”或“啟動子元件”可以互換使用,是指一段核酸序列,通常是但不限于控制其操作性地連接的核酸序列的轉錄的DNA或RNA或其類似物。啟動子區域包含足夠用于RNA聚合酶識別、結合和起始轉錄的特定序列。啟動子區域的這一部分被稱為啟動子。此外,啟動子區域包含調節RNA聚合酶的這一識別、結合和起始轉錄的活性的序列。這些序列可以順式作用、或可以響應于反式作用因子。取決于調節的性質,啟動子可以是組成型或調節型。
在本文中,術語“調控序列”與“調控元件”互換使用,是指一段核酸的元件,通常是但不限于DNA或RNA或其類似物,調節其操作性地連接的核酸序列的轉錄,從而作為轉錄調節器起作用。調控序列調節其操作地連接的基因和/或核酸序列的表達。調控序列通常包含“調控元件”,調控元件是作為轉錄結合結構域的核酸序列,并且通過轉錄蛋白和/或轉錄因子、阻遏子或增強子等的核酸結合結構域識別。典型的調控序列包括但不限于:轉錄啟動子、誘導型啟動子和轉錄元件、控制轉錄的可選的操作序列、編碼合適的mRNA核糖體結合位點的序列以及控制轉錄和/或翻譯的終止的序列。
調控序列可以是單一調控序列或多重調控序列、或經修飾的調控序列或其片段。經修飾的調控序列是核酸序列已通過一些手段(例如但不限于突變、甲基化等)加以改變或修飾的調控序列。
本文所使用的冠詞“一”(“a”和“an”)是指一個或多于一個(即,至少一個)的語法賓語的冠詞。
為了方便起見,在整個申請(包括說明書、實施例和附加的權利要求書)中使用的某些術語被收集在此。除非另有定義,本文使用的所有技術和科學術語具有與本發明所屬的領域的普通技術人員通常所理解的相同含義。
應理解的是,本發明并不限于本文所述的特定的方法、方案和試劑等,并且可能會有所不同。本文所使用的術語僅用于描述特定的實施方式的目的,并不打算限制本發明的范圍,本發明的范圍僅由權利要求書所定義。
除了在操作實施例中或另有指示以外,本文所使用的表示成分的量或反應條件的所有數字均應理解為在所有情況下均由術語“約”加以修飾。當用來描述本發明時,術語“約”在與百分比連接使用時意味著±5%。
在一個方面,本發明涉及本文所述的組合物、方法及其各自的組件,對于本發明來說必要的是,對于包含未指定的必要或非必要的要素而言是開放性的(“包括”)。在一些實施方式中,待包含在組合物、方法或其各自的組件的描述中的其它要素被限定為不會實質上影響本發明的基礎和新特征的要素(“基本上包含”)。這同樣適用于所描述方法中的步驟以及組合物和其中的組件。在其它實施方式中,本文所述的發明、組合物、方法及其相應的組件旨在排除任何不被認為是組件、組合物或方法的必需要素的任何要素(“由…組成”)。
出于描述和公開的目的,將被認定的所有專利、專利申請和出版物以引用方式并入本文,例如,在此類出版物中描述的可與本發明結合使用的方法學。這些出版物僅由于它們的公開早于本申請的申請日而提供。在這方面沒有任何內容應被理解為承認本發明人沒有權利憑借先前的發明或因為任何其它原因而將此類公開提前。所有關于這些文件的內容的日期或表述是基于申請人可獲得的信息,并不構成關于這些文件的日期或內容的正確性的任何承認。
實施例
下面的實施例闡明了本文所述的本發明的一些實施方式和方面。對于相關領域的技術人員來說顯而易見的是,在不改變本發明的精神或范圍的情況下,可以進行各種修改、增加、替換等,并且這些修改和變化均涵蓋在隨后的權利要求書所限定的本發明的范圍之內。以下的實施例不以任何方式限制本發明。
實施例1可以由非必需營養素制造必需的n-6和n-3多不飽和脂肪酸(PUFA)的轉基因動物的制造
為了消除脂肪酸補充劑的需要,制造了可以由非必需營養素制造必需的n-6和n-3PUFA的動物模型。在一些實施方式中,轉基因動物模型是鼠類模型。制造這種轉基因鼠類模型的示例性方法是:首先創建具有編碼將單不飽和脂肪酸(MUFA)轉化為n-6亞油酸(18:2n-6,LA)的酶的秀麗隱桿線蟲fat-2基因(或其變體)的fat-2轉基因小鼠(17),然后使fat-2轉基因小鼠與事先制造的具有編碼將n-6轉化為n-3PUFA的酶的秀麗隱桿線蟲fat-1基因(或其變體)的fat-1轉基因小鼠雜交(18)。通過該方法,制造復合fat-1/fat-2轉基因小鼠,以下簡稱“ω”小鼠。“ω”小鼠可以由僅含有飽和脂肪和/或碳水化合物的飲食制造n-6和n-3PUFA(圖1A)。
為了使秀麗隱桿線蟲fat-2基因在哺乳動物中更高地表達,首先基于哺乳動物去飽和酶序列來優化fat-2序列的密碼子,并且啟動子(例如雞β-肌動蛋白啟動子)被用來建立轉基因構建體。在該實施例中使用的經優化的fat-2序列是SEQ ID NO.1。然后例如通過顯微注射將轉基因構建體施用至小鼠,以創造fat-2轉基因小鼠。在對轉基因小鼠進行示出fat-2表型和基因型的評估后,將雜合子fat-2轉基因小鼠與野生型小鼠(例如,C57BL6野生型(WT)小鼠)回交多個世代(例如,~5代),然后與雜合fat-1轉基因小鼠雜交。由此制造的后代由WT小鼠、fat-1小鼠、fat-2小鼠和ω小鼠構成。先前已經對fat-1轉基因小鼠進行了描述(12,19)。對WT、fat-2和ω同窩小鼠的基因型和表型進行評估。fat-1和fat-2轉基因的表達通過PCR進行確定。WT小鼠不會表達fat-1或fat-2轉基因的任一種。fat-2小鼠僅攜帶fat-2轉基因,而ω小鼠表達fat-1轉基因和fat-2轉基因(圖1B)。
當WT、fat-2和ω同窩小鼠被飼喂同樣的高飽和脂肪、高碳水化合物和低n-6PUFA的飲食,例如通過氣相色譜法(GC)進行表型確定,顯示了三種不同的組織脂肪酸圖譜(圖1C和圖1D)。WT小鼠展現出高水平的飽和脂肪和非常低水平的必需脂肪酸,主要是n-6PUFA,n-6/n-3PUFA的比值為約3.5。fat-2轉基因小鼠顯示出總的組織PUFA含量的顯著增加,肌肉組織中的n-6PUFA含量由約700μg/g倍增至1350μg/g,這歸因于油酸轉化為n-6亞油酸(LA)和花生四烯酸(AA),而n-3PUFA的水平沒有太大的變化,使得n-6/n-3PUFA的比值為約5。ω轉基因小鼠也展現出顯著增高的總PUFA含量,但是與它們的WT和fat-2同窩小鼠相比,n-3PUFA的組織含量增加約五倍,這歸因于幾乎一半的n-6PUFA含量轉化為n-3PUFA,n-6/n-3PUFA的比值顯著降低為0.75(圖1D)。fat-2和ω小鼠中的MUFA水平相應減小,表明MUFA被轉化為n-6PUFA。在三種表型之間,檢測到飽和脂肪酸(SFA)水平無顯著差異。下面的表1顯示了三種基因型之間的各種組織中的脂肪酸分布的比較。
表1.三種基因型之間的各種組織中的脂肪酸分布的比較。
WT:野生型;SFA:飽和脂肪酸;MUFA:單不飽和脂肪酸;PUFA:多不飽和脂肪酸;n-6:n-6;n-3:n-3;n.s.:不顯著。每組N=3;*P<0.05,**P<0.01,***P<0.001。
此外,當飼喂高碳水化合物、無脂肪飲食時,fat-2和ω小鼠仍然分別展現出n-6和n-3PUFA的顯著的組織水平,表明在缺乏飲食脂肪且僅給予碳水化合物時,它們具有制造必需脂肪酸的能力(表2)。
表2.在用無脂肪飲食飼喂的小鼠中的尾組織的脂肪酸分布。
WT:野生型;SFA:飽和脂肪酸;MUFA:單不飽和脂肪酸;PUFA:多不飽和脂肪酸;n-6:n-6;n-3:n-3;n.s.:不顯著。每組N=3;*P<0.05,**P<0.01,***P<0.001。
盡管飲食幾乎不含這些脂肪酸,fat-2小鼠中的n-6PUFA的組織豐度和ω小鼠中的n-3和n-6PUFA的組織豐度表明轉基因小鼠由非必需營養素(例如,MUFA、SFA以及甚至碳水化合物)制造必需脂肪酸的能力。這一技術使得能夠使用單一飲食來創建必需脂肪酸的不同的組織水平,以使可以在沒有飲食的干擾因素的情況下評估不同的脂肪對健康狀況的特定影響。
用于制造上述的轉基因動物的示例性方法
密碼子優化:為了有效地在哺乳動物中在體內表達來自低等生命秀麗隱桿線蟲的基因,秀麗隱桿線蟲所使用的密碼子被調整以匹配哺乳動物所使用的密碼子。從基因庫(GenBank登錄號NM_070159)獲得fat-2基因序列。哺乳動物去飽和酶以及先前優化的fat-1基因被用作參比以確定秀麗隱桿線蟲和哺乳動物之間的去飽和酶的密碼子使用方面的差異。然后人工調整密碼子,以實現超過80%的優化。經優化的Fat-2序列的實施例是SEQ ID NO.1的核苷酸序列。
基因合成:在對基因序列進行修飾以優化密碼子使用之后,例如通過GenScript(Piscataway,NJ)合成fat-2基因。基因被合成為在兩側具有限制性酶切位點(例如,EcoR I消化位點),然后遞送至質粒或載體(例如pUC57質粒)。擴增后,將fat-2序列插入含有啟動子和調控元件的表達質粒中。在一個實施方式中,fat-2序列被插入含有雞β-肌動蛋白啟動子和巨細胞病毒增強子的pCAGGS表達質粒中。連接后,確定方向并擴增質粒。最后,用適當的限制性內切酶(例如Ssp I和Sfi I)切除含有啟動子、fat-2序列和多聚A序列的片段,以用于顯微注射(圖5)。
顯微注射:通過如下制造轉基因動物系:將經純化的經消化的片段(例如,由Ssp I和Sfi I消化)注射入感興趣的動物的受精卵(例如,C57BL/6X C3H小鼠的受精卵)。將經注射DNA的卵移植至假孕動物(例如,B6C3F1小鼠)以制造轉基因動物(例如,轉基因小鼠)。初始的轉基因小鼠接受基因分型和表型分型。
基因分型和表型分型:通過移除轉基因動物的組織(例如,小鼠尾尖)進行基因分型,以獲得用于RT-PCR的DNA樣本,該RT-PCR用下述引物進行:fat-2正向,GCGGCCA GACCCAGACCATC;以及fat-2反向,GGGCGAC GTGACCGTTGGTA。PCR產物在2%瓊脂糖凝膠上進行凝膠電泳。如此前在參考文獻26中描述的,使用氣相色譜(GC)通過脂肪酸組成分析進行表型分型。斷奶后,fat-2小鼠保持低PUFA飲食(表3)。
表3.低PUFA飲食和無脂肪飲食的組成(PUFA:多不飽和脂肪酸。)
在飲食20天后進行GC,以使得能夠用于更清晰的表型分型。組織樣本(例如,尾組織樣本)在液氮下被磨成粉末并接受總的脂質提取,并且通過在~14%三氟化硼(BF3)-甲醇試劑(Sigma-Aldrich,St.Louis,MO)和己烷(Sigma Aldrich)下在~100℃下加熱~1h進行脂肪酸甲基化(26)。使用配備火焰離子化檢測器的完全自動化6890N Network GC System(Agilent Technologies,Santa Clara,CA)對脂肪酸甲酯進行GC分析。通過與脂肪酸標準品(Nu-chek Prep,Elysian,MN)比較來識別可分辨的脂肪酸的峰,并且所有的分離的峰的面積百分比使用GC ChemStation Software(Agilent)進行分析。
在識別了基因型和表型之后,使fat-2小鼠與野生型(WT)動物(例如,C57BL6小鼠)交配以創建F1代。Fl代隨后與野生型動物(例如,WT C57BL6小鼠)回交至少5次,以證實基因是可傳遞的并建立純的背景,從而使fat-2系可以保持顯著的表型。使各代接受通過RT-PCR進行的基因分型和通過GC進行的表型分型。
ω小鼠的制造:復合fat-1/fat-2轉基因小鼠通過雜合的fat-2轉基因小鼠與雜合的fat-1轉基因小鼠雜交而建立,這此前在參考文獻18和美國專利號7,238,851中描述,以引用的方式將其內容并入本文。斷奶后,后代保持低PUFA飲食或無脂肪飲食(表3,如上所示),然后通過RT-PCR實施基因分型,并通過GC實施表型分型。通過ω小鼠的RT-PCR用如下引物進行基因分型:fat-1正向,TGTTCATGCCTTCT TCTTTTTCC;fat-1反向,GCGACCATACC TCAAACTTGGA;fat-2正向,GCGGCCA GACCCAGACCATC;fat-2反向,GGGCGAC GTGACCG TTGGTA。如此前在參考文獻26中描述的,使用GC通過脂肪酸組成分析進行表型分型。
實施例2可以由非必需營養素制造必需的n-6和n-3多不飽和脂肪酸(PUFA)的轉基因動物的表征和實用性
為了說明轉基因動物用于研究病癥(例如與脂肪代謝相關的病癥)的實用性,使用通常與代謝性疾病的發育相聯系的多個參數檢測了實施例1中描述的轉基因小鼠(即,WT小鼠、fat-2轉基因小鼠和ω小鼠)。
增加的肝臟脂肪合成是脂肪肝的病理基礎,它與代謝性疾病包括肥胖、糖尿病和癌癥有關(4)。為了評估不同的脂肪酸分布之間的肝臟脂肪合成方面的差異,分析了肝臟脂質含量。油紅O染色顯示出三種表型之間在脂質積累方面的顯著差異;具體而言,與其WT同窩小鼠相比,具有增高的組織n-6PUFA的fat-2小鼠展現出顯著更多的脂質積累,而在增高的組織n-3PUFA和平衡的n-6/n-3PUFA比值的ω小鼠中,脂質累積顯著減少(圖2A)。因此,肝臟甘油三酯(TG)含量的測量顯示出類似的模式,fat-2小鼠中具有最大量甘油三酯,而ω小鼠中具有最低量甘油三酯(圖2B)。關鍵的脂肪合成相關的基因的表達在fat-2小鼠中升高但在ω小鼠中降低,這些相關的基因的表達包括例如但不限于:硬脂酰輔酶A去飽和酶(SCD-1)、脂肪酸合酶(FAS)和乙酰輔酶A羧化酶(ACC)(圖2C)。這些結果表明n-6和n-3PUFA對肝臟脂肪合成的不同影響。
腸道菌群被認為是與代謝疾病相關的許多生理和病理病癥的關鍵決定因素(5)。腸桿菌科的增高的水平和雙歧桿菌的下降的水平已連接至與內毒素血癥引起的輕度炎癥(20,21)。因此,這兩種腸道微生物物種被選擇,以通過糞便培養和糞便細菌DNA的PCR測量來評估它們可能會如何受到組織脂肪酸分布的變化的影響。值得注意的是,雖然三組小鼠均飼喂相同的飲食,目前的發現表明,各組表現出與它們各自的脂肪酸分布相關的不同的腸道菌群的組成。如圖3A所示,腸桿菌科種群數量在fat-2小鼠中增加,而在ω小鼠中顯著降低。相比之下,圖3B顯示出雙歧桿菌種群數量表現出相反的趨勢,在fat-2小鼠中的存在大大減少,而在ω小鼠中升高。關于飲食對腸道菌群的影響的此前的報告在很大程度上歸因于對腸空腔中的飲食成分與腸道菌群的直接相互作用的影響(22);然而,三種不同的腸道菌群分布可以產生自單一飲食的當前發現首次顯示了這些差異可以僅僅由組織脂肪酸組成方面的變化誘導。因此,本文所提出的實驗系統或轉基因小鼠提供了獨特的機會以探討宿主組織含量與腸道微生物組學之間的相互作用。
慢性低度炎癥是許多疾病的共同機制,主要特點是炎性細胞因子的升高的血漿水平,炎性細胞因子包括例如但不限于TNF-α、IL-1β和IL-6(6,7,23)。使用多重檢測,測定多個關鍵炎性細胞因子的血漿水平。發現在三組之間,TNF-α和IL-6水平顯著不同,在fat-2小鼠中水平最高,而在ω小鼠中水平最低(圖4A)。因為低度炎癥往往可以通過腸道細菌衍生的血漿內毒素(例如脂多糖(LPS))誘導(24,25),所以測定了LPS的血漿水平。如圖4B所示,LPS水平在fat-2小鼠中最高,而在ω小鼠中最低,與如上所示的腸道菌群分布和炎癥細胞因子水平一致。本文所提出的發現表明了潛在的新機制(組織n-6或n-3PUFA水平的改變通過調制腸道菌群和相關的內毒素血癥來影響低度炎癥)。總之,這些發現表明,低度炎癥由更高的組織n-6PUFA水平促進,而通過增高組織n-3PUFA水平和平衡組織n-6/n-3PUFA比值來加以抑制。
當今西方人的飲食與貫穿人類進化的大部的飲食從根本上是不同的。在過去的數十年里所發生的膳食營養素方面的許多變化中,一些關鍵變化包括飽和脂肪、碳水化合物的和n-6PUFA的攝入增加以及n-3PUFA的攝入減少(1,2)。作為其結果,現代人類具有偏愛n-6PUFA的高達20:1的n-6與n-3PUFA的比值;從進化上來看,這個比值已經接近1:1,并且相信該差異具有深刻的生理后果(1,2)。同時,慢性低度炎癥已成為與慢性代謝性疾病(例如糖尿病、肥胖、心臟病和癌癥)的患病率上升相關的常見的折磨(6,7)。然而,膳食構成方面的變化、尤其是n-6/n-3PUFA的比值是否與低度炎癥的患病率以及當今的健康流行病之間真正存在聯系,仍然值得商榷。
使用本文所述的良好控制的實驗體系得出的當前發現提供了這種聯系的證據。在該實施例中,所有的小鼠均飼喂高飽和脂肪、高碳水化合物和低n-6PUFA的飲食。雖然WT小鼠和fat-2小鼠之間的唯一區別是fat-2小鼠具有升高的組織n-6PUFA水平,fat-2小鼠表現出肝脂質發生、腸道菌群和炎性細胞因子水平的最不利病癥。這些結果表明,當在高飽和脂肪和低n-3PUFA的存在下組織n-6PUFA增加時,引起代謝性疾病的健康并發癥的風險更大。這些結果還表明,鑒于n-6PUFA水平對其結果的顯著影響,在解釋使用高脂肪飲食的動物或人類的研究時需要考慮n-6PUFA含量。到目前為止,大多數現有的研究未考慮n-6PUFA含量。此外,以往的研究未能夠在使用油或補充劑時從其它成分(例如,抗氧化劑和植物甾醇)的潛在的有利影響中分離開n-6PUFA的影響。
如在ω小鼠中所見的,當前的發現還表明如何解決由增高的組織n-6PUFA引起的健康并發癥。fat-2和ω小鼠的不同僅在于ω小鼠具有降低的組織n-6PUFA水平和增高的n-3PUFA水平。然而,在fat-2小鼠中觀察到的不良健康結果在ω小鼠中極大地減少。這些發現強調了n-3PUFA和平衡的組織n-6/n-3PUFA比值在降低代謝性疾病的風險方面的重要性。
本文所提出的發現對現代健康流行病有很大的影響。組織成分與消費現代西方飲食的動物高度相似的fat-2小鼠表明n-6PUFA的高組織水平似乎是當今的健康流行病的病因之一。ω小鼠顯示出,增高組織n-3PUFA水平和降低n-6PUFA水平以平衡組織n-6/n-3PUFA的比值可以是抵消這些不良健康狀況的有效方法。這些發現也表明用于最佳健康的平衡的n-6/n-3PUFA的比值的進化偏好(1,2)。
此外,本文所提出的發現表明了在闡明改變組織脂肪組成對疾病病癥的影響方面,這些轉基因動物模型如何可以發揮巨大的效用。當將這些模型以其它感興趣的飲食或不同疾病病癥使用時,與分析技術例如基因組學和代謝組學相結合,潛在的應用是顯而易見的。這種沒有飲食的混雜因素的全面的數據可以使人們更好地了解營養素與基因的相互作用,并解決本領域的目前存在的不確定性,以及識別用于預防和治療代謝性疾病的新的靶標或方法。
此外,本文所提出的一個方面涉及可以通過僅用碳水化合物和/或飽和脂肪飼喂動物而在動物產品(例如,肉、奶、蛋等)中制造必需脂肪酸(尤其是有益的n-3PUFA)的新的轉基因技術。鑒于n-3PUFA主要限于海洋資源(例如,魚和海藻),本文所述的轉基因技術和轉基因動物可以因此創造可持續且可獲得的n-3PUFA的來源,尤其是在僅可用碳水化合物和/或飽和脂肪的場合。
表征轉基因動物的示例性方法
油紅O染色:為了確定肝臟脂質累積,將經冷凍的肝切片(例如,10μm)固定于4%磷酸緩沖的多聚甲醛中,用油紅O(Sigma-Aldrich)染色,并用蘇木精(Sigma-Aldrich)復染。切片通過光學顯微鏡檢查,使用CCD相機(QImaging,Surrey,加拿大)獲得圖像。
肝臟甘油三酯(TG)含量的測定:將肝組織用5%NP-40提取,并用dH2O稀釋10倍,然后采用比色分析試劑盒(Sigma-Aldrich,TR0100)按照制造商的說明書進行TG測定。
基因表達的PCR分析:切取肝臟組織,并在液氮中研磨。總RNA提取用TRIzol試劑(Invitrogen Life Technologies,Grand Island,NY)按照制造商的說明書實施。用iScript逆轉錄試劑盒(Bio-Rad,Hercules,CA)將來自各樣品的3μg RNA逆轉錄成cDNA。使用Mastercycler Pro S熱循環儀(Eppendorff,Hauppauge,NY)以下述程序進行PCR:95℃,5分鐘→(95℃,30秒→58℃,30秒→72℃,30秒)×35→72℃,5分鐘。將10μl PCR產物通過1.5%瓊脂糖凝膠電泳進行分析,在UV光下觀察并拍照。各條帶的密度使用Image J軟件量化,且將各PCR產物的相對量作為相同樣本中的管家基因GAPDH的帶密度的比值加以計算。
細菌培養:收集單獨的糞便樣品,例如,直接收集在微量離心管中的腦心浸液(BHI)培養基(200μl)中,并保持在冰上。以特定的重量:體積比(例如,10mg樣品:100μl BHI)將BHI培養基添加至各管。將樣品進行渦旋和連續稀釋,然后涂布于瓊脂平板上(例如,MacConkey瓊脂(BD,USA)平板或Bifido瓊脂(Anaerobe Systems,Morgan Hill,CA)平板),以分別對腸桿菌科和雙歧桿菌屬的種進行計數。將MacConkey瓊脂平板在周圍空氣中于37℃下孵育24小時,而將Bifido瓊脂平板在厭氧袋(Fisher Scientific)中于37℃的孵化器中孵育48小時。
細菌DNA的定量PCR(qPCR)測量:使用QIAamp DNA Stool Mini Kit(Qiagen,Valencia,CA)按照制造商的說明書從100g存儲在-80℃下的糞便樣品中提取細菌的基因組DNA。DNA濃度通過在260nm下的吸光度進行確定,并用Nanodrop分光光度計(Biotek,Winooski,VT)通過確定A260/A280比值來評估純度。使用處于PRISM 9000Light Cycler(Applied Biosystems,USA)中的SyBR Green按照制造商的說明書進行qPCR。使用下述的組特異性16S rRNA基因引物(Invitrogen):腸桿菌科正向,5′-GTG CCA GCA GCC GCG GTA A-3′以及反向,5′-CCT CAA GGG CAC AAC CTC CAA G-3′;雙歧桿菌屬的種正向,5′-TCG CGT CCG GTG TGA AAG3′以及反向,5′-CCA CAT CCA GCA TCC AC-3′。數據分析采用MxPro QPCR軟件(v4.10,Agilent)進行。各糞便樣本的細菌濃度(微生物DNA拷貝數/克糞便)通過比較由標準曲線得到的Ct值進行計算,標準曲線利用來自相應的參比菌株(大腸桿菌MG1655和雙歧桿菌菌株12147BFAA)的已知濃度的細菌基因組DNA(BEI Resources,Manassas,VA)的系列的五倍稀釋構建。細菌基因組的量使用阿伏伽德羅常數計算,并假設堿基對的平均分子量是660g/mol。將標準曲線歸一化為各組細菌的16S rRNA基因的拷貝數。將各樣本中的16S rRNA基因拷貝數歸一化為糞便的克數。
血漿細胞因子水平的測定:例如,按照制造商的說明書,通過安排在磁珠上的Bio-Plex免疫測定(Bio-Rad),分析血清樣品的如下的水平:TNF-α、IL-1β、IL-6、MCP-1和IL-10。將Xponent軟件(Luminex,Austin,TX)用于數據采集和分析。
測量血漿LPS濃度:例如,按照制造商的說明書,用ToxinSensor顯色鱟變形細胞裂解物(LAL)內毒素檢測試劑盒(GenScript)測定血漿LPS濃度。例如,將樣品使用無內毒素的水稀釋10倍,調整到所建議的pH,并在70℃下加熱10分鐘以使污染蛋白的抑制或增強最小化。將LAL試劑添加至血清樣品,在37℃下孵育45分鐘,并在545nm讀取吸光度。
統計分析:將GraphPad Prism 5(GraphPad Software,San Diego,CA)用于所有的統計分析。通過F檢驗對數據集進行分析以驗證正態分布。將單因素方差分析以及隨后的Tukey檢驗用于確定統計學顯著性,設定為*P<0.05,**P<0.01,以及***P<0.001。
參考文獻
1.Leaf,A.&Weber,P.C.A new era for science in nutrition.Am.J.Clin.Nutr.45,1048-1053(1987)
2.Cordain,L.et al.Origins and evolution of the Western diet:health implications for the 21st century.Am.J.Clin.Nutr.81,341-354(2005)
3.Institute of Medicine of the National Academies.Dietary fats:total fat and fatty acids.In:Dietary reference intakes for energy,carbohydrate,fiber,fat,fatty acids,cholesterol,protein,and amino acids (macronutrients).Washington,DC:The National Academy Press,pp.335-432(2002)
4.Borén,J.,Taskinen,M.R.,Olofsson,S.O.,&Levin,M.Ectopic lipid storage and insulin resistance:a harmful relationship.J.Intern.Med.274,25-40(2013)
5.Sekirov,I.,Russell,S.L.,Antunes,L.C.,&Finlay,B.B.Gut microbiota in health and disease.Physiol.Rev.90,859-904(2010)
6.Hotamisligil,G.S.Inflammation and metabolic disorders.Nature 14,860-867(2006)
7.Ruiz-B.,Pruimboom,L.,Dijck-Brouwer,D.A.,&Muskiet,F.A.Lifestyle and nutritional imbalances associated with Western diseases:causes and consequences of chronic systemic low-grade inflammation in an evolutionary context.J.Nutr.Biochem.24,1183-1201(2013)
8.Kuller,L.H.Dietary fat and chronic diseases:epidemiologic overview.J.Am.Diet.Assoc.97,S9-15(1997)
9.Joint WHO/FAO Expert Consultation.Diet,Nutrition and the Prevention of Chronic Diseases(WHO technical report series 916).World Health Organization,Geneva.pp.81-94(2003)
10.Weisburger,J.H.Dietary fat and risk of chronic disease:mechanistic insights from experimental studies.J.Am.Diet.Assoc.97,S16-23(1997)
11.Simopoulos,A.P.The importance of the n-6/n-3 fatty acid ratio in cardiovascular disease and other chronic diseases.Exp.Biol.Med.233,674-688(2008)
12.Kang,J.X.The n-6/n-3 fatty acid ratio in chronic diseases:animal models and molecular aspects.World.Rev.Nutr.Diet.102,22-29(2011)
13.Volpe,J.J.&Vagelos,P.R.Mechanisms and regulation of biosynthesis of saturated fatty acids.Physiol.Rev.56,339-417(1976)
14.Paton,C.M.&Ntambi,J.M.Biochemical and physiological function of stearoyl-CoA desaturase.Am.J.Physiol.Endocrinol.Metab.297,E28-37(2009)
15.Leonard,A.E.,Pereira,S.L.,Sprecher,H.,&Huang,Y.S.Elongation of long-chain fatty acids.Prog.Lipid Res.43,36-54(2004)
16.Gebauer,S.K.,Psota,T.L.,Harris,W.S.,Kris-Etherton,P.M.n-3 fatty acid dietary recommendations and food sources to achieve essentiality and cardiovascular benefits.Am.J.Clin.Nutr.83,1526s-1535s(2006)
17.Watts,J.L.&Browse,J.Genetic dissection of polyunsaturated fatty acid synthesis in Caenorhabditis elegans.Proc.Natl.Acad.Sci.U S A99,5854-5859(2002)
18.Kang,J.X.,Wang,J.,Wu,L.,&Kang,Z.B.Transgenic mice:fat-1mice convert n-6 to n-3 fatty acids.Nature 427,504(2004)
19.Kang,J.X.Fat-1 transgenic mice:A new model for n-3 research.Prostaglandins Leuko.Essent.Fatty Acids 77,263-267(2007)
20.Cani,P.D.,et al.Selective increases of bifidobacteria in gut microflora improve high-fat-diet-induced diabetes in mice through a mechanism associated with endotoxaemia.Diabetologia 50,2374-2383(2007)
21.Kim,K.A.,Gu,W.,Lee,I.A.,Joh,E.H.,&Kim,D.H.High fat diet-induced gut microbiota exacerbates inflammation and obesity in mice via the TLR4 signaling pathway.PLoS One 7,e47713(2012)
22.Diamant,M.,Blaak,E.E.,&de Vos,W.M.Do nutrient-gut-microbiota interactions play a role in human obesity,insulin resistance and type 2diabetes?Obes.Rev.12,272-281(2011)
23.Nathan,C.&Ding,A.Nonresolving inflammation.Cell 140,871-882(2010)
24.Cani,P.D.,et al.Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice.Diabetes 57,1470-1481(2008)
25.Moreira,A.P.,Texeira,T.F.,Ferreira,A.B.,Peluzio,Mdo.C.,&Alfenas,Rde.C.Influence of a high-fat diet on gut microbiota,intestinal permeability and metabolic endotoxaemia.Br.J.Nutr.108,801-809(2012)
26.Kang,J.X.&Wang,J.A simplified method for analysis of polyunsaturated fatty acids.BMC Biochem.6,5(2005)
序列表
SEQ ID NO.1(經優化的秀麗隱桿線蟲fat-2基因序列)
TAAAACTTGGCCCCCGACGAAGATGACAATCGCCACAAAAGTGAACACAAATAAAAAAGACCTGGATACGATCAAGGTGCCGGAGCTGCCAAGCGTGGCAGCTGTCAAAGCCGCAATCCCTGAGCACTGCTTTGTGAAGGATCCCTTGACTAGCATTTCATATCTGATCAAGGATTACGTGCTTCTCGCCGGTCTCTACTTTGCAGTTCCCTACATAGAGCATTATCTCGGATGGATCGGGCTGCTTGGCTGGTATTGGGCCATGGGAATTGTTGGCTCCGCATTGTTCTGTGTGGGGCACGACTGCGGACACGGATCATTCTCCGATTATGAATGGCTCAATGATCTGTGTGGCCATTTAGCCCATGCTCCTATTCTGGCTCCGTTCTGGCCCTGGCAGAAATCTCACCGCCAGCATCACCAGTACACATCCCACGTGGAAAAGGATAAGGGACACCCCTGGGTTACTGAGGAAGACTACAATAATCGCACCGCCATTGAGAAATATTTCGCCGTGATTCCAATTAGCGGATGGCTGCGATGGAATCCCATCTACACCATCGTCGGTCTGCCCGATGGCTCTCACTTCTGGCCTTGGTCCCGGCTCTTCGAGACTACCGAGGATCGTGTCAAGTGTGCAGTTTCTGGCGTTGCATGCGCTATCTGCGCTTACATTGCCTTTGTGCTCTGCGACTATTCTGTCTACACATTTGTCAAGTACTACTACATTCCACTGCTCTTCCAGGGCCTGATCCTCGTCATTATCACGTATCTTCAACACCAGAATGAGGATATTGAGGTCTACGAAGCCGATGAGTGGGGCTTTGTACGCGGCCAGACCCAGACCATCGACAGGCACTGGGGCTTCGGACTAGACAACATCATGCACAACATTACCAACGGTCACGTCGCCCATCACTTCTTCTTCACCAAAATCCCCCACTATCATCTGTTGGAGGCAACTCCCGCCATCAAGAAAGCCCTGGAACCTCTGAAAGACACTCAGTACGGATACAAACGGGAAGTCAACTACAACTGGTTCTTCAAATATCTGCACTACAACGTGACCCTCGACTACTTGACCCACAAAGCAAAGGGTGTGCTGCAGTACCGCAGTGGCGTTGAGGCTGCAAAGGCTAAGAAGGCCCAGTGAACTACAAAATCTCCTGACACGTGTTCATTTTTTTGATTGCCATTTTATGTTATAACCAATTTTGAATTTGTTTTTGAAAATTAATTCTCACATATTTCAATGAAAATTTATGTGCTACTTTTG
SEQ ID NO.2(經優化的秀麗隱桿線蟲fat-1基因序列)
caagtttgaggtatggtcgctcattccagcgaagggctgtccgccacggctccggtcaccggcggcgatgtgctggtggatgcccgtgcatctctggaggagaaggaggccccccgcgacgtgaatgcaaacactaaacaggccaccactgaggagccccgcatccagttacccactgtggatgccttccgccgcgcaattcccgcacactgcttcgagagggacctcgtgaaatcaatcaggtatctggtgcaggactttgcggcactgacaattctgtactttgcccttcccgcctttgagtactttggcctgtttggttacctggtgtggaacatttttatgggcgtttttggcttcgcgctgttcgtcgttggacacgactgtcttcacggctcattctccgataatcagaatctcaatgatttcattggacatatcgccttcagcccactcttctctccctacttcccctggcagaaaagtcacaagctgcaccacgccttcaccaaccacatcgacaaagatcatggacacgtgtggatacaggataaggattgggaagcaatgcccagctggaaaagatggttcaatcctattcctttctctggctggctgaaatggttccctgtgtacactctgttcggtttctgcgatggatcccacttctggccttactcctcactgtttgtgcgcaactctgaacgcgttcagtgtgtaatctctggaatctgctgctgtgtgtgcgcatatattgctctaacaattgctggaagctattccaattggttctggtactattgggttccactttctttcttcggcttgatgctcgtcattgttacctatctgcagcacgtcgacgacgtcgctgaggtgtacgaggctgatgaatggagcttcgtccggggacagacccagaccatcgatcgttactatggcctcggcttggacacaacgatgcaccatatcacagacggacacgttgcccaccacttcttcaacaaaatcccacattaccatctcatcgaagcaaccgaaggtgtcaaaaaggtcttggagccgttgtccgacacccaatacgggtacaaatctcaggtgaactacgatttctttgcccggttcctgtggttcaactacaagctcgactatctcgttcacaagaccgccggaatcatgcaattccgaacaactctcgaggagaaggcaaaggccaagtgaaagaatatcccgtgccgttctagagtacaacaacaacttctgcgttttcaccggttttgctctaattgcaatttttctttgttctatatatatttttttgctttttaattttattctctctaaaaaacttctacttttcagtgcgttgaatgcataaagccataactctt
SEQ ID NO.3(SEQ ID NO.1的氨基酸序列)
KTWPPTKMetTIATKVNTNKKDLDTIKVPELPSVAAVKAAIPEHCFVKDPLTSISYLIKDYVLLAGLYFAVPYIEHYLGWIGLLGWYWAMetGIVGSALFCVGHDCGHGSFSDYEWLNDLCGHLAHAPILAPFWPWQKSHRQHHQYTSHVEKDKGHPWVTEEDYNNRTAIEKYFAVIPISGWLRWNPIYTIVGLPDGSHFWPWSRLFETTEDRVKCAVSGVACAICAYIAFVLCDYSVYTFVKYYYIPLLFQGLILVIITYLQHQNEDIEVYEADEWGFVRGQTQTIDRHWGFGLDNIMetHNITNGHVAHHFFFTKIPHYHLLEATPAIKKALEPLKDTQYGYKREVNYNWFFKYLHYNVTLDYLTHKAKGVLQYRSGVEAAKAKKAQStopTTKSPDTCSFFStopLPFYVITNFEFVFENStopFSHISMetKIYVLLL
SEQ ID NO.4(SEQ ID NO.2的氨基酸序列)
SEQ ID NO.5(野生型秀麗隱桿線蟲fat-2mRNA序列)
SEQ ID NO.6(參比序列是野生型秀麗隱桿線蟲fat-2基因序列。經優化的密碼子可見于以下示出的以大寫字母表示的位置)
SEQ ID NO.7(δ12去飽和酶的菠菜FAD2mRNA)
SEQ ID NO.8(野生型秀麗隱桿線蟲fat-1mRNA序列)
- 還沒有人留言評論。精彩留言會獲得點贊!