一種苦苣苔科植物組織培養方法與流程
本發明涉及植物組織培養領域,具體的說是涉及一種苦苣苔科植物組織培養方法。
背景技術:
苦苣苔科(Gesneriaceae)植物多為多年生草本植物,種類繁多,全世界約有140屬,2000余種,我國有58屬463種。有的種類既耐旱又耐陰、耐濕,有的種類具有很高的藥用價值,有的種類株型、葉形、花形變化豐富,花葉兼美,觀賞價值高,具有一定的室內觀賞盆花開發前景;但目前大多種類尚未進入商品開發階段,且由于自身的遺傳缺陷及野生資源的過度開發,很多具有較高應用價值的苦苣苔科植物已瀕臨滅菌。利用組織培養快速繁殖技術有助于苦苣苔科植物的商品開發和種質資源保存,還有利于苦苣苔科植物的良種選育、人工種子培育、生理代謝研究等工作的進一步開展。
目前,苦苣苔的組織培養技術已有較多報道,但是在眾多的現有技術中,初代培養不定芽的分化率、繼代增殖培養的增殖系數比較低,并且生根率也沒有能夠達到100%,如專利CN102144556A公開的瑤山苣苔組織培養及快速繁殖的方法中,其不定芽分化率僅為31.7%,而繁殖系數僅為4.6/60d,生根率為90.7%;專利CN103141390A公開的紅苞半蒴苣苔的繁殖方法,其記載的繼代繁殖培養的增殖倍數為3.6倍;CN105325301A公開了一種心葉小花苣苔兩步成苗組培快速繁殖的方法,其記載的不定芽分化率最高為86.9%,增殖系數最高為6.1/50d,生根率最高為89.5%/30d。CN104823855A公開的短毛唇柱苣苔組培快繁方法中,增殖系數為15,雖然有所提高,但是仍舊不高。此外,還有諸多苦苣苔科植物的組織快繁技術,但是由于在培養基的選擇搭配上不夠理想,致使在培養過程中,愈傷組織誘導率、不定芽分化率、增至培養的增殖系數以及生根率等各階段的效果較差。因此,提供一種在各階段具有較好快繁效果的組織培養方法,可以極大地推動苦苣苔科植物的經濟效益。
技術實現要素:
有鑒于此,本發明的目的在于提供一種苦苣苔科植物組織培養方法,使得所述組織培養方法能夠在培養過程中具備較高的愈傷誘導率、不定芽分化率、增殖系數和生根率。
為了實現上述目的,本發明提供如下技術方案:
一種苦苣苔科植物組織培養方法,包括:
步驟1、取苦苣苔科植物的外植體進行滅菌;
步驟2、將外植體接種到初代誘導培養基中,先進行暗培養誘導出愈傷組織,而后進行光培養分化出不定芽;所述初代誘導培養基采用如下之一:
(1)含有0.04mg/L的TDZ、0.2~0.8mg/L的2,4-D、0.1~0.3mg/L的NAA、20~25g/L的蔗糖的MS培養基,pH值為5.8-6.0;
(2)含有0.8mg/L的6-BA、0.08mg/L的KT、0.1mg/L的IAA、20~25g/L的蔗糖的MS培養基,pH值5.8-6.0;
步驟3、將分化出不定芽的芽塊接種到繼代培養基中進行增殖培養,獲得叢生芽的有效苗,所述繼代培養基為含有0.01mg/L的TDZ、0.4mg/L的6-BA、0.05mg/L的NAA、200mg/L的CH(即水解酪蛋白)的MS培養基,pH值5.8-6.0;
步驟4、將有效苗轉接到生根培養基上進行生根培養,獲得完整無菌苗,所述生根培養基為含有0.2mg/L的IBA、0.1mg/L的IAA、20g/L的蔗糖的1/2MS培養基,pH值為6.0~6.2。
對于植物組織培養,培養基是其生長狀態的最關鍵因素之一,現有苦苣苔植物的組織培養方法由于對初代誘導分化、繼代增殖以及生根三個階段的培養基選擇以及組合搭配不當,使得各階段的愈傷誘導率、不定芽分化率、增殖系數和生根率都比較差,本發明選擇特定的三個階段培養基組成了一個成體系的苦苣苔植物快繁工藝,在每一個階段都具有較好的效果。
作為優選,步驟1為取苦苣苔科植物的外植體用酒精和升汞進行滅菌。
進一步優選地,步驟1為:
取苦苣苔科植株的外植體,用自來水沖洗干凈后,移入超凈工作臺,用75%酒精浸泡30~60s,無菌水清洗2次,然后用加2滴TWeen-20的0.1%HgCl2溶液處理5min,無菌水清洗1次;再用加2滴TWeen-20的0.1%HgCl2溶液處理2~5min,無菌水清洗5~6次,將外植體置于無菌濾紙上吸干水分,待用。
在本發明中,所述苦苣苔科植物優選為報春苣苔、旋朔苣苔或半蒴苣苔,其中包括多痕報春苣苔(Primulina minutihamata)、永福報春苣苔(Primulina yungfuensis)、藥用報春苣苔(Primulina medica)、豬耳朵(Boea hygrometrica)、疏脈半蒴苣苔(Hemiboea cavalerei var.paucinervis)、武宣報春苣苔(Primulina wuxuanensis)。而所選用的外植體優選采用苦苣苔科植物的葉片和/或葉柄。其中,作為優選,多痕報春苣苔、永福報春苣苔、藥用報春苣苔、豬耳朵采用含有0.04mg/L的TDZ、0.2~0.8mg/L的2,4-D、0.1~0.3mg/L的NAA、20~25g/L的蔗糖的MS培養基作為初代誘導培養基,pH值為5.8-6.0;疏脈半蒴苣苔、武宣報春苣苔采用含有0.8mg/L的6-BA、0.08mg/L的KT、0.1mg/L的IAA、20~25g/L的蔗糖的MS培養基作為初代誘導培養基,pH值5.8-6.0。
作為優選,所述暗培養在20~25℃下培養。所述光培養、增殖培養以及生根培養均優選在20~25℃、光照強度1500~2000lx,光照時間14h/d下培養。
暗培養一般培養20~35d后,根據愈傷組織或芽的誘導分化情況將培養所得的愈傷組織或芽分別轉接到原培養基上進行光培養;在增殖培養過程中,一般培養30d;而在生根培養中,一般培養1-2周。
本方法以6種苦苣苔植物的葉片和(或)葉柄為外植體材料,利用本發明組織培養技術和原理,經過愈傷組織誘導、分化及叢生芽增殖和生根的過程,快速獲得多痕報春苣苔、武宣報春苣苔、永福報春苣苔、疏脈半蒴苣苔、藥用報春苣苔、豬耳朵6種苦苣苔科植物無菌苗,其中愈傷組織誘導率高達90%以上,分化率達100%,增殖系數約50~120,生根率達100%。各階段的效果數據均顯著高于現有技術中相關苦苣苔科植物組織培養方法。
由以上技術方案可知,本發明選擇特定的初代誘導培養基、繼代培養基和生根培養基,利用組織培養技術,通過一種新途徑獲得了多痕報春苣苔、武宣報春苣苔、永福報春苣苔、疏脈半蒴苣苔、藥用報春苣苔、豬耳朵等多種苦苣苔科植物的無菌苗,建立了穩定、高效的組培快繁體系。
附圖說明
圖1所示為多痕報春苣苔愈傷組織誘導及分化圖;
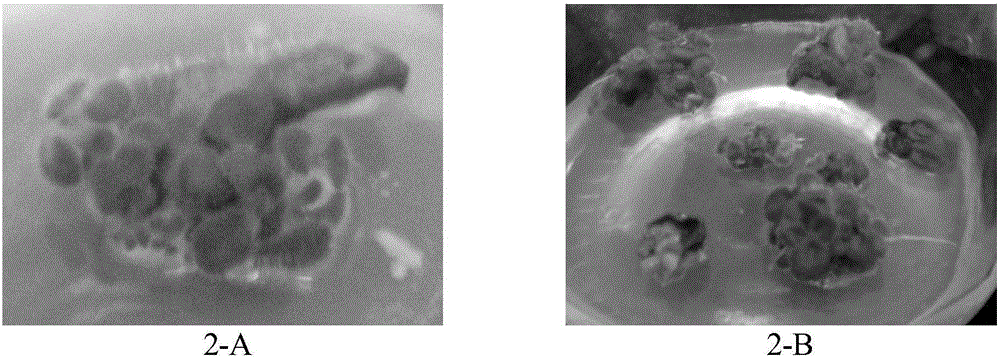
圖2所示為永福報苣苔春愈傷組織形成及分化圖;
圖3所示為藥用報春苣苔愈傷組織形成及分化圖;
圖4所示為豬耳朵愈傷組織形成及分化圖;
圖5所示為疏脈半蒴苣苔愈傷組織形成及分化圖;
圖6所示為武宣報春苣苔愈傷組織形成及分化圖;
圖7所示為多痕報春苣苔叢生芽增殖圖;
圖8所示為永福報春苣苔叢生芽增殖圖;
圖9所示為藥用報春苣苔叢生芽增殖及芽苗生根圖;
圖10所示為豬耳朵叢生芽增殖圖;
圖11所示為疏脈半蒴苣苔叢生芽增殖圖;
圖12所示為武宣報春苣苔叢生芽增殖圖;
圖13所示為多痕報春苣苔芽苗生根圖;
圖14所示為永福報春苣苔芽苗生根圖;
圖15所示為豬耳朵芽苗生根圖;
圖16所示為疏脈半蒴苣苔芽苗生根圖;
圖17所示為武宣報春苣苔芽苗生根圖。
具體實施方式
本發明實施例公開了一種苦苣苔科植物組織培養方法,本領域技術人員可以借鑒本文內容,適當改進工藝參數實現。特別需要指出的是,所有類似的替換和改動對本領域技術人員來說是顯而易見的,它們都被視為包括在本發明內。本發明所述組織培養方法已通過較佳實施例進行了描述,相關人員明顯能在不脫離本發明內容、精神和范圍內對本文所述的組織培養方法進行改動或適當變更與組合,來實現和應用本發明技術。
以下就本發明所提供的一種苦苣苔科植物組織培養方法做進一步說明。
實施例1:本發明所述苦苣苔科植物組織培養方法
外植體滅菌:
取研究用健康苦苣苔植株(多痕報春苣苔、武宣報春苣苔、永福報春苣苔、疏脈半蒴苣苔、藥用報春苣苔、豬耳朵)的葉片和葉柄,用自來水沖洗干凈后,移入超凈工作臺,用75%酒精浸泡30~60s,無菌水清洗2次,然后用0.1%HgCl2(加2滴TWeen-20)溶液處理5min,無菌水清洗1次;再用0.1%HgCl2(加2滴TWeen-20)溶液處理一次,葉片2~3min,葉柄3~5min,無菌水清洗5~6次。將葉片或葉柄置于無菌濾紙上吸干水分,葉片剪成0.5cm×0.5cm大小的塊,葉柄切成0.5~1.0cm長的小段,待用。
愈傷組織誘導及不定芽分化:
將已滅菌并處理好的葉片,接種于初代誘導培養基中培養,培養溫度20~25℃,先進行暗培養,待愈傷長出后進行光培養(光照強度1500~2000lx,光照時間14h/d)。所用培養基為:(1)MS+TDZ 0.04mg/L+2,4-D 0.2~0.8mg/L+NAA 0.1~0.3mg/L,用于多痕報春苣苔、永福報春苣苔、藥用報春苣苔、豬耳朵的初代誘導培養;(2)MS+6-BA 0.8mg/L+KT 0.08mg/L+IAA 0.1mg/L,用于疏脈半蒴苣苔和武宣報春苣苔的初代誘導培養。其中培養基的蔗糖含量為20~25g/L,pH為5.8~6.0。
暗培養20~35d后,根據愈傷組織或芽的誘導分化情況將培養所得的愈傷組織或芽分別轉接到原培養基上進行光培養,各苦苣苔誘導分化情況見圖1-6。
增殖培養:
將初代培養所得的芽塊分割成每塊帶1~2個芽的小塊,轉入繼代培養基中進行增殖培養,培養溫度20~25℃,光照強度1500~2000lx,光照時間14h/d。所用培養基為:MS+TDZ 0.01mg/L+6-BA 0.4mg/L+NAA 0.05mg/L+CH 200mg/L,pH為5.8~6.0。約30d后,每個瓶內的有效苗(長出3~4片葉,葉綠而平展,生長正常的小苗)數均達30~40株,各苦苣苔叢生芽增殖情況情況見圖7-12。
生根培養:
將上述培養所得的無菌健壯有效苗轉接到生根培養基上進行生根培養,培養溫度20~25℃,光照強度1500~2000lx,光照時間14h/d。所用培養基為:1/2MS+IBA 0.2mg/L+IAA 0.1mg/L,培養基糖含量為20g/L,pH為6.0~6.2。培養1~2周后,無菌芽苗開始生根,獲得完整無菌苗,各苦苣苔生根情況見圖13-17。
實施例2:組織培養試驗
試驗對象:多痕報春苣苔、武宣報春苣苔、永福報春苣苔、疏脈半蒴苣苔、藥用報春苣苔、豬耳朵;
外植體:葉片和葉柄;
結果見表1。
表1
由表1結果可知,相比較現有專利的愈傷誘導率、不定芽分化率、叢生芽增殖系數以及生根率,本發明在各方面均達到了更優的效果,特別是叢生芽增殖系數是極其顯著的高于當前各專利技術中的效果。
以上所述只是用于理解本發明的方法及其核心思想,應當指出,對于本技術領域的普通技術人員來說,在不脫離本發明原理的前提下,可以對本發明進行若干改進和修飾,這些改進和修飾也落入本發明權利的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!