微過氧化物酶用于治療碳氧血紅蛋白血癥的用途的制作方法
本申請要求2014年5月22日提交的申請號為62/001,754的美國專利申請的權益,該申請在此通過引用全文納入本申請。
技術領域
本申請公開內容涉及能夠以高親和力結合一氧化碳的微過氧化物酶,及其用于治療碳氧血紅蛋白血癥和一氧化碳中毒的用途。
致謝政府支持
本發明是政府支持下做出的,該政府支持的授權號是HL103455,由美國國立衛生研究院授予。政府對本發明享有一定的權利。
背景技術:
對一氧化碳的吸入暴露是環境中毒的主要原因。個體可能在多種情況下暴露于空氣中的一氧化碳,例如房屋火災、使用發電機、或屋內使用戶外燒烤架、或在封閉空間中運行汽車的自殺嘗試期間。一氧化碳在細胞中結合血紅蛋白(產生碳氧血紅蛋白)和血紅素蛋白,特別是呼吸傳輸鏈的酶。結合至血紅蛋白和其它血紅素蛋白的一氧化碳的累積損害了氧化磷酸化作用的氧輸送和氧利用。這最終導致重要器官——如大腦和心臟——的嚴重缺氧和缺血性損傷。在其血液中累積大于15%的碳氧血紅蛋白的個體具有腦損傷和神經認知功能障礙的風險。含有更高水平的碳氧血紅蛋白的個體具有死亡的風險。存活的含有非常高水平的碳氧血紅蛋白的患者通常會遭受不可逆的腦損傷和腦死亡。
盡管利用標準動脈和靜脈血氣分析以及共血氧飽和度的方法可以快速診斷一氧化碳中毒,盡管意識到一氧化碳中毒的危險因素,但是對于這種有毒暴露沒有可用的解毒劑。當前療法是由面罩給予100%的氧氣,并且盡可能地使病人暴露于高壓氧氣。高壓氧氣療法的機制是氧氣會增加一氧化碳從血紅蛋白和組織的釋放速率,并加速一氧化碳的自然清除。然而,這種治療只對一氧化碳的清除速率具有不太大的作用,并且基于高壓氧氣設備的復雜性,這種療法無法在現場使用。
發明概要
需要一種有效的、快速的和容易獲得的療法治療碳氧血紅蛋白血癥(也稱為一氧化碳中毒)。本申請公開了微過氧化物酶能夠以高親和力結合一氧化碳(CO)并從血紅蛋白中取代CO,從而作為CO的清除劑發揮作用。本申請所公開的數據表明,分離或重組的微過氧化物酶可以用在例如從血液或動物組織的血紅蛋白中除去一氧化碳的方法中,以及用在治療碳氧血紅蛋白血癥的方法中。
本申請提供了一種治療受試者的碳氧血紅蛋白血癥的方法,該方法選擇具有碳氧血紅蛋白血癥的受試者,并向受試者施用治療有效量的分離或重組的微過氧化物酶,其中所述微過氧化物酶包括結合至卟啉部分的肽。在一些實施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非規范的氨基酸。
本申請進一步提供了一種從血液或組織的血紅蛋白中除去一氧化碳的方法,該方法使血液或組織與分離或重組的微過氧化物酶相接觸,其中所述分離或重組的微過氧化物酶包括結合至卟啉部分的肽。在一些實施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非規范的氨基酸。在一些實施方案中,該方法是體外方法。在其它實例中,該方法是體內方法,其中使血液或組織與分離或重組的微過氧化物酶相接觸包括向受試者施用該分離或重組的微過氧化物酶。
本申請還提供了確定分離或重組的微過氧化物酶的有效性的方法。
根據參照附圖進行的下面的詳細說明,本申請的前述和其它目的、特征和優點將更加顯而易見。
附圖的簡要說明
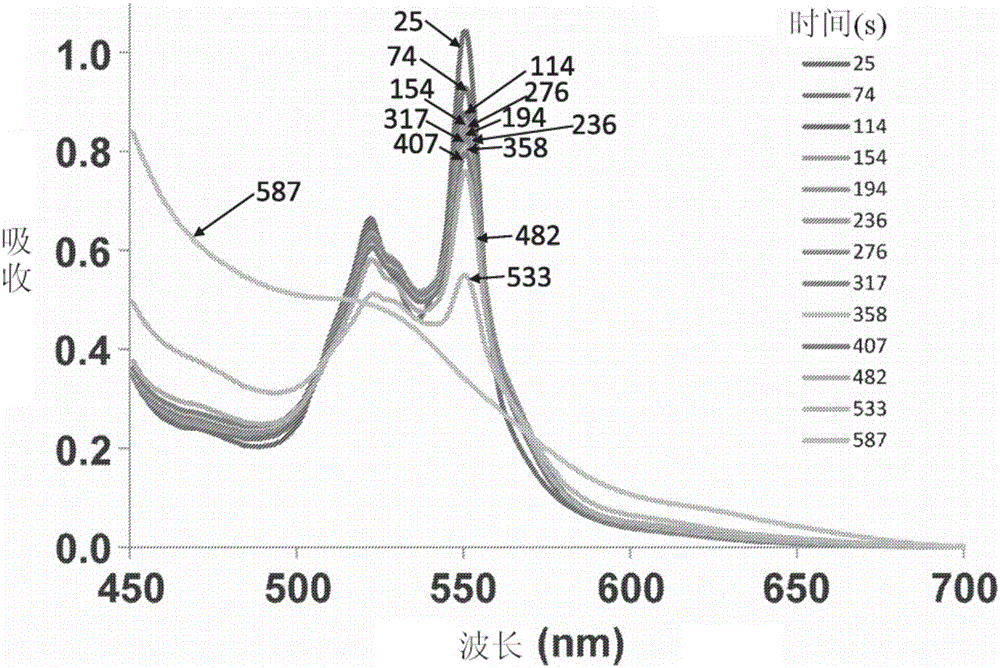
圖1:脫氧-MP11從紅細胞(RBC)中清除CO。該圖顯示了在與CO飽和的紅細胞(RBC-CO)混合后,微過氧化物酶-11(MP11)的光譜的吸收變化。MP11與RBC-CO混合,并在不同的時間點(25-587秒)上從反應混合物中提取樣品。MP11通過離心從RBC中提純。該光譜展示了脫氧-MP11(峰值在520和550nm)衰減形成CO結合的MP11。
圖2:MP11介導的從RBC中清除CO的動力學。在511nm處的吸收衰減后監測CO結合MP11的速率。每個數據點(*)表示所選擇的時間點測量值,實線表示單指數衰減擬合。
圖3:CO飽和的紅細胞與MP11的混合導致CO從血紅蛋白至MP11的凈轉移。數據點表示混合后在選定時間點上CO結合的(圓圈)或脫氧(*)血紅蛋白的相對量。實線表示單指數方程的擬合。
序列表
如37C.F.R.1.822所定義的,在所附的序列表中列出的氨基酸序列使用標準的三字母代碼表示氨基酸。序列表作為ASCII文本文件提交,創建于2015年4月28日,3.10KB,其通過引用納入本申請。在所附的序列表中:
SEQ ID NO:1是能夠結合卟啉部分的微過氧化物酶的氨基酸基序;在該序列中,Xaa是任何天然的或非規范的氨基酸。
SEQ ID NO:2和3是在所公開的方法中使用的重組微過氧化物酶的代表性氨基酸共有序列;在這些序列中,Xaa是任何天然的或非規范的氨基酸。
SEQ ID NO:4是微過氧化物酶-11(MP11)的肽部分的氨基酸序列。
SEQ ID NO:5是微過氧化物酶-6(MP6)的肽部分的氨基酸序列。
SEQ ID NO:6是微過氧化物酶-8(MP8)的肽部分的氨基酸序列。
SEQ ID NO:7是微過氧化物酶-9(MP9)的肽部分的氨基酸序列。
SEQ ID NO:8是微過氧化物酶-17(MP17)的肽部分的氨基酸序列。
SEQ ID NO:9是衍生自人細胞色素c的肽的氨基酸序列。
SEQ ID NO:10是衍生自馬細胞色素c的肽的氨基酸序列。
詳細說明
I.縮寫
CO 一氧化碳
Hb 血紅蛋白
HbA 血紅蛋白A
HbCO 碳氧血紅蛋白
MP 微過氧化物酶
RBC 紅細胞
RBC-CO 一氧化碳飽和的紅細胞
II.術語和方法
除非另有說明,否則技術術語按照常規用法使用。分子生物學中常用術語的定義可見Benjamin Lewin,Genes V,Oxford University Press出版,1994(ISBN 0-19-854287-9);Kendrew等(編),The Encyclopedia of Molecular Biology,Blackwell Science Ltd.出版,1994(ISBN 0-632-02182-9);和Robert A.Meyers(編),Molecular Biology and Biotechnology:a Comprehensive Desk Reference,VCH Publishers,Inc.出版,1995(ISBN 1-56081-569-8)。
為了方便理解本申請的各實施方案,下面提供了具體術語的解釋:
施用:通過任何有效途徑向受試者提供或給予藥劑,例如治療劑(如微過氧化物酶)。示例性的施用途徑包括,但不限于,注射或輸注(如皮下、肌內、皮內、腹膜內、鞘內、靜脈內、腦室內、紋狀體內、顱內和進入脊髓),口服、導管內、舌下、直腸、透皮、鼻內、陰道和吸入途徑。
解毒劑:中和或抵消毒藥作用的藥劑。
一氧化碳(CO):一種無色、無臭且無味的氣體,在濃度足夠高時遇到對人類和動物是有毒的。在正常的動物新陳代謝中也產生低水平的CO。
碳氧血紅蛋白(HbCO):一氧化碳(CO)和血紅蛋白(Hb)的穩定絡合物,當CO在正常的新陳代謝期間被吸入時或產生時在紅細胞中形成碳氧血紅蛋白。
碳氧血紅蛋白血癥或一氧化碳中毒:在血液中過量一氧化碳的存在導致的病癥。通常,暴露于100每百萬份(ppm)或更高的CO足以引起碳氧血紅蛋白血癥。輕度的急性CO中毒的癥狀包括頭暈、精神錯亂、頭痛、眩暈和流感狀效應;較大的暴露可導致中樞神經系統和心臟的明顯中毒,甚至死亡。在急性中毒后,經常出現長期后遺癥。一氧化碳也可對孕婦的胎兒產生嚴重影響。長期暴露于低水平的一氧化碳可導致抑郁、精神錯亂和記憶喪失。一氧化碳主要通過在血液中與血紅蛋白結合形成碳氧血紅蛋白(HbCO)而在人體中引起不良影響。這阻止氧氣結合血紅蛋白,降低血液的攜氧能力,導致缺氧。此外,認為肌紅蛋白和線粒體細胞色素氧化酶也被不利地影響。碳氧血紅蛋白可以還原為血紅蛋白,但因為HbCO絡合物相當穩定,恢復需要時間。目前的治療CO中毒的方法包括施用100%的氧氣或提供高壓氧氣療法。
接觸:以直接的物理關聯方式放置;包括固體和液體形式。在體內方法的上下文中使用時,“接觸”還包括施用。
血紅蛋白(Hb):在脊椎動物和其它動物的血液的紅細胞中的含鐵的運輸氧的金屬蛋白。在人類中,血紅蛋白分子是四種球狀蛋白質亞基的集合。每個亞基由與非蛋白血紅素基團緊密關聯的蛋白質鏈構成。每個蛋白質鏈在球蛋白折疊排列中排成一組相互連接的α-螺旋結構片段,稱作“球蛋白折疊排列”是因為這種排列與其它血紅素/球蛋白中使用的折疊基序相同。這種折疊模式包括強烈結合血紅素基團的口袋。
異源:異源蛋白質或多肽是指衍生自不同來源或物種的蛋白質或多肽。
分離的:“分離的”生物組分(例如核酸分子、蛋白質或細胞)已經基本上從該生物組分在其中自然存在的生物體本身或生物體的細胞、血液或組織的其它生物組分中分開或純化出來,例如其它染色體和染色體外DNA和RNA、蛋白質和細胞。已經“分離的”核酸分子和蛋白質包括通過標準純化方法純化的那些。該術語還包括在宿主細胞中通過重組表達制備的核酸分子和蛋白質,以及化學合成的核酸分子和蛋白質。
金屬離子:具有凈電荷的分類是金屬(如過渡金屬)的任何原子元素。在本申請的上下文中,卟啉部分的金屬離子通常(但不排他地)具有凈正電荷2+或3+。示例性的金屬離子包括二價鐵離子(Fe2+)和三價鐵離子(Fe3+)。
微過氧化物酶(MP):具有兩個半胱氨酸殘基的小肽,它共價結合至卟啉部分。微過氧化物酶通過細胞色素c蛋白水解或通過人工合成獲得。
非規范的氨基酸:不是在自然界中發現的并由遺傳密碼直接編碼的20種標準氨基酸的任何氨基酸。“非規范”的氨基酸也被稱為“非標準”或“非天然”的氨基酸。
肽或多肽:聚合物,其中單體是氨基酸殘基,它們通過酰胺鍵連接在一起。當氨基酸是α-氨基酸時,無論是L-光學異構體或是D-光學異構體都可以使用,優選的是L-異構體。本申請所用的術語“肽”、“多肽”或“蛋白質”意在涵蓋任何氨基酸序列并且包括經修飾的序列,包括經修飾的球蛋白。術語“肽”和“多肽”是特別意在涵蓋天然存在的蛋白質,以及通過重組或合成產生的蛋白質。
保守氨基酸取代是指,當發生取代時,對原蛋白質的性質干擾最少,即蛋白質的結構和特別是功能是保守的并且通過這種取代沒有顯著的改變。保守取代的實例如下表所示。
保守取代一般維持(a)多肽骨架在取代區域的結構,例如片狀或螺旋的構象,(b)分子在目標位點的電荷或疏水性,或(c)側鏈的體積。
一般預期使蛋白質性質產生最大變化的取代是非保守的,例如下列變化——其中:(a)親水性殘基,例如絲氨酸或蘇氨酸,取代(或被……取代)疏水性殘基,例如亮氨酸、異亮氨酸、苯丙氨酸、纈氨酸或丙氨酸;(b)半胱氨酸或脯氨酸取代(或被……取代)任何其它殘基;(c)具有正電性側鏈的殘基,例如賴氨酸、精氨酸或組氨酸,取代(或被……取代)負電性殘基,例如谷氨酸或天冬氨酸;或(d)具有大體積側鏈的殘基,例如苯丙氨酸,取代(或被……取代)不具有側鏈的殘基,例如甘氨酸。
藥學上可接受的載體:使用的藥學上可接受的載體是常規的。Remington’s Pharmaceutical Sciences,by E.W.Martin,Mack Publishing Co.,Easton,PA,15th Edition,1975描述了適用于本申請公開的組合物的藥學輸送的組合物和制劑。通常,載體的性質取決于所采用的具體施用模式。除了生物學上中性的載體,待施用的藥物組合物可含有少量的無毒輔助物質,如潤濕劑或乳化劑、防腐劑和pH緩沖劑等,例如乙酸鈉或脫水山梨醇單月桂酸酯。
卟啉:含四個吡咯環的有機化合物,作為血紅蛋白、葉綠素和某些酶中的金屬結合輔助因子起作用。
原卟啉:不含金屬的卟啉。原卟啉是四吡咯,其含有以下側鏈-甲基(4)、丙酸(2)和乙烯基(2)。原卟啉結合例如二價鐵以在血紅蛋白和肌紅蛋白中形成血紅素基團,并且結合三價鐵以在過氧化氫酶和某些細胞色素中形成血晶素基團。
原卟啉IX:輔基(如血紅素和細胞色素c)的前體。原卟啉IX與二價鐵(Fe2+)結合形成血紅蛋白的血紅素。
重組:重組核酸或蛋白質是具有非天然存在的序列或具有人工組合兩個原本分開的序列片段得到的序列的重組核酸或蛋白質。人工組合通常是通過化學合成或通過人工操作核酸的分離片段,例如通過基因工程技術,而完成。術語重組包括通過添加、取代或除去天然核酸分子或蛋白質的一部分而改變的核酸或蛋白質。
序列同一性/相似性:兩個或更多個核酸序列之間,或兩個或更多個氨基酸序列之間的同一性,由術語序列之間的同一性或相似性來表述。序列同一性可以用同一性百分比來量度;百分比越高,序列越相同。序列相似性可以用相似性百分比(其考慮保守氨基酸取代)來量度;百分比越高,序列越相似。在使用標準方法比對時,核酸或氨基酸序列的同系物或直系同源物具有相對較高的序列同一性/相似性。當直系同源蛋白質或cDNA衍生自更密切相關的物種(如人和小鼠的序列)時,與更遠相關的物種(如人類和線蟲的序列)相比,同源性更顯著。
用于比較的序列比對方法在本領域中是公知的。多種程序和比對算法描述于Smith&Waterman,Adv.Appl.Math.2:482,1981;Needleman&Wunsch,J.Mol.Biol.48:443,1970;Pearson&Lipman,Proc.Natl.Acad.Sci.USA 85:2444,1988;Higgins&Sharp,Gene,73:237-44,1988;Higgins&Sharp,CABIOS 5:151-3,1989;Corpetet al.,Nuc.Acids Res.16:10881-90,1988;Huang et al.Computer Appls.in the Biosciences 8,155-65,1992;和Pearson et al.,Meth.Mol.Bio.24:307-31,1994中。Altschul et al.,J.Mol.Biol.215:403-10,1990提供了詳細考慮的序列比對方法和同源性計算法。
NCBI基本局部比對搜索工具(BLAST)(Altschul et al.,J.Mol.Biol.215:403-10,1990)是可從幾個來源得到,包括國家生物信息中心(NCBI)和互聯網,該工具可與序列分析程序blastp、blastn、blastx、tblastn和tblastx聯合使用。更多信息可以在NCBI網站上找到。
受試者:活的多細胞生物體,包括脊椎動物生物體——一個包括人類和非人類哺乳動物的類別。
合成:通過人工裝置在實驗室中產生,例如合成多肽可以是在實驗室中化學合成的。
治療有效量:化合物或組合物(例如分離或重組的微過氧化物酶)的量,足以在所治療的受試者上實現所需的效果。例如,這可以是清除在血液或組織中的一氧化碳、降低血液中的HbCO水平、和/或減輕一個或多個與一氧化碳中毒有關的體征或癥狀所必需的量。
過渡金屬:一種元素,其原子具有部分充滿的d子殼,或其可產生具有不完整d子殼的陽離子。周期表的d區中列出了過渡金屬。過渡金屬包括,例如,鐵、鈷、鎳、銅、鋅、鈀、銀、鎘、鈧、鈦、釩、鉻、錳、釔、鋯、鈮、鉬、锝、釕、銠、鉿、鉭、鎢、錸、鋨、銥、鉑、金、汞、钅盧(rutherfordium),钅杜(dubnium),钅喜(seaborgium),钅波(bohrium),钅黑(hassium)和序麥(meitnerium)。
除非另有說明,本申請的所有的技術和科學術語具有與本申請公開內容所屬領域的技術人員的通常理解的相同的含義。單數術語“一”(“a”,“an”)和“該”(“the”)也可以理解為復數的,除非上下文另有明確的說明。“包括A或B”的意味著包括A、或B、或A和B。進一步地,可以理解針對核酸或多肽給出的所有堿基大小和氨基酸大小,以及所有分子重量或分子質量值都是近似值,而且是為說明的目的而提供的。盡管與本申請所述的內容類似或等同的方法和材料可以在本申請公開內容的實踐或測試中使用,但合適的方法和材料是如下所述的。本申請提及的所有出版物、專利申請、專利和其他參考文獻都通過引用全文納入本申請。在沖突的情況下,以本申請說明書——包括術語解釋——為準。另外,材料、方法和實施例僅是說明性的,而不是限制性的。
III.詳細說明
需要一種有效的、快速的和容易獲得的療法來治療碳氧血紅蛋白血癥(包括CO中毒)。本申請公開了微過氧化物酶能夠以高親和力結合一氧化碳(CO)并從血紅蛋白中取代CO,從而作為CO清除劑發揮作用。本申請公開的方法涉及分離或重組的微過氧化物酶從血液或組織的血紅蛋白中除去一氧化碳的用途,以及其用于治療碳氧血紅蛋白血癥(或CO中毒)的用途。
A.治療碳氧血紅蛋白血癥或一氧化碳中毒的方法
本申請提供了一種治療受試者的碳氧血紅蛋白血癥的方法,包括選擇具有碳氧血紅蛋白血癥的受試者,和向受試者施用治療有效量的分離或重組的微過氧化物酶,其中所述分離或重組的微過氧化物酶包括結合(如共價結合)至卟啉部分的肽。所述肽可以是線狀的或環狀的。
在一些實施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非規范的氨基酸。在一些實例中,所述肽的氨基酸序列包括X(1-20)CXXCH(SEQ ID NO:2)或X(1-20)CXXCHX(1-20)(SEQ ID NO:3),其中X是任何天然的或非規范的氨基酸。在具體的非限制性實例中,所述肽的氨基酸序列包括VQKCAQCHTVE(SEQ ID NO:4),這是MP11肽的序列。在一個實例中,所述肽的氨基酸序列由VQKCAQCHTVE(SEQ ID NO:4)組成。在其它實例中,所述肽的氨基酸序列包括CAQCHT(SEQ ID NO:5),CAQCHTVE(SEQ ID NO:6)、KCAQCHTVE(SEQ ID NO:7)、CKACHMVQAPDGTDIVK(SEQ ID NO:8)、GDVEKGKKIFIMKCSQCHTVE(SEQ ID NO:9)或GDVEKGKKIFVQKCAQCHTVE(SEQ ID NO:10),或由這些序列組成。在另外的其它實例中,所述肽的氨基酸序列包括具有1、2、3、4或5個氨基酸取代的SEQ ID NO:4-10的任一個。
微過氧化物酶的卟啉部分包括金屬離子。在一些實施方案中,該金屬是過渡金屬。在一些實例中,過渡金屬是鐵、鋅、鈀、錳、鈷、銅、鎳或鎘。在一個非限制性的實例中,過渡金屬是鐵。例如,在一些情況下,金屬鐵是二價鐵(Fe2+)。
在一些實施方案中,卟啉部分包括原卟啉IX。在一些實例中,原卟啉IX包括鐵離子,例如Fe2+。在其它實例中,鐵被替換為另一過渡金屬,例如,但不限于,鋅、鈀、錳、鈷、銅、鎳或鎘。
在一些情況下,選擇肽的氨基酸組成和/或卟啉部分的過渡金屬離子,以改變微過氧化物酶的一種或多種性質。例如,可進行對氨基酸序列和/或金屬離子的修飾以降低過氧化物酶活性、提高疏水性或親水性(以增加血漿半衰期或生物利用度)、和/或穩定血紅素結合。此外,可以選擇特定的氨基酸以允許環肽的生成。
在一些實施方案中,受試者在其血液中具有至少3%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%或至少50%的碳氧血紅蛋白(HbCO)(相對于總血紅蛋白)。用于測量HbCO方法,例如分光光度法或色譜法,是本領域公知的(參見,例如美國專利申請公布號2003/0202170;Rodkeyet al.,ClinChem 25(8):1388-1393,1979;Barker et al.,Anesthesiology105(5):892-897,2006)。
在一些實施方案中,分離或重組的微過氧化物酶是通過靜脈輸注施用的。
在一些實施方案中,向受試者施用的微過氧化物酶的劑量是約1克至約300克,例如約10克至約100克、約10克至約50克、約30克至約300克、或約30克至約150克。在具體的實例中,向受試者施用的微過氧化物酶的劑量是約1、約10、約20、約30、約40、約50、約60、約70、約80、約90、約100、約125、約150、約175、約200、約225、約250或約300克。
向受試者施用的分離或重組的微過氧化物酶可以是單一劑量,或是根據需要的多劑量形式,以使HbCO降至無毒的水平。
在一些實施方案中,向受試者施用的劑量是在受試者的血液和/或組織中減少HbCO至少1%、至少2%、至少3%、至少4%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%(相對于治療前的HbCO水平)所需的分離或重組的微過氧化物酶的量。
B.從血紅蛋白中除去一氧化碳的方法
本申請還提供了從血液或動物組織的血紅蛋白中除去一氧化碳的方法,包括使血液或組織與分離或重組的微過氧化物酶相接觸,其中所述分離或重組的微過氧化物酶包括共價結合至卟啉部分的肽。本申請進一步提供了減少在血液或動物組織中的碳氧血紅蛋白(HbCO)的方法,包括使血液或組織與分離或重組的微過氧化物酶相接觸,其中所述分離或重組的微過氧化物酶包括共價結合至卟啉部分的肽。該肽可以是線狀的或環狀的。制備環肽的方法是本領域公知的(例如見美國專利申請公開號2013/0310265;2012/0122799;和2011/0256567)。
在該方法的一些實施方案中,所述肽的氨基酸序列包括CXXCH(SEQ ID NO:1),其中X是任何天然的或非規范的氨基酸。在一些實例中,所述肽的氨基酸序列包括X(1-20)CXXCH(SEQ ID NO:2)或X(1-20)CXXCHX(1-20)(SEQ ID NO:3),其中X是任何天然的或非規范的氨基酸。在具體的非限制性實例中,所述肽的氨基酸序列包括VQKCAQCHTVE(SEQ ID NO:4),這是微過氧化物酶-11(MP11)的序列。在一個實例中,所述肽的氨基酸序列由VQKCAQCHTVE(SEQ ID NO:4)組成。在其它實例中,所述肽的氨基酸序列包括CAQCHT(SEQ ID NO:5)、CAQCHTVE(SEQ ID NO:6)、KCAQCHTVE(SEQ ID NO:7)、CKACHMVQAPDGTDIVK(SEQ ID NO:8)、GDVEKGKKIFIMKCSQCHTVE(SEQ ID NO:9)或GDVEKGKKIFVQKCAQCHTVE(SEQ ID NO:10),或由這些序列組成。在另外的其它實例中,所述肽的氨基酸序列包括具有1、2、3、4或5個氨基酸取代的SEQ ID NO:4-10的任一個。
微過氧化物酶的卟啉部分包括金屬離子。在一些實施方案中,該金屬是過渡金屬。在一些實例中,過渡金屬是鐵、鋅、鈀、錳、鈷、銅、鎳或鎘。在一個非限制性的實例中,過渡金屬是鐵。例如,在一些情況下,金屬鐵是二價鐵(Fe2+)。
在一些實施方案中,卟啉部分包括原卟啉IX。在一些實例中,原卟啉IX包括鐵離子,例如Fe2+。在其它實例中,鐵被替換為另一過渡金屬,例如,但不限于,鋅、鈀、錳、鈷、銅、鎳或鎘。
在一些情況下,選擇肽的氨基酸組成和/或卟啉部分的過渡金屬離子,以改變微過氧化物酶的一種或多種性質。例如,可進行對氨基酸序列和/或金屬離子的修飾以降低過氧化物酶活性、提高疏水性或親水性(以增加血漿半衰期或生物利用度)、和/或穩定血紅素結合。此外,可以選擇特定的氨基酸以允許環肽的生成。
在一些實施方案中,從血液或組織的血紅蛋白中除去一氧化碳的方法,或減少在血液或組織中的HbCO的方法,是體外方法。
在一些實施方案中,從血液或組織的血紅蛋白中除去一氧化碳的方法,或減少在血液或組織中的HbCO的方法,是體內方法,其中使血液或組織與分離或重組的微過氧化物酶相接觸,包括向受試者施用所述分離或重組的微過氧化物酶。
在一些實施方案中,在治療前受試者的血液中具有至少3%、至少5%、至少10%、至少15%或至少20%、至少30%、至少40%或至少50%的碳氧血紅蛋白(HbCO)。
在一些實施方案中,分離或重組的微過氧化物酶是通過靜脈輸注施用的。
在一些實施方案中,向受試者施用的微過氧化物酶的劑量是約1克至約300克,例如約10克至約100克、約10克至約50克、約30克至約300克、或約30克至約150克。在具體的實例中,向受試者施用的微過氧化物酶的劑量是約1、約10、約20、約30、約40、約50、約60、約70、約80、約90、約100、約125、約150、約175、約200、約225、約250或約300克。
向受試者施用的分離或重組的微過氧化物酶可以是單一劑量,或是根據需要的多劑量形式,以使HbCO降至無毒的水平。
在一些實施方案中,向受試者施用的劑量是在受試者的血液和/或組織中減少HbCO至少1%、至少2%、至少3%、至少4%、至少5%、至少10%、至少15%、至少20%、至少25%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、或至少90%(相對于治療前的HbCO水平)所需的分離或重組的微過氧化物酶的量。
C.微過氧化物酶的生產和合成
微過氧化物酶由共價結合至卟啉部分——例如血紅素——的肽組成,并且可以由天然存在的c型細胞色素衍生得到(Braun and-Meyer,Proc Natl Acad Sci USA 101(35):12830-12835,2004)。微過氧化物酶的肽鏈包括基序CXXCH(SEQ ID NO:1)。微過氧化物酶的卟啉部分通過硫醚鏈接到半胱氨酸側鏈上的方式,與肽共價結合(Speeet al.,Eur J Biochem241:215-220,1996)。
微過氧化物酶可以由c型細胞色素的蛋白水解消化生成。通過蛋白水解消化生成微過氧化物酶(如MP6、MP8、MP9、MP11、MP17和MP50)的方法先前已有描述(參見,例如Speeetal.,Eur JBiochem 241:215-220,1996;Rusvaiet al.,Biochem Pharmacol 37:4574-4577,1988;Nakamura et al.,Tetrahedron Lett 33:5409-5412,1992;Adams et al.,Biometals 7:214-220,1994;Aron et al.,J Inorg Biochem 27:227-243,1986)。MP6、MP8、MP9、MP11和MP50,其分別具有6、8、9、11和50個氨基酸的肽鏈,已由馬心臟細胞色素c衍生得到;MP17(具有17個氨基酸的肽),已由多能硫桿菌(Thiobacillus versutus)的細胞色素c550生成(Speeet al.,Eur J Biochem241:215-220,1996)。MP6、MP8、MP9、MP11和MP17肽的氨基酸序列如下所述:
MP6-CAQCHT(SEQ ID NO:5);
MP8-CAQCHTVE(SEQ ID NO:6);
MP9-KCAQCHTVE(SEQ ID NO:7);
MP11-VQKCAQCHTVE(SEQ ID NO:4);
MP17-CKACHMVQAPDGTDIVK(SEQ ID NO:8)。
本申請公開內容還預期使用替代的微過氧化物酶肽序列,例如下面所述的:
GDVEKGKKIFIMKCSQCHTVE(SEQ ID NO:9)
GDVEKGKKIFVQKCAQCHTVE(SEQ ID NO:10)。
SEQ ID NO:9和SEQ ID NO:10分別衍生自人和馬的細胞色素c。這些肽具有比SEQ ID NO:4的MP11肽更長的N-末端部分。在一些實施方案中,SEQ ID NO:9和SEQ ID NO:10在細菌中生成,例如大腸桿菌。
生成重組微過氧化物酶的生物合成方法也有描述(參見Braun and-Meyer,Proc NatlAcadSci USA 101(35):12830-12835,2004)。Braun和-Meyer描述了一種人工微過氧化物酶的體內合成方法,該方法利用大腸桿菌的分泌和細胞色素c成熟裝置。
在細菌中,c型細胞色素作為具有N-末端信號序列的多肽前體被合成,用于通過通用蛋白質II型分泌系統(Sec)輸出至周質。在易位后,用引導肽酶處理可溶性c型細胞色素(-Meyer and Künzler,Eur J Biochem246:794-799,1997)。血紅素與c型細胞色素的共價連接發生在細胞質膜的周質側。在大腸桿菌中,該工藝需要八個細胞色素c成熟蛋白質(CcmA-H)(-Meyeret al.,J Bacteriol 177:4321-4326,1995;Grove et al.,Mol Microbiol 19:467-481,1996)。在Braun和-Meyer描述的系統中,含有CXXCH(SEQ ID NO:1)基序的小肽在大腸桿菌周質中表達,并且使用組成式表達ccmA-H操縱子的質粒實現血紅素的共價連接,從而提供了一種生成在肽的氨基酸序列中發生變化的重組微過氧化物酶的方式。
微過氧化物酶,如MP8、MP9和MP11,也是市售可購的,如購自Sigma-Aldrich(St.Louis,MO)。
D.測試分離或重組的微過氧化物酶的有效性的方法
本申請還提供了測試分離或重組的微過氧化物酶的從血液或組織中除去HbCO的有效性的方法(也稱為從血液或組織中清除CO,例如從血液或組織的RBC血紅蛋白中清除)。在一些實施方案中,該方法包括使分離或重組的微過氧化物酶與HbCO相接觸(如接觸含CO飽和的紅細胞的樣品)持續一段時長,該時長足以允許CO向微過氧化物酶的轉移,并且測量HbCO隨時間的變化和/或脫氧-Hb隨時間的變化。HbCO隨時間的減少和/或脫氧-Hb隨時間的增加,表明重組微過氧化物酶在從血液或組織中除去HbCO方面是有效的。在一些實例中,HbCO的減少(和/或脫氧-Hb的增加))是約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%或約90%。
在其它實施方案中,所述方法包括使分離或重組的微過氧化物酶與HbCO(如CO飽和的紅細胞)接觸持續一段時長,該時長足以允許CO向微過氧化物酶(MP)的轉移,并且測量脫氧-MP隨時間的變化和/或CO結合的MP隨時間的變化。脫氧-MP隨時間的減少和/或CO結合的MP隨時間的增加,表明重組微過氧化物酶在從血液或組織中除去HbCO方面是有效的。在一些實例中,脫氧MP的減少(和/或CO結合的MP的增加)是約10%、約20%、約30%、約40%、約50%、約60%、約70%、約80%或約90%。
在一些實例中,足以允許CO轉移至微過氧化物酶的時長是約30秒、約1分鐘、約2分鐘、約3分鐘、約4分鐘、約5分鐘、約6分鐘、約7分鐘、約8分鐘、約9分鐘或約10分鐘。在一些實例中,HbCO、脫氧HB、脫氧MP和/或CO結合的MP隨時間的變化是通過分光光度法測量的,例如通過檢測在HbCO與微過氧化物酶接觸后微過氧化物酶光譜的吸收變化。
提供以下實施例用于說明某些具體特征和/或實施方案。這些實施例不應被解釋為將本申請公開內容限制于所描述的具體特征或實施方案。
實施例
實施例1:用微過氧化物酶從RBC血紅蛋白中除去CO
進行研究以確定微過氧化物酶是否能夠從紅細胞中清除CO。按照如下方案進行:
1.一氧化碳飽和的紅細胞(RBC-CO)和微過氧化物酶-11(MP11)在10mM連二亞硫酸鹽的存在下進行結合,得到50μM血紅蛋白A(HbA)和約100μM MP11的最終濃度。
2.取0.3mL的體積,微離心5秒。
3.取上清液,并放入空的微管中。
4.將含有10mM連二亞硫酸鹽和0.5%NP40的PBS加入RBC顆粒中。
5.重復步驟2-4,直至所有的反應體積耗盡。
6.立即測量在NP40/PBS中的RBC的吸收,然后測量上清液樣品(以相同的順序離心得到)的吸收。
在與RBC-CO混合之后MP11光譜的吸收變化如圖1所示。光譜表明脫氧MP11衰減形成CO結合的MP11。在511nm處的吸收衰減后監測CO結合MP11的速率。MP11介導的從紅細胞中清除CO的動力學如圖2所示。在與脫氧MP11混合后,血紅蛋白物質在選定時間點(0、2、4、6、8和10分鐘)的變化如圖3所示。脫氧Hb隨時間的增加(和相應的HbCO隨時間的減少)表明,CO-飽和的紅細胞與MP11的混合導致CO從血紅蛋白向MP11的凈轉移。因此,這些結果表明MP11從RBC血紅蛋白中清除CO。
實施例2:用分離或重組的微過氧化物酶治療受試者的方法
本實施例描述了分離或重組的微過氧化物酶用于治療患有碳氧血紅蛋白血癥(或CO中毒)的人類受試者的用途。
選擇被診斷患有或懷疑患有碳氧血紅蛋白血癥的受試者進行治療。向受試者施用治療有效量的分離或重組的微過氧化物酶,例如通過靜脈輸注施用。在一些實例中,微過氧化物酶是MP11,人類受試者被施用10-100克的MP11。在其它實例中,微過氧化物酶是重組的微過氧化物酶,人類受試者被施用30-300克的重組的微過氧化物酶。醫療從業者可以確定合適的治療劑量,并根據需要調整,以有效地降低受試者的HbCO。可以測量受試者的HbCO水平,以確定已施用有效劑量。可以根據需要提供額外的劑量,以減少HbCO至可接受的水平(例如對于吸煙者≤5%或對于吸煙者≤15%)。
鑒于本發明的原理可應用于許多可能的實施方案,應當認識到,所舉例說明的實施方案僅是本發明的優選實施例,而不應被視為對本發明范圍的限制。相反地,本發明的范圍由下面的權利要求限定。因此,我們要求將這些權利要求的范圍和主旨所涵蓋的所有實施方案作為本發明進行保護。
序列表
<110> 高等教育聯邦系統-匹茲堡大學
<120> 微過氧化物酶用于治療碳氧血紅蛋白血癥的用途
<130> 8123-92829-02
<150> US 62/001,754
<151> 2014-05-22
<160> 10
<170> PatentIn版本3.5
<210> 1
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<220>
<221> MISC_特征
<222> (2)..(3)
<223> Xaa = 任何天然的或非規范的氨基酸
<400> 1
Cys Xaa Xaa Cys His
1 5
<210> 2
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<220>
<221> MISC_特征
<222> (1)..(1)
<223> Xaa = 天然的或非規范的氨基酸的1-20個殘基的任意組合
<220>
<221> MISC_特征
<222> (3)..(4)
<223> Xaa = 任何天然的或非規范的氨基酸
<400> 2
Xaa Cys Xaa Xaa Cys His
1 5
<210> 3
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<220>
<221> MISC_特征
<222> (1)..(1)
<223> Xaa = 天然的或非規范的氨基酸的1-20個殘基的任意組合
<220>
<221> MISC_特征
<222> (3)..(4)
<223> Xaa = 任何天然的或非規范的氨基酸
<220>
<221> MISC_特征
<222> (7)..(7)
<223> Xaa = 天然的或非規范的氨基酸的1-20個殘基的任意組合
<400> 3
Xaa Cys Xaa Xaa Cys His Xaa
1 5
<210> 4
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 4
Val Gln Lys Cys Ala Gln Cys His Thr Val Glu
1 5 10
<210> 5
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 5
Cys Ala Gln Cys His Thr
1 5
<210> 6
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 6
Cys Ala Gln Cys His Thr Val Glu
1 5
<210> 7
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 7
Lys Cys Ala Gln Cys His Thr Val Glu
1 5
<210> 8
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 8
Cys Lys Ala Cys His Met Val Gln Ala Pro Asp Gly Thr Asp Ile Val
1 5 10 15
Lys
<210> 9
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 9
Gly Asp Val Glu Lys Gly Lys Lys Ile Phe Ile Met Lys Cys Ser Gln
1 5 10 15
Cys His Thr Val Glu
20
<210> 10
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成肽
<400> 10
Gly Asp Val Glu Lys Gly Lys Lys Ile Phe Val Gln Lys Cys Ala Gln
1 5 10 15
Cys His Thr Val Glu
20
- 還沒有人留言評論。精彩留言會獲得點贊!