丙型肝炎病毒輔助受體CD36的特異性抑制劑在制備防治丙型肝炎病毒感染藥物中的應用的制作方法
本發明涉及一種丙型肝炎病毒(hcv)輔助受體cd36蛋白的特異性抑制劑在防治hcv感染中的應用,特別涉及hcv輔助受體cd36蛋白的特異性抑制劑—磺基-n-琥珀酰亞胺油酸酯(sulfo-n-succinimidyloleate,sso)在防治hcv感染中的應用,本發明屬于生物醫藥領域。
背景技術:
丙型肝炎是一種由丙型肝炎病毒(hepatitiscvirus,hcv)感染引起的病毒性肝炎,呈全球性流行,據世界衛生組織篩查,過去15年,全球至少有1.85億人感染hcv,且每年新發丙型肝炎病例約3~4萬例。據統計,hcv急性感染后,大約86%的感染者不能自發清除病毒而變為慢性感染,繼而發展為慢性肝臟疾病,10%~20%的感染者進一步惡化造成肝硬化,約7%的肝硬化患者發展為肝細胞癌(hepatocellularcarcinoma,hcc),最終導致肝衰竭甚至死亡,每年大約有130萬人死于hcv慢性感染及相關疾病。而且,40%~74%的慢性感染患者伴有冷球蛋白血癥、周圍神經病變、雷諾氏綜合征以及干燥綜合征等肝外疾病。在未來20年,由hcv感染引起的肝臟疾病所導致的死亡將繼續上升。因此,hcv感染被認為是全球性的重大疾病,已成為嚴重的社會經濟和公共衛生問題。據衛生部公布的數據,近年來我國hcv感染報告病例數呈逐年上升的趨勢。
hcv存在非常高的基因多態性,目前普遍將hcv病毒株分為7種主要的基因型和67種亞型,各個基因型的全球地理性分布相對復雜,全世界發現最多的是1a和1b,被稱為“流行亞型”。我國的感染率為0.43%,中國大陸最常見的基因型是1b和2a,二者流行率為91.6%。
hcv是高復制病毒,在患者體內,每天可產生大約1萬億的病毒顆粒,由于病毒rna多聚酶沒有校正功能,復制具有高突變性,長期用藥易誘導產生耐藥病毒株,能夠逃脫宿主的免疫反應而使得hcv疫苗以及泛基因型抗病毒藥物的研發面臨巨大挑戰。到目前為止,依然沒有hcv的保護性疫苗能夠滿足臨床的需要。過 去幾十年,長效干擾素(peg-ifn-α)聯合利巴韋林(ribavirin,rbv)一直是歐洲肝臟研究學會(easl)批準的慢性丙型肝炎患者的標準治療方案,但感染患者的持續病毒應答率較低,且伴有嚴重的副作用。近年來國外研發小分子化合物,通過直接作用于病毒自身蛋白來抑制病毒的復制,初步研究顯示了很好的臨床應用前景,少數幾個已批準上市,還有部分直接抗病毒藥物(daas)正處于臨床在研,有望獲批用于hcv感染的治療,但這些化合物存在諸多缺點,如化合物主要是針對基因1型而其它基因型效果不好、不同程度地出現耐藥問題、對以往無效患者的總體療效明顯降低、對難治性患者的不可用藥問題、副作用問題使患者的依從性不好影響療效、靶點有限導致聯合方案有限、以及費用昂貴等,這將是今后抗hcv藥物研發所要面臨的巨大挑戰。
hcv依賴宿主存活并完成復制周期,近幾年來,宿主蛋白的深入探索為hcv感染的治療和抗hcv藥物的開發提供了新的策略和方向。通過調節宿主環境來抑制病毒的復制,與daas聯合治療慢性丙型肝炎,有望降低病毒的耐藥突變率從而達到更好的治療效果,逐漸成為抗hcv藥物研發的熱點,也是解決耐藥問題和對各種基因型hcv感染都有效的一個新思路。
在以宿主蛋白為靶點的抗hcv藥物的研究中,本發明證實,宿主分化簇36(clusterofdifferentiation36,cd36)蛋白的特異性抑制劑磺基-n-琥珀酰亞胺油酸酯(sulfo-n-succinimidyloleate,sso)通過阻斷cd36蛋白的輔助受體功能而顯示出強效的抗hcv活性。本發明提出了sso的抗hcv作用,迄今為止未見國內外相關文獻報道,研發此類藥物能夠為臨床抗hcv藥物特別是抗耐藥hcv藥物的研發提供新的思路和視角。
技術實現要素:
本發明的目的之一是提供丙型肝炎病毒(hcv)輔助受體cd36蛋白的特異性抑制劑,特別是磺基-n-琥珀酰亞胺油酸酯(sulfo-n-succinimidyloleate,sso)在制備防治hcv感染藥物中的應用;
本發明的目的之二是提供一種抗hcv的藥物組合物。
本發明的目的之三是提供所述藥物組合物在制備防治hcv感染藥物中的應用。
為了達到上述目的,本發明采用了以下技術手段:
本發明首先檢測了上述sso的體內安全性和體外毒性,然后檢測了sso的體外抗hcv活性以及與臨床已知抗hcv藥物的聯合用藥效果,并分析了所述sso 對耐藥hcv的抑制活性,最后分析了sso的作用機制。
本發明通過研究首次發現并證實hcv輔助受體細胞膜表面蛋白cd36的一種特異性抑制劑sso能夠通過直接與cd36結合,阻斷hcv感染的早期階段而發揮強效的抗病毒活性,具有很高的體外治療指數。sso的抗病毒機制不同于目前所有已知的臨床和在研的抗病毒藥物。sso與已知臨床應用的抗病毒藥物(vx-950或ifn-α)聯合應用,能夠顯著增強vx-950和ifn-α的抗病毒活性,且證實sso對已知臨床用藥telaprevir、simeprevir或sofosbuvir引起的耐藥病毒株也有顯著的抑制作用。另外,實驗證實口服sso后安全性好,對小鼠體重、存活率以及肝腎功能沒有影響。
因此,在上述研究的基礎上,本發明提出了hcv輔助受體cd36蛋白的特異性抑制劑在制備防治hcv感染藥物中的應用。
在本發明中,優選的,所述的hcv輔助受體cd36蛋白的特異性抑制劑為磺基-n-琥珀酰亞胺油酸酯(sulfo-n-succinimidyloleate,sso),其結構如式(i)所示:
在本發明中,所述的丙型肝炎病毒為hcv野生型或hcv耐藥病毒株。
在本發明中,優選的,所述的hcv耐藥病毒株為hcv蛋白酶抑制劑telaprevir耐藥株、hcv蛋白酶抑制劑simeprevir耐藥株或hcv多聚酶抑制劑sofosbuvir耐藥株。
進一步的,本發明還提出了一種抗hcv的藥物組合物,其含有磺基-n-琥珀酰亞胺基油酸酯以及另外一種或多種抗hcv的藥物。
在本發明,優選的,所述的藥物組合物中的另外一種或多種抗hcv的藥物包括但不限于特拉匹韋(vx-950)、α-干擾素(ifn-α)或其組合。
在本發明,優選的,所述的藥物組合物中還含有一種或多種藥學上可接受的載體。
再進一步的,本發明還提出了所述的藥物組合物在制備防治hcv感染藥物中 的應用。
本發明所述的cd36特異性抑制劑,特別是sso有望開發成為新型的防治hcv感染的藥物,并有望在將來通過與已知藥物聯合用藥,來完全清除丙肝病人體內的hcv病毒,尤其是可用于防治hcv感染導致的肝移植患者的hcv再感染。
附圖說明
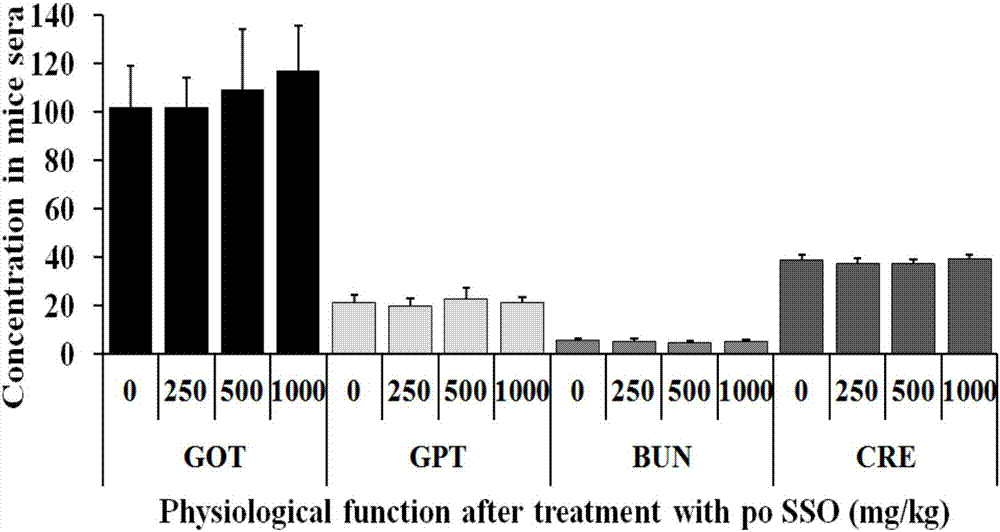
圖1為sso對小鼠體重的影響(n=10);
圖2為sso對小鼠肝腎功能的影響(n=10);
圖3為sso在細胞內抑制hcv復制(n=3);
圖3a為sso的細胞毒性以及rna水平抗hcv活性,圖3b為蛋白水平抗hcv活性;
圖4為sso增強vx-950的體外抗hcv活性;
圖4a為rna水平抗hcv活性(n=4);圖4b為蛋白水平抗hcv活性(n=4);**,與溶劑對照組比較,p<0.01;#,與vx-950單用組比較,p<0.05;
圖5為sso增強ifn-α的體外抗hcv活性;
圖5a為rna水平抗hcv活性(n=3);圖5b為蛋白水平抗hcv活性(n=3);*,與溶劑對照組比較,p<0.05;**,與溶劑對照組比較,p<0.01;#,與ifn-α單用組比較,p<0.05;
圖6為sso抑制hcv生活周期的早期階段(before,感染前2小時加藥處理細胞2小時);
圖6a為rna水平抗hcv活性(n=3);圖6b為蛋白水平抗hcv活性(n=4);**,與溶劑對照組比較,p<0.01;
圖7為sso抑制hcv生活周期的早期階段(during,感染同時加藥處理細胞2小時);
圖7a為rna水平抗hcv活性(n=3);圖7b為蛋白水平抗hcv活性(n=4);**,與溶劑對照組比較,p<0.01;
圖8為sso抑制hcv生活周期的早期階段(after,感染后2小時加藥處理細胞2小時);
圖8a為rna水平抗hcv活性(n=3);圖8b為蛋白水平抗hcv活性(n=3);
圖9為biacore實時分析sso與cd36蛋白間的相互作用曲線;
大圖為sso單濃度與cd36蛋白之間相互作用曲線;右下角插入的小圖為濃度 梯度的sso與cd36蛋白之間相互作用曲線;
圖10為cd36表達水平對sso抗hcv活性的影響。
圖10a為cd36低表達增強sso活性(n=3);圖10b為cd36高表達減弱sso活性(n=3)。*,與完全空白對照組比較,p<0.05;**,與完全空白對照組比較,p<0.01;##,與sso單用比較,p<0.01。
具體實施方式
下面結合具體實施例來進一步描述本發明,本發明的優點和特點將會隨著描述而更為清楚。這些實施例僅用于例證目的,絕不對本發明的范圍構成任何限制。
本發明中體外實驗所用sso均用dmso配制成20mm的母液,保存于-20℃,臨用前用完全培養液稀釋至工作濃度。體內實驗中sso用5%tween-80配制成相應濃度。
實施例1體外活性和安全性測定
1.1體內安全性測定
昆明種小鼠,4周齡,40只,體重19.0±1.0g。適應性喂養2天后(約21.0±1.0g),隨機分為4組,每組10只,雌雄各半,實驗動物使用許可證號為syxk(京)2012–0021。動物分組及給藥情況如表1所示,給藥前,小鼠稱重并禁食4~6小時。然后每組小鼠分別一次性灌胃給予對照溶媒(5%tween-80)或250mg/kg、500mg/kg和1000mg/kgsso并禁食4小時。給藥后小鼠正常飼養7天,每天觀察小鼠存活率和體重變化,第7天稱重并采集血液樣本,檢測樣本中谷草轉氨酶(glutamateoxaloacetatetransaminase,got)、谷丙轉氨酶(glutamate-pyruvatetransaminase,gpt)、尿素(bloodureanitrogen,bun)和肌酐(creatinine,cre)水平,以分析sso的體內安全性。
表1動物分組及給藥情況
結果:
sso對小鼠體重的影響如圖1所示,sso對小鼠肝腎功能的影響如圖2所示,從上述結果可以看出口服sso后安全性好,對小鼠體重、存活率以及肝腎功能沒有影響。
1.2細胞毒性測定
收集生長良好的細胞(huh7.5細胞或gs4.3細胞),用含10%胎牛血清的dmem培養液配細胞懸液,接種于96孔板內,每孔100μl,1×104個細胞/孔,37℃,5%co2孵箱培養24h后,加入以3倍梯度稀釋的sso藥物溶液,每個濃度設3個平行孔,最高濃度為100μm,并設置等量的dmso作為對照。藥物處理72h后,每孔加入mtt溶液10μl(5mg/ml),繼續培養4h后吸棄上清液,每孔加100μldmso,震蕩10分鐘以充分溶解甲瓚結晶。然后以630nm為參考波長,測定570nm處的吸光值。reed&muench法計算半數細胞毒性濃度(halfmaximalcytotoxicconcentration,cc50),結果如表2及圖3所示。
表2sso的抗hcv活性
1.3體外抗hcv活性
huh7.5細胞以3×104個/cm2密度種入6孔板或96孔板。培養24小時后,細胞感染hcv-2a(感染量為45iu/細胞)的同時,用不同濃度的sso藥物溶液處理,并以等量的dmso作為對照。處理72小時后,提取細胞內總rna(96孔板和6孔板)和總蛋白(6孔板),分別定量hcvrna以及hcvcore和ns3蛋白以分析化合物的體外抗hcv活性,并計算半數有效濃度(halfmaximaleffectiveconcentration,ec50)。
結果如圖3及表1所示,圖3a為sso的細胞毒性以及rna水平抗hcv活性,圖3b為sso蛋白水平抗hcv活性。
以上結果表明,sso對huh7.5細胞沒有毒性,且sso能夠抑制病毒rna的復制及hcvcore和ns3蛋白的合成,即sso具有體外抗病毒的活性。
實施例2sso增強已知抗hcv藥物的活性
huh7.5細胞感染hcv-2a(感染量為45iu/細胞)的同時,用sso(1.0μm)聯合vx-950(0.1μm)或聯合ifn-α(1.0u/ml)處理,以等量的dmso作為對照。72小時后提取細胞內總rna和總蛋白,分別定量hcvrna以及hcvcore和ns3蛋白以分析sso對vx-950或ifn-α的抗病毒活性的影響。
結果如圖4及圖5所示,以上結果表明:相較于單獨使用,sso與已知臨床應用的抗病毒藥物(vx-950或ifn-α)聯合應用,能夠顯著增強vx-950和ifn-α的抗病毒活性,說明sso與vx-950或ifn-α之間存在協同作用。
實施例3sso具有抑制耐藥hcv感染的活性
通過點突變,構建hcv耐藥病毒株(蛋白酶抑制劑telaprevir耐藥株(hcv-a156t)、蛋白酶抑制劑simeprevir耐藥株(hcv-s282t)和多聚酶抑制劑sofosbuvir耐藥株(hcv-d168v)),以檢測sso抗耐藥病毒的活性。huh7.5細胞以3×104個/cm2密度種入96孔板。培養24小時后,細胞感染耐藥hcv(感染量為45iu/細胞)的同時,用不同濃度的sso藥物溶液處理,以相應的耐藥藥物作為陰性對照,以等量的dmso作為空白對照。處理72小時后,提取細胞內總rna,定量hcvrna以分析sso的體外抗耐藥hcv活性,并計算ec50,結果如下表3-表5所示。
表3sso抗telaprevir耐藥hcv活性
注:wt(wildtype)為野生型hcv病毒株;hcv-a156t為telaprevir耐藥病毒株;耐藥倍數為藥物抗突變株活性ec50和抗野生株ec50的比值。
表4sso抗sofosbuvir耐藥hcv活性
注:wt(wildtype)為野生型hcv病毒株;hcv-s282t為sofosbuvir耐藥病毒 株;耐藥倍數為藥物抗突變株活性ec50和抗野生株ec50的比值。
表5sso抗simerevir耐藥hcv活性
注:wt(wildtype)為野生型hcv病毒株;hcv-d168v為simeprevir耐藥病毒株;耐藥倍數為藥物抗突變株活性ec50和抗野生株ec50的比值。
以上結果表明,sso對已知臨床用藥telaprevir、simeprevir或sofosbuvir引起的耐藥病毒株也有顯著的抑制作用。
實施例4sso治療hcv感染的作用機制
4.1sso抑制hcv感染的階段
huh7.5細胞以3×104個/cm2的密度種入6孔板培養。培養24小時后,感染hcv-2a,感染量為150iu/細胞。分別在感染前2小時(before)、感染的同時(during)或感染后2小時(after),各加入5μm、25μm的sso溶液處理,以等量的dmso作溶劑對照。hcv感染或sso處理2小時后,棄去藥物或/和感染液,細胞用pbs洗滌1次,加入新的完全培養液繼續培養。72小時后,提取細胞內總rna和總蛋白,分別定量hcvrna以及hcvcore和ns3蛋白以分析sso抑制hcv復制的環節。結果如圖6-圖8所示。
圖6a為hcv生活周期的早期階段(before,感染前加藥預處理細胞2小時)中,sso在rna水平的抗hcv活性;圖6b為sso在蛋白水平的抗hcv活性。圖7a為hcv生活周期的早期階段(during,感染同時加藥處理細胞2小時)中,sso在rna水平的抗hcv活性;圖7b為sso在蛋白水平的抗hcv活性,圖8a為hcv生活周期的早期階段(after,感染后加藥處理細胞2小時)中,sso在rna水平的抗hcv活性;圖8b為sso在蛋白水平的抗hcv活性。
以上結果表明,sso主要通過阻斷hcv感染的早期階段而發揮強效的抗病毒活性。
4.2sso與膜蛋白cd36的相互作用
4.2.1sso與cd36直接結合
采用biacore技術,實時觀察小分子化合物sso與cd36之間的相互作用。首先在293t/17細胞中,通過轉染高表達質粒cd36-ha誘導蛋白表達,借助融合的ha標簽蛋白純化得到目的蛋白cd36-ha,進行濃縮、脫鹽純化并定量。然后,將蛋白cd36-ha分別用ph4.0、4.5、5.0和5.5的醋酸鈉緩沖液稀釋成200μl濃度為80μg/ml的溶液,進行預富集,確定最佳偶條件均為ph4.5。接著用ph4.5的醋酸鈉緩沖液將cd36-ha稀釋至80μg/ml,通過氨基偶聯的方式,將其偶聯到cm5芯片上,并用nhs和edc活化芯片,用乙醇胺封閉(ethanolamine)芯片。偶聯結束后,cd36-ha的響應值分別為4800ru。用濃度為50μm的sso測試結合反應,并用不同的再生液再生芯片。并以單循環的方式,用濃度為0μm、50μm、100μm、200μm和500μm的sso溶液測試結合反應。
圖9為采用biacore實時分析sso與cd36蛋白間的相互作用曲線。大圖為sso單濃度與cd36蛋白之間相互作用曲線;右下角插入的小圖為濃度梯度的sso與cd36蛋白之間相互作用曲線。
以上結果表明:sso通過直接結合膜蛋白cd36發揮抗hcv活性。
4.2.2cd36表達水平影響sso藥效
huh7.5細胞以4.5×104個/cm2密度種入6孔板培養。培養24小時后,轉染0.2μgpcdna3.1(+)-cd36質粒(以等量的pcdna3.1(+)作對照)或150pmolcd36sirna(以等量的controlsirna-a作對照),轉染48h后,感染hcv-2a(感染量為150iu/細胞)的同時用5μm的sso溶液處理。2h后,細胞用pbs漂洗一次,然后加入正常培養液培養。96h后,提取細胞內總rna,定量hcvrna以分析cd36表達水平對sso抗hcv藥效的影響。
圖10為cd36表達水平對sso抗hcv活性的影響。該結果表明cd36低表達能夠增強sso活性(圖10a),而cd36高表達能夠減弱sso活性(圖10b)。
以上結果表明:sso通過直接與cd36結合,阻斷hcv感染的早期階段而發揮強效的抗病毒活性。
以上所述內容僅為本發明的優選實施例,對于本發明而言僅是說明性的,而絕非限制性的。本領域技術人員應該理解的是,在不偏離本發明的精神和范圍下可以對本發明技術方案的細節和形式進行修改或替換,但都將落入本發明的保護范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 作為AXL抑制劑的雜環化合物的制作方法與工藝
- HPTP?β抑制劑的制作方法與工藝
- 作為LSD1抑制劑的環丙胺的制作方法與工藝
- KRAS G12C的抑制劑的制作方法與工藝
- 調節雌激素受體突變體的方法和組合物與流程
- 作為PI3K抑制劑的吡啶并[1,2?A]嘧啶酮類似物的制作方法與工藝
- 作為PI3K抑制劑的吡啶并[1,2?A]嘧啶酮類似物的制作方法與工藝
- 包含Ⅲ類受體酪氨酸激酶抑制劑和烷基化組蛋白?脫乙酰酶抑制劑融合分子EDO?S101的藥物組合及其在治療癌癥中的用途的制作方法與工藝
- 包含Ⅲ類受體酪氨酸激酶抑制劑和烷基化組蛋白?脫乙酰酶抑制劑融合分子EDO?S101的藥物組合及其在治療癌癥中的用途的制作方法與工藝
- 新型雌激素相關受體α抑制劑及其醫學用途的制作方法與工藝
- 作為原肌球蛋白受體激酶(Trk)抑制劑的取代的吡唑并[1,5?a]吡啶的制作方法與工藝
- 一種核孤兒受體TR3抑制劑多肽及其應用的制作方法與工藝
- 程序性死亡受體1基因抑制劑及其制備方法與應用與流程
- 作為H3受體抑制劑的包含哌啶和哌嗪環的氨基甲酸酯/脲衍生物的制作方法與工藝
- 一種雄性激素受體抑制劑的結晶形式及其制備方法與流程
- 一種雄性激素受體抑制劑的結晶形式及其制備方法與流程
- 丙型肝炎病毒輔助受體CD36的特異性抑制劑在制備防治丙型肝炎病毒感染藥物中的應用的制造方法與工藝
- IRE?1α抑制劑的制造方法與工藝
- 白細胞介素?23受體的口服肽抑制劑以及其治療炎癥性腸病的用途的制造方法與工藝
- 一類孿藥型HMG?CoA還原酶抑制劑及其合成方法與制造工藝
- Flt3蛋白在制備肝癌對索拉菲尼療效評估試劑盒中的應用
- 用于治療癌癥的雄激素受體抑制劑與akt抑制劑的組合的制作方法
- 一種藥物中間體2-芳酰基吲哚衍生物的合成方法
- 一種作用于EGFR敏感突變激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤類化合物及 ...的制作方法
- 一種6-溴喹啉的制備方法
- 一種基于巢式復合cold-pcr的t790m突變檢測方法
- 具抗腫瘤活性的表皮生長因子受體酪氨酸激酶抑制劑irsf和irsh及其制備方法和應用
- 具抗腫瘤活性的表皮生長因子受體酪氨酸激酶抑制劑irsf和irsh及其制備方法和應用
- 一種多維替尼的制備方法
- 具有抗腫瘤活性的表皮生長因子受體酪氨酸激酶抑制劑nxgf和nxgh及其制備方法和應用