艾滋病生物細胞免疫治療儀的制作方法
本發明涉及醫學領域中艾滋病生物細胞免疫治療儀的制備及應用,主要用于艾滋病患者血細胞內、外艾滋病毒的清除,從而達到治療艾滋病的目的。
背景技術:
艾滋病是由人類免疫缺陷病毒(Human Immunodeficiency Virus,HIV)引起的傳染病,在全球廣泛流行,根據世界衛生組織(WHO)和聯合國艾滋病規劃署的有關報告,自1981年美國發現首例艾滋病病例以來,至今全球有208個國家和地區受到了艾滋病的嚴重威脅,約有4000萬人感染了艾滋病,死亡人數已超過2000萬,每天約有6000人成為艾滋病感染者,同時每天約有300多人死于艾滋病。在中國HIV感染者正處于高速增長期,目前已遠超過100萬。艾滋病已經成為繼腫瘤、心腦血管疾病、結核病、糖尿病后又一個人類面臨的重大感染性疾病,已成為全球關注的嚴重的公共衛生和社會問題。
人類免疫缺陷病毒是一種感染人類免疫細胞的慢病毒(Lentivirus),屬反轉錄病毒的一種,直徑約120納米,大致呈球形。病毒外膜是類脂包膜(來自宿主細胞),并嵌有病毒的蛋白gp120與gp41。gp41是跨膜蛋白,gp120位于表面,并與gp41通過非共價作用結合。向內是由蛋白p17形成的球形基質(Matrix),以及蛋白p24形成的半錐形衣殼(Capsid),衣殼在電鏡下呈高電子密度,內含有病毒的RNA基因組、酶(逆轉錄酶、整合酶、蛋白酶)以及其他來自宿主細胞的成分。
HIV進入人體后,首先被巨噬細胞吞噬,但HIV很快改變了巨噬細胞內某些部位的酸性環境,創造了適合其生存的條件,不但不被殺滅反而在其內繁殖。因為CD4是HIV的受體,所以經巨噬細胞內繁殖的HIV通過其囊膜蛋白gp120并在gp41的輔助下(gp41起著橋的作用,利用自身的疏水作用介導病毒囊膜與細胞膜融合)進入CD4+細胞(細胞、單核巨噬細胞、樹突狀細胞等),在細胞內迅速增殖,每天產生109~1010病毒顆粒,并不斷進入其他正常的和再生的CD4+細胞內復制,制造更多的病毒感染細胞,使外周血CD4+T細胞持續破壞、減少。HIV的gp120與CD4受體結合可直接激活受感染的細胞凋亡,甚至感染HIV的T細胞表達的囊膜抗原也可啟動正常T細胞,通過細胞表面CD4分子交聯間接地引起CD4+細胞的大量破壞,結果造成以CD4+T細胞缺損為中心的嚴重免疫缺陷,患者主要表現:外周淋巴細胞減少,T4/T8比例配置,對植物血凝素和某些抗原的反應消失,遲發型變態反應下降,NK細胞、巨噬細胞活性減弱,IL2、γ干擾素等細胞因子合成減少。CD4+T細胞是最重要的免疫細胞,感染者一旦失去了大量CD4+T細胞,整個免疫系統就會遭到致命的打擊,對各種疾病的感染都失去抵抗力。HIV進入宿主CD4+細胞后也可以表現為長期潛伏而不表現出臨床癥狀,其基因組RNA反轉錄成雙鏈DNA,與病毒整合酶進入宿主細胞核內,在整合酶的作用下,雙鏈DNA整合到宿主細胞基因組內,被整合的病毒DNA稱為前病毒,可潛伏數月甚至多年不復制,造成AIDS數月至多年的潛伏期。在AIDS的潛伏期,HIV主要在淋巴結的巨噬細胞和樹突狀細胞內繁殖,這些細胞是體內的HIV貯存庫,可釋放至外周血或轉染外周血中的CD4+T細胞,有絲分裂原、抗原、TNF、IL-2和淋巴素(LT)都能激發HIV前病毒基因在感染的CD4+T細胞內轉錄復制。經大量增殖后,HIV病毒顆粒不斷從被破壞的感染細胞釋放并游離于血液,然后再進入其他細胞繼續感染過程。
HIV感染后可刺激機體生產囊膜蛋白(Gp120,Gp41)抗體和核心蛋白(P24)抗體。在HIV攜帶者、艾滋病病人血清中測出低水平的抗病毒中和抗體,其中艾滋病病人水平最低,HIV攜帶者最高,說明該抗體在體內有保護作用。但抗體不能與單核巨噬細胞內存留的病毒接觸,且HIV囊膜蛋白易發生抗原性變異,原有抗體失去作用,使中和抗體不能發揮應有的作用。在潛伏感染階段,HIV前病毒整合入宿主細胞基因組中,因此HIV不會被免疫系統所識別,所以僅依靠自身免疫功能無法將其清除。另外一個很重要的原因應該是,根據抗體殺滅、清除抗原的機理推測,免疫性抗體與抗原結合后,如果要產生免疫效應,要么通過激活補體,介導ADCC效應溶解細胞性抗原,但HIV不是細胞性抗原;要么通過趨化作用吸引吞噬細胞吞噬清除抗原,但HIV反而在吞噬細胞內被保護、增殖;要么抗體與抗原結合起中和作用,使之失去感染力,但HIV抗原結構多變,往往使抗體難以識別。
從目前已用于臨床的艾滋病治療方法看,效果不那么理想:(1)HIV逆轉錄酶抑制劑:僅能防止尚未感染HIV的易感細胞感染,對已感染的細胞沒有治療作用,且毒副作用較多,包括腺粒體毒性、骨髓抑制、紅細胞性貧血、粒細胞和血小板減少、胰腺炎,加之交叉耐藥性的產生,這類藥已不單獨使用,主要做聯合用藥,且易產生耐藥變株,導致臨床療效下降或失效。(2)HIV蛋白酶抑制劑:易產生藥物性肝損傷、脂質代謝紊亂等毒副作用及耐藥性。(3)HIV整合酶抑制劑:通過抑制HIV病毒DNA與宿主細胞DNA整合而發揮作用,與HIV逆轉錄酶抑制劑和蛋白酶抑制劑聯合同時使用對抗病毒有協同作用。(4)抑制HIV病毒進入抑制劑:包括阻斷gp120與CD4結合、阻斷HIV與輔助受體結合、作用于gp41膜亞單位及作用于T淋巴細胞表面CC趨化因子受體5(CCR5)來阻斷HIV進入宿主細胞,但對肝和心臟有副作用。(5)細胞因子治療:主要用于調節T細胞動態平衡。(6)HIV疫苗治療:由于HIV的特殊性,如固有免疫不足以抵御HIV及其靶向破壞免疫系統,病毒突變迅速,導致至今尚未開發出真正安全有效的疫苗。(7)基因治療:HIV基因治療的研究從未間斷,包括反義技術、RNA誘餌、RNA干擾、細胞內抗體、顯性陰性突變體、自殺基因等,但進入II期臨床試驗階段的基因療法幾乎沒有。(8)單克隆抗體被動免疫療法:通過下調CD4+T細胞表面CCR5來降低HIV的易感性、延緩艾滋病的進展和減少HIV的擴散,中和單克隆抗體2G12、2F5和4E10應用于HIV感染者具有良好的耐受性和安全性,能延緩但不能阻止病毒的反彈(9)過繼性免疫細胞治療:體外大量培養HIV自體的CD4+T細胞時會導致病毒大量擴增,增加病毒感染的CD4+T細胞數量,而回輸CD4+T細胞可能會增加體內病毒復制的場所,導致病毒載量反彈,總體上看,過繼性免疫細胞治療無明顯的毒副作用,也未取得滿意的治療效果。
人類的吞噬細胞有大、小兩種,小吞噬細胞是外周血中的中性粒細胞,大吞噬細胞是血中的單核細胞和多種器官、組織中的巨噬細胞,兩者構成單核吞噬細胞系統。單核細胞由骨髓中的單核細胞前體發育分化而成,約占血液中白細胞總數的3%-8%,其體積較淋巴細胞略大,單核細胞在血液中僅停留12-24小時,然后進入結締組織或器官,發育成熟為巨噬細胞,巨噬細胞是單核吞噬細胞系統中高度分化、成熟的細胞類型,具有較強的吞噬功能,游走巨噬細胞大于單核細胞數倍,壽命較長,可在組織中存活幾個月,定居的巨噬細胞有不同的名稱,在肝中為枯否細胞、在腦中為小膠質細胞、在骨中為破骨細胞等,其表達Fc受體、C3b受體和CDl4,在固有免疫中發揮防御功能,也是參與適應性免疫的專職抗原提呈細胞。巨噬細胞表達的CD4分子,是艾滋病毒(HIV)的受體,HIV進入人體后,首先遭到巨噬細胞的吞噬,但HIV很快改變了巨噬細胞內某些部位的酸性環境,創造了適合其生存的條件,不但不被殺滅反而在其內大量繁殖聚集,轉而將HIV傳遞給CD4+T細胞。
有文獻報道,猴腎病毒40(SV40)可以使某些人類細胞發生永生化。Poulin DL、Kung AL和Sullivan CS等研究表明,SV40LT抗原基因的導入能加快轉化細胞的生長速率,永生化細胞在體外多次傳代后,仍具有相對穩定的增殖特性和功能狀態,同時也能保留其原始細胞的許多分化表型,可以用于人類和動物某些種類的細胞模型的建立。也有文獻報道,導入外源性hTERT可以使細胞保持正常表型及分化特征,近年來已利用hTERT成功建立了某些細胞的永生化細胞系,基本保持染色體穩定、分化正常、接觸抑制、無致瘤性等相對“正常”的生長特征,在口腔醫學領域,日本學者Kamata、Fujita和Fujii轉染hTERT建立了永生化人牙齦成纖維細胞、牙周細胞、牙髓細胞系和牙囊細胞系,細胞群體倍增數達150次以上,細胞均表現原有的生物學特性,誘導培養后都可以表達來源細胞的相關蛋白,Kitagawa等轉染hTERT建立了人成牙骨質細胞系,細胞倍增達200次以上,細胞分化標志物如堿性磷酸酶、I型膠原等表達穩定。近來的研究證明,猴腎病毒40(SV40)可以使某些人類細胞發生永生化,可使細胞渡過M1期后繼續存活、傳代培養20-30代,然后細胞又會進入危機期(M2期),細胞死亡率增加并伴染色體異常,分裂的細胞逐漸減少,絕大多數細胞發生死亡,而hTERT可以維持細胞染色體端粒的穩定,從而使細胞渡過危機期(M2期),可繼續存活、傳代達100-300代以上,所以用SV40和hTERT同時轉染人離體組織細胞建立永生化細胞系,SV40可以使細胞渡過M1期,hTERT可以使細胞渡過M2期,比單獨使用其中之一建立的細胞系更穩定、壽命更長。
但未見基于SV40LT和/或hTERT基因構建巨噬細胞系進而大量擴增以用于艾滋病治療的報道。
技術實現要素:
為了解決久攻不克的艾滋病治療領域的世界性難題,本發明人提出了本發明。
本發明的目的是要提供艾滋病生物細胞免疫治療儀;另一目的是要提供艾滋病生物細胞免疫治療儀的制備及應用方法。
本發明的目的是這樣實現的:制備能濾除多細胞結合而成的含有HIV的大體積細胞的血液分離器及能分離單個血細胞和血漿的血漿分離器,制備以T4 DNA連接經BamHI酶切質粒SV40LTag DNA和載體pcDNA3.1(-)DNA的產物而構建的SV40LTag-pcDNA3.1(-)重組子以及以Ligation Mix連接經EcoR I和Xho I雙酶切質粒pCIneo-hTERT和載體pLXSNneo的產物而構建的pLXSNneo-hTERT重組子,進而以脂質體聯合轉染巨噬細胞致其永生化,經擴增后配制于細胞凍存液,使細胞濃度達80%,然后灌注高生物相容性材料制成的能防止細胞及其碎片濾出并能為巨噬細胞吞噬HIV提供場所的凈化器,其中巨噬細胞株被固定在凈化器中起吞噬HIV之用,所制凈化器進而與血液、血漿分離器組合并附加計算機調控程序而制備艾滋病生物細胞免疫治療儀,體外循環中的血液被治療儀中的血液分離器濾除大體積的多核巨細胞、被血漿分離器分成血漿和單個血細胞,血漿經凈化器清除HIV后與單個血細胞匯合后回輸。
本發明由血液分離器、血漿分離器和凈化器構成,其中血液分離器的孔徑為150~250μm、50~150μm、15~40μm、8~15μm、5~8μm、3~5μm、1~2μm,能濾除血液中HIV感染細胞形成的多核巨細胞或多細胞聚合體,血漿分離器能分離中等體積的單個血細胞和血漿,血漿凈化器中的凈化劑為巨噬細胞株,配制于細胞凍存液后便于長期低溫保存備用,因巨噬細胞表達的CD4分子是艾滋病毒的受體,具有天然吞噬HIV的特性,本發明模擬巨噬細胞在體內非特異性吞噬的模式,當含有HIV的血漿流經凈化器時,HIV與巨噬細胞發生接觸而被吞噬,隨之被阻留于凈化器內,所以在艾滋病血漿凈化治療的體外循環中,含有大量HIV的大體積細胞首先被血液分離器濾除,而血漿中游離的HIV被凈化器清除,凈化后的血漿與中等體積的單個血細胞匯合后回輸,從而清除結合在細胞表面和/或細胞內的HIV以及游離于血漿的HIV。本發明以體外濾除HIV的方法替代長期以來無法有效殺滅HIV的常規體內抗逆轉錄藥物治療方法。
具體實施方式
圖1是根據本發明提出的艾滋病生物細胞免疫治療儀的應用示意圖。
圖2是根據本發明提出的血液分離器的內部結構示意圖。
圖3是根據本發明提出的血漿分離器的內部結構示意圖。
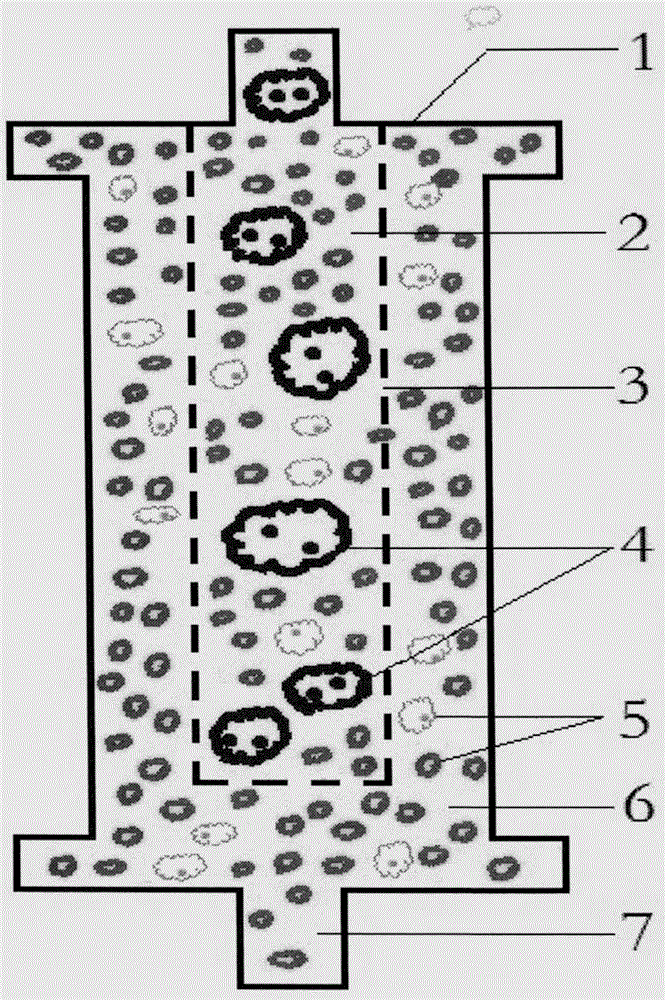
圖4是根據本發明提出的凈化器的內部結構示意圖。
圖1中,動脈血路管(1)的一端與動脈血管相連通,另一端經肝素和血液泵(2)與含有廢液出口(5)的血液分離器(3)相連,血液分離器(3)經血液出口(4)、血液泵(6)、循環管路(7)與血漿分離器(8)相連,血漿分離器(8)的血漿出口經血漿泵(9)和血路管(10)與兩個并聯的凈化器(11)和凈化器(12)相連,兩個凈化器的出口管路(13)與血漿分離器(8)的血細胞出口管路(14)匯合后經靜脈管路(15)匯流體循環。
圖2表示圖1中的血液分離器(3)的內部結構。圖2中,分離器(1)的內腔(2)的管壁上有很多微孔(3),多核巨細胞(4)不能濾過微孔(3)而被阻留在內腔(2),從而可被清除,能通過微孔(3)的中、小體積的單個血細胞(5)進入外腔(6),然后經出口(7)流出,進而經圖1所示的血漿分離器(8)分離出血細胞和血漿。
圖3表示圖1中的血漿分離器(8)的內部結構。圖3中,1是血漿分離器,2是血漿分離器內腔,3是血漿分離器內腔管壁上的微孔,4是不能通過微孔(3)的單個血細胞,5是能通過微孔(3)的血漿化學成份,6是血漿分離器外腔,7是血漿流出口,8是具有可開關閥門的血細胞出口。
圖4中,1為凈化器,2為凈化器中的巨噬細胞株;3為與血漿一起進入凈化器的HIV,4為HIV被凈化器中的吞噬細胞吞噬后不再下移的吞噬體,5為巨噬細胞產生的巨噬細胞因子。
下面結合圖1、圖2、圖3和圖4,對本發明提出的艾滋病生物細胞免疫治療儀的實施方案作詳細的描述。
一、構建巨噬細胞株
(一)分選巨噬細胞
1、采集原代細胞
(1)采集單個核血液細胞:指以密度梯度離心法從血液中分離的淋巴細胞和單核巨噬細胞。具體方法是:購買血液中心的濃縮白細胞或為科研而保存的臍帶血,取2mL標本,PBS液將血液稀釋2~3倍,充分混勻后將6mL抗凝血用滴管沿管壁緩慢疊加于已加入4mL淋巴細胞分離液的10mL離心管中水平離心機中水平離心(400r/min,20℃)35min;離心后管內分為3層,上層為血漿和PBS液,下層主要為紅細胞和粒細胞,中層為淋巴細胞分離液,在上、中層界面處有一以單個核細胞為主的白色云霧層狹窄帶為PBMC,用毛細吸管插到云霧層,吸取PBMC置入另一50mL離心管中,加入5倍以上體積PBS離心(300r/min,20℃)10min,棄上清50mLPBS重懸細胞,離心(350r/min,20℃)15min,棄上清,加入Buffer(PBS+0.5%新生牛血清+2mmol/LEDTA,pH7.2)2mL重懸細胞,取15uL細胞懸液加入血球計數板上顯微鏡下計數4個大方格內的細胞(PBMC)總數。(2)采集單個核組織細胞:由浙江大學組織工程研究平臺提供。實質上屬于來自脾臟的巨噬細胞,其制備方法是:①脾臟組織的獲取和轉運:在論理委員會批準和患者知情同意下,取手術切除的脾臟標本組織,立即剪碎成體積約1mm3的小組織塊,移入裝有預冷4℃的無菌密封瓶內,迅速轉運至細胞培養室。②脾臟組織細胞混懸液的制備:將脾臟組織塊移至無菌操作臺,PBS洗滌3次,RPMI-1640洗滌2次,以清除組織內的血液并保證組織的無菌。機械研磨脾臟組織,這時便有大量的組織細胞懸混于RPMI-1640液中。用200目不銹鋼濾網過濾懸混有組織細胞的RPMI-1640液,濾液為脾臟組織細胞混懸液(主要含紅細胞、淋巴細胞、巨噬細胞等)。③脾臟組織細胞混懸液中紅細胞的裂解:然后用RPMI-1640液洗滌離心(1000r/min,3min),以去除細胞碎屑,加入Tris-NH4Cl作用5min,裂解紅細胞,迅速離心(1000r/min,3min),去除上清液內的裂解紅細胞碎片,PBS洗滌離心3次,RPMI-1640洗滌離心1次,以清除混懸液中殘存的Tris-NH4Cl,避免其影響細胞的存活,此時,混懸液中主要含脾臟組織巨噬細胞和淋巴細胞。④脾臟組織巨噬細胞的貼壁培養:將前述混懸液作為培養細胞原液,臺盼藍染色判定活力并計數,用RPMI-1640液調整細胞濃度為(3~5)×106/L,將調整好濃度的細胞懸液接種于玻璃培養瓶內,培養條件為37℃,50mL/LCO2,100%濕度,分別培養2~3h,相差顯微鏡下觀察形態。貼壁脾臟組織巨噬細胞的消化:貼壁脾臟組織巨噬細胞的消化:吸去培養上清液,巨噬細胞貼壁,PBS反復吹打、消化,所得細胞懸液洗滌離心(1000r/min,3min),得到分離純化的巨噬細胞。此外,還可以取治療或手術后廢棄的標本提取制備,如腹膜腔液、肺泡、肝臟、脾臟、腹膜組織、小腸黏膜等。(3)采集羊水、絨毛細胞:浙江大學附屬婦產科醫院生殖遺傳實驗室備用。在論理委員會批準和患者知情同意下,取實驗診斷報告后的剩余羊水、絨毛細胞,選擇對數生長期細胞留用。
2、分選貼壁細胞(巨噬細胞初步貼壁分選)
按常規細胞培養,但根據細胞性質的不同,適當調整培養時間,培養條件等,一般貼壁法將單個核血液細胞(PBMC)或單個核組織細胞(巨噬細胞)置于含有RPMI-1640培養基的培養皿中,于37℃,5%CO2的細胞培養箱(Themo electro corporation CLASS 100,美國)中孵育2h,待單個核細胞貼壁后,吸棄上層懸浮細胞(巨噬細胞以外的細胞不易貼壁而隨上層液除去),PBs緩沖液輕輕洗滌3遍,加入少量RPMI-1640培養基,用細胞刮刀刮下貼壁細胞(主要為巨噬細胞,但還有少量其他貼壁細胞)。1 000r/min離心5min,棄上清。羊水細胞、絨毛細胞培養1~7天,出現細胞生長克隆、細胞生長匯合率達到60~80%的對數生長期細胞,以胰酶消化,PBS清洗,獲取細胞懸液,配成合適細胞濃度。
3、分選CD4細胞
采用免疫磁珠法分選CD4細胞:①主要試劑和儀器:CD4免疫磁珠(德國美天旎生物技術有限公司);0.2%臺盼藍染色液(上海生工生物工程技術服務公司);新生牛血清(Hyclone公司);MiniMACS磁力分離系統(德國美天旎生物技術有限公司)。②CD4細胞免疫磁珠分選方法:細胞懸液均分至兩個1.5mLEppendorf管,離心(300r/min,20℃)10min,棄去上清,重懸細胞每80uLBuffer含細胞數107個,每107個細胞加20uLCD4MicroBeads或CD8MicroBeads,充分混勻,在4~8℃孵化15min,用1mLBuffer洗滌細胞,離心(300r/min,20℃)10min,棄去上清500uLBuffer重懸細胞,將MS分離柱放置在MACS分離器的磁場中,以500uLBuffer漂洗,將500uL細胞懸液通過分離柱,用500uLBuffer沖洗分離柱重復操作3次,收集流出液,流出液中含非CD4細胞,自分離器中取出分離柱,用1000uLBuffer加壓沖洗分離柱,收集流出液,此為CD4細胞(細胞活力檢測:細胞純化前后分別取15uL細胞懸液與等體積臺盼藍溶液混合,顯微鏡下觀察不著色發亮者為活細胞,著色脹大者為死細胞,計算200個細胞中活細胞的百分比)。此時分選的細胞主要為巨噬細胞。
4、分選CDl4細胞(分選巨噬細胞)
CDl4為單核細胞和巨噬細胞特有的表面標志,理論上如果從單個核組織細胞、羊水細胞及絨毛細胞中分選,則所得細胞為巨噬細胞;如果從單個核血液細胞中分選,則所得細胞包括單核細胞和巨噬細胞;但因單核細胞壽命短、僅在外周血中存活1天且遠不如巨噬細胞易于貼壁生長,所以在本發明的細胞貼壁培養中已基本除去,分選出來的細胞基本為巨噬細胞。
基本方法類同于CD4細胞,采用免疫磁珠法。①試劑:人CDl4免疫磁珠試劑盒(Miltenyi Biotec,德國),RPMI-1640培養基(Hyclone,美國);②免疫磁珠法:(A)磁珠與特異性靶細胞一單核細胞結合:每1×108個PBMC加入200uL偶聯CDl4抗體的磁珠和800uL緩沖液(含有10%的牛血清白蛋白2.5mL和2mol/L EDTA0.5mL,4℃冰箱預冷),在15mL離心管中充分混勻,4℃孵育15min,中間可輕微振搖1次。15min后取出離心管,每1×107個細胞加入1~2mL預冷緩沖液,1 000r/min,離心8min,棄上清,加入0.5mL緩沖液并吹打成單細胞懸液。(B)收集磁珠標記的單核細胞:將細胞分離柱置于MACS磁力架上,加入1mL緩沖液平衡細胞分離柱,待無液體滴下,立即將上述細胞懸液加人細胞分離柱中,用0.5mL緩沖液沖洗細胞分離柱3次。待沖洗完畢后,加入1mL緩沖液,從磁力架中移出細胞分離柱,用針柱快速推動,沖出在分離柱中與CDl4抗體一磁珠相結合的細胞,即為CDl4+的巨噬細胞。
此外,還可采用以下2種方法分選,包括①貼壁法:將PBMC置于含有RPMI-1640培養基的培養皿中,于37℃,含5%CO:的細胞培養箱(Themo electro corporation CLASS 100,美國)中孵育2h。待單核細胞貼壁后,吸棄上層懸浮細胞,PBs緩沖液輕輕洗滌3遍,加入少量RPMI-1640培養基,用細胞刮刀刮下貼壁細胞。1 000r/min離心5min,棄上清。②流式細胞術法:CDl4標記:取PBMC,用緩沖液(含有10%的牛血清白蛋白2.5mL和2mol/LEDTA 0.5mL)調整細胞密度為1×108/mL,在每毫升細胞懸液中加入CDl4+-FITC抗體100uL,4℃避光標記18min,再向離心管中加入1mL流式緩沖液以終止染色,PBs洗滌3次,用含2%青鏈霉素的PBS調整細胞密度為2×107/mL。流式細胞儀分選:將制備的細胞在流式細胞儀(BD FAcsAria II,美國)上分選,根據CDl4抗體的熒光強度、細胞的相對大小以及細胞的相對顆粒性和內部結構的復雜性,收集CDl4+細胞(巨噬細胞)備用。
(二)構建SV40LT/pcDNA3.1和hTERT/pLXSNneo重組子
1、提取SV40LT和hTERT基因
(1)SV40LT和hTERT的提取:(I)酶切SV40LT和hTERT:①酶切SV40LT:從市售購買含有大T抗原基因的SV40冰凍干粉或SV40質粒,溶解于適量的H2O或TE緩沖液中,加2uL10×酶切緩沖液、18uL H2O和限制性內切酶BamH I(1-5U/ugDNA),37℃溫育1h,75℃加熱15min,滅活酶,加入5uL電泳加樣緩沖液(也可通過加入0.5mol/L EDTA)終止反應以備電泳。②酶切hTERT:hTERT位于質粒pClneo-hTERT的EcoRI與SalI位點之間,pLXSNneo載體多克隆位點(MCS)含EcoRI與XhoI酶切位點。從市售購買pCIneo-hTERT質粒,溶解于適量的超凈H2O或TE緩沖液中,加2uL10×酶切緩沖液和18uL H2O,加入限制性內切酶EcoR I和Xho I各0.5ul,37℃溫育1h,75℃加熱15min,滅活酶,加入5uL電泳加樣緩沖液(也可通過加入0.5mol/L EDTA)終止反應,按常規PCR法擴增hTERT后,收取擴增物以備電泳。(II)SV40LT和hTERT電泳:①SV40LT(SV40DNA)電泳:取電泳級瓊脂糖以電泳緩沖液配成10%瓊脂糖凝膠,倒入已封好的凝膠灌制平臺上,插上樣品梳,待膠凝固后從制膠平臺上除去封帶,拔出梳子,放入加有足夠電泳緩沖液的電泳槽中,緩沖液高出凝膠表面約1mm,用適量的10×加樣緩沖液制備DNA樣品,然后用移液器將樣品加入樣品孔中,并同時做合適的DNA分子量標準對照物,接通電極,使DNA向陽極移動,在1-10V/cm凝膠的電壓下電泳至足夠分離DNA片段的距離時,關閉電源。②hTERT電泳:取電泳級瓊脂糖以電泳緩沖液配成10%瓊脂糖凝膠,倒入已封好的凝膠灌制平臺上,插上樣品梳,待膠凝固后從制膠平臺上除去封帶,拔出梳子,放入加有足夠電泳緩沖液的電泳槽中,緩沖液高出凝膠表面約1mm,用適量的10×加樣緩沖液制備hTERT酶切樣品,然后用移液器將樣品加入樣品孔中,并同時做合適的標準對照物,接通電極,使hTERT向陽極移動,在1-10V/cm(80V)凝膠的電壓下電泳至足夠分離hTERT片段的距離時(30min),關閉電源。(III)SV40LT和hTERT純化與回收:①SV40LT純化與回收:從瓊脂糖中分離出約2600bp SV40大T抗原DNA:在300-360nm長波紫外光源下(使用長波紫外光源以防止DNA損傷)將含目標DNA片段的凝膠條帶切下裝入透析袋中,向透析袋內加入2ml電泳緩沖液,使之浸沒凝膠,并排空汽泡,將透析袋水平放入電泳槽(長度方向與電泳平行),加入適量緩沖液將透析袋浸沒(約6-7mm),接通電源,150伏電洗,在紫外燈下觀察待DNA全部移出凝膠,改變電場方向繼續通電1分鐘,從透析袋中吸出緩沖液于1-5ml Eppendorf管中,加入1.5倍體積正丁醇,混勻抽提去EB,在臺式離心機上最高速2分鐘,吸去上層正丁醇溶液,如此重復二次,在下層DNA的溶液中加入等體積酚氯仿(2個)抽提2次,上清液轉入到另一Eppendorf管中加入1/10倍體積3M NaAc、2倍體積預冷無水乙醇,于20℃過夜,12000g,4℃下離心10分鐘,得DNA沉淀,棄上清,加入70%乙醇洗滌2次后棄干乙醇,加入50μl TE溶解DNA。此外,還可用低熔點瓊脂糖凝膠法、DNA濾膜插片法等將目的DNA片段從凝膠中分離、純化出來。②hTERT純化與回收:從瓊脂糖中分離hTERT條帶:在長波紫外光源下將含目標hTERT片段的凝膠條帶切下裝入透析袋中,向透析袋內加入2ml電泳緩沖液,使之浸沒凝膠,并排空汽泡,將透析袋水平放入電泳槽(長度方向與電泳平行),加入適量緩沖液將透析袋浸沒(約6-7mm),接通電源,150伏電洗,在紫外燈下觀察待hTERT全部移出凝膠,改變電場方向繼續通電1分鐘,從透析袋中吸出緩沖液于1-5ml Eppendorf管中,加入1.5倍體積正丁醇,混勻抽提去EB,在臺式離心機上最高速2分鐘,吸去上層正丁醇溶液,如此重復二次,自下層hTERT的溶液中加入等體積酚氯仿(2個)抽提2次,上清轉入另一Eppendorf管中加入1/10倍體積3M NaAc、2倍體積預冷無水乙醇,于20℃過夜,12000g,4℃下離心10分鐘,得hTERT沉淀,棄上清,加入70%乙醇洗滌2次后棄干乙醇,加入50μl TE溶解hTERT。此外,還可用低熔點瓊脂糖凝膠法、hTERT濾膜插片法等將目的hTERT片段從凝膠中分離、純化出來。
2、構建SV40LT/pcDNA3.1重組子
取9μl上述DNA成份(0.1-5μg)、10μl 2×連接緩沖液、1μl 10mmol/L ATP、T4 DNA連接酶(20~500粘性末端單位)或大腸桿菌DNA連接酶、pcDNA3.1空載體混合,15℃溫育24h,構建成SV40LT/pcDNA3.1重組子。
3、構建hTERT/pLXSNneo重組子
取9μl上述純化的hTERT成份(0.1-5μg)、1μl 10mmol/L ATP、10ul Ligation Mix或大腸桿菌DNA連接酶、2ul pLXSNneo空載體混合,15℃溫育24h,構建pLXSNneo-hTERT重組子。
4、純化、擴增、鑒定SV40LT/pcDNA3.1和hTERT/pLXSNneo重組子
(I)SV40LT/pcDNA3.1重組子的擴增、分離與鑒定:①大腸桿菌感受態的制備:其基本方法是用冰預冷的CaCl2或多種2價陽離子等處理細菌,使之進入感受態得以轉化,用CaCl2制備新鮮或冷凍的大腸桿菌感受態細胞,常用于成批制備感受態細菌,本法適用于大多數大腸桿菌菌株,操作過程簡述如下:從37℃培養16~20h的新鮮平板中挑取一個單菌落(如大腸桿菌DH52),或1ml新鮮的16~20h過夜培養物,轉到一個含有100mlLB培養基的1L或500ml燒瓶中,于37℃劇烈振搖培養約2~3h(旋轉搖床200~300r/min),每隔20~30min測量OD600值≈0.4,在無菌條件下將細菌轉移到一個,用冰預冷的50ml聚丙烯離心管中,在冰上放置10~20min后,于4℃用SorvallGS2轉頭(或與其離心管相配的轉頭)以4000r/min離心10min,以回收細胞,倒數培養液,將管倒置1min以使最后殘留的痕量培養液流盡,以10ml用冰預冷的0.1mMCaCl2重懸每份沉淀,放于冰上,于4℃用SorvallGS3轉頭(或與其相應的轉頭)以4000r/min離心10min,以回收細胞,倒出培養液,將管倒置1min以使最后殘留的痕量培養液流盡,每50ml初始培養物用2ml冰預冷的0.1M CaCl2重懸每份沉定,此時,可以迅速將細胞分裝成小份,液氮中冰凍,-70℃貯存備用,用冷卻的無菌吸頭從每種感受態細胞懸液中各取200μl轉移到無菌的微量離心管中,每管加DNA或連接反應混合物(體積≤10μl,DNA≤50ng),輕輕旋轉以混勻內容物,在冰中放置30min,將離心管放到預加溫到40℃的循環水浴中的試管架上,放置90s~2min,不要搖動試管,快速將管轉移到冰浴中,使細胞冷卻1~2min,每離心管加800μlSOC培養基,用水浴將培養基加溫到37℃,然后將管轉移到37℃搖床上,溫育45min使細菌復蘇,并且表達質粒編碼的抗生素抗性標記基因,將適當體積(每個90mm平板可達200μl)已轉化的感受態細胞轉移到含200mmol/LMgSO4和相應抗生素的SOB培養基上,將平板置于室溫至液體被吸收,倒置平皿,于37℃培養,12~16h后可出現菌落。②重組子的篩選、擴增與提取:用無菌牙簽或滅菌接種針挑選單個菌落接種于5mL無菌的LB培養基或豐富培養基(如超級肉湯或TB超級肉湯培養基)中,培養過夜后,再加入到500mL含LB培養基(含有適當抗生素)的2L燒瓶中,再于37℃培養至飽和狀態(OD600≈4,為提高產量,應采用表面積較大及帶折流板的燒瓶以盡量增大通氣度,振搖速度應大于400r/min),于4℃,6000g離心10min,用4mL GTL溶液重懸沉淀,并轉移到一個容積≥20mL的高速離心管中(細菌沉淀可以在-20℃或-70℃無限期保存),加入1mL新配的含25mg/mL溶菌酶的GTE溶液,重懸沉淀,于室溫放置10min,加入10mL新配NaOH/SDS溶液,并且輕輕混勻直至液體變得均一、清亮而粘稠,于冰上放置10min,加入7.5mL乙酸溶液,用吸管輕輕攪拌直至粘稠度下降并形成大的沉淀,于冰上放置10min,于4℃,20 000g離心10min,將上清輕輕倒入至另一個干凈的離心管中,如果有可見的飄浮物可用數層紗布過濾,加入0.6倍體積的異丙醇,顛倒混勻,室溫放置5~10min,于室溫,1 500g離心10min,加入2mL70%乙醇輕輕洗滌沉淀,然后短暫快速離心,吸去乙醇,并真空干燥(沉淀可在4℃長期保存)。③重組子的鑒定:上述從感受態大腸桿菌中提取的DNA(含SV40T/pcDNA3.1),同上法用限制性內切酶BamH I進行酶切,10g/L瓊脂糖凝膠電泳鑒定,獲得大小約2600bp及5600bp的2條帶,前者符合GenBank中SV40T片段的大小。(II)hTERT/pLXSNneo重組子的純化、擴增、鑒定:①大腸桿菌感受態的制備:其基本方法是用冰預冷的CaCl2或多種2價陽離子等處理細菌,使之進入感受態得以轉化,用CaCl2制備新鮮或冷凍的大腸桿菌感受態細胞,常用于成批制備感受態細菌,本法適用于大多數大腸桿菌菌株,操作過程簡述如下:從37℃培養16~20h的新鮮平板中挑取一個單菌落(如大腸桿菌DH52),或1ml新鮮的16~20h過夜培養物,轉到一個含有100mlLB培養基的1L或500ml燒瓶中,于37℃劇烈振搖培養約2~3h(旋轉搖床200~300r/min),每隔20~30min測量OD600值≈0.4,在無菌條件下將細菌轉移到一個,用冰預冷的50ml聚丙烯離心管中,在冰上放置10~20min,于4℃用Sorvall6S2轉頭(或與其離心管相配的轉頭)以4000r/min離心10min,以回收細胞,倒數培養液,將管倒置1min以使最后殘留的痕量培養液流盡,以10ml用冰預冷的0.1mMCaCl2重懸每份沉淀,放于冰上,于4℃用SorvallGS3轉頭(或與其相應的轉頭)以4000r/min離心10min,以回收細胞,倒出培養液,將管倒置1min以使最后殘留的痕量培養液流盡,每50ml初始培養物用2ml冰預冷的0.1M CaCl2重懸每份沉定,迅速將細胞分裝成小份,液氮中冰凍,-70℃貯存備用。②以感受態大腸桿菌純化和擴增hTERT/pLXSNneo重組子:用冷卻的無菌吸頭從每種感受態細胞懸液中分別取200μl轉移到無菌的微量離心管中,在每管中加DNA或連接反應混合物(體積≤10μl,DNA≤50ng),輕輕旋轉以混勻內容物,在冰中放置30min,將離心管放到預加溫到40℃的循環水浴中的試管架上,放置90s~2min,不要搖動試管,快速將管轉移到冰浴中,使細胞冷卻1~2min,每離心管加800μlSOC培養基,用水浴將培養基加溫到37℃,然后將管轉移到37℃搖床上,溫育45min使細菌復蘇,并且表達質粒編碼的抗生素抗性標記基因,將適當體積(每90mm平板可達200μl)已轉化的感受態細胞轉移到含200mmol/LMgS04和相應抗生素的SOB培養基上,將平板置于室溫至液體被吸收,倒置平皿,于37℃培養,12~16h后可出現菌落。③篩選、擴增重組子:用無菌牙簽或滅菌接種針挑選單個菌落接種于5mL無菌的LB培養基或豐富培養基(如超級肉湯或TB超級肉湯培養基)中,培養過夜后,再加入到500mL含LB培養基(含有適當抗生素)的2L燒瓶中,再于37℃培養至飽和狀態(OD600≈4,為提高產量,應采用表面積較大及帶折流板的燒瓶以盡量增大通氣度,振搖速度應大于400r/min),于4℃,6000g離心10min,用4mL GTL溶液重懸沉淀,并轉移到一個容積≥20mL的高速離心管中(細菌沉淀可以在-20℃或-70℃無限期保存),加入1mL新配的含25mg/mL溶菌酶的GTE溶液,重懸沉淀,于室溫放置10min,加入10mL新配NaOH/SDS溶液,并且輕輕混勻直至液體變得均一、清亮而粘稠,于冰上放置10min,加入7.5mL乙酸溶液,用吸管輕輕攪拌直至粘稠度下降并形成大的沉淀,于冰上放置10min,于4℃,20 000g離心10min,將上清輕輕倒入至另一個干凈的離心管中,如果有可見的飄浮物可用數層紗布過濾,加入0.6倍體積的異丙醇,顛倒混勻,室溫放置5~10min,于室溫,1 500g離心10min,加入2mL70%乙醇輕輕洗滌沉淀,然后短暫快速離心,吸去乙醇,并真空干燥(沉淀可在4℃長期保存)。④重組質粒的鑒定與擴增:挑取平皿上的單菌落,接種于3ml含100ug/ml氨芐青霉素LB培養基中,37℃,250r/min搖床中培養,14h后收集培養物,4℃、10000r/min離心5min,按試劑盒說明書小量提取并純化重組質粒;以EcoRI和HindIII雙酶切重組質粒反應體系:限制性內切酶各0.5ul、10×buffer 2ul、重組質粒10ul、加水補足至20ul,37℃酶切1h。酶切產物于80V電壓條件下進行0.8%瓊脂糖電泳,時間30min,凝膠成像系統拍照;按常規測定重組質粒的序列;重組質粒經酶切、測序鑒定準確后,將含有該質粒的細菌接種至LB培養液中,擴增培養,按大劑量質粒抽提試劑盒說明書進行大劑量質粒抽提純化,紫外分光光度計測定質粒濃度及純度后備用。
(三)構建巨噬細胞株
1、聯合轉染SV40LT和hTERT致巨噬細胞永生化
將重組子SV40LT/pcDNA3.1和hTERT/pLXSNneo導入巨噬細胞,構建巨噬細胞株,并行擴大培養,具體方法為:在1.5ml微量離心管中制備下列溶液:取A管,將SV40LT/pcDNA3.1溶于50μl無血清培養液中;取B管,將hTERT/pLXSNneo溶于50μl無血清培養液中;然后取C管,將20μl脂質體Lipofectamine溶解于80μl無血清培養液中,將A管、B管和C管混勻,在室溫的條件下靜置45min。用無血清培養液洗滌上述T淋巴細胞2次。然后分別在Lipofectamine-SV40LT/pcDNA3.1和Lipofectamine-hTERT/pLXSNneo混合物中加入1ml無血清培養液,輕輕混勻,再滴加至上述T淋巴細胞中,然后加入1ml無血清培養液(胎牛血清濃度為20ml/L),在CO2培養箱培養10h,吸出轉染液,加4ml完全培養液(胎牛血清濃度為20%),繼續培養20h,棄去培養液,更換濃度為400mg·L-1的G418培養液繼續培養,8天后選擇活細胞作擴大培養后,再加大G418濃度到800mg·L-1,將能在高濃度的G418環境中穩定生長的細胞繼續進行擴增培養。培養9天左右鏡下觀察,可見巨噬細胞明顯增大,出現聚集現象。如果細胞增長慢,或細胞密度低,或培養液pH值呈酸性,吸出半量培養液,進行等量換液。當總量達到14ml時轉移到75ml培養瓶中,每2-3周加入5-10ml新鮮培養基。細胞培養至第15-20周(約第135代),仍處于對數生長期,即細胞增加數量與培養時間呈倍增關系,死亡細胞少于10%(通過讀取培養容器的刻度判斷細胞數量的增加情況;通過臺盼藍染色法鑒別死細胞和活細胞。因為正常的活細胞,胞膜結構完整,能夠排斥,使臺盼藍不能夠進入胞內;而喪失活性的細胞,胞膜的通透性增加,可被臺盼藍染成藍色,可判斷為細胞已經死亡。方法是每周吸取一定量的細胞培養懸液,與臺盼藍染色劑混合后置室溫5~10分鐘,然后制成細胞薄片,在顯微鏡下計數1000個細胞總數,計算著色的死細胞和不著色的活細胞的百分比)。此后隨著培養代數的增加和培養時間的延長,細胞數量的增加變慢、死亡細胞越來越多,直至細胞不再增加,甚至溶解、減少、全部死亡。當總量達到45ml時,置50ml離心管中,離心1500轉,10分鐘,棄上清,加入3ml凍存培養基(5%二甲基亞楓(dimethyl sufoxide),95%FBS)混勻,成細胞懸浮液(細胞濃度約為105/ml)。凍存管分裝,1ml/管,置-20℃2h,再置-70℃2h,然后凍存在-196℃液氮中(或立即置零下80度,1-2小時后移入液氮罐中)。以此構建永生化巨噬細胞株(系)。
2、鑒定巨噬細胞株的生物學特性
①觀察細胞鏡下形態:可見巨噬細胞漿豐富,不規則,在液體下能伸縮;②觀察細胞生長曲線:取生長較好的轉染細胞,制成細胞懸液,經計數,分別取1.4×104細胞接種于30個含15 FBS低糖DMEM培養基培養瓶,每天取2瓶細胞進行計數,計算均值,連續觀察直至細胞數量明顯下降,培養3天后每隔2天給未計數的細胞換液,采用同樣方法觀察轉染細胞在hepato ZYME-SFM無血清培養基中的生長情況,結果以培養時間為橫軸,細胞數量為縱軸(對數),描繪在半對數座標上制成曲線后即成該細胞的生長曲線,永生化細胞系呈典型的“S”特征或“穹隆”形成;③檢查染色體:通過分析染色體核型,如果染色體核型為二倍體“46,XX”或“46,XY”,或與原代細胞的核型相同,則說明該細胞系沒有發生惡性轉化(同時可用流式細胞儀分析細胞系中是否出現異常的DNA群體,如果沒有,也說明細胞系未出現瘤性特征);④裸鼠致瘤試驗:將hTERT和SV40LT永生化的細胞以3×107接種裸鼠背部皮下,2個月后,4只裸鼠均未見腫瘤形成,證明此細胞為非惡化細胞;⑤轉染細胞DNA中hTERT和SV40大T基因檢測:如以免疫組織化學檢測,hTERT和SV40轉染的細胞核內染色可見大量棕色顆粒,表明hTERT或SV40LT抗原已整合入細胞內;也可用RT-PCR法檢測T抗原在細胞中的表達,其中T抗原的引物:上游引物(A4239)5’-GTT ATG ATT ATA ACT GTT ATG-3’,下游引物(S4496)5’-GAA ATG CCA TCT AGT GAT-3’;擴增產物長度為268bp,擴增條件為94℃,5min,即:(94℃,1min;55℃,1min,-0.5℃/循環;72℃,1min)×30、(94℃,30S;40℃,30S,72℃,30S)×15,擴增體系為50μl:[Mg2+]2mmol/L、dNTPs200μmol/L、引物濃度0.4μmol/L、Taq 1U、模板5μl;實驗組以第19代細胞的cDNA為模板(參照市售cDNA第一鏈合成試劑盒進行cDNA第一鏈合成,產物-20℃保存);陰性對照設兩個,分別以無菌水、原代細胞的cDNA做模板,陽性對照以SV40 DNA為模板(參照SDS-蛋白酶K法提取SV40 DNA,因為SV40病毒無包膜,不使用SDS破膜,取5μl進行1.5%瓊脂糖凝膠電泳檢測,其余-20℃保存備用);⑥mRNA表達產物測定:T抗原mRNA RT-PCR產物測序:取100μl體系的擴增產物,用凝膠回收試劑盒(Takara,日本)回收產物,取2μl DNA溶液稀釋100倍,測濃度,余下的DNA及上、下游引物各10μl進行測序。⑦流式細胞術檢測:檢測第19代細胞系中合成、分裂的細胞比例,如果其增殖能力明顯比未建系的正常細胞增強,說明是hTERT和SV40大T抗原整合、表達的結果。⑧DNA序列測定:按常規測序儀檢測,顯示hTERT和SV40大T抗原基因序列。總之,永生化巨噬細胞株具有的特性為:①巨噬細胞轉染了SV40LT和hTERT基因從而可長期傳代培養;②巨噬細胞的染色體核型為二倍體,即“46,XX”或“46,XY”;③巨噬細胞的生長曲線如以培養時間為橫軸,細胞數量為縱軸,在hepato ZYME-SFM無血清培養基中呈“S”特征或“穹隆”形成;④細胞不能在軟瓊脂內生長(形成克隆);⑤細胞為非惡化細胞,裸鼠致瘤試驗陰性;⑥細胞的DNA中同時整合了SV40LT和hTERT基因,表達SV40LT和hTERT基因的mRNA產物;⑦體外連續培養15-20周(約第135代)仍處于對數生長期;⑧能反復凍存、長期傳代培養。
3、檢測巨噬細胞株的功能
將巨噬細胞株接種于96孔培養板中,觀察細胞生長情況,7-10天后,細胞克隆生長面積達到1/10個細胞孔時,去培養上清,選擇生長狀態良好的培養孔,顯微鏡下標記細胞株生長的位置、大小,使用無菌槍頭在標注的位置吸取細胞克隆到新的有完全培養基的培養孔內,然后依次倍比稀釋到后面數孔,37℃,5%CO2培養箱內培養一周左右,顯微鏡下觀察細胞生長情況,待細胞克隆長滿至孔底面積1/10以上時,取細胞或培養上清檢測巨噬細胞株的功能。包括:①巨噬細胞株吞噬細菌功能檢測:將巨噬細胞與葡萄球菌或白色念珠菌懸液混合溫育,涂片,固定,堿性亞甲蘭液染色,在油鏡下觀察吞噬情況,計數吞噬細菌和未吞噬細菌的巨噬細胞數比例,以吞噬細菌功能強的巨噬細胞作為備選陽性克隆株。②巨噬細胞株吞噬HIV功能檢測:取疾控中心保存的艾滋病(AIDS)患者的血漿與巨噬細胞株混合培養后,分離細胞株,PBS清洗3次,測定經裂解的吞噬細胞株吞噬HIV的功能,具體根據HIV-1p24抗原檢測試劑盒(酶聯免疫法,上海啟發生物科技有限公司)操作,以已知濃度0pg/ml、0.5pg/ml、1pg/ml、2.5pg/ml、5pg/ml、20pg/ml、40pg/ml、80pg/ml的p24抗原作為對照,最低檢測限低于5pg/ml,測定范圍0~400pg/ml,線性范圍0.5pg/ml~80pg/ml,15min內450nm測定吸光度(OD),空白對照校準品吸光度值不高于0.050,0pg吸光度值不高于0.100,1000pg/ml吸光度不低于1.000,當吸光度>0.12時被認為是陽性。具體按試劑盒說明書操作。③巨噬細胞株產生巨噬細胞因子檢測:以人巨噬細胞移動抑制因子(MIF)ELISA檢測試劑盒(上海百蕊生物科技有限公司)按說明書操作,檢測范圍為0~800pg/ml,敏感度為1.0pg/ml,可在白色背景下,直接用肉眼觀察:反應孔內顏色越深,陽性越強,陰性反應為無色或極淺,依據所呈顏色的深淺,以“+”、“-”號表示。也可測OD值:在ELISA檢測儀上,于450nm(若以ABTS顯色,則410nm)處,以空白對照孔調零后測各孔OD值,若大于規定的陰性對照OD值的2.1倍,即為陽性,具體按試劑盒說明書操作。MIF是集細胞因子、生長因子、激素和酶特性于一身的多效能蛋白分子,作為固有免疫和炎癥反應的調節因子發揮中樞性的作用,在各種感染和急慢性炎癥性疾病中發揮多種免疫功能。根據檢測結果,挑選具有較強吞噬功能的培養孔中的細胞克隆重復進行下一輪稀釋培養,重復2-3輪,檢測功能穩定后取出,轉入培養瓶擴增培養。
4、巨噬細胞株的凍存與復蘇
保存前12小時調整細胞生長狀態,取一瓶生長旺盛,形態良好的細胞,適當消化后制成細胞懸液,1000r/min離心5min,去上清液,輕彈管底使細胞松散,加入4℃保存的9份完全培養液和1份DMSO,分裝細胞凍存管,1mL/管,-70℃冰箱過夜,取出后將凍存管放入液氮容器中保存備用。復蘇前準備好40℃左右的熱水,將凍存管從液氮中小心取出,迅速置于熱水中均勻搖動使細胞解凍,解凍后在1000r/min離心5min,超凈工作臺內無菌條件下打開凍存管,將解凍后的細胞用完全培養液洗滌一次,然后在1000r/min離心5min,棄去上清,以備作擴增培養。
5、巨噬細胞株的擴增
將上述細胞沉淀使用完全培養液輕輕重懸后移入培養瓶內,置37℃,5%CO2培養箱中培養。反復傳代擴增培養,直至所需的巨噬細胞株數量,每傳代培養10代,檢測巨噬細胞株的功能,觀察是否穩定。繼續在數瓶內進行大規模培養,保存備用。
本申請的技術方案,所采用的原代細胞包括直接分離和干細胞誘導來源的巨噬細胞、樹突狀細胞、神經膠質細胞、CD4+T細胞、單核細胞以及通過化學偶聯、交聯、親和吸附制成的包被有CD4分子的顆粒,和/或與CD4+細胞功能相似的顆粒。永生化細胞株的構建方法包括常規的細胞溶合雜交瘤技術。質粒載體包括選用SV40LT/pLXSN、hTERT/pLPCX、SV40LT/pcDNA3.1(-)和hTERT/pLXSNneo。致永生化的成份包括逆轉錄病毒基因、SV40LT、hTERT、EB病毒、腫瘤基因、細胞生長刺激劑和誘導劑以及包括抗CD3單克隆抗體、抗CD3/CD28雙抗體在內的CD4+細胞表面抗體。
二、凈化器的制備
1、凈化劑的充填
將本發明制備的巨噬細胞株,以無菌生理鹽水清洗后,再以1000r/min離心5min(低速短時離心),取細胞沉淀裝配丙烯酸酯之類高生物相容性材料(與血漿分離器材料相同)制成的圓柱形凈化器,至4/5,然后加細胞凍存液(含30%胎牛血清、12%二甲亞砜的1640培養液),使細胞濃度達80%,輕輕搖勻,封口,經4℃,0.5h;-20℃,2h;-70℃,過夜,入-196℃液氮凍存備用。解凍使用時,需迅速將凍存管投入到已經預熱的37℃水浴中,并不斷搖動,使管中的液體迅速融化,然后以無菌生理鹽水清洗后使用。在制備凈化劑時,保存細胞的介質包括選用生理鹽水、常規細胞培養液、細胞凍存液。以吞噬HIV的巨噬細胞株配制凈化劑時,其濃度為80%,以吸附HIV的免疫細胞和免疫顆粒配制凈化劑時,其濃度為95%以上。可以將多種細胞混合配制成凈化劑。
2、凈化器的規格
凈化器可為底徑小、頂徑大的圓柱形,或方形、漏斗形,容積為200~300ml,進出口均設有細胞篩網,進口處頂徑篩網目數為800目;出口處底徑篩網目數為2.0~5.0目(2.5~5.0目相當于0.1~0.2微米或100~200納米),具體可制成2.0目、2.5目、3.0目、3.5目、4.0目、4.5目和5.0目的7種不同規格,用以阻擋120納米的HIV病毒或更大的細菌;液體出口處設置目數為100目(相當于4微米)的細胞濾網,用以阻擋可能濾出的細胞;液體進出口與網篩之間設有緩沖區,有利于系統循環的穩定性。
3、凈化器的材料
血液凈化器選用丙烯酸酯之類的高分子材料,要求生物相容性好,幾乎不激活補體、不引起炎癥反應、不引起白細胞、血小板、血氧分壓、補體C3a、C5a的改變。可通過共價、接枝、聚合等方法改進材料的結構、調節表面的不均勻性、親水性、減少對凝血及氧化應激的影響、從而提高生物相容性、減少并發癥的發生。在吸附器內表面加親水凝膠,將2甲基丙烯酰氧乙基磷酸膽堿-丁基異丁烯酸固化在醋酸纖維素膜上,通過控制濕紡過程,可生成CA/PMB30、CA/PMB80和CA/PMB30-80,具有較高的血液和細胞相容性。將某些具有抗凝作用的物質固化在載體或吸附器內表面的材料上,可抑制血液凝固,提高生物相容性,還可降低肝素用量,并有可能實現無肝素化。將肝素共價結合到聚醚砜表面,既保持了聚醚砜的力學性能,又能提高吸附器內表面的抗凝血性能。在醋酸纖維膜上共價固化亞油酸膜,或將共價結合到聚丙烯酸的亞油酸嫁接到聚砜膜表面,都可以有更好的組織相容性和抗凝血效果。隨著高分子材料和納米技術的不斷發展,與人類血管內皮接近的材料在不久的將來將會出現。
三、分離器的制備
(一)血液分離器的制備
1、制備原理:①血細胞、細菌、病毒的分子大小:人體血液中有形成份(細胞)的大小為:正常紅細胞大約為7微米(μm),是雙凹圓盤狀的細胞;白細胞分為5種,中性粒細胞約12μm,嗜酸性粒細胞略大些,嗜堿性粒細胞與中性粒細胞接近,小淋巴細胞6-8μm,與紅細胞近似,單核細胞最大,約15-20μm。血小板為圓盤形,直徑1~4微米到7~8微米不等,人的血小板平均直徑為2-4微米,厚0.5~1.5微米。細菌的大小為:球菌的直徑約在0.75-1.25μm之間,桿菌長度約在2-5μm,螺旋菌長約100-200μm。病毒的大小以納米(nm)為單位[1cm=10mm,1mm=1000μm,1μm=1000nm],不同病毒間大小差異很大,最小的如植物的聯體病毒(Geminiviruses)直徑僅18-20nm,最大的動物痘病毒(Poxviruses)大小達300-450nm×170-260nm,最長的如絲狀病毒科(Filoviridae)病毒粒子大小為80nm×790-14000nm,多數單個病毒粒子的直徑在100nm左右,艾滋病毒為100-120nm(0.1-0.12μm)。②艾滋病患者血液中存在的相關成份:多核巨細胞(HIV感染細胞表面的gp120與CD4+細胞結合而成的大體積的HIV感染細胞)、gp120細胞(表面有gp120但以單個細胞存在的HIV感染細胞)、基因整合細胞(艾滋病感染初期或潛伏期,整合有HIV雙鏈DNA,但細胞表面沒有gp120的HIV感染細胞)、正常白細胞(未感染HIV的單個細胞存在的粒細胞、單核細胞、淋巴細胞)、紅細胞、血小板、化學成份(蛋白質、糖類、脂類、電解質等)、游離的HIV、細菌及其他微生物。③多核巨細胞為天然的大體積細胞;gp120細胞和基因整合細胞可通過抗原和抗體的免疫反應使細胞凝集為大體積多細胞聚合體;游離的HIV可通過載體顆粒/免疫反應轉變為大體積成份。④根據上述3點,可以制備能通過單個細胞但不能通過大體積細胞或顆粒的血液分離器。⑤選用具有選擇性吸附功能的材料,經本發明的體外血液循環支路篩除血液中的HIV感染細胞。
2、血液分離器的材料與要求:同本發明的凈化器,選用聚醋無紡布、醋酸纖維、脫脂棉等,要求生物相容性好,幾乎不激活補體、不引起炎癥反應和白細胞、血小板、血氧分壓、C3a、C5a的改變。
3、血液分離器的型號:血液分離器的外形制備成柱形結構(以醋酸纖維或脫脂棉為材料制作濾芯)、扁平結構(以聚醋無紡布為材料制作濾芯);孔徑制備成150~250μm、50~150μm、15~40μm、8~15μm、5~8μm、3~5μm、1~2μm的型號。
4、血液分離器的應用原則:根據艾滋病患者的病情選用不同型號的分離器,原則上先選用大孔徑型號做預篩濾,然后選用較小孔徑的型號。重度艾滋病患者常發生嚴重的機會性感染,血液中含有不同大小的成份。如含有特大體積的真菌、螺旋菌、腫瘤細胞及其他異物,則選用孔徑為150~250μm或50~150μm的分離器;如為篩濾HIV感染的單核巨噬細胞、多核巨細胞、多細胞聚合體及吸附有HIV的顆粒性物質,以及為了置換易受HIV感染的CD4+細胞,則選用15~40μm、8~15μm、5~8μm、3~5μm之類的型號。這幾種型號近似或小于血液中單個紅細胞、中性粒細胞、小淋巴細胞的體積,但紅細胞、中性粒細胞及巨噬細胞具有變形運動的特性,能通過比自身體積更小的微孔。
(二)血漿分離器的制備
(1)制備原理:根據血細胞和血漿成份的分子大小制備。如人體血液中有形成份(血細胞)的大小為:正常紅細胞大約為7微米(μm),是雙凹圓盤狀的細胞;白細胞分為5種,中性粒細胞約12μm,嗜酸性粒細胞略大些,嗜堿性粒細胞與中性粒細胞接近,小淋巴細胞6-8μm,與紅細胞近似,單核細胞最大,約15-20μm。血小板為圓盤形,直徑1~4微米到7~8微米不等,人的血小板平均直徑為2-4微米,厚0.5~1.5微米。
(2)材料:可選用聚醋無紡布、醋酸纖維、脫脂棉等,要求生物相容性好,幾乎不激活補體、不引起炎癥反應、不引起白細胞、血小板、血氧分壓、補體C3a、C5a的改變。可通過共價、接枝、聚合等方法改進材料的結構、調節表面的微觀不均勻性、親水性、減少對凝血及氧化應激的影響、從而提高篩濾充分性和生物相容性、減少并發癥的發生。
(3)型號與規格:就分離器的外形來說,可以醋酸纖維或脫脂棉等材料作濾芯制備成柱形結構、以聚醋無紡布等材料作濾芯制備成扁平結構等形狀;按待分離的血細胞和血漿成份的分子大小確定孔徑。本發明所涉及的血漿分離器用性質穩定、生物相容性好、通透性高的高分子聚合物制成空心纖維型濾器,空心纖維膜直徑為270~370μm,膜厚度為50μm,孔徑為0.2~0.6μm,纖維長度為13.5~26μm。該孔僅準許血漿濾過,但能阻擋所有的細胞成分。
四、艾滋病生物細胞免疫治療儀的構件
1、關鍵構件:(1)血液分離器:用于按體積大小篩除以多核巨細胞或多細胞聚合體狀態存在的HIV感染細胞,即用于清除血細胞內的HIV;(2)血漿分離器:用于分離單個血細胞和血漿;(3)血漿凈化器:用于吸附血漿中的HIV。
2、附加構件:包括血泵、肝素泵、動靜脈壓和空氣監測、溫度控制系統、除氣系統、電導率監測系統、超濾監測和漏血監測等部分組成。(1)血泵(Blood Pump):用來推動血液循環以維持血液凈化治療的順利進行,通常血泵部分往往具有轉速檢測功能,以監測病人的血流情況,因此血泵轉輪與凹槽間距設定要精確,并需要經常調整,根據血路泵管的情況,一般將間距設定為3.2~3.3mm,不可太松,否則會造成血流檢測不準;也不可太緊,否則會造成管路破裂。(2)肝素泵(Heparin Pump):肝素泵相當于臨床上應用的微量注射泵,用以持續向篩濾管道(病人血液)中注射肝素,由于病人的血液在體外循環與空氣接觸,容易發生凝血現象,使用肝素泵可以防止凝血的發生。(3)動靜脈壓監測:動脈壓監測主要用以動態監測血液分離器微孔的堵塞情況,另外用以監測體外循環血栓、凝固和壓力的變化。當血流不足時,動脈壓就會降低;當有凝血、血栓形成,特別是分離器微孔堵塞時,動脈壓就會升高;靜脈壓監測用來監測管路血液回流的壓力,當分離器微孔堵塞、凝血、血栓形成、血流不足以及靜脈血回流針頭脫落時,靜脈壓就會下降,如果血路回流管扭曲堵塞或回流針頭發生堵塞時,靜脈壓就會升高。(4)空氣監測(Air Detector):用來監測血液流路的空氣氣泡,一般用超聲波探測的原理,為了避免病人發生空氣栓塞而設置。當監測到有空氣氣泡時,檢測系統會驅動動、靜脈血路夾來阻斷血流,防止危險的發生。
總之,在本發明關鍵構件和附加構件的基礎上,引入計算機調控而制成操作的人性化、治療的個性化、設計的安全性,以及模塊化、自動監測及調控、液晶顯示、自行判斷警報原因及解除信號等微電腦處理的血液凈化治療儀。
五、艾滋病生物細胞免疫治療儀的連接通路與使用方法
1、安裝:如圖1,以無菌操作連接各部件,包括血液分離器、血漿分離器、血漿凈化器及各循環管路。
2、排氣:以無菌生理鹽水充液分離器、凈化器及各循環管路,排除分離器、凈化器及其循環管路內的氣體、氣泡,仔細檢查,確認無氣體、氣泡后使用。
3、通液:將動脈血路管(1)接通艾滋病患者的動脈血管,在操作中再次仔細檢查排氣是否完全,液流是否通暢,并避免管內流液污染。
4、抗凝:從肝素泵(2)向液流中注射抗凝劑(肝素),初次為2500∪或20~30∪/kg。
5、啟動:將動脈血路管(1)的一端與動脈血管相連通,將靜脈管路(15)接通靜脈血管,然后打開血液泵(2),血流量為100~150ml/min,如圖1,當動脈血液經動脈血路管(1)、肝素和血液泵(2)進入血液分離器(3)時,因HIV感染而形成的大體積多核巨細胞被阻留在血液分離器(3)內,單個血細胞和血漿依次經血液出口(4)、血液泵(6)和循環管路(7)流入血漿分離器(8),分離的血漿依次經血漿泵(9)和血路管(10)流入此時開放的凈化器(11),待充滿血漿、約10分鐘,開始放出血漿,經出口管路(13)流出,同步向凈化器(12)灌注血漿,在凈化器(11)內的血漿將近流完時,再次開始灌注血漿,此時凈化器(12)開始放出血漿,兩個并聯的凈化器(11)和(12)交替進行。如表示圖1中的血液分離器(3)的內部結構的圖2所示,血液分離器(1)的內腔(2)的管壁上有很多微孔(3),多核巨細胞(4)不能濾過微孔(3)而被阻留在內腔(2),從而可被清除,能通過微孔(3)的中、小體積的單個血細胞(5)及血漿進入外腔(6),然后經出口(7)流出,進而經圖1所示的血漿分離器(8)分離出血細胞和血漿。如表示圖1中的血漿分離器(8)的內部結構的圖3所示,血漿分離器(1)的內腔(2)的管壁上有很多微孔(3),不能通過微孔(3)的單個血細胞(4)經具有可開關閥門的血細胞出口(8)流出,進入圖1所示的血細胞出口管路(14);能通過微孔(3)的血漿及其化學成分(5)進入血漿分離器外腔(6),然后經血漿流出口(7)、圖1所示的血漿泵(9)和血路管(10)進入凈化器。如表示圖1中凈化器(11)和(12)內部結構的圖4所示,當含有HIV(3)的血漿進入凈化器(1)時,其中的HIV(3)被凈化器中的巨噬細胞(2)吞噬后形成不再下移的巨噬細胞吞噬體(4),被清除HIV后的凈化血漿經圖1所示的出口管路(13)與血漿分離器(8)分離的單個細胞在出口管路(14)處匯合后經靜脈管路(15)匯流。如此清除HIV,凈化血液,直至事先設定的血漿循環量(通常為9L),治療才宣告結束,整個治療過程均由電腦控制,并可隨時檢測工作狀態,使用方便、自動化和安全。
六、艾滋病生物細胞免疫治療儀功效的驗證
1、血液分離器濾除HIV感染細胞功效的驗證
表1 AIDS患者外周血大、中、小白細胞中HIV-p24檢測結果(p24:pg/ml)
本發明人按照本發明的基本方法,做了如下的簡易驗證實驗:取疾控中心和傳染病實驗室生物樣本庫保存的已確診的艾滋病(AIDS)患者的抗凝全血若干份,分別取數份相同ABO血型的抗凝全血混合成為5例,使血液量足夠大,然后委托中心血站按成份輸血的血液成份分離方法,經血液成份分離系統分離出白細胞、紅細胞、血漿,取白細胞成份按常規離心沉淀,吸棄上清液,以適量的生理鹽水懸浮白細胞沉淀,然后加入合適比例的gp120抗體(上海廣銳生物科技有限公司),混勻后置37℃反應5分鐘,然后以孔徑為20~30um的血液成份分離系統分離出大體積的白細胞(稱為大白細胞),對濾過的白細胞濾液再進一步以孔徑為15~25um的血液成份分離系統分離出中等體積的白細胞(稱為中白細胞),濾液中的白細胞為小體積的白細胞(稱為小白細胞),分別收集大、中、小白細胞分離懸液,常規離心沉淀,吸棄上清液,以定量移液器分別吸取等量的大、中、小白細胞沉淀,常規方法(機械或細胞裂解液)裂解細胞(如用同種裂解液,需加量相等),離心沉淀后取上清液,然后根據HIV-1p24抗原檢測試劑盒(酶聯免疫法,上海啟發生物科技有限公司)操作,以已知濃度0pg/ml、0.5pg/ml、1pg/ml、2.5pg/ml、5pg/ml、20pg/ml、40pg/ml、80pg/ml的p24抗原作為對照,最低檢測限低于5pg/ml,測定范圍0~400pg/ml,線性范圍0.5pg/ml~80pg/ml,15min內450nm測定吸光度(OD),空白對照校準品吸光度值不高于0.050,0pg吸光度值不高于0.100,1000pg/ml吸光度不低于1.000,當吸光度>0.12時被認為是陽性,檢測結果(表1)說明,AIDS患者不同體積大小的白細胞中的HIV-p24含量不同,在大、中、小白細胞中HIV-p24的平均含量分別為275.0pg/ml、196.0pg/ml、126.4pg/ml,其中大、小白細胞中HIV-p24平均含量相差148.6pg/ml,減少了54.4%;在大、中、小白細胞中HIV-P24的總含量分別為1375.0pg/ml、979.9pg/ml、632.1pg/ml,其中大、小白細胞中HIV-p24總含量相差742.9pg/ml,減少了54.3%,經統計學檢驗,t=2.43,p<0.05。說明AIDS患者體內的大體積白細胞或經gp120抗體作用后而形成的大體積白細胞中含有較高含量的HIV,能通過實施本發明的技術方案被分離清除。
2、凈化器清除HIV功效的驗證
為了驗證巨噬細胞株清除HIV的功效,本發明設計了簡易的測試方法:取滅菌的2.5×300mm魏氏血沉管5支,分別吸取經離心(1000r/min,5min)沉淀的巨噬細胞株至200mm刻度,接著吸取經100℃溶化后保溫在39~41℃備用的0.9%瓊脂糖C1-4B,達到約10mm長刻度,置血沉管冷卻后,瓊脂糖成為半固體,能阻止血沉管內細胞流出但不會阻止小分子的水和化學成份之類的物質通過。另取疾控中心及傳染病實驗室樣本庫保存的艾滋病(AIDS)患者的5例血漿,各約10mL,各取9mLAIDS濾前血漿分批次注入血沉管(簡易凈化裝置)上端空管,待流經血沉管下層的巨噬細胞株層并從血沉管內流出后,收集流出液,稱為AIDS濾后血漿。取AIDS濾前血漿和濾后血漿,以人巨噬細胞移動抑制因子(MIF)ELISA檢測試劑盒(上海百蕊生物科技有限公司)配對檢測,按說明書操作,檢測范圍為0~800pg/ml,敏感度為1.0pg/ml,可在白色背景下,直接用肉眼觀察:反應孔內顏色越深,陽性越強,陰性反應為無色或極淺,依據所呈顏色的深淺,以“+”、“-”號表示。也可測OD值:在ELISA檢測儀上,于450nm(若以ABTS顯色,則410nm)處,以空白對照孔調零后測各孔OD值,若大于規定的陰性對照OD值的2.1倍,即為陽性。結果如表1,濾前血漿中MIF檢測結果均為陰性(或因含量低于檢測靈敏度、血漿長期保存致降解等),而濾后血漿中檢測結果均為陽性。說明巨噬細胞株在此過程產生了MIF細胞因子。MIF是集細胞因子、生長因子、激素和酶特性于一身的多效能蛋白分子,作為固有免疫和炎癥反應的調節因子發揮中樞性的作用,在各種感染和急慢性炎癥性疾病中發揮多種免疫功能。在作AIDS血漿濾過簡易凈化器前后MIF配對檢測的同時,本發明還做了HIV-1p24的配對檢測,根據HIV-1p24抗原檢測試劑盒(酶聯免疫法,上海啟發生物科技有限公司)操作,以已知濃度0pg/ml、0.5pg/ml、1pg/ml、2.5pg/ml、5pg/ml、20pg/ml、40pg/ml、80pg/ml的p24抗原作為對照,最低檢測限低于5pg/ml,測定范圍0~400pg/ml,線性范圍0.5pg/ml~80pg/ml,15min內450nm測定吸光度(OD),空白對照校準品吸光度值不高于0.050,0pg吸光度值不高于0.100,1000pg/ml吸光度不低于1.000,當吸光度>0.12時被認為是陽性,結果(表2)說明AIDS血漿濾過簡易凈化裝置后,部分HIV已被巨噬細胞株吞噬吸附,濾過后的血漿HIV明顯減少,經第1次濾過后,HIV清除率為20.55%,經第2次濾過后,HIV清除率為42.83%,p<0.01,具有明顯的效果,說明隨著濾過次數的增加HIV會被不斷地清除,從而達到治療AIDS目的。
表1 AIDS血漿濾過含巨噬細胞的簡易凈化裝置前后MIF檢測結果(定量:pg/ml)
表2 AIDS血漿濾過含巨噬細胞的簡易凈化裝置前后p24檢測結果(p24:pg/ml)
總之,上述簡易驗證實驗表明,已被HIV感染的外周血白細胞易融合成大體積的多核巨細胞或多細胞聚合體,能被血液分離器分離清除;而血漿中游離的HIV,能被血漿凈化劑(巨噬細胞株)清除,表明以分離器和凈化器(劑)為關鍵部件構成的艾滋病生物細胞免疫治療儀具有顯著的清除血細胞內、外HIV病毒的治療功效。
- 還沒有人留言評論。精彩留言會獲得點贊!