一種右蘭索拉唑緩釋膠囊及制備方法與流程
本發明屬于藥物制劑
技術領域:
,具體涉及一種右蘭索拉唑緩釋膠囊及制備方法。
背景技術:
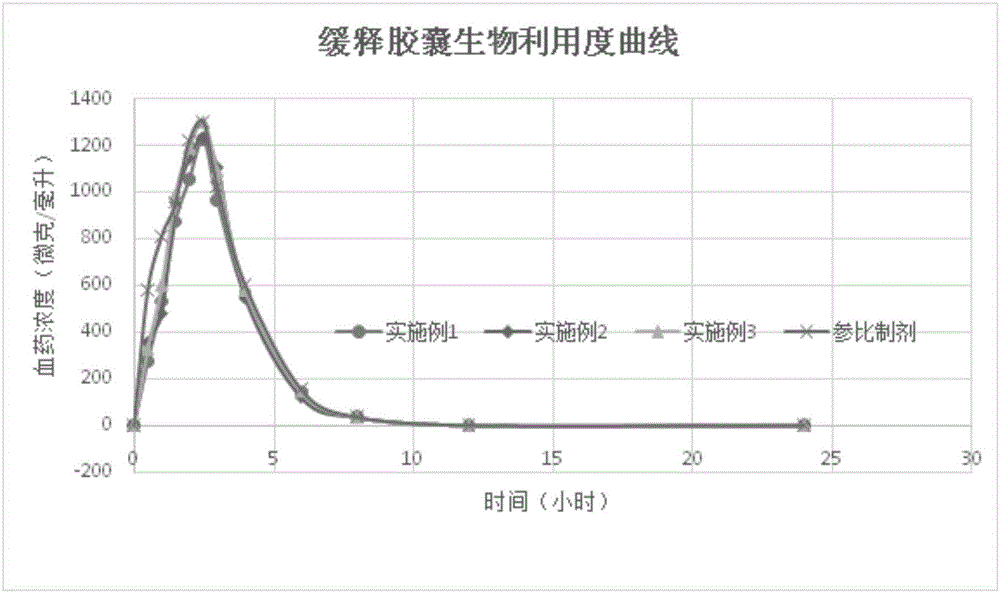
:右蘭索拉唑,英文名:(R)-Lansoprazole,別名:2-[[3-甲基-4-(2,2,2-三氟乙氧基)吡啶-2-基]甲基亞磺酰基]-1H-苯并咪唑。美國FDA于2009年1月30日批準日本武田制藥公司研發的食管炎治療新藥右蘭索拉唑(通用名為Dexlansoprazole)上市。該藥是質子泵抑制劑蘭索拉唑的對映體,又被稱為右旋蘭索拉唑,用于治療與非糜爛性胃食管反流病相關的胃灼熱及不同程度的糜爛性食道炎。此次上市劑型是緩釋膠囊,內置兩層腸溶包衣單位,可使藥物在給藥后1~2小時和4~5小時后分別出現兩個血藥濃度峰值,作用時間超過蘭索拉唑,且Kapidex的給藥時間不受食物和用餐時間的影響。臨床Ⅲ期試驗顯示,該藥能為在日間或夜間伴胃灼熱癥狀的胃食管反流病患者提供長達24小時的抑酸作用和持續的癥狀緩解效果。目前研究較多的右蘭索拉唑緩釋膠囊一般由兩種右蘭索拉唑微丸組成,其中一種為腸溶微丸,另一種為緩釋微丸。腸溶微丸一般由空白丸芯、活性藥物層、隔離衣層和腸溶衣層組成。緩釋微丸由空白丸芯、活性藥物層、隔離衣層和緩釋衣層組成。而右蘭索拉唑遲釋膠囊則由腸溶微丸與緩釋微丸按照質量比為1:3混合,裝入膠囊制備而成。右蘭索拉唑緩釋膠囊的活性藥物層一般由右蘭索拉唑、填充劑、崩解劑、粘合劑和穩定劑等組成。目前采用的穩定劑一般是碳酸鎂、碳酸鈉、碳酸氫鈉,磷酸氫二鈉、氫氧化鈉等(公開號為CN104523654A的專利文獻)。或者,穩定劑為碳酸鈣、碳酸鎂、氧化鎂、氫氧化鈉、氫氧化鎂、磷酸氫二鈉或葡甲胺等(公告號為CN103961329B的專利文獻)。或者,所述穩定劑為氫氧化鎂、碳酸鎂、碳酸鈉或氫氧化鈉(公告號為CN102600109的專利文獻)。采用這些穩定劑時,長時間存放后,藥物中單雜和總雜含量明顯增加,導致藥物安全性降低。技術實現要素:本發明提供了一種右蘭索拉唑緩釋膠囊,該緩釋膠囊采用新的穩定劑組分,大大提高了藥物的穩定性,保證了藥物的安全性。本發明的另外一個發明目的是提供一種右蘭索拉唑緩釋膠囊的制備方法。一種右蘭索拉唑緩釋膠囊,包括腸溶微丸和緩釋微丸,所述腸溶微丸或/和緩釋微丸包括活性藥物丸芯,該活性藥物丸芯中包括右蘭索拉唑活性成分和穩定劑,所述穩定劑為氫氧化鈣和氫氧化鉀的組合物。一種右蘭索拉唑緩釋膠囊,包括腸溶微丸和緩釋微丸,所述腸溶微丸包括活性藥物丸芯、隔離層和腸溶層,所述緩釋微丸包括活性藥物丸芯、隔離層和腸溶緩釋層,所述活性藥物丸芯中包括右蘭索拉唑活性成分和穩定劑,所述穩定劑為氫氧化鈣和氫氧化鉀的組合物。本發明中,所述右蘭索拉唑活性成分可以是右蘭索拉唑或者其旋光異構體,或者可接受的鹽或者其他可接受的右蘭索拉唑API藥物等。作為優選,所述氫氧化鈣和氫氧化鉀的質量比為(1-8):1;作為進一步優選,所述氫氧化鈣和氫氧化鉀的質量比為(2-8):1,作為優選,所述氫氧化鈣和氫氧化鉀的質量比為(3-8):1。作為更進一步優選,所述氫氧化鈣和氫氧化鉀的質量比為7:2或者8:1或者4:1。作為優選,在腸溶微丸中,所述穩定劑與右蘭索拉唑活性成分的重量百分比為:10%-20%;在緩釋微丸中,所述穩定劑與右蘭索拉唑活性成分的重量百分比為:10%-20%。作為優選,在腸溶微丸和緩釋微丸中,所述穩定劑與右蘭索拉唑活性成分的重量百分比均為10%-20%,作為進一步優選,所述穩定劑與右蘭索拉唑活性成分的重量百分比均為14%-17%,更進一步優選為15%-17%。作為進一步優選,所述腸溶微丸和緩釋微丸中活性藥物丸芯的組成均相同,其中穩定劑與右蘭索拉唑活性成分的重量百分比均為14%-17%,進一步為15%-17%。進一步簡化了右蘭索拉唑緩釋膠囊的制備工藝,降低藥物制備成本。作為優選,按照其中右蘭索拉唑的質量計,所述腸溶微丸和緩釋微丸的質量比為1:(2.8-3.2),進一步優選為1:3。其中以腸溶微丸和緩釋微丸總質量計算,右蘭索拉唑活性成分(API)的總的質量百分比約為15%-25%,進一步優選為18%-22%,更進一步優選為20%-22%。作為優選,所述活性藥物丸芯中包括甘露醇;作為進一步優選,以活性藥物丸芯總重量計,所述的甘露醇的重量百分比為5%-15%。甘露醇的加入,加快了藥物活性成分的崩解速度,保證其在更短的時間內達到有效藥物濃度。作為優選,所述活性藥物丸芯中,所述甘露醇的重量百分比為8-12%。作為優選,以活性藥物丸芯總重量計,所述活性藥物丸芯包括:作為優選,所述隔離層為歐巴代YS-1-7006,腸溶微丸和緩釋微丸中,所述隔離層與活性藥物層丸芯的重量百分比為10%-30%,進一步優選為10%-20%。作為優選,以腸溶微丸總重量計,所述腸溶微丸包括:所述隔離層顆粒為包覆有隔離層的活性藥物丸芯。作為優選,所述聚丙烯酸樹脂A可以是聚丙烯酸樹脂L30D-55或者聚丙烯酸樹脂L100-55;可以選擇尤特奇L30D-55或者尤特奇L100-55等。作為優選,若以腸溶微丸總重量計,所述聚丙烯酸樹脂A所占的重量百分比為10-20%,進一步優選為12-18%。或者,作為優選,若以腸溶微丸和緩釋微丸總重量計所述聚丙烯酸樹脂A所占的重量百分比為2~5%。活性藥物丸芯經過隔離層包衣液包衣后,形成隔離層小丸,作為優選,隔離層小丸中,所述活性藥物丸芯所占的重量百分比為80~90%,進一步優選為85-90%。作為優選,以緩釋微丸總重量計,所述緩釋微丸包括:作為優選,所述聚丙烯酸樹脂B可以是聚丙烯酸樹脂S100,可以選擇市售的尤特奇S100。作為優選,若以緩釋微丸總重量計,所述聚丙烯酸樹脂B所占的重量百分比為15%-25%,作為進一步優選,所述聚丙烯酸樹脂B所占的重量百分比為20-25%。或者作為優選,若以腸溶微丸和緩釋微丸總重量計,所述聚丙烯酸樹脂B所占的重量百分比為15%-20%。本發明還提供了一種制備上述任一項技術方案所述的右蘭索拉唑緩釋膠囊的方法,為流化床包衣法。所述流化床包衣法依次包括如下步驟:(1)利用右蘭索拉唑包衣混合液在蔗糖空白丸芯上進行包衣得到活性藥物層顆粒;(2)利用隔離包衣混合液在隔離層顆粒上進行包衣得到隔離層顆粒;(3)利用腸溶層顆粒包衣液在隔離層顆粒上進行包衣得到腸溶微丸;(4)利用腸溶緩釋層包衣液在隔離層顆粒上進行包衣得到緩釋腸溶微丸;(5)將得到的腸溶微丸和緩釋腸溶微丸進行膠囊填充得到所述的右蘭索拉唑緩釋膠囊。對于口服藥物,藥物口服進入體內后,依序經過口腔、食道、胃、十二指腸、空腸、回腸、結腸和直腸。由于在口腔和食道的滯留時間相對較少,因此,在此兩段消化道中藥物受消化道的影響較小;相對的,在胃、十二指腸、空腸和回腸的平均駐留時間增加,大部分藥物在此吸收,因此藥物受此段消化道的影響增加;在結腸和直腸由于消化液的減少,藥物吸收量也減少,因此藥物受此段消化道影響程度下降。根據生物藥劑學中對人體消化道環境的描述,胃的平均pH值為1左右,十二指腸的平均pH值為6.0左右,空腸和回腸的平均pH值為7.4左右。我們通常希望,其在胃中的釋放度盡可能低,以降低對胃部的刺激等副作用,同時保證右蘭索拉唑藥物的穩定性;在經過十二指腸時,其中的腸溶微丸中的活性藥物組分能夠全部釋放,被十二指腸吸收,而緩釋腸溶微丸不釋放;而在到達空腸和回腸時,其中的緩釋腸溶微丸開始迅速釋放,被空腸和回腸吸收,完成藥物的整個吸收過程。而由我們的實驗證實,本發明的右旋蘭索拉唑膠囊完美的呈現兩段釋放模式,在經過胃部2個小時左右的時間,幾乎沒有藥物溶出,而在經過十二指腸兩個小時左右,其中25%的右旋蘭索拉唑被快速釋放吸收,在經過空腸和回腸的2個小時剩余75%的右旋蘭索拉唑被快速釋放吸收,即本發明的右旋蘭索拉唑膠囊產品能夠延長右旋蘭索拉唑的作用時間,使右旋蘭索拉唑的抑酸效果得到增加。與現有技術相比,本發明的有益效果體現在:實驗表明,采用氫氧化鈣和氫氧化鉀的組合作為穩定劑時,制備得到的右蘭索拉唑緩釋膠囊在酸介質中的釋放量均為標示量以下,且遠遠低于原研對照樣品的釋放量。而且,溶出實驗表明本發明得到的右蘭索拉唑緩釋膠囊的溶出度與原研對照品的溶出度相當,完全符合藥物設計要求。更為重要的是,采用氫氧化鈣和氫氧化鉀作為穩定劑時,相對比單組份的穩定劑,穩定劑的添加量減少,且穩定性更好。同時,本發明的右蘭索拉唑緩釋膠囊的生物利用度完全符合要求。附圖說明圖1為實施例制備的緩釋膠囊以及對照樣的溶出曲線;圖2為實施例制備的緩釋膠囊和對比樣的緩釋膠囊生物利用度曲線。具體實施方式下面結合實施例對本發明作進一步說明:實施例1緩釋膠囊由腸溶微丸(顆粒)和緩釋腸溶微丸(顆粒)組成制備工藝:(1)活性藥物層顆粒的制備成份投料量(克)蔗糖空白丸芯400右蘭索拉唑600無水氫氧化鈣80無水氫氧化鉀20羥丙基纖維素240十二烷基硫酸鈉300甘露醇180丙酮6800將微粒化的氫氧化鈣加入到含丙酮的容器中,混合15分鐘,然后加入微粒化的右蘭索拉唑,再混合45分鐘,然后再加入氫氧化鉀溶液,得到的氫氧化鈣、氫氧化鉀和右蘭索拉唑的混合物被保留用作進一步加工。將羥丙基纖維素加入到含丙酮的容器中并混合,直到固體溶解,得到羥丙基纖維素的混合物。將羥丙基纖維素的混合物與氫氧化鈣、氫氧化鉀和右蘭索拉唑的混合物混合,混合0.5小時,將得到的氫氧化鈣、氫氧化鉀、右蘭索拉唑進和羥丙基纖維素的混合物被保留用作進一步加工。將微粒化的甘露醇、十二烷基硫酸鈉加入到含丙酮的容器中,混合1.5小時,得到的甘露醇的混合物被保留用作進一步加工。將氫氧化鈣、氫氧化鉀、右蘭索拉唑和羥丙基纖維素的混合物與甘露醇的混合物混合,混合6小時,得到的活性藥物包衣液被保留用作進一步加工。將上述活性藥物包衣液放入到預先裝有蔗糖空白丸芯,且底部帶有噴霧器的流化床中(入口氣溫:31-33℃;物料溫度:31-32℃;包衣溶液噴霧速率:26.7g/min;以及噴霧氣壓:1bar;噴嘴:1.0mm)進行噴霧,噴霧得到的包裹材料于40℃下在流化床中干燥,得到右蘭索拉唑包覆的糖丸。該產品通過30目的網篩(最低)和20目網篩(最高)的篩分,得到活性藥物層顆粒(或者活性藥物丸芯)。(2)隔離層顆粒的制備成份投料量(克)活性藥物層顆粒800歐巴代YS-1-7006120純化水1500隔離包衣混合液制備:向水中加入歐巴代YS-1-7006并混合,制備得到8%歐巴代YS-1-7006混合物,該混合物被留作進一步加工。流化床處理器:預熱流化床(帶有噴霧器)至入口溫度為50℃并具合適的氣流。將活性藥物層顆粒加入流化床中,使用隔離包衣混合液進行流化包衣(入口溫度:65℃;物料溫度:42-45℃(設置43℃);噴霧氣壓:2.5bar;噴嘴:1.0mm;噴霧速度為12mL/min)。生成的包覆材料于60℃下在流化床中干燥1小時,干燥后的產品通過30目的網篩(最低)和20目網篩(最高)的篩分,得到隔離層顆粒。(3)腸溶層顆粒的制備腸溶層顆粒包衣液制備:將尤特奇L30D-55在合適的容器中與異丙醇混合,溶解,得到的尤特奇L30D-55混合物被保留用作進一步加工。將滑石粉通過120目網篩篩分,然后再將篩分后的檸檬酸三乙酯和聚山梨醇酯80以及異丙醇混合,將該混合物加入到尤特奇L30D-55混合物中并進行充分地進一步混合,得到腸溶層顆粒包衣液一。將歐巴代YS-1-7006溶于純水中,溶清后,加入氣相硅膠,攪拌1小時,分散均勻,制備得到腸溶層顆粒包衣液二。流化床處理器(尤特奇L30D-55):預熱流化床(帶有噴霧器)至入口溫度為45℃。將隔離層顆粒加入流化床處理器機器中,使用腸溶層顆粒包衣液進行流化(入口溫度:55℃;物料溫度:42-45℃(設置43℃);噴霧氣壓:2.5bar;噴嘴:1.0mm;噴霧速度為15mL/min),其中包衣液一噴完后干燥30min,再噴包衣液二。生成的材料于60℃下在流化床中干燥1小時,得到的產品通過22目的網篩(最低)和16目網篩(最高)的篩分,得到腸溶衣包覆的右蘭索拉唑的顆粒,即腸溶層顆粒。(4)腸溶緩釋層顆粒的制備成份投料量(克)隔離層顆粒400聚山梨酯803.5檸檬酸三乙酯18.9滑石粉16.5純化水200異丙醇1400尤特奇S100125尤特奇S100腸衣包衣液的制備:將尤特奇S100在合適的容器中與異丙醇和純化水進行混合,得到的尤特奇S100混合物被保留用作進一步加工。將滑石粉(通過120目網篩篩分過)、檸檬酸三乙酯和聚山梨醇酯80和純化水混合,然后將該混合物加入到尤特奇S100混合物中,并進行充分地進一步混合。流化床處理器:預熱流化床(帶有噴霧器)入口溫度45℃并具合適的氣流。將被隔離層顆粒加入流化床處理器機器中,使用尤特奇S100腸衣包衣液進行流化(入口溫度:45℃;產品溫度:42-45℃(設置43℃);噴霧氣壓:2.1bar;噴嘴:1.0mm;噴霧速度為15mL/min)。生成的材料于60℃下在流化床中干燥1小時,該產品通過22目的網篩(最低)和16目網篩(最高)的篩分,得到腸溶衣包覆的右蘭索拉唑的顆粒,即腸溶緩釋層顆粒。(5)膠囊填充成份投料量(克)腸溶層顆粒500腸溶緩釋層顆粒1500流體氣相硅膠20最終混合:將腸溶層顆粒(25%,以右蘭索拉唑總量計)、腸溶緩釋層顆粒(75%,右蘭索拉唑總量計)和流體氣相硅膠,以提供最終產品。實施例2緩釋膠囊由腸溶微丸和緩釋腸溶微丸組成制備工藝:(1)活性藥物層顆粒的制備將微粒化的氫氧化鈣和氫氧化鉀加入到含丙酮的容器中,至少混合15分鐘,然后加入微粒化的右蘭索拉唑,并混合45分鐘,得到的氫氧化鈣、氫氧化鉀和右蘭索拉唑的混合物被保留用作進一步加工。將羥丙基纖維素加入到含丙酮的容器中并混合,直到固體溶解,得到羥丙基纖維素丙酮混合物。將羥丙基纖維素與丙酮混合物與氫氧化鈣、氫氧化鉀和右蘭索拉唑的混合物混合,生成的混合物至少混合0.5小時,得到氫氧化鈣、氫氧化鉀、右蘭索拉唑和羥丙基纖維素的混合物被保留用作進一步加工。將微粒化的甘露醇、十二烷基硫酸鈉加入到含丙酮的容器中,至少混合1.5小時,得到的甘露醇混合物被保留用作進一步加工。將上述制備的氫氧化鈣、氫氧化鉀、右蘭索拉唑和羥丙基纖維素的混合物與甘露醇的混合物混合,生成的混合物混合6小時,得到的活性藥物層包衣液被保留用作進一步加工。隨后將制備得到的活性藥物層包衣液放入到底部裝有噴霧器的流化床(流化床中預先裝有蔗糖空白丸芯)中(入口氣溫:31-33℃;物料溫度:31-32℃;包衣溶液噴霧速率:26.7g/min;噴嘴:1.0mm;以及噴霧氣壓:1bar),噴霧得到的包裹材料于40℃下在流化床中干燥,得到右蘭索拉唑包覆的糖丸。該產品通過30目的網篩(最低)和20目網篩(最高)的篩分,得到活性藥物層顆粒。(2)隔離層顆粒的制備成份投料量(克)活性藥物層顆粒800歐巴代YS-1-7006120純化水1500隔離包衣混合液制備:通過向水中加入歐巴代YS-1-7006并混合而制備8%歐巴代YS-1-7006混合物,該混合物被留作進一步加工。流化床處理器:預熱流化床,入口溫度為50℃。將活性藥物層顆粒加入流化床處理器機器中,使用隔離包衣混合液進行流化包衣(入口溫度:65℃;物料溫度:42-45℃(設置43℃);噴霧氣壓:2.5bar;噴嘴:1.0mm;噴霧速度為12mL/min)。生成的包覆材料于60℃下在流化床在干燥1小時,以提供隔離層顆粒,該產品通過30目的網篩(最低)和20目網篩(最高)的篩分,得到最終的隔離層顆粒。(3)腸溶層顆粒的制備腸溶層顆粒包衣液:將尤特奇L30D-55在合適的容器中與純化水混合,得到的尤特奇L30D-55混合物被保留用作進一步加工。滑石粉通過120目網篩篩分,然后再將檸檬酸三乙酯和聚山梨醇酯80與純化水混合,然后將混合物加入到尤特奇L30D-55混合物中并進行充分地進一步混合,得到腸溶層顆粒包衣液一。將歐巴代YS-1-7006溶于純水中,溶清后,加入氣相硅膠,攪拌1小時,分散均勻,制備得到腸溶層顆粒包衣液二。流化床處理器(尤特奇L30D-55):預熱流化床至入口溫度45℃并具合適的氣流。將隔離層顆粒加入流化床處理器機器中,使用腸溶層顆粒包衣液進行流化(入口溫度:55℃;物料溫度:42-45℃(設置43℃);噴霧氣壓:2.5bar;噴嘴:1.0mm;噴霧速度為15mL/min),其中包衣液一噴完后干燥30min,再噴包衣液二。生成的材料于60℃下在流化床中干燥1小時,以提供腸溶衣包覆的右蘭索拉唑的顆粒。該產品通過22目的網篩(最低)和16目網篩(最高)的篩分,得到最終的腸溶層顆粒。(4)腸溶緩釋層顆粒的制備成份投料量(克)隔離層顆粒400聚山梨酯803.2檸檬酸三乙酯17.4滑石粉16.0純化水300異丙醇1500尤特奇S100120尤特奇S100腸衣包衣液的制備:將尤特奇S100在合適的容器中與異丙醇和純化水進行混合,得到的尤特奇S100混合物被保留用作進一步加工。將滑石粉(通過120目網篩篩分過)、檸檬酸三乙酯和聚山梨醇酯80純化水混合,再加入到尤特奇S100混合物中,并進行充分地進一步混合,得到尤特奇S100腸衣包衣液。流化床處理器:預熱流化床至入口溫度45℃并具合適的氣流。將被隔離層顆粒加入流化床處理器機器中,使用尤特奇S100腸衣包衣液進行流化(入口溫度:45℃;產品溫度:42-45℃(設置43℃);噴霧氣壓:2.1bar;噴嘴:1.0mm;噴霧速度為15mL/min)。生成的材料于60℃下在流化床中干燥1小時,以提供腸溶衣包覆的右蘭索拉唑的顆粒。該產品通過22目的網篩(最低)和16目網篩(最高)的篩分,得到最終的腸溶緩釋層顆粒。(5)膠囊填充成份投料量(克)腸溶層顆粒500腸溶緩釋層顆粒1500流體氣相硅膠20最終混合:將腸溶層顆粒(25%,以右蘭索拉唑總量計)、腸溶緩釋層顆粒(75%,右蘭索拉唑總量計)和流體氣相硅膠,以提供最終產品。實施例3緩釋膠囊由腸溶微丸(顆粒)和緩釋腸溶微丸(顆粒)組成制備工藝:(1)活性藥物層顆粒的制備成份投料量(克)蔗糖空白丸芯400右蘭索拉唑600無水氫氧化鈣76無水氫氧化鉀19羥丙基纖維素250十二烷基硫酸鈉300甘露醇180丙酮6800將微粒化的氫氧化鈣加入到含丙酮的容器中,混合30分鐘,然后加入微粒化的右蘭索拉唑,再混合1.5小時,然后加入氫氧化鉀溶液,得到的氫氧化鈣、氫氧化鉀和右蘭索拉唑的混合物被保留用作進一步加工。將微粒化的甘露醇、十二烷基硫酸鈉加入到含丙酮的容器中,混合2小時,得到的甘露醇、十二烷基硫酸鈉的混合物被保留用作進一步加工。將羥丙基纖維素加入到含丙酮的容器中并混合,直到固體溶解,得到羥丙基纖維素的混合物。將甘露醇、十二烷基硫酸鈉的混合物與氫氧化鈣、氫氧化鉀和右蘭索拉唑的混合物混合,混合1.5小時,然后加入羥丙基纖維素的混合物,攪拌2小時,過30目篩,得到活性藥物包衣液,待噴。將上述活性藥物包衣液放入到預先裝有蔗糖空白丸芯,且底部帶有噴霧器的流化床中(入口氣溫:31-33℃;物料溫度:31-32℃;包衣溶液噴霧速率:40g/min;以及噴霧氣壓:2.0bar;噴嘴:1.0mm)進行噴霧,噴霧得到的包裹材料于40℃下在流化床中干燥,得到右蘭索拉唑包覆的糖丸。該產品通過30目的網篩(最低)和20目網篩(最高)的篩分,得到活性藥物層顆粒(或者活性藥物丸芯)。(2)隔離層顆粒的制備成份投料量(克)活性藥物層顆粒800歐巴代YS-1-7006220純化水1500隔離包衣混合液制備:向水中加入歐巴代YS-1-7006并混合,制備得到8%歐巴代YS-1-7006混合物,該混合物被留作進一步加工。流化床處理器:預熱流化床(帶有噴霧器)至入口溫度為50℃并具合適的氣流。將活性藥物層顆粒加入流化床中,使用隔離包衣混合液進行流化包衣(入口溫度:65℃;物料溫度:42-45℃(設置43℃);噴霧氣壓:2.5bar;噴嘴:1.0mm;噴霧速度為12mL/min)。生成的包覆材料于60℃下在流化床中干燥1小時,干燥后的產品通過30目的網篩(最低)和20目網篩(最高)的篩分,得到隔離層顆粒。(3)腸溶層顆粒的制備成份投料量(克)隔離層顆粒400聚山梨酯803.2檸檬酸三乙酯14.2滑石粉8.8純化水450尤特奇L100-5574歐巴代YS-1-70068.9氣相硅膠8.9異丙醇1400腸溶層顆粒包衣液制備:將尤特奇L30D-55在合適的容器中與異丙醇混合,得到的尤特奇L30D-55混合物被保留用作進一步加工。將滑石粉通過120目網篩篩分,然后再將篩分后的檸檬酸三乙酯和聚山梨醇酯80以及異丙醇混合,將該混合物加入到尤特奇L30D-55混合物中并進行充分地進一步混合,得到腸溶層顆粒包衣液一;將歐巴代YS-1-7006溶解于純化水中,溶清后,加入氣相硅膠,攪拌1小時,分散均勻,得到包衣液二。流化床處理器(尤特奇L30D-55):預熱流化床(帶有噴霧器)至入口溫度為45℃。將隔離層顆粒加入流化床處理器機器中,使用腸溶層顆粒包衣液進行流化(入口溫度:55℃;物料溫度:42-45℃(設置43℃);噴霧氣壓:2.5bar;噴嘴:1.0mm;噴霧速度為15mL/min),其中包衣液1噴完后干燥30min,再噴包衣液二。生成的材料于60℃下在流化床中干燥1小時,得到的產品通過22目的網篩(最低)和16目網篩(最高)的篩分,得到腸溶衣包覆的右蘭索拉唑的顆粒,即腸溶層顆粒。(5)腸溶緩釋層顆粒的制備成份投料量(克)隔離層顆粒400聚山梨酯803.2檸檬酸三乙酯18.4滑石粉15.9純化水200異丙醇1400尤特奇S100121尤特奇S100腸衣包衣液的制備:將尤特奇S100在合適的容器中與異丙醇和純化水進行混合,得到的尤特奇S100混合物被保留用作進一步加工。將滑石粉(通過120目網篩篩分過)、檸檬酸三乙酯和聚山梨醇酯80和純化水混合,然后將該混合物加入到尤特奇S100混合物中,并進行充分地進一步混合。流化床處理器:預熱流化床(帶有噴霧器)入口溫度45℃并具合適的氣流。將隔離層顆粒加入流化床處理器機器中,使用尤特奇S100腸衣包衣液進行流化(入口溫度:45℃;產品溫度:42-45℃(設置43℃);噴霧氣壓:2.1bar;噴嘴:1.0mm;噴霧速度為15mL/min)。生成的材料于60℃下在流化床中干燥1小時,該產品通過22目的網篩(最低)和16目網篩(最高)的篩分,得到腸溶衣包覆的右蘭索拉唑的顆粒,即腸溶緩釋層顆粒。(5)膠囊填充成份投料量(克)腸溶層顆粒500腸溶緩釋層顆粒1500流體氣相硅膠20最終混合:將腸溶層顆粒(25%,以右蘭索拉唑總量計)、腸溶緩釋層顆粒(75%,右蘭索拉唑總量計)和流體氣相硅膠,以提供最終產品。測試例1:緩釋膠囊溶出度實驗分別取由實施例1、實施例2制的右蘭索拉唑緩釋膠囊8粒,以及原研右旋蘭索拉唑對照樣8粒(參比制劑為Dexilant膠囊),參照釋放度測定法(中國藥典2010年版附錄XD第二法)測定上述緩釋膠囊在不同介質中的釋放度。酸中釋放量:以0.1N的鹽酸溶液(8.5→1000)500ml為溶出介質,轉速為每分鐘75轉,介質溫度恒定在37℃士0.5℃,分別將實施例1、實施例2制備的膠囊、對照樣投入到裝有上述溶出介質的溶出杯中,依法操作,經2小時,取溶液10ml,0.45μm濾膜過濾,取濾液作為供試品溶液。另精密稱取右旋蘭索拉唑對照品20mg,至20ml棕色容量瓶,用甲醇溶液并定容至刻度,即得標準儲備液。移取該液1.0ml至200ml棕色容量瓶,用0.1NHCl稀釋并定容,作為對照溶液。取1cm的比色杯在301nm的波長下分別測定紫外吸收,扣除800-750nm波長段的平均值,計算釋放量。檢測實施例1、實施例2制備得到的右蘭索拉唑緩釋膠囊和對照樣在酸中的釋放量,檢測結果見表3。表3實施例實施例1實施例2實施例3對照樣(原研)酸中釋放量0.89%0.78%0.79%1.18%參比制劑為Dexilant膠囊(對照樣)由表3可知,本發明優選蘭索拉唑緩釋膠囊酸介質中的釋放量均為標示量的3%以下,優于對照樣。pH6.0釋放量:在上述剩余490ml的酸溶液中,加入配制好的pH6.0PBS緩沖液濃溶液210ml,混勻后調pH至6.0(可用(5mol/L)氫氧化鈉調整),作為溶出介質,轉速為每分鐘75轉,介質溫度恒定在37℃士0.5℃,依法操作,分別在5,10,20,30,45,60,120分鐘取樣10ml,0.45μm濾膜過濾,取續濾液作為供試品溶液。另移取4.0ml標準儲備溶液至200ml棕色容量瓶,用混勻的pH6.0緩沖液稀釋并定容,作為對照品溶液。取0.5cm的比色杯在230nm的波長下分別測定對照品溶液的紫外吸收,扣除800-750nm波長段的平均值,計算2小時的釋放量。pH7.4釋放量:在上述剩余630ml的緩沖液中,加入配制好的pH7.4PBS緩沖液濃溶液270ml,混勻后調pH至7.4,作為溶出介質,轉速為每分鐘75轉,介質溫度恒定在37℃士0.5℃,依法操作,分別在5,10,20,30,45,60,120分鐘取樣10ml,0.45μm濾膜過濾,取續濾液作為供試品溶液。另移取5.0ml標準儲備溶液至100ml棕色容量瓶,用混勻的pH7.4緩沖液稀釋并定容,作為對照品溶液。取0.5cm的比色杯在284nm的波長下分別測定紫外吸收,扣除800-750nm波長段的平均值,計算2小時的釋放量。結果見圖1,由圖1可知,本發明得到的緩釋膠囊的溶出速率與現有的原研樣品相當,符合人體生物學要求。測試例2:緩釋膠囊的穩定性實驗外觀本品應為白色至微黃色腸溶球狀顆粒。含量色譜條件液相色譜儀:Agilent1200或類似;色譜柱:C18,150×4.6mm,5μm或類似;流速:1.0ml/min;波長:285nm;柱溫:35℃;進樣量:20μl;流動相:0.02mol/L的乙酸銨:乙腈(60:40),混合,搖勻。0.02mol/L乙酸銨:稱取1.54g的乙酸銨用水溶解并稀釋至1000ml,搖勻。溶液配制稀釋劑:0.01MNaOH-CAN(1:1)供試液:精密稱取250mg顆粒至100ml棕色容量瓶內,加入約40ml的甲醇,立即超聲30分鐘,在超聲前幾分鐘,如果發現容量瓶內有小丸聚集,手動振搖使之分散。超聲結束后,冷卻至室溫,加甲醇定容至刻度,搖勻。取適量混勻后溶液至刻度離心管,在3000rpm轉速條件下離心10min。在0.45μm濾膜過濾。移取10ml至50ml量瓶中,用稀釋劑稀釋至刻度。對照液:精密稱定工作對照品50mg于100ml量瓶中,用稀釋液溶解并稀釋至刻度,吸取10.0ml于50ml量瓶中,用稀釋液稀釋至刻度。有關物質色譜條件液相色譜儀:Agilent1200或類似;色譜柱:AgilentC18,150×4.6mm,5μm或相似;流速:1.0ml/min;進樣量:20μl;波長:285nm;柱溫:35℃;流動相A:0.02M乙酸銨—乙腈(80:20)。0.02mol/L乙酸銨:稱取1.54g的乙酸銨用水溶解并稀釋至1000ml,搖勻;流動相B:乙腈。稀釋劑:0.01N氫氧化鈉—ACN(1:1)按下表進行梯度洗脫檢測結果見表4:表4相關物及外觀由表4結果可知,本發明制備得到的膠囊在長時間存放時,具有穩定性優勢,對照樣在加速兩個月后穩定性開始明顯降低,單雜和總雜含量明顯增加。測試例3:緩釋膠囊生物利用度試驗為了檢驗本發明制劑的生物利用度,研究了Beagle犬口服由實施例1,實施例2、實施例3制得的右蘭索拉唑緩釋膠囊和參比制劑(Dexilant膠囊)相對生物利用度。使用16只雄性Beagle犬進行研究,體重在15KG左右,禁食12小時。采用雙制劑雙周期交叉實驗設計,于給藥后0、0.5、1、1.5、2、2.5、3、4、6、8、12、24小時,取血2mL于有肝素的試管中,4000rpm離心10min,取上層血漿,然后HPLC測得右蘭索拉唑在犬體內的血藥濃度(微克/毫升)。結果見圖2。由圖2可知,本發明的右蘭索拉唑緩釋膠囊生物利用度與原研樣品的生物利用度相當。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1