一種鉑納米晶復合納米材料的制備方法及產品與流程
本發明涉及鉑納米晶材料制備領域,具體涉及一種鉑納米晶復合納米材料的制備方法及產品。
背景技術:
目前,盡管國內外醫療水平不斷提高,但惡性腫瘤仍嚴重威脅人類的生命安全。世界衛生組織(WHO)等權威機構已發布統計數據,在肝、肺、食道和胃等多種惡性腫瘤中,中國新增病例和死亡人數均居世界首位。
自1978年被美國FDA批準以來,順鉑廣泛應用于頭頸癌、卵巢癌、睪丸癌、膀胱癌、肺癌及結腸直腸癌等多種腫瘤的治療。由于細胞內的氯離子濃度較低,順鉑進入細胞后,其配體氯會被水分子取代,形成的正電鉑離子能夠與細胞內DNA、RNA和蛋白質等親核分子作用。其中,DNA為順鉑的主要作用靶點,順鉑多與DNA中的嘌呤堿基的N7位點結合,形成Pt-DNA加合物。
但是,普遍耐藥以及嚴重的毒副作用限制了順鉑在臨床治療的持續應用。臨床中很多病人存在先天或者獲得性順鉑耐藥性。癌癥病人在給予順鉑之后,腫瘤細胞會從各個通路抵御順鉑的作用,導致獲得性耐藥,如:1)通過調節細胞膜轉運體,使順鉑分子入胞量減少;2)增大細胞漿內含硫蛋白的解毒效應;3)DNA修復加快;4)提高細胞對DNA損傷的耐受性等。另外,順鉑會導致包括腎小管損傷在內的較為嚴重的腎毒性、胃腸道毒性、血液毒性和耳毒性等。而且病人體內順鉑的累積也是潛在的危險因素。
而近些年來,第二代、第三代鉑類藥物層出不窮,如卡鉑、奧沙利鉑、沙伯以及吡鉑等,雖然有一些改進,但至今沒有任何一種鉑類藥物能取代順鉑。因此,許多的研究人員致力于研究新型的鉑類復合材料來解決順鉑相關的一系列問題。
技術實現要素:
本發明的目的在于針對現有技術的不足,提供一種鉑納米晶復合納米材料的制備方法及產品,所得到的鉑納米晶復合納米材料具備良好的抗腫瘤活性,不僅可以克服腫瘤耐藥,而且對正常組織有良好的生物安全性。
本發明所提供的技術方案為:
一種鉑納米晶復合納米材料的制備方法,包括如下步驟:
1)將乙酰丙酮鉑溶解在油胺和油酸中,真空條件下在50~100℃下攪拌;升溫至150~250℃,繼續注入三乙基硼氫化鋰,反應1~60分鐘,不良溶劑沉淀,得到小尺寸鉑納米晶;
2)將步驟1)中得到的小尺寸鉑納米晶采用薄膜分散法或乳化溶劑揮發法,進行兩親性高分子的組裝修飾,得到鉑納米晶復合納米材料。
上述技術方案中,步驟1)中所得的小尺寸鉑納米晶的粒徑為1~10nm,經過步驟2)后得到的鉑納米晶復合納米材料的粒徑為1~600nm。小尺寸鉑納米晶與鉑納米晶復合納米材料所屬的粒徑范圍,便于應用于腫瘤治療。
鉑納米晶復合納米材料借助小尺寸鉑納米晶、功能性高分子以及腫瘤組織固有的特征微環境,實現對腫瘤細胞內DNA的大規模殺傷,進而高效殺傷腫瘤細胞。首先,功能性高分子以及高通透性和滯留效應(EPR效應)可以實現腫瘤組織靶向。入胞后,刺激介導納米材料解體為很多個小尺寸鉑納米晶,其極大的比表面積顯著加快鉑離子溢出速率;其次,腫瘤微酸環境以及內涵體的較大酸度會進一步促使鉑納米晶表面溶解腐蝕,釋放出大量鉑離子,擴散至細胞核內破壞DNA,進而導致腫瘤細胞死亡。利用功能性高分子靶向傳遞和微環境響應性解體伴隨pH調控鉑離子釋放,聯合使用多種策略,不僅增強對腫瘤的殺傷,同時也降低對正常組織的毒副作用。
所述兩親性高分子可以選用功能性高分子,具體優選為市售的兩親性高分子或合成的高分子聚合物(如刺激響應的高分子聚合物或連接腫瘤靶向分子的高分子聚合物)。
所述市售兩親性高分子選自泊洛沙姆、聚乙烯吡咯烷酮、聚乙烯醇、吐溫、維生素E聚乙二醇琥珀酸酯、聚乳酸-羥基乙酸共聚物、聚乳酸、司盤、磷脂、聚乙二醇、十二烷基硫酸鈉、十六烷基三甲基溴化銨、白蛋白、脂蛋白、蓖麻油聚氧乙烯醚、脂肪酸聚氧乙烯酯、脂肪酸聚氧乙烯醚、烷基酚聚氧乙烯醚和多元醇酯中的一種或多種。
所述刺激響應的高分子聚合物選自腫瘤pH響應的高分子聚合物、腫瘤ROS響應的高分子聚合物、腫瘤酶響應的高分子聚合物、光響應的高分子聚合物、熱響應的高分子聚合物、磁響應的高分子聚合物和超聲響應的高分子聚合物中的一種或多種。
所述腫瘤pH響應的高分子聚合物選自通過物理吸附或化學合成內含咪唑、哌啶、原酸酯鍵、馬來酸二甲酯鍵、肟鍵、縮醛/縮酮鍵、腙鍵、酰胺或酰腙鍵的一種或多種的親水-疏水嵌段高分子聚合物。
所述腫瘤ROS響應的高分子聚合物選自通過物理吸附或化學合成內含二硒鍵、琥珀酰亞胺-硫醚鍵、二硫鍵的一種或多種的親水-疏水嵌段高分子聚合物。
所述腫瘤酶響應的高分子聚合物選自通過物理吸附或化學合成內含對基質金屬蛋白酶、前列腺特異性抗原、組織蛋白酶B、分泌型磷脂酶A2、α-淀粉酶、賴氨酰基氧化酶、β-葡萄糖醛酸苷酶、成纖維細胞活化蛋白敏感的一種或多種的親水-疏水嵌段高分子聚合物。
所述連接腫瘤靶向分子選自葉酸、透明質酸、蛋白、多肽、抗體、核酸適配體、DNA和RNA中的一種或多種。
作為優選,所述步驟1)中真空條件下在50~100℃下攪拌0.5~2h。
作為優選,所述步驟1)中乙酰丙酮鉑、油胺、油酸和三乙基硼氫化鋰的投料比為20~200mg:2~20ml:0.01~0.5ml:0.05~1ml。
作為優選,所述步驟2)中的薄膜分散法的制備過程:將小尺寸鉑納米晶分散在良溶劑中,室溫下攪拌并加入兩親性高分子,減壓蒸發,水化,得到鉑納米晶復合納米材料。所述水化時優選使用pH緩沖液,進一步優選為PBS緩沖液。
作為優選,所述步驟2)中的乳化溶劑揮發法的制備過程:將小尺寸鉑納米晶分散在良溶劑中,室溫下攪拌并加入到兩親性高分子水溶液中,超聲,減壓蒸發,得到鉑納米晶復合納米材料。
作為優選,所述步驟2)中小尺寸鉑納米晶與兩親性高分子的質量投料比為1:1~50。通過調控二者之間的質量投料比,一方面,實現對刺激的靈敏響應,即于腫瘤部位實現刺激介導的分解組裝;另一方面,控制鉑納米晶復合納米材料中裝載的小尺寸鉑納米晶數量。
作為優選,所述兩親性高分子選自泊洛沙姆、聚乙烯吡咯烷酮、聚乙烯醇、吐溫、維生素E聚乙二醇琥珀酸酯和聚乳酸-羥基乙酸共聚物中的一種或幾種。
作為優選,所述兩親性高分子為通過物理吸附或化學合成的刺激響應的高分子聚合物,或者通過物理吸附或化學合成連接腫瘤靶向分子的高分子聚合物。
進一步優選,所述兩親性高分子選自泊洛沙姆-葉酸復合高分子、硬脂胺-聚(天冬氨酸-咪唑)高分子、脫氧膽酸-SS-透明質酸高分子或疏水陽離子穿透肽-MMP2敏感肽-聚乙二醇高分子。
作為優選,所述步驟1)中不良溶劑選自丙酮、乙醇、乙酸乙酯、甲醇、甲基吡咯烷酮、中鏈醇、乙腈、二甲基甲酰胺和二甲基亞砜中的一種或多種。
作為優選,所述步驟2)中良溶劑選自二氯甲烷、三氯甲烷、正己烷、環己烷和二氧六環中的一種或多種。
本發明還提供一種上述的制備方法得到的鉑納米晶復合納米材料。
同現有技術相比,本發明的有益效果體現在:
(1)首先通過合成小尺寸鉑納米晶,由于其表面的鉑離子溢出速率可由pH調控。在中性環境中,鉑納米晶表面鉑離子溢出速率很慢;而偏酸環境會加速表面腐蝕釋放大量鉑離子。在腫瘤治療中,腫瘤微酸環境以及內涵體的較大酸度會促使鉑納米晶表面溶解腐蝕,釋放出大量鉑離子,擴散至細胞核內破壞DNA,進而導致腫瘤細胞死亡;而到達正常組織的鉑納米晶因釋放鉑離子少,毒性很低。
(2)鉑納米晶復合納米材料使用功能性高分子對小尺寸鉑納米晶進行組裝修飾。借助功能性高分子以及高通透性和滯留效應(EPR效應)實現對腫瘤細胞的靶向,進而高效殺傷腫瘤細胞。
(3)鉑納米晶復合納米材料不僅可以克服腫瘤耐藥,而且對正常組織有良好的生物安全性。
(4)本發明涉及反應體系溫和,條件可控,具有良好的臨床轉化可能性。
附圖說明
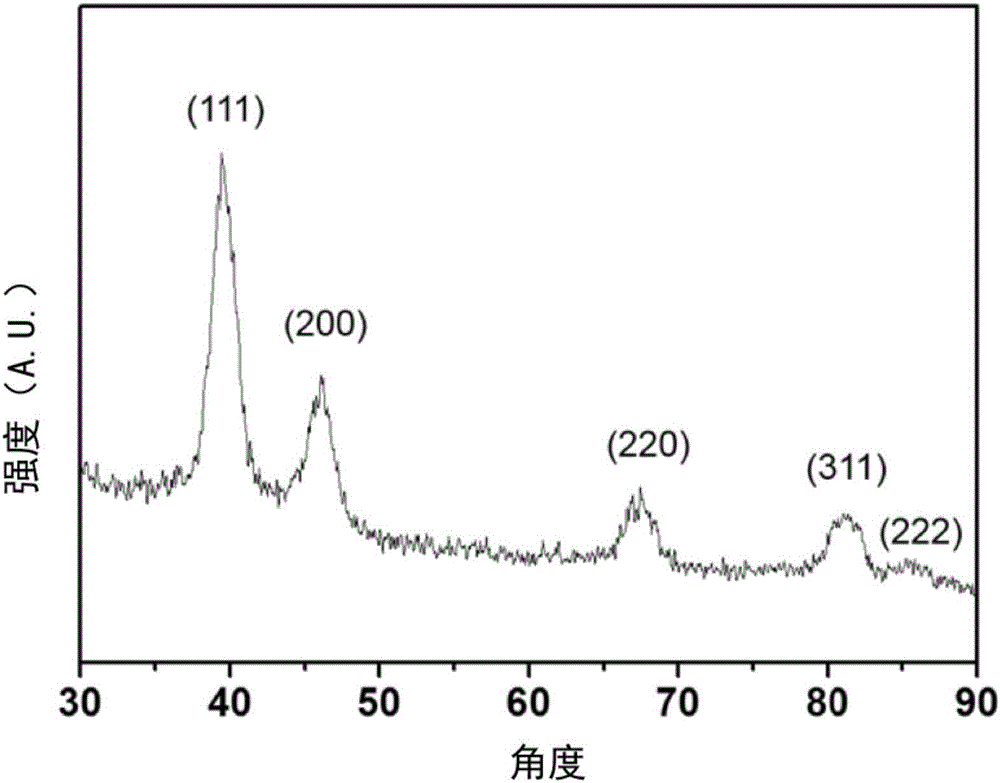
圖1為實施例1中的小尺寸鉑納米晶的X射線衍射圖;
圖2為實施例1中的小尺寸鉑納米晶的透射電子顯微鏡照片;
圖3為實施例3中的鉑納米晶復合納米材料的動態光散射粒度分布圖;
圖4為實施例4中的pH敏感鉑納米晶復合材料在pH7.4和pH5.5的透射電子顯微鏡照片;
圖5為鉑納米晶復合材料在不同pH下對腫瘤細胞的細胞毒性;
圖6為靜脈注射鉑納米晶復合材料的平均血藥濃度-時間曲線。
具體實施方式
下述實施例中的方法,如無特別說明,均為常規方法。
室溫溫度范圍為20-25℃。
下面結合具體的實施例和說明書附圖詳細闡述本發明小尺寸鉑納米晶和鉑納米晶復合納米材料的制備及其在腫瘤治療中的應用。
實施例1
小尺寸鉑納米晶的合成:將80mg乙酰丙酮鉑與7ml油胺,0.09ml油酸,真空條件下在70℃攪拌1小時,以5℃/min的速度升至170℃;將0.2ml三乙基硼氫化鋰注射到反應體系中,老化5分鐘,丙酮沉淀,離心得到小尺寸鉑納米晶。
對得到的小尺寸鉑納米晶進行X射線衍射分析,結果如附圖1所示;對小尺寸鉑納米晶用透射電鏡進行形貌表征,結果如附圖2所示,粒徑在2~4nm。
實施例2
小尺寸鉑納米晶的合成:將80mg乙酰丙酮鉑與5ml油胺,0.05ml油酸,真空條件下在70℃攪拌2小時,以5℃/min的速度升至170℃;將0.2ml三乙基硼氫化鋰注射到反應體系中,老化30分鐘,丙酮沉淀,離心得到鉑納米晶。得到的鉑納米粒尺寸在4~6nm。
實施例3
鉑納米晶復合納米材料的制備:將1.2mg小尺寸鉑納米晶(按照本實施例2方法制得)和20mg泊洛沙姆P188分散在氯仿中,室溫攪拌1h,減壓蒸發除去有機溶劑。加入3ml PBS(pH 7.4)水化,即得鉑納米晶復合納米材料。
利用動態光散射分析得到的鉑納米晶復合納米材料的粒度分布,結果如附圖3所示。
實施例4
pH敏感鉑納米晶復合材料的制備:將1.2mg小尺寸鉑納米晶(按照本實施例1方法制得)和20mg泊洛沙姆-葉酸復合高分子(F127-FA)分散在氯仿中,邊攪拌邊加入15mg硬脂胺-聚(天冬氨酸-咪唑)的甲醇溶液(氯仿:甲醇=10:1,v/v),室溫攪拌1h,減壓蒸發除去有機溶劑。加入3ml PBS(pH7.4)水化,得腫瘤pH敏感的鉑納米晶復合納米材料。
使用透射電鏡對得到的pH敏感的鉑納米晶復合材料在pH 7.4和pH 5.5進行形貌表征,結果如附圖4所示。結果顯示,該種鉑納米晶復合材料有良好的pH響應性。
實施例5
鉑納米晶復合納米材料的制備:將1.2mg小尺寸鉑納米晶(按照本實施例2方法制得)和20mg疏水脫氧膽酸-SS-透明質酸(HA-SS-DOCA)分散在氯仿中,室溫攪拌1h,減壓蒸發除去有機溶劑。加入3ml PBS(pH 7.4)水化,即得腫瘤ROX敏感的鉑納米晶復合納米材料。
實施例6
鉑納米晶復合納米材料的制備:將1.2mg小尺寸鉑納米晶(按照本實施例2方法制得)分散在氯仿中,滴入20mg疏水陽離子穿透肽-MMP2敏感肽-聚乙二醇(PepFect14-GPLGIAGQ-PEG)的水溶液中,探頭超聲(3分鐘,150W),即得腫瘤酶敏感的鉑納米晶復合納米材料。
實施例7
鉑納米晶復合納米材料的制備:將1.2mg小尺寸鉑納米晶(按照本實施例1方法制得)分散在氯仿中,滴入20mg維生素E聚乙二醇琥珀酸酯的水溶液中,探頭超聲(3分鐘,150W)形成均勻乳液。減壓蒸發除去有機溶劑,即得鉑納米晶復合納米材料。
性能實驗
一、鉑納米晶復合材料對人源腫瘤細胞系的細胞毒性
1、材料:腫瘤細胞株(肝癌HCCLM3);
2、方法:取對數生長期的人源腫瘤細胞,用新鮮的培養基將細胞密度調至1×104cells/ml,接種于96孔扳內,200μl/well,于37℃,5%CO2的培養箱內培養。細胞貼壁培養12-24h后換成含有鉑納米晶復合材料(按照本實施例4方法制得)的新鮮培養液。細胞加藥后繼續培養24h,吸出培養液并用200μl PBS洗。然后向96孔扳內加入MTT溶液(200μl/well),于37℃下共同孵育1~4h,吸出培養液,加入200μl DMSO,震蕩搖勻后,測定其光密度OD值。
數據處理,利用酶標儀相應軟件進行數據處理,計算每一種樣品3~5個孔OD值的平均值,利用平均值按如下公式計算細胞成活率(Cell Viability%)。
細胞成活率%=樣品組OD值的平均值/空白對照組OD值的平均值×100%(Cell Viability%=ODsample/ODcontrol×100%)
結果見實施例附圖5。
二、鉑納米晶復合材料在老鼠動物體內藥代動力學研究
1、材料和方法
1.1、藥品和試劑:鉑納米晶復合材料(按照本實施例3方法制得),規格10ml:3mg,自制;氯仿、甲醇、乙醇,分析級,國藥集團化學試劑有限公司;實驗用水,重蒸餾水。
1.2、動物:balb/c小鼠,體重(20±3)g,6只,雄性,由浙江大學試驗動物中心提供。
2、給藥方案與樣品采集:
balb/c雄性小鼠實驗前禁食12小時,按2mg/kg劑量于尾靜脈注射鉑納米復合材料,給藥后于0.0833,0.1667,0.25,0.5,0.75,1,2,4,6,8,12h,眼眶取血約0.1ml全血置于肝素化試管中,待測。
3、全血樣品處理及分析:
精密吸取全血樣品50μl,加入5ml 70%硝酸。室溫溶解24h后,熱臺揮去濃硝酸,用2%稀硝酸稀釋至5ml,于ICP-MS定量分析。靜脈注射鉑納米復合材料的平均血藥濃度-時間曲線見附圖6。
以上所述實施例對本發明的技術方案和有益效果進行了詳細說明,應理解的是以上所述僅為本發明的具體實施例,并不用于限制本發明,凡在本發明的原則范圍內所做的任何修改,補充和等同替換等,均應包含在本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!