一種還原敏感納米膠束的制備及應用的制作方法
本發明涉及一種兩親性嵌段聚合物的制備和應用,特別是一種還原敏感納米膠束的制備和應用。
背景技術:
近幾十年來,兩親性嵌段聚合物形成的膠束在藥物釋放領域引起了極大的興趣。各種納米載體廣泛發展應用于改善癌癥化療效果,這些納米載體由于其增強的通透性和滯留(EPR)效應而具有靶向控制釋放抗癌藥物的能力。基于兩親嵌段聚合物的聚合物膠束是一種抗癌藥物納米載體,廣泛應用于藥物輸送,其具有多種優異的顯著特征,包括長循環時間、良好的藥物溶解性以及腫瘤位點的被動靶向能力(Deng,et al.J.Nano Today 2012,7,467—480)。兩親性聚合物通過分子間的相互作用在水中可以自組裝形成聚合物納米膠束(Micelles)。納米膠束作為藥物載體進入體內,可以有效地減少人體網狀內皮系統(RES)巨噬細胞的吞噬,能穿越細胞間隙,可通過人體最小的毛細血管及血腦屏障(BBB)并被細胞組織吸收,釋放出抗癌膠束殺死癌變細胞。同時,納米膠束可以避免藥物活性喪失,有利于藥物的貯藏和運輸。因此聚合物納米膠束在藥物的控制釋放上具有巨大應用潛力。
制備兩親聚合物的一個方法是將末端官能化的親水鏈段作為大分子引發劑開環聚合疏水聚合物的單體形成具有疏水鏈段的兩親結構。常見的末端官能化的親水鏈段包括聚乙二醇(PEG)、聚磷酸酯(PEEP)等。常用的可生物降解的疏水鏈段包括聚酯(聚己內酯,聚丙交酯,聚碳酸酯等)和聚氨基酸(如聚γ-芐酯-L-谷氨酸、聚γ-芐酯-L-天冬氨酸、聚苯丙氨酸和聚亮氨酸等)。作為親水鏈段,聚磷酸酯(PEEP)由于良好的生物相容性,以及可以通過水解和酶催化的可降解性,在生物醫學領域的應用引起了廣泛關注。作為疏水鏈段,天然和合成的聚氨基酸具有良好的生物相容性,生物降解性,代謝產物對人體無害,且無免疫原性(Tang,et al.Bioconjugate Chem.2009,20,1095-1099;Liu,et al.Biomacromolecules 2011,12(5),1567-1577;Li,et al.AngewChemInt Ed Engl 2009,48(52),9914-9918)。
兩親性共聚物通過自組裝形成的聚集體如納米粒子、納米膠束、聚合物囊泡等藥物載體雖然可延長在體內的循環時間,增加藥物載體在腫瘤部位的蓄積,但往往不能有效地將藥物釋放出來,從而降低了藥效。引入響應性是增強納米藥物載體EPR效應的主要方法。近年來,開發具有環境敏感性(pH、溫度、氧化還原環境等)的納米載體引起科研工作者的極大興趣(Chen,et al.J.Control.Release,2013,169:171-179;Zhong,et al.Biomacromolecules,2013,14:3723-3730)。其中具有還原響應性的納米載體成為研究熱點之一(Sun,et al.J.Biomaterials,2009,30(31):6358-6366;Chen et al.J.Control.Release,2013,169:171-179;Zhong,et al.Biomacromolecules,2013,14:3723-3730)。此類兩親性嵌段聚合物中親水段多為PEG,而聚磷酸酯(PEEP)作為親水段的具有響應性的聚合物的報道相對較少。
技術實現要素:
本發明的目的是要提供一種還原敏感納米膠束的制備及應用,解決兩親性共聚物通過自組裝形成的聚集體如納米粒子、納米膠束、聚合物囊泡藥物載體,不能有效地將藥物釋放出來,降低了藥效的問題。
為達到上述目的,本發明具體技術方案是:該還原敏感納米膠束是由兩親性嵌段聚合物通過自組裝形成,膠束由親水殼及疏水內核構成的;所述的兩親性嵌段聚合物是還原響應性聚磷酸酯-聚氨基酸嵌段聚合物;所述的兩親性嵌段聚合物主鏈通過還原敏感的硫硫鍵連接,構成納米膠束。
所述的親水殼為聚磷酸酯,聚磷酸酯分子量為1000~10000Da;所述的疏水內核為聚谷氨酸芐酯、聚天冬氨酸芐酯聚或N-芐氧羰基賴氨酸中的一種,聚氨基酸酯分子量為500~10000Da。
所述親水段的聚合度固定為36,疏水段的聚合度分別為32、48、64。
將兩親性嵌段聚合物先溶在有機溶劑中,室溫攪拌條件下向聚合物溶液中滴加質量百分比為180%-270%的二次水;通過自組裝形成以聚磷酸酯為親水殼,聚氨基酸酯為疏水內核的納米膠束;所述納米膠束的粒徑為10~300nm,粒徑分布PDI為0.01~0.30。
所述的聚合物溶液為聚合物質量百分比濃度為0.2%的二甲亞砜、四氫呋喃或N,N-二甲基甲酰胺溶液;所述的有機溶劑包括:二甲亞砜、四氫呋喃或N,N-二甲基甲酰胺。
所述的兩親性嵌段聚合物是還原響應性聚磷酸酯-聚氨基酸嵌段聚合物,具有還原性聚磷酸酯-聚谷氨酸芐酯類兩親性型嵌段聚合物的制備方法是:在室溫下,通過含有二硫鍵的氨基末端聚磷酸酯(PEEP-SS-NH2)作為大分子引發劑,對L-谷氨酸-γ-芐酯-N-羧基環內酸酐(BLG-NCA)開環聚合合成一系列兩親嵌段聚合物;
具體操作如下:
在氮氣保護下,將0.22g,0.04mmol的氨基末端聚磷酸酯和0.56g,2.12mmol的L-谷氨酸-γ-芐酯-N-羧基環內酸酐BLG-NCA溶于5mL無水DMF中,35℃攪拌反應48h后,反應溶液沉降于冰乙醚中,真空干燥即得到還原敏感的嵌段共聚物PEEP-SS-PBLG。所述兩親性嵌段聚合物中聚谷氨酸鏈段單元通過加入的BLG-NCA與PEEP的比例、反應時間、反應溫度實施調節。
氨基末端聚磷酸酯制備,所述的氨基末端聚磷酸酯為聚合物,其合成是以小分子異丙醇為引發劑,辛酸亞錫Sn(Oct)2為催化劑,對環狀磷酸酯單體開環聚合合成羥基末端的聚磷酸酯后,再依次與丁二酸酐(SA)及半胱胺反應得到;
具體操作如下:
(1)在氮氣保護下,將191.4mg,3.19mmol的異丙醇和10g,65.8mmol的EEP單體溶于48mL無水THF中,將324.2mg,0.8mmol的辛酸亞錫加入體系,35℃攪拌反應3h后,將體系沉降于甲醇/冰乙醚中,常溫真空干燥得到聚合物PEEP;所述的甲醇/冰乙醚為v/v,1:10;
(2)在氮氣保護下,將5.5g,1.0mmol的羥基末端的聚磷酸酯PEEP和0.12g,1.2mmol的丁二酸酐溶于50mL二氯甲烷/吡啶的混合溶液中,將體系置于25℃下攪拌反應24h;
(3)反應結束,將體系在冰乙醚中沉降兩次,常溫真空干燥得到羧基末端的聚磷酸酯(PEEP-COOH);
(4)在氮氣保護下,將2.8g,0.5mmol的聚磷酸酯、0.47g,2.5mmol的1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC·HCl)和0.12g,1.0mmol的N-羥基琥珀酰亞胺(NHS)溶于25mL無水DMSO中,于常溫下攪拌反應過夜;
(5)然后將上述反應混合液逐滴滴加到2.21g,9.8mmol的半胱胺鹽酸鹽溶液中,繼續于常溫下攪拌反應48h;
(6)反應結束后,用50mL二氯甲烷萃取3次;
(7)旋轉蒸發儀濃縮后,沉降于冰乙醚中,真空干燥得到含有二硫鍵的氨基末端聚磷酸酯(PEEP-SS-NH2)。
還原敏感納米膠束作為藥物載體的應用:將疏水性藥物先溶在有機溶液中,再與所述兩親性嵌段聚合物的有機溶液共同攪拌,然后再滴加有機溶液的2倍體積的二次水,將得到的溶液攪拌1小時后透析,得到包裹藥物的納米膠束;所述疏水性藥物選用但不局限于:阿霉素,紫杉醇,姜黃素或喜樹堿中的一種。
納米膠束的降解環境:納米膠束在還原環境中降解,用以降解的還原劑選自含巰基的分子或含三價磷的化合物;所述的含巰基的分子具體為:1,4-二硫代-D,L-蘇丁醇(DTT),谷胱甘肽(GSH);所述的含三價磷的化合物具體為:三(2-氯乙基)磷酸酯(tris(2-carboxyethyl)-phosphine,TCEP)。
當DTT的濃度為10mM的時候,上述還原敏感的納米膠束會降解。
由于采用了上述技術方案,兩親性嵌段聚合物在水中自組裝形成尺寸穩定,分布均一的納米膠束,兩親性嵌段聚合物PEEP-SS-PBLG,其中,PEEP在生理環境下能夠通過水解或酶催化的方式降解,聚磷酸酯絕大多數都具有良好的生物相容性,沒有毒副作用,其安全性得到FDA認證;聚氨基酸酯PBLG生物相容性好,在體內可被酶降解成小分子而被排出體外。因此整個體系具有非常優良的生物相容性。
聚磷酸酯作為親水鏈段,聚氨基酸酯作為疏水鏈段,得到兩親性嵌段聚合物,可以自組裝形成納米膠束,由于聚合物中間含有硫硫鍵,這種納米膠束對細胞內的還原環境敏感,能斷開硫硫鍵,快速降解。
納米膠束具有還原敏感性,所述納米膠束作為藥物載體,能提高疏水藥物在體內血液循環時的穩定性,提高納米膠束被腫瘤細胞內吞的效率,從而提高藥物的生物利用度,同時納米膠束降解后可方便排除體外。
本發明優點:
⑴由于本發明的兩親性嵌段聚合物親水段和疏水段通過具有還原敏感的硫硫鍵連接,因此可以通過對兩親性嵌段聚合物自組裝得到穩定的還原敏感性納米膠束,此納米膠束具有較小的臨界膠束濃度,所以在細胞外和血液中不易解離,從而保證納米膠束包封的藥物穩定;克服了藥物在體內易被泄漏、運載效率低、循環時間短等不足。
⑵一旦進入腫瘤細胞,此納米膠束在細胞還原性條件下則快速解降解,藥物被快速釋放出來,從而產生高效治療作用,解決了藥物載體藥物釋放緩慢,容易產生抗藥性的問題,達到了本發明的目的。
附圖說明:
圖1是本發明實施例一、二、三中制備聚合物PEEP-SS-PBLG的合成路線圖。
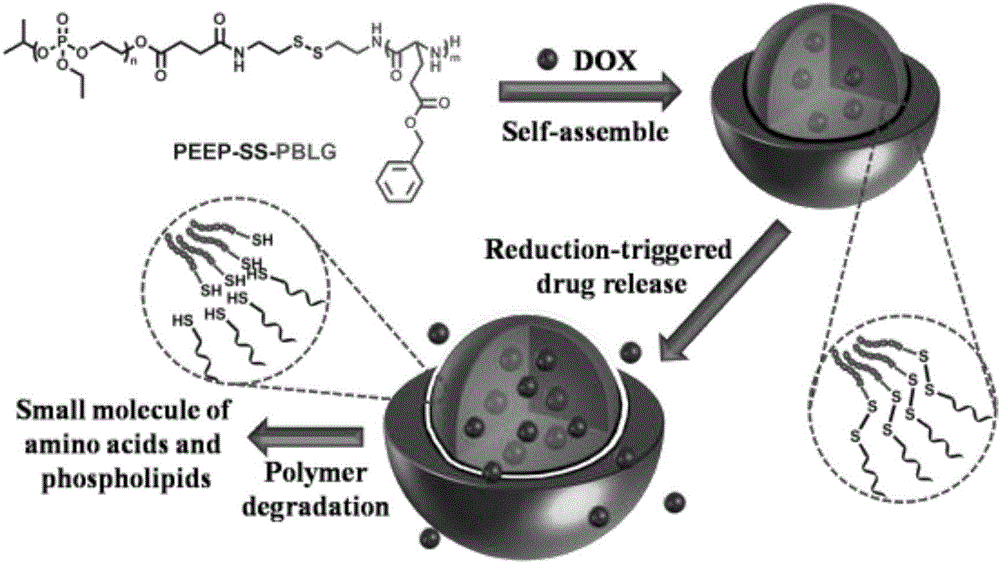
圖2是本發明實施例所得聚合物PEEP-SS-PBLG自組裝成膠束的工作原理示意圖。
具體實施方式
本發明的還原敏感納米膠束是由兩親性嵌段聚合物通過自組裝形成,膠束由親水殼及疏水內核構成的;所述的兩親性嵌段聚合物是還原響應性聚磷酸酯-聚氨基酸嵌段聚合物;所述的兩親性嵌段聚合物主鏈通過還原敏感的硫硫鍵連接,構成納米膠束。
所述的親水殼為聚磷酸酯,聚磷酸酯分子量為1000~10000Da;所述的疏水內核為聚谷氨酸芐酯、聚天冬氨酸芐酯聚或N-芐氧羰基賴氨酸中的一種,聚氨基酸酯分子量為500~10000Da。
所述親水段的聚合度固定為36,疏水段的聚合度分別為32、48、64。
納米膠束的制備方法:將兩親性嵌段聚合物先溶在有機溶劑中,室溫攪拌條件下向聚合物溶液中滴加質量百分比為180%-270%的二次水;通過自組裝形成以聚磷酸酯為親水殼,聚氨基酸酯為疏水內核的納米膠束;所述納米膠束的粒徑為10~300nm,粒徑分布PDI為0.01~0.30。
所述的聚合物溶液為聚合物質量百分比濃度為0.2%的二甲亞砜、四氫呋喃或N,N-二甲基甲酰胺溶液;所述的有機溶劑包括:二甲亞砜、四氫呋喃或N,N-二甲基甲酰胺。
所述的兩親性嵌段聚合物是還原響應性聚磷酸酯-聚氨基酸嵌段聚合物,具有還原性聚磷酸酯-聚谷氨酸芐酯類兩親性型嵌段聚合物的制備方法是:在室溫下,通過含有二硫鍵的氨基末端聚磷酸酯(PEEP-SS-NH2)作為大分子引發劑,對L-谷氨酸-γ-芐酯-N-羧基環內酸酐(BLG-NCA)開環聚合合成一系列兩親嵌段聚合物;
具體操作如下:
在氮氣保護下,將0.22g,0.04mmol的氨基末端聚磷酸酯和0.56g,2.12mmol的L-谷氨酸-γ-芐酯-N-羧基環內酸酐BLG-NCA溶于5mL無水DMF中,35℃攪拌反應48h后,反應溶液沉降于冰乙醚中,真空干燥即得到還原敏感的嵌段共聚物PEEP-SS-PBLG。所述兩親性嵌段聚合物中聚谷氨酸鏈段單元通過加入的BLG-NCA與PEEP的比例、反應時間、反應溫度實施調節。
氨基末端聚磷酸酯制備,所述的氨基末端聚磷酸酯為聚合物,其合成是以小分子異丙醇為引發劑,辛酸亞錫Sn(Oct)2為催化劑,對環狀磷酸酯單體開環聚合合成羥基末端的聚磷酸酯后,再依次與丁二酸酐(SA)及半胱胺反應得到;
具體操作如下:
(1)在氮氣保護下,將191.4mg,3.19mmol的異丙醇和10g,65.8mmol的EEP單體溶于48mL無水THF中,將324.2mg,0.8mmol的辛酸亞錫加入體系,35℃攪拌反應3h后,將體系沉降于甲醇/冰乙醚中,常溫真空干燥得到聚合物PEEP;所述的甲醇/冰乙醚為v/v,1:10;
(2)在氮氣保護下,將5.5g,1.0mmol的羥基末端的聚磷酸酯PEEP和0.12g,1.2mmol的丁二酸酐溶于50mL二氯甲烷/吡啶的混合溶液中,將體系置于25℃下攪拌反應24h;
(3)反應結束,將體系在冰乙醚中沉降兩次,常溫真空干燥得到羧基末端的聚磷酸酯(PEEP-COOH);
(4)在氮氣保護下,將2.8g,0.5mmol的聚磷酸酯、0.47g,2.5mmol的1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC·HCl)和0.12g,1.0mmol的N-羥基琥珀酰亞胺(NHS)溶于25mL無水DMSO中,于常溫下攪拌反應過夜;
(5)然后將上述反應混合液逐滴滴加到2.21g,9.8mmol的半胱胺鹽酸鹽溶液中,繼續于常溫下攪拌反應48h;
(6)反應結束后,用50mL二氯甲烷萃取3次;
(7)旋轉蒸發儀濃縮后,沉降于冰乙醚中,真空干燥得到含有二硫鍵的氨基末端聚磷酸酯(PEEP-SS-NH2)。
環狀磷酸酯單體2-乙氧基-2-氧-1,3,2-二氧磷雜環戊烷(EEP)的合成是以三氯化磷為起始原料,與乙二醇通過親核取代環合形成2-氯-1,3,2-二氧磷雜環戊烷,再經過與氧氣作用得到2-氯-2-氧-1,3,2-二氧磷雜環戊烷的重要磷酰氯中間體,最后與乙醇反應,以三乙胺(TEA)作為縛酸劑,合成環狀磷酸酯單體EEP;
具體操作如下:
(1)氮氣保護下,將350mL無水二氯甲烷和412.5g,3mol的三氯化磷加入燒瓶中;
(2)攪拌均勻后,將186.0g,3mol的乙二醇劇烈攪拌下緩慢滴加到體系中,室溫反應30分鐘,停止反應后除去溶劑,減壓蒸餾得到無色透明油狀產物2-氯-1,3,2-二氧磷雜環戊烷;
(3)氮氣保護下,量取480mL無水苯,加入1L單口瓶中,再加入240.0g,1.9mol的2-氯-1,3,2-二氧磷雜環戊烷,加熱至50℃,攪拌均勻后,通入干燥氧氣氧化;
(4)24h后停止反應,旋轉蒸發除去苯,減壓蒸餾得到無色透明油狀產物2-氯-2-氧-1,3,2-二氧磷雜環戊烷;
(5)氮氣保護下,將6.8g,148.2mmol乙醇與等摩爾量的15.0g,148.2mmol的三乙胺溶解在100mL甲苯中,得到的混合溶液冷卻至-5℃;
(6)再將21.1g,148.2mmol的2-氯-2-氧-1,3,2-二氧磷雜環戊烷溶解于50mL甲苯中,攪拌下,將其緩慢滴加入低溫的混合溶液中;
(7)滴加完畢后,室溫攪拌1.5h,然后在氮氣保護下過濾并除去沉淀物;
(8)將濾液濃縮并減壓蒸餾兩次得到無色油狀產物2-乙氧基-2-氧-1,3,2-二氧磷雜環戊烷。
還原敏感納米膠束作為藥物載體的應用:將疏水性藥物先溶在有機溶液中,再與所述兩親性嵌段聚合物的有機溶液共同攪拌,然后再滴加二次水(有機溶液量的2-3倍),將得到的溶液攪拌1小時后透析,得到包裹藥物的納米膠束;所述疏水性藥物選用但不局限于:阿霉素,紫杉醇,姜黃素或喜樹堿中的一種。
納米膠束的降解環境:納米膠束在還原環境中降解,用以降解的還原劑選自但不限于:含巰基的分子或含三價磷的化合物;所述的含巰基的分子具體為:1,4-二硫代-D,L-蘇丁醇(DTT),谷胱甘肽(GSH);所述的含三價磷的化合物具體為:三(2-氯乙基)磷酸酯(tris(2-carboxyethyl)-phosphine,TCEP)。
下面結合附圖及實施例對本發明作進一步描述:
實施例1:合成環狀磷酸酯單體
環狀磷酸酯單體2-乙氧基-2-氧-1,3,2-二氧磷雜環戊烷(EEP)是以三氯化磷為起始原料,與乙二醇通過親核取代環合形成2-氯-1,3,2-二氧磷雜環戊烷(CP),再經過與氧氣作用得到2-氯-2-氧-1,3,2-二氧磷雜環戊烷(COP)的重要磷酰氯中間體,最后將COP與乙醇反應,以三乙胺(TEA)作為縛酸劑,合成環狀磷酸酯單體EEP。具體操作如下:
氮氣保護下,將350mL無水二氯甲烷和三氯化磷(412.5g,3mol)加入燒瓶中。攪拌均勻后,將乙二醇(186.0g,3mol)劇烈攪拌下緩慢滴加到體系中,室溫反應30分鐘,停止反應后除去溶劑,減壓蒸餾得到無色透明油狀產物2-氯-1,3,2-二氧磷雜環戊烷CP(b.p.為42℃/1600Pa,產率為74.7%)。
氮氣保護下,量取480mL無水苯,加入1L單口瓶中,再加入2-氯-1,3,2-二氧磷雜環戊烷(240.0g,1.9mol),加熱至50℃,攪拌均勻后,通入干燥氧氣氧化。24h后停止反應,旋轉蒸發除去苯,減壓蒸餾得到無色透明油狀產物2-氯-2-氧-1,3,2-二氧磷雜環戊烷COP(b.p.為88-90℃/107Pa,產率為86.3%)。
氮氣保護下,將乙醇(6.8g,148.2mmol)與等摩爾量的三乙胺(15.0g,148.2mmol)溶解在100mL甲苯中,得到的混合溶液冷卻至-5℃。再將2-氯-2-氧-1,3,2-二氧磷雜環戊烷(21.1g,148.2mmol)溶解于50mL甲苯中,攪拌下,將其緩慢滴加入低溫的混合溶液中。滴加完畢后,室溫攪拌1.5h,然后在氮氣保護下過濾并除去沉淀物。將濾液濃縮并減壓蒸餾兩次得到無色油狀產物2-乙氧基-2-氧-1,3,2-二氧磷雜環戊烷(b.p.為85-87℃/113Pa,產率為68.5%)。
實施例2:合成聚合物PEEP-SS-NH2
該大分子引發劑是以小分子異丙醇為引發劑,辛酸亞錫Sn(Oct)2為催化劑,對環狀磷酸酯單體開環聚合合成羥基末端的聚磷酸酯PEEP-OH后,再依次與丁二酸酐(SA)及半胱胺反應得到。
在氮氣保護下,將異丙醇(191.4mg,3.19mmol)和EEP單體(10g,65.8mmol)溶于48mL無水THF中,將辛酸亞錫(324.2mg,0.8mmol)加入體系,35℃攪拌反應3h后,將體系沉降于甲醇/冰乙醚(v/v,1:10)中,常溫真空干燥得到聚合物PEEP。產率為73.5%。
在氮氣保護下,將羥基末端的聚磷酸酯PEEP-OH(5.5g,1.0mmol)和丁二酸酐(0.12g,1.2mmol)溶于50mL二氯甲烷/吡啶的混合溶液中,將體系置于25℃下攪拌反應24h。反應結束,將體系在冰乙醚中沉降兩次,常溫真空干燥得到羧基末端的聚磷酸酯(PEEP-COOH)。產率為91.6%。
在氮氣保護下,將PEEP-COOH(2.8g,0.5mmol)、1-乙基-(3-二甲基氨基丙基)碳酰二亞胺鹽酸鹽(EDC·HCl)(0.47g,2.5mmol)和N-羥基琥珀酰亞胺(NHS)(0.12g,1.0mmol)溶于25mL無水DMSO中,于常溫下攪拌反應過夜。然后將上述反應混合液逐滴滴加到半胱胺鹽酸鹽(2.21g,9.8mmol)的溶液中,繼續于常溫下攪拌反應48h。反應結束后,用50mL二氯甲烷萃取3次。旋轉蒸發儀濃縮后,沉降于冰乙醚中,真空干燥得到含有二硫鍵的氨基末端聚磷酸酯(PEEP-SS-NH2),產率為85.7%。
實施例3:合成聚合物PEEP-SS-PBLG
該兩親性嵌段共聚物是以PEEP-SS-NH2為大分子引發劑,在無水無氧條件下,對BLG-NCA單體進行開環聚合得到。簡言之,在氮氣保護下,將PEEP-SS-NH2(0.22g,0.04mmol)和L-谷氨酸-γ-芐酯-N-羧基環內酸酐BLG-NCA(0.56g,2.12mmol)溶于5mL無水DMF中,35℃攪拌反應48h后,反應溶液沉降于冰乙醚中,真空干燥即得到還原敏感的嵌段共聚物PEEP-SS-PBLG。
實施例4:聚磷酸酯-SS-聚谷氨酸芐酯(PEEP-SS-PBLG)納米膠束制備
聚合物PEEP-SS-PBLG的納米膠束通過透析方法制備。具體過程是:將2mg聚合物PEEP-SS-PBLGL溶于1mL二甲亞砜,在25℃攪拌條件下,向其中滴加2mL去離子水。得到的溶液攪拌1小時后,裝入預先準備好的透析袋中(SPECTRA/POR,MWCO:3500),用去離子水透析24小時。
實施例5:聚磷酸酯-聚谷氨酸芐酯(PEEP-PBLG)納米膠束制備
聚合物PEEP-PBLG納米膠束通過透析方法制備。具體過程是:將2mg聚合物PEEP-PBLG溶在1mL二甲亞砜中,在25℃攪拌條件下,向其中滴加2mL去離子水。得到的溶液攪拌1小時后,裝入預先準備好的透析袋中(SPECTRA/POR,MWCO:3500),用去離子水透析24小時。
按照實施例4和例5制備不同疏水單元的兩親性嵌段聚合物膠束,并測試所形成的納米膠束的尺寸和分布,結果如表1所示:
表1不同單元的疏水鏈段的兩親性嵌段聚合物納米膠束
實施例6:還原敏感的聚磷酸酯-SS-聚谷氨酸芐酯納米膠束的降解
氮氣保護下,將稱好的DTT加到2.0mL PEEP-SS-PBLG聚合物納米膠束(0.001毫克/毫升)的玻璃樣品池中,使最終DTT的濃度是10mM。同時準備同樣的納米膠束,不加入DTT,作為對照。然后兩個玻璃樣品池用橡膠塞封住,搖勻,置于37℃恒溫搖床(200rpm)中,在選定時間、37℃下,通過動態激光光散射(DLS)來跟蹤測定顆粒的粒徑變化。當在膠束溶液中加入一定量的DTT后,膠束很快發生變化,3.5h后溶液中出現大量的粒徑約1000nm的聚集體,并且在繼續震蕩至9h后溶液中只有粒徑約1000nm的聚集體,這表明PEEP-SS-PBLG膠束在還原環境下,親水鏈段PEEP和疏水鏈段PBLG之間的二硫鍵被還原觸發而斷裂,導致膠束發生解離,親水PEEP外殼脫落,從而粒子發生聚集。相對而言,沒有加DTT的膠束溶液在震蕩過程中幾乎沒有發生變化。
實施例7:包裹模型小分子抗癌藥物阿霉素及其DTT觸發釋放
PEEP-SS-PBLG和PEEP-PBLG膠束對抗癌藥物的包封都是通過透析法實現的。這里,以PEEP-SS-PBLG為例,取2.4mg的該聚合物溶解在0.9mL二甲亞砜中,將設計好的載藥量15%所需的阿霉素加入其中,超聲0.5h后,在室溫攪拌條件下,向二甲亞砜溶液中緩慢滴加1.8mL二次水,滴加完畢后再超聲1h。然后將混合溶液移至透析袋(MWCO:3500)中,透析24h后取出。
DOX在聚合物納米膠束中的包封率的確定:取一定量的載藥納米膠束溶液,先通過冷凍干燥法將溶液中的水除去,然后加入0.5mL二甲亞砜超聲1小時,取該溶液20μL加入到3mL二甲亞砜中,通過熒光測試,結合阿霉素的標準曲線計算包封率。
包封率=(納米膠束中阿霉素的質量/投入的阿霉素的質量)×100%
按照實施例七制備不同聚合物的載藥納米膠束,并測試所得納米膠束的尺寸、分布以及包封率等,結果如表2所示:
表2不同聚合物載藥量的載藥膠束
實施例8:載有阿霉素的載藥膠束的DTT觸發釋放
把載有DOX的納米膠束分成同體積兩份,裝入相應的透析袋中,前者被浸入40mL含有10mM DTT的PB溶液中,后者被浸入40mL相同溫度的PB(20mM)中,置于37℃恒溫搖床(200rpm)中。隔一定時間取設定體積的透析袋外的透析液用來測定其熒光強度,并補充相應體積的新鮮液體。持續實驗24小時。
結果表明:載有DOX的還原敏感的納米膠束在10mM DTT、37℃下20mM PB中,PEEP-SS-PBLG聚合物載藥膠束在沒有DTT存在的條件下,24h內僅僅釋放出25.7%的DOX。而在模擬細胞質和細胞核的還原環境(10mM DTT)下,PEEP-SS-PBLG載藥膠束能夠快速地釋放出DOX,且釋放量高達92.1%。相反,作為對照的非還原敏感PEEP-PBLG載藥膠束即使在10mM的DTT的還原環境下,在24h內也僅僅釋放出24.5%的DOX。實驗結果表明,含有二硫鍵的PEEP-SS-PBLG載藥膠束,對還原環境有響應性,可以在體內還原環境中更快地釋放藥物,提高療效。
本專利涉及的物質名稱
- 還沒有人留言評論。精彩留言會獲得點贊!