反式法尼基硫代水楊酸的應(yīng)用的制作方法
本發(fā)明屬于抗癡呆藥物領(lǐng)域,具體涉及一種反式法尼基硫代水楊酸(Trans Farnesyl Thiosalicylic Acid/Salirasib,F(xiàn)TS)在制備抗癡呆藥物中的應(yīng)用。
背景技術(shù):
癡呆已被稱為世界上當(dāng)前的“流行病”之一,在發(fā)達(dá)國(guó)家被估計(jì)列為第四位最常見的死亡原因。所謂的老年性癡呆癥,最常見的為阿爾茨海默病(Alzheimer’s disease,AD)。阿爾茨海默病是一種發(fā)生在老年期及老年前期以進(jìn)行性認(rèn)知障礙為主要臨床表現(xiàn)的神經(jīng)退行性疾病。隨著世界人口進(jìn)入老齡化,阿爾茨海默病的發(fā)病率快速上升,幾乎每7秒鐘就有一人患病,預(yù)測(cè)到2050年將增加到11540萬人。但是,迄今仍然缺乏療效顯著和可靠、副作用少、維持療效的抗癡呆藥物。
阿爾茨海默病腦的主要特征性病理變化為大腦皮層萎縮,β-淀粉樣蛋白(Aβ)沉積,神經(jīng)原纖維纏結(jié),膽堿能神經(jīng)系統(tǒng)損害,以及老年斑的形成。中樞膽堿能神經(jīng)是構(gòu)成學(xué)習(xí)記憶的重要生物學(xué)基礎(chǔ)。海馬的乙酰膽堿受體α7亞型(α7nACh)介導(dǎo)鈣離子內(nèi)流參與記憶的形成。AD腦中膽堿能神經(jīng)元選擇性退變。臨床病理分析發(fā)現(xiàn)α7nACh受體在AD患者腦中的密度明顯下降,且α7nACh受體水平降低與AD患者認(rèn)知功能評(píng)分密切相關(guān)。Aβ能直接抑制α7nACh受體功能,損害突觸傳遞和可塑性,提出α7nACh受體損害是AD早期認(rèn)知障礙的重要病理機(jī)制。AD腦的神經(jīng)細(xì)胞死亡,導(dǎo)致谷氨酸NMDA受體減少和功能降低也被認(rèn)為是認(rèn)知功能減退的關(guān)鍵病理機(jī)制。
Ras傳導(dǎo)通路參與支氣管哮喘、腫瘤等疾病的發(fā)生,因此Ras信號(hào)通路被作為抗腫瘤和治療支氣管哮喘的靶標(biāo)。反式法尼基硫代水楊酸(Trans Farnesyl Thiosalicylic Acid/Salirasib,F(xiàn)TS)是一種新型的Ras抑制劑。FTS能模擬Ras的幾基末端法尼半胱氨酸,將活化Ras從它的膜鑲嵌結(jié)構(gòu)域上移去從而發(fā)揮Ras抑制功能。FTS對(duì)結(jié)合活化GTP的Ras具有明顯的選擇性抑制作用。在動(dòng)物實(shí)驗(yàn)中,F(xiàn)TS無明顯毒性或不良副作用。
技術(shù)實(shí)現(xiàn)要素:
解決的技術(shù)問題:本發(fā)明提供一種反式法尼基硫代水楊酸(FTS)在制備抗癡呆藥物中的應(yīng)用。
技術(shù)方案:反式法尼基硫代水楊酸在制備抗癡呆藥物中的應(yīng)用。。
所述反式法尼基硫代水楊酸(FTS)的結(jié)構(gòu)為
FTS別名為2-[[(2E,6E)-3,7,11-三甲基-2,6,10-十二烷三烯-1-基]硫代]苯甲酸;
分子式:C22H30O2S,分子量:358.54。
有益效果:反式法尼基硫代水楊酸(FTS)對(duì)老年性癡呆,阿爾茨海默病認(rèn)知障礙具有明顯的改善作用。具體的說,(1)在阿爾茨海默病模型小鼠,F(xiàn)TS經(jīng)口腔或腹腔注射處理都能改善模型小鼠的認(rèn)知功能障礙,(2)FTS能減少Aβ的神經(jīng)毒性,減少神經(jīng)細(xì)胞死亡,(3)FTS能恢復(fù)阿爾茨海默病模型小鼠海馬腦區(qū)的突觸傳遞效應(yīng)和長(zhǎng)時(shí)程增強(qiáng)誘導(dǎo),(4)FTS經(jīng)口腔、腹腔注射或細(xì)胞孵育能劑量依賴地增強(qiáng)小鼠海馬腦區(qū)的突觸傳遞效應(yīng)和長(zhǎng)時(shí)程增強(qiáng)誘導(dǎo)。(5)FTS增強(qiáng)神經(jīng)細(xì)胞谷氨酸NMDA受體的活性;(6)FTS增強(qiáng)神經(jīng)細(xì)胞α7nACh的活性。
附圖說明
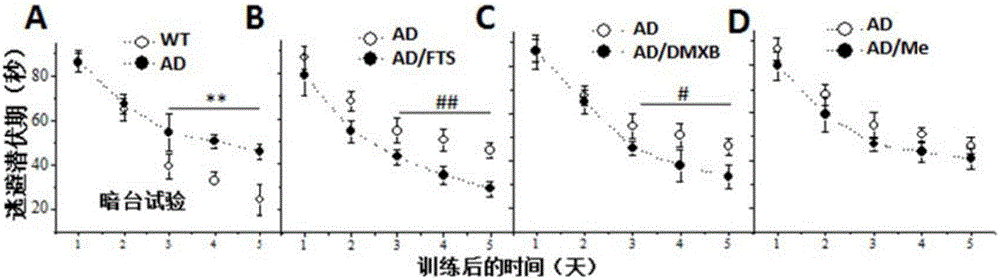
圖1為FTS連續(xù)20天進(jìn)行APP/PS1小鼠腹腔注射后,,(A-D))Morris水迷宮隱蔽平臺(tái)的逃避潛伏期;
圖2為Morris水迷宮空間探索時(shí)的各象限游泳時(shí)間百分比;
圖3為“Y“迷宮的進(jìn)臂交替率(%);
圖4-A為海馬CA1區(qū)的突觸傳遞功能;
圖4-B為海馬CA1區(qū)的長(zhǎng)時(shí)程增強(qiáng)(LTP)誘導(dǎo)。*P<0.05和**P<0.01vs.野生型小鼠;#P<0.05和##P<0.01vs.APP/PS1小鼠。
圖5為FTS連續(xù)14天進(jìn)行Aβ25-35小鼠腹腔注射后,(A-D)Morris水迷宮隱蔽平臺(tái)的逃避潛伏期;
圖6為Morris水迷宮空間探索時(shí)的各象限游泳時(shí)間百分比;
圖7為“Y“迷宮的進(jìn)臂交替率(%);
圖8為海馬CA1區(qū)神經(jīng)細(xì)胞的計(jì)數(shù);
圖9為海馬CA1區(qū)的突觸傳遞功能和長(zhǎng)時(shí)程增強(qiáng)(LTP)誘導(dǎo)。*P<0.05和**P<0.01vs.對(duì)照組小鼠;#P<0.05和##P<0.01vs.Aβ25-35小鼠。
圖10為FTS增強(qiáng)海馬腦區(qū)的突觸傳遞效應(yīng)和長(zhǎng)時(shí)程增強(qiáng)誘導(dǎo)的試驗(yàn)結(jié)果圖。為2-4小時(shí)用FTS處理海馬腦片后,(A-B)海馬CA1腦區(qū)的突觸傳遞效應(yīng)和海馬CA1腦區(qū)的LTP誘導(dǎo)。*P<0.05和**P<0.01vs.對(duì)照組。
圖11為FTS連續(xù)5天進(jìn)行小鼠腹腔注射后,(A-B)海馬CA1腦區(qū)的突觸傳遞效應(yīng)和海馬CA1腦區(qū)的LTP誘導(dǎo)。
圖12為FTS增強(qiáng)海馬神經(jīng)細(xì)胞的谷氨酸NMDA受體活性的試驗(yàn)結(jié)果圖。為2-4小時(shí)用FTS處理海馬腦片后,NMDA受體的鈣離子內(nèi)向電流(INMDA)的密度曲線。*P<0.05和**P<0.01vs.對(duì)照組。
圖13為FTS連續(xù)5天進(jìn)行小鼠腹腔注射后,NMDA受體的鈣離子內(nèi)向電流(INMDA)的密度曲線。*P<0.05和**P<0.01vs.對(duì)照組。
圖14為FTS增強(qiáng)α7nACh受體活性的試驗(yàn)結(jié)果圖,為2-4小時(shí)用FTS處理海馬腦片后,乙酰膽堿(ACh)誘導(dǎo)的α7nACh受體內(nèi)向電流(IACh)的密度曲線。*P<0.05和**P<0.01vs.對(duì)照組。
圖15為FTS連續(xù)5天進(jìn)行小鼠腹腔注射后,乙酰膽堿(ACh)誘導(dǎo)的α7nACh受體內(nèi)向電流(IACh)的密度曲線。*P<0.05和**P<0.01vs.對(duì)照組。
具體實(shí)施方式
本發(fā)明結(jié)合附圖和實(shí)施例作進(jìn)一步的說明,(1)在阿爾茨海默病模型小鼠,F(xiàn)TS經(jīng)口腔或腹腔注射等途徑處理都能改善小鼠的認(rèn)知功能障礙,(2)FTS能減少Aβ的神經(jīng)毒性和神經(jīng)細(xì)胞死亡,(3)FTS能恢復(fù)阿爾茨海默病模型小鼠海馬腦區(qū)的突觸傳遞效應(yīng)和長(zhǎng)時(shí)程增強(qiáng)誘導(dǎo),(4)FTS經(jīng)口腔或腹腔注射,細(xì)胞孵育等途徑處理能劑量依賴地增強(qiáng)小鼠海馬腦區(qū)的突觸傳遞效應(yīng)和長(zhǎng)時(shí)程增強(qiáng)誘導(dǎo)。(5)FTS增強(qiáng)神經(jīng)細(xì)胞谷氨酸NMDA受體的活性;(6)FTS增強(qiáng)神經(jīng)細(xì)胞α7nACh受體的活性。
實(shí)施例1:FTS改善APP/PS1轉(zhuǎn)基因小鼠(阿爾茨海默病模型)的認(rèn)知功能和神經(jīng)系統(tǒng)功能
實(shí)驗(yàn)主要材料:
動(dòng)物飼養(yǎng)在南京醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心,并且維持在溫度23±2℃,濕度55±5%,12:12h光/暗循環(huán)的環(huán)境下。它們可以自由的取食物和水。
阿爾茨海默病模型小鼠
APP/PS1小鼠:10月齡雄性和雌性APPswe/PS1dE9雙轉(zhuǎn)基因型小鼠(以下簡(jiǎn)稱,APP/PS1小鼠)從Jackson實(shí)驗(yàn)室(Bar Harbor,ME,USA)購(gòu)得,運(yùn)用Jackson實(shí)驗(yàn)室推薦的PCR方法進(jìn)行基因型鑒定。
藥物和試劑
反式法尼基硫代水楊酸(Trans-farnesylthiosalicylic acid,F(xiàn)TS)從美國(guó)Calbiochem公司購(gòu)買(Cat#344555)。FTS在5%Tween 80產(chǎn)生乳液或溶解于dimethyl sulfoxide(DMSO)。用生理鹽水或人工腦脊液稀釋到使用濃度(DMSO的最終濃度低于0.1%),進(jìn)行腹腔注射(5mg/kg)。
α7nACh受體激動(dòng)劑3-(2,4-dimethoxybenzylidene)-anabaseine(DMXB,日本大昭制藥公司提供,代號(hào)GTS-21,Taisho Pharmaceuticals,Tokushima,Japan)溶解在生理鹽水中進(jìn)行腹腔注射(2mg/kg)。
NMDA受體拮抗劑鹽酸美金剛(易倍申,批號(hào)366825,規(guī)格10mg/片,丹麥靈北藥廠產(chǎn)品)用0.1%的DMSO配制至所需濃度(Memantine,5mg/kg)進(jìn)行灌胃給藥。
實(shí)驗(yàn)操作
空間認(rèn)知行為的評(píng)價(jià):
Morris水迷宮試驗(yàn):采用Morris水迷宮檢測(cè)小鼠空間學(xué)習(xí)的長(zhǎng)期記憶功能(Aβ25-35給藥后第6-11天)。《隱蔽平臺(tái)試驗(yàn)(hidden platform trial)》直徑120cm、高45cm的圓形白色水池,水深30cm,水溫保持(23±1)℃,水中加入食品添加劑深藍(lán)色粉末。將水池等分成四個(gè)象限,在池壁上標(biāo)記四個(gè)象限的入水點(diǎn),在第四象限正中處放一個(gè)直徑為7cm的圓形平臺(tái),平臺(tái)頂?shù)陀谒?cm。迷宮上方安置帶有視頻拍攝系統(tǒng)的攝像機(jī),以便同步記錄小鼠的游泳軌跡。訓(xùn)練期間迷宮外參照物保持不變,室內(nèi)保持安靜。第一次實(shí)驗(yàn)前一天(Aβ25-35給藥后第5天)撤去隱蔽平臺(tái),將小鼠放入水池中自由游泳60秒,以檢測(cè)各組小鼠間的游泳能力有無差異。前五天進(jìn)行定向航行實(shí)驗(yàn),每天訓(xùn)練4次,每次訓(xùn)練的設(shè)定時(shí)間為90秒,訓(xùn)練時(shí)將小鼠面向池壁依次從各個(gè)象限的入水點(diǎn)入水,觀察并記錄小鼠的登臺(tái)潛伏期(即從小鼠入水到找到水下隱蔽平臺(tái)并立于其上所需時(shí)間)。登臺(tái)潛伏期(逃避潛伏期,escape latency)反應(yīng)了小鼠的學(xué)習(xí)記憶能力:登臺(tái)潛伏期越短,說明小鼠的學(xué)習(xí)記憶能力越好。如果小鼠在90秒內(nèi)未找到平臺(tái),潛伏期記為90秒。《空間探索試驗(yàn)(probe trial)》第6天(Aβ25-35給藥后第11天)撤去隱蔽平臺(tái)進(jìn)行空間探索實(shí)驗(yàn),小鼠從平臺(tái)所在象限的對(duì)面象限入水,記錄小鼠在60秒內(nèi)的游泳軌跡,分別對(duì)小鼠在各個(gè)象限(target quadrant,opposite quadrant,adjacent right and left quadrant)的停留時(shí)間進(jìn)行統(tǒng)計(jì)分析。對(duì)小鼠原站臺(tái)所在象限停留時(shí)間%進(jìn)行分析。
“Y”迷宮試驗(yàn):短期記憶可以用Y-maze實(shí)驗(yàn)來評(píng)估。Y-maze即黑色Y形三等分輻射式迷路箱,由3個(gè)支臂和一個(gè)連接區(qū)組成,三臂互相間夾角120°,每臂長(zhǎng)38.5厘米,上寬8厘米,下寬3.5厘米,高12厘米,三個(gè)臂可任選一臂為起始臂。每只小鼠從固定一臂的末端釋放,讓小鼠自由活動(dòng)8分鐘,記錄每次進(jìn)臂的次序。三次連續(xù)進(jìn)入不同的三個(gè)臂被定為交替進(jìn)臂(如:ABC,ACB,BAC,BCA,CAB,CBA)。交替進(jìn)臂率的計(jì)算為:1-(錯(cuò)誤次數(shù)/總次數(shù)-2)×100%。另外,總的進(jìn)臂次數(shù)也可以確定。
海馬突觸傳遞功能檢查
腦片制備:小鼠在乙醚麻醉下快速斷頭取腦,置于0–4℃冰凍人工腦脊液(artificial cerebrospinal fluid,ACSF)中2min左右備用。ACSF成分為(mM):124.0NaCl,4.5KCl,2.0CaCl2,1.0MgCl2,26.0NaHCO3,1.2NaH2PO4,10.0D-glucose。使用前通混合氣(95%O2,5%CO2)使pH值穩(wěn)定在7.4。鼠腦經(jīng)稍加修飾后移至振動(dòng)切片機(jī)浴槽內(nèi),在0–4℃ACSF中切取包含海馬的冠狀腦片2–4片(厚度400μm)。將切好的腦片迅速轉(zhuǎn)移至持續(xù)通飽和氧混合氣的ACSF中,在室溫(22–25℃)下孵育至少60min后移至恒溫記錄浴槽,浴槽為浸潤(rùn)式灌流系統(tǒng),灌流速度1mL/min,溫度30±1℃,并持續(xù)通氧。記錄電極使用標(biāo)準(zhǔn)硼硅酸鹽玻璃管經(jīng)P-97拉制儀拉制,沖灌2M NaCl溶液后電極阻抗為4–5MΩ。刺激電極為自制雙極鎢絲電極,直徑50μm,極間距為100–150μm,尖端裸露40–60μm。刺激電極為雙極鎢絲電極置于海馬腦片CA2或CA1區(qū)的謝弗側(cè)支處,進(jìn)行順向刺激,距離刺激電極約2–3mm,其尖端位于腦片表面下50–200μm處,記錄興奮性的突觸后電位EPSP。記錄信號(hào)經(jīng)放大器放大,Bridge模式,濾波5kHz,經(jīng)A/D卡進(jìn)行數(shù)模轉(zhuǎn)換后用Clampex軟件(Axon Inc.,USA)顯示并保存。使用SEN-3301刺激器,刺激波寬0.1ms,刺激強(qiáng)度約為0.1–1.0mA,刺激間隔為15秒,每4個(gè)刺激進(jìn)行一次疊加平均獲得標(biāo)準(zhǔn)EPSP。每次實(shí)驗(yàn)時(shí),刺激強(qiáng)度從閾值開始直至誘發(fā)最大EPSP,測(cè)定輸入–輸出(input-output relationship,I/O)曲線。每一個(gè)刺激強(qiáng)度取5個(gè)反應(yīng),以刺激強(qiáng)度為橫坐標(biāo),以平均的EPSP斜率為縱坐標(biāo)得到I/O曲線。根據(jù)I/O曲線,選擇最大反應(yīng)的刺激強(qiáng)度一半作為測(cè)試刺激強(qiáng)度進(jìn)行長(zhǎng)時(shí)程增強(qiáng)實(shí)驗(yàn)。長(zhǎng)時(shí)程增強(qiáng)(long-term potentiation,LTP)的誘導(dǎo)是先用實(shí)驗(yàn)刺激強(qiáng)度刺激腦片作為條件測(cè)試,采集20分鐘作為平均的基數(shù)值(100%),然后進(jìn)行高頻條件刺激(HFS,100Hz,100次刺激共1秒),再施以高頻條件刺激前的同樣實(shí)驗(yàn)測(cè)試,至少穩(wěn)定記錄1小時(shí)。高頻條件刺激后如果EPSP斜率增加20%或以上,判斷為L(zhǎng)TP的發(fā)生。
統(tǒng)計(jì)學(xué)分析
定量資料表示為均值±標(biāo)準(zhǔn)誤。Morris水迷宮原站臺(tái)所在象限時(shí)間%和“Y”迷宮采用雙因數(shù)和單因素方差分析。Scheffe`s檢驗(yàn)測(cè)定兩組間的差異顯著性。將差異P<0.05定義為差異顯著。
試驗(yàn)結(jié)果:
(1)Morris水迷宮—隱蔽平臺(tái)試驗(yàn):與野生型小鼠相比,10月齡APP/PS1小鼠的逃避潛伏期顯著延長(zhǎng)(**P<0.01vs.野生型小鼠,n=8,圖1-A)。FTS(5mg/kg)處理(20天)能減少APP/PS1小鼠的逃避潛伏期(##P<0.01vs.APP/PS1小鼠,n=8,圖1-B)。α7nACh受體激動(dòng)劑DMXB(2mg/kg)20天處理能部分改善APP/PS1小鼠的逃避潛伏期(#P<0.05vs.APP/PS1小鼠,n=8,圖1-C),而美金剛(5mg/kg)不能降低APP/PS1小鼠的逃避潛伏期(P>0.05,n=8,圖1-D)。
(2)Morris水迷宮—空間探索試驗(yàn):與野生型小鼠相比,APP/PS1小鼠在站臺(tái)象限的游泳時(shí)間顯著減少(**P<0.01vs.野生型小鼠,n=8,圖2)。FTS處理能增加APP/PS1小鼠在站臺(tái)象限的游泳時(shí)間(##P<0.01vs.APP/PS1小鼠,n=8)。DMXB能改善APP/PS1小鼠在站臺(tái)象限的游泳時(shí)間(#P<0.05vs.APP/PS1小鼠,n=8)。美金剛不能增加APP/PS1小鼠在站臺(tái)象限的游泳時(shí)間(P>0.05,n=8)。
(3)“Y“迷宮的檢測(cè)結(jié)果顯示,APP/PS1小鼠與野生型小鼠比較進(jìn)臂交替率有顯著性減少(**P<0.01vs.野生型小鼠,n=8,圖3)。FTS處理能明顯增加APP/PS1小鼠的進(jìn)臂交替率(##P<0.01vs.APP/PS1小鼠,n=8)。DMXB能增加APP/PS1小鼠的進(jìn)臂交替率(#P<0.05vs.APP/PS1小鼠,n=8)。美金剛處理并不能明顯改善APP/PS1小鼠的進(jìn)臂交替率(P>0.05,n=8)。
(4)電生理檢測(cè)結(jié)果顯示,APP/PS1小鼠的海馬CA1區(qū)的突觸傳遞斜率明顯低于野生型小鼠(**P<0.01vs.野生型小鼠,n=8,圖4-A)。FTS處理能提高APP/PS1小鼠的突觸傳遞斜率(#P<0.05&##P<0.01vs.APP/PS1小鼠,n=8)。DMXB使用能恢復(fù)APP/PS1小鼠的突觸傳遞斜率(#P<0.05vs.APP/PS1小鼠,n=8)。美金剛處理并不能明顯改善APP/PS1小鼠的突觸傳遞斜率(P>0.05,n=8)。
(5)電生理檢測(cè)結(jié)果顯示,APP/PS1小鼠的海馬CA1區(qū)的LTP不能誘導(dǎo)(n=8,圖4-B)。FTS處理能恢復(fù)APP/PS1小鼠的LTP誘導(dǎo)(n=8)。DMXB能30-40%恢復(fù)APP/PS1小鼠的LTP誘導(dǎo)(n=8)。而美金剛處理并不能恢復(fù)APP/PS1小鼠的LTP誘導(dǎo)(n=8)。
(圖中略寫符號(hào),WT:野生型小鼠,AD:APP/PS1小鼠,Me:美金剛;PQ:站臺(tái)象限,OQ:站臺(tái)對(duì)面象限,R-AQ:站臺(tái)右側(cè)象限,L-AQ:站臺(tái)左側(cè)象限)。
結(jié)論:FTS有顯著的抗阿爾茨海默病癡呆作用。
實(shí)施例2:FTS改善Aβ25-35小鼠(阿爾茨海默病模型)的認(rèn)知損害和保護(hù)神經(jīng)細(xì)胞
實(shí)驗(yàn)主要材料:
動(dòng)物飼養(yǎng)在南京醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心,并且維持在溫度23±2℃,濕度55±5%,12:12h光/暗循環(huán)的環(huán)境下。它們可以自由的取食物和水。
藥物和試劑
同實(shí)施例1。
阿爾茨海默病模型小鼠
將Aβ25-35溶于無菌雙蒸水中配成1mg/mL的溶液,置于37℃水浴箱中孵育4天,使其成為聚集態(tài)。注射前可以用生理鹽水稀釋到終濃度。Maurice等人發(fā)現(xiàn),以上方法處理后可以看到兩種類型的Aβ聚集態(tài),分別是雙折射的纖維型和球型結(jié)構(gòu)[1]。小鼠經(jīng)2%水合氯醛腹腔麻醉(400mg/kg)后固定于小鼠腦立體定位儀上。參照Paxinos和Watson小鼠立體定位圖譜,以前囟為參考點(diǎn),在前囟后0.3mm,右側(cè)1.0mm,深度2.5mm用微量進(jìn)樣器將3μl聚集態(tài)Aβ25-35(6nmol)或滅菌生理鹽水(對(duì)照組)分別于15min緩慢注射到小鼠雙側(cè)的側(cè)腦室,注射完畢后靜待5min后緩慢地拔出微量注射器,縫合皮膚。注射位置的準(zhǔn)確性預(yù)先通過注射墨汁來確定。動(dòng)物于Aβ25-35注射后第4-10天進(jìn)行Morris水迷宮測(cè)試,第11天進(jìn)行“Y”迷宮檢測(cè),測(cè)得空間學(xué)習(xí)記憶能力,第12-16天進(jìn)行海馬組織的病理學(xué)檢查和電生理學(xué)LTP檢測(cè)。
實(shí)驗(yàn)操作
空間認(rèn)知行為的評(píng)價(jià):同實(shí)施例1。
組織學(xué)的檢測(cè):Aβ25-35給藥后第14天,小鼠用2%水合氯醛(400mg/kg)腹腔麻醉,0.01M PBS和4%多聚甲醛灌流固定,經(jīng)常規(guī)后固定、梯度酒精脫水、透明、石蠟包埋后,做5μm海馬連續(xù)冠狀石蠟切片。石蠟切片在37℃烘箱中過夜后,室溫存放。《甲苯胺藍(lán)染色》5μm石蠟切片在37℃烘箱中放1h后,脫蠟水化,ddH2O洗10min,經(jīng)0.25%甲苯胺藍(lán)染色后用95%酒精分色、梯度酒精脫水、二甲苯透明、中性樹膠封片。以海馬CA1區(qū)和CA3區(qū)錐體神經(jīng)細(xì)胞染色清晰為標(biāo)準(zhǔn),光學(xué)顯微鏡下觀察腦組織病理變化(圖8的左圖)。存活的錐體細(xì)胞表現(xiàn)為圓形細(xì)胞體中帶有一個(gè)清晰深染的細(xì)胞核。將已固定的海馬組織用0.01M PBS沖洗,置于15%蔗糖緩沖溶液中,4℃冰箱過夜,待組織沉底后置于30%蔗糖緩沖液脫水,組織沉底后進(jìn)行冰凍切片,冠狀切片厚40μm,每5張取1張得海馬連續(xù)切片,進(jìn)行甲苯胺藍(lán)和TUNEL染色。利用Microbrightfield Stereo Investigator軟件計(jì)算整個(gè)海馬CA1或CA3區(qū)三維層面上的正常錐體細(xì)胞數(shù)(圖-2G的右圖)。
海馬突觸傳遞功能檢查:同實(shí)施例1。
統(tǒng)計(jì)學(xué)分析方法:同實(shí)施例1。
試驗(yàn)結(jié)果:
(1)Morris水迷宮—隱蔽平臺(tái)試驗(yàn),與對(duì)照組相比,Aβ25-35小鼠的逃避潛伏期顯著延長(zhǎng)(**P<0.01vs.對(duì)照組小鼠,n=8,圖5-A)。FTS(5mg/kg)處理(12天)能減少Aβ25-35小鼠的逃避潛伏期(##P<0.01vs.Aβ25-35小鼠,n=8,圖5-B)。DMXB(2mg/kg)能改善Aβ25-35小鼠的逃避潛伏期(#P<0.05vs.Aβ25-35小鼠,n=8,圖5-C)。但是,美金剛處理幾乎不能降低Aβ25-35小鼠的逃避潛伏期(#P<0.05vs.Aβ25-35小鼠,n=8,圖5-D)。
(2)Morris水迷宮—空間探索試驗(yàn):與野生型小鼠相比,Aβ25-35小鼠在站臺(tái)象限的游泳時(shí)間顯著減少(**P<0.01vs.對(duì)照組小鼠,n=8,圖6)。FTS處理能增加Aβ25-35小鼠在站臺(tái)象限的游泳時(shí)間(##P<0.01vs.Aβ25-35小鼠,n=8)。DMXB能部分改善Aβ25-35小鼠在站臺(tái)象限的游泳時(shí)間(#P<0.05vs.Aβ25-35小鼠,n=8),但是美金剛處理并不能改善Aβ25-35小鼠在站臺(tái)象限的游泳時(shí)間(P>0.05,n=8)。
(3)“Y“迷宮的檢測(cè)結(jié)果顯示,Aβ25-35小鼠與對(duì)照組比較進(jìn)臂交替率有顯著性減少(**P<0.01vs.對(duì)照組小鼠,n=8,圖7)。FTS處理處理能明顯增加Aβ25-35小鼠的進(jìn)臂交替率(##P<0.01vs.Aβ25-35小鼠,n=8)。DMXB能部分改善Aβ25-35小鼠的進(jìn)臂交替率(#P<0.05vs.Aβ25-35小鼠,n=8)。美金剛不能改善Aβ25-35小鼠的進(jìn)臂交替率(P>0.05,n=8)。
(4)海馬細(xì)胞計(jì)算結(jié)果顯示,與對(duì)照組相比Aβ25-35小鼠海馬CA1區(qū)錐體細(xì)胞數(shù)量明顯減少(*P<0.05vs.對(duì)照組小鼠,n=8,圖8)。FTS處理能明顯減少Aβ25-35小鼠海馬CA1區(qū)錐體細(xì)胞的丟失(#P<0.05vs.Aβ25-35小鼠,n=8)。DMXB或美金剛并不能減少Aβ25-35小鼠的錐體細(xì)胞的丟失(P>0.05,n=8)。
(5)電生理檢測(cè)結(jié)果顯示,Aβ25-35小鼠的海馬CA1區(qū)不能誘導(dǎo)LTP(n=8,圖9)。FTS處理能恢復(fù)Aβ25-35小鼠的LTP誘導(dǎo)(n=8)。DMXB能部分恢復(fù)Aβ25-35小鼠的LTP誘導(dǎo)(n=8)。但是,美金剛不能改善Aβ25-35小鼠的LTP誘導(dǎo)(n=8)。
(圖中略寫符號(hào),control:對(duì)照組小鼠,Aβ:Aβ25-35小鼠,Me:美金剛;PQ:站臺(tái)象限,OQ:站臺(tái)對(duì)面象限,R-AQ:站臺(tái)右側(cè)象限,L-AQ:站臺(tái)左側(cè)象限)。
結(jié)論:FTS具有神經(jīng)保護(hù)作用和抗阿爾茨海默病癡呆的作用。
實(shí)施例3:FTS增強(qiáng)小鼠海馬腦區(qū)的突觸傳遞效應(yīng)和長(zhǎng)時(shí)程增強(qiáng)誘導(dǎo)。
實(shí)驗(yàn)主要材料:
3月齡的ICR小鼠購(gòu)自南京醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心。動(dòng)物飼養(yǎng)在南京醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心,并且維持在溫度23±2℃,濕度55±5%,12:12h光/暗循環(huán)的環(huán)境下。它們可以自由的取食食物和水。
藥物和試劑
同實(shí)施例1。FTS在5%Tween 80產(chǎn)生乳液或溶解于dimethyl sulfoxide(DMSO)。用生理鹽水或人工腦脊液(mM:124.0NaCl,4.5KCl,2.0CaCl2,1.0MgCl2,26.0NaHCO3,1.2NaH2PO4,10.0D-glucose)稀釋到使用濃度(DMSO的最終濃度低于0.1%),進(jìn)行腹腔注射(5mg/kg)或腦片孵育(5-15μM)。
海馬突觸傳遞功能檢查:同實(shí)施例1。
統(tǒng)計(jì)學(xué)分析方法:同實(shí)施例1。
試驗(yàn)結(jié)果:
(1)用FTS(5-15μM)進(jìn)行2-4小時(shí)的海馬腦片孵育能劑量依賴地增強(qiáng)海馬CA1腦區(qū)的EPSP斜率(*P<0.05和**P<0.01vs.對(duì)照組小鼠,n=10;圖10-A)。
(2)用FTS(10μM)進(jìn)行2-4小時(shí)的海馬腦片孵育,海馬CA1腦區(qū)的高頻條件刺激(100Hz,100次刺激)誘導(dǎo)LTP的幅值明顯增加(圖10-B)。
(3)為FTS(5mg/kg)連續(xù)5天進(jìn)行小鼠腹腔注射后,海馬CA1腦區(qū)的EPSP斜率明顯增大(**P<0.01vs.對(duì)照組小鼠,n=10;圖11-A)。
(4)為FTS(5mg/kg)連續(xù)5天進(jìn)行小鼠腹腔注射后,在海馬CA1腦區(qū)給予弱的高頻條件刺激(10次共0.1秒)能誘導(dǎo)LTP,但是在對(duì)照組小鼠不能誘導(dǎo)LTP(圖11-B),提示LTP誘導(dǎo)閾值顯著降低。
結(jié)論:FTS能提高神經(jīng)回來興奮性和降低LTP誘導(dǎo)閾值。
實(shí)施例4:FTS能增強(qiáng)神經(jīng)細(xì)胞的NMDA受體活性
實(shí)驗(yàn)主要材料:
30-35天齡的ICR小鼠購(gòu)自南京醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心。動(dòng)物飼養(yǎng)在南京醫(yī)科大學(xué)實(shí)驗(yàn)動(dòng)物中心,并且維持在溫度23±2℃,濕度55±5%,12:12h光/暗循環(huán)的環(huán)境下。它們可以自由的取食食物和水。
藥物和試劑
同實(shí)施例1。
實(shí)驗(yàn)操作
電生理的檢測(cè)和分析:(1)海馬腦片制備:乙醚麻醉后快速斷頭取腦,置于0-4℃冰凍人工腦脊液中1分鐘備用。人工腦脊液使用前通混合氣(95%O2,5%CO2)使pH值穩(wěn)定在7.4。鼠腦稍加修飾后移至振動(dòng)切片機(jī)浴槽內(nèi),在0-4℃人工腦脊液中切取包含海馬的冠狀腦片3-6片(厚度350μm)。將切好的腦片迅速轉(zhuǎn)移至持續(xù)通混合氣的氧飽和人工腦脊液中,在28℃左右孵育至少60分鐘后移至記錄浴槽。浴槽為浸潤(rùn)式灌流系統(tǒng),灌流速度2mL/min,灌流液為持續(xù)通95%O2/5%CO2混合氣體的ACSF。微電極的拉制:選用長(zhǎng)10cm,外徑為1.5mm,內(nèi)徑為0.86mm標(biāo)準(zhǔn)硼硅酸鹽玻璃毛細(xì)管,在水平拉制儀上用四步拉制法拉制成記錄用微電極。充灌電極內(nèi)液后電極尖端入水阻抗為4-6MΩ。電極無需拋光即可直接進(jìn)行實(shí)驗(yàn)。循環(huán)灌流系統(tǒng):實(shí)驗(yàn)中人工腦脊液用作灌流液進(jìn)行循環(huán)灌流。溶液置于一定容積的刻度管中,并持續(xù)給95%O2/5%CO2混合氣,通過恒流泵的動(dòng)力作用將氧飽和ACSF泵入記錄槽。溶液灌流速度由調(diào)節(jié)閥進(jìn)行控制,通常為2-3mL/min,需要特殊沖洗的實(shí)驗(yàn),可將流速調(diào)至5-8mL/min,以使藥物快速而有效的作用于腦片細(xì)胞或者將殘留的藥物迅速?zèng)_洗干凈。灌流液溫度通過恒溫水浴鍋控制在28-30℃,使得記錄槽溫度維持在室溫附近。保持實(shí)驗(yàn)室封閉透光,室內(nèi)常溫(22-25℃),并具備較好的隔離噪音等條件。灌流系統(tǒng)所用的灌流管定期(兩周)更換,以免被污塘堵塞。
(2)全細(xì)胞膜片鉗記錄:實(shí)驗(yàn)在室溫(22-25℃)下進(jìn)行。將孵育好的腦片,轉(zhuǎn)移到記錄糟內(nèi),并用鉑金絲網(wǎng)固定,置于正置顯微鏡載物臺(tái)(配有40×的水鏡)上。在40×水鏡下,通過CCD(EvolutuonQE)采集圖象并可在顯示器上進(jìn)行實(shí)時(shí)觀察。實(shí)驗(yàn)過程中,選取腦片上CA1或CA3區(qū)胞體飽滿均勻,邊界清晰的神經(jīng)元為記錄對(duì)象。在電壓鉗模式下用MP-225微型操縱儀引導(dǎo)充有電極內(nèi)液的玻璃微電極靠近細(xì)胞,記錄電極入水前要先給予一正壓(將1mL注射器向前輕推1/10的體積),以防止電極尖端被污染。待電極靠近細(xì)胞,細(xì)胞出現(xiàn)小凹陷,并能觀察到電極阻抗上升3-5MΩ,釋放正壓并用給予適當(dāng)負(fù)壓進(jìn)行封接,同時(shí)逐步將鉗制電壓調(diào)節(jié)到–70mV,形成高阻封接(>1GΩ)。待形成穩(wěn)定的封接后,給予強(qiáng)烈而短促的負(fù)壓打破電極尖端下的小片細(xì)胞膜,從而形成穩(wěn)定的全細(xì)胞記錄模式。全細(xì)胞膜片鉗所用放大器為EPC-10,數(shù)據(jù)采集使用2.9kHz低通濾波,并在10kHz采樣。在電流記錄時(shí),通過實(shí)時(shí)監(jiān)控窗口,監(jiān)測(cè)串聯(lián)電阻(Rs)的變化,防止破膜的回封引起電流動(dòng)力學(xué)參數(shù)如幅度和衰減時(shí)間(decay time)的變化。其中Rs或者電容值的變化不應(yīng)超過原值的20%,同時(shí)保持Rs<30M,Ra>200M。所采集數(shù)據(jù)中統(tǒng)計(jì)時(shí)舍去未補(bǔ)償?shù)拇?lián)電阻導(dǎo)致的電壓鉗誤差超過5mV的神經(jīng)元數(shù)據(jù)。采樣后數(shù)據(jù)用PulseFit(HEKA公司)進(jìn)行數(shù)據(jù)分析。記錄NMDA受體電流(INMDA)時(shí),鉗制為–60mV,NMDA溶解到灌流液中,通過快速噴藥系統(tǒng)局部對(duì)目標(biāo)神經(jīng)元胞體進(jìn)行加藥。同時(shí)浴槽循環(huán)灌流液中加入1μM strychnine,10μM bicuculline,10μM NBQX和0.1μM TTX。電生理結(jié)果用pClamp軟件(Axon公司)或PulseFit軟件(HEKA公司)進(jìn)行數(shù)據(jù)處理。膜片鉗記錄數(shù)據(jù)分析:相關(guān)量效曲線用Hill方程進(jìn)行擬合,n為Hill系數(shù),EC50為半數(shù)有效劑量。
實(shí)驗(yàn)結(jié)果
(1)海馬腦片進(jìn)行FTS(10μM)4小時(shí)孵育,能增加NMDA誘導(dǎo)的NMDA受體內(nèi)向電流(INMDA)的密度(*P<0.05和**P<0.01vs.對(duì)照組小鼠,n=10;圖12)。
(2)給與小鼠連續(xù)5天的FTS(5mg/kg)腹腔注射,能增加INMDA的密度(**P<0.01vs.對(duì)照組小鼠,n=10;圖13)。
結(jié)論:FTS能增強(qiáng)NMDA受體的活性。
實(shí)施例5:FTS能增強(qiáng)神經(jīng)細(xì)胞α7nACh受體的活性
實(shí)驗(yàn)主要材料:
同實(shí)施例1。
藥物和試劑
同實(shí)施例4。
實(shí)驗(yàn)操作
電生理的檢測(cè)和分析:(1)同實(shí)施例4。記錄α7nACh受體電流(IACh)時(shí),鉗制為–60mV,乙酰膽堿(ACh)溶解到灌流液中,通過快速噴藥系統(tǒng)局部對(duì)目標(biāo)神經(jīng)元胞體進(jìn)行加藥。同時(shí)浴槽循環(huán)灌流液中加入1μM strychnine,10μM bicuculline,10μM NBQX和0.1μM TTX。電生理結(jié)果用pClamp軟件(Axon公司)或PulseFit軟件(HEKA公司)進(jìn)行數(shù)據(jù)處理。膜片鉗記錄數(shù)據(jù)分析:相關(guān)量效曲線用Hill方程進(jìn)行擬合,n為Hill系數(shù),EC50為半數(shù)有效劑量。
實(shí)驗(yàn)結(jié)果
(1)海馬腦片進(jìn)行FTS(10μM)4小時(shí)孵育,能增加乙酰膽堿(ACh)誘導(dǎo)的α7nACh受體內(nèi)向電流(IACh)的密度(*P<0.05vs.對(duì)照組小鼠,n=10;圖14)。
(2)給與小鼠連續(xù)5天的FTS(5mg/kg)腹腔注射,能增加IACh的密度(**P<0.01vs.對(duì)照組小鼠,n=10;圖15)。
(3)結(jié)論:FTS能增強(qiáng)α7nACh受體的活性。
- 還沒有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 一種添加硫代酯類輔助抗氧劑的鋁銀漿組合物的制作方法
- 添加苯酚的硫代硫酸鹽無氰鍍金的電鍍液及電鍍方法
- 反應(yīng)促進(jìn)劑、以及使用其的氨基甲酸酯化合物、硫代氨基甲酸酯化合物、酰胺化合物或脲 ...的制作方法
- 測(cè)定有機(jī)硫代硫酸鹽中硫的定量分析方法
- 一種C-3位硫代咪唑并[1,2-a]吡啶類化合物的制備方法
- 一種利用零價(jià)鐵-過硫酸鹽同時(shí)去除重金屬-有機(jī)物復(fù)合污染水體的方法
- 硫代丙醇酸生產(chǎn)過程中的副產(chǎn)物處理方法
- 鹽酸反應(yīng)器的防護(hù)方法及鹽酸反應(yīng)器的制造方法
- 一種兒童型鹽酸頭孢甲肟與低鈉載體藥物組合物的制作方法
- 包含至少一種烴基(硫代)糖苷的微生物檢測(cè)介質(zhì)的制作方法