前列腺素D2在制備治療胃癌藥物中的應用的制作方法
本發明屬于腫瘤治療藥物技術領域,涉及前列腺素D2(PGD2)在制備治療胃癌藥物中的應用。
背景技術:
PGD2是前列腺素的一種,是重要的細胞信號分子,它的合成主要通過以下的生物過程:細胞膜上的磷脂酶A 轉化成花生四烯酸,后者在環氧化酶(包括COX-1 和COX-2)的催化下,被分解成不穩定的中間產物前列腺素H2,前列腺素H2又被三種不同的酶:前列腺素D合成酶(PGDS),前列腺素E合成酶及前列腺素F合成酶轉化為更穩定的PGD2,PGE2,PGF2。PGDS前列腺素系列的關鍵酶系,又包括脂質運載蛋白型PGD 合成酶(L-PTGDS)和造血型PGD合成酶(H-PTGDS);
研究表明前列腺素具有抑制炎癥,減少胃酸分泌,胃腸平滑肌蠕動等作用,因此目前臨床上的用途主要用于治療哮喘、胃腸潰瘍病、休克、高血壓及心血管疾病。
增殖和遷移是腫瘤細胞最重要的生物學特征,某種程度上反應了腫瘤的生長速度和遠端轉移能力;PGD2在腫瘤中的作用及機制極少被研究,雖有零星報道證明PGD2可能抑制腦部腫瘤增殖,但是PGD2對胃癌細胞增殖和遷移是否有作用,目前并無報道。
CRTH2又叫GPR44,是PGD2特異性受體之一,主要表達于Th2細胞中,但據The Human Protein Atlas網站(http://www.proteinatlas.org/)中的信息,此受體亦可以表達于胃粘膜中,然而其作用并不清楚。本發明通過基因的敲減實驗首次公開,PGD2對腫瘤細胞體外擴增和遷移的抑制作用依賴于CRTH2受體。
腫瘤干細胞被認為是腫瘤發生發展甚至是耐藥的種子細胞,自我更新能力是腫瘤干細胞的重要特征,對腫瘤干細胞自我更新能力的抑制作用是腫瘤治療研究的熱點,PGD2及相關的信號傳導是否影響腫瘤干細胞擴增和分化國內外仍無公開報道。已有的研究結果顯示,PGD2合成限速酶L-PTGDS和受體CRTH2的表達與胃癌干細胞標記Sall4、Lgr5的表達呈負向相關,證明PGD2/CRTH2信號可能調控為干細胞的自我更新。本專利首次公開PGD2對胃癌腫瘤干細胞的調控作用。
技術實現要素:
本發明的目的在于克服現有技術中的缺陷,提出PGD2在胃癌治療發展中的新用途以及PGD2在胃癌抑制藥物方面的新應用。
本發明提供一種PGD2在制備治療胃癌藥物中的應用。
進一步的,本發明提供一種PGD2在抑制胃癌細胞擴增和遷移的新應用。
本發明通過試驗證明,PGD2能夠有效地抑制腫瘤細胞體外擴增和遷移,本發明首次公開PGD2可以有效的控制胃癌細胞的生長。
本發明涉及的PGD2抑制胃癌細胞增殖和遷移的證明過程還包括抑制PGD2合成的關鍵酶和受體表達,反向證明PGD2對胃癌細胞的作用。通過干擾PGD2合成的關鍵酶(L-PTGDS),降低內源性PGD2的分泌,以及降低受體CRTH2表達證明內源性PGD2對腫瘤細胞體外擴增和遷移的抑制作用。
在一具體實例中,PGD2能夠抑制胃癌細胞株HGC-27和SGC-7901的體外擴增和遷移能力;
在一具體實例中,通過小發卡RNA(shRNA)的敲減胃癌中PGD2合成的限速酶L-PTGDS及PGD2受體分子CRTH2,證明內源性PGD2對腫瘤細胞體外增殖和遷移的抑制作用,并提示這種作用是通過CRTH2信號完成。
本發明還提供的一種PGD2在抑制胃癌細胞干性基因表達和自我更新的新應用;
本發明還通過試驗證明,本發明涉及的PGD2還能夠抑制胃癌細胞腫瘤干細胞標記的表達和腫瘤細胞的自我更新能力;PGD2能夠下調干細胞相關基因的表達,并抑制胃癌干細胞的自我更新能力,具有極佳的臨床應用價值。
在一具體實例中,外源性PGD2能夠有效地控制HGC-27和SGC-7901細胞的成球能力(自我更新能力)和干細胞相關基因的表達,為PGD2體外抑制胃癌生長提供理論依據;
在一具體實例中,通過小發卡RNA(shRNA)的敲減胃癌中PGD2合成的限速酶L-PTGDS及PGD2受體分子CRTH2,證明內源性PGD2對能夠有效地控制HGC-27和SGC-7901細胞的成球能力(自我更新能力),提示這種作用是通過CRTH2受體完成。
本發明還提供一種治療胃癌的藥物,所述藥物包含有效成分前列腺素D2。
所述藥物還包括藥學上可接受的載體,為本領域公知常識,在此不做贅述。
本發明的有益效果:
由上述描述不難發現,本發明涉及的是PGD2的新應用和控制胃癌細胞生長的新方法,與現有PGD2用途相比,具有以下的特點:
(1)外源性PGD2直接處理能夠有效地控制胃癌細胞株的體外克隆能力(增殖擴增能力)和遷移能力,將合成PGD2的限速酶L-PTGDS和PGD2作用受體CRTH2應用小發卡RNA進行敲減后,胃癌細胞的體外擴增能力和遷移能力有明顯的上調,反向證明內源性的PGD2對胃癌細胞的作用,證明PGD2通過CRTH2受體抑制腫瘤細胞相關生物學特性,因此本發明具有重要的臨床意義。
(2)外源性的PGD2刺激能夠有效地控制胃癌細胞株的干細胞相關基因的表達和腫瘤干細胞的自我更新能力,將合成PGD2的限速酶L-PTGDS和PGD2作用受體CRTH2應用小發卡RNA進行敲減后,對胃癌干細胞的這種抑制作用消失,由此本發明首次公開PGD2通過CRTH2受體抑制腫瘤細胞干細胞特性的新作用和控制胃癌進展的新機制,因此本發明具有重要的臨床意義。
附圖說明
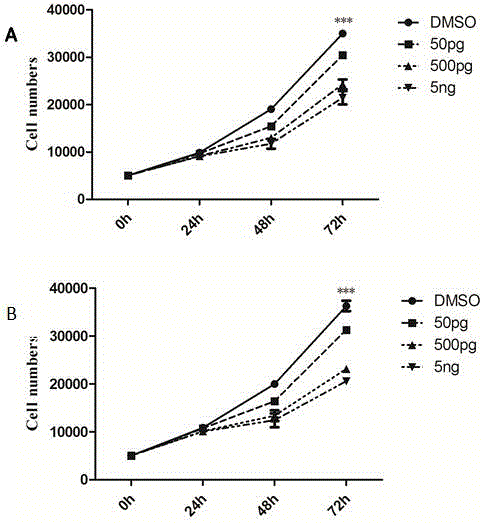
圖1為不同濃度的PGD2對SGC-7901(圖A)和HGC-27(圖B)細胞增殖的抑制作用(***表示DMSO組與其他各組比較的統計學p值均小于0.001);
圖2為不同濃度的PGD2對SGC-7901細胞遷移的抑制作用;A:Transwell檢測細胞遷移能力100x;B:依據A圖結果,計數每高倍鏡下細胞數量(p<0.001表示DMSO組與其他各組比較的統計學p值均小于0.001);
圖3為不同濃度的PGD2對HGC-27細胞遷移的抑制作用;A:Transwell檢測細胞遷移能力100x;B:依據A圖結果,計數每高倍鏡下細胞數量(p<0.001表示DMSO組與其他各組比較的統計學p值均小于0.001);
圖4為成球實驗檢測外源性的PGD2抑制HGC-27細胞自我更新能力(***表示DMSO組與其他各組比較p<0.001)。
圖5為成球實驗檢測外源性的PGD2抑制SGC-7901細胞自我更新能力(***表示DMSO組與其他各組比較p<0.001)。
圖6為定量PCR檢測外源性的PGD2抑制HGC-27(圖A)和SGC-7901(圖B)細胞干性標記基因mRNA的表達(*表示p<0.05;**表示p<0.01;***表示DMSO組與其他各組比較p<0.001)。
圖7為Western Blot檢測外源性的PGD2抑制HGC-27細胞(圖A)和SGC-7901細胞(圖B)Sall4、Nanog、Oct4蛋白表達。
圖8為HGC-27和SGC-7901中敲減L-PTGDS及CRTH2的表達;A:定量PCR檢測HGC-27細胞中L-PTGDS及CRTH2的表達;B:定量PCR檢測SGC-7901細胞中L-PTGDS及CRTH2的表達;C:ELISA檢測HGC-27細胞敲減L-PTGDS及CRTH2后,上清中PGD2因子的含量(***表示shGFP組與其他各組比較的統計學p值均小于0.001)。
圖9為克隆形成實驗檢測L-PTGDS及CRTH2敲減對HGC-27增殖的影響;A:克隆形成的大體照片;B:對A圖中克隆的統計結果,計數每高倍鏡視野中克隆個數(***表示shGFP組與其他各組比較的統計學p值均小于0.001)
圖10為克隆形成實驗檢測L-PTGDS及CRTH2敲減對SGC-7901增殖的影響;A:克隆形成的大體照片;B:對A圖中克隆的統計結果,計數每高倍鏡視野中克隆個數(***表示shGFP組與其他各組比較的統計學p值均小于0.001);
圖11為Transwell實驗檢測L-PTGDS及CRTH2敲減對HGC-27細胞遷移的影響;A:Transwell膜下方穿過細胞的照片100x;B:對A圖中遷過細胞數量的統計結果,計數每高倍鏡視野中克隆個數(***表示shGFP組與其他各組比較的統計學p值均小于0.001);
圖12為Transwell實驗檢測L-PTGDS及CRTH2敲減對HGC-27細胞遷移的影響;A:Transwell膜下方穿過細胞的照片100x;B:對A圖中遷過細胞數量的統計結果,計數每高倍鏡視野中克隆個數(***表示shGFP組與其他各組比較的統計學p值均小于0.001)。
圖13為成球實驗檢測L-PTGDS和CRTH2敲減后HGC-27細胞自我更新能力(***表示shGFP組與其他各組比較p<0.001)。
圖14為定量PCR檢測L-PTGDS和CRTH2敲減后HGC-27細胞(圖A)和SGC-7901細胞(圖B)干性標記基因mRNA的表達(*表示p<0.05;**表示p<0.01;***表示DMSO組與其他各組比較p<0.001)。
圖15為Western Blot檢測L-PTGDS和CRTH2敲減后HGC-27和SGC-7901細胞Sall4、Nanog、Oct4蛋白表達。
圖16為成球實驗檢測外源性的PGD2對L-PTGDS和CRTH2敲減后HGC-27細胞自我更新能力的影響(**表示p<0.01;***表示DMSO組與其他各組比較p<0.001)。
具體實施實例
以下結合具體實施例對本發明更好的闡述,以便與對本發明更好的理解。
實施例所使用的主要材料和來源分別如下:
細胞培養試劑:1640 DMEM(Gibco公司產品)、胎牛血清(Gibco公司產品)、胰蛋白酶(Sigma公司產品)、二氧化碳培養箱(Forma公司)、無血清培養基(上海依科賽公司)、human EGF因子(Gibco公司)、human FGF因子(Gibco公司)、B27(Gibco公司)、RNA提取試劑盒(上海英駿公司)、細胞蛋白提取試劑盒(碧云天公司)、逆轉錄試劑盒(南京諾維贊公司)、Western Blot相關試劑(碧云天公司);結晶紫(上海碧云天試劑有限公司)。
倒置顯微鏡、生物顯微鏡、超凈工作臺、臺式離心機;
PGD2純品(美國Sigma公司)、24(6)孔培養板(Corning公司)、Transwell遷移板(Corning公司);敲減L-PTGDS及CRTH2的shRNA慢病毒(簡稱:shL-PTGDS及shCRTH2)及對照病毒(shGFP)(賽業(廣州)生物科技有限公司)、定量PCR mix(南京諾維贊生物科技有限公司)、定量PCR排管(Biorad公司)。
胃癌細胞株HGC-27、SGC-7901購自中科院上海細胞所。
實施例1:外源性的PGD2抑制胃癌細胞株SGC7901和HGC-27的體外擴增和遷移
(1) PGD2純品的稀釋:由美國Sigma公司購得PGD2因子(1mg裝),加入100μL的二甲亞砜(DMSO)試劑進行溶解,稀釋成濃度為100ng/μL的母液,再用空白1640DMEM培養液將母液按1:1000的比例稀釋為100pg/μL的營養液(后續步驟所提提到的應用液均為此濃度);
(2) 外源性PGD2對腫瘤細胞體外增殖影響:將HGC-27和SGC-7901細胞種在24孔板中,細胞密度為5000/孔,同時加入不同量的PGD2應用液進行刺激,使細胞接觸的終濃度為:50pg/mL, 500pg/mL 和5ng/mL,DMSO為對照。在不同濃度PGD2作用24h,48h,72h后計數每孔細胞的數量,結果顯示,從24h開始,與陰性對照DMSO相比,PGD2抑制HGC-27和SGC-7901細胞數量的增加,并且這種抑制作用與PGD2作用濃度呈依賴關系,濃度越高抑制越明顯,如圖1,圖中***表示DMSO組與其他各組比較的統計學p值均小于0.001。
(3)外源性PGD2對腫瘤細胞體外遷移作用的影響:將HGC-27和SGC-7901細胞種在6板中,細胞密度為100000/孔,待細胞完全貼壁后加入不同量的PGD2應用液進行刺激,使細胞接觸的終濃度為:50pg/mL, 500pg/mL和5ng/mL,DMSO為對照。PGD2刺激48h后,通過胰酶消化各孔細胞后計數,將不同濃度PGD2作用后的細胞以100000種在Transwell小室中(用無血清的1640DMEM稀釋),Transwell孔的下室加500μL含有10%胎牛血清的1640DMEM培養液,放入培養箱中繼續培養12h,取出Transwell板通過4%多聚甲醛進行固定后應用結晶紫進行染色,通過棉簽將培養小室膜上方細胞擦凈,計數膜下方細胞的數量,結果顯示,與陰性對照DMSO相比,PGD2顯著得抑制HGC-27和SGC-7901遷移能力,并且這種抑制作用與PGD2作用濃度呈依賴關系,濃度越高對HGC-27和SGC-7901遷移抑制作用越明顯(圖2,圖3)。
實施例2:外源性的PGD2抑制胃癌細胞自我更新能力和相關基因表達
PGD2純品的稀釋同實施例1。
(1) 外源性PGD2對腫瘤細胞成球能力(自我更新能力)的抑制作用:首先配置干細胞無血清培養基(配方為:20ng/mL EGF、10ng/mL FGF、1:50 B27因子),將HGC-27和SGC-7901細胞種在6孔板中,培養條件為無血清干細胞培養液,細胞密度為5000/孔,同時加入不同量的PGD2應用液進行刺激,使細胞接觸的終濃度為:50pg/mL、 500pg/mL 和5ng/mL,DMSO為對照,培養7天后,40倍顯微鏡下觀察成球個數(直徑大于70μm即為為一個球),200倍下觀察成球大小,結果顯示,與陰性對照DMSO相比,外源性的PGD2顯著地抑制了HGC-27和SGC-7901細胞成球的數量和球體的大小,并且這種抑制作用與PGD2作用濃度呈依賴關系,濃度越高抑制越明顯(圖4,圖5),這一結果就表明PGD2抑制胃癌干細胞的自我更新能力;
(2)外源性PGD2抑制胃癌干細胞相關基因的表達:將HGC-27和SGC-7901細胞種在6孔板中(2塊),培養條件為無血清干細胞培養液,細胞密度為500000/孔,同時加入不同量的PGD2應用液進行刺激,使細胞接觸的終濃度為:50pg/mL, 500pg/mL 和5ng/mL,DMSO為對照,培養48h后,取一塊6孔板進行RNA提取工作(按照RNA提取試劑盒說明書進行),逆轉錄后檢測PGD2對Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因的mRNA表達情況的影響,結果顯示外源性的PGD2顯著地抑制了HGC-27和SGC-7901細胞Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因的mRNA,并且這種抑制作用與PGD2作用濃度呈依賴關系,濃度越高抑制越明顯(圖6);取同樣:50pg/mL, 500pg/mL 和5ng/mL PGD2刺激的另一塊6孔板進行蛋白提取(按照蛋白提取試劑盒說明書),通過Western Blot檢測外源性的PGD2對HGC-27和SGC-7901細胞Sall4、Oct4、Nanog的蛋白水平表達的影響,結果顯示,外源性的PGD2顯著地抑制了HGC-27和SGC-7901細胞all4、Oct4、Nanog的蛋白的表達,并且這種抑制作用與PGD2作用濃度呈依賴關系,濃度越高抑制越明顯(圖7)。
表1 引物序列如下
實施例3:通過小發卡RNA(shRNA)敲減胃癌中PGD2合成的限速酶L-PTGDS及PGD2受體分子CRTH2,證明內源性PGD2對腫瘤細胞體外增殖和遷移的抑制作用,并提示這種作用是通過CRTH2信號完成。
對實施例3中涉及的關鍵分子進行介紹:L-PTGDS是PGD2合成的關鍵酶,換言之,L-PTGDS表達量影響細胞自身分泌PGD2的量,敲減L-PTGDS的表達可以有效地的減少PGD2的分泌;而CRTH2是PGD2結合重要受體,主要表達于細胞膜上,是PGD2向細胞內傳導信號重要分子,敲減CRTH2可以阻斷PGD2對靶細胞的功能。
對本發明實施例3具體實施步驟描述如下:
(1)敲減L-PTGDS及CRTH2細胞株的構建:通過南京諾維贊公司構建shL-PTGDS及shCRTH2的慢病毒,依據公司提供的轉染步驟對HGC-27和SGC-7901細胞中L-PTGDS和CRTH2的表達進行敲減,以shGFP為敲減的陰性對照,依據慢病毒轉染的說明書操作步驟獲得了shGFP,shL-PTGDS及shCRTH2的穩定細胞株;
(2)HGC-27及SGC-7901細胞中L-PTGDS和CRTH2敲減效果的檢測:獲得shGFP,shL-PTGDS及shCRTH2細胞株后,通過定量PCR分析敲減的效果,結果顯示shL-PTGDS轉染HGC-27和SGC-7901細胞中L-PTGDS表達減低,shCRTH2轉染組CRTH2敲減成功(圖8A, 8B),重要的是,HGC-27細胞中敲減L-PTGDS后自分泌的PGD2分泌量減少(圖8C);
表2.CRTH2和L-PTGDS的PCR擴增的引物序列如下:
(3)降低內源性PGD2分泌和阻斷其受體后胃癌細胞株增殖能力的檢測:本發明通過克隆形成實驗分析了shL-PTGDS(通過shRNA干擾L-PTGDS表達的腫瘤細胞)及shCRTH2細胞(通過shRNA干擾CRTH2表達的腫瘤細胞)的增殖能力,將1000個細胞種于6孔板中,二氧化碳培養箱正常培養7天后對其結晶紫的染色,觀察其形成克隆的大小和多少,結果顯示,L-PTGDS和CRTH2敲減后HGC-27和SGC-7901細胞的體外擴增速度明顯的高于對照細胞(shGFP)(圖9 和圖10),此結果表明內源性PGD2對胃癌細胞增殖具有抑制作用。
(4)降低內源性PGD2分泌和阻斷其受體后胃癌細胞株遷移能力的檢測:本發明通過Transwell實驗分析了shL-PTGDS及shCRTH2細胞的遷移能力,將100000個待檢細胞懸浮于200微升的無血清的DMEM中并將其種于Transwell小室的上方,小室下方加入500微升的有血清的培養基,放入二氧化碳培養箱中12h后,將小室取出,通過結晶紫染色觀察遷移至小室下方細胞的多少,結果顯示,L-PTGDS和CRTH2敲減后HGC-27和SGC-7901細胞遷移速度明顯的高于shGFP對照細胞(圖11 和圖12),此結果提示內源性PGD2對抑制HGC-27和SGC-7901細胞遷移作用。
實施例4:通過小發卡RNA(shRNA)敲減胃癌中PGD2合成的限速酶L-PTGDS及PGD2受體分子CRTH2,證明內源性PGD2對腫瘤細胞自我更新和基因表達的抑制作用。
敲減L-PTGDS及CRTH2細胞株的構建及敲減效果監測同實施例3。
(1)降低內源性PGD2分泌和阻斷其受體后胃癌細胞株成球能力的檢測:本發明通過成球實驗分析了shL-PTGDS及shCRTH2細胞的自我更新能力,結果顯示,L-PTGDS和CRTH2敲減后HGC-27和SGC-7901細胞的成球能力明顯的高于對照細胞(shGFP)(圖13),此結果表明內源性PGD2對胃癌細胞成球能力明顯地抑制作用。
(2)降低內源性PGD2分泌和阻斷其受體對胃癌細胞株干性基因表達的影響:本發明通過定量PCR實驗分析了shL-PTGDS及shCRTH2細胞的Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因的mRNA表達,結果顯示,L-PTGDS和CRTH2敲減后HGC-27和SGC-7901細胞的Sall4、Oct4、Nanog、Lgr5、Sox2、CD44干性基因明顯的高于對照細胞(shGFP)(圖14);Western Blot檢測Sall4、Nanog、Oct4蛋白水平的檢測也顯示了同樣的結果(圖15)。
(3)為了進一步證明PGD2對胃癌干細胞的作用,將外源性的PGD2(5ng/mL)刺激shGFP、shL-PTGDS、shCRTH2細胞,結果顯示,5ng/ml的PGD2抑制了shGFP和shL-PTGDS細胞的成球能力,而對shCRTH2細胞無明顯地作用(圖 16),這一結果表明外源性PGD2回補了了shL-PTGDS敲減引起的PGD2的缺失,而PGD2這種作用是通過CRTH2完成的。
- 還沒有人留言評論。精彩留言會獲得點贊!