一種防止血管再狹窄的血管支架及其制備方法與流程
本發明涉及一種醫療用品,具體是一種能防止血管再狹窄的血管支架及其制備方法。
背景技術:
1964年Dotter和Judkings提出了經皮腔內血管成形術的概念,并假設使用硅橡膠或塑料來支撐血管,以保持血管腔內血流通暢。1987年Siwart等首次將血管內金屬支架用于冠狀動脈,為治療血管堵塞性疾病提供了很好的途徑。理想的血管支架應當具備以下的特征:(1)較好的生物相容性:最小的促凝作用,植入后不易發生凝血反應和血栓,不易引起血管壁的炎癥反應和內膜增生;(2)易定位性;(3)具有良好的柔韌性,易推到病變部位;(4)易擴張,支撐力強并有機械耐用性。
在血管內放置支架已經成為心血管疾病的重要手段,但是在支架置入治療后常常存在血管再狹窄的問,在支架放置病例中,約有15-30%發生再狹窄的問題,嚴重限制了治療的遠期效果,迄今為止仍是亟待解決的難題。近年來,藥物洗脫支架的出現成為一種支架研究的熱點,隨著藥物洗脫支架的應用,大大減少了支架內再狹窄的發生。
但是現有的支架在藥物負載方式上,一種是將藥物混合在各種凝膠中,涂敷在支架表面,這種涂敷方式存在涂敷不穩固的缺點;為此,許多支架做出了改進,例如在支架表面加工若干微孔,在微孔內填充藥物,但是在支架表面均勻加工微孔,加工難度大;載藥附著效果差。
技術實現要素:
本發明所要解決的問題是克服現有技術的不足,提供一種結構合理,支撐效果良好,并且能夠有效防止血管再狹窄的血管支架。
為解決上述問題,本發明采用的技術方案是:一種防止血管再狹窄的血管支架,所述支架為管狀結構,包括沿軸向設置的支撐單元和連接單元,所述支撐單元為橢圓形狀的網環,相鄰的支撐單元之間通過連接單元連接;所述支撐單元的大小不同,根據覆蓋面積大小的不同分別定義為大支撐單元、中支撐單元和小支撐單元,沿橫向方向上大支撐單元的兩側均為中支撐單元,中支撐單元的兩側分別為大支撐單元和小支撐單元,小支撐單元的兩側均為中支撐單元,在橫向方向上大支撐單元、中支撐單元和小支撐單元的數量分別為3行、6行和3行;在支架表面包覆PLA生物降解膜,所述PLA生物降解膜包括兩層,兩層PLA生物降解膜之間設置放射性元素,所述放射性元素均勻分布在地塞米松凝膠中;所述PLA生物降解膜表面浸潤防止血管再狹窄的藥物。
優選的,所述大支撐單元、中支撐單元和小支撐單元的短軸的長度比為4∶3∶2,在支架上大支撐單元、中支撐單元和小支撐單元的數量比為3∶4∶6。
優選的,在軸向上的連接單元為直線型。
優選的,在橫向上的連接單元為“S”型。
優選的,所述PLA生物降解膜表面浸潤的防止血管再狹窄的藥物包括雷帕霉素、紫杉醇。
優選的,所述放射性元素為32P。
優選的,所述支架采用鎂金屬合金制成。
一種防止血管再狹窄的血管支架的制備方法,包括以下步驟:
(1)首先制備鎂金屬合金的支架,將鎂金屬合金管通過激光雕刻成設定形狀;
(2)將PLA可降解生物膜浸潤在防止血管再狹窄的藥物中;
(3)在第一層PLA生物降解膜外側涂覆一層地塞米松凝膠,地塞米松凝膠中均勻的混合著放射性元素,在地塞米松凝膠的外側再包覆一層PLA生物降解膜;
(4)將處理好的PLA可降解生物膜包覆在支架表面,緩慢烘干,去除支架表面上的水分。
優選的,所述的PLA生物降解膜在藥物中浸潤的時間為1小時到3小時。
本發明相對于現有技術的有益效果在于:
1、將支撐單元分為大中小三種,且在橫向分布上大支撐單元兩側均為中支撐單元,中支撐單元的兩側分別為大支撐單元和小支撐單元,小支撐單元的兩側均為中支撐單元,在橫向方向上大支撐單元、中支撐單元和小支撐單元的數量分別為3行、6行和3行;小支撐單元的徑向支撐力更大,大支撐單元的徑向支撐力最小,大中小型號不同的支撐單元使支架具有較高的彈性,適中的徑向支撐力;在橫向的截面上小支撐單元構成支架的三個支撐點,這三個支撐點構成三角形的三個頂點,而三角形是最穩固的形狀,能夠提高支架的穩固性,可以更好的抵抗血管的彈性回縮作用。
2、在支架表面包覆PLA生物降解膜,所述PLA生物降解膜包括兩層,兩層PLA生物降解膜之間設置放射性元素。PLA(Polylactic Acid)聚乳酸是可再生的植物資源(如玉米)所提出的淀粉原料制成,使用后能被微生物完全降解,最終生成二氧化碳和水,均為人體代謝產物,不會在體內殘留。PLA生物降解膜表面浸潤防止血管再狹窄的藥物,能夠在人體內緩慢釋放藥物,可以抑制血管內膜過度增生,防止做過支架的血管發生再狹窄的情況。
3、在兩層PLA生物降解膜中間還具有放射性元素,而放射性元素的作用主要是利用放射線的電離輻射作用,抑制血管損傷后的平滑肌細胞增生和遷移,從而大大降低血管再狹窄的發生率。而傳統的放射性支架是將放射性元素直接放置在支架上,而支架是鏤空的,這就造成放射性元素不均勻,進而在作用血管時便存在問題。而PLA生物降解膜完全的包覆在支架上,均勻有效的作用于受損血管。
4、放射性元素通過地塞米松凝膠固定在兩層PLA生物降解膜之間,地塞米松是一種消炎劑,采用凝膠的形式,在固定放射性元素的同時,還能起到消炎的作用。
5、大支撐單元、中支撐單元和小支撐單元的短軸的長度比為4∶3∶2,在支架上大支撐單元、中支撐單元和小支撐單元的數量比為3∶4∶6。這樣每行大支撐單元、中支撐單元和小支撐單元組成的距離是相等的。
6、在軸向上的連接單元為直線型,在橫向上的連接單元為“S”型。相比較而言,“S”形的支撐單元擴張性能更好一些,在橫向上需要配合擴張氣囊使用,需要較大的擴張彈性,故在橫向上設置“S”形的支撐單元。而在軸向上并不需要太大的延伸性,只是需要較好的連接性。
7、支架采用鎂金屬合金制成,鎂合金是一種生物可降解的金屬材料,最早在上世紀30年代就開始用于骨組織修復和整形外科,但是由于純鎂的降解速率太快,從而產生大量的氫氣,限制了其應用。但是隨著合金技術的發展,更多的合金元素被發現和應用,從而使可降解的鎂合金又被人們所重新認識。研究表面鎂合金具有良好的生物相容性和優良的機械性能,一些其他的金屬元素和稀土元素的加入,使得其物理化學性能和生物性能得到改善和提高,尤其是解決了鎂合金在體內降解過快的缺點。
本發明防止血管再狹窄的機理在于:(1)PLA生物降解膜浸潤在藥物,如雷帕霉素、紫杉醇等中,PLA緩慢釋放作用于血管中。雷帕霉素通過抑制血管平滑肌細胞增生、抑制細胞大小、影響細胞外基質的合成,抑制損傷后血管內炎癥等作用有效抑制支架內再狹窄。而紫杉醇具有很高的親脂性,從而促使快速的細胞攝取,并由于細胞骨架結構的改變在平滑肌細胞中發揮長期持續的效果。在1.0-10.0mmol/L的劑量范圍內,紫杉醇可導致幾乎完全的生長抑制。通過雷帕霉素及紫杉醇的協同作用,可以抑制由于血管的醫源性損傷引起的諸多血管活性物質、促血栓形成及促有絲分裂因子釋放等問題,進而達到防止血管再狹窄的作用。(2)隨著表面層PLA生物降解膜的逐步降解,中間的放射線元素和地塞米松凝膠開始發揮作用,放射性元素32P,通過32P射線源的近距離放射可以阻止細胞增生,導致細胞凋亡并抑制細胞遷移從而減少新生內皮積聚,同時通過減少后期纖維化修復反應,抑制重構引起的狹窄。同時地塞米松具有消炎的作用,可以對受損的血管內壁進行消炎。(3)當中間的放射性元素及地塞米松凝膠作用完成后,第二層的PLA生物降解膜上的藥物開始發揮作用。如此通過三層物質分階段的作用,延長了抑制血管再狹窄藥物的作用時間,具體的抑制藥物包括雷帕霉素、紫杉醇等抑制細胞生長的藥物,還包括地塞米松凝膠消炎藥物,還包括放射性元素,多種方式分步驟作用,增強防止血管狹窄的作用。
血管支架的制備過程:先利用激光雕刻技術將鎂金屬合金管雕刻成如下的形狀:橢圓形狀的網環支撐單元,相鄰的支撐單元之間通過連接單元連接;而在橫向方向上大支撐單元兩側均為中支撐單元,中支撐單元的兩側分別為大支撐單元和小支撐單元,小支撐單元的兩側均為中支撐單元,在橫向方向上大支撐單元、中支撐單元和小支撐單元的數量分別為3行、6行和3行。在支架上支撐單元大小型號不同,彈性適中,徑向支撐力由于三行小支撐單元的存在大大得到提高。
對PLA可降解生物膜浸潤藥物的具體處理方式為:將PLA可降解生物膜浸潤在防止血管再狹窄的藥物中,將雷帕霉素和紫杉醇分別放置在容器中,將PLA可降解生物膜先放置在雷帕霉素溶液中浸潤1-3小時,浸潤結束后緩慢烘干,再將烘干后的表面帶有雷帕霉素的PLA生物降解膜放置在紫杉醇的溶液中浸潤1-3小時,浸潤結束后再緩慢烘干。
然后將一些放射性元素加入到地塞米松凝膠之間,緩慢攪拌,直至放射性元素均勻分布在地塞米松凝膠之中。
再將一層烘干的PLA可降解生物膜包覆在支架表面,在第一層PLA可降解生物膜的表面上涂覆含有放射性元素32P的地塞米松凝膠,在地塞米松凝膠外層再包覆一層PLA可降解生物膜。將處理好的雙層PLA可降解生物膜整體包覆在血管支架上,為增加PLA可降解生物膜和血管支架的黏合性,可以應用一些醫用粘和劑對PLA可降解生物膜和血管支架進行黏合。
最后在完成黏合之后,將支架緩慢烘干,去除水分,進行真空包裝。
附圖說明
圖1為本發明支撐單元與連接單元的結構示意圖;
圖2為圖1中部分結構的放大結構示意圖;
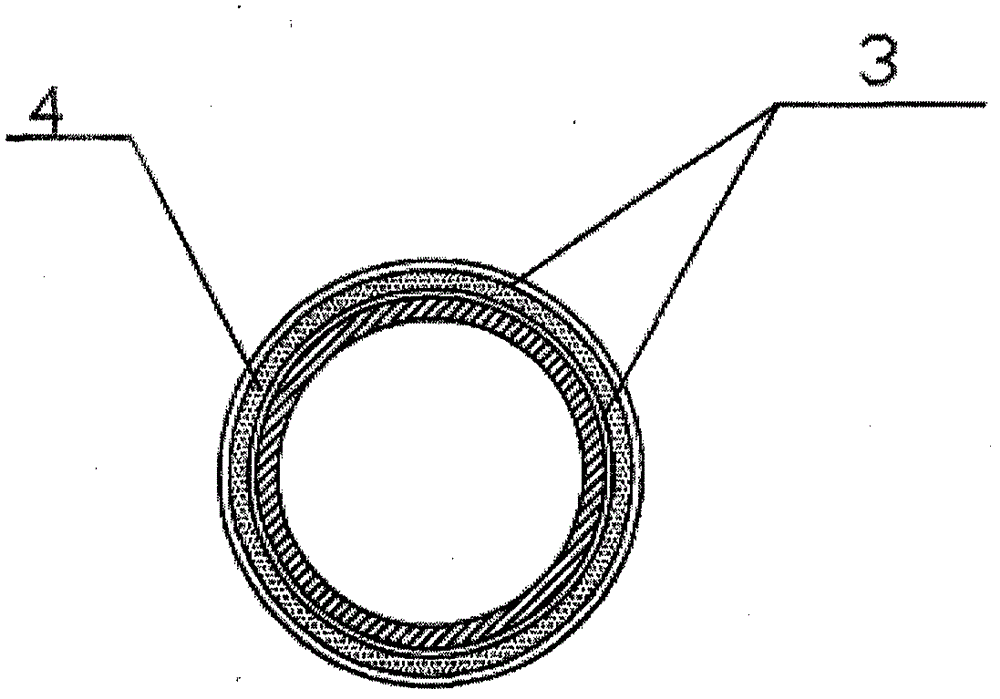
圖3本發明沿橫向剖開的結構示意圖。
圖中標記:
1、支撐單元;2、連接單元;11、大支撐單元;12、中支撐單元;13、小支撐單元;3、PLA生物降解膜;4、地塞米松凝膠。
具體實施方式
下面結合附圖對本發明做進一步描述:
一種防止血管再狹窄的血管支架,所述支架為管狀結構,包括沿軸向設置的支撐單元1和連接單元2,所述支撐單元1為橢圓形狀的網環,相鄰的支撐單元1之間通過連接單元2連接;所述支撐單元1的大小不同,根據覆蓋面積大小的不同分別定義為大支撐單元11、中支撐單元12和小支撐單元13,沿橫向方向上大支撐單元11兩側均為中支撐單元12,中支撐單元12的兩側分別為大支撐單元11和小支撐單元13,小支撐單元13的兩側均為中支撐單元12,在橫向方向上大支撐單元11、中支撐單元12和小支撐單元13的數量分別為3行、6 行和3行;在支架表面包覆PLA生物降解膜3,所述PLA生物降解膜3包括兩層,兩層PLA生物降解膜3之間設置放射性元素,所述放射性元素均勻分布在地塞米松凝膠4中;所述PLA生物降解膜3表面浸潤防止血管再狹窄的藥物。
大支撐單元11、中支撐單元12和小支撐單元13的短軸的長度比為4∶3∶2,在支架上大支撐單元11、中支撐單元12和小支撐單元13的數量比為3∶4∶6。在軸向上的連接單元2為直線型,在橫向上的連接單元2為“S”型,PLA生物降解膜3表面浸潤的防止血管再狹窄的藥物包括雷帕霉素、紫杉醇,放射性元素為32P,支架采用鎂金屬合金制成。
一種防止血管再狹窄的血管支架的制備方法,包括以下步驟:
(1)首先制備鎂金屬合金的支架,將鎂金屬合金管通過激光雕刻成設定形狀;
(2)將PLA可降解生物膜浸潤在防止血管再狹窄的藥物中;
(3)將一層PLA生物降解膜包覆在金屬支架外側,在第一層PLA生物降解膜外側涂覆一層地塞米松凝膠4,地塞米松凝膠4中均勻的混合著放射性元素,在地塞米松凝膠4的外側再包覆一層PLA生物降解膜;
(4)將支架緩慢烘干,去除支架表面上的水分。
PLA生物降解膜在藥物中浸潤的時間為1小時到3小時。
本發明相對于現有技術的有益效果在于:
1、將支撐單元1分為大中小三種,且在橫向分布上大支撐單元11兩側均為中支撐單元12,中支撐單元12的兩側分別為大支撐單元11和小支撐單元13,小支撐單元13的兩側均為中支撐單元12,在橫向方向上大支撐單元11、中支撐單元12和小支撐單元13的數量分別為3行、6行和3行。小支撐單元13的徑向支撐力更大,大支撐單元11的徑向支撐力最小,大中小型號不同的支撐單元1使支架具有較高的彈性,適中的徑向支撐力;大支撐單元11、中支撐單元12和小支撐單元13均為三個,三個小支撐單元13構成支架的三個支撐點,這三個支撐點構成三角形的三個頂點,而三角形是最穩固的形狀,能夠提高支架的穩固性,可以更好的抵抗血管的彈性回縮作用。
2、在支架表面包覆PLA生物降解膜3,所述PLA生物降解膜3包括兩層,兩層PLA生物降解膜3之間設置放射性元素。PLA(Polylactic Acid)聚乳酸是可再生的植物資源(如玉米)所提出的淀粉原料制成,使用后能被微生物完全降解,最終生成二氧化碳和水,均為人體代謝產物,不會在體內殘留。PLA生物降解膜3表面浸潤防止血管再狹窄的藥物,能夠在人體內緩慢釋放藥物,可以抑制血管內膜過度增生,防止做過支架的血管發生再狹窄的情況。
3、在兩層PLA生物降解膜3中間還具有放射性元素,而放射性元素的作用主要是利用放射線的電離輻射作用,抑制血管損傷后的平滑肌細胞增生和遷移,從而大大降低血管再狹窄的發生率。而傳統的放射性支架是將放射性元素直接放置在支架上,而支架是鏤空的,這就造成放射性元素不均勻,進而在作用血管時便存在問題。而PLA生物降解膜3完全的包覆在支架上,均勻有效的作用于受損血管。
4、放射性元素通過地塞米松凝膠4固定在兩層PLA生物降解膜之間,地塞米松是一種消炎劑,采用凝膠的形式,在固定放射性元素的同時,還能起到消炎的作用。
5、大支撐單元11、中支撐單元12和小支撐單元13的短軸的長度比為4∶3∶2,在支架上大支撐單元11、中支撐單元12和小支撐單元13的數量比為3∶4∶6。這樣每行大支撐單元11、中支撐單元12和小支撐單元13組成的距離是相等的。
6、在軸向上的連接單元2為直線型,在橫向上的連接單元2在為“S”型。相比較而言,“S”形的連接單元2在為“S”型擴張性能更好一些,在橫向上需要配合擴張氣囊使用,需要較大的擴張彈性,故在橫向上設置“S”形的連接單元2。而在軸向上并不需要太大的延伸性,只是需要較好的連接性。
7、支架采用鎂金屬合金制成,鎂合金是一種生物可降解的金屬材料,最早在上世紀30年代就開始用于骨組織修復和整形外科,但是由于純鎂的降解速率太快,從而產生大量的氫氣,限制了其應用。但是隨著合金技術的發展,更多的合金元素被發現和應用,從而使可降解的鎂合金又被人們所重新認識。研究表面鎂合金具有良好的生物相容性和優良的機械性能,一些其他的金屬元素和稀土元素的加入,使得其物理化學性能和生物性能得到改善和提高,尤其是解決了鎂合金在體內降解過快的缺點。
本發明防止血管再狹窄的機理在于:(1)PLA生物降解膜3浸潤在藥物,如雷帕霉素、紫杉醇等中,PLA緩慢釋放作用于血管中。雷帕霉素通過抑制血管平滑肌細胞增生、抑制細胞大小、影響細胞外基質的合成,抑制損傷后血管內炎癥等作用有效抑制支架內再狹窄。而紫杉醇具有很高的親脂性,從而促使快速的細胞攝取,并由于細胞骨架結構的改變在平滑肌細胞中發揮長期持續的效果。在1.0-10.0mmol/L的劑量范圍內,紫杉醇可導致幾乎完全的生長抑制。通過雷帕霉素及紫杉醇的協同作用,可以抑制由于血管的醫源性損傷引起的諸多血管活性物質、促血栓形成及促有絲分裂因子釋放等問題,進而達到防止血管再狹窄的作用。(2)隨著表面層PLA生物降解膜的逐步降解,中間的放射線元素和地塞米松凝膠4開始發揮作用,放射性元素32P,通過32P射線源的近距離放射可以阻止細胞增生,導致細胞凋亡并抑制細胞遷移從而減少新生內皮積聚,同時通過減少后期纖維化修復反應,抑制重構引起的狹窄。同時地塞米松具有消炎的作用,可以對受損的血管內壁進行消炎。(3)當中間的放射性元素及地塞米松凝膠4作用完成后,第二層的PLA生物降解膜上的藥物開始發揮作用。如此通過三層物質分階段的作用,延長了抑制血管再狹窄藥物的作用時間,具體的抑制藥物包括雷帕霉素、紫杉醇等抑制細胞生長的藥物,還包括地塞米松凝膠4消炎藥物,還包括放射性元素,多種方式分步驟作用,增強防止血管狹窄的作用。
血管支架的制備過程:先利用激光雕刻技術將鎂金屬合金管雕刻成如下的形狀:橢圓形狀的網環支撐單元,相鄰的支撐單元1之間通過連接單元2連接,相鄰的支撐單元1通過連接單元2連接;而在橫向方向上大支撐單元11兩側均為中支撐單元12,中支撐單元12的兩側分別為大支撐單元11和小支撐單元13,小支撐單元13的兩側均為中支撐單元12,在橫向方向上大支撐單元11、中支撐單元12和小支撐單元13的數量分別為3行、6行和3行。在支架上連接單元2在為“S”型大小型號不同,彈性適中,徑向支撐力由于三行小支撐單元13的存在大大得到提高。
對PLA可降解生物膜浸潤藥物的具體處理方式為:將PLA可降解生物膜浸潤在防止血管再狹窄的藥物中,將雷帕霉素和紫杉醇分別放置在容器中,將PLA可降解生物膜先放置在雷帕霉素溶液中浸潤1-3小時,浸潤結束后緩慢烘干,再將烘干后的表面帶有雷帕霉素的PLA生物降解膜3放置在紫杉醇的溶液中浸潤1-3小時,浸潤結束后再緩慢烘干。
然后將一些放射性元素加入到地塞米松凝膠4之間,緩慢攪拌,直至放射性元素均勻分布在地塞米松凝膠4之中。
再將一層烘干的PLA可降解生物膜包覆在支架表面,在第一層PLA可降解生物膜的表面上涂覆含有放射性元素32P的地塞米松凝膠4,在地塞米松凝膠4外層再包覆一層PLA可降解生物膜。將處理好的雙層PLA可降解生物膜整體包覆在血管支架上,為增加PLA可降解生物膜和血管支架的黏合性,可以應用一些醫用粘和劑對PLA可降解生物膜和血管支架進行黏合。
最后在完成黏合之后,將支架緩慢烘干,去除水分,進行真空包裝。
在本發明中,所謂的軸向是指支架的長度方向,而橫向是指支架的寬度方向。在該血管支架的形狀方面,沿軸向將支架向兩邊剖開,攤開的形狀包括一行一行的連接單元2在為“S”型和連接相鄰連接單元2在為“S”型的連接單元2,其排列順序是大支撐單元11、中支撐單元12、小支撐單元13、中支撐單元12、大支撐單元11、中支撐單元12、小支撐單元13、中支撐單元12、大支撐單元11、中支撐單元12、小支撐單元13和中支撐單元12。按照這種順序組成的血管支架,在橫向上看,三行小支撐單元13之間距離相等,而小支撐單元13的徑向支撐力相比較于中支撐單元12和大支撐單元11要大,故三行小支撐單元13其實相當于組成了三角形的三個頂點,而三角形是最穩固的形狀,能有效的提高血管支架的徑向支撐力。且采用大小型號不等的連接單元2在為“S”型而不是全部采用小支撐單元13,能有效提高血管的柔順性,若全部采用大支撐單元11又不能起到足夠的徑向支撐作用。
在制備血管支架時,首先選擇鎂金屬合金材料,其中鎂金屬的含量可以占主導,其余的材料包括金屬和稀土元素,其他金屬可以是鋅、鈣、鋯,稀土金屬可以是釹和鈮。將支架利用激光切割成預定形狀后,進行后續的打磨拋光處理。然后將PLA生物降解膜包覆在支架表面,對PLA可降解生物膜浸潤藥物的具體處理方式為:將PLA可降解生物膜先放置在雷帕霉素溶液中浸潤3小時,浸潤結束后緩慢烘干,再將烘干后的表面帶有雷帕霉素的PLA生物降解膜3放置在紫杉醇的溶液中浸潤3小時,浸潤結束后再緩慢烘干。然后將一些放射性元素加入到地塞米松凝膠4之間,緩慢攪拌,直至放射性元素均勻分布在地塞米松凝膠4之中。再將一層烘干的PLA可降解生物膜包覆在支架表面,在第一層PLA可降解生物膜的表面上涂覆含有放射性元素32P的地塞米松凝膠4,在地塞米松凝膠4外層再包覆一層PLA可降解生物膜。將處理好的雙層PLA可降解生物膜整體包覆在血管支架上,為增加PLA可降解生物膜和血管支架的黏合性,可以應用一些醫用粘和劑對PLA可降解生物膜和血管支架進行黏合。最后在完成黏合之后,將支架緩慢烘干,去除水分,進行真空包裝。
這種方式制得的血管支架拉伸強度的范圍是200-300MPa,彈性模量為20-50GPa;斷裂伸長率為3-10%,符合血管支架的要求;血管支架表面PLA降解膜全部水解完成的時間在180天-240天,血管支架全部水解完成時間為300天-360天,降解生成的金屬離子除少部分被人體利用外,大部分通過腎小管過濾排出體外。
以上所述,僅是本發明的較佳實施例而已,并非是對本發明作其它形式的限制。任何熟悉本專業的技術人員可能利用上述揭示的技術內容加以變更或改型為等同變化的等效實施例。但是凡是未脫離本發明技術方案內容,依據本發明的構造及工作原理對以上實施例所作的任何簡單修改、等同變化與改型,仍屬于本發明技術方案的保護范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!