自組裝的納米氧化鋅載藥膠囊及其制備方法和應用與流程
本發明屬納米材料技術和醫藥技術領域,具體涉及一種自組裝的納米氧化鋅載藥膠囊及其制備方法和應用。
背景技術:
癌癥已經成為21世紀多發病和常見病,找到癌癥的治療方法是人類近些年來的共同目標。近年來,納米材料由于其面向固體腫瘤的好的滲透性和在腫瘤處良好的留存性,被賦予了很多關注。盡管以納米材料為平臺的載藥系統受到了廣泛的關注,但是其實際應用遇到四個方面的阻礙。第一,大多數納米材料難以生物降解,甚至對于生物體系具有很大的毒性;第二,載藥釋放系統需要在水中高度分散并且長期保持穩定,而大多數納米材料會在短期內團聚甚至沉淀;第三,載體越穩定就越難分解,而藥物釋放率高則要求載體快速完全分解,兩者之間的平衡不容易把握;第四,關于藥物載體響應的機制,依賴于光照、磁場、超聲等條件響應分解的結構十分復雜,需要復雜的合成過程,最終導致藥物載體納米粒子的組成結構不均一,而且很難被生物完全降解。
氧化鋅作為一種安全無毒的材料,是美國食品和藥物管理局(foodanddrugadministration)認證的安全物質(fda代碼21cfr182.8991),已經在化妝品、皮膚藥膏、食品包裝等領域生產應用。粒徑1~5納米的氧化鋅量子點具有豐富的表面缺陷,很容易被水分子破壞,因此通過表面修飾的方法制備水溶性的氧化鋅量子點是把它應用到生物醫藥領域的關鍵。氧化鋅量子點對ph敏感的性質特別適合于細胞內液呈弱酸性的癌細胞,氧化鋅量子點在癌細胞內可以很快溶解而在正常細胞內保持穩定,用來負載抗癌藥物分子就能夠區分癌細胞和正常細胞,實現靶向給藥。經過精巧的設計,由氧化鋅量子點構建的ph響應藥物運載與控制釋放系統能夠完美的解決上述納米載藥體常見的四個問題。
很多抗癌藥物自身的疏水性限制了其應用,異維a酸就是其中之一。異維a酸是傳統的抗皮膚癌藥物,但是其疏水性阻礙了它的實際應用。以前的研究人員曾經采用脂質體來包裹和運載異維a酸,然而脂質體的特性使其藥物負載率和釋放率都很低。本發明通過構筑氧化鋅納米載藥平臺,不僅成功解決水溶性問題,而且異維a酸負載率達到34.6%。此載藥體系在生理條件中保持穩定,接觸到腫瘤或者炎癥組織的酸性環境就會分解,完全釋放出包裹的藥物。
技術實現要素:
本發明的目的是提供一種由氧化鋅納米粒子自組裝形成的載藥膠囊及其制備方法和在癌癥治療方面的應用。
本發明提出的自組裝的納米氧化鋅載藥物膠囊,由氧化鋅納米晶內核、聚合物外殼、藥物分子三個部分構成。
本發明提供的納米氧化鋅載藥物膠囊的制備方法,具體步驟為:
(1)合成“氧化鋅-高分子”復合納米粒子,將有機鋅鹽放在乙醇中水解生成氧化鋅納米粒子,鋅鹽的濃度是0.09m-0.11m。此過程中,利用自由基引發氧化鋅納米粒子表面功能團與溶劑中的高分子單體共聚,在65℃-75℃經過兩步聚合反應形成“疏水-親水”共聚物殼層。其中,第一步是具有不飽和雙鍵的功能團與溶劑中的高分子單體共聚,第二步是共聚的高分子交聯到zno納米粒子表面。然后,通過透析除去雜質和溶劑,獲得“氧化鋅-高分子”復合納米粒子;該納米粒子溶于水溶液、ph7緩沖溶液或細胞培養液中,得到“氧化鋅-高分子”復合納米粒子溶液;能長期保持穩定;
(2)將上述“氧化鋅-高分子”復合納米粒子溶液與疏水藥物溶液混合,利用藥物分子與納米粒子之間的相互作用,自組裝形成“氧化鋅-藥物”復合納米膠囊;經過反復透析和濃縮凍干,最終獲得粉末狀產物。
其中,氧化鋅-高分子”復合納米粒子和疏水藥物的質量比通常為1:(0.1-0.5),
所述疏水藥物的溶液,一般為異維a酸的二甲亞砜溶液(異維a酸本身不溶于水,而二甲亞砜可以和水混溶),還可以為地塞米松的二甲亞砜溶液等。
本發明制備得到的“氧化鋅-藥物”復合納米膠囊,直徑為50~150納米(根據實驗條件可調節),藥物負載量超過30%(總質量比),在室溫下水溶液中保持穩定超過1年。
本發明制備得到的“氧化鋅-藥物”復合納米膠囊,具有高負載率(異維a酸負載率達到34.6%)、水溶性強、結構穩定、對ph值敏感等優點,能夠大量負載疏水性藥物,同時根據ph響應完全釋放藥物,可以用于高效殺死癌細胞。
所以本發明的“氧化鋅-藥物”復合納米膠囊可以用于制備癌癥治療藥物。
本發明提出的“氧化鋅-藥物”復合納米膠囊,可以對各種癌細胞進行體外殺傷,其抗癌毒性比疏水的藥物本身普遍提高2-3倍。例如,負載了異維a酸后,對肺癌細胞a549的毒性甚至超過了已經市場化的抗肺癌藥物尼達尼布和克唑替尼。
所述的“氧化鋅-藥物”復合納米膠囊,具有ph響應的功能,將其溶解到不同ph值的緩沖溶液中,可利用氧化鋅納米粒子在弱酸性條件下分解的特征釋放藥物。當ph值在7.0以上,該納米粒子非常穩定;當ph值在6.0~7.0范圍,氧化鋅納米粒子緩慢分解;當ph在5.0~6.0范圍,氧化鋅納米粒子在24小時內就能完全分解釋放藥物,藥物釋放率超過95%。由于癌細胞中,ph值通常在6.0以下,而正常細胞的ph值在7.4左右,因此這種“氧化鋅-藥物”復合納米膠囊能夠選擇性殺死癌細胞。
本發明的原理是,先通過溶膠凝膠法和兩步共聚反應在氧化鋅納米粒子表面包覆共聚高分子,該高分子由疏水基團和親水鏈段構建,具有表面活性劑的特征。這種設計一方面保護了氧化鋅內核不被水溶液破壞,同時具有良好的水溶性;另一方面“氧化鋅-高分子”納米粒子能夠包覆到疏水的藥物分子聚集體上,形成自組裝的膠囊型納米球載藥平臺。該載藥平臺在ph7以上結構長期保持穩定,但是在ph6以下氧化鋅完全分解同時導致整個膠囊分解釋放藥物,實現了在腫瘤弱酸性環境下靶向給藥的目標。雖然氧化鋅和高分子本身幾乎無毒,但是癌細胞毒性測試證明用該載藥平臺釋放藥物的毒性顯著超過藥物本身,甚至超過某些市場化的同類抗癌藥物。
附圖說明
圖1是實施例5產品的高分辨透射電子顯微鏡照片。其中,a為“氧化鋅-高分子”納米粒子的透射電鏡照片,b為“氧化鋅-高分子”納米粒子的高分辨透射電鏡照片,c為負載了異維a酸的納米膠囊的透射電鏡照片,d為負載了異維a酸的納米膠囊的場發射掃描電鏡照片,其中插圖是其高分辨照片。從a和b圖可以看出實施例5的產品其氧化鋅納米粒子的直徑為3納米,晶格間距為0.25nm;從c和d圖可以看出合成的納米膠囊為100nm,為氧化鋅包裹的異維a酸的核殼結構。
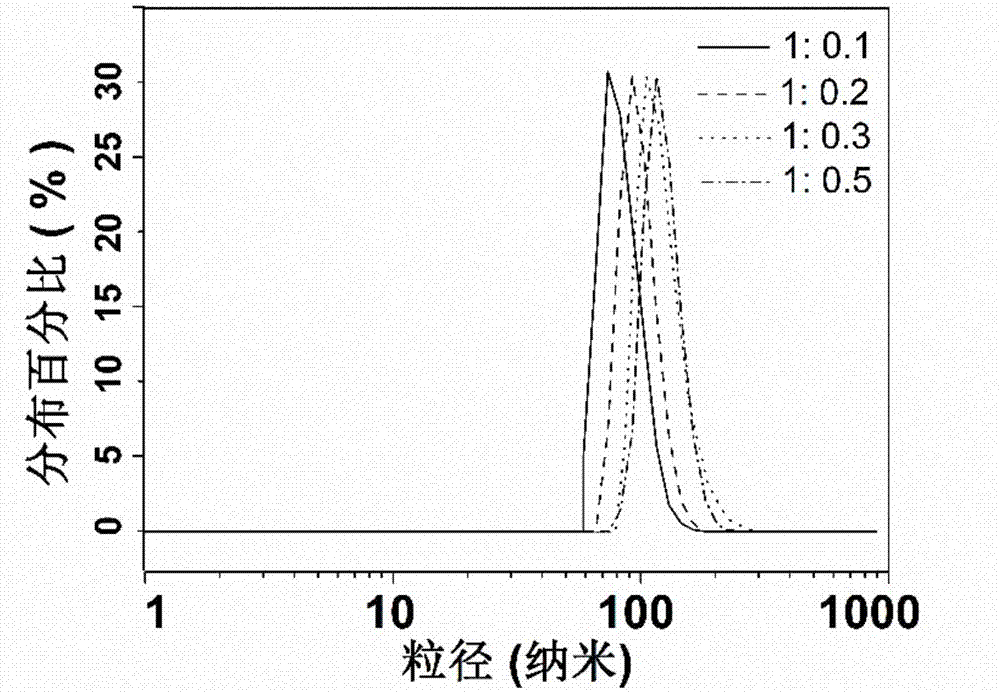
圖2是氧化鋅與異維a酸在合成過程中的配比從1:0.1變化到1:0.5時,所得到的納米膠囊平均直徑從70納米變化到110納米。隨著氧化鋅與異維a酸質量比的增加,合成的微乳球的直徑也逐步增加。
圖3是氧化鋅藥物復合物載體平臺對于癌細胞的治療效果的比較。圖中abcd為氧化鋅、異維a酸和氧化鋅-異維a酸復合納米載體分別對于前列腺癌細胞du145、宮頸癌細胞hela、乳腺癌細胞mcf-7和肺癌細胞a549四種癌細胞的mtt細胞毒性測試對比圖。可以看出復合后的氧化鋅異維a酸復合物的毒性遠大于氧化鋅和異維a酸單體,證明了復合物的毒性增強。其中對于肺癌細胞a549,其毒性的提升最明顯,所以我們將之與已經上市的抗肺癌藥物尼達尼布和克唑替尼進行了對比試驗,實驗結果顯示,純的異維a酸比起上市藥物并不優越,但是對于復合物,發現其對于a549的殺死作用遠大于克唑替尼和尼達尼布,改良的藥物載體平臺大大增強了異維a酸的抗癌效果。
圖4為“氧化鋅-高分子”納米粒子在水中自組裝形成納米膠囊,負載藥物后在癌細胞弱酸性條件下分解釋放藥物的過程。
圖5是將氧化鋅異維a酸藥物載體系統于不同癌細胞分別作用12小時,24小時和48小時之后得到的細胞存活率對比圖。從結果來看,作用時間超過24小時后,數據幾乎無改變,表明24小時是藥物作用于癌細胞的最佳時間。
具體實施方式
實施例1
(1)氧化鋅量子點的合成
稱取0.47克的甲基丙烯酸鋅粉末置于三口燒瓶中,加入25毫升的無水乙醇,加熱至72℃至其完全溶解。待其冷卻至室溫后,加入0.06克的偶氮異丁腈(aibn)和3.75毫升的聚乙二醇單甲醚甲基丙烯酸酯(pegmema),在磁力攪拌的作用下加熱至72℃;10min后,加入25毫升的氫氧化鋰溶液(0.14摩爾/升)和0.06克的偶氮異丁腈(aibn)。于72℃下磁力攪拌1小時。待其冷卻至室溫后,放入透析袋中,于去離子水中透析3天,得到聚合物修飾的氧化鋅納米材料;
(2)氧化鋅-異維a酸納米粒子的合成
取20毫升的氧化鋅(1毫克/毫升)納米粒子的水溶液,加入0.025克的異維a酸溶于25毫升的二甲亞砜溶液2毫升,在黑暗中攪拌,之后用去離子水透析三天除去未反應的藥物和二甲亞砜溶液;
(3)將復合藥物中藥物濃度配制為為10微克/毫升,作用于肺癌細胞a54924h,之后測細胞存活率。主要是應用酶標儀來檢測細胞的存活率。通過酶標儀的檢測可以得出細胞的生存狀態。主要的原理是酶聯免疫吸附劑測定原理,抗原或抗體結合到一些固相載體表面,同時保持其免疫活性,此時抗原或抗體與特定的酶連接成酶標抗原或抗體,能保留載體的免疫活性,也能保留酶的活性。洗滌把固相載體上的抗原抗體復合物和其他物質分開,載體上的酶含量和標本中受檢物質含量形成特定的比例。將酶反應的底物加入后,底物被酶催化成有色的產物,產物的含量和標本中受檢物質的含量相關,因此可根據顏色的深淺進行定性或者定量分析。鑒于酶的催化頻率高,極大地放大了反應結果,使測定方法達到很高的敏感度。存活率=(測定樣品吸光度-空白樣品吸光度)/(對照細胞吸光度-空白細胞吸光度)。
實施例2
制備方法和實施例1相同,但是步驟(2)中使用的異維a酸(1毫克/毫升)為4毫升,其他條件不變。研究不同的投料比對于納米藥物系統負載率的影響,以及mtt測試得到的細胞存活率。
實施例3
制備方法和實施例1相同,但是步驟(2)中使用的異維a酸(1毫克/毫升)為6毫升,其他條件不變。研究不同的投料比對于納米藥物系統負載率的影響,以及mtt測試得到的細胞存活率。
實施例4
制備方法和實施例1相同,但是步驟(2)中使用的異維a酸(1毫克/毫升)為10毫升,其他條件不變。研究不同的投料比對于納米藥物系統負載率的影響,以及mtt測試得到的細胞存活率。
實施例5
制備方法和實施例1相同,但是步驟(3)中使用的細胞換成前列腺癌細胞du145其他條件不變。研究納米藥物載體對于不同的癌細胞的作用,以及mtt測試得到的細胞存活率。
實施例6
制備方法和實施例1相同,但是步驟(3)中使用的細胞換為宮頸癌細胞hela其他條件不變。研究納米藥物載體對于不同的癌細胞的作用,以及mtt測試得到的細胞存活率。
實施例7
制備方法和實施例1相同,但是步驟(3)中使用的細胞換為乳腺癌細胞mcf-7,其他條件不變。研究納米藥物載體對于不同的癌細胞的作用,以及mtt測試得到的細胞存活率。
實施例8
制備方法和實施例1相同,但是步驟(3)中使用的細胞換為乳人結直腸腺上皮細胞dld-1,其他條件不變。研究納米藥物載體對于不同的癌細胞的作用,以及mtt測試得到的細胞存活率。
實施例9
制備方法和實施例1相同,但是步驟(3)中使用的細胞換為肝癌細胞hepg-2,其他條件不變。研究納米藥物載體對于不同的癌細胞的作用,以及mtt測試得到的細胞存活率。
實施例10
制備方法和實施例1相同,但是步驟(1)中使用的異維a酸換為維a酸,其他條件不變。研究不同疏水性藥物的負載性質,以及mtt測試得到的細胞存活率。
實施例11
制備方法和實施例5相同,但是步驟(2)中將異維a酸替換成視黃醇,其他條件不變。研究不同疏水性藥物的負載性質,以及mtt測試得到的細胞存活率。
實施例12
制備方法和實施例5相同,但是步驟(2)中將異維a酸替換成阿利維a酸,其他條件不變。研究不同疏水性藥物的負載性質,以及mtt測試得到的細胞存活率。
本發明將不同的疏水性藥物異維a酸、維甲酸、視黃醇、阿利維a酸與氧化鋅納米材料的復合,并對于異維a酸的不同比例進行探索,“氧化鋅-高分子”納米粒子與異維a酸的質量比為1:0.5左右時為最佳,并將之應用于肺癌細胞a549、前列腺癌細胞du145、宮頸癌細胞hela、乳腺癌細胞mcf-7的癌細胞、人結直腸腺上皮細胞dld-1、肝癌細胞hepg2的檢測之中。見下表3所示。
表3
- 還沒有人留言評論。精彩留言會獲得點贊!