一種阿托伐他汀鈣亞微乳劑及其制備方法與流程
本發明涉及藥劑學技術領域,尤其涉及一種阿托伐他汀鈣亞微乳劑及其制備方法。
背景技術:
阿托伐他汀鈣(atorvastatincalcium,atc)是經典的第三代他汀類降脂藥,商品名為立普妥,是由美國輝瑞制藥公司于1997年上市上產的,劑型為片劑。阿托伐他汀鈣能夠抑制肝臟的膽固醇以及hmg-coa還原酶的生物合成,以此來降低血清脂蛋白濃度和血漿中膽固醇濃度,而且還可以增加細胞表面的肝臟低密度脂蛋白(ldl)受體來增加ldl的攝取和分解代謝以此來減少ldl的生成。阿托伐他汀鈣能夠降低由于脂類代謝功能缺損患者血漿總膽固醇,載脂蛋白,甘油三酯以及ldl膽固醇的水平,同時其能夠明顯減輕由純合子和雜合子所致的家族性高膽固醇血癥和非家族性膽固醇血癥。由于阿托伐他汀鈣屬于bcsii類藥物,其較差的溶解性使得藥物在胃腸道內溶出速率較慢導致了其絕對生物利用度僅有12%,hmg-coa還原酶抑制劑活性的生物利用度只有30%。
阿托伐他汀鈣較低的生物利用度主要源于較差的溶解性,酸性溶液中易降解為內酯結構以及體內清除速率較快三方面原因。因此有研究人員采用新型技術制備阿托伐他汀鈣口服制劑以提高藥物的體內生物利用度。專利201110078062.0采用環糊精作為輔料制備了阿托伐他汀鈣的包合物并以此壓片,專利結果表明該方法可提高藥物的溶解度和穩定性。專利201410567515.x公開了一種阿托伐他汀鈣固體制劑組合物,該方法采用卡波姆、乙基纖維素、丙烯酸樹脂等作為輔料制備了載藥固體分散體并以此壓片,所得到片劑具有較好的溶解性并降低了給藥后胃部的副作用。專利201310725029.1公開了一種阿托伐他汀鈣納米脂質載體及其制備方法,可提高藥物水溶性和穩定性。
技術實現要素:
本發明所要解決的技術問題,就是提出一種阿托伐他汀鈣亞微乳劑,其亞微乳劑平均粒徑小于150nm,能夠有效增加藥物的溶解度同時提高了藥物的體內生物利用度,即改善藥物在小腸內的吸收情況。
此外,本發明還提出了上述阿托伐他汀鈣亞微乳劑的制備方法,本方法可有效避免使用有機溶媒、具有工藝重現性好、質量穩定、產品生物利用度高等優勢,可拓展阿托伐他汀鈣的服藥形式和改善體內療效。
為解決上述技術問題,本發明采用以下技術方案予以實現:
一種阿托伐他汀鈣亞微乳劑,每100ml亞微乳劑中包括如下組分:
其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在油相溶劑中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
作為優選地,每100ml所述阿托伐他汀鈣亞微乳劑中包括如下組分:
作為優選地,所述阿托伐他汀鈣磷脂復合物中的磷脂選自豆磷脂、卵磷脂或人工合成磷脂酰膽堿的至少一種。
作為優選地,所述油相溶劑選自大豆油、中鏈甘油三酯、橄欖油、維生素e及維生素e酯中的至少一種。
作為優選地,所述乳化劑選自卵磷脂、大豆磷脂、氫化磷脂中的至少一種。
作為優選地,所述穩定劑選自吐溫80、泊洛沙姆188、膽固醇硫酸酯鹽、油酸中的至少一種。
作為優選地,所述電位調節劑選自油酸鈉、磷脂酰甘油鈉鹽、磷脂酸鈉鹽中的至少一種。電位調節劑的目的是使制得的乳滴表面帶負電,這樣由于同種電荷的排斥作用使得乳滴不容易聚集,增加乳劑的穩定性,通常是其表面的zeta點位值穩定在-25~-40mv之間可以認為所制備乳劑穩定性良好。
作為優選地,所述阿托伐他汀鈣亞微乳劑的ph值范圍為4-9,通過加入hcl或naoh調節。
本發明還提出了上述阿托伐他汀鈣亞微乳劑的制備方法,包括如下步驟:
(1)稱取油相溶劑加熱至50-85℃,并加入阿托伐他汀鈣磷脂復合物,攪拌使之完全溶解形成溶液,作為油相;
(2)將水加熱至50-85℃,再依次加入乳化劑、穩定劑、電位調節劑、甘油,攪拌形成溶液,作為水相;
(3)將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,緩慢滴加油相,在加熱保溫條件下,以6000-14000rpm高速剪切2~25min得到初乳;
(4)上述初乳中加入hcl或naoh調節ph值為4-9,加水補齊定容至100ml刻度,采用高壓均質法在20℃~60℃下經過200~1200bar的壓力均質2~10次,得到阿托伐他汀鈣亞微乳劑;
(5)將制備的阿托伐他汀鈣亞微乳劑灌裝熔封后,在121℃下高壓滅菌15min得最終成品。
本發明對阿托伐他汀鈣亞微乳劑的處方工藝進行了篩選優化,具體是:以離心穩定常數,平均粒徑,多分散系數作為指標,對影響亞微乳質量的處方因素(油相種類及用量,乳化劑種類及用量,穩定劑種類及用量、電位調節劑及用量、載藥量)進行考察并通過正交實驗對進一步優化,獲得最優的處方;對影響亞微乳質量的工藝參數(剪切溫度、剪切速度、剪切時間、均質溫度、均質壓力、均質循環次數)進行考察并再通過正交實驗對制備工藝進行優化,得出最佳的工藝參數和操作流程。
阿托伐他汀鈣屬于油水均難溶性藥物,本發明采用磷脂復合技術將阿托伐他汀鈣制備成磷脂復合物并以此作為藥物前體制備亞微乳劑。該亞微乳劑平均粒徑小于150nm,能夠有效增加藥物的溶解度同時提高了藥物的體內生物利用度。該方法可有效避免使用有機溶媒、具有工藝重現性好、質量穩定、生物利用度高等優勢,可拓展阿托伐他汀鈣的服藥形式和改善體內療效。
發明人在研究中發現,將阿托伐他汀鈣制備成亞微乳劑之后(水包油型乳劑),其在口服給藥后相比市售制劑不僅提高了藥物的生物利用度,而且在體內表現出了明顯緩慢釋放的效果。本發明所制備的阿托伐他汀鈣亞微乳劑具有以下特點:
(1)采用了阿托伐他汀鈣與磷脂復合的方法改善藥物在油相中的溶解度和穩定性,藥物具有更長的儲存期。
(2)與納米粒載體、膠束載體、微球載體和自乳化載體等相比,阿托伐他汀鈣亞微乳劑避免使用較高濃度的有機溶媒,降低了潛在的毒副作用風險。
(3)阿托伐他汀鈣亞微乳劑制備工藝成熟、重現性好、方法穩定,能夠進行規模化的批量生產。
(4)本發明制備的阿托伐他汀鈣亞微乳劑外觀呈乳白色,平均粒徑為120nm,ph為6.5,包封率為97.57%,經穩定性考察表明其性質質量良好。
附圖說明
圖1本發明制得的阿托伐他汀鈣亞微乳劑電鏡形態圖;
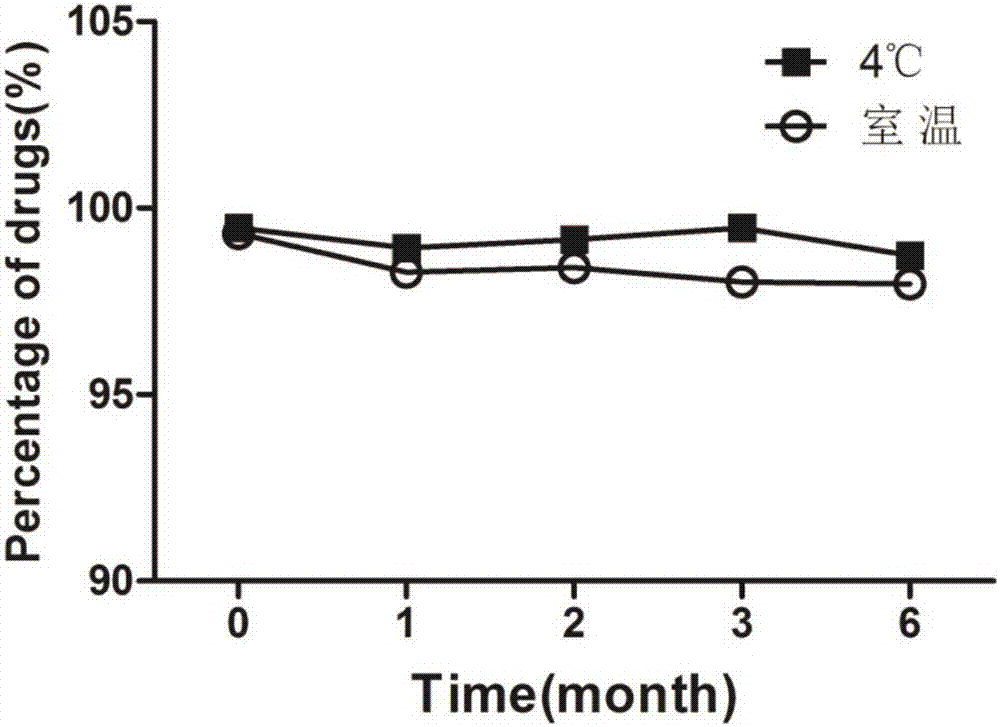
圖2本發明阿托伐他汀鈣亞微乳劑6個月內的含量變化曲線;
圖3本發明阿托伐他汀鈣亞微乳劑與市售制劑的血藥濃度-時間曲線;
圖4本發明阿托伐他汀鈣亞微乳劑與市售制劑的不同腸段吸收速率比較。
具體實施方式
為讓本領域的技術人員更加清晰直觀的了解本發明,下文中將參考附圖并結合實施例來詳細說明本發明。需要說明的是,在不沖突的情況下,本發明中的實施例及實施例中的特征可以相互組合。
本發明中考察載藥亞微乳劑性質的評價指標:
在進行單因素考察的過程中,以離心穩定常數ke,平均粒徑s,多分散系數pdi三個指標來對制備的亞微乳進行評價。
在進行正交優化的過程中,將以上三個指標進行加權評分,評分越小表明所制備亞微乳的質量越優。具體評分規則為:w=(s/smax+pdi/pdimax+ke/kemax)×100,其中s為粒徑,smax為所測最大粒徑;pdi為分散系數,pdimax為所測最大粒徑分散系數;ke為離心穩定常數,kemax為所測最大離心穩定常數。
本發明中所用阿托伐他汀鈣純度>99%,批號:2015123304,市售品立普妥(阿托伐他汀鈣片)由輝瑞制藥有限公司生產,規格為20m,批號:n08117。
實施例1
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:0.5g阿托伐他汀鈣磷脂復合物、5.0g大豆油、0.40g卵磷脂、0.40g泊洛沙姆188、0.20g吐溫80、0.024g油酸鈉、1.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取0.5g阿托伐他汀鈣磷脂復合物加入到5.0g大豆油作為油相,于60℃水浴加熱。稱取0.40g卵磷脂,0.40g泊洛沙姆188,0.20g吐溫80,0.024g油酸鈉,1.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。加入鹽酸或者氫氧化鈉溶液調節終乳ph值至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例2
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:0.5g阿托伐他汀鈣磷脂復合物、10.0g大豆油、0.67g卵磷脂、0.67g泊洛沙姆188、0.20g吐溫80、0.024g油酸鈉、2.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取0.5g阿托伐他汀鈣磷脂復合物加入到10.0g大豆油作為油相中,于60℃水浴加熱。稱取0.67g卵磷脂,0.67g泊洛沙姆188,0.20g吐溫80,0.024g油酸鈉,2.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。加入鹽酸或者氫氧化鈉溶液調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例3
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:0.5g阿托伐他汀鈣磷脂復合物、5.0g大豆油、0.80g卵磷脂、0.40g泊洛沙姆188、0.20g吐溫80、0.024g油酸鈉、1.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取0.5g阿托伐他汀鈣磷脂復合物加入到5.0g大豆油作為油相,于60℃水浴加熱。稱取0.80g卵磷脂,0.40g泊洛沙姆188,0.20g吐溫80,0.024g油酸鈉,1.0g甘油于適量70℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例4
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:1.0g阿托伐他汀鈣磷脂復合物、10.0g大豆油、1.6g卵磷脂、1.6g泊洛沙姆188、0.60g吐溫80、0.08g油酸鈉、2.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取1.0g阿托伐他汀鈣磷脂復合物加入到10.0g大豆油作為油相,于60℃水浴加熱。稱取1.6g卵磷脂,1.6g泊洛沙姆188,0.6g吐溫80,0.08g油酸鈉,2.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例5
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:1.5g阿托伐他汀鈣磷脂復合物、15g大豆油、1.2g卵磷脂、1.8g泊洛沙姆188、0.6g吐溫80、0.1g油酸鈉、3.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取1.5g阿托伐他汀鈣磷脂復合物加入到15g大豆油作為油相,于60℃水浴加熱。稱取1.2g卵磷脂,1.8g泊洛沙姆188,0.6g吐溫80,0.1g油酸鈉,3.0g甘油于適量70℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例6
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:2.0g阿托伐他汀鈣磷脂復合物、20g大豆油、1.80g卵磷脂、2.40g泊洛沙姆188、3.20g吐溫80、0.14g油酸鈉、4.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取2.0g阿托伐他汀鈣磷脂復合物加入到20g大豆油作為油相,于60℃水浴加熱。稱取1.8g卵磷脂,2.4g泊洛沙姆188,3.2g吐溫80,0.14g油酸鈉,4.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例7
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:3.0g阿托伐他汀鈣磷脂復合物、30g大豆油、2.4g卵磷脂、3.6g泊洛沙姆188、3.33g吐溫80、0.12g油酸鈉、5.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取3.0g阿托伐他汀鈣磷脂復合物加入到30g大豆油作為油相,于60℃水浴加熱。稱取2.4g卵磷脂,3.6g泊洛沙姆188,3.33g吐溫80,0.12g油酸鈉,5.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在10000rpm剪切速度下,緩慢滴加油相,剪切5min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1000bar壓力在20℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例8
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:2.5g阿托伐他汀鈣磷脂復合物、25g大豆油、0.4g卵磷脂、0.60g泊洛沙姆188、0.8g吐溫80、0.03g油酸鈉、5.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取2.5g阿托伐他汀鈣磷脂復合物加入到25g大豆油作為油相,于60℃水浴加熱。稱取0.40g卵磷脂,0.60g泊洛沙姆188,0.80g吐溫80,0.03g油酸鈉,5.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在8000rpm剪切速度下,緩慢滴加油相,剪切7min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用800bar壓力在30℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例9
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:1.5g阿托伐他汀鈣磷脂復合物、15g大豆油、2.40g卵磷脂、1.8g泊洛沙姆188、2.4g吐溫80、0.18g油酸鈉、3.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取1.5g阿托伐他汀鈣磷脂復合物加入到15g大豆油作為油相,于60℃水浴加熱。稱取2.40g卵磷脂,1.80g泊洛沙姆188,2.40g吐溫80,0.18g油酸鈉,3.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在14000rpm剪切速度下,緩慢滴加油相,剪切20min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1200bar壓力在40℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例10
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:5g阿托伐他汀鈣磷脂復合物、20g大豆油、1.20g卵磷脂、2.4g泊洛沙姆188、4.0g吐溫80、0.15g油酸鈉、4.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取5g阿托伐他汀鈣磷脂復合物加入到20g大豆油作為油相,于60℃水浴加熱。稱取1.20g卵磷脂,2.40g泊洛沙姆188,4.0g吐溫80,0.15g油酸鈉,4.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在14000rpm剪切速度下,緩慢滴加油相,剪切20min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1200bar壓力在40℃下循環5次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例11
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:0.5g阿托伐他汀鈣磷脂復合物、5.0g大豆油、0.80g卵磷脂、0.60g泊洛沙姆188、0.80g吐溫80、0.03g油酸鈉、1.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取0.5g阿托伐他汀鈣磷脂復合物加入到5.0g大豆油作為油相,于60℃水浴加熱。稱取0.80g卵磷脂,0.60g泊洛沙姆188,0.80g吐溫80,0.03g油酸鈉,1.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在14000rpm剪切速度下,緩慢滴加油相,剪切20min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1200bar壓力在20℃下循環6次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
實例12
本實施例的阿托伐他汀鈣亞微乳,每100ml亞微乳劑中包括如下組分:3.0g阿托伐他汀鈣磷脂復合物、30g大豆油、4.0g卵磷脂、3.0g泊洛沙姆188、4.0g吐溫80、0.15g油酸鈉、5.0g甘油以及加至100ml的蒸餾水,其中,所述阿托伐他汀鈣磷脂復合物作為前體藥物,以增加阿托伐他汀鈣在大豆油中的溶解度,阿托伐他汀鈣與磷脂的摩爾比為1:1。
制備上述阿托伐他汀鈣亞微乳的步驟如下:稱取3.0g阿托伐他汀鈣磷脂復合物加入到30g大豆油作為油相,于60℃水浴加熱。稱取4.0g卵磷脂,3.0g泊洛沙姆188,4.0g吐溫80,0.15g油酸鈉,5.0g甘油于適量60℃的蒸餾水作為水相。將水相加入到100ml塑料離心管中,置于高速分散機,將分散機機探頭浸入水相中,在12000rpm剪切速度下,緩慢滴加油相,剪切10min。剪切結束后,補加蒸餾水定容至100ml,攪拌除去氣泡冷卻至室溫得初乳。接著采用1200bar壓力在20℃下循環6次,最終得終乳。調節終乳ph至7.5左右,安瓿充氮氣灌裝,121℃高壓滅菌15min得成品。對制備的亞微乳進行粒徑,離心穩定常數,多分散系數進行測定。
為了篩選優化本發明中阿托伐他汀鈣的制備工藝和處方組成,本發明進行了各項相關實驗研究,具體如下。
①處方組成的篩選優化
根據處方考察結果,選擇顯著性的影響因素,每個因素選取4個不同水平,使用spss軟件生成5因素4水平的正交表。評分所得越小,說明其制備的乳劑穩定性良好,粒徑小而均勻。正交實驗水平因素設計表如表1所示,正交實驗結果如表2所示。
表1正交實驗水平因素表
表2正交實驗方差結果分析
結果顯示5個因素中對于亞微乳影響程度的大小順序為油相溶劑用量>泊洛沙姆188>油酸鈉>吐溫80>卵磷脂。根據對正交實驗的方差分析結果,采用最佳處方制備的阿托伐他汀鈣亞微乳外觀良好,乳液粘度低,沒有掛壁現象。
②制備工藝的篩選優化
根據單因素考察亞微乳制備過程中的各個因素對于乳劑質量的影響,確定了影響顯著的因素包括剪切溫度,均質壓力,均質循環次數和均值溫度,設計4因素3水平試驗,進行最佳制備工藝的正交優化,因素水平表如表3所示,正交實驗結果如表4所示。正交實驗結果表明各因素的影響程度分別是a>b>d>c,根據極差結果分析確定的最佳工藝組合為a3b3c1d2,即最佳的制備工藝為剪切溫度70℃,高壓均質壓力1200bar,均質循環次數7次,均質溫度30℃,照此工藝條件所制備的亞微乳粒徑較小且分布均勻,亞微乳呈乳白色,黏度低,無掛壁現象,滅菌后乳劑穩定性良好。
表3正交實驗水平因素表
表4工藝優化正交實驗方案
③阿托伐他汀鈣亞微乳的最佳處方工藝驗證
依據最佳處方工藝制備三批亞微乳(以實施例8為例),觀察期外觀和形態,并對粒徑,電位,ph值,含量和包封率進行測定。結果顯示所制備亞微乳其外觀乳白,無明顯掛壁,伴有淡藍色乳光,其離心穩定性好,平均粒徑為124.7nm,平均包封率可達97.1%。形態和測定如圖1和表5所示。
表5三批乳劑評價結果
④阿托伐他汀鈣亞微乳的穩定性考察
所制備的亞微乳(以實施例8為例)經高壓滅菌后進行長期儲存其外觀,ph值,粒徑,含量和包封率均未發生明顯改變,表明制備的亞微乳穩定性良好。結果研究表明無論在4℃還是在室溫下儲存,體系的ph沒有明顯變化;在考察期內,乳滴粒徑未見明顯的變化;自制的三批亞微乳樣品的6個月的平均包封率為97.54%,表明藥物絕大部分分布于油相中;含量的測定表明亞微乳作為阿托伐他汀鈣的載體能夠保證其在儲存過程中的穩定性,室溫和4℃下存放六個月其含量基本沒有變化,如圖2所示。
表6亞微乳ph考察結果
表7亞微乳粒徑考察結果(單位nm)
表8亞微乳包封率考察結果(%)
⑤阿托伐他汀鈣亞微乳的體內生物利用度
阿托伐他汀鈣亞微乳(以實施例8為例)與市售制劑生物利用度的比較。采用口服灌胃的方法比較阿托伐他汀鈣亞微乳和市售制劑立普妥的口服生物利用度,采用hplc法測定不同時間的血藥濃度變化,繪制藥時曲線,運用das3.0軟件對藥動學數據進行分析。
結果表明市售制劑達峰時間為0.5h,阿托伐他汀鈣亞微乳的達峰時間略有延長至0.75h。二者cmax分別為0.531mg/l和0.801mg/l,亞微乳組比市售制劑組提高1.62倍。亞微乳組的藥時曲線下面積(auc)為4.03mg/l·h,較市售組(1.72mg/l·h)提高了2.34倍,且半衰期明顯延長,吸收速率常數顯著增加,說明阿托伐他汀鈣亞微乳可以有效促進藥物的體內吸收,改善體循環時間并顯著提高生物利用度,相關藥動學曲線及參數見圖3和表9。
表9體內藥動學參數
⑥阿托伐他汀鈣亞微乳的在體腸灌流實驗
采用大鼠小腸灌流的方法來比較阿托伐他汀鈣亞微乳(以實施例8為例)和市售片劑在十二指腸,回腸,空腸,結腸的吸收情況。根據不同時間腸灌流液中的剩余藥量,求算出不同腸段的吸收速率常數和表觀滲透系數。其中吸收速率常數ka的計算如下:
lnxt=-ka·t+lnx0
lnxt=-ka·t+lnx0
其中xt是時間t是灌流液中剩余的藥量,x0是時間t=0時灌流液中的藥物量。
圖4結果顯示阿托伐他汀鈣在四個腸段的吸收沒明顯差異,其在四個腸段的吸收情況為十二指腸>回腸>空腸≈結腸,相對來說阿托伐他汀鈣在十二指腸吸收較好。而將阿托伐他汀鈣制備成亞微乳后能夠促進其在各個腸段的吸收,尤其在結腸吸收改變最明顯,表明了阿托伐他汀鈣亞微乳能夠明顯改善其在結腸段的吸收情況,制備成亞微乳后其在各腸段的吸收情況為結腸>十二指腸>空腸>回腸。
需要說明的是,對于前述的方法實施例,其中各組分的選擇,可以做相應的更換,并不限于上述實施例公開的選擇,具體參照說明書中發明內容公開的為準,只需各組分間比例符合比例即可。
另應說明的是:以上實施例僅用以說明本發明的技術方案,而非對其限制;盡管參照前述實施例對本發明進行了詳細的說明,本領域的普通技術人員應當理解:其依然可以對前述各實施例所記載的技術方案進行修改,或者對其中部分技術特征進行等同替換;而這些修改或者替換,并不使相應技術方案的本質脫離本發明各實施例技術方案的精神和范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!