一種改性金納米棒@硫氧化釓及其制備方法與流程
本發明屬于納米材料制備領域,具體涉及一種改性金納米棒@硫氧化釓及其制備方法。
背景技術:
在過去二十年,納米材料因其獨特的光學及物理性質,在生物應用領域已經被廣泛探究,尤其是在生物成像和藥物遞送方面。金納米棒是研究最多的膠體納米粒子之一,作為一種典型的等離子納米粒子,金納米棒在近紅外區域可以調整它的縱向表面等離子共振性質,已經在疾病診斷的應用領域中被廣泛的探索。大多數以金為基礎的納米平臺用等離子共振來增強雙光子光致發光和局部光熱,同時提高生物成像和光熱治療。單分散的金納米棒通常用晶種法來制備,用陽離子表面活性劑ctab作為“軟模板”。但是ctab是一種生物毒性分子,對細胞具有毒性作用。另外,金納米棒在激光照射下容易發生熱變形,金納米棒由棒狀結構逐漸轉變成球形結構,長徑比顯著減小,從而導致lspr明顯藍移。這種熱變形大大限制了金納米棒在高溫下的應用,并且對金納米棒在生物醫學上的光熱療法也是不利的。
為了解決上述問題,我們構建了一種核殼結構的金納米棒,在金納米棒表面包裹上gd2o2s。制備核殼結構的金納米棒/硫氧釓的方法簡單,易于合成,沒有復雜的去除ctab以及修飾成像劑等繁瑣步驟。將金納米棒構建成核殼結構后,金納米棒的生物毒性降低,同時光熱穩定性也得到提高。金納米棒本身的光熱轉換效率高,可用于腫瘤的光熱治療。而在其表面包裹的無定型gd2o2s可以用于mri成像,光聲成像。這種將無損,非入侵式的成像和治療結合在一起的納米材料在生物醫學方面將應用的更為廣泛。
技術實現要素:
本發明的目的在于針對現有技術的不足,提供一種改性金納米棒@硫氧化釓及其制備方法。將gd2o2s包覆金納米棒后,降低了金納米棒的生物毒性,提高了其光熱穩定性;同時gd2o2s可以用于mri成像,光聲成像,拓寬了納米材料的應用。
為實現上述發明目的,本發明采用如下技術方案;
一種改性金納米棒@硫氧化釓的制備方法:將金納米棒與六亞甲基四胺、抗壞血酸和硫代乙酰胺混合均勻,然后往混合液中加入gd(no3)3,將混合液加熱至80℃,攪拌至獲得深紫色溶液;然后離心收集下層產物,經乙醇和去離子水洗滌多次后,得到金納米棒@硫氧化釓;將金納米棒@硫氧化釓(gd2o2s)與聚丙烯酸混合,超聲處理,得到水溶性聚丙烯酸改性的gnrs@gd2o2s。
金納米棒、gd(no3)3中的金元素和釓元素的摩爾之比為:1:1.5~13;
金納米棒@gd2o2s與聚丙烯酸的用量之比為:1:0.5~1;
根據上述方法制得的改性金納米棒@gd2o2s,其殼層的厚度為4~20nm。
金納米棒的制備方法,包括以下步驟:
(1)晶種溶液的配制:將haucl4和ctab溶液混合攪拌均勻,然后在攪拌下將新鮮制備的冰冷的nabh4溶液加入到混合物溶液中,繼續攪拌一段時間。之后將其在室溫條件下靜置;
(2)生長液的配制;將haucl4和agno3、ctab溶液溫育一段時間,然后加入一定量的aa;
(3)制備金納米棒;將種子溶液注入生長溶液中,將溶液溫和混合一段時間,并在27-30℃下靜置6小時,得到所需的gnrs。
本發明的有益效果在于:
1)本發明在金納米棒上包覆gd2o2s,所形成的核殼結構的納米材料,一方面顯著降低了金納米棒本身的生物毒性,提高了其光熱穩定性;另一方面gd2o2s可以用于mri成像,光聲成像;gd2o2s與金納米棒結合所制得的納米材料集光熱治療與mri、pai成像于一體,在生物醫學方面有更為廣泛的應用;
2)制備方法簡單,可重復性好,沒有復雜的去除ctab以及修飾成像劑等繁瑣步驟。
附圖說明
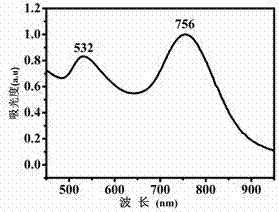
圖1a-圖1d為金納米棒及實施例1-3制得的改性gnrs@gd2o2s的紫外可見吸收光譜圖,其中,圖1a表示單純的金納米棒,圖1b表示gd2o2s殼層厚度為4nm的gnrs@gd2o2s,圖1c表示gd2o2s殼層厚度為8nm的gnrs@gd2o2s,圖1d表示gd2o2s殼層厚度為20nm的gnrs@gd2o2s;
圖2a-圖2d為金納米棒及實施例1-3制得的改性gnrs@gd2o2s透射電鏡顯微鏡圖(tem),其中,圖2a表示單純的金納米棒,圖2b表示gd2o2s殼層厚度為4nm的gnrs@gd2o2s,圖2c表示gd2o2s殼層厚度為8nm的gnrs@gd2o2s,圖2d表示gd2o2s殼層厚度為20nm的gnrs@gd2o2s;
圖3實施例3中制備的gnrs@gd2o2s在不同濃度同一激光功率照射下的升溫曲線;
圖4實施例3中制備的gnrs@gd2o2s在同一濃度不同激光功率照射下的紅外熱成像圖;
圖5實施例3中制備的gnrs@gd2o2s光熱循環曲線圖,其中,上方曲線為gnrs@gd2o2s,下方曲線為gnrs;
圖6為實施例3中制備的gnrs@gd2o2s對細胞的殺傷效果圖;
圖7a-圖7c為實施例3中制備的gnrs@gd2o2s的mri成像結果,其中,圖7a為不同濃度的gnrs@gd2o2s和釓噴酸葡胺(gd-dtpa)的mrit1信號成像圖,圖7b為mri信號強度與gnrs@gd2o2s和釓噴酸葡胺(gd-dtpa)濃度的線性關系,圖7c為荷瘤小鼠的mri成像圖,其中左圖為注射材料前的mri成像圖,右圖為注射材料后的mri成像圖;
圖8a-圖8c為實施例3中制備的gnrs@gd2o2s的pai成像結果,其中,圖8a為不同濃度的gnrs@gd2o2s光聲成像圖,圖8b為不同濃度的gnrs@gd2o2s光聲信號強度圖,圖8c為荷瘤小鼠的pai成像圖,其中左圖為注射材料前的光聲成像圖,右圖為注射材料后的光聲成像圖;
圖9為實施例3中制備的gnrs@gd2o2s的荷瘤小鼠的紅外熱成像圖;
圖10為實施例3中制備的gnrs@gd2o2s的荷瘤小鼠的光熱治療效果圖;
圖11為實施例3中制備的gnrs@gd2o2s的荷瘤小鼠注射材料后的腫瘤生長曲線;
圖12為實施例3中制備的gnrs@gd2o2s的荷瘤小鼠在不同治療條件下治療后的腫瘤h&e圖。
具體實施方式
本發明結合具體實施例參見附圖進一步說明如下,然而,這些實施例不應視為是對本發明范圍的限制。
實施例1
制備殼層為4nm厚的改性gnrs@gd2o2s,包括以下步驟:
1)晶種溶液的配制:將0.01m,0.25mlhaucl4加入到0.1m,9.75mlctab溶液中攪拌,然后在攪拌下將新鮮制備的冰冷的0.01m,0.6mlnabh4溶液加入到混合物溶液中,繼續攪拌2分鐘,之后將其在室溫條件下靜置2h;
2)生長液的配制:將0.01m,2mlhaucl4與0.01m,0.35mlagno3和0.1m,40mlctab溶液溫育,然后加入0.1m,0.32mlaa;
3)制備金納米棒:將25μl種子溶液注入生長溶液中,將溶液溫和混合30秒,并在28℃下靜置6小時,得到所需的gnrs;
4)制備改性gnrs@gd2o2s:將步驟3)制備的未離心的10mlgnrs與1ml,0.1m六亞甲基四胺,0.5ml,0.1maa和40μl,0.1m硫代乙酰胺混合,然后加入40μl,0.1mgd(no3)3,將反應混合物加熱至80℃,輕輕攪拌8小時,獲得深紫色溶液;通過離心(10000rpm,10分鐘)收集產物,隨后用乙醇和去離子水洗滌數次,然后將gnrs@gd2o2s和聚丙烯酸的混合物(gnrs@gd2o2s和聚丙烯酸的用量比為1:0.5)超聲處理6小時,以獲得水溶性paa改性的gnrs@gd2o2s,所得溶液置于常溫下保存。
實施例2
制備殼層為8nm厚的改性gnrs@gd2o2s,包括以下步驟:
1)晶種溶液的配制:將0.01m,0.25mlhaucl4加入到0.1m,9.75mlctab溶液中攪拌,然后在攪拌下將新鮮制備的冰冷的0.01m,0.6mlnabh4溶液加入到混合物溶液中,繼續攪拌2分鐘,之后將其在室溫條件下靜置2h;
2)生長液的配制:將0.01m,2mlhaucl4與0.01m,0.35mlagno3和0.1m,40mlctab溶液溫育,然后加入0.1m,0.32mlaa;
3)制備金納米棒:將25μl種子溶液注入生長溶液中,將溶液溫和混合30秒,并在30℃下靜置6小時,得到所需的gnrs;
4)制備改性gnrs@gd2o2s:將步驟3)制備的未離心的10mlgnrs與1ml,0.1m六亞甲基四胺,0.5ml,0.1maa和40μl,0.5m硫代乙酰胺混合,然后加入40μl,0.5mgd(no3)3,將反應混合物加熱至80℃,輕輕攪拌8小時,獲得深紫色溶液;通過離心(10000rpm,10分鐘)收集產物,隨后用乙醇和去離子水洗滌數次,將gnrs@gd2o2s和聚丙烯酸的混合物(gnrs@gd2o2s和聚丙烯酸的用量比為1:0.8)超聲處理6小時,以獲得水溶性paa改性的gnrs@gd2o2s,所得溶液置于常溫下保存。
實施例3
制備殼層為20nm厚的改性gnrs@gd2o2s,包括以下步驟:
1)晶種溶液的配制:將0.01m,0.25mlhaucl4加入到0.1m,9.75mlctab溶液中攪拌,然后在攪拌下將新鮮制備的冰冷的0.01m,0.6mlnabh4溶液加入到混合物溶液中,繼續攪拌2分鐘,之后將其在室溫條件下靜置2h;
2)生長液的配制:將0.01m,2mlhaucl4與0.01m,0.35mlagno3和0.1m,40mlctab溶液溫育,然后加入0.1m,0.32mlaa;
3)制備金納米棒:將25μl種子溶液注入生長溶液中,將溶液溫和混合30秒,并在30℃下靜置6小時,得到所需的gnrs;
4)制備改性gnrs@gd2o2s:將步驟3)制備的未離心的10mlgnrs與1ml,0.1m六亞甲基四胺,0.5ml,0.1maa和40μl,0.8m硫代乙酰胺混合,然后加入40μl,0.8mgd(no3)3,將反應混合物加熱至80℃,輕輕攪拌8小時,獲得深紫色溶液;通過離心(10000rpm,10分鐘)收集產物,隨后用乙醇和去離子水洗滌數次,然后分散在去離子水中用于進一步使用。最后,將gnrs@gd2o2s和聚丙烯酸的混合物(gnrs@gd2o2s和聚丙烯酸的用量比為1:1)超聲處理6小時,以獲得水溶性paa改性的gnrs@gd2o2s。所得溶液置于常溫下保存。
實施例4
本實例用于說明不同濃度的gnrs@gd2o2s在激光照射下的升溫情況。
將實施例3中制備的gnrs@gd2o2s離心水洗一次后,將其配制成濃度為12.5、25、50和100μgml-1(以au濃度計算),隨后取1ml溶液至比色皿中,用808nm激光以1wcm-2的功率分別照射5min。溫度用熱成像儀記錄。
實施例5
本實例用于說明gnrs@gd2o2s在不同一激光功率照射下的升溫情況。
將實施例3中制備的gnrs@gd2o2s離心水洗一次后,將其配制成濃度為100μgml-1(以au濃度計算),隨后取1ml溶液至比色皿中,用808nm激光以0.5、0.8、1wcm-2的功率分別照射5min。溫度用熱成像儀記錄。
實施例6
本實例用于說明gnrs@gd2o2s光熱循環穩定性。
將實施例3中制備的gnrs@gd2o2s離心水洗一次后,將其配制成濃度為100μgml-1(以au濃度計算),同樣,配制相同濃度的gnrs,隨后取1ml溶液至比色皿中,用808nm激光光照10min后停止光照,讓其溫度降至室溫,再光照10min,重復做4個循環,溫度用熱成像儀記錄。從圖5可以看到,經歷4個循環后,gnrs@gd2o2s溫度變化值很小,gnrs的溫度變化值明顯降低,可以表明gnrs@gd2o2s的光穩定性很好。這個結果進一步證明了gnrs@gd2o2s能夠用于光熱的成像劑。
實施例7
本實例用于說明gnrs@gd2o2s對細胞的殺傷效果。
hepg2細胞放在96孔板細胞培養基里溫育24h,然后加入不同濃度的gnrs@gd2o2s(0,12.5,25,50和75ìg/ml)再溫育4h后,用近紅外激光(808nm,1w/cm2)照射細胞5min和不照射5min。細胞的存活率用cck-8檢測。
實施例8
本實例用于說明gnrs@gd2o2s可以用于磁共振成像。
將實例3中制備的gnrs@gd2o2s離心水洗一次后,配制成一系列濃度為:0.05,0.1,0.2和0.4mm(gd離子濃度),同時也配制同濃度的釓噴酸葡胺溶液。取1ml溶液至色譜瓶中,測量mri信號。將100μl,50μgml-1材料瘤內注射進荷瘤小鼠,測試注射前和注射后的mri成像圖,圖7a顯示了不同濃度材料的mrit1成像圖,圖7b是mri信號強度與gd濃度的關系圖,可以看出兩者顯示出了很好的線性關系,且gnrs@gd2o2s的弛豫率是標準的mri造影劑釓噴酸葡胺的兩倍,圖7c是活體mri成像,在活體成像中mri信號強度在注射后也明顯增強。因此,gnrs@gd2o2s可作為一種很好的mri造影劑,用來進行生物成像。
實施例9
本實例用于說明gnrs@gd2o2s可以用于光聲成像。
將實例3中制備的gnrs@gd2o2s離心水洗一次后,配制成一系列濃度為:0、15、30、60和90μgml-1(以gd離子濃度計算),測量pai信號。將100μl,50μgml-1材料瘤內注射進荷瘤小鼠,測試注射前和注射后的pai成像圖。圖8a顯示了不同濃度材料的pai成像圖,圖8b是pai信號強度圖,圖8c是活體pai成像,在活體成像中pai信號強度在注射后也明顯增強。因此,gnrs@gd2o2s可作為一種很好的pai造影劑,用來進行生物成像。
實施例10
實驗組將100μl,50μgml-1實施例3中gnrs@gd2o2s瘤內注射進老鼠腫瘤部位,然后用808nm激光以1wcm-2的功率光照8min,空白組為注射pbs到腫瘤光照。溫度用熱成像儀記錄,每隔兩分鐘拍一次照。最后選取了實驗組和空白組進行對比,可以發現實驗組的溫度最高溫達到52.1℃,而空白組的最高溫度大約為34.9℃。可以看出gnrs@gd2o2s的光熱轉換效率良好,具有光熱治療效果。
實施例11
將20只老鼠平分為4組,每5只一組,將100μl,50μgml-1實施例3中gnrs@gd2o2s瘤內注射進老鼠腫瘤部位,然后用808nm激光以1wcm-2的功率光照8min作為實驗組。另外三組為控制組:空白組為無任何處理,注射材料到老鼠腫瘤部位不光照,注射pbs到腫瘤進行光照。然后每隔兩天對老鼠進行拍照,連續觀察16天。從實驗組和空白組對比可以看出治療后,實驗組的老鼠腫瘤明顯減小,基本近無,而空白組的老鼠腫瘤不斷變大。因此,gnrs@gd2o2s具有良好的光熱治療效果。
實施例12
本實例用于說明荷瘤小鼠治療過程中的腫瘤大小變化。
將實施例11中的各組老鼠每隔兩天用游標卡尺量腫瘤的大小,連續觀察16天,用腫瘤體積對天數作圖。從圖11可以看出除了實驗組的腫瘤體積在變小,其它三組的腫瘤體積在16天這一段時間內都在增大。說明了gnrs@gd2o2s具有光熱治療效果。
實施例13
本實例用于說明荷瘤小鼠治療后的組織損傷。
將實施例11中的各組老鼠在治療16天后處死,取出腫瘤部位,進行h&e染色,獲得腫瘤組織切片。從圖12可以看出,單純的材料不加光照對組織沒有損傷,而加光照后組織就有損傷,達到光熱治療效果。
采用銀離子介導的晶種生長法制備了金納米棒,并對金納米棒進行了gd2o2s的包埋,成功制備了殼層厚度分別為4nm、8nm、20nm的gnrs@gd2o2s,包裹的殼層改變金棒表面的介電常數進而對金棒的lspr進行調節,在近紅外激發窗口具有良好的光熱轉換效率(22.6%),且結合pai和mri成像,將腫瘤的診斷與治療一體化,更有利于金納米棒的應用。
以上結合具體實施例解釋為對本發明的技術原理。這些描述只是為了解釋本發明的原理,而不能以任何方式解釋為對本發明保護范圍的限制。基于此處的解釋,本領域的技術人員不需要付出創造性的勞動即可聯想到本發明的其它具體實施方式,采用等同替換或等效變換形成的技術方案,均落入本發明的保護范圍之內。
- 還沒有人留言評論。精彩留言會獲得點贊!