具有改變特性的α?淀粉酶變異體的制作方法
本申請是申請日為2005年07月05日,申請?zhí)枮椤?01310141642.9”、名稱為“具有改變特性的α-淀粉酶變異體”的發(fā)明專利申請的分案申請。本發(fā)明涉及親本termamyl-樣α-淀粉酶的變異體(突變體),該變異體具有α-淀粉酶活性且相對于所述親本α-淀粉酶表現(xiàn)出至少一種下列特性改變:底物特異性,底物結(jié)合,底物裂解方式,熱穩(wěn)定性,ph活性譜(profile),ph穩(wěn)定性譜,氧化穩(wěn)定性,ca2+依賴性,pi減少和增加以及改進的洗滌效果,比活,在例如,高溫和/或低/高ph條件下,特別是在低鈣濃度下的穩(wěn)定性,和在洗滌劑(detergent)存在下的穩(wěn)定性,例如在洗滌劑中的貯存穩(wěn)定性。本發(fā)明的變異體適合于淀粉轉(zhuǎn)化,乙醇生產(chǎn),衣物洗滌,盤子洗滌,硬表面清潔,紡織品脫漿(desizing),和/或甜味劑生產(chǎn)。
背景技術(shù):
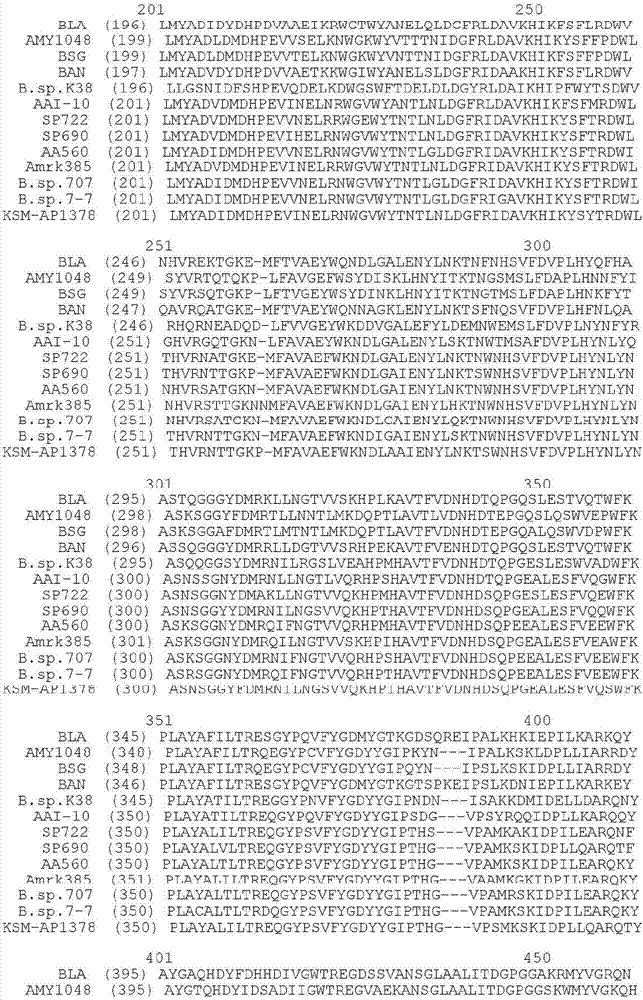
:α-淀粉酶(α-1,4-葡聚糖-4-葡聚糖水解酶,e.c.3.2.1.1)由一組酶構(gòu)成,它催化淀粉和其它直鏈和支鏈1,4-糖苷鍵寡糖和多糖的水解。本發(fā)明的目的是提供特別適用于洗滌劑用途的改進α-淀粉酶。本發(fā)明的概述本發(fā)明的目的是提供termamyl-樣淀粉酶,與相應的親本α-淀粉酶,即,未突變的α-淀粉酶相比該變異體具有α-淀粉酶活性且相對于所述親本α-淀粉酶表現(xiàn)出至少一種上述特性改變。具體地,本發(fā)明涉及如下各項:1.親本termamyl-樣α-淀粉酶的變異體,其包含在選自如下組中的一個或多個位置改變:26,30,33,82,37,106,118,128,133,149,150,160,178,182,186,193,203,214,231,256,257,258,269,270,272,283,295,296,298,299,303,304,305,311,314,315,318,319,339,345,361,378,383,419,421,437,441,444,445,446,447,450,461,471,482,484,其中(a)改變是獨立地(i)在占據(jù)該位置的氨基酸下游插入氨基酸,(ii)缺失占據(jù)該位置的氨基酸,或(iii)用不同的氨基酸取代占據(jù)該位置的氨基酸,(b)該變異體具有α-淀粉酶活性,和(c)各位置相應于具有親本termamyl-樣α-淀粉酶的氨基酸序列的親本α-淀粉酶的氨基酸序列位置,該親本termamyl-樣α-淀粉酶具有seqidno:12所示的aa560的氨基酸序列。2.項1的變異體,其中該突變是:r26s,d30n,n33d,r82h,k37t,n106d,k118q,n128y,g133e,a,g149a,n,n150h,q,y160f,y178f,g182t,g186a,t193s,n,d,e,q,y203l,v214i,t,d231n,g256k,t257i,g258d,k269s,q,n270f,y,d,l272i,v,a,n283d,y295f,n,d,q,e,n296k,q,e,y298f,h,n299f,y,q,t,s303q,k,y304f,r,k,g305d,q311n,q,k,r,t,s,y,f,n314d,s,t,q,g315n,s,t,v318l,q319e,k,s,t,a339s,t,e345n,r,q361e,g378k,k383r,t419n,h421y,n437h,f441l,r444e,y,n445q,k446r,a447y,v450t,t461p,n471e,w482y,n484q。3.項1-2的變異體,其中該變異體在一個或多個甲硫氨酸殘基上具有額外的突變。4.項3的變異體,其中該甲硫氨酸殘基是:m9,m10,m116,m202,m208,m261,m309,m323,m382,m410,m430,和m440。5.項4的變異體,其中該突變是:m9l,i,m10l,m105l,i,f,m116n,d,l,i,f,w,r,k,m202i,l,v,t,m208f,y,l,i,m261l,i,m309l,i,m323l,i,s,t,a,q,e,n,d,m382l,i,y,f,k,m410l,i,v,m430l,i,和m440l,i,f,y。6.項1-5的變異體,其中該變異體具有一個或多個下列突變:m9l+m202i,m9l+m202i+m323t,m9l+m202i+323t+m382y,m9l+m202i+y295f+a339s,m9l+m202i+y295f,m9l+m202i+a339s,m9l+m202i+y295f+a339s,m9l+m202i+y295f+a339s+e345r,m9l+g149a+m202i+y295f+a339s+e345r,m9l+m202l,m9l+m202l+m323t,m9l+m202l+m232t+m382y,m9l+m202l+y295f+a339s,m9l+m202l+y295f,m9l+m202l+a339s,m9l+m202l+y295f+a339s,m9l+m202l+y295f+a339s,e345r,m9l+g149a+m202l+y295f+a339s+e345r,m9l+m202t,m9l+m202t+m323t,m9l+m202t+m323t+m382y,m9l+m202t+y295f+a339s,m9l+m202t+y295f,m9l+m202t+a339s,m9l+m202t+y295f+a339s,m9l+m202t+y295f+a339s+e345r,m9l+g149a+m202t+y295f+a339s+e345r,m9l+g149a+m202i+v214t+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202l+v214i+y295f+m323t+a339s+e345r+m382y,m9l+g149a+g182t+g186a+m202i+v214i+y295f+n299y+m323t+a339s,m9l+g149a+g182t+g186a+m202l+t257i+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202l+v214t+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202i+v214i+y295f+m323t+a339s+e345r+m382y,m9l+g149a+g182t+g186a+m202l+v214i+y295f+n299y+m323t+a339s,m9l+g149a+g182t+g186a+m202i+t257i+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202i+v214t+y295f+n299y+m323t+a339s+e345r+n471e,m9l+g149a+m202l+v214i+y295f+m323t+a339s+e345r+m382y+n471e,m9l+g149a+g182t+g186a+m202i+v214i+y295f+n299y+m323t+a339s+n471e,m9l+g149a+g182t+g186a+m202l+t257i+y295f+n299y+m323t+a339s+e345r+n471e,m202l+m105f+m208f,g133e+m202l+q361e,g133e+m202l+r444e,m202l+y295f,m202l+a339s,m202l+m323t,m202l+m323t+m309l,m202l+m323t+m430i,m202l+v214t+r444y,m202l+n283d+q361e,m202l+m382y+k383r,m202l+k446r+n484q,m202i+y295f,m202i+a339s,m202i+m105f+m208f,g133e+m202i+q361e,g133e+m202i+r444e,m202i+m202i+m323t,m202i+m202i+m323t+m309l,m202i+m323t+m430i,m202i+v214t+r444y,m202i+n283d+q361e,m202i+m382y+k383r,m202i+k446r+n484q,m202v+m105f+m208f,g133e+m202v+q361e,g133e+m202v+r444e,m202v+m323t,m202v+m323t+m309l,m202v+m323t+m430i,m202v+m323t+m9l,m202v+v214t+r444y,m202v+n283d+q361e,m202v+m382y+k383r,m202v+k446r+n484q,m202t+m105f+m208f,g133e+m202t+q361e,g133e+m202t+r444e,m202t+y295f,m202t+a339s,m202t+m323t,m202t+m323t+m309l,m202t+m323t+m430i,m202t+m323t+m9l,m202t+v214t+r444y,m202t+n283d+q361e,m202t+a339s,m202t+y295fm202t+n299f,y,m202t+m382y+k383r,m202t+k446r+n484q。7.項1-6的變異體,其中該變異體還含有突變d183*+g184*。8.項1-7的變異體,其中該變異體還含有在r118的突變,特別是r118k。9.項1-8的變異體,其中該變異體還含有在n195的突變,特別是n195f。10.項1-9的變異體,其中該變異體還含有在r320的突變,特別是r320k。11.項1-10的變異體,其中該變異體還含有在r458的突變,特別是r458k。12.項1-11的變異體,其中該變異體含有突變d183*+g184*+r118k+n195f+r320k+r458k與一個或多個下列突變的組合:k118q,k37t,h421y,v450t,k383r,n445q,y178f,v318l,w482y,n283d+q361e,m105f+m208f,m202l+m323t+m430i,k446r+n484q,r444y,n106d,y203l,g133e+q361e,m323e,v214t,m202l+m323t+m309l,m202l,m202l+m323t,m202l+m323t+m9l+m382y+k383r,m202l+m323t+m9l+m382y,m202l+m323t+m9l。13.項12的變異體,其中該變異體含有突變d183*+g184*+r118k+n195f+r320k+r458k+m202l+m323t+m9l。14.項13的變異體,其中該變異體還含有一個或多個下列突變:t461p,y298h,g133e+r444e,y298f,m202t,m202i,m202v,v214t+m323e+m382y+k383r+n471ey178f+g258d+t419n+n437hg149n+n150q+m382y+k383ry160f+v214t+m382yn128y+g149a+v214t+d231n+m382y+f441lr82h+n128y+g149a+v214t+m382yn150h+v214tv214t+e345nv214t+g305d+m382y+r444ev214t+m382y+a447ym202i+v214t+m382y+k383r+r444yv214t+g378kv214t+a256kr26s+d30n+n33d+v214t+m382y。15.項1-14中任一項的變異體,其中該親本termamyl-樣α-淀粉酶來源于地衣芽孢桿菌,解淀粉芽孢桿菌,嗜熱脂肪芽孢桿菌,芽孢桿菌屬菌種ncib12289,ncib12512,ncib12513或dsm9375,或dsmzno.12649,ksmap1378,或ksmk36或ksmk38的菌株。16.項1-15的變異體,其中該親本termamyl-樣α-淀粉酶是選自seqidnos:2,4,6,8,10,12,13,14,1516,17,和18所述的組中的任何α-淀粉酶。17.根據(jù)項1-16任一項的變異體,其中該親本termamyl-樣α-淀粉酶具有與seqidno:4有至少60%,優(yōu)選70%,更優(yōu)選至少80%,甚至更優(yōu)選至少大約90%,甚至更優(yōu)選至少95%,甚至更優(yōu)選至少97%,和甚至更優(yōu)選至少99%同一性程度的氨基酸序列。18.項1-17中任一項的變異體,其中該親本termamyl-樣α-淀粉酶由核酸序列編碼,該核酸序列在低等,優(yōu)選中等,優(yōu)選高度嚴格條件下與seqidno:11的核酸序列雜交。19.項1-18的變異體,該變異體相對于所述親本α-淀粉酶具有至少一種下列特性改變:底物特異性,底物結(jié)合,底物裂解模式,熱穩(wěn)定性,ph活性譜,ph穩(wěn)定性譜,氧化穩(wěn)定性,ca2+依賴性,pi減少和增加以及改進的洗滌效果,比活,在例如,高溫和/或低/高ph條件下,特別是在低鈣濃度下的穩(wěn)定性,和在去污劑存在下的穩(wěn)定性,例如在去污劑中的貯存穩(wěn)定性。20.一種dna構(gòu)建體,它含有編碼根據(jù)項1至19任一項的α-淀粉酶變異體的dna序列。21.一種重組表達載體,它攜帶根據(jù)項20的dna構(gòu)建體。22.用根據(jù)項20的dna構(gòu)建體或根據(jù)項21的載體轉(zhuǎn)化的細胞。23.根據(jù)項22的細胞,它是微生物,優(yōu)選細菌或真菌,特別是革蘭氏陽性細菌,例如枯草芽孢桿菌,地衣芽孢桿菌,遲緩芽孢桿菌,短芽孢桿菌,嗜熱脂肪芽孢桿菌,嗜堿芽孢桿菌,解淀粉芽孢桿菌,凝固芽孢桿菌,環(huán)狀芽孢桿菌,燦爛芽孢桿菌或蘇蕓金芽孢桿菌。24.一種組合物,它含有項1-19的α-淀粉酶變異體。25.一種去污劑添加劑,它含有根據(jù)項1至19任一項的α-淀粉酶變異體,任選以無塵粒狀,穩(wěn)定液體或受保護酶的形式。26.根據(jù)項25的去污劑添加劑,它含有0.02-200mg酶蛋白/g添加劑。27.根據(jù)項25或26的去污劑添加劑,它還含有另一酶,例如蛋白酶,脂肪酶,過氧化物酶,甘露聚糖酶,產(chǎn)麥芽糖淀粉酶,cgtase,淀粉酶或另一淀粉分解酶,例如葡糖淀粉酶,和/或纖維素酶。28.一種去污劑組合物,它含有根據(jù)項1到19任一項的α-淀粉酶變異體。29.根據(jù)項28的去污劑組合物,它還含有另一酶,例如蛋白酶,脂肪酶,過氧化物酶,甘露聚糖酶,產(chǎn)麥芽糖淀粉酶,cgtase,另一種淀粉分解酶和/或纖維素酶。30.含有根據(jù)項1到19任一項的α-淀粉酶變異體的手工或自動餐具去污劑組合物。31.根據(jù)項30的餐具去污劑組合物,它還含有另一酶,例如蛋白酶,脂肪酶,過氧化物酶,甘露聚糖酶,產(chǎn)麥芽糖淀粉酶,cgtase,淀粉酶或另一種淀粉分解酶,例如葡糖淀粉酶,和/或纖維素酶。32.含有根據(jù)項1到19任一項的α-淀粉酶變異體的手工或自動洗衣洗滌組合物。33.根據(jù)項32的洗衣洗滌組合物,它還含有另一種酶,例如蛋白酶,脂肪酶,過氧化物酶,甘露聚糖酶,產(chǎn)麥芽糖淀粉酶,cgtase,淀粉酶或另一種淀粉分解酶,例如葡糖淀粉酶和/或纖維素酶。34.根據(jù)項1到19任一項的α-淀粉酶變異體或根據(jù)項24到34的組合物在洗滌和/或餐具中的用途。35.根據(jù)項1到19任一項的α-淀粉酶變異體或根據(jù)項24到34的組合物在紡織品脫漿中的用途。36.根據(jù)項1到19任一項的α-淀粉酶變異體或根據(jù)項24到34的組合物在淀粉液化中的用途。37.生產(chǎn)根據(jù)項1-19任一項的變異體的方法,其中在有助于生產(chǎn)該變異體的條件下培養(yǎng)根據(jù)項22至23任一項的細胞,隨后從培養(yǎng)物中回收該變異體。命名法在本說明書和權(quán)利要求書中,使用氨基酸殘基的常規(guī)單字母和3字母代碼。為了便于參照,本發(fā)明的α-淀粉酶變異體使用如下命名法描述:原始氨基酸:位置:取代氨基酸根據(jù)該命名法,例如在第30位丙氨酸取代天冬酰胺表示為:ala30asn或a30n在相同位置缺失丙氨酸表示為:ala30*或a30*插入另一氨基酸殘基,例如賴氨酸,表示為:ala30alalys或a30ak缺失連續(xù)的一段氨基酸殘基,例如氨基酸殘基30-33,表示為(30-33)*或δ(a30-n33)。如果與其它α-淀粉酶相比特定α-淀粉酶含有“缺失”且在該位置含有插入,則表示為:*36asp或*36d,表示在第36位插入天冬氨酸。多個突變用加號分開,即:ala30asn+glu34ser或a30n+e34s表示在第30位和34位分別用丙氨酸和谷氨酸取代天冬酰胺和絲氨酸的突變。當在給定位置可插入一個或多個可選擇的氨基酸殘基時,表示為:a30n,e或a30n或a30e另外,當本文鑒定了適合于修飾的位置而沒有建議任何具體的修飾時,應理解為任意氨基酸殘基都可取代該位置的氨基酸殘基。因此,例如,當提及修飾第30位的丙氨酸,但沒有指定時,應理解為該丙氨酸可缺失或用任何其它氨基酸,即r,n,d,a,c,q,e,g,h,i,l,k,m,f,p,s,t,w,y,v中的任一個取代此外,“a30x”是指下列取代中的任一個:a30r,a30n,a30d,a30c,a30q,a30e,a30g,a30h,a30i,a30l,a30k,a30m,a30f,a30p,a30s,a30t,a30w,a30y,或a30v;或簡寫為:a30r,n,d,c,q,e,g,h,i,l,k,m,f,p,s,t,w,y,v。如果用于編號的親本酶在該位置已經(jīng)具有建議取代的所述氨基酸殘基,則使用如下命名法:例如,如果野生型中存在n或v之一則表示為“x30n”或“x30n,v”。因此,這意味著其它相應的親本酶在第30位取代成“asn”或“val”。氨基酸殘基的特性帶電荷的氨基酸:asp,glu,arg,lys,his帶負電荷的氨基酸(前面為帶最大負電荷的殘基):asp,glu帶正電荷的氨基酸(前面為帶最大正電荷的殘基):arg,lys,his中性氨基酸:gly,ala,val,leu,ile,phe,tyr,trp,met,cys,asn,gln,ser,thr,pro疏水氨基酸殘基(疏水性最大的殘基在后面列出):gly,ala,val,pro,met,leu,ile,tyr,phe,trp,親水氨基酸(親水性最大的殘基在后面列出):thr,ser,cys,gln,asn附圖的簡要描述圖1是13個親本termamyl-樣α-淀粉酶的氨基酸序列的序列對比。本發(fā)明的詳細描述本發(fā)明的目的是提供多肽,例如酶,特別是α-淀粉酶,它相對于所述親本多肽至少一種下列特性改變:底物特異性,底物結(jié)合,底物裂解方式,熱穩(wěn)定性,ph/活性譜(profile),氧化穩(wěn)定性,ca2+依賴性,和特別是在衣物和盤子洗滌應用中的比活。該特性將在下文中進一步限定。多肽根據(jù)本發(fā)明的多肽包括具有生物學活性,抗微生物活性,和酶活性的蛋白質(zhì)。涉及的酶活性包括蛋白酶,淀粉酶,cgtases,甘露聚糖酶,產(chǎn)麥芽糖淀粉酶(maltogenicamylases),葡糖淀粉酶,糖酶,轉(zhuǎn)移酶,裂合酶,氧化還原酶,脂肪酶。在一個優(yōu)選的實施方案中,該酶是α-淀粉酶,特別是芽孢桿菌屬(bacillus)或曲霉屬(aspergillus)α-淀粉酶。在優(yōu)選的實施方案中,芽孢桿菌屬α-淀粉酶是termamyl-樣淀粉酶。具有生物學活性的多肽包括,epo,tpo,生長激素,調(diào)節(jié)肽,凝血因子,抗體等。sp722的三級結(jié)構(gòu)和模擬(modelling)另一termamyl-樣α-淀粉酶的三級結(jié)構(gòu)根據(jù)wo01/66712附件1所示的sp722的三級結(jié)構(gòu)發(fā)現(xiàn)了本發(fā)明的α-淀粉酶突變體。根據(jù)其它三級結(jié)構(gòu)可發(fā)現(xiàn)其它多肽的突變體。根據(jù)wo01/66712附件1公開的sp722三級結(jié)構(gòu)建立了另一堿性termamyl-樣淀粉酶,即aa560的模型。aa560α-淀粉酶與模板淀粉酶(sp722)大約87%相同且序列對比不含插入或缺失。本發(fā)明的發(fā)現(xiàn)可應用到與seqidno:12所示的termamyl-樣α-淀粉酶具有至少60%同一性,優(yōu)選至少70%同一性,更優(yōu)選80%同一性,甚至更優(yōu)選85%同一性,甚至更優(yōu)選90%同一性,甚至更優(yōu)選95%同一性,甚至更優(yōu)選97%同一性,甚至更優(yōu)選99%同一性的termamyl-樣淀粉酶上。優(yōu)選的是該發(fā)現(xiàn)可用于堿性termamyl-樣α-淀粉酶,特別是與sp722(seqidno:4,在圖1的序列對比中編號為7)相比在一級結(jié)構(gòu)的序列對比中具有相同長度而沒有添加氨基酸殘基或間隙(gaps)的堿性α-淀粉酶。具體地說,該發(fā)現(xiàn)可用于下列堿性termamyl-樣α-淀粉酶:sp690(seqidno:2),sp722(seqidno:4),aa560(seqidno:12),#707α-淀粉酶(seqidno:13),在wo97/00324中公開的ksmap1378α-淀粉酶,在wo02/10356中公開的#sp7-7α-淀粉酶,或其片斷或截短形式。后面所述的堿性α-淀粉酶在上述相互作用區(qū)周圍具有非常相似的三級晶體結(jié)構(gòu),且具有相同的一級結(jié)構(gòu)長度,即485個氨基酸。與此相反,例如,當與sp722進行序列對比時,termamyl(表示為圖1序列對比中的序列號1)缺少兩個氨基酸殘基(位置1和2);在位置174和181-182有間隙;在位置378-381有3個額外的氨基酸殘基。與sp722進行序列對比時,ban(表示為圖1序列對比中的序列號4)缺少5個氨基酸殘基(位置1-4和488);在位置174和181-182有間隙;在位置378-381有3個額外的氨基酸殘基。與sp722進行序列對比時,bsg(表示為圖1序列對比中的序列號3)缺少1個氨基酸殘基(位置1);且在位置489-519有31個額外的氨基酸殘基。與sp722進行序列對比時,ksm-k36和ksm-k38(ep1,022,334-a)缺少5個氨基酸殘基(位置1和2)且在位置174和181-182有間隙。與sp722進行序列對比時,aa180,aa20和amrk385(丹麥專利申請?zhí)杙a200000347或pct/dk01/00133)在位置261有一個額外的氨基酸。下面描述了如何從另一α-淀粉酶模擬termamyl-樣α-淀粉酶。該方法可按例如上文所述推廣(exprepolated)到其它多肽。termamyl-樣α-淀粉酶的模擬wo96/23874提供了termamyl-樣α-淀粉酶的三級結(jié)構(gòu)(3d結(jié)構(gòu)),x-射線晶體結(jié)構(gòu)數(shù)據(jù),它由解淀粉芽孢桿菌(b.amyloliquefaciens)α-淀粉酶(bantm)的300個n-末端氨基酸殘基和地衣芽孢桿菌(b.licheniformis)α-淀粉酶的c-末端氨基酸301-483組成(seqidno:8)。wo96/23874還描述了根據(jù)對親本termamyl-樣α-淀粉酶的結(jié)構(gòu)分析設計(模擬)相對于該親本表現(xiàn)出特性改變的該親本termamyl-樣α-淀粉酶的變異體的方法。根據(jù)在此作為參考文獻引用的wo96/23874可模擬其它termamyl-樣結(jié)構(gòu)。為了獲得本發(fā)明的變異體,可按實施例1所述根據(jù)sp722的三級結(jié)構(gòu)(在附件1中公開)設計(模擬)aa560的三級結(jié)構(gòu)。同樣可構(gòu)建其它termamyl-樣α-淀粉酶的結(jié)構(gòu)(例如,本文所述的那些結(jié)構(gòu))。termamyl-樣α-淀粉酶由芽孢桿菌屬菌種產(chǎn)生的許多α-淀粉酶在氨基酸水平上具有高度同源性(同一性)。許多芽孢桿菌屬α-淀粉酶的同一性可參見下表1(clustalw):表1例如,發(fā)現(xiàn)包含seqidno:8所示氨基酸序列的地衣芽孢桿菌α-淀粉酶(可作為termamyltm購買)與包含seqidno:10所示氨基酸序列的解淀粉芽孢桿菌α-淀粉酶具有大約81%的同源性且與包含seqidno:6所示氨基酸序列的嗜熱脂肪芽孢桿菌(b.stearothermophilus)α-淀粉酶有大約65%的同源性。其它同源性α-淀粉酶包括wo95/26397中公開且分別在本文中以seqidno:2和seqidno:4所示的sp690和sp722。其它淀粉酶是來自芽孢桿菌屬菌種且以seqidno:12所示的aa560α-淀粉酶,和tsukamoto等,biochemicalandbiophysicalresearchcommunications,151(1988),第25-31頁所述的來自芽孢桿菌屬菌種的#707α-淀粉酶。ksmap1378α-淀粉酶在wo97/00324(來自kaocorporation)中公開。根據(jù)本發(fā)明還包含在ep1,022,334中公開的k38和k38α-淀粉酶。其它α-淀粉酶以seqidnos:13,14,15,16,17,和18顯示。還有其它的同源性α-淀粉酶包括在ep0252666中描述的地衣芽孢桿菌菌株(atcc27811)產(chǎn)生的α-淀粉酶,和在wo91/00353和wo94/18314中鑒定的α-淀粉酶。其它商品termamyl-樣α-淀粉酶包含在以下列商品名銷售的產(chǎn)品中:optithermtm和takathermtm(來自solvay);maxamyltm(來自gist-brocades/genencor),spezymaatm和spezymedeltaaatm(來自genencor),和keistasetm(來自daiwa),purastartmst5000e,purastratmhpaml(來自genencorint.).由于在這些α-淀粉酶之間發(fā)現(xiàn)的基本同源性,因此可認為它們屬于同類α-淀粉酶,即“termamyl-樣α-淀粉酶”類型。因此,在本文中,術(shù)語“termamyl-樣α-淀粉酶”試圖表示這樣的α-淀粉酶,即,它在氨基酸水平上表現(xiàn)出與termamyltm,即,具有本文seqidno:8所示氨基酸序列的地衣芽孢桿菌α-淀粉酶具有基本同一性。換句話說,所有下列具有本文seqidnos:2,4,6,8,10,12,13,14,15,16,17,和18所示氨基酸序列的α-淀粉酶都認為是“termamyl-樣α-淀粉酶”。其它termamyl-樣α-淀粉酶是如下α-淀粉酶:i)與seqidnos:2,4,6,8,10,12,13,14,15,16,17和18所示的氨基酸序列中的至少一個顯示出至少60%,例如至少70%,例如至少75%,或至少80%,至少85%,至少90%,至少95%,至少97%,至少99%同源性和/或ii)由這樣的dna序列編碼,該dna序列與明顯來自本說明書seqidnos:1,3,5,7,9,11的編碼上述α-淀粉酶的dna序列(其編碼序列分別編碼本文seqidnos:2,4,6,8,10和12所示的氨基酸序列)雜交。應理解在本申請中還包括由1)與termamyl具有高度同源性的催化域和2)糖結(jié)合域(cbm)組成的termamyl淀粉酶。該結(jié)合域位于相對于催化域序列的n-末端或相對于催化域的c-末端,可能存在超過1個的cbm,它位于n-或c-末端或兩者都有。具有cbm的淀粉酶可來自天然來源或者是遺傳工程融合編碼淀粉酶的基因與編碼cbm的基因的結(jié)果。同源性(同一性)同源性可測定為兩個序列之間的同一性程度,它表明了第一個序列從第二個序列衍生。同源性可借助于本領域已知的計算機程序合適地測定,例如gcg程序包中提供的gap(上述)。因此,gapgcgv8可使用同一性的默認記分矩陣和下列默認參數(shù):分別用于核酸序列比較的gap產(chǎn)生罰分5.0和gap延長罰分(extensionpenalty)0.3,和分別用于蛋白質(zhì)序列比較的gap產(chǎn)生罰分3.0和gap延長罰分0.1。gap使用needleman和wunsch,(1970),j.mol.biol.48,p.443-453的方法進行序列對比并計算同一性。termamyl(seqidno:8)與例如,另一α-淀粉酶之間的結(jié)構(gòu)對比可用于鑒定在其它termamyl-樣α-淀粉酶中的相當/相應位置。獲得所述結(jié)構(gòu)對比的一個方法是使用gcg程序包的pileup程序,使用間隙罰分的默認值,即間隙產(chǎn)生罰分3.0和間隙延長罰分0.1。其它結(jié)構(gòu)對比方法包括疏水簇分析(gaboriaud等,(1987),febsletters224,第149-155頁)和反向穿線(threading)(huber,t;torda,ae,proteinsciencevol.7,no.1第142-149頁(1998))。雜交用于按照上述特性ii)鑒定多肽,例如termamyl-樣α-淀粉酶的寡核苷酸探針可根據(jù)所述α-淀粉酶的全長或部分核苷酸或氨基酸序列合適地制備。檢測雜交的合適條件包括在5xssc中預浸泡和在20%甲酰胺,5xden-hardt's溶液,50mm磷酸鈉,ph6.8,和50mg變性超聲處理小牛胸腺dna的溶液中~40℃下預雜交1小時,接著在添加了100mmatp的相同溶液中~40℃下雜交18小時,接著在2xssc,0.2%sds中在40℃下(低度嚴格),優(yōu)選在50℃下(中等嚴格),更優(yōu)選在65℃下(高度嚴格),甚至更優(yōu)選在~75℃下(極高嚴格條件)洗滌濾膜30分鐘3次。關于雜交方法的更多細節(jié)可參見sambrook等,molecular_cloning:alaboratorymanual,第二版,coldspringharbor,1989。在本文中,“來自于”不僅用于表示由所述生物菌株生產(chǎn)或可生產(chǎn)的α-淀粉酶,而且還表示由該菌株分離的dna序列編碼且在用所述dna序列轉(zhuǎn)化的宿主生物中產(chǎn)生的α-淀粉酶。最后,該術(shù)語用于表示這樣的α-淀粉酶,它由合成和/或cdna來源的dna序列編碼且具有所述α-淀粉酶的鑒定特征。該術(shù)語還用于表示該親本α-淀粉酶是天然存在的α-淀粉酶的變異體,即該變異體是對天然存在的α-淀粉酶的一個或多個氨基酸殘基進行修飾(插入,取代,缺失)的結(jié)果。親本termamyl-樣α-淀粉酶根據(jù)本發(fā)明,上述所有的termamy-樣α-淀粉酶可用作親本(即,主鏈)α-淀粉酶。在本發(fā)明優(yōu)選的實施方案中,親本α-淀粉酶來源于地衣芽孢桿菌,例如,上述之一,例如具有seqidno:10所示氨基酸序列的地衣芽孢桿菌α-淀粉酶。在一個優(yōu)選的實施方案中,親本termamyl-樣α-淀粉酶是sp722或bsg或aa560,包括sp722+r181*+g182*,sp722+d183*+g184*;sp722+d183*+g184*+n195f;sp722+d183*+g184*+m202l;sp722+d183*+g184*+n195f+m202l;sp722+d183*+g184*+r181q;sp722+d183*+g184*+r118k+n195f+r320k+r458k;bsg+i181*+g182*;bsg+i181*+g182*+n193f;bsg+i181*+g182*+m200l;bsg+i181*+g182*+n193f+m200l;aa560+d183*+g184*;aa560+d183*+g184*+n195f;aa560+d183*+g184*+m202l;aa560+d183*+g184*+n195f+m202l;aa560+d183*+g184*+r118k+n195f+r320k+r458k中任一種。“bsg+i181*+g182*+n193f”是指具有如下突變的嗜熱脂肪芽孢桿菌(b.stearothermophilus)α-淀粉酶:在位置i181和g182缺失和在位置193由asn(n)取代成phe(f)。親本雜合termamyl-樣α-淀粉酶親本α-淀粉酶(即,主鏈α-淀粉酶)也可以是雜合α-淀粉酶,即這樣的一種α-淀粉酶,它包含來自至少一種α-淀粉酶的部分氨基酸序列的組合。親本雜合α-淀粉酶可以是根據(jù)氨基酸同源性(同一性)和/或dna雜交(如上所述)測定屬于termamyl-樣α-淀粉酶家族的α-淀粉酶。在這種情況下,雜合α-淀粉酶一般由至少一部分termamyl-樣α-淀粉酶和選自微生物(細菌或真菌)和/或哺乳動物來源的termamyl-樣α-淀粉酶或非-termamyl-樣α-淀粉酶的一種或多種其它α-淀粉酶的部分組成。因此,親本雜合α-淀粉酶可包含來自至少兩種termamyl-樣α-淀粉酶,或來自至少一種termamyl-樣和至少一種非-termamyl-樣細菌α-淀粉酶,或來自至少一種termamyl-樣和至少一種真菌α-淀粉酶的部分氨基酸序列的組合。提供部分氨基酸序列的該termamyl-樣α-淀粉酶可以是任何本文提及的特異性termamyl-樣α-淀粉酶。例如,親本α-淀粉酶可包含來源于地衣芽孢桿菌菌株的α-淀粉酶的c-末端部分,和來源于解淀粉芽孢桿菌菌株或來源于嗜熱脂肪芽孢桿菌菌株的α-淀粉酶的n-末端部分。例如,親本α-淀粉酶可包含地衣芽孢桿菌α-淀粉酶的c-末端部分的至少430個氨基酸殘基,且例如,可包含a)相應于具有seqidno:10所示氨基酸序列的解淀粉芽孢桿菌α-淀粉酶的37個n-末端氨基酸殘基的氨基酸片斷和相應于具有seqidno:8所示氨基酸序列的地衣芽孢桿菌α-淀粉酶的445個c-末端氨基酸殘基的氨基酸片斷,或除了n-末端35個氨基酸殘基(成熟蛋白質(zhì)中)被ban(成熟蛋白質(zhì)),即,seqidno:10所示的解淀粉芽孢桿菌α-淀粉酶的n-末端33個殘基取代外,與termamyl序列,即,seqidno:8所示的bacilluslicheniformisα-淀粉酶相同的雜合termamyl-樣α-淀粉酶;或b)相應于具有seqidno:6所示氨基酸序列的嗜熱脂肪芽孢桿菌α-淀粉酶的68個n-末端氨基酸殘基的氨基酸片斷和相應于具有seqidno:8所示氨基酸序列的地衣芽孢桿菌α-淀粉酶的415個c-末端氨基酸殘基的氨基酸片斷。另一合適的親本雜合α-淀粉酶是由ban,解淀粉芽孢桿菌α-淀粉酶n-末端(成熟蛋白質(zhì)的氨基酸1-300)和termamyl的c-末端(成熟蛋白質(zhì)的氨基酸301-483)組成的以前在wo96/23874(來自novonordisk)中描述的α-淀粉酶。另一合適的親本雜合α-淀粉酶由seqidnos:2,4,6,8,10,12,13,14,15,16,17,或18的序列,和seqidno:13(amy1048)的最后99個氨基酸組成。在本發(fā)明的一個優(yōu)選的實施方案中,親本termamyl-樣α-淀粉酶是seqidno:8和seqidno:10的雜合α-淀粉酶。具體地說,親本雜合termamyl-樣α-淀粉酶可以是包含seqidno:8所示的地衣芽孢桿菌α-淀粉酶的445個c-末端氨基酸殘基和seqidno:10所示的來源于解淀粉芽孢桿菌α-淀粉酶的33個n-末端氨基酸殘基的雜合α-淀粉酶,它還可合適地具有下列突變:h156y+a181t+n190f+a209v+q264s(使用seqidno:8中的編號)。后一提及的雜合體用于下面的實施例且稱為le174。其它具體涉及的親本α-淀粉酶包括具有少數(shù)突變的le174,即,具有下列突變的剛才上文提及的雜合體:a181t+n190f+a209v+q264s;n190f+a209v+q264s;a209v+q264s;q264s;h156y+n190f+a209v+q264s;h156y+a209v+q264s;h156y+q264s;h156y+a181t+a209v+q264s;h156y+a181t+q264s;h156y+q264s;h156y+a181t+n190f+q264s;h156y+a181t+n190f;h156y+a181t+n190f+a209v。這些雜合體也認為是本發(fā)明的部分。在一個優(yōu)選的實施方案中,親本termamyl-樣α-淀粉酶是le174,包括le174+g48a+t49i+g107a+i201f;le174+m197l;或le174+g48a+t49i+g107a+m197l+i201f中任一個。其它涉及的親本α-淀粉酶包括le429,它是具有另一取代i201f的le174。根據(jù)本發(fā)明,le335是α-淀粉酶,它與le429相比,具有另外的取代t49i+g107a;le399是le335+g48a,即,具有g(shù)48a+t49i+g107a+i201f的le174。構(gòu)建本發(fā)明的變異體構(gòu)建感興趣的變異體可通過在有助于產(chǎn)生該變異體的條件下培養(yǎng)包含編碼該變異體的dna序列的微生物來實現(xiàn)。然后可從所得的培養(yǎng)液中回收該變異體。這點在下面進行詳細地描述。改變的特性下面討論存在于本發(fā)明變異體中的突變與可能由其引起的所需特性改變(相對于親本termamyl-樣α-淀粉酶)之間的關系。如上所述,本發(fā)明涉及特別是在高溫和/或低ph,特別是在低鈣濃度下具有改變特性的termamyl-樣α-淀粉酶。在本發(fā)明上下文中,“高溫”是指從70-120℃的溫度,優(yōu)選80-100℃,特別是85-95℃。在本發(fā)明上下文中,術(shù)語“低ph”是指從4-6范圍內(nèi)的ph,優(yōu)選4.2-5.5,特別是4.5-5。在本發(fā)明上下文中,術(shù)語“高ph”是指從8-11范圍內(nèi)的ph,特別是8.5-10.6。在本發(fā)明上下文中,術(shù)語“低鈣濃度”是指低于60ppm的游離鈣水平,優(yōu)選40ppm,更優(yōu)選25ppm,特別是5ppm鈣。與具體涉及的改變特性相聯(lián)系的具體涉及的親本termamyl-樣α-淀粉酶是上述親本termamyl-樣α-淀粉酶和親本雜合termamyl-樣α-淀粉酶。sp722α-淀粉酶用作起點,但在例如,termamyl,bsg,ban,aa560,sp690,aa180,ksmap1378,sp7-7和#707,k38,和k36的相應位置應理解為也被公開。設計改進氧化穩(wěn)定性的淀粉酶變異體:已表明seqidno:8中的m197或seqidno:12中相當?shù)膍202在漂白劑,例如,洗滌劑中的過硼酸鹽等存在的條件下增加穩(wěn)定性。另外seqidno:8中的m15突變也顯示出相同效果,但是對于seqidno:2,4,6,10,和12和在相當于m15位置沒有相應甲硫氨酸的其它淀粉酶,發(fā)現(xiàn)其它殘基,特別是其它甲硫氨酸增加的穩(wěn)定性超過對于m202所觀察到的情況。這些殘基包括但不限于seqidno:12,17,和18中的m9,m10,m105,m116(在sp690,sp722,amrk385中不存在)m202,m208,m261,m309,m323(僅存在于aa560,sp722中),m382,m410(sp.7-7),m430,m440,而在seqidno:16(aai-10)中,最感興趣的位置是:m10,m105,m202,m208,m246,m286,m309,m430,m440,m454,在seqidno:14(amrk385)中最感興趣的位置是:m9,m10,m105,m202,m208,m262,m310,m383,m431,m441,在seqidno:15(k38)中最感興趣的位置是:m7,m8,m103,m107,m277,m281,m304,m318,m380,m425,m435。最優(yōu)選的取代是:m9l,i,m10l,m105l,i,f,m116n,d,l,i,f,w,r,k,m202l,i,t,v,m208f,y,l,i,m261l,i,m309l,i,m323l,i,s,t,a,q,e,n,d,m382l,i,y,f,k,m410l,i,v,m430l,i,m440l,i,f,y。如上所述,在漂白劑存在的條件下m202顯示出對于穩(wěn)定性是重要的。然而將m202突變成對于穩(wěn)定性優(yōu)選的取代時,降低該淀粉酶的活性。為了再活化該淀粉酶,已表明沿推定的底物結(jié)合裂口進行的取代對該活性有益。它們包括:t193,k269,n270,l272,y295,n296,n299,s303,y304,q311,n314,g315,q319,和a339等。優(yōu)選的突變是:t193s,n,d,e,q,k269s,q,n270f,y,d,l272i,v,a,y295f,n,d,q,e,n296k,q,e,n299f,y,q,t,s303q,k,y304f,r,k,q311n,q,k,r,t,s,y,f,n314d,s,t,q,g315n,s,t,q319e,k,s,t,a339s,t。洗滌應用的最佳酶為能最佳工作必須滿足幾個標準。它在使用前在洗滌劑基質(zhì)中應當穩(wěn)定,它在洗滌期間應當穩(wěn)定且它在洗滌期間應當有高度活性。已報道了優(yōu)化各標準的幾個例子,但是由于氧化穩(wěn)定性淀粉酶活性低且有活性的淀粉酶穩(wěn)定性差,因此,本發(fā)明的范圍是鑒定滿足所有三個要求的最佳取代組合。優(yōu)選的組合是:m9l+m202im9l+m202i+m323tm9l+m202i+m323t+m382ym202i+y295fm202i+a339sm9l+m202i+y295f+a339sm9l+m202i+y295fm9l+m202i+a339sm9l+m202i+y295f+a339sm9l+m202i+y295f+a339s+e345rm9l+g149a+m202i+y295f+a339s+e345rm9l+m202lm9l+m202l+m323tm9l+m202l+m323t+m382ym202l+y295fm202l+a339sm9l+m202l+y295f+a339sm9l+m202l+y295fm9l+m202l+a339sm9l+m202l+y295f+a339sm9l+m202l+y295f+a339s+e345rm9l+g149a+m202l+y295f+a339s+e345rm9l+m202tm9l+m202t+m323tm9l+m202t+m323t+m382ym202t+y295fm202t+a339sm9l+m202t+y295f+a339sm9l+m202t+y295fm9l+m202t+a339sm9l+m202t+y295f+a339sm9l+m202t+y295f+a339s+e345rm9l+g149a+m202t+y295f+a339s+e345rm9l+g149a+m202i+v214t+y295f+n299y+m323t+a339s+e345rm9l+g149a+m202l+v214i+y295f+m323t+a339s+e345r+m382ym9l+g149a+g182t+g186a+m202i+v214i+y295f+n299y+m323t+a339sm9l+g149a+g182t+g186a+m202l+t257i+y295f+n299y+m323t+a339s+e345rm9l+g149a+m202l+v214t+y295f+n299y+m323t+a339s+e345rm9l+g149a+m202i+v214i+y295f+m323t+a339s+e345r+m382ym9l+g149a+g182t+g186a+m202l+v214i+y295f+n299y+m323t+a339sm9l+g149a+g182t+g186a+m202i+t257i+y295f+n299y+m323t+a339s+e345rm9l+g149a+m202i+v214t+y295f+n299y+m323t+a339s+e345r+n471em9l+g149a+m202l+v214i+y295f+m323t+a339s+e345r+m382y+n471em9l+g149a+g182t+g186a+m202i+v214i+y295f+n299y+m323t+a339s+n471em9l+g149a+g182t+g186a+m202l+t257i+y295f+n299y+m323t+a339s+e345r+n471e在第一個方面,親本termamyl-樣α-淀粉酶的變異體包含在選自如下組中一個或多個位置有改變:26,30,33,82,37,106,118,128,133,149,150,160,178,182,186,193,203,214,231,256,257,258,269,270,272,283,295,296,298,299,303,304,305,311,314,315,318,319,339,345,361,378,383,419,421,437,441,444,445,446,447,450,461,471,482,484,其中(a)改變是獨立地(i)在占據(jù)該位置的氨基酸下游插入一個氨基酸,(ii)缺失占據(jù)該位置的氨基酸,或(iii)用不同的氨基酸取代占據(jù)該位置的氨基酸,(b)該變異體具有α-淀粉酶活性,和(c)各位置相應于具有親本termamyl-樣α-淀粉酶的氨基酸序列的親本α-淀粉酶的氨基酸序列位置,該親本termamyl-樣α-淀粉酶具有seqidno:12所示的aa560的氨基酸序列。在優(yōu)選的實施方案中,本發(fā)明的變異體(使用seqidno:12的編號)具有一個或多個下列突變/取代:r26s,d30n,n33d,r82h,k37t,n106d,k118q,n128y,g133e,a,g149a,n,n150h,q,y160f,y178f,g182t,g186a,t193s,n,d,e,q,y203l,v214i,t,d231n,g256k,t257i,g258d,k269s,q,n270f,y,d,l272i,v,a,n283d,y295f,n,d,q,e,n296k,q,e,y298f,h,n299f,y,q,t,s303q,k,y304f,r,k,g305d,q311n,q,k,r,t,s,y,f,n314d,s,t,q,g315n,s,t,v318l,q319e,k,s,t,a339s,t,e345n,r,q361e,g378k,k383r,t419n,h421y,n437h,f441l,r444e,y,n445q,k446r,a447y,v450t,t461p,n471e,w482y,n484q。使用seqidno:12作為編號基礎,優(yōu)選的雙重,三重和多重突變包括:m9l+m202i,m9l+m202i+m323t,m9l+m202i+323t+m382y,m9l+m202i+y295f+a339s,m9l+m202i+y295f,m9l+m202i+a339s,m9l+m202i+y295f+a339s,m9l+m202i+y295f+a339s+e345r,m9l+g149a+m202i+y295f+a339s+e345r,m9l+m202l,m9l+m202l+m323t,m9l+m202l+m232t+m382y,m9l+m202l+y295f+a339s,m9l+m202l+y295f,m9l+m202l+a339s,m9l+m202l+y295f+a339s,m9l+m202l+y295f+a339s,e345r,m9l+g149a+m202l+y295f+a339s+e345r,m9l+m202t,m9l+m202t+m323t,m9l+m202t+m323t+m382y,m9l+m202t+y295f+a339s,m9l+m202t+y295f,m9l+m202t+a339s,m9l+m202t+y295f+a339s,m9l+m202t+y295f+a339s+e345r,m9l+g149a+m202t+y295f+a339s+e345r,m9l+g149a+m202i+v214t+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202l+v214i+y295f+m323t+a339s+e345r+m382y,m9l+g149a+g182t+g186a+m202i+v214i+y295f+n299y+m323t+a339s,m9l+g149a+g182t+g186a+m202l+t257i+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202l+v214t+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202i+v214i+y295f+m323t+a339s+e345r+m382y,m9l+g149a+g182t+g186a+m202l+v214i+y295f+n299y+m323t+a339s,m9l+g149a+g182t+g186a+m202i+t257i+y295f+n299y+m323t+a339s+e345r,m9l+g149a+m202i+v214t+y295f+n299y+m323t+a339s+e345r+n471e,m9l+g149a+m202l+v214i+y295f+m323t+a339s+e345r+m382y+n471e,m9l+g149a+g182t+g186a+m202i+v214i+y295f+n299y+m323t+a339s+n471e,m9l+g149a+g182t+g186a+m202l+t257i+y295f+n299y+m323t+a339s+e345r+n471e,m202l+m105f+m208f,g133e+m202l+q361e,g133e+m202l+r444e,m202l+y295f,m202l+a339s,m202l+m323t,m202l+m323t+m309l,m202l+m323t+m430i,m202l+v214t+r444y,m202l+n283d+q361e,m202l+m382y+k383r,m202l+k446r+n484q,m202i+y295f,m202i+a339s,m202i+m105f+m208f,g133e+m202i+q361e,g133e+m202i+r444e,m202i+m202i+m323t,m202i+m202i+m323t+m309l,m202i+m323t+m430i,m202i+v214t+r444y,m202i+n283d+q361e,m202i+m382y+k383r,m202i+k446r+n484q,m202v+m105f+m208f,g133e+m202v+q361e,g133e+m202v+r444e,m202v+m323t,m202v+m323t+m309l,m202v+m323t+m430i,m202v+m323t+m9l,m202v+v214t+r444y,m202v+n283d+q361e,m202v+m382y+k383r,m202v+k446r+n484q,m202t+m105f+m208f,g133e+m202t+q361e,g133e+m202t+r444e,m202t+y295f,m202t+a339s,m202t+m323t,m202t+m323t+m309l,m202t+m323t+m430i,m202t+m323t+m9l,m202t+v214t+r444y,m202t+n283d+q361e,m202t+a339s,m202t+y295fm202t+n299f,y,m202t+m382y+k383r,m202t+k446r+n484q穩(wěn)定性在本發(fā)明上下文中,對于實現(xiàn)改變的穩(wěn)定性,特別是改良的穩(wěn)定性(即,更高或更低),特別是在高溫(即,70-120℃)和/或極端ph(即,低或高ph,即分別為ph4-6或ph8-11下),特別是在低于60ppm的游離(即,未結(jié)合,因此在溶液中)鈣濃度下改良的穩(wěn)定性重要的突變(包括氨基酸取代和缺失)包括“改變的特性”部分所列的任何突變。該穩(wěn)定性可按下面“材料和方法”部分所述來測定。ca2+穩(wěn)定性改變的ca2+穩(wěn)定性是指在ca2+排除(depletion)的條件下酶穩(wěn)定性改良,即穩(wěn)定性更高或更低。在本發(fā)明上下文中,對于實現(xiàn)改變的ca2+穩(wěn)定性,特別是改良的ca2+穩(wěn)定性,即,更高或更低的穩(wěn)定性,特別是在高ph(即,ph8-10.5)下改良的ca2+穩(wěn)定性重要的突變(包括氨基酸取代和缺失)包括“改變的特性”部分所列的任何突變。比活在本發(fā)明的另一方面,對于獲得表現(xiàn)出改變的比活(specificactivity),特別是增加或降低比活,特別是在從10-60℃,優(yōu)選在20-50℃,特別是在30-40℃下改變的比活的變異體重要的突變(包括氨基酸取代和缺失)包括“改變的特性”部分所列的任何突變。該比活可按下面“材料和方法”部分所述來測定。氧化穩(wěn)定性本發(fā)明的變異體可具有改變的氧化穩(wěn)定性,特別是與親本α-淀粉酶相比更高的氧化穩(wěn)定性。增強的氧化穩(wěn)定性在例如,洗滌劑組合物中具有優(yōu)勢而降低的氧化穩(wěn)定性在淀粉液化組合物中具有優(yōu)勢。氧化穩(wěn)定性可按下面“材料和方法”部分所述來測定。改變的ph活性譜對于獲得具有改變的ph活性譜(profile),特別是在高ph(即,ph8-10.5)或低ph(即,ph4-6)下活性提高的變異體重要的位置和突變包括位于靠近活性位點殘基的氨基酸殘基的突變。優(yōu)選的特異性突變/取代是對所述位置進行在上面“改變的特性”部分所列的突變/取代。合適的測定法在下面“材料和方法”部分描述。洗滌效果對于獲得特別是在中性到高ph,即,ph6-11,優(yōu)選ph8.5-11下具有改進的洗滌效果的變異體重要的位置和突變包括在所述位置進行的上文“改變的特性”部分所列的具體突變/取代。洗滌效果可按下面“材料和方法”部分所述檢測。制備本發(fā)明的α-淀粉酶變異體的方法將突變導入基因的一些方法是本領域已知的。在簡要討論編碼α-淀粉酶的dna序列的克隆后,將討論在α-淀粉酶編碼序列內(nèi)特定位點產(chǎn)生突變的方法。克隆編碼α-淀粉酶的dna序列編碼親本α-淀粉酶的dna序列可使用本領域熟知的各種方法從產(chǎn)生所述α-淀粉酶的任何細胞或微生物中分離。首先,使用來自產(chǎn)生所需研究的α-淀粉酶的生物的染色體dna或信使rna構(gòu)建基因組dna和/或cdna文庫。然后,如果已知該α-淀粉酶的氨基酸序列,可合成同源的標記寡核苷酸探針并用于從所述生物制備的基因組文庫中鑒定編碼α-淀粉酶的克隆。另外,含有與已知α-淀粉酶基因同源的序列的標記寡核苷酸探針可用作探針以便使用低度嚴格的雜交和洗滌條件鑒定編碼α-淀粉酶的克隆。鑒定編碼α-淀粉酶的克隆的另一方法包括將基因組dna片斷插入表達載體,例如質(zhì)粒中,用所得的基因組dna文庫轉(zhuǎn)化α-淀粉酶陰性細菌,然后將轉(zhuǎn)化的細菌涂布到含有α-淀粉酶底物的瓊脂上,從而允許鑒定表達α-淀粉酶的克隆。作為選擇,可用已建立的標準方法,例如,s.l.beaucage和m.h.caruthers,tetrahedronletters22,1981,第1859-1869頁所述的亞磷酸胺方法或matthes等,theemboj.3,1984,第801-805頁所述的方法通過合成制備編碼該酶的dna序列。在亞磷酸胺方法中,在例如,自動dna合成儀上合成寡核苷酸,純化,退火,連接并在合適的載體中克隆。最后,該dna序列可以是混合的基因組和合成來源,混合的合成和cdna來源或混合的基因組和cdna來源,按照標準技術(shù)通過連接合成的,基因組或cdna來源的片斷(視情況,該片斷相應于完整dna序列的各個部分)制備。該dna序列也可通過聚合酶鏈式反應(pcr)使用特異性引物來制備,例如按us4,683,202或r.k.saiki等,science239,1988,第487-491頁所述。定點誘變一旦分離了編碼α-淀粉酶的dna序列,鑒定了突變所需的位點,可使用合成寡核苷酸導入突變。這些寡核苷酸含有所需突變位點側(cè)翼的核苷酸序列;在寡核苷酸合成期間插入突變核苷酸。在一個具體方法中,在攜帶α-淀粉酶基因的載體中產(chǎn)生橋接編碼α-淀粉酶序列的dna單鏈缺口。然后將攜帶所需突變的合成核苷酸與單鏈dna的同源部分退火。然后用dna聚合酶i(klenow片斷)填充剩下的缺口并使用t4連接酶連接該構(gòu)建體。該方法的具體實施例在morinaga等,(1984)中描述。us4,760,025公開了通過對序列盒進行較小改變導入編碼多個突變的寡核苷酸。然而,通過morinaga方法可在任何時間導入甚至更大數(shù)目的各種突變,因為可導入各種長度的多個寡核苷酸。將突變導入編碼α-淀粉酶的dna序列中的另一方法在nelson和long(1989)中描述。它包含通過使用化學合成的dna鏈作為pcr反應的一個引物導入含有所需突變的pcr片斷的3-步生產(chǎn)法。通過用限制性內(nèi)切核酸酶裂解并再插入表達質(zhì)粒中可從pcr-產(chǎn)生的片斷中分離攜帶該突變的dna片斷。提供本發(fā)明的變異體的另一方法包括基因改組,例如在wo95/22625(affymaxtechnologiesn.v.)或wo96/00343(novonordiska/s)中所述,或產(chǎn)生包含所述突變,例如,取代和/或缺失的雜合酶的其它相應技術(shù)。隨機誘變隨機誘變適合于作為定位(localised)或區(qū)域特異性隨機誘變在翻譯成所示氨基酸序列的所述基因的至少三個部分中,或在整個基因內(nèi)進行。對編碼親本α-淀粉酶的dna序列的隨機誘變可通過使用本領域已知的任何方法按常規(guī)進行。與上述內(nèi)容相關,本發(fā)明的另一方面涉及產(chǎn)生親本α-淀粉酶變異體的方法,例如,其中該變異體表現(xiàn)出在靠近分支點裂解寡糖底物的能力降低,且還表現(xiàn)出相對于親本底物特異性提高和/或比活提高,該方法為:(a)對編碼親本α-淀粉酶的dna序列進行隨機誘變,(b)在宿主細胞中表達步驟(a)獲得的突變dna序列,和(c)篩選表達相對于親本α-淀粉酶具有改變特性(即,熱穩(wěn)定性)的α-淀粉酶變異體的宿主細胞。本發(fā)明上述方法的步驟(a)優(yōu)選使用摻雜(doped)引物進行。例如,隨機誘變可通過使用合適的物理或化學誘變劑,通過使用合適的寡核苷酸,或者通過對dna序列進行pcr產(chǎn)生的誘變來進行。另外,隨機誘變可通過使用這些誘變劑的任意組合進行。誘變劑可以是,例如,誘導轉(zhuǎn)換,易位,倒位,拼湊,缺失和/或插入的試劑。適合于該目的的物理或化學誘變劑的例子包括紫外(uv)輻射,羥胺,n-甲基-n'-硝基-n-亞硝基胍(mnng),o-甲基羥胺,亞硝酸,乙基甲磺酸(ems),亞硫酸氫鈉,甲酸,和核苷酸類似物。當使用該試劑時,一般通過在適合于發(fā)生誘變的條件下在選定誘變劑存在下溫育待誘變的編碼親本酶的dna序列并選擇具有所需特性的突變dna來進行誘變。當使用寡核苷酸進行誘變時,可在寡核苷酸合成期間在需改變的位置用三個非親本核苷酸摻雜或鍥入(spiked)該寡核苷酸。進行摻雜或鍥入使得可以避免不需要的氨基酸密碼子。摻雜或鍥入的寡核苷酸可通過任何公開的技術(shù),使用例如,pcr,lcr或認為合適的任何dna聚合酶和連接酶摻入編碼α-淀粉酶的dna中。優(yōu)選的是,摻雜使用“固定隨機摻雜”進行,其中預先確定各位置中野生型和突變的百分數(shù)。另外,摻雜可定向優(yōu)先導入某些核苷酸,從而優(yōu)先導入一個或多個特定氨基酸殘基。可進行摻雜以便例如,允許在各位置導入90%野生型和10%的突變。選擇摻雜方案的另一考慮是以遺傳和蛋白質(zhì)結(jié)構(gòu)約束為基礎。摻雜方案可通過使用dope程序進行,該程序特別是確保避免導入終止密碼子。當使用pcr-產(chǎn)生的誘變時,在增加核苷酸錯誤摻入的條件下對化學處理或未處理的編碼親本α-淀粉酶的基因進行pcr(deshler1992;leung等,technique,vol.1,1989,第11-15頁)。大腸桿菌的增變株(fowler等,molec.gen.genet.,133,1974,第179-191頁),啤酒糖酵母(s.cereviseae)或任何其它微生物可用于隨機誘變編碼α-淀粉酶的dna,通過例如,將含有親本糖基化酶的質(zhì)粒轉(zhuǎn)化進增變株,繁殖含有該質(zhì)粒的增變株和從該增變株分離突變的質(zhì)粒。隨后可將突變質(zhì)粒轉(zhuǎn)化進表達生物中。待誘變的dna序列可方便地存在于從表達親本α-淀粉酶的生物制備的基因組或cdna文庫中。另外,該dna序列可存在于諸如質(zhì)粒或噬菌體的合適載體中,這樣用誘變劑溫育或與其接觸。待誘變的dna也可通過整合在所述細胞的基因組中或者存在于該細胞攜帶的載體中而存在于宿主細胞中。最后,待誘變的dna可以是分離的形式,應明白進行隨機誘變的dna序列優(yōu)選是cdna或基因組dna序列。在某些情況下,在進行表達步驟b)或篩選步驟c)之前擴增突變的dna序列是合適的。該擴增可按照本領域已知的方法進行,目前優(yōu)選的方法是使用根據(jù)親本酶的dna或氨基酸序列制備的寡核苷酸引物的pcr產(chǎn)生的擴增。用誘變劑溫育或與其接觸后,通過在允許發(fā)生表達的條件下培養(yǎng)攜帶該dna序列的合適宿主細胞可表達突變的dna。用于該目的的宿主細胞是用任選存在于載體中的突變dna序列轉(zhuǎn)化的細胞,或在誘變處理期間攜帶編碼親本酶的dna序列的細胞。合適宿主細胞的例子如下:革蘭氏陽性細菌,例如枯草芽孢桿菌,地衣芽孢桿菌(bacilluslicheniformis),遲緩芽孢桿菌(bacilluslentus),短芽孢桿菌(bacillusbrevis),嗜熱脂肪芽孢桿菌(bacillusstearothermophilus),嗜堿芽孢桿菌(bacillusalkalophilus),解淀粉芽孢桿菌(bacillusamyloliquefaciens),凝固芽孢桿菌(bacilluscoagulans),環(huán)狀芽孢桿菌(bacilluscirculans),燦爛芽孢桿菌(bacilluslautus),巨大芽孢桿菌(bacillusmegaterium),蘇蕓金芽孢桿菌(bacillusthuringiensis),streptomyceslividans或streptomycesmurinus;和革蘭氏陰性細菌,例如大腸桿菌。突變的dna序列還可包含編碼允許表達突變的dna序列的功能的dna序列。定位(localised)隨機誘變可將隨機誘變有利地定位于所述親本α-淀粉酶的一部分上。例如,當該酶的某些區(qū)域被鑒定為對于該酶的給定特性特別重要且當修飾時預期將產(chǎn)生具有改良特性的變異體時這是有利的。當親本酶的三級結(jié)構(gòu)被闡明且與該酶的功能相關聯(lián)時一般可鑒定該區(qū)域。通過使用上述pcr產(chǎn)生的誘變技術(shù)或本領域已知的任何其它合適的技術(shù)可方便地進行定位的,或區(qū)域特異性的隨機誘變。作為選擇,通過例如,插入合適的載體中可分離編碼待修飾的部分dna序列的dna序列,且通過使用任何上述誘變方法隨后對所述的部分進行誘變。提供α-淀粉酶變異體的另一方法提供本發(fā)明的變異體的另一方法包括本領域已知的基因改組方法,包括例如在wo95/22625(affymaxtechnologiesn.v.)和wo96/00343(novonordiska/s)中所述的方法。表達α-淀粉酶變異體根據(jù)本發(fā)明,通過上述方法,或者通過本領域已知的任何可供選擇的方法產(chǎn)生的編碼變異體的dna可使用一般包括編碼啟動子,操縱子,核糖體結(jié)合位點,翻譯起始信號,和任選阻遏基因或各種激活基因的調(diào)控序列的表達載體以酶的形式表達。攜帶編碼本發(fā)明的α-淀粉酶變異體的dna序列的重組表達載體可以是可方便地對其進行重組dna操作的任何載體,且載體的選擇通常依賴于它將要導入的宿主細胞。因此,該載體可以是自主復制載體,即,作為染色體外實體存在,其復制獨立于染色體復制的載體,例如,質(zhì)粒,噬菌體或染色體外元件,微型染色體或人工染色體。作為選擇,該載體可以是導入宿主細胞時整合進宿主細胞基因組并與整合進的染色體一起復制的載體。在載體中,該dna序列應與合適的啟動子序列可操作地連接。該啟動子可以是在選定的宿主細胞中表現(xiàn)出轉(zhuǎn)錄活性的任何dna序列且可來自于與該宿主細胞同源或異源的編碼蛋白質(zhì)的基因。指導編碼本發(fā)明的α-淀粉酶變異體的dna序列在特別是細菌宿主中轉(zhuǎn)錄的合適啟動子的例子是大腸桿菌lac操縱子的啟動子,天藍色鏈霉菌(streptomycescoelicolor)瓊脂糖酶基因daga啟動子,地衣芽孢桿菌α-淀粉酶基因(amyl)的啟動子,嗜熱脂肪芽孢桿菌產(chǎn)麥芽糖淀粉酶基因(amym)的啟動子,解淀粉芽孢桿菌α-淀粉酶(amyq)的啟動子,枯草芽孢桿菌xyla和xylb基因的啟動子等。為了在真菌宿主中轉(zhuǎn)錄,有用的啟動子的例子是來自編碼米曲霉taka淀粉酶,rhizomucormiehei天冬氨酸蛋白酶,黑曲霉中性α-淀粉酶,黑曲霉酸穩(wěn)定性α-淀粉酶,黑曲霉葡糖淀粉酶,rhizomucormiehei脂肪酶,米曲霉堿性蛋白酶,米曲霉丙糖磷酸異構(gòu)酶或構(gòu)巢曲霉(a.nidulans)乙酰胺酶的基因的那些啟動子。本發(fā)明的表達載體也可包含與編碼本發(fā)明的α-淀粉酶變異體的dna序列可操作地連接的合適的轉(zhuǎn)錄終止子和在真核細胞中的多聚腺苷化序列。終止和多聚腺苷化序列可合適地來源于與啟動子相同的來源。該載體還可包含使得該載體能夠在所述宿主細胞中復制的dna序列。該序列的例子是質(zhì)粒puc19,pacyc177,pub110,pe194,pamb1和pij702的復制起點。該載體也可包含選擇性標記,例如,其產(chǎn)物彌補宿主細胞缺陷的基因,例如,枯草芽孢桿菌或地衣芽孢桿菌的dal基因,或賦予抗生素抗性,例如氨芐青霉素,卡那霉素,氯霉素或四環(huán)素抗性的基因。另外,該載體可包含曲霉屬選擇標記,例如amds,argb,niad和sc,產(chǎn)生潮霉素抗性的標記,或該選擇可通過共轉(zhuǎn)化實現(xiàn),例如在wo91/17243中所述。盡管細胞內(nèi)表達在某些方面,例如,當使用某些細菌作為宿主細胞時具有優(yōu)勢,但是一般優(yōu)選在細胞外表達。一般來說,本文提及的芽孢桿菌屬α-淀粉酶包含允許表達的蛋白酶分泌進培養(yǎng)基的前肽區(qū)(preregion)。如果需要,該前肽區(qū)可用不同前肽區(qū)或信號序列取代,它可通過取代編碼各前肽區(qū)的dna序列按常規(guī)完成。用于分別連接編碼α-淀粉酶變異體,啟動子,終止子和其它元件的本發(fā)明的dna構(gòu)建體,并將它們插入含有復制必需信息的合適載體的方法是本領域的技術(shù)人員熟知的(參見,例如,sambrook等,molecularcloning:alaboratorymanual,第二版,coldspringharbor,1989)。包含上述本發(fā)明的dna構(gòu)建體或表達載體的本發(fā)明的細胞用作重組生產(chǎn)本發(fā)明的α-淀粉酶變異體的宿主細胞是有利的。可通過將該dna構(gòu)建體(一個或多個拷貝)方便地整合進宿主染色體中用編碼變異體的本發(fā)明的dna構(gòu)建體轉(zhuǎn)化該細胞。一般認為該整合是具有優(yōu)勢的,因為該dna序列在細胞中穩(wěn)定維持的可能性更大。將dna構(gòu)建體整合進宿主染色體可按照常規(guī)方法進行,例如,通過同源或異源重組。作為選擇,該細胞可用與不同類型的宿主細胞相聯(lián)系的上述表達載體轉(zhuǎn)化。本發(fā)明的細胞可以是高等生物的細胞,例如哺乳動物或昆蟲,但是優(yōu)選微生物細胞,例如細菌或真菌(包括酵母)細胞。合適的細菌的例子是革蘭氏陽性細菌,例如枯草芽孢桿菌,地衣芽孢桿菌,遲緩芽孢桿菌,短芽孢桿菌,嗜熱脂肪芽孢桿菌,嗜堿芽孢桿菌,解淀粉芽孢桿菌,凝固芽孢桿菌,環(huán)狀芽孢桿菌,燦爛芽孢桿菌,巨大芽孢桿菌,蘇蕓金芽孢桿菌,或streptomyceslividans或streptomycesmurinus,或革蘭氏陰性細菌,例如大腸桿菌。細菌的轉(zhuǎn)化可通過例如,原生質(zhì)體轉(zhuǎn)化或通過使用感受態(tài)細胞以本身已知的方式實現(xiàn)。酵母生物合適地選自糖酵母屬(saccharomyces)或裂殖糖酵母屬(schizosaccharomyces)的菌種,例如啤酒糖酵母(saccharomycescerevisiae)。有利的絲狀真菌屬于曲霉屬的菌種,例如米曲霉或黑曲霉。真菌細胞可通過包含原生質(zhì)體形成和原生質(zhì)體轉(zhuǎn)化的方法進行轉(zhuǎn)化,接著以本身已知的方式再生細胞壁。轉(zhuǎn)化曲霉屬宿主細胞的合適方法在ep238023中描述。在另一方面,本發(fā)明涉及產(chǎn)生本發(fā)明的α-淀粉酶變異體的方法,該方法包括在有助于生產(chǎn)該變異體的條件下培養(yǎng)上述宿主細胞并從細胞和/或培養(yǎng)基中回收該變異體。用于培養(yǎng)該細胞的培養(yǎng)基可以是適合于所述宿主細胞生長并獲得本發(fā)明的α-淀粉酶變異體表達的任何常規(guī)培養(yǎng)基。合適的培養(yǎng)基可從供應商獲得或者可按照公開的配方(例如,在美國典型培養(yǎng)物保藏中心的產(chǎn)品目錄中所述)制備。從宿主細胞分泌的α-淀粉酶變異體可按常規(guī)通過熟知的方法從培養(yǎng)基中回收,包括通過離心或過濾分離細胞與培養(yǎng)基,借助于諸如硫酸銨的鹽沉淀培養(yǎng)基中的蛋白質(zhì)成份,接著使用色譜法,例如離子交換色譜法,親和色譜法,或類似方法。工業(yè)應用本發(fā)明的α-淀粉酶變異體具有允許各種工業(yè)應用的寶貴特性。具體地說,本發(fā)明的酶變異體適用于用作洗滌,洗碗,和硬表面清潔去污劑組合物的成份。具有改變特性的本發(fā)明的變異體可用于淀粉加工,特別是淀粉轉(zhuǎn)化,特別是淀粉的液化(參見,例如,us3,912,590,ep專利申請?zhí)?52730和63909,wo99/19467,和wo96/28567,所有文獻在此引用以供參考)。本發(fā)明還涉及用于淀粉轉(zhuǎn)化用途的組合物,它除了本發(fā)明的變異體外,還包含葡糖淀粉酶,支鏈淀粉酶,和其它α-淀粉酶。另外,本發(fā)明的變異體還特別用于從淀粉或完整谷粒生產(chǎn)增甜劑和乙醇(參見,例如,在此作為參考文獻引用的美國專利號5,231,017),例如燃料,飲料和工業(yè)乙醇。本發(fā)明的變異體也可用于紡織品,織物和服裝的脫漿(參見,例如,wo95/21247,us專利4,643,736,ep119,920,在此引用以供參考),啤酒制備或釀造,紙漿和紙生產(chǎn),和飼料和食品生產(chǎn)。淀粉轉(zhuǎn)化常規(guī)淀粉轉(zhuǎn)化方法,例如液化和糖化方法在例如,美國專利號3,912,590和ep專利公開號252,730和63,909中描述,在此引用以供參考。在一個實施方案中,將淀粉降解成諸如糖或脂肪替代品的低分子量糖成份的淀粉轉(zhuǎn)化方法包括去分支步驟。淀粉轉(zhuǎn)化成糖為了將淀粉轉(zhuǎn)化成糖,應解聚淀粉。該解聚過程由預處理步驟和兩個或三個連續(xù)的加工步驟組成,即,液化過程,糖化過程和依賴于所需最終產(chǎn)物任選的異構(gòu)化過程。天然淀粉的預處理天然淀粉由顯微顆粒組成,它在室溫下不溶于水。當加熱含水淀粉漿料時,該顆粒膨脹并最終破裂,將淀粉分子分散進溶液中。在該“糊化”過程中,粘度顯著增加。由于在典型的工業(yè)過程中固形物水平是30-40%,因此淀粉要變稀或“液化”(liquefied)使其能夠處理。這種粘度的降低目前主要通過酶降解獲得。液化(liquefaction)液化步驟期間,長鏈淀粉由α-淀粉酶降解為分支和線性較短單位(麥芽糖糊精)。液化步驟在105-110℃下進行5到10分鐘,接著在95℃進行1-2小時。ph位于5.5到6.2之間。為了保證在這些條件下的最佳酶穩(wěn)定性,加入1mm鈣(40ppm游離鈣離子)。該處理后,液化的淀粉具有10-15的“葡萄糖當量”(de)。糖化經(jīng)過液化過程后,通過加入葡糖淀粉酶(例如,amg)和去分支酶,例如異淀粉酶(美國專利號4,335,208)或支鏈淀粉酶(例如,promozymetm)(美國專利號4,560,651)將麥芽糖糊精轉(zhuǎn)化為葡萄糖。在該步驟前,將ph值降低到低于4.5,維持高溫(高于95℃)以便滅活液化α-淀粉酶以減少稱為“潘糖前體”的短寡糖形成,該寡糖不能被去分支酶正確水解。將溫度降低到60℃,加入葡糖淀粉酶和去分支酶。該糖化過程進行24-72小時。一般來說,在液化步驟后變性α-淀粉酶時,大約0.2-0.5%的糖化產(chǎn)物是不能被支鏈淀粉酶降解的分支的三糖62-α-葡糖基麥芽糖(潘糖)。如果在糖化期間存在來自液化步驟的活性淀粉酶(即,不變性),該水平可高達1-2%,這是非常不希望的,因為它明顯降低了糖化產(chǎn)量。異構(gòu)化當所需的最終糖產(chǎn)物是例如,高果糖糖漿時,可將葡萄糖糖漿轉(zhuǎn)變成果糖。在糖化過程后,將ph值增加到6-8的范圍內(nèi),優(yōu)選7.5,且通過離子交換去掉鈣。然后使用例如,固定化葡萄糖異構(gòu)酶(例如,sweetzymetmit)將葡萄糖糖漿轉(zhuǎn)化成高果糖糖漿。乙醇生產(chǎn)一般來說,從完整谷粒生產(chǎn)醇(乙醇)可分成4個主要步驟:-磨碎-液化-糖化-發(fā)酵磨碎磨碎谷粒以便打開該結(jié)構(gòu)并允許進一步加工。使用濕磨或干磨兩個步驟。在干磨中,磨碎完整種仁并用于該方法的剩下部分。濕磨可產(chǎn)生極好的胚芽(germ)和粗粉(meal)(淀粉顆粒和蛋白質(zhì))分離且除少數(shù)例外情況外一般用于平行生產(chǎn)糖漿的情況。液化在液化過程中,淀粉顆粒通過水解溶解成大部分dp高于4的麥芽糖糊精。水解可通過酸處理或通過α-淀粉酶的酶處理進行。酸水解用于有限的情況中。粗制材料可以是磨細的完整谷粒或來自淀粉加工的副產(chǎn)物(sidestream)。酶液化一般作為三步加熱漿料法進行。將漿料加熱到60-95℃之間,優(yōu)選80-85℃,加入酶。然后在95-140℃之間,優(yōu)選105-125℃下噴射蒸煮該漿料,冷卻到60-95℃并加入更多酶以獲得最終水解。液化過程在ph4.5-6.5,一般在5到6之間的ph下進行。磨碎并液化的谷粒也稱為麥芽汁。糖化為了生產(chǎn)可被酵母代謝的低分子量糖dp1-3,可進一步水解液化產(chǎn)生的麥芽糖糊精。水解一般通過葡糖淀粉酶進行酶處理,作為選擇,可使用α-葡糖苷酶或酸性α-淀粉酶。全部糖化步驟可持續(xù)72小時,然而,通常僅進行一般40-90分鐘的預糖化和隨后在發(fā)酵期間完成糖化(ssf)。糖化一般在從30-65℃,一般大約60℃的溫度下和在ph4.5下進行。發(fā)酵一般來自糖酵母屬(saccharomyces)菌種的酵母加入麥芽汁中且發(fā)酵進行24-96小時,例如一般35-60小時。溫度在26-34℃之間,一般在大約32℃下,ph為ph3-6,優(yōu)選大約ph4-5。注意最廣泛使用的方法是同時糖化和發(fā)酵(ssf)方法,其中沒有糖化保持期,這意味著酵母和酶一起加入。當進行ssf時,通常在發(fā)酵前立即引入在超過50℃溫度下的預糖化步驟。蒸餾發(fā)酵后,蒸餾麥芽汁提取乙醇。根據(jù)本發(fā)明方法獲得的乙醇可用作例如,燃料乙醇;飲料乙醇,即可飲用的精制酒精(neutralethanol);或工業(yè)乙醇。副產(chǎn)品發(fā)酵剩余物是一般以液體形式或干燥形式用于動物飼料的谷粒。如何進行液化,糖化,發(fā)酵,蒸餾,和回收乙醇的進一步細節(jié)是技術(shù)人員熟知的。根據(jù)本發(fā)明的方法,糖化和發(fā)酵可同時或分開進行。紙漿和紙生產(chǎn)本發(fā)明的堿性α-淀粉酶也可用于從淀粉強化的廢紙或薄紙板生產(chǎn)木質(zhì)素纖維素材料,例如紙漿,紙和薄紙板,特別是在ph超過7下進行再制漿和淀粉酶通過降解強化淀粉促進廢料分解的情況下。本發(fā)明的α-淀粉酶特別用于從淀粉覆蓋的打印紙生產(chǎn)造紙紙漿的方法中。該方法可按wo95/14807所述進行,包括如下步驟:a)分解紙以便生產(chǎn)紙漿,b)在步驟a)之前,期間或之后用淀粉降解酶處理,和c)在步驟a)和b)之后從紙漿分離墨汁顆粒本發(fā)明的α-淀粉酶在酶修飾的淀粉與諸如碳酸鈣,高嶺土(kaolin)和粘土的堿性填料一起用于造紙的情況下對于修飾淀粉也非常有用。使用本發(fā)明的堿性α-淀粉酶,使得在該填料存在下修飾淀粉成為可能,從而使得整體方法更簡單。紡織品,織物和衣服的脫漿本發(fā)明的α-淀粉酶在紡織品,織物或衣服脫漿中也非常有用。在紡織品加工工業(yè)中,α-淀粉酶在脫漿過程中按傳統(tǒng)用作輔助劑以促進含淀粉漿料的去除,該漿料在紡織期間用作覆蓋織物紗線的保護劑。紡織后完全去掉漿料涂層對于確保清洗,漂白和染色織物的隨后加工中的最佳效果是重要的。優(yōu)選酶促淀粉分解,因為它不會對纖維材料產(chǎn)生任何有害影響。為了降低加工成本和提高工廠產(chǎn)量(millthroughput),有時將脫漿加工與清洗(scouring)和漂白步驟合并。在這種情況下,一般使用諸如堿或氧化劑的非酶輔助劑分解淀粉,因為傳統(tǒng)的α-淀粉酶與高ph水平和漂白劑非常不相容。非酶分解淀粉漿料導致一些纖維損壞,因為使用了相當烈性的化學品。因此,需要使用本發(fā)明的α-淀粉酶,因為它們在堿性溶液中具有改良的性能。該α-淀粉酶可單獨使用或者在對含纖維素的織物或紡織品進行脫漿時可與纖維素酶聯(lián)合使用。脫漿和漂白方法是本領域熟知。例如,該方法在本文作為參考文獻引用的wo95/21247,美國專利4,643,736,ep119,920中描述。商業(yè)上可獲得的用于脫漿的產(chǎn)品包括來自novozymesa/s的和ultra。啤酒生產(chǎn)本發(fā)明的α-淀粉酶在啤酒生產(chǎn)方法中也非常有用;一般在麥芽汁處理期間添加該α-淀粉酶。去污劑組合物本發(fā)明的α-淀粉酶可添加到去污劑組合物中并因此成為去污劑組合物的一種成份。本發(fā)明的去污劑組合物可配制成例如,手工或機械洗衣的去污劑組合物,包括適合于染色織物預處理的洗衣添加劑組合物和漂洗添加的織物軟化劑組合物,或配制成用于常規(guī)家庭硬表面清潔操作的去污劑組合物,或配制成用于手工或機械的洗碗操作。在一個具體方面,本發(fā)明提供了包含本發(fā)明酶的去污劑添加劑。該去污劑添加劑以及去污劑組合物可包含一個或多個其它酶,例如蛋白酶,脂肪酶,過氧化物酶,另一淀粉分解酶,例如,另一α-淀粉酶,葡糖淀粉酶,產(chǎn)麥芽糖淀粉酶,cgtase和/或纖維素酶,甘露聚糖酶(例如mannawaytm,來自novozymes,denmark),果膠酶,果膠裂解酶,角質(zhì)酶,和/或漆酶。一般來說,選定酶的特性應與選擇的去污劑相容,(即,ph最適,與其它酶和非酶成份等相容),且該酶應當以有效量存在。蛋白酶:合適的蛋白酶包括動物,植物或微生物來源的蛋白酶。優(yōu)選微生物來源。包括化學修飾或蛋白質(zhì)改造的突變體。該蛋白酶可以是絲氨酸蛋白酶或金屬蛋白酶,優(yōu)選堿性微生物蛋白酶或胰蛋白酶樣蛋白酶。堿性蛋白酶的例子有枯草桿菌蛋白酶,特別是來源于芽孢桿菌屬的那些枯草桿菌蛋白酶,例如,枯草桿菌蛋白酶novo,枯草桿菌蛋白酶carlsberg,枯草桿菌蛋白酶309,枯草桿菌蛋白酶147和枯草桿菌蛋白酶168(在wo89/06279中描述)。胰蛋白酶樣蛋白酶的例子是胰蛋白酶(例如,豬或牛來源的胰蛋白酶)和在wo89/06270和wo94/25583中所述的鐮孢屬(fusarium)蛋白酶。有用的蛋白酶的例子是在wo92/19729,wo98/20115,wo98/20116,和wo98/34946中所述的變異體,特別是在一個或多個下列位置:27,36,57,76,87,97,101,104,120,123,167,170,194,206,218,222,224,235和274中具有取代的變異體。優(yōu)選的商業(yè)上可獲得的蛋白酶包括和(來自novozymesa/s),maxacal,purafect(genencorinternationalinc.)。脂肪酶:合適的脂肪酶包括細菌或真菌來源的那些脂肪酶。包括化學修飾的或蛋白質(zhì)改造的突變體。有用的脂肪酶的例子包括來自腐質(zhì)酶屬(humicola)(同義詞thermomyces),例如,來自ep258068和ep305216中所述的h.lanuginosa(t.lanuginosus)或來自wo96/13580中所述的h.insolens的脂肪酶,假單胞菌屬(pseudomonas)脂肪酶,例如,來自p.alcaligenes或類產(chǎn)堿假單胞菌(p.pseudoalcaligenes)(ep218272),蔥頭假單胞菌(p.cepacia)(ep331376),司徒茨氏假單胞菌(p.stutzeri)(gb1,372,034),熒光假單胞菌(p.fluorescens),假單胞菌屬菌株sd705(wo95/06720和wo96/27002),p.wisconsinensis(wo96/12012)的脂肪酶,芽孢桿菌屬脂肪酶,例如,來自枯草芽孢桿菌(dartois等,(1993),biochemicaetbiophysicaacta,1131,253-360),嗜熱脂肪芽孢桿菌(jp64/744992)或短小芽孢桿菌(b.pumilus)(wo91/16422)的脂肪酶。其它例子是脂肪酶變異體,例如在wo92/05249,wo94/01541,ep407225,ep260105,wo95/35381,wo96/00292,wo95/30744,wo94/25578,wo95/14783,wo95/22615,wo97/04079和wo97/07202中所述的那些變異體。優(yōu)選的商業(yè)上可獲得的脂肪酶包括lipolasetm和lipolaseultratm(novozymesa/s)。淀粉酶:合適的淀粉酶(α和/或β)包括細菌或真菌來源的那些淀粉酶。包括化學修飾的或蛋白質(zhì)改造的變異體。淀粉酶包括例如,從芽孢桿菌屬,例如地衣芽孢桿菌的特定菌株獲得的α-淀粉酶,它在gb1,296,839中進行了更詳細的描述。有用的α-淀粉酶的例子是在wo94/02597,wo94/18314,wo96/23873,和wo97/43424中所述的變異體,特別是在一個或多個下列位置:15,23,105,106,124,128,133,154,156,181,188,190,197,202,208,209,243,264,304,305,391,408,和444中具有取代的變異體。商業(yè)上可獲得的α-淀粉酶是duramyltm,liquezymetmtermamyltm,natalasetm,supramyltm,stainzymetm,fungamyltm和bantm(novozymesa/s),rapidasetm,purastartm和purastaroxamtm(來自genencorinternationalinc.)。纖維素酶:合適的纖維素酶包括細菌或真菌來源的那些酶。包括化學修飾或蛋白質(zhì)改造的變異體。合適的纖維素酶包括來自芽孢桿菌屬,假單胞菌屬,腐質(zhì)酶屬,鐮孢屬(fusarium),草根霉屬(thielavia),支頂孢屬(acremonium)的纖維素酶,例如,在us4,435,307,us5,648,263,us5,691,178,us5,776,757和wo89/09259中公開的由humicolainsolens,myceliophthorathermophila和尖孢鐮孢(fusariumoxysporum)產(chǎn)生的真菌纖維素酶。特別合適的纖維素酶是具有顏色喜好優(yōu)點(colourcarebenefit)的堿性或中性纖維素酶。該纖維素酶的例子是在ep0495257,ep0531372,wo96/11262,wo96/29397,wo98/08940中所述的纖維素酶。其它例子是纖維素酶變異體,例如在wo94/07998,ep0531315,us5,457,046,us5,686,593,us5,763,254,wo95/24471,wo98/12307和pct/dk98/00299中所述的那些變異體。商業(yè)上可獲得的纖維素酶包括和(novozymesa/s),和puradax(genencorinternationalinc.),和(kaocorporation)。過氧化物酶/氧化酶:合適的過氧化物酶/氧化酶包括植物,細菌或真菌來源的那些酶。包括化學修飾或蛋白質(zhì)改造的突變體。有用的過氧化物酶的例子包括來自coprinus,例如,來自c.cinereus的過氧化物酶及其變異體,例如在wo93/24618,wo95/10602,和wo98/15257中所述的那些酶。商業(yè)上可獲得的過氧化物酶包括(novozymesa/s)。通過加入含有一種或多種酶的分開的(separate)添加劑,或者通過加入含有所有這些酶的組合添加劑可在去污劑組合物中包含去污劑酶。本發(fā)明的去污劑添加劑,即,分開的添加劑或組合添加劑可配制成例如,粒狀,液體,漿液等。優(yōu)選的去污劑添加劑配制品是粒狀,特別是無塵粒狀,液體,特別是穩(wěn)定液體,或漿液。無塵粒狀可按例如,在us4,106,991和4,661,452中所述生產(chǎn)且任選通過本領域已知的方法包衣。蠟狀包衣材料的例子是具有1000至20000平均分子量的聚環(huán)氧乙烷產(chǎn)物(聚乙二醇,peg);具有16到50個環(huán)氧乙烷單元的乙氧基化壬烷基酚;其中醇含有12到20個碳原子且有15到80個環(huán)氧乙烷單元的乙氧基化脂肪醇;脂肪醇;脂肪酸;和脂肪酸的單-和二-和三酸甘油酯。適合于通過流化床技術(shù)應用的成膜包衣材料的例子在gb1483591中提供。液體酶制品可通過例如,按照已有方法加入諸如丙二醇的多元醇,糖或糖醇,乳酸或硼酸來穩(wěn)定。根據(jù)ep238,216中公開的方法可制備保護的酶。本發(fā)明的去污劑組合物可以是任何方便的形式,例如,棒狀,片劑,粉末,顆粒,糊劑或液體。液體去污劑可以是含水的,一般含高達70%的水和0-30%有機溶劑,或可不含水。去污劑組合物含有一種或多種表面活性劑,它可以是包括半極性的非離子,和/或陰離子和/或陽離子和/或兩性離子的表面活性劑。表面活性劑一般以0.1%到60%的重量水平存在。當其中包含時,去污劑通常含有從大約1%到大約40%的陰離子表面活性劑,例如,線性烷基苯磺酸鹽,α-鏈烯磺酸鹽,烷基硫酸鹽(脂肪醇硫酸鹽),脂肪醇乙氧硫酸鹽,仲鏈烷磺酸鹽,α-硫代脂肪酸甲酯,烷基或鏈烯基琥珀酸或肥皂。當其中包含時,去污劑通常含有從大約0.2%到大約40%的非離子表面活性劑,例如,乙氧基化醇,乙氧基化壬烷基酚,烷基多聚糖苷,烷基二甲基氧化胺,乙氧基化脂肪酸一乙醇酰胺,脂肪酸一乙醇酰胺,聚羥基烷基脂肪酸酰胺,或葡糖胺的n-酰基n-烷基衍生物("葡糖酰胺")。去污劑可含有0-65%的去污劑組份或絡合劑,例如沸石,二磷酸鹽,三磷酸鹽,膦酸(phosphonate),碳酸鹽,檸檬酸鹽,氮三乙酸,乙二胺四乙酸,二亞乙基三胺五乙酸,烷基或烯基琥珀酸,可溶性硅酸鹽或分層硅酸鹽(例如,sks-6,來自hoechst)。該去污劑(detergent)可包含一個或多個聚合物。例子有羧甲基纖維素,聚乙烯吡咯烷酮,聚乙二醇,聚乙烯醇,聚乙烯啶-n-氧化物,聚乙烯咪唑,聚羧酸酯,例如聚丙烯酸酯,馬來酸/丙烯酸共聚物和月桂基異丁烯酸/丙烯酸共聚物。去污劑可含有漂白系統(tǒng),它可包含h2o2源,例如可與諸如四乙酰乙二胺或壬酰羥苯磺酸的過酸形成漂白活化劑結(jié)合的過硼酸鹽或過碳酸鹽。作為選擇,漂白系統(tǒng)可含有例如酰胺,亞胺,或砜形式的過氧酸。本發(fā)明的去污劑組合物的酶可使用常規(guī)穩(wěn)定劑穩(wěn)定,例如,諸如丙二醇或甘油的多元醇,糖或糖醇,乳酸,硼酸,或硼酸衍生物,例如,芳香硼酸酯,或苯基硼酸衍生物,例如4-甲酰基苯基硼酸,且該組合物可按例如,wo92/19709和wo92/19708所述配制。該去污劑也可含有其它常規(guī)去污劑成份,例如,織物調(diào)節(jié)劑,包括粘土,泡沫激發(fā)劑,泡沫抑制劑,抗腐蝕劑,塵土懸浮劑,抗塵土再沉積劑,染料,殺菌劑,光亮劑,水溶助劑(hydrotropes),玷污抑制劑,或香料。本發(fā)明還涉及在去污劑組合物中以相應于每升洗滌溶液0.001-100mg酶蛋白,優(yōu)選每升洗滌溶液0.005-5mg酶蛋白,更優(yōu)選每升洗滌溶液0.01-1mg酶蛋白且特別是每升洗滌溶液0.1-1mg酶蛋白的量加入任何酶,特別是本發(fā)明的酶。本發(fā)明的酶還可摻入在此作為參考文獻引用的wo97/07202中公開的去污劑配制品中。洗碗去污劑組合物本發(fā)明的酶也可用于洗碗去污劑組合物中,包括下列組合物:1)粉劑自動洗碗組合物非離子表面活性劑0.4-2.5%硅酸鈉0-20%二硅酸鈉3-20%三磷酸鈉20-40%碳酸鈉0-20%過硼酸鈉2-9%四乙酰乙二胺(taed)1-4%硫酸鈉5-33%酶0.0001-0.1%2)粉劑自動洗碗組合物3)粉劑自動洗碗組合物非離子表面活性劑0.5-2.0%二硅酸鈉25-40%檸檬酸鈉30-55%碳酸鈉0-29%碳酸氫鈉0-20%一水過硼酸鈉0-15%四乙酰乙二胺(taed)0-6%馬來酸/丙烯酸共聚物0-5%粘土1-3%聚氨基酸0-20%聚丙烯酸鈉0-8%酶0.0001-0.1%4)粉劑自動洗碗組合物5)粉劑自動洗碗組合物非離子表面活性劑1-7%二硅酸鈉18-30%檸檬酸三鈉10-24%碳酸鈉12-20%單過硫酸(2khso5.khso4.k2so4)15-21%漂白穩(wěn)定劑0.1-2%馬來酸/丙烯酸共聚物0-6%二亞乙基三胺五乙酸酯,五鈉鹽0-2.5%酶0.0001-0.1%硫酸鈉,水平衡6)具有清潔表面活性劑系統(tǒng)的粉劑和液體洗碗組合物7)非水液體自動洗碗組合物8)無水液體洗碗組合物9)觸變液體自動洗碗組合物10)液體自動洗碗組合物乙氧基化醇0-20%磺酸脂肪酸酯0-30%十二烷基硫酸鈉0-20%烷基聚糖苷酯(alkylpolyglycoside)0-21%油酸0-10%一水二硅酸鈉18-33%脫水檸檬酸鈉18-33%硬脂酸鈉0-2.5%一水過硼酸鈉0-13%四乙酰乙二胺(taed)0-8%馬來酸/丙烯酸共聚物4-8%酶0.0001-0.1%11)含保護性漂白顆粒的液體自動洗碗組合物12)1),2),3),4),6)和10)所述的自動洗碗組合物,其中過硼酸鹽被過碳酸鹽取代。13)1)-6)所述的自動洗碗組合物,它還含有錳催化劑。錳催化劑可以是,例如,“用于低溫漂白的有效錳催化劑”,nature369,1994,第637-639頁中所述的化合物之一。材料和方法酶:sp722:seqidno:4,可從novozymes獲得,且在wo95/26397中描述。aa560:seqidno:12;在wo00/60060中公開且可從novozymesa/s獲得;在丹麥專利申請?zhí)杙a199900490中公開;于1999年1月25日在dsmz保藏且保藏號為dsmzno.12649。aa560按布達佩斯條約在用于專利程序的微生物國際保藏中心deutshesammmlungvonmicroorganismenundzellkulturengmbh(dsmz),mascheroderweg1b,d-38124braunschweigde保藏。ax379:可從novozymes獲得。枯草芽孢桿菌(bacillussubtilis)sha273:參見wo95/10603。質(zhì)粒pje1含有編碼sp722α-淀粉酶變異體的基因(seqidno:4):即相應于成熟蛋白氨基酸d183-g184的6個核苷酸缺失。je1基因的轉(zhuǎn)錄由amyl啟動子指導。該質(zhì)粒還含有復制起點和從質(zhì)粒pub110獲得的賦予氯霉素抗性的cat-基因(gryczan,tj等,(1978),j.bact.134:318-329)。pdn1528含有編碼termamyl,amyl的完整基因,其表達由其自身的啟動子指導。另外,該質(zhì)粒含有來自質(zhì)粒pub110的復制起點,ori,和來自質(zhì)粒pc194的賦予氯霉素抗性的cat基因。pdn1528在wo96/23874的圖9中顯示。方法:常規(guī)分子生物學方法:除非另有說明,dna操作和轉(zhuǎn)化使用標準分子生物學方法進行(sambrook等,(1989);ausubel等,(1995);harwood和cutting(1990)。模型構(gòu)建檢索蛋白質(zhì)結(jié)構(gòu)數(shù)據(jù)庫,例如“theproteindatabank(pdb)(<http://www.pdb.bnl.gov/>)”或“thebrookhavendatabankatbrookhavennationallaboratory,us”中與需要建立模型的所述分子相似的蛋白質(zhì)。對氨基酸序列進行序列對比,考慮結(jié)構(gòu)保守區(qū)并將坐標(coordinates)從對照蛋白復制到目的蛋白。從具有相似氨基酸序列的其它蛋白質(zhì),或者通過使用大多數(shù)3d軟件包,例如biosym,msi的homology中建立的隨機結(jié)構(gòu)產(chǎn)生功能設定具有插入和缺失的坐標區(qū)域。當設定了目的蛋白的所有氨基酸的坐標并通過例如,biosym,msi的discover程序的命令endrepair和splicerepair將該片斷連接在一起時,需要精選該模型。該模型的能量首先通過松弛該分子來最小化(discover程序中的relax命令)且隨后通過分子動力學來最小化。參考文獻可參見同源性構(gòu)建軟件,例如biosym,msi的homology的操作手冊。獲得感興趣區(qū)域的方法:有3個已知的細菌α-淀粉酶3d結(jié)構(gòu)。兩個地衣芽孢桿菌α-淀粉酶,brookhavendatabase1bpl(machius等,(1995),j.mol.biol.246,第545-559頁)和1vjs(song等,(1996),enzymesforcarbohydrate163engineering(prog.biotechnol.v12)。這兩個結(jié)構(gòu)在兩個鈣離子和一個鈉離子結(jié)合位點周圍的區(qū)域缺少所謂b-結(jié)構(gòu)域的重要結(jié)構(gòu)片斷。還有一個α-淀粉酶ba2的3d結(jié)構(gòu)(wo96/23874,它是公開的bantm(seqidno.5)和地衣芽孢桿菌α-淀粉酶(seqidno.4)之間的雜合體,它含有全部b-結(jié)構(gòu)域且因此含有a和b結(jié)構(gòu)域之間的金屬離子。另外,來自b.stearothermophilus的α-淀粉酶主要部分的結(jié)構(gòu)也被sued[?]公開且堿性α-淀粉酶sp722的結(jié)構(gòu)在wo01/66712中提供。為了構(gòu)建給定α-淀粉酶的最佳模型,選擇非常同源的結(jié)構(gòu),即地衣芽孢桿菌α-淀粉酶的良好模型最好根據(jù)ba2的結(jié)構(gòu)來構(gòu)建,因此它是b.amyloliquefacienceα-淀粉酶的良好模型,而類似aa560,sp707,sp7-7和ksm-ap1378的堿性α-淀粉酶最好根據(jù)sp722α-淀粉酶的結(jié)構(gòu)來構(gòu)建。從sp722的三級結(jié)構(gòu)同源性構(gòu)建aa560如上所述,aa560α-淀粉酶(seqidno:12)與sp722(seqidno:4)的總體同源性是大約87%。aa560與sp722的序列對比表明其中沒有插入或缺失,也可參見圖1。aa560α-淀粉酶的三級結(jié)構(gòu)是使用“材料和方法”部分所述的方法“模型構(gòu)建”在附件1所公開的結(jié)構(gòu)上建立的模型。在unix工作站運行insight和biosym,msi的同源性軟件可顯示sp722的結(jié)構(gòu)。對氨基酸序列進行序列對比并將sp722的坐標(coordinated)設定到aa560的氨基酸上。在sp722結(jié)構(gòu)中缺失的aa560的前4個氨基酸的坐標(coordinates)由“endrepair”功能指定。aa560的模型通過首先使用“relax”命令松弛氨基酸側(cè)向改變,然后運行分子動力學以最小化該3d模型的能量。選擇insight95,msi的默認參數(shù)用于兩種松弛分子動力學。α-淀粉酶變異體的發(fā)酵和純化發(fā)酵和純化可按本領域熟知的方法進行。α-淀粉酶和變異體的發(fā)酵發(fā)酵可按本領域熟知的或者如下的方法進行。將含有相關表達質(zhì)粒的枯草芽孢桿菌劃線在具有相關抗生素的lb-瓊脂糖平板上,并在37℃下生長過夜。將菌落轉(zhuǎn)移到500ml搖瓶中的添加了相關抗生素(例如,10mg/l氯霉素)的100mlbpx培養(yǎng)基中。bpx培養(yǎng)基的組成成份:培養(yǎng)物在37℃下以270rpm搖動4到5天。通過以4500rpm離心20-25分鐘從發(fā)酵肉湯中去掉細胞和細胞碎片。然后過濾上清獲得完全澄清的溶液。濃縮濾液并在uf-濾膜(10000截留膜)上洗滌且將緩沖液更換成20mm乙酸鹽ph5.5。將uf-濾液加樣到s-瓊脂糖f.f.上并在相同緩沖液中用0.2mnacl通過洗脫步驟進行洗脫。洗脫物用10mmtris,ph9.0進行透析并加樣到q-瓊脂糖f.f.上,用在6倍柱體積內(nèi)從0-0.3mnacl的線性梯度進行洗脫。合并含有活性的餾分(通過phadebas測定法測量),將ph調(diào)節(jié)到ph7.5并通過用0.5%w/vol.活性炭處理5分鐘去掉剩余的顏色。穩(wěn)定性測定使用如下方法測量淀粉酶的穩(wěn)定性:將酶在相應條件下溫育。在各時間點,例如0,5,10,15和30分鐘后取樣并在測定緩沖液(0.1m50mmbritton緩沖液,ph7.3)中稀釋25倍(相同稀釋度用于所有的取樣)并在標準條件ph7.3,37℃下使用phadebas測定法(pharmacia)測量活性。溫育前(0分鐘)測定的活性用作對照(100%)。計算下降百分數(shù)作為溫育時間的函數(shù)。表中表示了在例如,溫育30分鐘后的剩余活性。測量鈣-和ph-依賴性穩(wěn)定性執(zhí)行正常的工業(yè)溶解程序,使用ph6.0-6.2作為溶解ph并添加40ppm游離鈣以提高在95℃-105℃下的穩(wěn)定性。進行本文提出的一些取代以提高在如下條件下的穩(wěn)定性:1.比ph6.2更低的ph和/或2.比40ppm游離鈣更低的游離鈣水平。可使用兩個不同的方法測量在所述α-淀粉酶中通過不同取代獲得的穩(wěn)定性改變:方法1.在降低的ph,ph5.0下,在存在5ppm游離鈣時測量穩(wěn)定性的一種測定法。將10微克變異體在如下條件:0.1m乙酸鹽溶液,ph調(diào)節(jié)到ph5.0,含有5ppm鈣和5%w/w普通玉米淀粉(不含鈣)中溫育。溫育在95℃水浴中進行30分鐘。方法2.在不含游離鈣且其中ph維持在ph6.0時測量穩(wěn)定性的一種測定法。該測定法可測量鈣靈敏度的下降:將10微克變異體在如下條件下溫育:0.1m乙酸鈉,ph調(diào)節(jié)到ph6.0,含有5%w/w普通玉米淀粉(不含鈣)。溫育在95℃的水浴中進行30分鐘。α-淀粉酶活性的測定法1.phadebas測定法α-淀粉酶活性通過采用片作為底物的方法來測定。phadebas片(amylasetest,pharmaciadiagnostic提供)含有交聯(lián)不溶性藍色淀粉聚合物,它與牛血清白蛋白和緩沖劑物質(zhì)和成片劑混合。對于每次測量,將一片懸浮于含有5ml50mmbritton-robinson緩沖液(50mm乙酸,50mm磷酸,50mm硼酸,0.1mmcacl2,用naoh將ph調(diào)節(jié)到目的值)的試管中。在感興趣的溫度下在水浴中進行檢測。待測α-淀粉酶在xml的50mmbritton-robinson緩沖液中稀釋。將1ml該α-淀粉酶溶液加入到5ml50mmbritton-robinson緩沖液中。淀粉被α-淀粉酶水解產(chǎn)生可溶的藍色片段。在620nm下以分光光度法測定所得藍色溶液的吸光度是α-淀粉酶活性的函數(shù)。重要的是在溫育10或15分鐘后(檢測時間)測量的620nm下吸光度在0.2到2.0的620nm下吸光度單位范圍內(nèi)。在該吸光度范圍內(nèi),活性與吸光度之間呈線性(lambert-beer定律)。因此必須調(diào)節(jié)酶的稀釋度以符合該準則。在具體設定的條件(溫度,ph,反應時間,緩沖液條件)下,1mg給定的α-淀粉酶將水解一定量的底物并產(chǎn)生藍色。在620nm下測定顏色強度。測定的吸光度與所述α-淀粉酶在給定條件下的比活(活性/mg純α-淀粉酶蛋白質(zhì))成正比。2.可供選擇的方法通過采用pnp-g7底物的方法測定α-淀粉酶活性。pnp-g7是對-硝基苯-α,d-麥芽七糖苷的縮寫,它是封閉(blocked)的寡糖,可被內(nèi)切淀粉酶裂解。裂解后,試劑盒中包含的α-葡萄糖苷酶消化底物以釋放游離的pnp分子,該分子為黃色,因此可通過可見分光光度法在λ=405nm(400-420nm)下測量。含有pnp-g7底物和α-葡萄糖苷酶的試劑盒由boehringer-mannheim生產(chǎn)(產(chǎn)品目錄號:1054635)。為了制備底物,將1瓶底物(bm1442309)加入5ml緩沖液(bm1442309)中。為了制備α-葡萄糖苷酶,將1瓶α-葡萄糖苷酶(bm1462309)加入45ml緩沖液(bm1442309)中。通過將5mlα-葡萄糖苷酶溶液與1ml底物混合制備工作液。通過將20μl酶溶液轉(zhuǎn)移到96孔微量滴定板中并在25℃下溫育進行測定。加入25℃的200μl工作液。混合溶液并預溫育1分鐘,在3分鐘內(nèi)每隔15秒測量od405nm下的吸光度。時間依賴型吸光度曲線的斜率與所述α-淀粉酶在給定條件下的比活(每mg酶的活性)成正比。比活測定使用上述方法之一以活性/mg酶測定比活。按產(chǎn)品說明書進行(也可參見下文“α-淀粉酶活性測定法”)。氧化穩(wěn)定性測定將含有本發(fā)明不同變異體的粗濾培養(yǎng)液在ph9.0的50mmbritton-robinson緩沖液中稀釋到淀粉酶活性為100knu/ml(上文定義)并在40℃下溫育。隨后加入h2o2至200mm的濃度,將ph值再調(diào)節(jié)到9.0。在15秒后和5,15,和30分鐘后通過取樣測量活性,將它們用冰冷的水稀釋5倍并將它們貯存在冰上。使用上述phadebas方法測量剩余的活性,其中在620nm下以分光光度法測量所得藍色溶液的吸光度是α-淀粉酶活性的函數(shù)。相對于15秒后的活性計算在5,15和30分鐘后的活性以測定穩(wěn)定性。洗滌效果分別在25℃和40℃下;在從9-10.5范圍內(nèi)的ph下;在從6到15°dh范圍內(nèi)的水硬度;ca:mg比為從2:1到4:1的條件下在劑量為依賴于去污劑含有從3到5g/l所述α-淀粉酶變異體的不同去污劑溶液(參見上文材料部分所述)中通過洗滌弄臟的試驗樣品15和30分鐘評估洗滌效果。向去污劑溶液中以例如,0.01-5mg/l的濃度加入重組α-淀粉酶變異體。試驗樣品用橙色稻米淀粉弄臟(cs-28樣品可從cft,centerfortestmaterial,holland獲得)。洗滌后,通過使用elrephoremission分光光度計測量460nm下的褪色(remission)來評估樣品。結(jié)果表示為δr=用α-淀粉酶洗滌樣品的褪色減去在相同條件下不含α-淀粉酶洗滌的樣品褪色。實施例實施例1構(gòu)建aa560seqidno:12的變異體seqidno:12所示的編碼aa560α-淀粉酶的基因位于質(zhì)粒ptvb223中。該淀粉酶在枯草芽孢桿菌中從該構(gòu)建體上的amyl啟動子表達。按sarkar和sommer,(1990),biotechniques8:404-407所述的大引物方法構(gòu)建具有m202l突變的本發(fā)明的變異體。所得的編碼含m202l的ax379淀粉酶的質(zhì)粒命名為pca202-ax379。本發(fā)明其它變異體的構(gòu)建以相同的方式進行。實施例2測定洗滌活性使用在活性檢測中分別用作對照(表中第1欄)的淀粉酶ax379或ax413所述的常規(guī)方法構(gòu)建淀粉酶變異體。ax413變異體通過導入下表所示的突變由ax379產(chǎn)生。在模擬歐洲的40℃洗滌條件下在去污劑溶液中測量活性。制備每5ml4g/l去污劑溶液1片phadebas片劑的懸液并在eppendorf管中適當攪拌。在40℃下預熱5分鐘后,加入淀粉酶且混合物在劇烈攪拌下溫育20分鐘。通過加入10%1mnaoh終止反應并將試管以最小10000xg旋轉(zhuǎn)3分鐘。最后測量上清在650nm下的吸光度,使用無酶樣品作為空白對照。表3:突變活性提高ax3791k118q1.1k37t1.1h421y1.1v450t1.1k383r1.1n445q1.1y178f1.2v318l1.2w482y1.2n283d+q361e1.2m105f+m208f1.2m202l+m323t+m430i1.3k446r+n484q1.4r444y1.5n106d1.8y203l2.0g133e+q361e2.9m323e4.1v214t6.8m202l+m323t+m309l13m202l16m202l+m323t23m202l+m323t+m9l+m382y+k383r25m202l+m323t+m9l+m382y26m202l+m323t+m9l(ax413)27表4:實施例3測定洗碗期間的穩(wěn)定性使用在活性檢測中分別用作對照(表中第1欄)的淀粉酶ax379或ax413所述的常規(guī)方法構(gòu)建淀粉酶變異體。ax413變異體通過導入下表所示的突變由ax379產(chǎn)生。通過在40℃下溫育含大約0.1mg/ml淀粉酶的用于自動洗碗的4g/l去污劑18小時測量淀粉酶穩(wěn)定性。通過加入9倍體積的冷水(<5℃)終止溫育并貯存在冰上。在1小時內(nèi)使用phadebas淀粉酶試劑盒測量活性且將去污劑樣品的活性與在去污劑中在但在冰上溫育相同時間的樣品進行比較。表5:突變剩余活性提高ax4131v214t+m323e+m382y+k383r+n471e1.1y178f+g258d+t419n+n437h1.1g149n+n150q+m382y+k383r1.1y160f+v214t+m382y1.2n128y+g149a+v214t+d231n+m382y+f441l1.2r82h+n128y+g149a+v214t+m382y1.2n150h+v214t1.2v214t+e345n1.2v214t+g305d+m382y+r444e1.2v214t+m382y+a447y1.2m202i+v214t+m382y+k383r+r444y1.2v214t+g378k1.3v214t+a256k1.3r26s+d30n+n33d+v214t+m382y1.5實施例4按實施例1所述構(gòu)建seq.idno.12的淀粉酶變異體并使用豐富培養(yǎng)基在搖瓶中發(fā)酵。使用標準純化方法從上清純化淀粉酶變異體蛋白至超過90%的純度。從a280吸光度計算蛋白質(zhì)濃度,理論消光系數(shù)為2.9ml/mg/cm。按“方法”部分所述使用g7-pnp活性測定法測量淀粉酶樣品的活性,從而計算比活(sa),即,每mg淀粉酶蛋白的g7-pnp活性并與同源對照淀粉酶進行比較。實施例5使用含有漂白劑和每升0.2mg淀粉酶蛋白的9g/l(henkel)hdd傳統(tǒng)去污劑在按比例縮減洗衣機中使用在20分鐘內(nèi)達到40℃的常規(guī)歐洲加熱程序進行洗滌試驗。用ca,mg和nahco3將水硬度調(diào)節(jié)到16°dh。在含有色水稻淀粉的棉花樣品(cs-28,來自cft)上通過相對于無淀粉酶洗滌的樣品白度測量在存在淀粉酶時洗滌后的樣品白度評估洗滌效果。樣品在機內(nèi)過夜干燥后使用褪色分光光度計(macbethcolor-eye)測量白度。實施例6使用6g/lpersilmegaperls(henkel)去污劑和每升0.2mg淀粉酶蛋白在按比例縮減洗衣機中使用在20分鐘內(nèi)達到40℃的常規(guī)歐洲加熱程序進行洗滌試驗。用ca,mg和nahco3將水硬度調(diào)節(jié)到16°dh。在含有色稻米淀粉的棉花樣品(cs-28,來自cft)上通過相對于無淀粉酶洗滌的樣品白度測量在淀粉酶存在時洗滌后的樣品白度來評估洗滌效果。樣品在機內(nèi)過夜干燥后使用褪色分光光度計(macbethcolor-eye)測量白度。當前第1頁12
相關技術(shù)
網(wǎng)友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1