一種熱穩(wěn)定性和催化活力提高的角蛋白酶突變體的制作方法
本發(fā)明涉及一種熱穩(wěn)定性和催化活力提高的角蛋白酶突變體,屬于基因工程和酶工程技術(shù)領(lǐng)域。
背景技術(shù):
角蛋白酶(keratinase),是一種由微生物產(chǎn)生,可以降解角蛋白類底物(例如羽毛,羊毛,牛羊角等)的特異性蛋白酶。角蛋白酶作為一種底物專一性寬泛,水解催化能力強(qiáng)的蛋白酶,在工業(yè)化應(yīng)用中具有很大的潛力,可以替代傳統(tǒng)蛋白酶,用于羽毛降解、皮革紡織、飼料添加劑、有機(jī)化肥和洗滌劑等方面。此外,角蛋白酶還可效降解引起綿羊瘙癢癥和瘋牛病的阮病毒。隨著工業(yè)化的發(fā)展,野生菌所產(chǎn)角蛋白酶性能和產(chǎn)量遠(yuǎn)遠(yuǎn)不能滿足市場需求。目前篩選得到的產(chǎn)角蛋白酶野生菌大多集中在枯草桿菌屬,其胞外分泌的酶種類多,底物作用專一性差,而且產(chǎn)酶不穩(wěn)定,不利于工業(yè)化生產(chǎn)。采用基因工程菌,強(qiáng)化基因轉(zhuǎn)錄和翻譯,達(dá)到高效表達(dá)和活性分泌,可以有效提高角蛋白酶生產(chǎn)強(qiáng)度。重組角蛋白酶一般經(jīng)過性能改造,胞外酶活單一,簡化了發(fā)酵下游的純化工作。另外,工業(yè)化應(yīng)用上對(duì)酶的要求苛刻,如高溫環(huán)境會(huì)很大程度影響角蛋白酶活性。為減省生產(chǎn)成本,必須實(shí)現(xiàn)角蛋白酶重復(fù)利用,另外還需要催化活力高,底物專一性強(qiáng)的角蛋白酶進(jìn)行精細(xì)化學(xué)的催化。人們從自然界篩選分離地角蛋白酶已經(jīng)遠(yuǎn)遠(yuǎn)不能滿足工業(yè)化需求,所以通過分子改造技術(shù)尋求新型角蛋白酶將是一個(gè)新的研究手段。
發(fā)明人前期對(duì)來源于嗜麥芽窄食單胞菌(Stenotrophomonas maltophilia BBE11-1)的角蛋白酶KerSMD進(jìn)行了異源表達(dá)和結(jié)構(gòu)域互換改造,獲得了熱穩(wěn)定性提高的角蛋白酶突變體P1C2T2(一種熱穩(wěn)定性提高的角蛋白酶突變體及其制備方法;申請(qǐng)?zhí)枺篊N201410276309.3)。但在大腸桿菌的胞外表達(dá)中,胞外催化活力低。為了進(jìn)一步提高酶的應(yīng)用性能,有必要進(jìn)一步提高角蛋白酶的熱穩(wěn)定性和催化效率。
技術(shù)實(shí)現(xiàn)要素:
為了解決上述問題,本發(fā)明提供了一種角蛋白酶突變體,突變體與野生型角蛋白酶相比有更好的熱穩(wěn)定性和/或催化活力。
本發(fā)明的第一個(gè)目的是提供一種角蛋白酶突變體,所述突變體的氨基酸序列是在SEQ IDNO.1的角蛋白酶P1C2T2的氨基酸序列的基礎(chǔ)上,將第198位的酪氨酸突變成苯丙氨酸(命名為Y198F)、將第291位的酪氨酸突變成纈氨酸(命名為Y291V)、將第319位的酪氨酸突變成苯丙氨酸(命名為Y319F)、將第322位的丙氨酸突變成甘氨酸(命名為A322G)或者將第322位的丙氨酸突變成絲氨酸(命名為A322S)。
在本發(fā)明的一種實(shí)施方式中,所述角蛋白酶P1C2T2的核苷酸序列如SEQ ID NO:2所示。
本發(fā)明的第二個(gè)目的是提供編碼所述角蛋白酶突變體的核苷酸序列。
本發(fā)明的第三個(gè)目的是提供含有所述突變體的氨基酸序列的重組質(zhì)粒載體。
在本發(fā)明的一種實(shí)施方式中,所述重組質(zhì)粒載體是在pET系列、pGEX系列、pPICZ系列、pAN系列或pUB中的任意一種質(zhì)粒的基礎(chǔ)上構(gòu)建得到的。
本發(fā)明的第四個(gè)目的是提供一種表達(dá)所述突變體的基因工程菌。
在本發(fā)明的一種實(shí)施方式中,所述基因工程菌,是細(xì)菌、酵母或者其他真菌。
本發(fā)明還要求保護(hù)所述角蛋白酶突變體在羽毛降解、飼料添加劑、皮革處理以及紡織工藝等方面的應(yīng)用。
本發(fā)明的有益效果:
本發(fā)明構(gòu)建了多個(gè)熱穩(wěn)定性或者催化活力得到了提高的角蛋白酶突變體,具體如下:
(1)熱穩(wěn)定性:定點(diǎn)突變體Y198F、A322G和A322S在60℃環(huán)境下的比酶活大于出發(fā)型突變體P1C2T2以及其他突變體,其中A322S在70℃表現(xiàn)出最高酶活力,比P1C2T2增加將近40%。所有突變體的半衰期均大于野生型角蛋白酶KerSMD,其中突變體A322G和A322S的熱穩(wěn)定明顯提升,A322S熱穩(wěn)定性最強(qiáng),半衰期達(dá)到185min。
(2)催化效率:本發(fā)明獲得四種胞外角蛋白酶催化活力明顯提升的定點(diǎn)突變體,分別是Y198F,Y319F和A322G,其中Y319F催化活力為最大值1558U/ml,是出發(fā)突變體P1C2T2菌株的3倍。比酶活提升明顯的角蛋白酶主要有Y198F和Y319F以及A322G。
此外,本發(fā)明還獲得了胞外角蛋白酶催化活力和熱穩(wěn)定性都獲得明顯提高的新型角蛋白酶突變體A322G,比野生型角蛋白酶更具有應(yīng)用的價(jià)值和潛力。
附圖說明
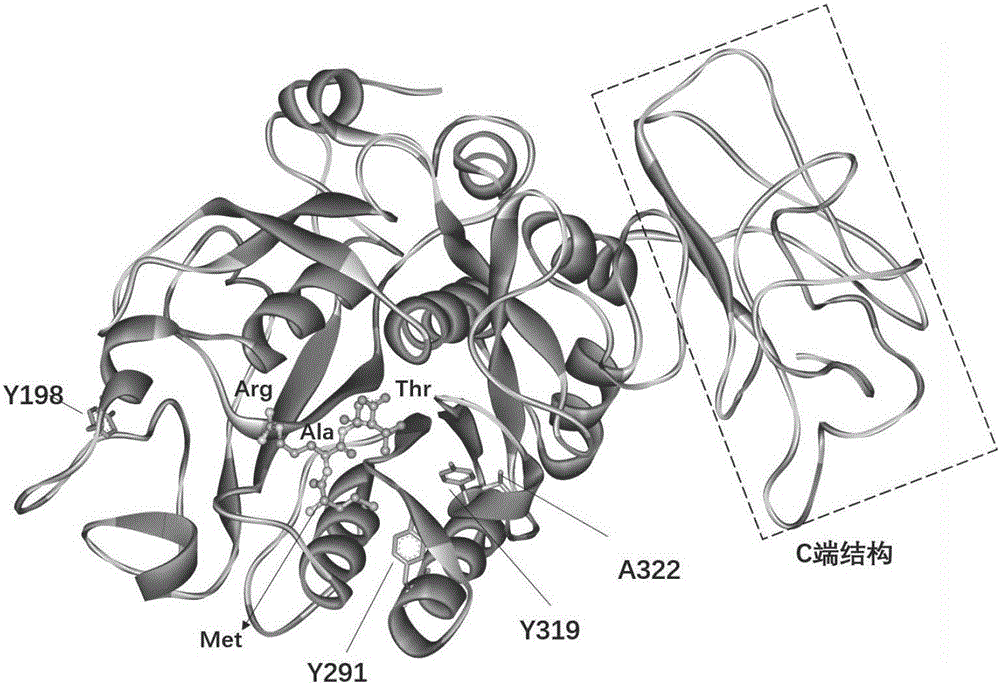
圖1:角蛋白酶P1C2T2的三維模擬結(jié)構(gòu);
圖2:角蛋白酶突變體的大腸桿菌發(fā)酵液上清SDS-PAGE凝膠電泳;其中,M代表蛋白分子量標(biāo)準(zhǔn),不同泳道名稱代表不同的突變蛋白,箭頭指示目的蛋白條帶位置;
圖3:角蛋白酶酶活測定標(biāo)準(zhǔn)曲線;
圖4:不同角蛋白酶突變體的大腸桿菌發(fā)酵液酶催化活力;
圖5:不同角蛋白酶突變體的最適反應(yīng)溫度;
圖6:不同角蛋白酶突變體的半衰期和比酶活。
具體實(shí)施方式
實(shí)施例1:角蛋白酶定點(diǎn)突變體的構(gòu)建
(1)角蛋白酶P1C2T2突變位點(diǎn)的選擇
以本實(shí)驗(yàn)以往專利(CN201410276309.3)中的角蛋白酶突變體P1C2T2為基礎(chǔ),構(gòu)建五種定點(diǎn)突變體。
本發(fā)明中,以相似度最高的枯草蛋白酶BprV的晶體結(jié)構(gòu)(PDB ID:3TI7)為模板,通過Modeller V9.11軟件構(gòu)建角蛋白酶P1C2T2成熟蛋白的三維模擬結(jié)構(gòu)(圖1)。通過氨基酸一級(jí)序列比對(duì)發(fā)現(xiàn),枯草蛋白酶BprV和角蛋白酶P1C2T2達(dá)到47%的相似度,雖然使用Modeller軟件構(gòu)建獲得的模型可以很大程度上滿足理性設(shè)計(jì)要求,但是仍然需要進(jìn)一步的優(yōu)化。本發(fā)明采用NAMD分子動(dòng)力學(xué)軟件對(duì)初步構(gòu)建的模型進(jìn)行分子動(dòng)力學(xué)計(jì)算,來獲得能量平衡和最低的模型為角蛋白酶最終三維模型結(jié)構(gòu)。具體分子動(dòng)力學(xué)計(jì)算條件如下:CHARMM力場,水盒形狀的周期邊界條件(periodic boundary condition),PME(Particle Mesh Ewald)運(yùn)算法則,設(shè)定固定動(dòng)力學(xué)溫度310K,1個(gè)大氣壓,以及1納秒的步驟時(shí)長,通過釋放整個(gè)系統(tǒng)運(yùn)行獲得最低能量值。對(duì)于整個(gè)蛋白模型結(jié)構(gòu)是否合理的驗(yàn)證,采用網(wǎng)上在線工具SAVES的PROCHECK和ERRAT功能(http://services.mbi.ucla.edu/SAVES/),當(dāng)立體空間值大于95%,則視為成功的能量優(yōu)化模型。
以前導(dǎo)肽C端末尾的4個(gè)氨基酸肽鏈(-Met-Ala-Arg-Thr-)為底物,與角蛋白酶P1C2T2進(jìn)行分子對(duì)接(圖1),定義Thr對(duì)應(yīng)的結(jié)合口袋為S1底物結(jié)合口袋,Arg對(duì)應(yīng)的是S2底物結(jié)合口袋,Ala對(duì)應(yīng)的是S3口袋,Met對(duì)應(yīng)的是S4口袋。AutoDock軟件的計(jì)算結(jié)果顯示,影響S1口袋的氨基酸位點(diǎn)是第319位的酪氨酸,影響S2口袋的是第198位酪氨酸,影響S4口袋的是第291位的酪氨酸,以上幾個(gè)位點(diǎn)都為帶電荷的酪氨酸,可能會(huì)抵抗具有疏水性的角蛋白底物,抑制底物催化活力。而第322位的丙氨酸靠近S1口袋,其電荷性質(zhì)可能影響口袋結(jié)構(gòu)的穩(wěn)定性,造成角蛋白酶熱穩(wěn)定性變化。所以本發(fā)明以減少底物結(jié)合口袋的疏水性和增強(qiáng)口袋穩(wěn)定性出發(fā),進(jìn)行以下五種突變體的構(gòu)建:Y198F,Y291V,Y319F,A322G和A322S。
(2)五種角蛋白酶P1C2T2定點(diǎn)突變體的構(gòu)建
根據(jù)P1C2T2的序列(氨基酸序列如SEQ ID NO.1所示,核苷酸序列如SEQ ID NO.2所示),分別設(shè)計(jì)定點(diǎn)突變的引物(表1),對(duì)攜帶角蛋白酶P1C2T2基因的質(zhì)粒P1C2T2/pET-22b(+)進(jìn)行定點(diǎn)突變PCR獲得目的突變體質(zhì)粒,轉(zhuǎn)導(dǎo)感受態(tài)大腸桿菌E.coli中進(jìn)行表達(dá),得到5種角蛋白酶定點(diǎn)突變體。具體如下:
表1不同角蛋白酶定點(diǎn)突變體的引物序列
采用大連寶生物的primeSTAR HS DNA擴(kuò)增酶,PCR擴(kuò)增程序設(shè)定為:首先,95℃預(yù)變性5min;然后進(jìn)入30個(gè)循環(huán):98℃變性10s,55℃退火5s,72℃延伸7min;最后72℃延伸10min,4℃保溫。PCR產(chǎn)物用1%瓊脂糖凝膠電泳進(jìn)行檢測。
PCR產(chǎn)物純化后,加入限制性內(nèi)切酶DpnI,37℃,水浴1h,降解模板質(zhì)粒,之后轉(zhuǎn)化E.coli JM109,挑取陽性克隆,LB液體培養(yǎng)基培養(yǎng)8-10h,保甘油管,送去測序。測序正確的突變體,從甘油管接種至LB培養(yǎng)基,過夜培養(yǎng),提取質(zhì)粒,將質(zhì)粒轉(zhuǎn)化表達(dá)宿主大腸桿菌BL21(DE3)感受態(tài)細(xì)胞,得到能夠表達(dá)突變體Y198F,Y291V,Y319F,A322G和A322S的五種重組菌株。
實(shí)施例2:角蛋白酶突變體的表達(dá)和純化
挑取轉(zhuǎn)入表達(dá)宿主大腸桿菌BL21(DE3)的陽性單克隆于LB液體培養(yǎng)基(含80μg/ml氨芐卡那抗生素)生長8~10h,按5%接種量將種子發(fā)酵液接到TB液體培養(yǎng)基(含含80μg/ml氨芐卡那抗生素);大腸桿菌在37℃搖床培養(yǎng)2h,至OD600=1.2左右,加入0.2mM終濃度的IPTG誘導(dǎo)細(xì)胞進(jìn)行胞外表達(dá)角蛋白酶,并在20℃搖床繼續(xù)培養(yǎng)發(fā)酵48h后,將發(fā)酵液于4℃、8000rpm離心15min除菌體,收集離心發(fā)酵上清液,進(jìn)行SDS-PAGE分析。發(fā)現(xiàn)胞外蛋白條帶單一,定點(diǎn)突變體的分子量大小接近P1C2T2的46kDa(圖2),另外還發(fā)現(xiàn)不同定點(diǎn)突變體的胞外表達(dá)量不同,其中突變體Y198F,Y291V,Y319F,A322G和A322S均大于P1C2T2,說明胞外表達(dá)量的增加。
采用AKTAavant蛋白純化儀進(jìn)行重組蛋白的純化,整個(gè)純化過程溫度控制為4℃。由于不同角蛋白酶突變體都含有組氨酸標(biāo)簽,所以可以鎳離子親和層析純化柱進(jìn)行分離純化,具體步驟如下:(1)平衡:用5倍體積的50mmol/LpH 7.2Tris-HCl緩沖液平衡純化柱;(2)上樣:預(yù)先處理好的樣品以0.5ml/min的流速上樣,上樣體積一般不超過柱體積的5倍;(3)洗脫:包括洗脫未吸附物質(zhì)、雜蛋白和目的蛋白,流速1.0ml/min,洗脫液為含有300mM咪唑的50mmol/LpH 7.2Tris-HCl緩沖液,進(jìn)行梯度洗脫,檢測波長為280nm,分批收集含角蛋白酶酶活的洗脫液;洗脫過程只出現(xiàn)一個(gè)目的蛋白洗脫峰,后續(xù)測酶活及SDS-PAGE蛋白電泳發(fā)現(xiàn),無論是野生型,還是突變體,峰頂收集的酶液為最純的部分。
實(shí)施例3:酶活分析方法
1)酶活測定方法
角蛋白酶酶活力的測定采用福林-酚試劑顯色方法測定。角蛋白酶在一定條件下,水解角蛋白底物釋放出酪氨酸。福林-酚試劑在堿性條件下可被酚類化合物還原呈藍(lán)色(鉬藍(lán)和鎢藍(lán)混合物),而角蛋白底物經(jīng)過水解,釋放游離的酪氨酸為酚類物質(zhì),發(fā)生顯色反應(yīng),可以在一定范圍內(nèi)其顏色的深淺與酪氨酸的釋放量成正比,故可以在660nm的波長下進(jìn)行比色,計(jì)算酶活。酶活單位定義:在上述條件下,以未反應(yīng)的樣品作為空白對(duì)照,將每分鐘催化分解角蛋白生成1μg酪氨酸的每毫升酶量定義為一個(gè)酶活單位。
酶活力測定步驟:
A.酶解反應(yīng):取適當(dāng)稀釋的發(fā)酵液上清200μl和含有2%(w/v)角蛋白的Gly-NaOH緩沖液(50mM,pH 9.0)300μl混合均勻,在50℃下反應(yīng)10分鐘后迅速加入500μl 5%(w/v)三氯乙酸溶液終止反應(yīng)。使用高速離心機(jī)離心10分鐘去除沉淀,獲得酶解反應(yīng)液上清。
B.顯色反應(yīng):取200μl酶解上清液到濃度為5%(w/v)的1ml碳酸鈉溶液中,混合均勻后再加入200μl福林-酚試劑(上海生工公司),50℃下反應(yīng)顯色10分鐘后以0μg/ml的酪氨酸標(biāo)準(zhǔn)液作為空白對(duì)照測定660nm處的吸光度,根據(jù)吸光度值對(duì)應(yīng)的酪氨酸濃度標(biāo)準(zhǔn)曲線計(jì)算酪氨酸釋放量(圖3)。
測定角蛋白酶P1C2T2、五種定點(diǎn)突變體Y198F,Y291V,Y319F,A322G和A322S在大腸桿菌異源表達(dá)中,實(shí)施例2得到的發(fā)酵液的角蛋白酶催化活力(圖4)。結(jié)果顯示,突變體Y198F,Y291V,Y319F,A322G和A322S的胞外酶催化活力分別為1416U/ml、619.2U/ml、1558U/ml、1295U/ml、714.4U/ml,與P1C2T2的560U/ml相比,分別提高了153%、11%、178%、131%、28%。其中Y319F催化活力為最大,是出發(fā)突變體P1C2T2菌株的3倍,另外突變體Y198F和A322G的胞外角蛋白酶催化活力也提高明顯。
實(shí)施例4:角蛋白酶突變體的最適溫度和熱穩(wěn)定性
以pH 7.0的Tris-HCl(50mM)為緩沖液,在40到70℃溫度范圍測定不同純化的角蛋白酶及突變體的最適反應(yīng)催化溫度。如圖5所示,所有角蛋白酶突變體的最適反應(yīng)溫度都為60℃,但是定點(diǎn)突變體Y198F、A322G和A322S在60℃環(huán)境下的酶活百分比分別為105%、115%和115%,大于出發(fā)型突變體P1C2T2以及其他突變體,其中A322S在70℃表現(xiàn)出最高酶活百分比102%,比P1C2T2的58%增加大于40%,說明突變體Y198F、A322G和A322S都是嗜熱性角蛋白酶突變體。
將純化的角蛋白酶和突變體用50mM pH 7.0Tris-HCl緩沖液稀釋至蛋白含量為0.5mg/ml,且pH為7.0,置于60℃恒溫水浴中,每隔20min取樣一次,測其殘留酶活,比較其穩(wěn)定性,如圖6所示。以野生型角蛋白酶KerSMD(NCBI編號(hào):KC814180)和本發(fā)明出發(fā)型突變體P1C2T2為比較對(duì)象,觀察不同突變體的半衰期(t1/2)和比酶活。本發(fā)明中所有突變體的半衰期均大于野生型角蛋白酶KerSMD的41min,其中A322S熱穩(wěn)定性最強(qiáng),半衰期達(dá)到185min,是野生型的4.5倍。其他突變體Y198F、Y291V,Y319F和A322G的半衰期分別為76min,92min,90min和160min。而比酶活提升明顯的角蛋白酶主要有Y198F、Y319F和A322G,分別為5664U/mg、4933U/mg和3700U/mg,比野生型KerSMD的3409U/mg分別提高了66%、45%和9%。
雖然本發(fā)明已以較佳實(shí)施例公開如上,但其并非用以限定本發(fā)明,任何熟悉此技術(shù)的人,在不脫離本發(fā)明的精神和范圍內(nèi),都可做各種的改動(dòng)與修飾,因此本發(fā)明的保護(hù)范圍應(yīng)該以權(quán)利要求書所界定的為準(zhǔn)。
- 還沒有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!