一種毛囊干細胞體外分化為卵母細胞的方法與流程
本發明生物醫學的干細胞與組織工程學技術領域,尤其涉及一種毛囊干細胞體外分化為卵母細胞的方法。
背景技術:
據統計,世界上現有不孕不育人群占育齡婦女的10% 左右;約1/5的婦女處于絕經期年齡段,隨著人口老齡化進程加快,越來越多女性將在雌激素匱乏狀態中度過更長時期;女性由于在工作和生活中面臨的各種壓力,致使卵巢早衰出現年輕化趨勢。在雌性不如動物生殖系統發育過程中,卵巢內絕大多數卵母細胞在發育過程中發生凋亡,因此在雌性生殖周期內能夠發育成熟并排出的卵母細胞相比整個原始卵泡庫來說非常少,同時我們對卵母細胞發生成熟的調控機制還知之甚少。因此,通過體外干細胞分化獲得卵母細胞,可以介入卵巢早衰的治療,恢復卵巢功能,以及延緩女性絕經期的到來,同時也能使我們更好的理解動物生殖細胞發生發育過程及其機制。
綜合最近研究進展,之前的研究大都采用胚胎干細胞(ESC)作為原材料,但是ESC處在哺乳動物個體發育的早期,在應用上存在倫理限制,并且取材困難,因此采用成體干細胞代替ESC向生殖細胞分化可以更好地解決問題。毛囊干細胞廣泛分布于哺乳動物毛發中,取材十分方便,對機體傷害最小,同時也不存在倫理問題限制。多項研究指出毛囊干細胞是一類具有自我更新能力及多向分化潛能的成體干細胞。
技術實現要素:
為解決現有技術中存在的上述缺陷并發揚優點,本發明旨在提供一種采用成體干細胞進行誘導分化培養,對機體傷害小、無倫理問題限制的卵母細胞體外培養方法。
為了實現上述發明目的,本發明采用以下技術方案:一種毛囊干細胞體外分化為卵母細胞的方法,包括將毛囊干細胞誘導分化為原始生殖細胞、將原始生殖細胞再次誘導分化為卵母細胞兩個步驟,其中:
1)將毛囊干細胞誘導分化為原始生殖細胞具體為:
①原始細胞準備:分別提取培養了1-2代綠色熒光轉移基因小鼠的毛囊干細胞與野生型小鼠成纖維細胞,并將野生型小鼠成纖維細胞采用絲裂霉素C處理,然后將毛囊干細胞與處理后的成纖維細胞按照數量比1:1的比例混合后待用;
②選用DMEM高糖培養基作為原始生殖細胞誘導培養基,并在該培養基內加入以DMEM高糖總質量計8%~12%質量分數的胎牛血清、以DMEM高糖總體積計40 mIU/ml~60 mIU/ml促卵泡素、80 IU/ml~120 IU/ml白血病抑制因子、15ng/ml~25 ng/ml骨形態發生因子、0.20 mmol/L~0.25 mmol/L丙酮酸鈉、0.08 mmol/L~0.12 mmol/L非必需氨基酸,1.5mmol/L~2.5mmol/L L-谷氨酰胺,0.08 mmol/L~0.12 mmol/L β-巰基乙醇, 8ng/ml~12 ng/ml表皮生長因子, 15ng/ml~25 ng/ml堿性成纖維細胞生長因子, 30ng/ml~50ng/ml干細胞生長因子;培養溫度35℃-38℃,濕度不低于80%,環境中CO2濃度4%-6%;
③將步驟①獲得的待用混合細胞植入步驟②準備的原始生殖細胞誘導培養基,然后將培養基放置在培養箱中,按常規方式進行培養8-10天,即獲得誘導分化出的原始生殖細胞;
2)將原始生殖細胞誘導分化為卵母細胞具體為:
①準備卵母細胞誘導培養基:選用DMEM/F12培養基作為卵母細胞誘導培養基,并在培養基內加入以DMEM/F12總質量計12%~18%質量分數的胎牛血清、0.8% ~1.2%質量分數的抗T細胞免疫毒素ITS、1.5%~2.5%質量分數的血清替代物B27、0.8% ~1.2%質量分數的青鏈霉素、以DMEM/F12總體積計1200 IU/ml~1800 IU/ml白細胞抑制因子LIF、40 mIU/ml~60 mIU/ml促卵泡素、8ng/ml~12 ng/ml表皮生長因子、0.08 mmol/L~0.12 mmol/L β-巰基乙醇;培養溫度35℃-38℃,濕度不低于80%,環境中CO2濃度4%-6%;
②將1)中步驟③獲得的原始生殖細胞稀釋至0.8×106個/L ~1.2×106個/L,然后植入24孔板表面并放置在步驟①獲得的培養基中懸浮培養,培養至通過常規方法檢測出現尺寸不低于50μm的大細胞,且該類大細胞呈現典型卵母細胞形態、有類似透明帶結構出現、表達卵母細胞特異基因,則所述大細胞為所需卵母細胞。
上述毛囊干細胞體外分化為卵母細胞的方法,其中:在步驟1)將毛囊干細胞誘導分化為原始生殖細胞和步驟2)將原始生殖細胞誘導分化為卵母細胞之間還增加有原始生殖細胞專向培養步驟,具體為:將1)中步驟③獲得的原始生殖細胞放入專向培養基內進行培養,所述專向培養基具體為:以DMEM高糖培養基作為基礎,其內添加以DMEM高糖總質量計8%~12%質量分數的胎牛血清、以DMEM高糖總體積計15ng/ml~25 ng/ml骨形態發生因子、以DMEM高糖總體積計0.20 mmol/L~0.25 mmol/L丙酮酸鈉、0.08 mmol/L~0.12 mmol/L非必需氨基酸,1.5 mmol/L~2.5mmol/L L-谷氨酰胺,0.08 mmol/L~0.12 mmol/L β-巰基乙醇, 15ng/ml~25ng/ml表皮生長因子, 30ng/ml~50ng/ml堿性成纖維細胞生長因子, 30ng/ml~50ng/ml干細胞生長因子;培養時間3-5天,溫度35℃-38℃,濕度不低于80%;環境中CO2濃度4%-6%;經過一定時間專向培養后可獲得更加純化、數量更多、形態更佳的原始生殖細胞。
上述毛囊干細胞體外分化為卵母細胞的方法,其中:將原始生殖細胞誘導分化為卵母細胞的培養周期為20天-25天,可獲得較多數量、形態典型、健康的卵母細胞。
與現有技術相比較,本發明具有以下優點:采用小鼠毛囊干細胞及成纖維細胞作為原細胞進行專向誘導分化,一方面對機體傷害小,另一方面,也無倫理問題限制,具有更廣闊的應用前景和重大的社會及經濟意義;采用的培養基成份配置更為合理、營養更齊全且更專向,用于適用的毛囊干細胞專向培養卵母細胞的效率高、再現率高、純度高、質量好;清楚地劃分了初步誘導分化和最終誘導分化培養,一方面使本發明的專向性更強,另一方面也為實際應用的步驟優化提供了更大的空間和應用價值,也大大降低了培養難度,提高了再現性;本發明最終建立了小鼠毛囊干細胞體外分化為卵母細胞的方法,以小鼠毛囊干細胞為材料,先在體外誘導分化為原始生殖細胞,再將分化的原始生殖細胞轉到卵母細胞誘導培養基中,獲得了典型卵子形態的卵母細胞,為毛囊干細胞向配子分化及研究應用提供了技術基礎。
附圖說明
圖1 為小鼠毛囊組織和毛囊干細胞培養圖片。
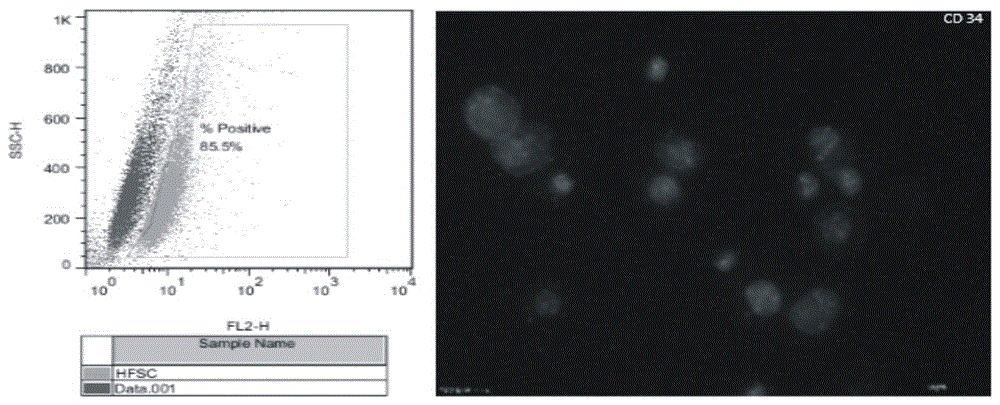
圖2 為小鼠毛囊干細胞CD34表達檢測分析圖片。
圖3 為小鼠毛囊干細胞分化的原始生殖細胞圖片。
圖4 為小鼠毛囊干細胞分化的原始生殖細胞基因表達檢測圖片。
圖5 為小鼠毛囊干細胞分化為卵母細胞的圖片。
圖6 為小鼠皮膚干細胞分化的卵母細胞檢測圖片。
具體實施方式
下面通過具體實施例和附圖對本發明方法做進一步闡述。
實施例1
一種毛囊干細胞體外分化為卵母細胞的方法,包括將毛囊干細胞誘導分化為原始生殖細胞、將原始生殖細胞再次誘導分化為卵母細胞兩個步驟,其中:
1)將毛囊干細胞誘導分化為原始生殖細胞具體為:
①原始細胞準備:分別提取培養了1代綠色熒光轉移基因小鼠的毛囊干細胞與野生型小鼠成纖維細胞,并將野生型小鼠成纖維細胞采用絲裂霉素C處理,然后將毛囊干細胞與處理后的成纖維細胞按照質量比1:1的比例混合后待用;
②選用DMEM高糖培養基作為原始生殖細胞誘導培養基,并在該培養基內加入以培養基內DMEM高糖總質量計8%質量分數的胎牛血清、40 mIU/ml促卵泡素、80 IU/ml白血病抑制因子、15ng/ml骨形態發生因子、0.20 mmol/L丙酮酸鈉、0.08 mmol/L非必需氨基酸,1.5 mmol/L L-谷氨酰胺,0.08 mmol/L β-巰基乙醇, 8ng/ml表皮生長因子, 15ng/ml堿性成纖維細胞生長因子, 30ng/ml干細胞生長因子;培養溫度35℃,濕度80%;環境中CO2濃度4%;
③將步驟①獲得的待用混合細胞植入步驟②準備的原始生殖細胞誘導培養基,然后將培養基放置在培養箱中,按常規方式進行培養8天,即獲得誘導分化出的原始生殖細胞;
2)將原始生殖細胞誘導分化為卵母細胞具體為:
①準備卵母細胞誘導培養基:選用DMEM/F12培養基作為卵母細胞誘導培養基,并在培養基內加入以培養基內DMEM/F12總質量計12%質量分數的胎牛血清、0.8%質量分數的抗T細胞免疫毒素ITS、0.8%質量分數的青鏈霉素、1.5%質量分數的血清替代物B27、1200 IU/ml白細胞抑制因子LIF、40 mIU/ml促卵泡素、8ng/ml表皮生長因子、0.08 mmol/L β-巰基乙醇;培養溫度35℃,濕度80%;環境中CO2濃度4%;
②將1)中步驟③獲得的原始生殖細胞稀釋至0.8×106個/L,然后植入24孔板表面并放置在步驟①獲得的卵母細胞誘導培養基中懸浮培養,培養20天后,通過常規方法檢測出現尺寸不低于50μm的大細胞,且該類大細胞呈現典型卵母細胞形態、有類似透明帶結構出現、表達卵母細胞特異基因,則所述大細胞為所需卵母細胞。
實施例2
一種毛囊干細胞體外分化為卵母細胞的方法,包括將毛囊干細胞誘導分化為原始生殖細胞、原始生殖細胞專向培養、將原始生殖細胞再次誘導分化為卵母細胞三個步驟,其中:
1)將毛囊干細胞誘導分化為原始生殖細胞具體為:
①原始細胞準備:分別提取培養了2代綠色熒光轉移基因小鼠的毛囊干細胞與野生型小鼠成纖維細胞,并將野生型小鼠成纖維細胞采用絲裂霉素C處理,然后將毛囊干細胞與處理后的成纖維細胞按照數量比1:1的比例混合后待用;
②選用DMEM高糖培養基作為原始生殖細胞誘導培養基,并在該培養基內加入以培養基內DMEM高糖總質量計12%質量分數的胎牛血清、60 mIU/ml促卵泡素、120IU/ml白血病抑制因子、25ng/ml骨形態發生因子、0.25 mmol/L丙酮酸鈉、0.12 mmol/L非必需氨基酸,2.5 mmol/L L-谷氨酰胺,0.12 mmol/L β-巰基乙醇, 12ng/ml表皮生長因子, 25ng/ml堿性成纖維細胞生長因子, 50ng/ml干細胞生長因子;培養,溫度38℃,濕度85%;環境中CO2濃度6%;
③將步驟①獲得的待用混合細胞植入步驟②準備的原始生殖細胞誘導培養基,然后將培養基放置在培養箱中,按常規方式進行培養10天,即獲得誘導分化出的原始生殖細胞;
2)原始生殖細胞專向培養,具體為:
將1)中步驟③獲得的原始生殖細胞放入專向培養基內進行培養,所述專向培養基具體為:以DMEM高糖培養基作為基礎,其內添加以培養基內DMEM高糖總質量計8%質量分數的胎牛血清、15ng/ml骨形態發生因子、0.20 mmol/L丙酮酸鈉、0.08 mmol/L非必需氨基酸,1.5 mmol/L L-谷氨酰胺,0.08 mmol/L β-巰基乙醇, 15ng/ml表皮生長因子, 30ng/ml堿性成纖維細胞生長因子, 30ng/ml干細胞生長因子;培養時間3天,溫度35℃,濕度80%;環境中CO2濃度4%;經過一定時間專向培養后可獲得更加純化、數量更多、形態更佳的原始生殖細胞。
3)將原始生殖細胞誘導分化為卵母細胞具體為:
①準備卵母細胞誘導培養基:選用DMEM/F12培養基作為卵母細胞誘導培養基,并在培養基內加入以培養基內DMEM/F12總質量計18%質量分數的胎牛血清、2.5%質量分數的血清替代物B27、1.2%質量分數的青鏈霉素、1.2%質量分數的抗T細胞免疫毒素ITS、以培養基內DMEM/F12總體積計1800 IU/ml白細胞抑制因子LIF、60 mIU/ml促卵泡素、12ng/ml表皮生長因子、0.12 mmol/L β-巰基乙醇;培養溫度38℃,濕度85%;環境中CO2濃度6%;
②將2)中獲得的原始生殖細胞稀釋至1.2×106個/L,然后植入24孔板表面并放置在步驟①獲得的卵母細胞誘導培養基中懸浮培養,培養25天,通過常規方法檢測出現尺寸不低于50μm的大細胞,且該類大細胞呈現典型卵母細胞形態、有類似透明帶結構出現、表達卵母細胞特異基因,則所述大細胞為所需卵母細胞。
實施例3
大體與實施例2相同,其差別在于:
2)原始生殖細胞專向培養,具體為:
將1)中步驟③獲得的原始生殖細胞放入專向培養基內進行培養,所述專向培養基具體為:以DMEM高糖培養基作為基礎,其內添加以培養基內DMEM高糖總質量計12%質量分數的胎牛血清、以培養基內DMEM高糖總體積計25 ng/ml骨形態發生因子、0.25 mmol/L丙酮酸鈉、0.12 mmol/L非必需氨基酸,2.5mmol/L L-谷氨酰胺,0.12 mmol/L β-巰基乙醇, 25ng/ml表皮生長因子, 50 ng/ml堿性成纖維細胞生長因子, 50ng/ml干細胞生長因子;培養時間5天,溫度38℃,濕度85%;環境中CO2濃度6%;經過一定時間專向培養后可獲得更加純化、數量更多、形態更佳的原始生殖細胞。
實施例4
本實施例為了更詳細地闡述本發明的毛囊干細胞體外分化為卵母細胞的方法,結合圖片、具體操作流程、用到的器具、具體藥品的來源等,將方法的步驟更加詳細地描述如下:
1、小鼠毛囊干細胞的分離培養
小鼠毛囊干細胞(HFSC)來源于新生7天,綠色熒光轉基因小鼠的觸須部毛囊。用手術鑷子將出生后7天小鼠毛囊從觸須部皮膚上取下(圖1中(1)),轉移至磷酸鹽緩沖液(PBS,pH 7.0)+10% 胎牛血清(FBS)的操作液中,去掉與毛囊連接在一起的皮脂腺,立毛肌,脂肪等雜質并在新鮮DMEM/F-12中洗3次,置于0.25% Trypsin-0.04% EDTA,37℃消化10分鐘,輕輕吹打混勻后加入10%血清終止消化,于DMEM/F-12中洗3遍,過400目細胞篩后轉入毛囊干細胞培養基培養,毛囊干細胞培養基包含DMEM/F12;2%血清替代物 B27;20ng/ml 表皮生長因子;40ng/ml堿性成纖維細胞生長因子;1% 青鏈霉素,以培養當天為零代,每4天傳代一次。圖1中(2)是剛培養的皮膚干細胞懸液,圖1中(3)是培養2天的毛囊干細胞,可見此時毛囊干細胞克隆球邊緣清晰,結構緊湊。毛囊干細胞經過傳代培養后,雜細胞數目減少,干細胞克隆球數目也越來越多(圖1中(4))。對培養的毛囊干細胞進行CD34表達分析,結果顯示,培養的毛囊干細胞中CD34陽性細胞比例達到85.5%(圖2)。
2、小鼠原始生殖細胞(PGC)的誘導
收集1-2代的毛囊干細胞克隆球,用0.25% Trypsin消化,室溫消化過程中吹打至單細胞,用10%胎牛血清終止消化,收集細胞,1500rpm離心5min;棄上清,加入少量原始生殖細胞誘導培養基懸浮細胞,將細胞稀釋到細胞濃度為5×104個/ml 原始生殖細胞誘導培養基里;
取1-3代成纖維細胞,倒掉培養基,加入4ml含有10μg絲裂霉素C的成纖維細胞培養基,置于培養箱中1.5-2小時,取出用磷酸鹽緩沖液洗5遍,用0.25% Trypsin將貼壁的成纖維細胞消化下來,洗滌后加入原始生殖細胞誘導培養基并稀釋至5×104個/ml,將兩種細胞混合液按體積1:1混合,加入到原始生殖細胞誘導培養基中并置于37℃、飽和濕度、5%CO2中培養,原始生殖細胞誘導培養基包括:DMEM高糖為基質, 10%質量分數的胎牛血清, 50 mIU/ml促卵泡素,100 IU/ml 白血病抑制因子,20 ng/ml 骨形態發生因子(BMP-4), 0.23 mmol/L 丙酮酸鈉, 0.1 mmol/L 非必需氨基酸, 2 mmol/L L-谷氨酰胺,0.1 mmol/L β-巰基乙醇, 10 ng/ml 表皮生長因子, 20 ng/ml 堿性成纖維細胞生長因子, 40 ng/ml 干細胞生長因子。細胞懸液開始呈懸浮狀態(圖3中(1)),在培養的8-10天,出現折光度大,“亮晶晶”的細胞(圖3中(2)),此時更換原始生殖細胞專向培養基,成分包括:DMEM高糖為基質, 10%質量分數的胎牛血清, 0.23 mmol/L 丙酮酸鈉, 0.1 mmol/L 非必需氨基酸, 2 mmol/L L-谷氨酰胺,0.1 mmol/L β-巰基乙醇, 20 ng/ml 表皮生長因子, 40 ng/ml 堿性成纖維細胞生長因子,20 ng/ml 骨形態發生因子(BMP-4),40 ng/ml 干細胞生長因子(SCF)(加入原始生殖細胞專向培養基后,培養基中原始生殖細胞數目隨著培養時間的增加,數目越來越多(圖3中(3-4))。收集這些分化的原始生殖細胞進行特異基因表達分析顯示,在原始生殖細胞分化的前15天,分化的原始生殖細胞其生殖細胞特異基因表達逐漸升高(圖4)。
3、分化的PGC轉移至卵母細胞誘導培養基
收集分化的PGC并轉移到卵母細胞誘導培養基中,稀釋到1*106個/ml的濃度并置于懸浮24孔板培養(圖5中(1)),卵母細胞誘導培養基成分如下:DMEM/F12為基質,以基質質量分數計15%胎牛血清,2%血清替代物B27,1% 青鏈霉素,1% 抗T細胞免疫毒素ITS,1500 IU/ml 白細胞抑制因子LIF,50 mIU/ml促卵泡素,10ng/ml 表皮生長因子,0.1 mmol/L β-巰基乙醇。誘導分化的第8天左右,會出現一些直徑在30μm-50μm的大細胞(圖5中(2)),在誘導分化的第12天,培養基中會出現眾多直徑在50μm以上的大細胞(圖5中(3)),在卵子誘導第21天時,一些大細胞呈現典型卵母細胞形態,并有類似透明帶結構出現(圖5中(4))。
4、細胞免疫熒光化學檢測分化的卵母細胞特定基因表達
取出分化的卵母細胞,棄培養基,PBS洗2遍,加入4%多聚甲醛室溫固定15分鐘。或PBS洗3遍,每遍5分鐘。用PBST(PBS+0.5%Trition-100)溶液進行透化,室溫10分鐘。PBS(磷酸亞緩沖液,PH 7.0)洗1遍,5分鐘。加入含10%山羊血清或馬血清的PBST(PBS+0.5%Trition-100),室溫封閉30-60分鐘。棄封閉液,加入一抗(1:50-1:200)稀釋于封閉液中,4℃過夜或37℃孵育2小時。1% BSA的PBS洗3遍,每遍5分鐘。加入二抗(1:50-1:200)稀釋于二抗稀釋液中,37℃避光放置1小時。PBS洗3遍,每遍5分鐘。加入終濃度的DAPI,室溫放置5分鐘。PBS洗3遍,每遍5分鐘。加入500μl PBS或PBS甘油(1:1)在熒光顯微鏡下拍照或避光保存。圖6中(1-3)說明分化的卵母細胞呈Dazl陽性并在細胞質表達,圖6中(4-6)說明分化的卵母細胞呈Vasa陽性并在細胞質表達,圖6中(7-9)說明分化的卵母細胞呈ZP-3陽性并在細胞核表達。
對所公開的實施例的上述說明,僅為了使本領域專業技術人員能夠實現或使用本發明。對這些實施例的多種修改對本領域的專業技術人員來說將是顯而易見的,本文中所定義的一般原理可以在不脫離本發明的精神或范圍的情況下,在其它實施例中實現。因此,本發明將不會被限制于本文所示的這些實施例,而是要符合與本文所公開的原理和新穎特點相一致的最寬的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!