一種基于16SrDNA測序的榨菜專用直投式發酵劑定向制備方法與流程
本發明涉及蔬菜加工與食品生物技術領域,具體涉及一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法。
背景技術:
榨菜是中國特產,屬于世界三大醬菜之一。榨菜在中國的種植面積廣,產量高,是主要的腌制加工蔬菜之一。傳統的榨菜鹽漬多采用高鹽濃度、自然發酵為主。傳統的自然發酵存在耗工耗時、發酵周期長、雜菌易污染、產品風味不純、食用安全性差等一系列應用上的弊端。榨菜鹽漬的現代化,是以制作過程的可控性以及標準化、規范化及周年穩定均衡生產為代表的一種生產技術模式,其中采用純菌接種就是其中一個重要環節,即通過人工分離鹽漬蔬菜鹵水中的腸膜明串珠菌、植物乳桿菌、乳酸乳桿菌等主要菌種,經凍干、復配后制作成直投式發酵劑用于榨菜鹽漬。由于直投式發酵劑具有活菌含量高(109~1012cfu/g)、安全性好、保質期長、使用方便、避免菌種退化等特點,且利于標準化生產以及能有效抑制雜菌、縮短發酵周期、降低亞硝酸鹽含量等優點,彌補了榨菜鹽漬自然發酵的諸多不足,可以解決上述弊端,在傳統發酵蔬菜產業中具有廣闊的應用前景。
榨菜的鹽漬過程是微生物的發酵過程。正是利用微生物的發酵原理,榨菜在自然發酵過程中,豐富的微生物菌群對榨菜制品的保藏和形成各自獨特的風味起到很大的作用,榨菜鹽漬過程中乳酸菌代謝產生的高濃度礦物質、乳酸和生物活性物質是構成泡菜獨特風味的重要原因。乳酸發酵是榨菜鹽漬過程中各種發酵作用種的最主要的發酵作用。主要的乳酸菌包括乳桿菌屬、片球菌屬、明串株菌屬、鏈球菌屬、乳球菌屬。在一定程度上,鹽漬榨菜的品質和風味很多程度上是由發酵過程中的乳酸菌菌群決定的。
但由于一些菌群的不可培養性或較差重復性,導致傳統的分離培養方式難以全面、客觀地反映榨菜鹽漬過程中的菌群結構和變化,因此目前根據傳統分離培養所制得的發酵劑生產的榨菜難以真正反映其風味與品質,出現了風味單一、發酵味不醇厚等問題。另外,傳統微生物種類鑒定的方法一般采用表型特征鑒定,但此法存在操作步驟繁瑣、工作量大、周期長、某些檢測結果不穩定等問題。因此,根據不同蔬菜的發酵特性,尋找更為優良、有效的發酵劑制備方法對于傳統蔬菜加工方式意義重大。
隨著生物技術的飛速發展,傳統的微生物鑒定方法常常難以鑒定眾多的生長習性復雜的微生物,因而基于基因組序列的分子鑒定受到廣泛關注。在細菌基因組中,編碼16S rRNA的rDNA基因具有良好的進化保守性,適宜分析的長度(約為1540bp),以及與進化距離相匹配的良好變異性,所以成為細菌分子鑒定的標準標識序列。16S rDNA序列分析的一個顯著特點是能及時鑒定出生長緩慢或生化反應惰性的細菌。
技術實現要素:
本發明針對傳統直投發酵劑存在發酵制品風味單一、發酵風味不醇厚等問題,提出了一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,該方法可定向篩選出主導榨菜鹽漬及榨菜風味、品質的不同乳酸菌屬,特異性和目標導向性強,準確度高,不必反復純化。
為實現本發明的發明目的,發明人提供如下技術方案:
一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,至少包括以下步驟:
(1)于榨菜鹽漬池中取樣,樣品置于無菌冷凍管中,立即放入液氮中保存,然后置于超低溫冰箱中,
(2)提取樣品DNA并做瓊脂糖凝膠電泳檢測后做PCR,擴增16S rDNA,所述的PCR擴增的特異性引物的上游引物515F具有如SEQ ID NO.1所示的核苷酸序列(5’-GTGCCAGCMGCCGCGG-3’),特異性引物的下游引物907R具有如SEQ ID NO.2所示的核苷酸序列(5’-CCGTCAATTCMTTTRAGTTT-3’),PCR擴增區域為微生物16S rDNA的V4-V5可變區域,測序前需對所述PCR產物進行回收純化,
(3)將步驟(2)獲得的PCR產物進行高通量測序并做比對分析,確定優勢菌群種類與組成比例,
(4)優勢菌株的定向篩選,
(5)定向篩選菌株的高密度增殖培養,
(6)離心并冷凍干燥,
將步驟(5)經高密度增值培養的菌液加入脫脂奶粉,搖勻后離心,去除上清培養液,收集試管底部菌體;收集的菌體加入凍干保護劑后做冷凍干燥,其中:菌體與凍干保護劑質量分數配比為1:3-1:2.5,
(7)將步驟(6)得到的各定向篩選和高密度增值培養的菌株冷凍干燥粉按照16S rDNA測序確定的優勢菌群種類與組成比例混合,制得榨菜專用直投式發酵劑。
作為優選方案,根據本發明所述的一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,其中,所述的步驟(1)中取樣采用3點取樣法,采集點分別位于鹽漬池中心、鹽漬池對角線兩點,每處采集3次樣品,采集后混勻。
作為優選方案,根據本發明所述的一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,其中,所述的步驟(4)優勢菌株的定向篩選按如下操作:在所述步驟(1)的所取樣品中,取1ml液體于生理鹽水中進行10倍的梯度稀釋,均勻涂布在定向培養基上,然后在35~37℃恒溫箱中定向培養36~72h,觀察菌落;然后將定向培養的菌株進行生理生化特征鑒定實驗;根據鑒定結果,將定向篩選后的菌株進行斜面培養。
作為優選方案,根據本發明所述的一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,其中,所述的步驟(5)定向篩選菌株的高密度增殖培養按如下步驟操作:將上述步驟(4)定向篩選與純化培養的菌株進行高密度增值培養,高密度增值培養基為MRS瓊脂培養基,培養條件為35~37℃恒溫箱中培養48~72h;所述的MRS瓊脂培養基配方為:蛋白胨10.0克、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐溫801.0毫升、磷酸氫二鉀2.0克、乙酸鈉5.0克、檸檬酸三胺2.0克、硫酸鎂0.2克、硫酸錳0.05克、瓊脂粉15.0克和蒸餾水1升,加熱溶解后,校正pH=6.2~7.2,121℃高壓滅菌15~20分鐘。
作為優選方案,根據本發明所述的一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,其中,所述的步驟(6)中將步驟(5)經高密度增值培養的菌液,加入2.7~3.5%經高溫滅菌的脫脂奶粉,搖勻后以4000-5000rpm轉速于-5~10℃條件下離心25-30分鐘。
作為優選方案,根據本發明所述的一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,其中,所述的步驟(6)中凍干保護劑配方為:脫脂乳25-30克、乳糖10-15克、葡糖糖5-12克、維生素C5-6.5克、D-山梨醇5-7.2克、L-谷氨酸5-6克和蒸餾水250mL;凍干保護劑加熱溶解后,121℃高壓滅菌15-20分鐘后備用。
作為優選方案,根據本發明所述的一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,其中,所述的步驟(6)中冷凍干燥的主要工藝參數為:-50~-70℃預凍12-24h后,-60~80℃凍干24-72h。
與現有技術相比,本發明的有益效果是:
(1)與采用傳統分離培養制備的傳統發酵劑相比,本發明通過高通量測序鑒定微生物菌群的16SrDNA,能準確的獲得榨菜自然發酵后詳細微生物群落結構與組成比例,并確定主要的乳酸菌菌群,從而準確的判斷不同微生物菌群對榨菜自然發酵進程與制品品質的影響。所使用的目標菌種具有多樣性、特異性,避免了傳統發酵劑菌種單一、菌群良莠不齊、非特異性等缺點。
(2)本發明定向制備獲得的榨菜專用發酵劑具有特異性與目標導向性特征。根據不同地方榨菜加工的不同工藝及品質、風味需求,通過配比菌種構成提高發酵效率,產物穩定、亞硝酸鹽含量顯著降低(圖3和圖4),避免了傳統發酵劑發酵過程中所導致的發酵風味不純的缺點。
(3)與傳統篩選方法制備的發酵劑相比,一種基于16S rDNA測序定向制備榨菜專用直投式發酵劑的方法在發酵劑制備過程中,菌種專一性強、活性高,所制得的發酵劑干粉易于儲藏與運輸。
附圖說明
圖1榨菜樣品16S rRNA基因PCR擴增產物瓊脂糖凝膠電泳圖譜。
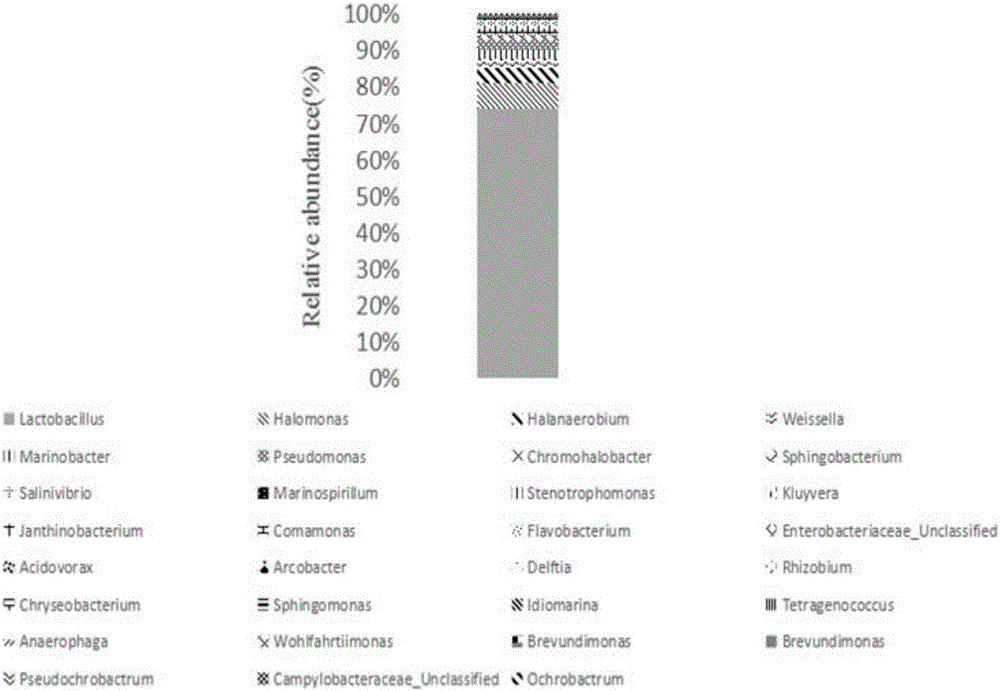
圖2榨菜中細菌在不同分類水平的分布。
圖3自然發酵榨菜中亞硝酸鹽含量柱形圖。
圖4本發明榨菜專用發酵劑的榨菜中亞硝酸鹽含量柱形圖。
具體實施方式
下面結合實施例,更具體地說明本發明的內容。應當理解,本發明的實施并不局限于下面的實施例,對本發明所做的任何形式上的變通和/或改變都將落入本發明保護范圍。
在本發明中,若非特指,所有的份、百分比均為重量單位,所有的設備和原料等均可從市場購得或是本行業常用的。若無特別指明,實施例采用的方法為本領域通用技術。
實施例1
一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法,按以下步驟進行:
(1)于榨菜鹽漬池中取樣,采用3點取樣法,采集點分別位于鹽漬池中心、鹽漬池對角線兩點,每處采集3次樣品。采集后混勻,置于15ml的無菌冷凍管中,立即放入液氮中保存,然后置于-70℃超低溫冰箱中。
(2)將步驟(1)采集的樣品用DNA提取試劑盒提取微生物的脫氧核糖核酸(英文縮寫DNA),所有樣品的DNA提取步驟均參照DNA提取試劑盒說明書。對提取到的樣品基因組DNA進行3%瓊脂糖凝膠電泳檢測(圖1)(3)將步驟(2)提取的DNA用特異性引物進行PCR,擴增微生物的16SrDNA,特異性引物的上游引物515F具有如SEQ ID NO.1所示的核苷酸序列(5’-GTGCCAGCMGCCGCGG-3’)、下游引物907R具有如SEQ ID NO.2所示的核苷酸序列(5’-CCGTCAATTCMTTTRAGTTT-3’),聚合酶鏈式反應(即PCR)擴增區域為微生物16S rDNA的V4-V5可變區域,測序前對所述PCR產物進行回收純化。
(4)將步驟(3)獲得的PCR產物進行高通量測序。篩選測序所得數據并與已有數據庫信息進行序列比對,獲得菌群的可操作分類單元(OTUs);且與現有16S V4-V5數據庫比對。根據標簽序列和reads,榨菜腌漬后乳桿菌屬(Lactobacillus)占有比例為72.7%,分別為:食品乳桿菌(Lactobacillus alimentarius)(核苷酸序列如SEQ ID NO.3所示)、Lactobacillus versmoldensis(核苷酸序列如SEQ ID NO.4所示)、腸膜明串珠菌(Leuconostoc mesenteroides)(核苷酸序列如SEQ ID NO.5所示)、植物乳桿菌(Lactobacillus plantarum)(核苷酸序列如SEQ ID NO.6所示)、短乳桿菌(Lactobacillus brevis)(核苷酸序列如SEQ ID NO.7所示),比例分別為:22.7%、37%、8%、2.6%、2.4%(圖2)。
(5)食品乳桿菌(Lactobacillus alimentarius)、Lactobacillus versmoldensis、腸膜明串珠菌(Leuconostoc mesenteroides)、植物乳桿菌(Lactobacillus plantarum)、短乳桿菌(Lactobacillus brevis)的定向篩選:
(5.1)食品乳桿菌(Lactobacillus alimentarius)的定向篩選:在上述步驟(1)的所取樣品中,取1ml液體于生理鹽水中進行10倍的梯度稀釋,均勻涂布在MRS培養基,然后在35~37℃恒溫箱中培養48~72h,觀察菌落。挑選出呈乳白色、不透明、圓形光滑的單菌落,進行斜面培養48~72h;接入液體MRS培養基培養48~60h。MRS瓊脂培養基配方為:蛋白胨10.0克、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐溫801.0毫升、磷酸氫二鉀2.0克、乙酸鈉5.0克、檸檬酸三胺2.0克、硫酸鎂0.2克;硫酸錳0.05克、瓊脂粉15.0克和蒸餾水1升;加熱溶解后,校正pH為6.2,121℃高壓滅菌15~20分鐘。
將篩選的菌株進行生理生化鑒定實驗,符合以下結果:
(5.2)Lactobacillus versmoldensis的定向篩選:在上述步驟(1)的所取樣品中,取1ml液體于生理鹽水中進行10倍的梯度稀釋,均勻涂布在MRS培養基,然后在36~37℃恒溫箱中培養48~72h,觀察菌落。挑選出呈乳白色、不透明、圓形光滑的單菌落,進行斜面培養48~72h;接入液體MRS培養基培養48~72h。MRS瓊脂培養基配方為:蛋白胨10.0克、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐溫801.0毫升、磷酸氫二鉀2.0克、乙酸鈉5.0克、檸檬酸三胺2.0克、硫酸鎂0.2克;硫酸錳0.05克、瓊脂粉15.0克和蒸餾水1升;加熱溶解后,校正pH為6.2,121℃高壓滅菌15~20分鐘。
將活化后的菌株,按3%接種量接種于膽鹽質量濃度分別為0、0.3、0.6g/l的MRS液體培養基中,37℃厭氧培養16h。然后篩選進行生理生化鑒定實驗,符合以下結果:
(5.3)腸膜明串珠菌(Leuconostoc mesenteroides)的定向篩選:取步驟(1)中1ml液體于生理鹽水中進行10倍的梯度稀釋,均勻涂布在YGPB培養基上,然后挑取典型菌落于YGPB培養基上平板上劃線,并置于25℃培養箱中厭氧培養2~3天,觀察菌落生長狀況。YGPB培養基配方為:葡萄糖10g、蛋白胨10g、牛肉浸膏8g、酵母浸膏3g、NaCl 5g、磷酸二氫鉀2.5g、磷酸氫二鉀2.5g、硫酸鎂0.2克;硫酸錳0.05克、pH6.8,瓊脂粉15.0克和蒸餾水1升;加熱溶解后,校正pH為6.2,121℃高壓滅菌15~20分鐘。
將篩選的菌株進行生理生化實驗,符合以下結果:
(5.4)植物乳桿菌(Lactobacillus plantarum)的定向篩選:在上述步驟(1)的所取樣品中,取1ml液體于生理鹽水中進行10倍的梯度稀釋,均勻涂布在定向MRS培養基上,于35~37℃恒溫箱中培養48~72h,觀察菌落,挑選出有溶鈣圈、呈乳白色、不透明、圓形光滑的單菌落,在MRS平板上劃線培養48~72h;斜面培養后,接入液體培養MRS培養48~72h。MRS瓊脂培養基配方為:蛋白胨10.0克、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐溫801.0毫升、磷酸氫二鉀2.0克、乙酸鈉5.0克、檸檬酸三胺2.0克、硫酸鎂0.2克;硫酸錳0.05克、1%碳酸鈣、0.05‰的納他霉素、瓊脂粉15.0克和蒸餾水1升;加熱溶解后,校正pH為6.2,121℃高壓滅菌15~20分鐘。
將篩選的菌株進行生理生化實驗,符合以下結果:
(5.5)短乳桿菌(Lactobacillus brevis)的定向篩選:在上述步驟(1)的所取樣品中,取1ml液體于生理鹽水中進行10倍的梯度稀釋,均勻涂布在MRS改良培養基,然后在37℃恒溫箱中培養48h,觀察菌落,挑選出呈乳白色、不透明、圓形光滑的單菌落,在MRS改良培養基平板上劃線培養48h。斜面培養后,接入液體MRS改良培養基中培養72h。MRS改良培養基配方為:葡萄糖20g,蛋白胨10g,牛肉膏10g,酵母膏5g,檸檬酸氫二銨2g和蒸餾水1000ml。溶解后,校正pH為6.5,121℃高壓滅菌15~20分鐘。
將篩選的菌株進行生理生化實驗,符合以下結果:
(6)定向篩選菌株的高密度增殖培養。將步驟(5)定向篩選與純化培養的食品乳桿菌、Lactobacillus versmoldensis、腸膜明串珠菌、植物乳桿菌和短乳桿菌進行高密度增值培養,高密度增值培養基為MRS瓊脂培養基,培養條件為35~37℃恒溫箱中培養64~72h。MRS瓊脂培養基配方為:蛋白胨10.0克、牛肉膏5.0克、酵母粉4.0克、葡萄糖20.0克、吐溫801.0毫升、磷酸氫二鉀2.0克、乙酸鈉5.0克、檸檬酸三胺2.0克、硫酸鎂0.2克、硫酸錳0.05克、瓊脂粉15.0克和蒸餾水1升;加熱溶解后,校正pH為6.2,121℃高壓滅菌15~20分鐘。
(7)定向篩選菌株的收集:將步驟(6)得到的經高密度增值培養的菌液,加入3.5%經高溫滅菌的脫脂奶粉,搖勻后以5000rpm轉速于-5℃條件下離心30分鐘,去除上清培養液,收集試管底部菌體。
(8)直投式發酵劑的冷凍干燥。將步驟(7)收集的菌體加入凍干保護劑,凍干保護劑配方為:脫脂乳30克、乳糖15克、葡糖糖12克、維生素C6.5克、D-山梨醇7.2克、L-谷氨酸6克和蒸餾水250mL。凍干保護劑加熱溶解后,121℃高壓滅菌20分鐘。菌體與凍干保護劑質量分數配比為1:3。冷凍干燥條件為:-70℃預凍24h后,-80℃凍干24h。
(9)榨菜專用直投式發酵劑的制備。按照16S rDNA測序結果所確認的乳酸菌的組成,將上述的凍干的食品乳桿菌(Lactobacillus alimentarius)、Lactobacillus versmoldensis、腸膜明串珠菌(Leuconostoc mesenteroides)、植物乳桿菌(Lactobacillus plantarum)、短乳桿菌(Lactobacillus brevis)按照22.7%、37%、8%、2.6%、2.4%比例混合,制得榨菜專用直投式發酵劑。經檢測,活菌含量為109~1012cfu/g。
將本發明制得的榨菜專用直投式發酵劑用于榨菜鹽漬,與自然發酵的榨菜比較,風味一致,而亞硝酸鹽含量明顯降低;同時采用本發明的榨菜專用直投式發酵劑用于榨菜鹽漬,具有產物穩定的特點,避免了傳統發酵劑發酵過程中所導致的發酵風味不純的缺點。本發明榨菜專用直投式發酵劑制得的榨菜與自然發酵榨菜中亞硝酸鹽含量比較,結果如圖3和圖4所示。可以看出,本發明的榨菜專用直投式發酵劑能顯著降低榨菜中亞硝酸鹽的含量,亞硝酸鹽含量幾乎只有自然發酵的一半。這是由于自然發酵菌群較為復雜,短時期內難以形成優勢菌群且產酸速度慢而直接影響對有害微生物的抑制;本發明的榨菜專用直投式發酵劑則能在短時期內迅速形成優勢菌群并快速產酸而使有害微生物得到有效抑制,因此使有害微生物對硝酸鹽的還原作用能力大為削弱,抑制和減少了亞硝酸鹽的生成。
實施例2
其他同實施例1,不同之處在于:
步驟(7):將步驟(6)得到的經高密度增值培養的菌液,加入2.7%經高溫滅菌的脫脂奶粉,搖勻后以4000rpm轉速于10℃條件下離心25分鐘,去除上清培養液,收集試管底部菌體。
步驟(8)直投式發酵劑的冷凍干燥。將步驟(7)收集的菌體加入凍干保護劑,凍干保護劑配方為:脫脂乳25克、乳糖10克、葡糖糖5克、維生素C5克、D-山梨醇5克、L-谷氨酸5克和蒸餾水250mL;凍干保護劑加熱溶解后,121℃高壓滅菌15分鐘后備用。菌體與凍干保護劑質量分數配比為1:2.5。冷凍干燥條件為:-50℃預凍12h后,-60℃凍干72h。
經檢測,本實施例與實施例1達到同樣技術效果,不再贅述。
SEQUENCE LISTING
<110> 浙江省農業科學院
<120> 一種基于16S rDNA測序的榨菜專用直投式發酵劑定向制備方法
<130> Z164859
<160> 7
<170> PatentIn version 3.3
<210> 1
<211> 16
<212> DNA
<213> 人工序列
<400> 1
gtgccagcmg ccgcgg 16
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
ccgtcaattc mtttragttt 20
<210> 3
<211> 450
<212> DNA
<213> Lactobacillus alimentarius
<400> 3
gtagggaatc ttccacaatg gacgaaagtc tgatggagca atgccgcgtg agtgaagaag 60
gttttcggat cgtaaaactc tgttgttgaa gaagaacata tgtgagagta actgttcacg 120
tactgacggt attcaaccag aaagccacgg ctaactacgt gccagcagcc gcggtaatac 180
gtaggtggca agcgttgtcc ggatttattg ggcgtaaaga gaatgtaggc ggttcattaa 240
gtttgaagtg aaagccctcg gctcaaccga ggaagtgctt cgaaaactgg tgaacttgag 300
tgcagaagag gaaagtggaa ctccatgtgt agcggtggaa tgcgtagata tatggaagaa 360
caccagtggc gaaggcggct ttctggtctg taactgacgc tgagattcga aagcatgggt 420
agcaaacagg attagaaacc cgagtagtcc 450
<210> 4
<211> 451
<212> DNA
<213> Lactobacillus versmoldensis
<400> 4
gtagggaatc ttccacaatg gacgaaagtc tgatggagca acgccgcgtg agtgaagaag 60
gttttcggat cgtaaaactc tgttgttgaa gaagaacatg cgtgagagta actgttcatg 120
tattgacggt attcaaccag aaagccacgg ctaactacgt gccagcagcc gcggtaatac 180
gtaggtggca agcgttatcc ggatttattg ggcgtaaagc gagtgcaggc ggtttattag 240
gtctgatgtg aaagccctcg gctcaaccga ggaagtgcat cggaaaccgg taaacttgag 300
tgcagaagag gagagtggaa ctccatgtgt agcggtggaa tgcgtagata tatggaagaa 360
caccagtggc gaaggcggct ctctggtctg taactgacgc tgaggctcga aagcgtgggt 420
agcaaacagg attagaaacc cgagtagtcc g 451
<210> 5
<211> 450
<212> DNA
<213> Leuconostoc mesenteroides
<400> 5
gtagggaatc ttccacaatg ggcgaaagcc tgatggagca acgccgcgtg tgtgatgaag 60
gctttcgggt cgtaaagcac tgttgtatgg gaagaaaagt taaggtaggg aatgacctta 120
gcctgacggt accataccag aaagggacgg ctaaatacgt gccagcagcc gcggtaatac 180
gtatgtcccg agcgttatcc ggatttattg ggcgtaaagc gagcgcagac ggttggttaa 240
gtctgatgtg aaagcccgga gctcaactcc ggaaaggcat tggaaactgg ttaacttgag 300
tgcagtagag gtaagtggaa ctccatgtgt agcggtggaa tgcgtagata tatggaagaa 360
caccagcggc gaaggcggct tactggactg taactgacgt tgaggctcga aagtgtgggt 420
agcaaacagg attagatacc ctagtagtcc 450
<210> 6
<211> 450
<212> DNA
<213> Lactobacillus plantarum
<400> 6
gtagggaatc ttccacaatg gacgaaagtc tgatggagca acgccgcgtg agtgaagaag 60
gttttcggat cgtaaaactc tgttgttgga gaagaatgta tctgatagta actgatcagg 120
tagtgacggt atccaaccag aaagccacgg ctaactacgt gccagcagcc gcggtaatac 180
gtaggtggca agcgttgtcc ggatttattg ggcgtaaagc gagcgcaggc ggtttcttaa 240
gtctgatgtg aaagccttcg gctcaaccga agaagtgcat cggaaactgg gaaacttgag 300
tgcagaagag gacagtggaa ctccatgtgt agcggtgaaa tgcgtagata tatggaagaa 360
caccagtggc gaaggcggct gtctggtctg taactgacgc tgaggctcga aagcatgggt 420
agcaaacagg attagaaacc ctagtagtcc 450
<210> 7
<211> 450
<212> DNA
<213> Lactobacillus brevis
<400> 7
gtagggaatc ttccacaatg gacgaaagtc tgatggagca atgccgcgtg agtgaagaag 60
ggtttcggct cgtaaaactc tgttgttaaa gaagaacact cttgagagta actgttcagg 120
agttgacggt atttaaccag aaagccacgg ctaactacgt gccagcagcc gcggtaatac 180
gtaggtggca agcgttgtcc ggatttattg ggcgtaaagc gagcgcaggc ggtttcttaa 240
gtctgatgtg aaagccttcg gcttaaccgg agaagtgcat cggaaactgg gagacttgag 300
tgcagaagag gacagtggaa ctccatgtgt agcggtggaa tgcgtagata tatggaagaa 360
caccagtggc gaaggcggct gtctagtctg taactgacgc tgaggctcga aagcatgggt 420
agcaaacagg attagatacc cttgtagtcc 450
- 還沒有人留言評論。精彩留言會獲得點贊!