用于檢測COX?1、COX?2和GPIIIa基因多態性的核酸、試劑盒及方法與流程
本發明屬于生物技術領域,具體涉及一種用于檢測COX-1、COX-2和GPIIIa基因多態性的核酸、試劑盒及方法。
背景技術:
單核苷酸多態性(Single Nucleotide Polymorphisms,SNP)是指在基因組上單個核苷酸的變異(包括置換、顛換、缺失和插入)形成的遺傳標記,相比微衛星分子標記,其數量多,多態性豐富。一般而言,SNP是指變異頻率大于1%的單核苷酸變異。在人類基因組中大概每1000個堿基就有一個SNP,人類基因組上的SNP總量大概是3×106個。因此,SNP成為第三代遺傳標志,人體許多表型差異、對藥物敏感度或疾病的易感性等都可能與SNP有關。
隨著我國人口老齡化,心腦血管病發病率逐年攀升,心腦血管疾病早已成為人類健康的第一大殺手,心腦血管疾病的高致死率、致殘率和復發率已造成了極大的社會負擔和經濟負擔。抗血小板藥物(尤其是阿司匹林)在心腦血管病的防治中起著至關重要的作用,但是目前的調查結果表明很多心腦血管病患者即使服用了抗血小板藥物,仍然反復再發卒中,這種現象稱為抗血小板藥物抵抗。
抗血小板藥物抵抗與諸多因素相關,如心腦血管病的相關危險因素(糖尿病、代謝綜合征、急性冠脈綜合征疾病等),患者依從性或藥物劑量,藥物相互作用及基因多態性等。其中基因多態性因素是目前研究熱點。阿司匹林在體內主要是通過與內皮細胞環氧酶(Cyclooxygenase,COX)的結合使其失活,從而抑制血栓素A2(TXA2)和前列環素(PGI2)的產生,達到抗血小板的作用。既往研究發現,在體內影響阿司匹林作用的多個環節因子存在基因多態性,這種多態性直接影響其功能,從而使得不同個體服用阿司匹林后,對血小板的反應不同。據不完全統計,臨床阿司匹林抵抗的患者高達40%。阿司匹林作為缺血性腦血管疾病二級預防的重要藥物,盡快明確阿司匹林抵抗相關基因多態性至關重要。
COX有兩種同工酶,即COX-1和COX-2。COX-l主要在成熟血小板表達,阿司匹林通過乙酰化COX-1活性位點530位的絲氨酸,不可逆抑制COX-1的活性,從而阻斷血栓素A2(TXA2)介導的血小板活化,用于預防血栓性血管事件的發生。研究發現COX-1常見的4個多態性位點與阿司匹林抵抗的關系,發現SNP中A842G與阿司匹林抵抗有關,在用AA誘導測血小板聚集率時,阿司匹林抵抗患者中攜帶G等位基因的頻率,要遠高于阿司匹林敏感者,用PFA-100測血小板功能時,攜帶G等位基因的患者,有著更短的閉孔時間。COX-2為誘導型酶,生理情況下,在大多數組織和細胞中檢測不到,離體情況下,許多刺激物,如生長因子、炎性細胞因子腫瘤誘導劑等可刺激細胞的COX-2表達。COX-2在動脈粥樣斑塊中表達,阿司匹林劑量需要達到抑制COX-1劑量的170倍,才能阻斷COX-2,小劑量阿司匹林不能完全抑制COX-2誘導的TXA2生成,也是阿司匹林抵抗的原因之一。COX-2基因啟動子-765G>C多態位點研究表明GC雜合基因攜帶者與GG純合基因攜帶者相比較,前者對阿司匹林藥效不敏感的概率是后者的3.872倍。
血小板膜糖蛋白(Glycoprotein IIIa,GPIIIa)是主要的血小板整合素和激活劑,它是一種跨膜的糖蛋白復合物。其作用是作為受體,介導纖維蛋白原結合于血小板表面及隨后的血小板聚集。GPIIIa基因編碼的PLA存在多態性,表現為PLA1/A1和PLA2/A2純合型、PLA1/A2雜合型。超過30%的心血管病患者為PLA2/A2純合型,許多研究證實PLA2/A2純合型與血小板活性增強有關,此型患者應用阿司匹林之后的抗血小板作用較差,說明此種單核苷酸多態性可能促成阿司匹林抵抗。迄今已發現5種GPIIIa的多態性,較為常見的是外顯子2第1565位氨基酸的突變,即T1565C(Leu33/Pro,rs5918),分別決定了PLA1和PLA2兩種等位基因,編碼Leu的位點稱為PLA1,編碼蛋白的位點稱為PLA2。
目前,針對基因多態性檢測的方法有多種,最簡單的方法是PCR-RFLP,但該方法操作復雜,樣本多時易造成PCR產物的交叉污染,且容易出現酶切不充分或酶切過度而出現假陰性或假陽性的結果,可靠性低。DNA測序法雖然是金標準,但步驟繁瑣,過程復雜,容易出現樣本間的交叉污染而導致測序失敗,另外測序儀價格超出了一般臨床檢驗實驗室的承受范圍。高分辨率溶解曲線法,快速,簡便,經濟實用,但是受儀器溫度控制,假陽性高。
技術實現要素:
為克服以上現有檢測技術的不足,本發明的提供了一組用于檢測COX-1、COX-2和GPIIIa基因多態性的核酸。本發明的另一個目的是提供一種用于檢測COX-1、COX-2和GPIIIa基因多態性的試劑盒及其檢測方法,該試劑盒及其檢測方法具有高靈敏度、高特異性、高準確度、高精確度、操作方法簡單等優點。
為實現上述目的,本發明采用以下技術方案:
一組用于檢測COX-1、COX-2和GPIIIa基因多態性的核酸,該核酸包括以下的引物對和檢測探針:
COX-1基因A842G野生型引物對:核苷酸序列如SEQ ID NO.1和SEQ ID NO.3所示;
COX-1基因A842G突變型引物對:核苷酸序列如SEQ ID NO.2和SEQ ID NO.3所示;
COX-1基因A842G檢測探針:核苷酸序列如SEQ ID NO.4所示;
COX-2基因G-765C野生型引物對:核苷酸序列如SEQ ID NO.5和SEQ ID NO.7所示;
COX-2基因G-765C突變型引物對:核苷酸序列如SEQ ID NO.6和SEQ ID NO.7所示;
COX-2基因G-765C檢測探針:核苷酸序列如SEQ ID NO.8所示;
GPIIIa基因T1565C野生型引物對:核苷酸序列如SEQ ID NO.9和SEQ ID NO.11所示;
GPIIIa基因T1565C突變型引物對:核苷酸序列如SEQ ID NO.10,和SEQ ID NO.11所示;
GPIIIa基因T1565C檢測探針:核苷酸序列如SEQ ID NO.12所示;
如上所述的核酸,優選的,所述核酸還包括內部質控,所述內部質控包括質控引物對和質控探針,所述質控引物對的核苷酸序列如SEQ ID No.13和SEQ ID No.14所示,所述質控探針的核苷酸序列如SEQ ID No.15所示。
如上所述的核酸,優選的,所述核酸還包括如下陽性對照物:
COX-1基因A842G野生型陽性對照物:含有如SEQ ID No.16所示的核苷酸序列;
COX-1基因A842G突變型陽性對照物:含有如SEQ ID No.17所示的核苷酸序列;
COX-2基因G-765C野生型陽性對照物:含有如SEQ ID No.18所示的核苷酸序列;
COX-2基因G-765C突變型陽性對照物:含有如SEQ ID No.19所示的核苷酸序列;
GPIIIa基因T1565C野生型陽性對照物:含有如SEQ ID No.20所示的核苷酸序列;
GPIIIa基因T1565C突變型陽性對照物:含有如SEQ ID No.21所示的核苷酸序列;
和質控陽性對照物:含有如SEQ ID No.22所示的核苷酸序列。
一種用于檢測COX-1、COX-2和GPIIIa基因多態性的試劑盒,該試劑盒用于實時熒光PCR檢測COX-1基因A842G位點、COX-2基因G-765C位點和GPIIIa基因T1565C位點的野生型和突變型,所述試劑盒包括如上所述的核酸,其中,各檢測探針的5'端連接熒光基團,3'端連接淬滅基團,或/和質控探針的5'端連接有不同于所述檢測探針的熒光基團,3'端連接有不同于所述檢測探針的淬滅基團。
如上所述的試劑盒,優選地,所述試劑盒還包括:PCR緩沖液、DNA聚合酶、dNTPs、礦物油、陰性對照物:水。
如上所述的試劑盒,優選地,所述熒光基團為FAM、JOE、CY3、HEX中任意一種,所述淬滅基團為MGB、BHQ1、TAMRA、BHQ2中任意一種。
一種檢測COX-1、COX-2和GPIIIa基因多態性的方法,該方法包括以下步驟:
(1)從樣品中提取DNA;
(2)對提取的所述DNA,同時進行COX-1、COX-2和GPIIIa基因的野生型體系和突變型體系的實時熒光PCR擴增;其中,在COX-1、COX-2和GPIIIa基因的野生型體系中含如上各基因的野生型引物對和對應的檢測探針;在COX-1、COX-2和GPIIIa基因的反突變型體系中含如上各基因所述突變型引物對和對應的檢測探針,各檢測探針的5'端連接有熒光基團,3'端連接有淬滅基團;
(3)收集熒光信號,選擇對應熒光基團的熒光檢測模式,基線調整取3~15個循環的熒光信號,以閾值線剛好超過正常陰性對照的最高點設定閾值線;
(4)結果判定:待測樣品的所述COX-1、COX-2和GPIIIa基因的野生型反應體系和突變型反應體系的熒光信號,達到設定閾值所需的循環次數Ct值的差值ΔCt值來確定樣本中含COX-1、COX-2和GPIIIa基因的基因型。
如上所述的方法,優選地,在步驟(2)中,COX-1、COX-2和GPIIIa基因的所述野生型體系和所述突變型體系中均還包括有作為內部質控的質控引物對和質控探針,所述質控引物對的核苷酸序列如SEQ ID No.13和SEQ ID No.14所示,所述質控探針的核苷酸序列如SEQ ID No.15所示,該質控探針的5'端連接有不同于所述探針的熒光基團,3'端連接有不同于所述探針的淬滅基團。
如上所述的方法,優選地,在步驟(2)中,在所述野生型體系和所述突變型體系中,各條引物和探針的終濃度為100-1000nmol/L;所述熒光基團為FAM、JOE、CY3、HEX中任意一種,所述淬滅基團為MGB、BHQ1、TAMRA、BHQ2中任意一種。
如上所述的方法,優選地,步驟(2)中,所述實時熒光PCR擴增的反應程序為:
第一階段:95℃5min;
第二階段:95℃5s,58℃30s,10個循環;
第三階段:95℃5s,58℃30s,72℃30s,30個循環;
第三階段:30個循環中72℃時,收集熒光信號。
如上所述的方法,優選地,所述檢測探針的5'端連接FAM,3'端連接MGB,所述質控探針的5'端連接JOE,3'端連接BHQ1;
步驟(4)中,所述確定樣本DNA的各基因型,各基因對應的野生型反應體系與突變型反應體系的Ct值按照如下計算確定樣本類型:
ΔCt=|野生型Ct值-突變型Ct值|≤2.5為雜合型樣本;
ΔCt=野生型Ct值-突變型Ct值>2.5為突變型樣本;
ΔCt=突變型Ct值-野生型Ct值>2.5為野生型樣本。
如上所述的方法,優選地,在步驟(2)中,還設有陽性對照和陰性對照,所述陽性對照是分別將含有如SEQ ID No.16所示的核苷酸序列的COX-1基因A842G野生型陽性對照物;含有如SEQ ID No.17所示的核苷酸序列的COX-1基因A842G突變型陽性對照物;含有如SEQ ID No.18所示的核苷酸序列的COX-2基因G-765C野生型陽性對照物;含有如SEQ ID No.19所示的核苷酸序列的COX-2基因G-765C突變型陽性對照物;含有如SEQ ID No.20所示的核苷酸序列的GPIIIa基因T1565C野生型陽性對照物;含有如SEQ ID No.21所示的核苷酸序列的GPIIIa基因T1565C突變型陽性對照物為模板,加入各自基因對應的反應體系中進行檢測;同時在該各自基因對應的反應體系均加入含有如SEQ ID No.22所示的核苷酸序列的質控陽性對照物;進行所述野生型體系和突變型體系的實時熒光PCR擴增;所述陰性對照為以無核酸酶水為模板,進行各自基因的所述野生型體系和突變型體系的實時熒光PCR擴增;
在步驟(4)中,所述陽性對照的野生型體系和突變型體系的FAM均有明顯的擴增曲線,JOE有明顯的擴增曲線且JOE信號的Ct值小于25,符合要求,檢測結果可靠;所述陰性對照的野生型體系和突變型體系的FAM都沒有明顯的擴增曲線,符合要求,檢測結果可靠,否則應重新配置檢測體系,重新進行檢測。
本發明提供了一組用于檢測COX-1、COX-2和GPIIIa基因多態性的核酸及試劑盒,同時建立具有特異性強、靈敏度高、準確度高、操作簡單的檢測COX-1、COX-2和GPIIIa基因多態性的檢測方法,其檢測結果為阿司匹林抵抗提供指導性意義。
本發明提供的檢測方法采用完全閉管操作,操作簡單、方便快捷、通過直接探測PCR過程中熒光信號值的獲得檢測的結果,不需要PCR后處理或電泳檢測,克服了常規PCR技術的易污染、出現假陽性,能有效避免非特異性擴增難題,并且適合大批量樣本的檢測。
本發明提供的檢測試劑盒及方法,用于檢測COX-1、COX-2和GPIIIa基因多態性時,為了避免漏檢、及初步判斷樣本DNA量是否在允許范圍內,設有內部質控,為了判斷檢測體系是否正常,還設有陰性對照和檢測引物的陽性對照;為了避免假陰性及漏檢,設有陽性對照,其陽性對照檢測呈陽性結果,說明檢測體系沒有問題,不會出現假陰性結果及漏檢;為了避免假陽性及漏檢,設有陰性對照,其陰性對照檢測呈陰性結果,說明檢測體系沒有問題,不會出現假陽性結果及漏檢;檢測試劑盒及方法設計嚴謹,有效避免漏檢、錯檢的可能。
與現有技術相比,本發明運用ARMS引物分野生型和突變型基因,有如下有益效果和顯著進步:
(1)靈敏度高,可以準確檢出低至0.01ng/μL的基因組DNA,檢測結果可信,且對于保存時間過長以及口腔拭子這些提取濃度很低的樣本能準確檢出。
(2)特異性強,對于高至500ng的基因組DNA樣本也能夠準確檢出。因此,可以減少稀釋樣本的過程,提取出的樣本直接上母液都能準確檢測而不會出現結果誤判。
(3)適用于多種樣本類型:本發明不僅能檢測常規的EDTA抗凝的全血細胞DNA,還能檢測提取質量差的口腔拭子,還可以直接檢測全血細胞裂解紅細胞后的白細胞,檢測結果準確度高。
(4)成本低,ARMS分型法相對Taqman探針分型法,不僅能保留Taqman的高靈敏度和高特異性,而且還能節約成本,ARMS引物合成快速簡單,合成成本低,擴增效果更佳。
(5)檢測速度快,整個檢測過程只需要90分鐘。
(6)應用Applied Biosystems公司生產的Fast master Premix預混在反應體系中,制備成可直接加入樣品檢測的試劑盒,減少了酶與樣本混合的步驟,減少了樣本的污染,操作更簡單,一步加樣,避免了氣溶膠污染引起的假陽性。
(7)安全:整個試劑盒不包含有毒有害物質,對操作人員和環境無危害。
本發明涉及的COX-1、COX-2和GPIIIA基因多態性檢測試劑盒適用于臨床多種樣本類型檢測,具有特異性強,靈敏度高,實驗周期短,操作簡單,安全無毒,成本低等顯著優點。
附圖說明
圖1為本發明一優選試劑盒檢測樣本XY04中COX-1基因的擴增曲線。
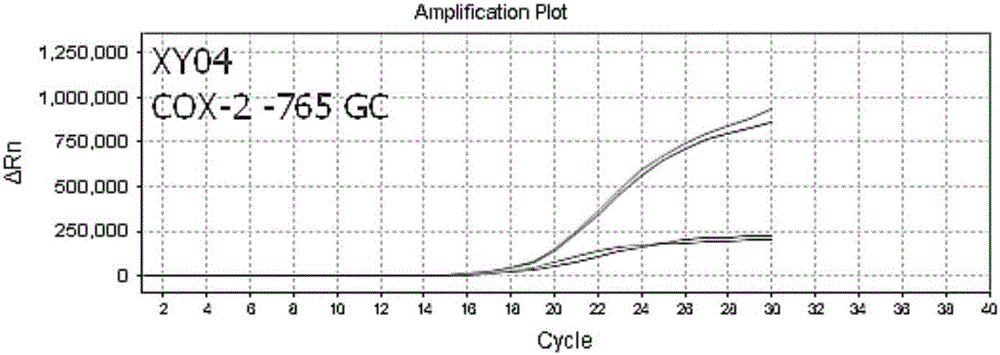
圖2為本發明一優選試劑盒檢測樣本XY04中COX-2基因的擴增曲線。
圖3為本發明一優選試劑盒檢測樣本XY04中GPIIIa基因的擴增曲線。
圖4為本發明一優選試劑盒檢測樣本KQ07中COX-1基因的擴增曲線。
圖5為本發明一優選試劑盒檢測樣本KQ07中COX-2基因的擴增曲線。
圖6為本發明一優選試劑盒檢測樣本KQ07中GPIIIa基因的擴增曲線。
圖7為本發明一優選試劑盒靈敏度的擴增曲線。
圖8為本發明一優選試劑盒特異性的擴增曲線。
具體實施方式
以下結合具體實例對本發明做進一步詳細說明,并非對本發明的限定,本發明的實施方式并不限于此,本發明提供的核苷酸序列的互補序列也可實現本發明,如無特殊說明,所用試劑為常規試劑,因此凡依照本公開內容所作出的本領域的等同替換,均屬于本發明的保護范圍。
實施例1引物、探針、驗證模板設計
本發明的具體原理是:針對不同基因位點分別設計野生型和突變型ARMS引物和Taqman-MGB探針,結合熒光定量PCR反應,對從人外周血細胞或口腔拭子中提取的基因組DNA進行檢測,可以一次性在一條6聯PCR反應條上實現對環氧化酶1(COX-1)基因A842G、環氧化酶2(COX-2)基因G-765C和血小板膜糖蛋白(GPIIIa)基因T1565C的基因多態性進行檢測,通過實時熒光PCR儀上收集信號,計算野生型和突變型的ΔCt值來確定樣本DNA的基因型。
分別針對人類COX-1基因A842G位點、COX-2基因G-765C位點、GPIIIa基因T1565C位點設計各基因對應的野生型上游引物、突變型上游引物、公用下游引物和公用檢測探針,通過多次試驗、優化、最后獲得的引物及檢測探針如下,核苷酸序列具體見表1:
COX-1基因A842G野生型ARMS引物:上游引物(AC1-FW)SEQ ID NO.1和下游引物(AC1-R)SEQ ID NO.3;
COX-1基因A842G突變型ARMS引物:上游引物(AC1-FM)SEQ ID NO.2,和下游引物SEQ ID NO.3;
COX-1基因A842G公用檢測探針(AC1-P):SEQ ID NO:4;
COX-2基因G-765C野生型ARMS引物:上游引物(AC2-FW)SEQ ID NO.5,下游引物(AC2-R)SEQ ID NO.7;
COX-2基因G-765C突變型ARMS引物:上游引物(AC2-FM)SEQ ID NO.6,下游引物SEQ ID NO.7;
COX-2基因G-765C公用檢測探針(AC2-P):SEQ ID NO:8;
GPIIIa基因T1565C野生型ARMS引物:上游引物(AGP-FW)SEQ ID NO.9,下游引物(AGP-R)SEQ ID NO.11;
GPIIIa基因T1565C突變型ARMS引物:上游引物(AGP-FM)SEQ ID NO.10,下游引物SEQ ID NO.11;
GPIIIa基因T1565C探針(AGP-P):SEQ ID NO.12。
其中,COX-1基因A842G野生型引物對的擴增產物長度為84bp,突變型引物擴增片段長度為84bp。擴增產物可作為陽性對照,即COX-1基因A842G野生型陽性對照物含SEQ ID No.16所示的核苷酸序列、COX-1基因A842G突變型陽性對照物含SEQ ID No.17所示的核苷酸序列。
COX-2基因G-765C野生型引物對的擴增產物長度為73bp,突變型引物擴增片段長度為74bp。擴增產物可作為陽性對照,即COX-2基因G-765C野生型陽性對照物含SEQ ID No.18所示的核苷酸序列、COX-2基因G-765C突變型陽性對照物含SEQ ID No.19所示的核苷酸序列。
GPIIIa基因T1565C野生型引物對的擴增產物長度為81bp,突變型引物擴增片段長度為79bp。擴增產物可作為陽性對照,即GPIIIa基因T1565C野生型陽性對照物含SEQ ID No.20所示的核苷酸序列、GPIIIa基因T1565C突變型陽性對照物含SEQ ID No.21所示的核苷酸序列;核苷酸序列具體見表1中所示。
進一步,為了對實時熒光PCR反應體系和實驗操作過程進行質控,同時檢測樣本的質量,避免漏檢,本發明設有內部質控,選用IL6基因作為內參基因,堿基序列為NCBI數據庫中基因序列編號為NCBI數據庫中基因序列編號為NT_007819.18第3147到3447位。針對這段序列設計的內部控制引物和內控探針,并對內控的上下游引物進行篩選,使非模版體系(NTC)沒有明顯的擴增曲線(不起線),樣本由明顯的擴增曲線(起線)正常。并對上述的三對基因的引物對、探針及各自擴增產物均不能產生交叉反應,通過對內部質控的質控引物對、質控探針的篩選和體系優化,建立了實時熒光PCR內部質控檢測體系,最后確定,質控引物對(IL6-F、IL6-R)核苷酸序列如SEQ ID NO:13~14所示,質控探針(IL6-P)的核苷酸序列如SEQ ID NO:15所示,具體見表1。
作為內部質控的質控引物對進行PCR擴增時,其擴增序列的大小為87bp,將該擴增序列作為內部質控陽性對照物,即包含如SEQ ID No.22所示序列,作為驗證是否漏檢的陽性對照。
表1本申請中引物探針及陽性對照物的序列
實施例2采用實時熒光PCR檢測COX-1、COX-2和GPIIIa基因多態性的方法
將實施例1篩選設計各基因的野生型上游引物、突變型上游引物、公用下游引物和公用檢測探針進行合成,在檢測探針的5'端連接熒光基團,3'端連接淬滅基團,其中,熒光基團可為FAM、JOE、CY3、HEX中任意一種,淬滅基團可為MGB、BHQ1、TAMRA、BHQ2中任意一種。
采用實時熒光PCR檢測COX-1、COX-2和GPIIIa基因多態性的方法。具體步驟如下:
(1)獲得待測樣品的DNA;
(2)應用設計的檢測引物及檢測探針,對待測樣本的DNA中對COX-1、COX-2和GPIIIa基因的A842G、G-765C、T1565C位點多態性進行實時熒光PCR擴增檢測,采用COX-1、COX-2和GPIIIa基因的野生型反應體系和突變型反應體系,均用40μL反應體系,PCR反應體系中組分如下:
10×PCR緩沖液:5~10μL
MgCl2:2.0~5.0mmol
dNTP:0.2~0.8mmol
各條引物:0.1~1.0μmol
各條探針:0.1~1.0μmol
Fast master premix:5~10μL
樣品DNA模板:10μL
其余用超純水補足總體積:40μL。
實時熒光PCR擴增反應條件優選為:
第一階段:95℃5min;
第二階段:95℃5s,58℃30s,10個循環;
第三階段:95℃5s,58℃30s,72℃30s,30個循環;
第三階段:30個循環中,72℃時收集熒光信號。
(3)收集熒光信號,選擇對應熒光基團的熒光檢測模式,基線調整取3~15個循環的熒光信號,以閾值線剛好超過正常陰性對照的最高點設定閾值線;
(4)結果判定:待測樣品的所述COX-1、COX-2和GPIIIa基因的野生型反應體系和突變型反應體系的熒光信號,達到設定閾值所需的循環次數Ct值的差值ΔCt值來確定樣本中含COX-1、COX-2和GPIIIa基因的基因型。
將各基因位點的野生型陽性對照物和突變型陽性對照物分別進行上述各基因野生型反應體系和突變型反應體系的實時熒光PCR擴增反應,結果顯示,所設計的各基因檢測引物及反應體系可有效擴增出其對應基因的野生型和突變型。
經過多次樣品的檢測,最后確定可根據如下判斷樣本的各基因的類型:ΔCt=|野生型Ct值-突變型Ct值|≤2.5為雜合型樣本;
ΔCt=野生型Ct值-突變型Ct值>2.5為突變型樣本;
ΔCt=突變型Ct值-野生型Ct值>2.5為野生型樣本。
對樣品進行檢測時,為避免漏檢,如避免有的反應體系中未加檢測樣本的情況出現,在每個反應體系中均設置有內部質控,即將質控引物對和質控探針都加入上述各反應體系中,其質控引物對和質控探針具體序列如實施例1中所述。應當注意的是公用檢測探針與質控探針熒光基團標記為不同檢測模式的熒光基團。具體的實時熒光PCR擴增反應體系組成按上述PCR反應液組分配置。對于人血液樣品或咽拭子樣品的DNA檢測時,質控探針的信號應有明顯的擴增曲線,檢測結果可靠,如果沒有明顯的擴增曲線,說明檢加提取的檢測樣品,
在探針合成時,探針與熒光基團和淬滅基團相連,檢測探針的熒光-淬滅基團為優選為FAM-MGB,質控探針的熒光-淬滅基團優選為JOE-BHQ1,當然,其它熒光-淬滅基團組合也同樣適用,比如,HEX-BHQ1、HEX-TAMRA、FAM-TAMRA、FAM-BHQ1、CY3-BHQ1、CY3-BHQ2等,檢測時選擇相應的熒光檢測模式。
本發明建立的方法中可用于每個反應體系檢測單個檢測一種基因,即當三種檢測探針都標記為FAM-MGB時,應分別配置各個基因的反應體系,即COX-1基因A842G野生型反應體系中對應有COX-1基因A842G野生型引物對和COX-1基因A842G檢測探針,COX-1基因A842G突變型反應體系中對應有COX-1基因A842G突變型引物對和COX-1基因A842G檢測探針,其他兩組基因以此類推。
本發明建立的方法中可用于每個反應體系檢測同時檢測三種基因,但是這三種基因的檢測探針標記均不同的熒光基因與淬滅基團,即COX-1基因A842G檢測探針、COX-2基因G-765C檢測探針、GPIIIa基因T1565C檢測探針應分別標記FAM-MGB、CY3-BHQ2、HEX-TAMRA,配置反應體系時,應將野生型反應體系中可同時加入三種基因的野生型引物和三種基因的檢測探針,在突變型反應體系中同時加入三種基因的突變型引物和三種基因的檢測探針,檢測時,根據熒光信號的不同來判斷各自基因的基因型,這種檢測方法加樣簡單,配置反應體系只需配置2中體系野生型和突變性即可,加樣品時,只要將樣本分別加入這兩個體系即可進行檢測。
為了避免假陰性及漏檢,檢測方法中還設有野生型反應體系、突變性反應體系和內部質控的陽性對照(STD),其陽性對照檢測呈陽性結果,說明檢測體系沒有問題,不會出現假陰性結果及漏檢;為了避免假陽性及漏檢,設有檢測引物和內部質控的陰性對照(NTC),其陰性對照檢測呈陰性結果,說明檢測體系沒有問題,不會出現假陽性結果及漏檢;否則,應重新進行反應體系的配置及檢測。陽性對照(STD)FAM信號Ct值作為實驗數據是否有效的判定標準。
上述實時熒光PCR反應可使用的儀器包括ABI實時PCR系統(例如7000,7300,7500,7900等);BioRad實時PCR檢測系統、Stratagene定量多聚酶鏈反應儀(例如MX4000,MX3000,MX3005)。
實施例3用于檢測COX-1、COX-2和GPIIIa基因多態性的試劑盒
用于檢測COX-1、COX-2和GPIIIa基因多態性的實時熒光PCR試劑盒包括以下成分:
COX-1基因A842G野生型引物對:核苷酸序列如SEQ ID NO.1和SEQ ID NO.3所示;
COX-1基因A842G突變型引物對:核苷酸序列如SEQ ID NO.2和SEQ ID NO.3所示;
COX-1基因A842G檢測探針:核苷酸序列如SEQ ID NO.4所示;
COX-2基因G-765C野生型引物對:核苷酸序列如SEQ ID NO.5和SEQ ID NO.7所示;
COX-2基因G-765C突變型引物對:核苷酸序列如SEQ ID NO.6,下游引物SEQ ID NO.7所示;
COX-2基因G-765C檢測探針:核苷酸序列如SEQ ID NO.8所示;
GPIIIa基因T1565C野生型引物對:核苷酸序列如SEQ ID NO.9和SEQ ID NO.11所示;
GPIIIa基因T1565C突變型引物對:核苷酸序列如SEQ ID NO.10,和SEQ ID NO.11所示;
GPIIIa基因T1565C檢測探針:核苷酸序列如SEQ ID NO.12所示;
各自的檢測探針的5'端連接熒光基團,3'端連接淬滅基團;
COX-1基因A842G野生型陽性對照物:含有如SEQ ID No.16所示的核苷酸序列;
COX-1基因A842G突變型陽性對照物:含有如SEQ ID No.17所示的核苷酸序列;
COX-2基因G-765C野生型陽性對照物:含有如SEQ ID No.18所示的核苷酸序列;
COX-2基因G-765C突變型陽性對照物:含有如SEQ ID No.19所示的核苷酸序列;
GPIIIa基因T1565C野生型陽性對照物:含有如SEQ ID No.20所示的核苷酸序列;
GPIIIa基因T1565C突變型陽性對照物:含有如SEQ ID No.21所示的核苷酸序列。
為了避免漏檢,錯檢,還包括:作為內部質控的質控引物對、質控探針和質控陽性對照物,
其中,質控引物對的核苷酸序列如SEQ ID No.13和SEQ ID No.14所示,質控探針的核苷酸序列如SEQ ID No.15所示,該質控探針的5'端連接有不同于檢測探針的熒光基團,3'端連接有不同于檢測探針的淬滅基團,質控陽性對照物含有如SEQ ID No.22所示的核苷酸序列。
為了防止反應體系在PCR擴增過程中揮發,影響檢測效果,試劑盒還包括有礦物油。
為了便于反應體系的配置,試劑盒還包括10×PCR緩沖液;DNA聚合酶,陰性對照物:超純水。其中DNA聚合酶可采用Fast master premix,采用ABI(美國應用生物系統公司);10×PCRbuffer(Mg2+Plus)采用TaKaRa寶生物工程(大連)有限公司,也可應用市場上其他公司的PCR緩沖液與DNA聚合酶。
實施例4快速檢測試劑盒的制備
本實施例的試劑盒是在實施例3的基礎上,制備成可以直接加入檢測樣品后,進行檢測的試劑盒。該試劑盒有檢測COX-1、COX-2、GPIIIa基因各自野生型和突變型體系的8聯PCR反應條以及驗證試劑盒性能分析時所需COX-1、COX-2、GPIIIa三個基因的野生型質粒、突變型質粒及內控質粒,各成分如表2所示,具體反應體系的配置見表3。其中,各基因的檢測探針的5'端連接FAM,3'端連接MGB,則檢測樣本信號類型為FAM信號;內部質控的質控探針5'端連接JOE,3'端連接BHQ1,內部質控信號類型為JOE信號(內控作為對試劑盒、DNA質量以及操作本身的質控);檢測引物、探針可陽性對照物委托上海英駿生物技術有限公司合成。
表2試劑盒組成
表3反應體系的配置
最后配置的各反應體系進行存放時,防止試劑盒放置時或進行PCR擴展時,反應體系液體的揮發,在各反應體系中均加入20μL礦物油,冷凍保存。
其中,AB premix全稱為Fast master premix,購自ABI(美國應用生物系統公司);10×PCR buffer(Mg2+Plus)購自TaKaRa寶生物工程(大連)有限公司,經過大量試驗、驗證該試劑盒為一種高靈敏、高特異性、高效的檢測的檢測試劑盒。
實施例5:實時熒光PCR法擴增臨床樣本DNA
一、臨床樣本DNA的提取
(1)、EDTA抗凝血樣品
本實施例是從EDTA抗凝血樣品(來自武漢大學中南醫院)中提取基因組DNA,并對其進行定量,作為PCR檢測的模板。采用天根的血液基因組DNA提取試劑盒,具體操作見該DNA提取試劑盒說明書,最后,將提取的EDTA抗凝血樣品DNA用紫外分光光度計進行定量,稀釋DNA濃度到1ng/μL。
(2)、口腔拭子樣本
本實施例是從口腔拭子(來自武漢大學中南醫院)中提取基因組DNA,并對其進行定量,作為PCR檢測的模板。采用康為世紀的口腔拭子基因組DNA提取試劑盒,具體操作詳該DNA提取試劑盒說明書,最后,將提取的口腔拭子DNA用紫外分光光度計進行定量,稀釋DNA濃度到1ng/μL。
二、檢測
本實施例為采用實施例4制備的試劑盒、上述方法提取的DNA樣品,進行實時熒光PCR擴增。
檢測方法如下:
1)每次PCR反應中,同時進行非模板對照(No Template Control;NTC)、陽性對照和待測樣本的檢測,具體見實施例3中所述;
2)將陽性對照物取出解凍后震蕩混勻,并離心30s;
3)將實施例4制備的8聯PCR反應條取出解凍后離心30s,防止反應液在開蓋時濺出;
4)將ddH2O(NTC)、實施例6中提取的DNA樣本、陽性對照物分別加入8聯PCR反應條,每孔10μL;
5)將以上8聯PCR反應條蓋好管蓋于離心機上離心30S,確保管壁上不沾有液滴;
6)將8聯PCR反應條放于實時熒光PCR儀器中,按如下程序設定:
第一階段:95℃5min;
第二階段:95℃5s,58℃30s,10個循環;
第三階段:95℃5s,58℃30s,72℃30s,30個循環;
第三階段:30個循環時,收集FAM和JOE信號。
本發明是利用ARMS引物區分野生型和突變型基因序列,通過反應體系的突變型和野生型FAM信號的熒光強度差異來判斷檢測結果;JOE是內控信號,用于檢測體系是否正常,樣本是否漏加及初步判斷樣本DNA量是否在允許范圍內,JOE信號應達到設定閾值(Ct值小于25);FAM是檢測信號,用于檢測樣本的基因多態性;在內控信號達到要求后,以每個SNP位點的突變型和野生型FAM信號達到設定閾值所需的循環次數Ct值的差值作為判斷標準。選擇1、2號管,根據FAM信號ΔCt值判斷檢測樣本COX-1 842的基因A842G位點的多態性;選擇3、4號管,根據FAM信號ΔCt值判斷檢測樣本COX-2-765的基因G-765C位點的多態性;選擇5、6號管,根據野生型和突變型FAM信號ΔCt值判斷檢測樣本GPIIIA1565的基因T1565C位點的多態性。判斷標準是ΔCt=|野生型Ct值-突變型Ct值|≤2.5為雜合型樣本,ΔCt=野生型Ct值-突變型Ct值>2.5為突變型樣本,ΔCt=突變型Ct值-野生型Ct值>2.5為野生型樣本,樣本結果判定具體見表4。
表4各基因多態性檢測結果判定
對來自武漢大學中南醫院10人(一個人同時取血液和口腔兩種不同類型的樣本)的10個EDTA抗凝血樣品(編號為XY01-XY10)和10個口腔拭子(編號為KQ01-KQ10)的檢測結果見表5,其中,例舉兩個樣本各基因多態性的擴增圖作為代表,EDTA抗凝的全血提取的基因組DNA樣本(編號XY04)的擴增曲線,如圖1為COX-1基因A842G位點為AA即純野生型;如圖2為COX-2基因G-765C位點為GC即雜合型;如圖3為GPIIIa基因T1565C位點為TT及純野生型;口腔拭子提取的基因組DNA樣本(編號KQ 07)的擴增曲線,如圖4為COX-1基因A842G位點為AA即雜合型;如圖5為COX-2基因G-765C位點為GG即純野生型;如圖6為GPIIIa基因T1565C位點為TC即雜合型。
表5樣本檢測結果
同時對上述這些樣本的DNA進行測序,由武漢艾康健測序公司(采用Sanger金標準)進行測序檢測,并將兩者的檢測能力進行比較,結果見表6。
表6本發明檢測結果和Sanger測序金標準比較
表6的結果說明:EDTA抗凝血提取的基因組DNA和口腔拭子提取的基因組DNA用本發明的試劑盒檢測的結果和Sanger測序的結果完全一致,說明本發明的試劑盒和檢測方法準確度高,適應樣本廣。
實施例6:對實施例4中制備的試劑盒和實施例5檢測的陽性基因組DNA進行靈敏度和特異性實驗
1.靈敏度實驗
對實施例4中制備的試劑盒進行實驗,把實施例5提取的基因組DNA作為模板,分別進行3種濃度梯度為1ng/μL(10ng/反應)、0.1ng/μL(1ng/反應)和0.01ng/μL(0.1ng/反應)在熒光定量PCR儀上進行檢測,三種不同濃度的基因組DNA作為模板的進行6個反應體系的檢測,檢測結果顯示,均能準確檢出0.01ng/μL的基因組DNA(結果擴增圖如圖7所示,僅例出一個反應體系的擴增圖,其他反應體系的擴增圖在此不在贅述)。因此,本試劑盒可以準確檢出低至0.01ng/μL的基因組DNA,且對于保存時間過長以及口腔拭子這些提取濃度很低的樣本能準確檢出。
2.特異性實驗
對實施例4中制備的試劑盒進行實驗,把實施例5提取的陽性基因組DNA作為模板,分別進行3種濃度為50ng/μL(500ng/反應)、10ng/μL(100ng/反應)和1ng/μL(10ng/反應)在熒光定量PCR儀上進行6個反應系統的檢測,結果顯示,三種不同濃度的基因組DNA作為模板的檢測,均能準確檢出(結果擴增圖如圖8所示,僅例出一個反應體系的擴增圖,其他反應體系的擴增圖在此不在贅述),說明當模板量為500ng時,檢測結果不會受過高濃度而影響結果的判讀。因此,對于高至500ng的基因組DNA樣本也能夠準確檢出。因此,可以減少稀釋樣本的過程,提取出的樣本直接上母液都能準確檢測而不會出現結果誤判。
以上所述實施例僅是為充分說明本發明而所舉的較佳的實施例,本發明的保護范圍不限于此。本技術領域的技術人員在本發明基礎上所作的等同替代或變換,均在本發明的保護范圍之內。
SEQUENCE LISTING
<110> 武漢海吉力生物科技有限公司
<120> 用于檢測COX-1、COX-2和GPIIIa基因多態性的核酸、試劑盒及方法
<130>
<160> 22
<170> PatentIn version 3.5
<210> 1
<211> 25
<212> DNA
<213> 人工合成
<400> 1
aactgagcac ctactacacg ctgca 25
<210> 2
<211> 25
<212> DNA
<213> 人工合成
<400> 2
aactgagcac ctactacatg caggg 25
<210> 3
<211> 22
<212> DNA
<213> 人工合成
<400> 3
tcccagaggg tggttgtaag at 22
<210> 4
<211> 16
<212> DNA
<213> 人工合成
<400> 4
ttgtgtgcat tccctc 16
<210> 5
<211> 21
<212> DNA
<213> 人工合成
<400> 5
gaggagaatt taccgttccc g 21
<210> 6
<211> 22
<212> DNA
<213> 人工合成
<400> 6
tgaggagaat ttacctgtcc cc 22
<210> 7
<211> 26
<212> DNA
<213> 人工合成
<400> 7
gaaatactgt tctccgtacc ttcacc 26
<210> 8
<211> 17
<212> DNA
<213> 人工合成
<400> 8
ctctctttcc aagaaac 17
<210> 9
<211> 22
<212> DNA
<213> 人工合成
<400> 9
ctgtcttaca ggacctgcca ct 22
<210> 10
<211> 20
<212> DNA
<213> 人工合成
<400> 10
gtcttacagt ccctgccttc 20
<210> 11
<211> 21
<212> DNA
<213> 人工合成
<400> 11
attctggggc acagttatcc t 21
<210> 12
<211> 16
<212> DNA
<213> 人工合成
<400> 12
acctcgctgt gacctg 16
<210> 13
<211> 18
<212> DNA
<213> 人工合成
<400> 13
acatgccagc cccacact 18
<210> 14
<211> 23
<212> DNA
<213> 人工合成
<400> 14
gagatcaaga gaggccagac aaa 23
<210> 15
<211> 26
<212> DNA
<213> 人工合成
<400> 15
agccaagttg ctgcttcctc cctgtg 26
<210> 16
<211> 84
<212> DNA
<213> 人工合成
<400> 16
aactgagcac ctactacatg ctggacactg caccaggaga tttgtgtgca ttccctcatt 60
gaatcttaca accaccctct ggga 84
<210> 17
<211> 84
<212> DNA
<213> 人工合成
<400> 17
aactgagcac ctactacatg ctgggcactg caccaggaga tttgtgtgca ttccctcatt 60
gaatcttaca accaccctct ggga 84
<210> 18
<211> 73
<212> DNA
<213> 人工合成
<400> 18
gaggagaatt tacctttccc gcctctcttt ccaagaaaca aggagggggt gaaggtacgg 60
agaacagtat ttc 73
<210> 19
<211> 74
<212> DNA
<213> 人工合成
<400> 19
tgaggagaat ttacctttcc cccctctctt tccaagaaac aaggaggggg tgaaggtacg 60
gagaacagta tttc 74
<210> 20
<211> 81
<212> DNA
<213> 人工合成
<400> 20
ctgtcttaca ggccctgcct ctgggctcac ctcgctgtga cctgaaggag aatctgctga 60
aggataactg tgccccagaa t 81
<210> 21
<211> 79
<212> DNA
<213> 人工合成
<400> 21
gtcttacagg ccctgcctcc gggctcacct cgctgtgacc tgaaggagaa tctgctgaag 60
gataactgtg ccccagaat 79
<210> 22
<211> 87
<212> DNA
<213> 人工合成
<400> 22
acatgccagc cccacactgg tggcatagga agccaagttg ctgcttcctc cctgtgcact 60
cccatttgtc tggcctctct tgatctc 87
- 還沒有人留言評論。精彩留言會獲得點贊!