一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的建立方法及其應用與流程
本發明屬于生物技術領域,涉及大腸桿菌O157:H7,具體涉及一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的建立方法及其應用。
背景技術:
大腸桿菌O157:H7是一種重要的人獸共患傳染病病原菌,該菌主要定居于一些反芻動物的腸道內,通過污染的水源及食物引起人與動物的感染。大腸桿菌O157:H7感染動物和人類后主要引起出血性腸炎、血栓性血小板減少性紫癜和腎溶血性尿毒綜合癥(HUS),以及其它一些器官系統的損傷甚至導致死亡,病死率為10%,引發HUS后病死率高達30%。由于大腸桿菌O157:H7傳播途徑廣、易于培養、感染性強,其致病因子-致死性志賀毒素還有可能被用于基因武器的構建,因此許多國家把它列為法定報告傳染病,美國疾病預防控制中心已將其列為B類生物恐怖病原體嚴加防范,我國已將大腸桿菌列為21世紀對國人衛生健康有重大影響的12種病原微生物之一。由于抗生素能夠造成大腸桿菌O157:H7菌體破壞,導致志賀毒素(Stx)釋放,從而促進HUS的發生和癥狀的加重,臨床上對該病的治療禁止用抗生素,目前對于該菌的感染尚缺乏有效的防治手段。而且迄今有關大腸桿菌O157:H7感染引起的免疫致病機制還不甚了解,難以做到有效控制大腸桿菌O157:H7感染。
大腸桿菌O157:H7的致病性與細菌粘附、毒素等有關。粘附因子粘附靶細胞是大腸桿菌O157:H7致病的關鍵步驟,病菌侵入宿主腸腔,依靠質粒介導的粘附因子粘附于盲腸和結腸的上皮細胞,并在其他致病因子的協同作用下產生粘附和擦拭性損傷(attaching and effacinglesions,A/E損傷)。細菌定殖到腸上皮細胞表面后造成A/E損傷,并產生志賀毒素,對宿主細胞造成強致病性。
技術實現要素:
本發明為解決大腸桿菌O157:H7(保藏號:ATCC 43895)在體外沒有生物黏附模型(腸道黏附和擦拭性損傷模型),供研究大腸桿菌O157:H7與宿主腸道細胞之間的相互作用的技術難題,公開了一種大腸桿菌O157:H7感染豬小腸上皮細胞(IPEC-J2)模型的建立方法及其應用。
為解決上述技術難題,本發明采用以下技術方案:
一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的建立方法,步驟如下:
(1)大腸桿菌O157:H7的活化及培養;
(2)大腸桿菌O157:H7感染豬小腸上皮細胞。
所述步驟(1)的具體操作為:
a.取-70℃保存的大腸桿菌O157:H7標準菌株50μL于5mL的液體LB中,置于37℃水浴恒溫振蕩器中200~300r/min培養12~14h得到活化的大腸桿菌O157:H7;
b.將活化的大腸桿菌O157:H7在瓊脂平板上劃線,于37℃溫箱中倒置培養12~16h,然后于無菌條件下挑取單個菌落于5mL LB培養基中,37℃水浴振蕩培養12~14h;
c.于無菌條件下挑取步驟b中,LB培養基上的單個菌落于5mL液體LB試管中,在37℃恒溫培養箱中培養12~14h,獲得大腸桿菌O157:H7種子菌液。
所述步驟(2)的具體操作為:
a.將預先高壓滅菌處理過的蓋玻片放入細胞培養皿中,再將豬小腸上皮細胞以2×105U/孔接種于細胞培養皿內,置37℃5%CO2的培養箱中培養過夜;
b.用無菌D-HanK′s液洗滌細胞三次后加入1mL含10%胎牛血清的1640培養液,第1孔留作空白對照,第2孔加入備用的大腸桿菌O157:H7菌液15μL,置37℃、5%CO2的培養箱中孵育3h,所述大腸桿菌O157:H7菌液的濃度為2×10 9cfu/mL;
c.孵育后,用無菌的D-HanK′s液洗滌細胞三次,洗掉未粘附的細菌,隨即在細胞培養皿內加入500μL 70%甲醇固定15min,取出玻片,無水甲醇處理3s,分別用革蘭氏染色法和吉姆薩染色法染色,待玻片充分干燥,用二甲苯和樹脂進行封片處理,完成大腸桿菌O157:H7感染豬小腸上皮細胞模型的建立。
一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的應用,所述大腸桿菌O157:H7感染豬小腸上皮細胞模型,作為檢測大腸桿菌O157:H7感染豬小腸上皮細胞黏附指數的應用。
所述應用步驟如下:
a.豬小腸上皮細胞以2×105個/孔接種于細胞培養皿內,置于37℃5%CO2恒溫培養箱中培養過夜;
b.用無菌D-HanK′s洗滌3次,空白細胞做對照,其他培養皿中分別加入備用的大腸桿菌O157:H7菌液15μL,置于37℃5%CO2恒溫培養箱中培養,孵育1h后,用無菌D-HanK′s液洗3次,去除未粘附的細菌;
c.向經步驟b處理過的培養皿中,加入500μL 0.25%Triton X-100裂解細胞15min,釋放出粘附在細胞表面的活細菌,8000r/min離心5min沉淀細菌,然后用D-HanK′s洗2次得到黏附的活細菌菌液;
d.將活細菌菌液以10倍倍比稀釋至10-4,每個稀釋度取100μL涂布在固體LB培養板中,每個稀釋度涂布三個平板;
e.將LB培養板置于37℃恒溫培養箱中培養12h,同時以固體培養基LB平板作為空白對照,選取菌落在30~300之間的平板進行計數,然后求其平均值,其黏附率=黏附于細胞的細菌總數/細菌總數,黏附指數=黏附細菌總數/細胞數。
一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的應用,所述大腸桿菌O157:H7感染豬小腸上皮細胞模型,作為檢測被大腸桿菌O157:H7感染后的豬小腸上皮細胞凋亡的應用。
所述檢測豬小腸上皮細胞凋亡的應用,采用的檢測方法為:Hoechst33258染色法或Annexin V-FITC/PI雙標記流式細胞術。
本發明的有益效果在于:
1.本發明公開了建立大腸桿菌O157:H7感染豬小腸上皮細胞模型的方法,首次證實了大腸桿菌O157:H7可以體外粘附豬腸道上皮細胞IPEC-J2,為研究大腸桿菌O157:H7感染引起的腸道A/E損傷過程及其機制奠定了基礎。
2.應用大腸桿菌O157:H7感染豬小腸上皮細胞模型,研究大腸桿菌O157:H7體外粘附IPEC-J2細胞的能力,以及誘導IPEC-J2凋亡的能力,為研究大腸桿菌O157:H7與宿主細胞的相互作用關系奠定了基礎,也為大腸桿菌O157:H7感染所致疾病的預防和治療提供新的思路和手段。
附圖說明
圖1為大腸桿菌O157:H7的生長曲線。
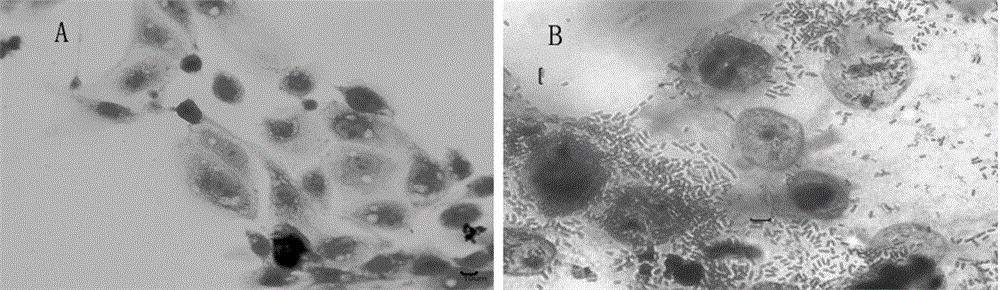
圖2為革蘭氏染色法檢測大腸桿菌O157:H7黏附IPEC-J2細胞顯微圖;其中A為正常IPEC細胞,B為標準株和IPEC細胞。
圖3為吉姆薩染色法檢測大腸桿菌O157:H7黏附IPEC-J2細胞顯微圖;其中A為正常IPEC細胞,B為標準株和IPEC細胞。
圖4為Hoechst33258染色結果圖;其中A:正常細胞;B:大腸桿菌O157感染引起IPEC細胞凋亡。
圖5為Annexin V-FITC/PI法檢測大腸桿菌O157:H7誘導IPEC-J2細胞凋亡圖,其中A:IPEC-J2空白細胞;B-E:分別是大腸桿菌O157:H7感染IPEC-J2細胞后30min、1h、2h、3h引起的細胞凋亡情況;圖中B1:Annexin V-FITC-/PI+損傷區域,B2:Annexin V-FITC+/PI+損傷區域,B3:Annexin V-FITC-/PI-區域,B4:Annexin V-FITC+/PI-區域。
具體實施方式
一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的建立方法,步驟如下:
(1)大腸桿菌O157:H7的活化及培養;
(2)大腸桿菌O157:H7感染豬小腸上皮細胞。
所述步驟(1)的具體操作為:
a.取-70℃保存的大腸桿菌O157:H7標準菌株50μL于5mL的液體LB中,置于37℃水浴恒溫振蕩器中200~300r/min培養12~14h得到活化的大腸桿菌O157:H7;
b.將活化的大腸桿菌O157:H7在瓊脂平板上劃線,于37℃溫箱中倒置培養12~16h,然后于無菌條件下挑取單個菌落于5mL LB培養基中,37℃水浴振蕩培養12~14h;
c.于無菌條件下挑取步驟b中,LB培養基上的單個菌落于5mL液體LB試管中,在37℃恒溫培養箱中培養12~14h,獲得大腸桿菌O157:H7種子菌液。
所述步驟(2)的具體操作為:
a.將預先高壓滅菌處理過的蓋玻片放入細胞培養皿中,再將豬小腸上皮細胞以2×105U/孔接種于細胞培養皿內,置37℃5%CO2的培養箱中培養過夜;
b.用無菌D-HanK′s液洗滌細胞三次后加入1mL含10%胎牛血清的1640培養液,第1孔留作空白對照,第2孔加入備用的大腸桿菌O157:H7菌液15μL,置37℃、5%CO2的培養箱中孵育3h,所述大腸桿菌O157:H7菌液的濃度為2×10 9cfu/mL;
c.孵育后,用無菌的D-HanK′s液洗滌細胞三次,洗掉未粘附的細菌,隨即在細胞培養皿內加入500μL 70%甲醇固定15min,取出玻片,無水甲醇處理3s,分別用革蘭氏染色法和吉姆薩染色法染色,待玻片充分干燥,用二甲苯和樹脂進行封片處理,完成大腸桿菌O157:H7感染豬小腸上皮細胞模型的建立。
一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的應用,所述大腸桿菌O157:H7感染豬小腸上皮細胞模型,作為檢測大腸桿菌O157:H7感染豬小腸上皮細胞黏附指數的應用。
所述應用步驟如下:
a.豬小腸上皮細胞以2×105個/孔接種于細胞培養皿內,置于37℃5%CO2恒溫培養箱中培養過夜;
b.用無菌D-HanK′s洗滌3次,空白細胞做對照,其他培養皿中分別加入備用的大腸桿菌O157:H7菌液15μL,置于37℃5%CO2恒溫培養箱中培養,孵育1h后,用無菌D-HanK′s液洗3次,去除未粘附的細菌;
c.向經步驟b處理過的培養皿中,加入500μL 0.25%Triton X-100裂解細胞15min,釋放出粘附在細胞表面的活細菌,8000r/min離心5min沉淀細菌,然后用D-HanK′s洗2次得到黏附的活細菌菌液;
d.將活細菌菌液以10倍倍比稀釋至10-4,每個稀釋度取100μL涂布在固體LB培養板中,每個稀釋度涂布三個平板;
e.將LB培養板置于37℃恒溫培養箱中培養12h,同時以固體培養基LB平板作為空白對照,選取菌落在30~300之間的平板進行計數,然后求其平均值,其黏附率=黏附于細胞的細菌總數/細菌總數,黏附指數=黏附細菌總數/細胞數。
一種大腸桿菌O157:H7感染豬小腸上皮細胞模型的應用,所述大腸桿菌O157:H7感染豬小腸上皮細胞模型,作為檢測被大腸桿菌O157:H7感染后的豬小腸上皮細胞凋亡的應用。
所述檢測豬小腸上皮細胞凋亡的應用,采用的檢測方法為:Hoechst33258染色法或AnnexinV-FITC/PI雙標記流式細胞術。
下面結合具體實施例,對本發明進行進一步的解釋說明:
1材料
1.1菌種與細胞
大腸桿菌O157∶H7標準菌株(ATCC 43895)和豬腸道上皮細胞(IPEC-J2)為本實驗室保存。
1.2主要試劑
細胞培養所用試1640、血清、胰蛋白酶等均購Hyclone公司;胰蛋白胨和酵母提取物購自英國OXOID有限公司;革蘭氏染色液和吉姆薩染色液為Sigma公司產品;細胞培養六孔板為Corning公司產品;20mm×20mm蓋玻片購自BOSTER公司;其它分析純試劑均由本實驗室提供。
1.3主要儀器
倒置顯微鏡(Leica Microsystems Wetzlar GmbH);CO2恒溫培養箱(Thermo);754紫外可見分光光度計(上海菁華科技儀器有限公司);常用恒溫培養箱(寧波機電工業設計院);超凈工作臺(蘇凈集團安泰公司);臺式離心機(SIGMA);流式細胞儀(美國BD公司)、熒光顯微鏡(日本尼康公司)、CFX96Real-Time PCR儀(BioRad公司)等。
2方法
2.1大腸桿菌O157:H7的活化及培養
取-70℃保存的大腸桿菌O157:H7標準菌株50μL于5mL的液體LB中,置于37℃水浴恒溫振蕩器中200~300r/min培養12~14h。
將活化后的大腸桿菌O157:H7在麥康凱瓊脂平板上劃線,于37℃溫箱中倒置培養12-16h。然后于無菌條件下挑取單個菌落于5mL LB培養基中,37℃水浴振蕩培養12-14h。
然后于無菌條件下挑取單個菌落于5mL液體LB試管中,在37℃隔熱式恒溫培養箱中培養12-14h,獲得大腸桿菌O157:H7種子菌液。
2.2大腸桿菌O157:H7生長曲線的測定與繪制
將大腸桿菌O157:H7種子菌液按1%的接種量接種到滅菌的、37℃預熱過的150mL LB培養基中,搖勻后分裝入42個大試管,每管5mL,37℃水浴恒溫振蕩器300r/min進行培養,每隔1h取出3管菌(作為3次平行),10倍倍比稀釋后,用平板菌落計數法計數,記錄每個時間點的三次平均值作為最終結果,并繪制生長曲線。以上述各個測定點的時間為橫坐標,測量的細菌數對數為縱坐標,繪制大腸桿菌O157的生長曲線。
2.3細菌黏附發明
將預先高壓滅菌過的20mm×20mm的蓋玻片放入細胞培養皿中,再將IPEC-J2細胞以2×105/孔接種于細胞培養皿內,置37℃5%CO2的培養箱中培養過夜。用無菌的D-HanK′s液洗滌細胞三次后加入1mL含10%胎牛血清的1640培養液(無雙抗),第1孔留作空白對照,第2孔加入備用的大腸桿菌O157:H7菌液15μL(2×10 9cfu/mL),置37℃、5%CO2的培養箱中孵育3h。孵育后,用無菌的D-HanK′s液洗滌細胞三次,洗掉未粘附的細菌。隨即在細胞培養皿內加入500μL 70%甲醇固定15min,取出玻片,無水甲醇處理3s,分別用革蘭氏染色法和吉姆薩染色法染色,待玻片充分干燥,用二甲苯和樹脂進行封片處理。待蓋玻片固定后,在MOTIC成像顯微鏡觀察。
2.4黏附指數及粘附率計算
IPEC-J2細胞以2×105個/孔接種于細胞培養皿內,置37℃5%CO2的培養箱中培養過夜。用無菌D-HanK′s洗滌3次,空白細胞做對照,其他培養皿中分別加入備用的3株大腸桿菌O157∶H7菌液15μL,置于37℃5%CO2培養箱中培養,孵育1h后,用無菌D-HanK′s液洗3次,去除未粘附的細菌后,加入500μL 0.25%Triton X-100裂解細胞15min,釋放出粘附在細胞表面的活細菌,8000r/min離心5min沉淀細菌,然后用D-HanK′s洗2次,倍比稀釋至10-4,將其按不同的稀釋度吸取100μL涂布在固體培養基LB中,每個稀釋度涂布三個平板。在37℃隔熱式電熱恒溫培養箱中培養12h,同時用一個固體培養基LB平板作為空白對照。選取菌落在30~300之間的平板進行計數,然后求其平均值,計算其黏附率=黏附于細胞的細菌總數/細菌總數,黏附指數=黏附細菌總數/細胞數。
2.5大腸桿菌O157:H7感染后誘導IPEC-J2細胞的凋亡檢測
2.5.1Hoechst33258染色法檢測IPEC-J2細胞的凋亡情況
在細胞培養皿中接種IPEC-J2細胞(細胞約2×105個/孔),培養至細胞密度大于90%,用無菌D-HanK′s洗滌3次,按1:100的量向細胞培養皿中加入大腸桿菌O157:H7,于37℃5%CO2培養箱中培養。分別取對照組的IPEC-J2細胞和大腸桿菌O157:H7細菌感染3h的IPEC-J2細胞,按照下面的步驟操做:
①棄上清,加入0.5mL的甲醇,固定10分鐘;
②去固定液,D-HanK′s洗滌3次,吸盡液體。洗滌時手輕輕晃動數次;
③加入1mL Hoechst 33258染色液,避光染色5分鐘。
④用D-HanK′s洗滌3次,每次3分鐘。
⑤滴一滴抗熒光淬滅封片液于細胞培養皿內;
⑥在熒光顯微鏡下觀察。
2.5.2Annexin V-FITC/PI雙標記流式細胞術檢測細胞凋亡情況
將IPEC-J2細胞接種到細胞培養皿中(2×105個/孔),培養至單層,用無菌D-HanK′s洗滌3次,按1:100的量向細胞培養皿中加入大腸桿菌O157:H7,置于37℃5%CO2培養箱中培養。分別于加菌后0、0.5、1、2和3h,用胰酶消化后,收集細胞,3 000r/min離心10min,用D-HanK′s洗滌3次。根據Annexin V-FITC/PI雙染試劑盒說明書,加入500μL結合緩沖液重新懸浮細胞,然后各加入5μL的Annexin V-FITC和10μL的PI混勻,室溫避光染色15min后,用流式細胞儀分析,Cellquest軟件分析結果。
3結果
3.1大腸桿菌O157:H7生長曲線的繪制
以測量的細菌數對數為縱坐標,以時間為橫坐標,繪制大腸桿菌O157的生長曲線(圖1),從圖1中可以看出,最初的2h大腸桿菌O157生長處于延滯期,2h后大腸桿菌O157生長進入對數生長期,5h后大腸桿菌O157生長進入穩定期。
3.2細菌黏附實驗結果
大腸桿菌O157:H7與IPEC-J2細胞黏附3h后,通過改良的革蘭氏染色法和吉姆薩染色法染色,在MOTIC成像顯微鏡下觀察粘附情況:正常的IPEC-J2細胞間有空隙,可見胞內顆粒雜質,且輪廓清晰,細胞呈多角形或梭狀;感染后的細胞周圍有大量的陰性桿狀細菌黏附(見圖2和3)。
3.3大腸桿菌O157:H7對IPEC-J2細胞的黏附率及黏附指數
大腸桿菌O157:H7侵染IPEC-J2細胞后,加入500μL 0.25%Triton X-100裂解細胞15min,釋放出粘附在細胞表面及細胞內的活細菌。10倍倍比稀釋后吸取100μL均勻涂布于固體LB平板,選取菌落個數在30~300的稀釋度進行菌落計數,求出細胞內外活菌總數,并計算出黏附率及黏附指數。結果如表1所示,大腸桿菌O157菌株表現出較強的黏附能力,對IPEC-J2細胞的黏附能力為30.4%,黏附指數為14.8。
表1大腸桿菌O157:H7的粘附率
3.4大腸桿菌O157:H7引起IPEC-J2細胞的凋亡情況
3.4.1 Hoechst33258染色結果
用Hoechst33258對細胞染色后,在熒光顯微鏡下觀察到活細胞核呈彌散、均勻熒光,壞死的細胞不被Hoechst染色,而凋亡的細胞,其細胞核或細胞質內可見濃染致密的顆粒塊狀藍色熒光及明顯核形態變化,如果見到3個或3個以上的DNA熒光碎片被認為是凋亡細胞。用Hoechst33258對正常的IPEC-J2細胞和感染大腸桿菌O157:H7 3h后的IPEC-J2細胞進行染色,結果如圖4所示。對照細胞的核呈彌散均勻熒光,而大腸桿菌O157:H7感染組的部分細胞核內可見濃染致密的顆粒塊狀熒光出現,說明細胞發生凋亡(圖B箭頭所示處)。
3.4.2 Annexin V-FITC/PI雙染流式細胞儀結果
根據Annexin V-FITC/PI雙染試劑盒說明書,在大腸桿菌O157:H7感染后不同時間(0、0.5、1、2和3h)收集IPEC-J2細胞進行染色,用流式細胞儀檢測,得到相應時間點的細胞凋亡率,結果見圖5(A-E)。圖中B4區域表示細胞群的早期凋亡細胞,B2區域表示的為晚期凋亡及壞死細胞,B3區域代表的是正常細胞。晚期凋亡及壞死細胞均經過早期凋亡這一階段,因此B2和B4的和表示總的凋亡率。由圖可知IPEC-J2細胞在大腸桿菌O157:H7感染后半個小時就有細胞凋亡,并且之后的凋亡率逐漸增加。隨著感染時間的延長,總的凋亡率也隨之增加。
4.討論
4.1大腸桿菌O157:H7生長曲線的測定
細菌的生長曲線反映了單細胞微生物在一定環境條件下于液體培養時所表現出的群體生長規律。依據其生長速率的不同,一般可把生長曲線分為延緩期、對數期、穩定期和衰亡期。這四個時期的長短因菌種的遺傳性、接種量和培養條件的不同而有所改變。不同來源的細菌有其各自不同的生長規律,同一種細菌不同的表現型也會有不同的生長規律。因此通過測定大腸桿菌O157:H7的生長曲線,可了解大腸桿菌O157:H7的生長規律。本研究中大腸桿菌O157:H7生長曲線的測定結果表明,大腸桿菌O157:H7的遲緩期為2h左右,較早的進入對數生長期;5h后進入穩定期,該數據對下一步進行細胞粘附發明研究有一定指導意義。
4.2細胞粘附發明
深入研究病原菌與宿主細胞的相互作用機制是徹底解決傳染病發生的根本所在。大腸桿菌O157:H7雖然是胞外菌,但是可以和腸上皮細胞緊密粘附,產生特征性的粘附和脫落(A/E)損傷。本發明以豬腸道上皮細胞IPEC-J2為體外模型,研究了大腸桿菌O157:H7對豬腸道上皮細胞IPEC-J2的粘附活性,結果表明大量的大腸桿菌O157粘附在IPEC-J2細胞上,且導致部分細胞收縮、連接松散、胞內空泡樣變、胞漿突起減少或消失,甚至細胞核裂解。粘附能力強說明該菌侵襲細胞的能力強,細胞更容易受到損傷,對機體而言就是該菌更容易讓機體致病而表現出相應的癥狀,在感染過程中也能觀察到部分細胞死亡、細胞形態發生明顯的變化。
據報道,大腸桿菌O157:H7可以粘附到Henle 407細胞(來自人小腸)、HEp-2細胞(人喉頭癌細胞)、T84(結腸癌細胞)細胞、HCT8(人回腸盲腸)細胞、HEL(人胚胎肺)細胞和HeLa細胞,且其粘附常為局灶型或微菌落型。本發明首次證實了大腸桿菌O157:H7可以體外粘附豬腸道上皮細胞IPEC-J2,為下一步研究大腸桿菌O157:H7的粘附機理,特別是最初的粘附機理奠定一定的基礎。
4.3大腸桿菌O157:H7誘導IPEC-J2細胞凋亡
凋亡是指在許多生理和病理條件下,細胞在形態學和生物化學方面發生的程序性死亡。它主要以細胞DNA發生特異性的降解,表現出核固縮、胞膜發泡和凋亡小體的形成為特征。研究報道,許多細菌都能引起細胞凋亡。現已證實,金黃色葡萄球菌、銅綠假單胞菌、沙門氏菌、幽門螺桿菌等均可以誘導宿主細胞發生或加重凋亡。機體受到細菌感染后,一方面致病菌誘導宿主細胞凋亡,有助于細菌的入侵、毒素的釋放或殺死巨噬細胞和淋巴細胞;另一方面,宿主細胞發生凋亡也是一種防御反應,可以消滅或限制致病菌的生長。
本發明以Hoechst 33258染色觀察細胞形態學改變和Annexin-V FITC/PI雙染流式細胞儀分析兩種方法,研究大腸桿菌O157:H7對IPEC-J2細胞凋亡的誘導作用。結果表明,大腸桿菌O157:H7可以誘導IPEC-J2細胞發生凋亡,且凋亡細胞形態改變都很明顯。Hoechst33258染色與Annexin-V FITC/PI雙染這兩種方法所得結果一致。大腸桿菌O157:H7感染IPEC-J2細胞后30min就有細胞凋亡,隨著大腸桿菌O157:H7刺激時間的延長,凋亡細胞率隨著增高。研究發現,大腸桿菌O157:H7的主要致病因子類志賀毒素(STX)的B亞基能夠誘導表達Gb3受體的細胞發生凋亡,因此對細胞凋亡與大腸桿菌O157:H7感染關系的進一步研究,將為大腸桿菌O157:H7感染所致疾病的預防和治療提供新的思路和手段。
- 還沒有人留言評論。精彩留言會獲得點贊!