與激活型肝星狀細胞特異性結合的多肽及制備方法和應用與流程
本發明涉及一種與激活型肝星狀細胞特異性結合的多肽及其制備方法,具體屬于生物技術領域。
背景技術:
肝纖維化(hepatic fibrosis)是由各種致病因子所致肝內結締組織異常增生,導致肝內彌漫性細胞外基質(extracellular matrix,ECM)過度沉淀的病理過程。病毒性肝炎、酒精肝、脂肪肝、自身免疫性肝病等多種肝病都可導致肝纖維化發生,是肝纖維化的常見病因。在我國,病毒性肝炎的發病率很高,其他肝病也較為常見,這些疾病的慢性發展通常演化為肝纖維化、肝硬化,甚至導致肝癌,已經成為嚴重影響我國人民健康的重大疾患之一。目前普遍認為慢性肝損傷在肝纖維化階段是可逆轉的,因此如何有效地控制及逆轉肝纖維化,防止其進一步演變具有極其重要的意義。
在對肝纖維化發病機制的研究中發現,肝星狀細胞(hepatic stellate cells,HSCs)激活在肝纖維化病理過程中扮演著關鍵性角色。在慢性肝損傷過程中,肝細胞、肝庫普弗細胞、血小板、內皮細胞等釋放一系列細胞因子使靜止型HSCs激活轉化為激活型HSCs,即肌成纖維細胞樣細胞(myofibroblast-like cells,MFCs)。激活型HSCs分泌大量的膠原蛋白,使Disse間隙的ECM增多;同時上調基質金屬蛋白酶抑制劑(matrix metalloproteinase inhibitor,MMPI)和組織金屬蛋白酶抑制劑(tissue inhibitor of metalloproteinase,TIMP)的表達,使ECM降解減少,導致ECM不斷堆積增加而形成肝纖維化和肝硬化。HSCs的活化是肝纖維化發生發展過程中的中心事件,激活型HSCs是肝纖維化發生發展中的“罪魁禍首”,也是肝纖維化防治的關鍵靶細胞。因此,篩選出一種與激活型肝星狀細胞特異性結合的多肽,顯得尤為必要。
技術實現要素:
為解決現有技術的不足,本發明的目的在于提供一種與激活型肝星狀細胞特異性結合的多肽及制備方法和應用,所得多肽可以與激活型肝星狀細胞特異性結合,其制備方法操作簡單,準確度高;所得多肽可用于制備肝纖維化診斷試劑或肝纖維化靶向治療藥物中。
為了實現上述目標,本發明采用如下的技術方案:
與激活型肝星狀細胞特異性結合的多肽,所述多肽的氨基酸序列為Thr-Val-Arg-Thr-Ser-Ala-Asp。
一種與激活型肝星狀細胞特異性結合的多肽的制備方法,其特征在于:包括以下步驟:(1)靜止型肝星狀細胞與激活型肝星狀細胞培養;(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選;(3)經DNA測序確定目標多肽。
前述與激活型肝星狀細胞特異性結合的多肽的制備方法中,步驟(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選,具體為:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉;在靜止型肝星狀細胞中加入噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育,棄去與激活型肝星狀細胞孵育后的上清液,用PBST緩沖液洗滌6次,加入pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫;收集洗脫液,加入pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液所含噬菌體滴度;隨后取該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟數次,篩選結束。本申請中采用差減篩選的方法,先去除與靜止型肝星狀細胞結合的噬菌體,隨后去除不與激活型肝星狀細胞結合的噬菌體,通過逐步的篩選過程,使得最終所得噬菌體具備僅與激活型肝星狀細胞特異性結合的特性,保障了最終篩選結果的高效性、準確性。
進一步地,前述與激活型肝星狀細胞特異性結合的多肽的制備方法中,步驟(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選,具體為:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入1.5mL質量濃度為1%的BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉30min;在靜止型肝星狀細胞中加入1.5mL滴度為2×1011pfu的噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育1h;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育1h,棄與激活型肝星狀細胞孵育后的上清液,用0.1%~0.3%PBST緩沖液洗滌6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫10min;收集洗脫液,加入150μL1mol/L的pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取0.5mL該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟數次,篩選結束。
進一步地,前述與激活型肝星狀細胞特異性結合的多肽的制備方法中,步驟(2)中共完成3~5輪篩選,所用0.1%~0.3%PBST緩沖液是指含Tween-20體積濃度為0.1%~0.3%的PBS緩沖液。
優選地,前述與激活型肝星狀細胞特異性結合的多肽的制備方法,步驟(2)中共完成4輪篩選;其中,第一輪篩選中所用0.1%PBST緩沖液為含Tween-20體積濃度為0.1%的PBS緩沖液;第二輪篩選中所用PBST緩沖液為0.2%PBST緩沖液,即含Tween-20體積濃度為0.2%的PBS緩沖液;第三輪和第四輪篩選中所用PBST緩沖液為0.3%PBST緩沖液,即含Tween-20體積濃度為0.3%的PBS緩沖液;第四輪篩選時洗脫液進行滴度測定后不再進行擴增純化。本申請中優選采用在不同的篩選階段選用不同濃度的緩沖液進行篩選操作,篩選范圍由大到小逐漸收縮,提升了篩選得到合適噬菌體的可能性,提高了篩選成功率。
前述與激活型肝星狀細胞特異性結合的多肽的制備方法中,步驟(3)經DNA測序確定目標多肽,具體為:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。測序結果顯示插入序列重復次數越多的噬菌體,其與激活型肝星狀細胞結合的特異性就越高、親和力也越高,該噬菌體展示的多肽即為與激活型肝星狀細胞特異性結合且親和力較高的多肽。
前述與激活型肝星狀細胞特異性結合的多肽的制備方法中,步驟(1)中靜止型肝星狀細胞是通過以下步驟培養:將大鼠麻醉后,采用質量濃度為0.05%的Ⅳ膠原酶體外循環消化以及Opetiprep密度梯度離心的方法,分離大鼠原代肝星狀細胞,用含20%FBS的高糖DMEM培養基重懸細胞,按3×106接種于6cm培養皿中,置于37℃、體積濃度5%的CO2的二氧化碳培養箱中培養24h,細胞貼壁單層長滿皿底,即得靜止型肝星狀細胞。當采用質量濃度為0.05%的Ⅳ膠原酶和質量濃度為0.1%的鏈蛋白酶體外循環消化時,鏈蛋白酶可以特異性地消化肝細胞,減少肝細胞與肝星狀細胞的粘附,提高肝星狀細胞的純度。
前述與激活型肝星狀細胞特異性結合的多肽的制備方法中,步驟(1)中激活型肝星狀細胞是通過以下步驟培養:原代分離的肝星狀細胞培養14天后,質量濃度為0.25%的胰酶常規消化傳代,用含10%FBS的高糖DMEM培養基重懸細胞沉淀后接種到新的6cm培養皿中,置于37℃、體積濃度5%的CO2條件下培養,待細胞貼壁單層長滿皿底,即得激活型肝星狀細胞。現有的從肝組織中分離純化出HSCs的方法,存在酶消耗量大、操作復雜不易控制或者是操作系統體積龐大、結構復雜等問題。采用本申請中方法培養靜止型肝星狀細胞和激活型肝星狀細胞,大幅降低了酶的用量,簡化了操作步驟,降低了操作難度,縮短了操作時間,易于培養得到靜止型肝星狀細胞和激活型肝星狀細胞。此外,也有效避免了常規方法培養得到靜止型肝星狀細胞自發活化的問題。
前述與激活型肝星狀細胞特異性結合的多肽在制備肝纖維化診斷試劑或肝纖維化靶向治療藥物中的應用。
為了確保本發明技術方案的科學、有效,發明人進行了一系列的實驗。具體如下所示。
1、實驗主要材料
1.1、實驗動物:雄性Wistar大鼠,購于重慶滕鑫生物技術有限公司,動物合格證號:SCXK(渝)2007-005。
1.2、細胞株:人肝星狀細胞株LX-2,大鼠肝星狀細胞株HSC-T6,人肝細胞株LO2,人肝癌細胞株HepG2,購于廣州吉妮歐生物科技有限公司。
1.3、主要儀器
超凈工作臺:蘇州凈化;倒置顯微鏡:德國ZEISS;CO2培養箱:美國Thermo;高速臺式冷凍離心機:Allegar 64R型,美國Beckman;肝組織循環灌流消化儀:本課題組設計并申請專利,專利號:ZL201420633713.7;臺式恒溫培養搖床:COS-100B型,上海比郎儀器制造有限公司;全波段酶標儀:SYNERGY H4型,美國BioTek;恒溫培養箱:HPX-9052MBE型,上海博訊實業有限公司醫療設備廠;生物安全柜:AB2-4S1型,新加坡ESCO;激光共聚焦顯微鏡:德國ZEISS;Bullet Blender:BB24-AU型,美國Next Advance。
1.4、主要試劑
DMEM(高糖)培養基:Hyclon公司;胎牛血清:Gibico公司;雙抗(青鏈霉素混合液):北京索萊寶科技有限公司;Ⅳ膠原酶:北京索萊寶科技有限公司;鏈蛋白酶:北京索萊寶科技有限公司;DNaseⅠ:北京索萊寶科技有限公司;Opetiprep密度梯度離心液:挪威Axis-Shield公司;牛血清白蛋白(BSA):sigma公司;Ph.D.-C7C噬菌體展示肽庫試劑盒:New England BioLabs公司。(包含①噬菌體隨機環七膚文庫,文庫滴度為2×1013pfu/ml,隨機多樣性為1.28×109;②–28gIII測序引物5′d(GTATGGGATTTTGCTAAACAAC)3′,–96gIII測序引物5′d(CCCTCATAGTTAGCGTAACG)3′;③E.coli宿主菌ER2738);空白對照噬菌體:New England BioLabs公司;PBS粉劑:北京鼎國昌盛生物技術有限責任公司;酵母提取物:Sigma公司;蛋白胨:Sigma公司;瓊脂糖:GENE公司;四環素:北京鼎國生物生物技術責任有限公司;IPTG(異丙基-β-D-硫代半乳糖苷):北京鼎國昌盛生物生物技術責任有限公司;X-gal(5-溴-4-氯-3吲哚-β-半乳糖苷):北京鼎國昌盛生物生物技術責任有限公司;二甲基甲酰胺:北京鼎國昌盛生物生物技術責任有限公司;聚乙二醇8000(PEG 8000):北京鼎國昌盛生物生物技術責任有限公司;PEG 8000:北京索萊寶科技有限公司;甘油:北京鼎國昌盛生物生物技術責任有限公司(121℃、20min高壓蒸汽滅菌,常溫下保存);HRP-抗M13噬菌體單克隆抗體:美國GE Healthcare公司;TMB底物顯色試劑盒:北京康為世紀生物科技有限公司;抗M13噬菌體單克隆抗體:New England BioLabs公司;Rabbit polyclonal Secondary Antibody to Mouse IgG-H&L,Abcam公司;DAPI:上海碧云天生物技術有限公司;488標記的抗組蛋白標簽抗體(Anti-6X His antibody,488):Abcam公司。其余所用的各種材料和試劑都是本領域中常用的材料和試劑,可以通過常規的商業途徑獲得。
1.5、主要試劑的配制
1.5.1、D-Hanks液(不含酚紅):精確稱取NaCl 8.0g、KCl 0.4g、Na2HPO 4.12g、H2O 0.133g、KH2PO4 0.06g和NaHCO3 0.35g,溶于適量超純水中,定容至1000mL,0.22μm微孔濾膜過濾除菌,4℃保存。
1.5.2、HBSS液(不含酚紅):精確稱取NaCl 8.0g、KCl 0.4g、MgSO4·7H2O 0.1g、MgCl2·6H2O 0.1g、Na2HPO4·2H2O 0.06g、KH2PO4 0.06g、C6H12O6 1.0g、CaCl2 0.14g和NaHCO3 0.35g,加超純水至1000mL,0.22μm微孔濾膜過濾,4℃保存。
1.5.3、全培養基(含20%FBS):無菌條件下準確量取79mL DMEM(高糖培養基),加入20mLFBS(胎牛血清)、1mL 100×雙抗,混勻,調整HP值為7.2~7.4,4℃保存。
1.5.4、全培養基(含10%FBS):無菌條件下準確量取89mL DMEM(高糖培養基),加入10mLFBS、1mL 100×雙抗,混勻,調整HP值為7.2~7.4,4℃保存。
1.5.5、PBS溶液:1L規格的PBS粉劑,溶于1L超純水中,溶解完全后,0.22μm微孔濾膜過濾除菌和雜質,移至高溫滅菌過的廣口瓶中,高壓滅菌20min,4℃保存。
1.5.6、質量濃度為0.25%的胰酶消化液:稱取0.5g的胰酶溶解于200mL的PBS溶液中(在冰浴中進行),攪拌溶解完全后,0.22μm的微孔濾膜過濾除菌,分裝后,-20℃保存。
1.5.7、LB培養基:胰化蛋白胨10g、酵母提取物5g和NaCl 5g加超純水至lL,用5mol/L NaOH調節pH至7.2~7.6,高壓蒸汽滅菌,4℃儲存。
1.5.8、LBT培養基:胰化蛋白胨10g、酵母提取物5g和NaCl 5g加超純水至1L,用5mol/L NaOH調節pH至7.2~7.6,高壓蒸汽滅菌,冷卻到70℃加入四環素Stoek 10μL,4℃儲存。
1.5.9、LB平板:胰化蛋白胨10g、酵母提取物5g、NaCl 5g和Agar15g,加超純水至1L,用5mol/L NaOH調節pH至7.2~7.6,高壓蒸汽滅菌,冷卻到70℃后加入到9cm的培養皿中鋪制LB平板,4℃避光保存。
1.5.10、四環素儲存液:按20mg/ml的濃度溶于無水乙醇中,-20℃冰箱中避光保存。
1.5.11、LBT平板:胰化蛋白胨10g、酵母提取物5g、NaCl 5g和Agar15g,加超純水至1L,用5mol/L NaOH調節pH至7.2~7.6,高壓蒸汽滅菌,冷卻到70℃后加入后加入四環素儲存液l mL,鋪制LBT平板,4℃避光保存。
1.5.12、PEG 8000/NaCl的配制:PEG-8000 60g和NaCl 43.83g,加超純水至300mL,121℃下,20min高壓滅菌,冷卻時振蕩防止分層,室溫下儲存。
1.5.13、IPTG/Xgal:稱取1.25g IPTG和1g Xgal溶于25mL二甲基甲酰胺中,-20℃避光保存。
1.5.14、LB/IPTG/Xgal平板:LB培養基+15g/L瓊脂粉,高壓滅菌,冷卻至低于70℃時,加入1mL IPTG/Xgal,混勻倒平板,平板4℃避光貯存。
1.5.15、頂層瓊脂:胰蛋白胨10g、酵母提取物5g、NaC1 5g、MgCl2·6H2O 1g和Agarose瓊脂糖7g,加超純水至1L,高壓滅菌,分裝于50mL錐形瓶,室溫保存,用時微波爐溶解。
1.5.16、質量濃度為1%的BSA:稱取1g BSA,加入100mLPBS,4℃冰箱中保存。
1.5.17、TBS(Tris緩沖鹽溶液):NaCl 8g、KCl 0.2g和Tris3g,溶于800mL超純水,HCl調pH值到7.4,超純水定容至1000mL,121℃、20min高壓蒸汽滅菌,室溫保存。
1.5.18、0.2mol/L的甘氨酸-鹽酸緩沖液(pH=2.2):50mL 0.2mol/L甘氨酸+44mL 0.2mol/L鹽酸,加超純水稀釋至200mL,0.22μm微孔濾膜過濾除菌,4℃保存。
2、實驗方法
2.1、細胞準備
2.1.1、大鼠麻醉后,采用質量濃度為0.05%的Ⅳ膠原酶和質量濃度為0.1%的鏈蛋白酶體外循環消化及Opetiprep密度梯度離心的方法,分離大鼠原代HSCs,用含20%FBS的高糖DMEM培養基重懸細胞,按3×106接種于6cm培養皿中,置于體積濃度5%的CO2、37℃的二氧化碳培養箱中培養24h,細胞貼壁單層長滿皿底,該細胞為靜止型HSCs,用于篩選。
2.1.2、原代分離的HSCs培養14天后,質量濃度為0.25%的胰酶常規消化傳代,用含10%FBS的高糖DMEM培養基重懸細胞沉淀后接種到新的6cm培養皿中,置于37℃、體積濃度5%的CO2條件下培養,待細胞貼壁單層長滿皿底,用于篩選。該細胞為激活型HSCs。
前期進行的自發熒光檢測、油紅O染色、Western blot及細胞免疫熒光檢測細胞desmin、α-SMA、CollagenⅠ表達等相關實驗已經證實上述方法原代分離培養培養24h的細胞為靜止型HSCs,傳代培養的細胞為激活型HSCs。
2.2、噬菌體隨機肽庫差減篩選和富集效應分析
取生長良好的靜止型HSCs及激活型HSCs,在37℃、體積濃度5%的CO2條件下,于無血清培養基中培養2h后進行篩選。分別在靜止型HSCs及激活型HSCs細胞培養皿中加入1.5mL質量濃度為1%的BSA,37℃、50rpm恒溫培養搖床中封閉30min;先在靜止型HSCs中加入1.5mL噬菌體原肽庫的稀釋液(滴度為2×1011pfu),于37℃、50rpm恒溫培養搖床中孵育1h;再將與靜止型HSCs孵育后的上清液(其中含未與靜止型HSCs結合的噬菌體)加入封閉后的激活型HSCs中,37℃、50rpm恒溫培養搖床中孵育1h;棄與激活型HSCs孵育后的上清液,用0.1%PBST緩沖液(Tween-20體積濃度為0.1%的PBS緩沖液)洗6次;加入1mL 0.2mol/L的甘氨酸-鹽酸緩沖液(pH=2.2),置于37℃、50rpm恒溫培養搖床上洗脫10min。收集洗脫液,加入150μL1mol/L的Tris-HCl(pH=9.1)進行中和,此洗脫液中含第一輪篩選出的噬菌體。取10μL洗脫液用LB/IPTG/X-gal平板培養測定噬菌體滴度,并計算回收率(即產出量與投入量比值,投入量為篩選前的噬菌體滴度,產出量為篩選后的噬菌體滴度)。取0.5mL洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體用離心及PEG/NaCl沉淀的方法進行純化(擴增后菌液倒入50mL離心管中,4℃、10000rpm條件下離心10min;將上清液的80%轉入新的50mL離心管中,加入1/6體積的PEG/NaCl,4℃沉淀過夜;4℃、12000rpm條件下離心10min,吸棄上清液,沉淀用1mL TBS重懸;重懸液于4℃、10000rpm條件下離心5min;上清液轉入1.5ml Epp管內,加入1/6體積的PEG/NaCl,冰上孵育60min;4℃、12000rpm條件下離心10min,吸棄上清液,沉淀用200μL TBS重懸;重懸液于4℃、10000rpm條件下離心5min,棄沉淀;上清轉入一個新的無菌0.5mL Epp管內,此為擴增并純化的噬菌體液,噬菌體液以1∶1的比例與滅菌甘油混勻后,儲存于-20℃,備用)。再次測定擴增、純化后噬菌體滴度,然后進行下一輪篩選。按同樣方法進行四輪篩選,四輪篩選中需注意:①其中第二輪篩選時洗脫所用液體為體積濃度為0.2%的PBST緩沖液(含Tween-20體積濃度為0.2%的PBS緩沖液),第三輪篩選時洗脫所用液體為體積濃度0.3%的PBST緩沖液(含Tween-20體積濃度為0.3%的PBS緩沖液),第四輪篩選時洗脫所用液體為體積濃度0.3%的PBST緩沖液(含Tween-20體積濃度為0.3%的PBS緩沖液);②第四輪篩選后的洗脫液只進行滴度測定,不需再擴增純化。
2.3、陽性噬菌體DNA測序
對第四輪篩選后的洗脫液進行滴度測定時,在LB/IPTG/X-gal平板上隨機挑起若干個(本次試驗中選擇34個)藍斑(陽性噬菌體克隆),并將每個克隆分別進行擴增和純化。純化后的陽性噬菌體克隆保存于50%甘油中,送上海生工采用自動測序儀進行測序。測序引物為:–96gIII測序引物5′d(CCCTCATAGTTAGCGTAACG)3′。根據所測出的堿基系列,在其插入位點(CGA ACA(NNM)7ACG CCA CCT CCA)找到插入系列(該片段中(NNM)7即為編碼所展示七肽的堿基序列,(NNM)7兩端ACA和ACG是編碼環七肽兩側相互連接成環半胱氨酸的密碼子)。再按照“堿基互補配對及密碼子決定氨基酸”的原理去推導出插入系列展示的多肽系列。
2.4、陽性噬菌體與激活型HSCs結合的親和力檢測
測序結果顯示34個陽性克隆對應20種DNA系列,即20種噬菌體。ELISA實驗檢測20種陽性噬菌體與激活型HSCs結合的親和力。
取激活型HSCs(傳代培養的HSCs),常規消化后用含10%FBS的DMEM(高糖)培養基將細胞密度調整成1×105/mL,按每孔100μL接種于96孔板上;培養至細胞貼壁長滿單層,棄培養基,PBS洗3遍,體積濃度為10%的中性福爾馬林常溫下固定30min;棄福爾馬林,PBS洗3遍,滴加體積濃度為3%的過氧化氫(100μL/孔),置于37℃孵箱中30min,阻斷內源性過氧化物酶活性;每孔加入質量濃度為1%的BSA 200μL,37℃封閉1h;將20種陽性噬菌體克隆分別加入孔中(1×1010pfu/孔),每個噬菌體克隆設3個復孔,另設空白噬菌體作陰性對照,設PBS為空白對照;37℃溫箱中孵育1h,吸棄上清液中未與細胞結合的噬菌體,用0.1%PBST緩沖液(Tween-20體積濃度為0.1%的PBS緩沖液)洗6遍,去除非特異性結合的噬菌體;加入Ⅰ抗(HRP-抗M13單克隆抗體,稀釋比例1∶5000)100μL/孔,37℃孵育1h;棄Ⅰ抗,PBS洗滌3次,每孔加入100μL TMB避光反應30min,加入50μL 0.1mol/L H2SO4終止反應;酶標儀上檢測各孔450nm處OD值。同時以靜止型HSCs(原代剛分離的大鼠HSCs),用含20%FBS的DMEM培養基將細胞密度調整成3×105/mL,按每孔100μL接種于96孔板上;接種24h后,細胞貼壁長滿單層,用體積濃度為10%的中性福爾馬林常溫下固定,用相同方法檢測各噬菌體克隆與靜止型HSCs結合后的OD450值。比較各陽性噬菌體克隆分別與靜止型HSCs及激活型HSCs結合后的OD值差異。
2.5、7號噬菌體與激活型HSCs結合的特異性鑒定
將測序鑒定出的20種噬菌體分別編號為1~20號,測序結果顯示其中7號噬菌體重復次數最多,共計10次。ELISA實驗結果顯示,7號噬菌體與激活型HSCs結合的親和力亦較高。采用細胞免疫熒光實驗鑒定7號噬菌體與激活型HSCs結合的特異性。
分別將傳代培養的大鼠HSCs(激活型)、原代分離的大鼠HSCs(靜止型)、HSC-T6(大鼠肝星狀細胞株,表型為激活型)、LX-2(人肝星狀細胞株,表型為激活型)、LO2(人肝細胞株)及HepG2(人肝癌細胞株)細胞接種于多聚賴氨酸包被過的激光共聚焦掃描顯微鏡專用皿(NEST,15mm)中;培養24h,細胞貼壁生長,體積濃度為10%的中性福爾馬林固定;吸去福爾馬林,PBS洗2次,每次5min;質量濃度為1%的BSA在37℃下封閉30min;加入7號噬菌體(滴度2×1011puf)37℃孵育1h;吸棄噬菌體,體積濃度為0.1%的PBST緩沖液(Tween-20體積濃度為0.1%的PBS緩沖液)洗6次,每次5min,去除非特異性結合的噬菌體;加入質量濃度為0.1%的NaBH4室溫處理10min,消除背景熒光;用Triton X-100體積濃度為0.2%的PBS緩沖液洗2次,每次5min,洗凈殘存的NaBH4;質量濃度為1%的BSA在37℃下封閉30min;加入Ⅰ抗(抗M13噬菌體單克隆抗體,稀釋比例1:100),4℃孵育過夜;棄Ⅰ抗,用Triton X-100體積濃度為0.2%的PBS緩沖液洗3次,每次5min;加入熒光Ⅱ抗(Rabbit polyclonal Secondary Antibody to Mouse IgG-H&L,550,稀釋比例為1:100)室溫孵育2h;棄Ⅱ抗,用Triton X-100體積濃度為0.2%的PBS緩沖液洗3次,每次5min;加入80μL DAPI染核,37℃孵育15min;PBS洗2次,每次5min;加入500μL PBS,激光共聚焦掃描顯微鏡觀察(檢測DAPI以及DyLight 550)并拍照。
另將傳代培養的大鼠HSCs、LX-2及HSC-T6(均為激活型HSCs),與空白噬菌共孵育,以同樣的方法檢測空白噬菌體是否與激活型HSCs結合。
2.6、7號噬菌體在肝纖維化模型大鼠體內的組織特異性檢測
取體重180~220g的雄性Wistar大鼠,采用皮下注射CCl4的方法建立CCl4誘導的肝纖維化大鼠模型。取2只肝纖維化模型大鼠及1只正常對照大鼠,腹腔注射質量濃度為8%的水合氯醛0.5mL/100g麻醉;舌下靜脈注射1mL滅活空白噬菌體(3×1012puf)循環40min,以封閉非特異性吞噬系統;封閉后,取1只模型大鼠靜脈注射7號噬菌體(2×1012puf),1只模型大鼠靜脈注射空白噬菌體(2×1012puf),對照大鼠靜脈注射7號噬菌體(2×1012puf),讓噬菌體在體內循環40min;大鼠胸腹部剃毛,碘伏、75%酒精依次消毒皮膚,剪開胸腔,心臟灌注生理鹽水沖凈全身血液,分別取心、肝、脾、肺、腎、腦及肌肉組織各一塊置于無菌平皿中,無菌生理鹽水洗3遍后裝入無菌EP管中;用眼科剪將EP管內的組織剪碎,再用無菌生理鹽水反復洗滌至肉眼見不到紅色(紅細胞);準確稱取剪碎后各組織100mg,加入新的無菌EP管中,加入400μL PBS,置于Bullet Blender中,制成組織勻漿;將組織勻漿液于4℃、10000rpm下離心10min,棄上清;加入體積濃度為0.1%的PBST緩沖液(Tween-20體積濃度為0.1%的PBS緩沖液)同樣條件下離心,洗滌組織沉淀6次,以去除非特異性結合的噬菌體;組織沉淀中加入1mL PBS混勻,制成100mg/mL的組織懸液。從中取出100μL(含組織10mg)進行噬菌體滴度測定。具體方法:100μL組織懸液,4℃、10000rpm離心10min,棄上清,沉淀中加入100μL ER2738大腸桿菌(OD600≈0.5)中靜置感染20min,再加入900μL LB培養基中室溫孵育30min;從中取出100μL加入3mL頂層瓊脂(45℃)混勻,傾注于37℃預溫的10cm LB/IPTG/Xgal平板上,37℃孵育過夜;計數平板上的藍斑數,計算出各組織的噬菌體滴度。若組織中藍斑過多而無法計數,則需重新取100μL組織懸液適度稀釋后再計算其噬菌體滴度。
2.7、Q肽與7號噬菌體克隆的競爭性結合實驗
上述實驗證實7號噬菌體與激活型HSCs(包括傳代培養的大鼠HSCs、大鼠肝星狀細胞株HSC-T6及人肝星狀細胞株LX-2)的結合具有較高的特異性,且在肝纖維化模型大鼠肝組織中有一定富集。7號噬菌體展示的多肽系列為:Thr-Val-Arg-Thr-Ser-Ala-Asp,命名為Q肽。采用競爭性結合實驗來鑒定Q肽是否能抑制7號噬菌體與激活型HSCs的特異性結合,以便考察7號噬菌體是否是通過其表面展示的Q肽與激活型HSCs結合的。
取激活型HSCs(傳代培養的大鼠HSCs),按3×105/孔接種到6孔板中,待細胞貼壁長滿單層,棄培養基,PBS洗3遍;質量濃度為1%的BSA在37℃封閉30min,在6個孔中分別加入質量濃度為10μg/mL、1μg/mL、0.1μg/mL、0.01μg/mL、0.001μg/mL及0μg/mL(對照組)的Q肽(委托吉爾生化(上海)有限公司合成,Cys-Thr-Val-Arg-Thr-Ser-Ala-Asp-Cys,CC二硫鍵成環;合成多肽經HPLC純化和質譜分析鑒定,純度達98%。),37℃孵育20min;在每孔中加入7號噬菌體2×1011puf,37℃孵育1h;吸棄各孔中含有噬菌體的上清,用體積濃度為0.1%的PBST緩沖液(Tween-20體積濃度為0.1%的PBS緩沖液)洗6遍,去除非特異性結合噬菌體;每孔加入1mL 0.2mol/L的甘氨酸-鹽酸緩沖液(pH=2.2),置于37℃、50rpm條件下恒溫培養搖床上洗脫10min;收集洗脫液到一潔凈無菌的1.5mL Epp管內,加入150μL1mol/L的Tris-HCl(pH=9.1)進行中和;測定各孔洗脫液中噬菌體滴度,計算抑制率[抑制率=(對照組噬菌體滴度-多肽各濃度組噬菌體滴度)/對照組噬菌體滴度×100%)]。同時采用同樣的方法檢測對照多肽(委托吉爾生化(上海)有限公司合成,Cys-Ser-Thr-Ala-Val-Asp-Thr-Arg-Cys,CC二硫鍵成環;合成多肽經HPLC純化和質譜分析鑒定,純度達98%。)對7號噬菌體與激活型HSCs結合的抑制率,并進行比較。
2.8、Q肽與激活型HSCs結合的特異性鑒定
競爭性結合實驗結果顯示Q肽可以明顯抑制7號噬菌體與激活型HSCs的結合,表明7號噬菌體與激活型HSCs的結合是通過其表明展示的Q肽實現的。采用免疫熒光實驗進一步證明Q肽在脫離了噬菌體這個載體后是否還能與激活型HSCs特異性結合。
委托吉爾生化(上海)有限公司合成組氨酸標簽標記的Q肽(His-His-His-His-His-Hi s-Cys-Thr-Val-Arg-Thr-Ser-Ala-Asp-Cys,CC二硫鍵成環)及組氨酸標記的對照多肽(His-His-His-His-His-His-Cys-Ser-Thr-Ala-Val-Asp-Thr-Arg-Cys,CC二硫鍵成環)合成的兩種多肽經HPLC純化和質譜分析鑒定,純度達98%。
分別將傳代培養的大鼠HSCs(激活型)、原代分離的大鼠HSCs(靜止型)、LX-2、HSC-T6、LO2及HepG2細胞接種于多聚賴氨酸包被過的激光共聚焦掃描顯微鏡專用的玻底皿中;培養24h后,用體積濃度為10%的中性福爾馬林固定;棄福爾馬林,PBS洗3次,每次5min;質量濃度為1%的BSA在37℃下封閉30min;所有細胞各取一皿加入100μg/mL(質量濃度為1%的BSA配制)的組氨酸標記Q肽100μL,再取傳代培養的大鼠HSCs、LX-2、HSC-T6(均為激活型)各一皿,加入100μg/mL的組氨酸標記對照多肽100μL,37℃孵育1h;PBS洗3次,每次5min;加入體積濃度為0.1%的NaBH4,室溫處理10min,消除背景熒光;用Triton X-100體積濃度為0.2%的PBS洗2次,每次5min;加入Ⅰ抗(488標記的抗組氨酸標簽抗體,稀釋比例1:100),4℃孵育過夜;棄抗體,PBS洗3次,每次5min;加入80μL DAPI染核,孵箱內37℃孵育15min;PBS洗2次,每次5min;加入500μL PBS,激光共聚焦掃描顯微鏡觀察(檢測DAPI以及DyLight 488)并拍照。
3、實驗結果
3.1、細胞培養結果
采用體外循環消化及密度梯度離心的方法分離到的大鼠HSCs培養24h時,細胞貼壁生長,細胞體積較小、折光性強,符合靜止型HSCs的特點;經傳代培養后,細胞體積明顯增大,胞突伸展,符合激活型HSCs的特征。見圖1。
3.2、每輪篩選后滴度測定和富集效應結果
取10μL每輪篩選后收集洗脫液,適當倍數稀釋,測定其噬菌體滴度。結果顯示,經過4輪差減篩選,回收量從第一輪的1.48×104pfu增加到第四輪的1.24×109pfu,回收率從第一輪的7.4×10-6(%)增加到第四輪的6.2×10-1(%),陽性噬菌體克隆得到有效的富集。見表1。
表1每輪篩選回收量及富集倍數
3.3、DNA系列測定結果
隨機挑起的34個陽性噬菌體克隆,共對應20種DNA系列,即20種噬菌體,分別編號為1~20號噬菌體。其中7號噬菌體重復次數最多,共計10次。7號噬菌中插入的系列為TGA CAA TCC TGC AGA CGA,所展示的多肽氨基酸系列為Thr-Val-Arg-Thr-Ser-Ala-Asp。7號噬菌體出現頻率最高,呈現出高富集性,將其展示的多肽命名為Q肽。
3.4、陽性噬菌體與激活型HSCs結合的親和力測定結果
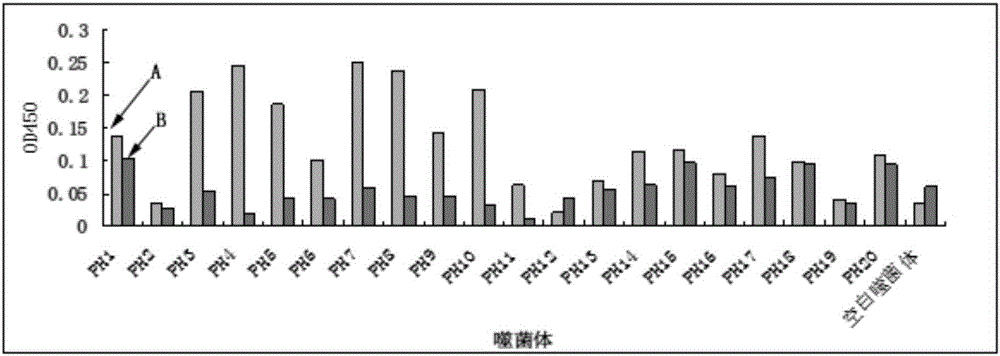
采用ELISA實驗對篩選出的20種陽性噬菌體與激活型HSCs特異性結合的親和力進行鑒定的結果顯示,20種噬菌體中絕大部分噬菌體與激活型HSCs結合的OD值均高于與靜止型HSCs結合的OD值;其中,7號噬菌體與激活型HSCs結合的OD值最高,且與激活型HSCs結合的OD值較與靜止型HSCs結合的OD值高10.95倍。如圖2所示。表明7號噬菌體與激活型HSCs有較高的親和力。
3.5、7號噬菌體與激活型HSCs細胞結合的特異性鑒定結果
實驗中所用的熒光Ⅱ抗被DyLight 550標記,被賦予黃色偽色彩;DAPI用于細胞核染色,被賦予藍色偽色彩。結果顯示:7號噬菌體分別與傳代培養的大鼠HSCs、大鼠肝星狀細胞株HSC-T6及人肝星狀細胞株LX-2三種表型為激活型的HSCs共孵育后,激光共聚焦顯微鏡下可見細胞核呈現較強的藍色熒光,細胞膜上有較強的黃色熒光;7號噬菌與靜止型HSCs(原代分離培養24h的大鼠HSCs)、人肝細胞株LO2和人肝癌細胞株HepG2共孵育后,激光共聚焦顯微鏡下細胞核呈現較強的藍色熒光,但基本見不到細胞膜上有黃色熒光;空白噬菌體與傳代培養的大鼠HSCs、大鼠肝星狀細胞株HSC-T6及人肝星狀細胞株LX-2三種表型為激活型的HSCs共孵育后,激光共聚焦顯微鏡下細胞核呈現較強的藍色熒光,未見到細胞膜上有明顯的黃色熒光。如圖3、4和5所示。結果表明,7號噬菌體與傳代培養的大鼠HSCs、大鼠肝星狀細胞株HSC-T6及人肝星狀細胞株LX-2三種表型為激活型的HSCs結合,而與其他細胞不結合,提示7號噬菌體與激活型HSCs的結合具有特異性。
3.6、7號噬菌體在肝纖維化模型大鼠體內的組織特異性檢測結果
在肝纖維化模型大鼠及正常大鼠體內分別注入7號噬菌體及空白噬菌體后,分別取3只大鼠的心、肝、脾、肺、腎、腦及肌肉組織進行噬菌體滴度測定。在檢測3只大鼠心、肺、腎、腦及肌肉組織的LB/IPTG/Xgal平板上均未見到藍斑,檢測不到相應組織的噬菌體滴度;而3只大鼠的肝、脾組織中均見到了藍色噬菌體斑。3只大鼠脾組織檢測后的藍斑計算在100以內,按100mg組織計則3只大鼠脾組織的藍斑數均在103數量級;3只大鼠肝組織檢測后的藍斑均較多,無法計數,逐對肝組織勻漿液進行稀釋后再次檢測,結果3只大鼠肝臟(100mg)中噬菌體滴度在104~105級,注入7號噬菌體的正常大鼠及注入空白噬菌體的肝纖維化大鼠肝組織(100mg)中噬菌體滴度在104級,注入陽性噬菌體的肝纖維化大鼠肝組織(100mg)內的噬菌體滴度最高,為105級。如表2所示。表明7號噬菌體能在肝纖維模型大鼠的肝組織內有一定富集,提示7號噬菌體對纖維化肝組織具有一定的特異性。
表2各組織中噬菌體滴度檢測結果
3.7、Q肽與7號噬菌體的競爭性結合實驗結果
競爭性結合實驗結果顯示:與不加入Q肽的對照組比較,在加入不同濃度Q肽的各組中與激活型HSCs結合的7號噬菌體數明顯減少,且Q肽濃度越高,與激活型HSCs結合的7號噬菌體數越少。表明Q肽可以明顯抑制7號噬菌體與激活型HSCs的結合,且Q肽濃度越高,其抑制作用越強,呈現出一定的劑量依賴性。如見圖6所示。提示7號噬菌體與激活型HSCs的結合是通過其表面展示的Q肽實現的。
3.8、Q肽與激活型HSCs特異性結合的鑒定結果
實驗中,Q肽被接上組氨酸標簽,所用的抗體為488標記的抗組氨酸標簽抗體,被賦予綠色偽色彩;用DAPI染細胞核,被賦予藍色偽色彩。共聚焦顯微鏡下觀察顯示,Q肽分別與傳代培養的HSCs、大鼠肝星狀細胞株HSC-T6和人肝星狀細胞株LX-2三種表型為激活型的HSCs共孵育后,可觀察到細胞核顯示很強的藍色熒光,細胞膜上有較強綠色熒光;Q肽分別與原代分離培養24h的大鼠HSCs(表型為靜止型的HSCs)、LO2細胞和HepG2細胞共孵育后,可觀察到細胞核顯示很強的藍色熒光,細胞膜上有很弱的綠色熒光;無關多肽分別與傳代培養的HSCs、大鼠肝星狀細胞株HSC-T6和人肝星狀細胞株LX-2三種表型為激活型的HSCs共孵育后,可觀察到細胞核顯示較強的藍色熒光,細胞膜上有很弱的綠色熒光。如圖7、8和9所示。結果表明,Q肽能與傳代培養的大鼠HSCs、大鼠肝星狀細胞株HSC-T6及人肝星狀細胞株LX-2三種表型為激活型的HSCs結合,而與其他細胞不結合,提示Q肽能與激活型HSCs特異性結合。
本發明的有益之處在于:本發明提供的一種與激活型肝星狀細胞特異性結合的多肽,能夠與激活型肝星狀細胞進行特異性結合,親和力高,且對纖維化肝組織有一定特異性。本發明的多肽為小分子短肽,穿透力強,免疫原性小,適宜作為靶向載體。本發明多肽還可以人工合成,獲取方便。本發明的制備方法以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選,并最終得到一種與激活型肝星狀細胞結合且具有高度特異性的多肽。本發明制備方法中庫容量大,篩選成功率高,操作簡單,成本低。本發明的多肽可用于制備肝纖維化診斷試劑或肝纖維化靶向治療藥物中,可以為肝纖維化的早期診斷和靶向治療提供新的有效手段。
附圖說明
圖1是本發明的細胞培養結果圖;
圖2是20種陽性噬菌體與激活型HSCs特異性結合的親和力鑒定結果圖;
圖3是7號噬菌體與激活型HSCs特異性結合后激光共聚焦顯微鏡圖;
圖4是7號噬菌體與靜止型HSCs結合后激光共聚焦顯微鏡圖;
圖5是空白噬菌體與激活型HSCs特異性結合后激光共聚焦顯微鏡圖;
圖6是Q肽與7號噬菌體的競爭性結合結果圖;
圖7是Q肽與激活型HSCs特異性結合鑒定結果圖;
圖8是Q肽與靜止型HSCs特異性結合鑒定結果圖;
圖9是對照多肽與激活型HSCs特異性結合鑒定結果圖;
圖中附圖標記的含義:圖1:A1-第一輪篩選所用靜止型HSCs,A2-第一輪篩選所用激活型HSCs,B1-第二輪篩選所用靜止型HSCs,B2-第二輪篩選所用激活型HSCs,C1-第三輪篩選所用靜止型HSCs,C2-第三輪篩選所用激活型HSCs,D1-第四輪篩選所用靜止型HSCs,D2-第四輪篩選所用激活型HSCs;圖2:A-陽性噬菌體與激活型HSCs結合,B-陽性噬菌體與靜止型HSCs結合;圖6:A-Q肽,B-對照多肽。
具體實施方式
以下結合具體實施例對本發明作進一步的介紹。
實施例1
與激活型肝星狀細胞特異性結合的多肽,其氨基酸序列為Thr-Val-Arg-Thr-Ser-Ala-Asp。
實施例1中與激活型肝星狀細胞特異性結合的多肽可以通過實施例2~7中方法制備得到。
實施例2
與激活型肝星狀細胞特異性結合的多肽的制備方法,包括以下步驟:
(1)靜止型肝星狀細胞與激活型肝星狀細胞培養
(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉;在靜止型肝星狀細胞中加入噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育,棄與激活型肝星狀細胞孵育后的上清液,用PBST緩沖液洗滌6次,加入pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫;收集洗脫液,加入pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟數次,篩選結束。
(3)經DNA測序確定目標多肽:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。
實施例3
與激活型肝星狀細胞特異性結合的多肽的制備方法,包括以下步驟:
(1)靜止型肝星狀細胞與激活型肝星狀細胞培養:靜止型肝星狀細胞以及激活型肝星狀細胞通過常規方法培養;
(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入1.5mL質量濃度為1%的BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉30min;在靜止型肝星狀細胞中加入1.5mL滴度為2×1011pfu的噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育1h;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育1h,棄與激活型肝星狀細胞孵育后的上清液,用0.1%PBST緩沖液洗滌6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫10min;收集洗脫液,加入150μL1mol/L的pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取0.5mL該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟4次,一共進行5輪篩選,篩選結束;其中,篩選中所用0.1%PBST緩沖液為Tween-20體積濃度為0.1%的PBS緩沖液;
(3)經DNA測序確定目標多肽:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。
實施例4
與激活型肝星狀細胞特異性結合的多肽的制備方法,包括以下步驟:
(1)靜止型肝星狀細胞與激活型肝星狀細胞培養:所述靜止型肝星狀細胞是通過以下步驟培養:將大鼠麻醉后,采用質量濃度為0.05%的Ⅳ膠原酶體外循環消化以及Opetiprep密度梯度離心的方法,分離大鼠原代肝星狀細胞,用含20%FBS的高糖DMEM培養基重懸細胞,按3×106接種于6cm培養皿中,置于37℃、體積濃度5%的CO2的二氧化碳培養箱中培養24h,細胞貼壁單層長滿皿底,即得靜止型肝星狀細胞;
所述激活型肝星狀細胞是通過以下步驟獲取:原代分離的肝星狀細胞培養14天后,質量濃度為0.25%的胰酶常規消化傳代,用含10%FBS的高糖DMEM培養基重懸細胞沉淀后接種到新的6cm培養皿中,置于37℃、體積濃度5%的CO2條件下培養,待細胞貼壁單層長滿皿底,即得激活型肝星狀細胞;
(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入1.5mL質量濃度為1%的BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉30min;在靜止型肝星狀細胞中加入1.5mL滴度為2×1011pfu的噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育1h;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育1h,棄與激活型肝星狀細胞孵育后的上清液,用0.3%PBST緩沖液洗滌6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫10min;收集洗脫液,加入150μL1mol/L的pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取0.5mL該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟2次,共完成3輪篩選,篩選結束;其中,篩選中所用0.3%PBST緩沖液為Tween-20體積濃度為0.3%的PBS緩沖液;
(3)經DNA測序確定目標多肽:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。
實施例5
與激活型肝星狀細胞特異性結合的多肽的制備方法,包括以下步驟:
(1)靜止型肝星狀細胞與激活型肝星狀細胞培養:所述靜止型肝星狀細胞是通過以下步驟培養:將大鼠麻醉后,采用質量濃度為0.05%的Ⅳ膠原酶體外循環消化以及Opetiprep密度梯度離心的方法,分離大鼠原代肝星狀細胞,用含20%FBS的高糖DMEM培養基重懸細胞,按3×106接種于6cm培養皿中,置于37℃、體積濃度5%的CO2的二氧化碳培養箱中培養24h,細胞貼壁單層長滿皿底,即得靜止型肝星狀細胞;
所述激活型肝星狀細胞是通過以下步驟培養:原代分離的肝星狀細胞培養14天后,質量濃度為0.25%的胰酶常規消化傳代,用含10%FBS的高糖DMEM培養基重懸細胞沉淀后接種到新的6cm培養皿中,置于37℃、體積濃度5%的CO2條件下培養,待細胞貼壁單層長滿皿底,即得激活型肝星狀細胞;
(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入1.5mL質量濃度為1%的BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉30min;在靜止型肝星狀細胞中加入1.5mL滴度為2×1011pfu的噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育1h;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育1h,棄與激活型肝星狀細胞孵育后的上清液,用0.2%PBST緩沖液洗滌6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫10min;收集洗脫液,加入150μL1mol/L的pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取0.5mL該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟3次,共完成4輪篩選,篩選結束;其中,篩選中所用0.2%PBST緩沖液為Tween-20體積濃度為0.2%的PBS緩沖液;
(3)經DNA測序確定目標多肽:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。
實施例6
與激活型肝星狀細胞特異性結合的多肽的制備方法,包括以下步驟:
(1)靜止型肝星狀細胞與激活型肝星狀細胞培養:靜止型肝星狀細胞以及激活型肝星狀細胞通過常規方法培養;
(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入1.5mL質量濃度為1%的BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉30min;在靜止型肝星狀細胞中加入1.5mL滴度為2×1011pfu的噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育1h;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育1h,棄與激活型肝星狀細胞孵育后的上清液,用0.1%PBST緩沖液洗滌6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫10min;收集洗脫液,加入150μL1mol/L的pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取0.5mL該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟3次,共完成4輪篩選,篩選結束;其中,第一輪篩選中所用0.1%PBST緩沖液為Tween-20體積濃度為0.1%的PBS緩沖液;第二輪篩選中所用PBST緩沖液為0.2%PBST緩沖液,即Tween-20體積濃度為0.2%的PBS緩沖液;第三輪和第四輪篩選中所用PBST緩沖液為0.3%PBST緩沖液,即Tween-20體積濃度為0.3%的PBS緩沖液;第四輪篩選時洗脫液進行滴度測定后不再進行擴增純化。
(3)經DNA測序確定目標多肽:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。
實施例7
與激活型肝星狀細胞特異性結合的多肽的制備方法,包括以下步驟:
(1)靜止型肝星狀細胞與激活型肝星狀細胞培養:所述靜止型肝星狀細胞是通過以下步驟培養:將大鼠麻醉后,采用質量濃度為0.05%的Ⅳ膠原酶和質量濃度為0.1%的鏈蛋白酶體外循環消化以及Opetiprep密度梯度離心的方法,分離大鼠原代肝星狀細胞,用含20%FBS的高糖DMEM培養基重懸細胞,按3×106接種于6cm培養皿中,置于37℃、體積濃度5%的CO2的二氧化碳培養箱中培養24h,細胞貼壁單層長滿皿底,即得靜止型肝星狀細胞;
所述激活型肝星狀細胞是通過以下步驟培養:原代分離的肝星狀細胞培養14天后,質量濃度為0.25%的胰酶常規消化傳代,用含10%FBS的高糖DMEM培養基重懸細胞沉淀后接種到新的6cm培養皿中,置于37℃、體積濃度5%的CO2條件下培養,待細胞貼壁單層長滿皿底,即得激活型肝星狀細胞;
(2)以靜止型肝星狀細胞為吸附細胞、激活型肝星狀細胞為靶細胞,采用噬菌體展示技術進行差減篩選:分別取步驟(1)中培養的生長良好的靜止型肝星狀細胞以及激活型肝星狀細胞,在37℃、體積濃度5%的CO2條件下,置于無血清培養基中培養2h后,備用;分別在所得靜止型肝星狀細胞以及激活型肝星狀細胞培養皿中加入1.5mL質量濃度為1%的BSA,在37℃、50rpm條件下,恒溫培養搖床中封閉30min;在靜止型肝星狀細胞中加入1.5mL滴度為2×1011pfu的噬菌體原始肽庫的稀釋液,在37℃、50rpm條件下恒溫培養搖床中孵育1h;隨后將與靜止型肝星狀細胞孵育后的上清液加入封閉后的激活型肝星狀細胞中,在37℃、50rpm條件下恒溫培養搖床中孵育1h,棄與激活型肝星狀細胞孵育后的上清液,用0.1%PBST緩沖液洗滌6次,加入1mL0.2mol/L的pH=2.2的甘氨酸-鹽酸緩沖液,置于37℃、50rpm條件下恒溫培養搖床中洗脫10min;收集洗脫液,加入150μL1mol/L的pH=9.1的Tris-HCl緩沖液進行中和;測定洗脫液中所含噬菌體滴度;隨后取0.5mL該洗脫液感染宿主菌E.coli ER2738進行擴增,擴增后噬菌體通過離心以及PEG/NaCl沉淀的方法進行純化,再次測定擴增、純化后噬菌體滴度,完成第一輪篩選;重復以上步驟3次,共完成4輪篩選,篩選結束;其中,第一輪篩選中所用0.1%PBST緩沖液為Tween-20體積濃度為0.1%的PBS緩沖液;第二輪篩選中所用PBST緩沖液為0.2%PBST緩沖液,即Tween-20體積濃度為0.2%的PBS緩沖液;第三輪和第四輪篩選中所用PBST緩沖液為0.3%PBST緩沖液,即Tween-20體積濃度為0.3%的PBS緩沖液;第四輪篩選時洗脫液進行滴度測定后不再進行擴增純化。
(3)經DNA測序確定目標多肽:取最后一輪篩選后的洗脫液進行噬菌體滴度測定時,選取若干個陽性噬菌體克隆,分別進行擴增和純化,隨后進行DNA測序,選取測序結果顯示插入序列重復次數最多的噬菌體,其所展示的多肽即為目標多肽。
實施例8
與激活型肝星狀細胞特異性結合的多肽,其氨基酸序列為Thr-Val-Arg-Thr-Ser-Ala-Asp,能夠在制備肝纖維化診斷試劑或肝纖維化靶向治療藥物中應用。
- 還沒有人留言評論。精彩留言會獲得點贊!