iolT1和iolT2蛋白在木糖轉運中的應用的制作方法
本發明屬于基因工程技術領域,具體涉及肌醇轉運蛋白iolt1和iolt2在木糖轉運中的新應用的專利申請。
背景技術:
種類繁多的木質纖維素資源年產量巨大,其中包括大量農林加工剩余物,其綜合利用既可帶來經濟效益,又能夠減少因焚燒等不當處理引起的環境污染。在木質纖維素原料中木糖組分含量達18~30%,僅次于葡萄糖組分,因此對其進行綜合利用可以顯著提高原料利用率。
現有對于木質纖維素原料利用方式之一,即是利用微生物發酵技術對其中的木糖或者葡萄糖組分進行發酵生產。其主要技術原理是:在細菌中,木糖經過木糖異構酶(xyloseisomerase,xi)催化形成木酮糖,隨后在木酮糖激酶(xylulokinase,xk)的作用下形成木酮糖-5-磷酸,進入戊糖磷酸途徑。
谷氨酸棒狀桿菌是一種多種氨基酸的生產菌株,其具有魯棒性強、代謝旺盛以及食品安全等特性。在微生物發酵生產中具有廣泛的用途,但就木質纖維素原料利用而已,谷氨酸棒狀桿菌自身并不能直接利用木糖,但由于其基因組上存在xk編碼基因,因而通過基因工程手段,在谷氨酸棒狀桿菌中過表達xi,從而賦予谷氨酸棒狀桿菌將木糖轉化為木酮糖的能力,進而通過相關代謝途徑及的酶的優化表達,獲得能夠將木糖轉化為各種目標產品的細胞工廠。
谷氨酸棒狀桿菌發酵利用木糖的過程中,木糖向谷氨酸棒狀桿菌細胞內的運輸是其被利用的第一步,因而高水平表達糖轉運蛋白可以促進谷氨酸棒狀桿菌對木糖的吸收。但已有研究表明,谷氨酸棒狀桿菌沒有專門的木糖轉運蛋白,因而推測其對木糖的吸收主要依賴于己糖轉運蛋白。
已有報道提出:谷氨酸棒狀桿菌中轉運葡萄糖的pts系統具有轉運木糖的能力,而pts系統在環境中同時存在葡萄糖和木糖的時候,木糖的轉運明顯會受到葡萄糖轉運的競爭性抑制(wang等,investigationofptsggeneinresponsetoxyloseutilizationincorynebacteriumglutamicum,2014,journalofindustrialmicrobiologyandbiotechnology)。因此要實現谷氨酸棒狀桿菌同時利用葡萄糖和木糖兩種碳源,需要尋找其他能夠轉運木糖且不受葡萄糖抑制的蛋白。長期以來,研究人員推測認為:在谷氨酸棒狀桿菌中,木糖的運輸是通過mfs家族的糖/質子同向轉運蛋白來完成的。然而,迄今為止該方面的研究并沒有取得實質性進展。
其他有關研究中,日本科學家ikeda等(identificationandapplicationofadifferentglucoseuptakesystemthatfunctionsasanalternativetothephosphotransferasesystemincorynebacteriumglutamicum,2011,appliedmicrobiologyandbiotechnology)首次發現:谷氨酸棒狀桿菌中肌醇轉運蛋白iolt1和iolt2具備葡萄糖轉運功能,但其表達需要移碼突變失活阻遏蛋白iolr的編碼基因。隨后,德國科學家lindner等(phosphotransferasesystem-independentglucoseutilizationincorynebacteriumglutamicumbyinositolpermeasesandglucokinases,2011,appliedandenvironmentalmicrobiology)也報道了類似的結果。但是關于肌醇轉運蛋白iolt1和iolt2是否具有木糖轉運能力,及是否可以提高谷氨酸棒狀桿菌對于木質纖維素原料的利用效率,尚缺乏進一步的應用報道。
技術實現要素:
本發明通過谷氨酸棒狀桿菌中特定基因敲除和pts系統失活菌株構建,目的在于驗證肌醇轉運蛋白iolt1和iolt2與木糖轉運之間的關系,從而為木質纖維素原料的開發利用奠定理論和應用基礎。
本申請的技術方案詳述如下。
iolt1和iolt2蛋白在木糖轉運中的應用,在谷氨酸棒狀桿菌中,肌醇轉運蛋白iolt1和iolt2,能夠轉運肌醇和葡萄糖,同時具有轉運木糖的能力;該轉運能力與谷氨酸棒狀桿菌中的pts系統(ptsg)的木糖轉運能力相當,且與pts系統對木糖的轉運具有互補的作用,并且其對木糖的轉運不受葡萄糖轉運的抑制。
一種同步利用木糖和葡萄糖的微生物發酵方法,具體包括如下步驟:
(1)以普通谷氨酸棒狀桿菌為菌株基礎,對其基因組中的iolr基因進行敲除,獲得谷氨酸棒狀桿菌的基因敲除菌株δiolr;
所述谷氨酸棒狀桿菌,具體例如c.glutamicumatcc13032菌株;
(2)對步驟(1)中基因敲除菌株,導入過表達重組質粒pxmj19-xyla以過表達木糖異構酶xi,從而使基因敲除菌株具有利用木糖的能力;
(3)利用含有木糖和葡萄糖的發酵培養基進行微生物發酵,即可充分利用培養基中木糖底物,從而實現對木質纖維素原料的開發利用。
前期研究基礎上,通過蛋白序列比對,發明人發現,iolt1/iolt2和大腸桿菌木糖轉運蛋白xyle具有較高同源性。因此,對這兩個蛋白是否具有木糖運輸能力,發明人進行了進一步的實驗研究。
本申請中,通過對δptsg(pts系統失活)、δptsgδiolr(pts系統失活與iolr基因敲除)和δptsgδiolrδiolt1δiolt2(pts系統失活、iolr基因與iolt1和iolt2基因同時敲除)等菌株系統構建,對肌醇轉運蛋白iolt1和iolt2與木糖轉運間的關系進行了充分研究。研究結果表明,在谷氨酸棒狀桿菌中,iolt1和iolt2蛋白具有轉運木糖的能力,能夠實現葡萄糖和木糖的同步轉運和代謝,且ptsg對低濃度木糖轉運是必需的。
總體而言,本申請通過基因工程技術手段證明了:谷氨酸棒狀桿菌中,肌醇轉運蛋白iolt1和iolt2具有轉運木糖的功能,該發現將有利于高效利用木糖的谷氨酸棒狀桿菌工程菌株的構建,尤其有益于構建同步利用葡萄糖和木糖的工程菌株。具體操作方面,利用基因工程技術,通過敲除缺失谷氨酸棒狀桿菌的ptsg,而利用這兩個蛋白(iolt1和iolt2)同時轉運葡萄糖和木糖,可實現木糖和葡萄糖的同步利用。這將為開發高效利用木質纖維素水解液等原料的基因工程菌株奠定了良好的基礎,具有較好的開發利用前景。
附圖說明
圖1為不同基因缺失谷氨酸棒狀桿菌菌株在基本培養基cgxii(木糖為唯一碳源)中的生長曲線;
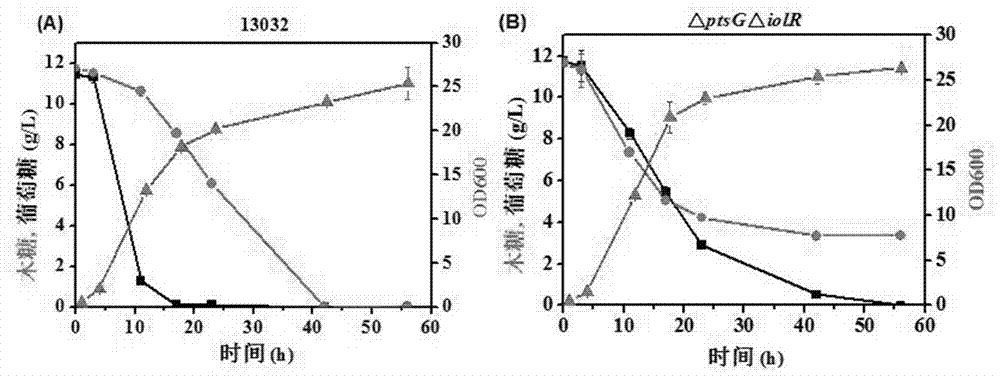
圖2為13032(圖a)和δptsgδiolr(圖b)菌株在基本培養基cgxii(木糖和葡萄糖為碳源)中的葡萄糖和木糖生長和耗糖曲線,圖中:▲代表od值,■代表葡萄糖濃度,●代表木糖濃度。
具體實施方式
下面結合實施例對本申請做進一步的解釋說明,在介紹具體實施例前,就下述實施例中部分生物材料情況簡要介紹如下。
生物材料:
谷氨酸棒狀桿菌(c.glutamicum)atcc13032,來源于美國模式菌種收集中心(americantypeculturecollection,atcc);
引物序列合成及相關測序工作,由金唯智公司完成提供。
實施例1
由于相關菌株構建是本發明中最為重要的操作步驟,因而本實施例就谷氨酸棒狀桿菌(c.glutamicum)13032/pxt01-xyla菌株(以下簡稱ptsg/pxt01-xyla,正常菌株轉化有pxt01-xyla質粒)、δptsg/pxt01-xyla菌株(ptsg系統失活,且轉化有pxt01-xyla質粒)、δptsgδiolr/pxt01-xyla菌株(ptsg系統失活,iolr基因敲除,且轉化有pxt01-xyla質粒)、δptsgδiolrδiolt1δiolt2/pxt01-xyla菌株(ptsg系統失活,iolr基因敲除,iolt1和iolt2基因也被敲除,且轉化有pxt01-xyla質粒)的構建過程簡要介紹如下。
一、ptsg、iolr、iolt1和iolt2基因的敲除
(1)c.glutamicum13032基因組dna的提取,
將單菌落接種于lb搖管中,32℃過夜培養12h后,按2%接種量接入30ml的lb培養基中進行搖瓶培養過夜;ctab法提取,具體提取過程參考如下操作過程:
a、將菌液13000rpm離心2min,去上清液,收集到1.5ml的ep管中;
加600μlph=8.0的tebuffer懸浮菌體,13000rpm離心2min,棄上清液;
b、加600μlte重新懸浮菌體,加入6μl的rnaase(10μg/ml),30μl的溶菌酶(50μg/ml)混勻,37℃保溫30min;
加30μl的10%sds和10μl的蛋白酶k,混勻,65℃保溫15min;
加入100μl的5mol/lnacl溶液混勻后,再加入80μlctab/nacl溶液,顛倒混勻50次,65℃水浴10min;
c、加入750μl的酚:氯仿:異戊醇(25:24:1)抽提,顛倒混勻50次,13000rpm離心15min;
將上清液吸入新的1.5mlep管中,加入等體積的酚:氯仿:異戊醇(25:24:1)抽提,顛倒混勻50次,13000rpm離心15min;
將上清液吸入新的1.5ml的ep管中,加1倍體積異丙醇,顛倒混合,-80℃冷激15min,13000rpm離心10min,棄上清;
d、加入70%乙醇,輕彈重懸,靜置6min,13000rpm離心5min,去上清;
烘箱干燥(37℃)后,加入50μl去離子水,溶解dna,測dna濃度,-20℃保存備用。
(2)目的基因的擴增,根據genbank公布的谷氨酸棒狀桿菌atcc13032中基因ptsg(geneid:1021001)、iolr(geneid:3342760)、iolt1(geneid:3342760)和iolt2的序列(geneid:1021001),以及它們的上下游序列,設計特異性引物(5’-3’)如下表所示:
以步驟(1)中所提取的c.glutamicum13032基因組dna為模板,以ptsg上游同源臂上游引物(iolt1-up-s)和下游引物(iolt1-up-a)為引物,進行pcr擴增,獲得ptsg的上游同源臂約500bp片段,同時以ptsg下游同源臂上游引物(iolt1-down-s)和下游引物(ptsg-down-a)為引物,pcr擴增獲得ptsg的下游同源臂約500bp片段;
pcr反應條件為:95℃預變性5min;98℃變性10s,55℃退火5s,72℃延伸30s,30個循環;72℃最后延伸10min(高保真primestarhs聚合酶)。
反應結束后取3μl擴增產物,進行1%的瓊脂糖凝膠電泳檢測擴增片段大小。
回收(采用cyclepurekit,omega)pcr擴增產物,以回收的上下游同源臂為模板(添加量為摩爾比1:1),同時以ptsg-up-s和ptsg-down-a為引物,進行重疊pcr,擴增上下游同源臂的重疊片段。
iolt2、iolr和ptsg的上下游同源臂的重疊片段的擴增方法同上。
(3)回收pcr產物,并與載體pk18mobsacb進行連接,對步驟(2)中的pcr擴增產物進行回收,并進行雙酶切,同時對pk18mobsacb載體進行對應的雙酶切,回收酶切產物,并進行連接;
雙酶切時:
iolt1上下游重疊片段雙酶切位點為:hindiii和sphi;
iolt2上下游重疊片段雙酶切位點為:ecori和sphi;
iolr上下游重疊片段雙酶切位點為:sphi和psti;
ptsg上下游重疊片段雙酶切位點為:xbai和ecori;
50μl的雙酶切體系參考設計如下:
質粒(pk18mobsacb載體)或目的片段(pcr擴增產物),3000~5000ng;
q.cut1(酶切位點用酶),1.5μl;
q.cut2(酶切位點用酶),1.5μl;
10×q.cutbuffer,5μl;
去離子水,加至50μl。
酶切產物回收后,10μl連接體系設計如下:目的片段(酶切后pcr產物片段)與載體(酶切后載體片段)摩爾比為3~9:1之間,solutioni連接酶5μl,其余用去離子水補齊;16℃連接4h。
(4)轉化與鑒定重組質粒,利用cacl2法,將步驟(3)中的重組質粒(連接產物)轉化入大腸桿菌dh5α感受態細胞;然后涂布lb固體培養基,挑選陽性轉化子進行搖管培養后,采用堿裂解法,提取質粒dna,進行重組質粒的pcr鑒定和酶切鑒定。
將鑒定正確的質粒送進行測序,各片段的測序結果用dnaman軟件與genbank中序列進行比對,以驗證基因ptsg、iolr、iolt1和iolt2重疊片段構建的正確性,也即,重組質粒構建正確。
(5)制備谷氨酸棒狀桿菌感受態細胞,具體可參考如下操作步驟:
a、從-80℃甘油保菌管中用接種針挑取l-谷氨酸棒狀桿菌,在lb平板培養基上三區劃線,32℃培養箱中培養過夜;
b、在步驟①的劃線平板培養基上挑取單菌落,接種到5ml的bhis培養基試管中,30℃、200r/min培養12h;
按1%接種量轉接到裝液量為100ml的bhis培養基(含150μltween80和2.5g甘氨酸)的500ml圓底瓶中,18℃、160rpm培養18h,測定od600值;
bhis培養基(g/l):腦心浸提物(brain-heartinfusion)37,山梨醇(sorbitol)91,ph7.0~7.2,培養基115℃高壓蒸汽滅菌15min;
c、將步驟b中od600=0.6左右的培養液冰上靜置20min;
然后在超凈臺中,將菌液收集到50ml的離心管中,4℃、6500rpm離心10min,棄上清;
d、用50ml預冷的10%甘油重懸洗菌,4℃、6500rpm離心10min,棄上清,重復此步驟三次(即,重復洗三次);
用2ml預冷的10%甘油將菌體重懸,用預冷的ep管,100μl/管分裝,-80℃保存備用。
(6)電轉化,將步驟(4)中測序鑒定正確重組質粒電轉化步驟(5)中所制備感受態細胞,具體轉化步驟參考如下:
a、在超凈工作臺內,用無水乙醇將電轉杯吹洗干凈后,將其倒置于干凈的濾紙上,大約20min后,將其置于冰上約預冷20min;
b、從-80℃冰箱取出保存的谷氨酸棒狀桿菌感受態細胞(步驟(5)中所制備),置于冰上融化5min左右;
將構建成功的重組質粒(步驟(4)中所制備)加入感受態細胞,輕彈混勻后置于步驟a的預冷后電轉杯中;放置冰中預冷20min左右;
c、用濾紙擦干電轉杯兩側,迅速放入電轉儀內,2500v條件下電擊后迅速加入1ml預熱的bhis復蘇液,輕輕吹打均勻后,轉移至離心管中,置于46℃水浴中熱擊6min;
熱擊結束后,32℃、200r/min復蘇約2h,然后進行進一步的菌株篩選和培養。
(7)篩選和鑒定基因敲除的谷氨酸棒狀桿菌重組菌株,對步驟(6)中電轉化復蘇后菌體,參考如下培養步驟進行菌株篩選:
a、復蘇完成以后,8000rpm/min離心2min以富集菌體,將所富集菌體涂布含卡那霉素的lb抗性平板(kmr,10μg/ml),32℃培養48h;
將平板上長出的單菌落分別對點到質量含量15%蔗糖的lb平板和含卡那霉素的lb抗性平板(kmr,10μg/ml)上,32℃培養18h;
b、挑選出在lb抗性平板上生長,但在15%蔗糖lb平板不生長的菌落,轉接lb培養基,32℃、200rpm/min培養18h,提取菌落的基因組,以kana-n和kana-c為引物(引物序列如seqidno.1、seqidno.2所示,具體為:kana-n:aagggactggctgctattggg,kana-c:gcccattcgccgccaagctc;擴增長度447bp),進行kana抗性基因的pcr檢測,驗證發生第一次重組的重組子,對驗證正確的重組子保菌。
(c、將步驟b中驗證正確的重組菌在含有15%蔗糖的搖管中傳代兩次(由于在15%蔗糖存在情況下,sacb基因的表達對宿主菌具有致死效應,因此可用來篩選發生第二次同源重組的菌株);
d、將步驟c中傳代培養后菌體,稀釋后涂布到15%蔗糖的平板上,32℃培養36h,將長出的單菌落分別對點到15%蔗糖平板和含卡那霉素的lb抗性平板(kmr,10μg/ml)上,32℃培養18h,篩選出在15%蔗糖平板生長、但是在含卡那霉素的lb平板上不生長的單菌落;
將表型正確的單菌落轉接到lb搖管中,32℃、200rpm/min過夜培養;
提取過夜培養后菌落基因組,以基因組dna為模板,以設計的同源重組引物進行pcr擴增(引物序列參考前述步驟(2)),pcr擴增中,72℃最后延伸后,補加0.5μlextaq酶以加polya尾。
回收pcr擴增產物,并將所回收dna片段連接到pmd18-t-simple載體上,10μl的連接體系參考設計如下:
所回收的pcr擴增產物,4.5μl;
pmd18-t-simple載體,0.5μl;
solutioni,5μl;
16℃連接過夜。
采用cacl2法,將連接產物轉化入大腸桿菌dh5α感受態細胞;采用堿裂解法,提取質粒dna,進行pcr鑒定和酶切鑒定;將鑒定正確的質粒進行測序分析,確定各基因成功敲除,即,基因缺失菌株構建正確。
經過篩選、鑒定,最終構建獲得δptsg菌株(ptsg系統失活)、δptsgδiolr菌株(ptsg系統失活,iolr基因敲除)、δptsgδiolrδiolt1δiolt2菌株(ptsg系統失活,iolr基因敲除,iolt1和iolt2基因也被敲除)。
二、構建木糖異構酶表達載體pxt01-xyla,參考現有技術,構建木糖異構酶表達載體pxt01-xyla。
三、電轉化,將步驟1中所構建的基因缺失菌株(δptsg菌株、δptsgδiolr菌株、δptsgδiolrδiolt1δiolt2菌株),以及c.glutamicum13032菌株分別制備感受態細胞,采用電轉化法,將步驟2中所構建的木糖異構酶表達載體pxt01-xyla分別轉化上述感受態細胞,經過篩選,最終獲得木糖異構酶過表達的不同基因敲除重組菌株,即獲得:
谷氨酸棒狀桿菌(c.glutamicum)13032/pxt01-xyla菌株(以下簡稱ptsg/pxt01-xyla,正常菌株轉化有pxt01-xyla質粒),
δptsg/pxt01-xyla菌株(ptsg系統失活,且轉化有pxt01-xyla質粒),
δptsgδiolr/pxt01-xyla菌株(ptsg系統失活,iolr基因敲除,且轉化有pxt01-xyla質粒),
δptsgδiolrδiolt1δiolt2/pxt01-xyla菌株(ptsg系統失活,iolr基因敲除,iolt1和iolt2基因也被敲除,且轉化有pxt01-xyla質粒)。
需要解釋的是,上述操作中未詳述實驗操作參考現有技術或實施例中其他有關步驟描述即可進行,文本簡要期間,不再過于重復描述。
實施例2
在實施例1所構建的重組菌株基礎上,發明人對不同的谷氨酸棒狀桿菌重組菌株均木糖和葡萄糖的生長利用情況進行了檢測分析,相關實驗過程簡要介紹如下。
蛋白iolt1和iolt2對pts系統的取代實驗
已有研究認為:谷氨酸棒狀桿菌中轉運葡萄糖的pts系統具有轉運木糖的能力,而pts系統在環境中同時存在葡萄糖和木糖的時候,木糖的轉運明顯會受到葡萄糖轉運的競爭性抑制。為此,發明人以實施例1中所構建的δptsgδiolr/pxt01-xyla菌株(ptsg基因敲除,因此pts系統缺失,iolr基因敲除,解除了對iolt1和iolt2基因抑制,從而使得iolt1和iolt2蛋白得以表達)作為實驗菌株,以正常的(c.glutamicum)13032/pxt01-xyla菌株作為對照,考察了以iolt1和iolt2蛋白取代pts系統時,iolt1和iolt2蛋白對木糖和葡萄糖的轉運能力(以菌株的耗糖情況作為評價依據)。具體培養過程介紹如下。
(1)菌種活化
將實施例1中所構建菌株進行活化培養,以恢復菌株活力,活化培養時,培養溫度為32℃,培養基可參考使用活化培養基,具體配方為:
活化培養基(g/l):蛋白胨10,牛肉膏10,酵母粉5,nacl2.5,玉米漿15ml/l,瓊脂25,ph7.0~7.2,滅菌條件:121℃、20min。
(2)種子培養
將步驟(1)中活化后菌株接入種子培養基中,32℃、200rpm培養時間12h左右,培養至od600=10±2左右;種子培養基參考設計如下:
種子培養基(g/l):葡萄糖10,腦心浸液37,ph7.0~7.2,滅菌條件:121℃、20min。
(3)搖瓶發酵培養
按4%體積比的接種量,將步驟(2)中的種子培養液接種發酵培養基,32℃、200rpm條件下進行培養;發酵培養基設計如下:
發酵培養基(cgxii)(g/l):木糖20(或木糖12,葡萄糖12),(nh4)2so420,k2hpo41,kh2po41,mgso40.25,尿素5,mops42,0.1m的cacl21ml,0.2g/l的生物素200μl,ph7.0~7.2,滅菌條件:121℃,20min。
實驗結果:
實驗結果包括對不同菌株發酵生長速度測定和發酵液中木糖、葡萄糖消耗量兩個方面的測定情況,具體介紹如下。
菌體濃度的測定
發酵過程中,定時取樣,將菌液樣品稀釋后,600nm處(v1200紫外分光光度計)測定樣品吸光度,以對發酵過程中菌體生長速度有所判定。
以木糖為唯一碳源的菌株生長過程的od600生長曲線如圖1所示,圖1中,atcc13032為出發菌株;δptsg為ptsg敲除菌株;δptsgδiolr為同時敲除ptsg和阻遏蛋白基因iolr的菌株;δptsgδiolrδiolt1δiolt2為4個基因敲除菌株。
從圖1可以看出,敲除pts系統后,重組菌株的od值下降了80%左右,表明pts系統去除后,無法有效利用培養基中糖分,因而生長效果發生了明顯降低;這一結果為專門研究mfs家族的iolt1/iolt2對木糖的轉運作用做了最好的參考對照。
發酵液中葡萄糖、木糖消耗量的測定
發酵過程中,定時取樣,將菌液樣品12000rpm離心5min,取上清液稀釋10倍后,過0.22μm膜,對濾液中糖(木糖、葡萄糖)采用hplc測定,測定時:
采用agilent1200高效液相色譜儀進行測定,
色譜柱:aminexhpx-87h(300×7.8mm,bio-rad);
檢測器:示差檢測器;
流動相:5mm硫酸;
流速0.6ml/min。
根據hplc檢測結果繪制葡萄糖和木糖消耗曲線,繪制結果如圖2所示(培養過程中,培養基中同時含有相同濃度(均為12g/l)的木糖和葡萄糖,即同時以木糖和葡萄糖為碳源)。
由圖2(a)可知,c.glutamicum13032發酵10h時,葡萄糖消耗至1g/l左右,木糖才開始被快速消耗,到42h時木糖消耗完畢。由此可見,原始出發菌株菌株是優先利用葡萄糖的。而由圖2(b)可知,δptsgδiolr菌株具備同步代謝木糖和葡萄糖的能力,然而培養40h以后培養基中始終殘留約3.6g/l木糖,可見ptsg對低濃度木糖轉運是必需的。
結合圖1、圖2,分析可以看出,在敲除ptsg的基礎上再通過敲除iolr激活iolt1和iolt2的表達后,菌株在木糖基本培養基上生長的最終od增加了2.5倍。這說明iolt1和iolt2肌醇轉運蛋白具有轉運木糖的能力。
進一步地,參考上述培養過程,發明人對δptsgδiolrδiolt1δiolt2重組菌株進行了培養,其最終od與僅敲除ptsg且未激活iolt1和iolt2表達的菌株相當(od600生長曲線如圖1所示)。
綜上結果可以看出:在谷氨酸棒狀桿菌中,iolt1和iolt2蛋白具有轉運木糖的能力。失活阻遏蛋白iolr后,iolt1和iolt2蛋白得以表達,這兩個蛋白對木糖的轉運能力與谷氨酸棒狀桿菌中的pts系統(ptsg)的木糖轉運能力是相當的,在pts系統失活時,可替代pts系統對木糖的轉運功能的發揮。基于此特性,利用重組菌株發酵時,可為木質纖維素原料中木糖、葡萄糖成分的同步利用奠定了必要的應用基礎。
sequencelisting
<110>蓮花健康產業集團股份有限公司
天津科技大學
<120>iolt1和iolt2蛋白在木糖轉運中的應用
<130>none
<160>2
<170>patentinversion3.5
<210>1
<211>21
<212>dna
<213>人工設計
<400>1
aagggactggctgctattggg21
<210>2
<211>20
<212>dna
<213>人工設計
<400>2
gcccattcgccgccaagctc20
- 還沒有人留言評論。精彩留言會獲得點贊!