一種氟?18標記的化合物及其制備方法與應用與流程
本發明屬于放射性藥物及核醫學技術領域,具體涉及一種氟-18標記的化合物及其制備方法與應用。
背景技術:
正電子發射斷層掃描(pet)作為21世紀生物醫學研究和臨床診斷的尖端技術,被稱為“活體生化顯像”技術,可以從體外無創、定量、動態地觀察人體內的生理、生化變化,洞察標記藥物在正常人或病人體內的活動。與spect相比,pet具有分辨率高和可定量分析等明顯優勢,且已成為現今用于活體中分子靶標確認和臨床疾病診斷重要的成像技術。
pet成像優越的靈敏度歸因于使用了正電子核素(例如碳-11,氟-18,鎵-68,銅-64等)標記的靶向分子探針。在眾多適用于pet成像的β+發射核素中,18f是臨床使用最廣泛的核素。因為它具有諸多優異的性質,如:較低的正電子能量,半衰期短(t1/2=109.8min)和來自醫用回旋加速器的大量的按需生產。18f的短物理半衰期使其需要簡單和快速的18f標記方法,這已成為放射化學家的長期挑戰。現有技術中,一般的18f標記的化合物,是通過在干燥條件和高溫條件下進行親核反應獲得,而對于多肽類的靶向分子,其標記通常需要更多的步驟。因此,一般的化合物放射標記通常是繁瑣且耗時的,這給臨床使用帶來巨大的挑戰。
近期,一些新的氟化反應,如18f-硅、18f-硼、以及18f-鋁螯合物的發展為直接18f標記合成提供了新策略。其中,利用離子交換法進行18f-標記的兩性離子烷基銨甲基三氟硼酸鹽(ambf3)是非常有應用前景的,因為其可以在溫和的溫度下在弱酸性水中獲得具有高純度和高比活性的示蹤劑。并且這種標記方法便利簡易,可以“試劑盒”化,特別適合大規模生產及臨床應用。
在診斷疾病的分子成像中,檢測異常氧化還原狀態是非常必要的,因為它常常與許多臨床疾病相關,包括癌癥,肝損傷和阿爾茨海默病。當前,已有一些熒光、核磁共振成像(mri)以及兩種模態的融合探針相繼得以開發,如含有二硫鍵的探針被內源性硫醇有效地切割,包括谷胱甘肽(gsh)和硫氧還蛋白(trx),其通常在腫瘤中水平升高。因此,它們在廣泛范圍的腫瘤的早期診斷中顯示出有前途的應用。
盡管這方面的研究有了一定的發展,但用于檢測活體中氧化還原狀態的氧化還原可激活pet成像探針的開發從未有報道過。已有報道2-氰基苯并噻唑(cbt)和半胱氨酸的1,2-氨基硫醇基團在生理條件下的可發生縮合反應,并通過自組裝形成納米聚集體。這種策略結合小分子探針與納米材料的優勢,為發展新型pet成像劑進行疾病的早期診斷提供了一種新思路。
技術實現要素:
為此,本發明所要解決的技術問題在于提供一種18f標記的化合物,并進一步公開其用于制備pet成像探針的用途。
為解決上述技術問題,本發明所述的一種18f標記的化合物,具有如下式(1)所示的結構:
本發明還公開了制備所述18f標記的化合物的標記前體,具有如下式(1-cold)所示的結構:
本發明還公開了一種制備所述標記前體的方法,包括如下步驟:
(1)在惰性氣體保護下,以n-boc-炔丙基甘氨酸和6-氨基-2-氰基苯并噻唑為反應原料,在n-甲基嗎啉和氯甲酸異丁酯存在下,溶于有機溶劑中于0℃進行反應,并于反應結束后,以酸性試劑停止反應,得到化合物a;
(2)取化合物a溶于dcm溶液,并加入tfa于室溫下反應,得到化合物b;
(3)在惰性氣體保護下,以化合物b和半胱氨酸為反應原料,溶于thf溶液,在hbtu和dipea或三乙胺共同存在下,于室溫下進行反應,得到化合物c;
(4)取化合物c溶于有機溶劑,并加入tfa于室溫下反應,得到化合物d;
(5)在惰性氣體保護下,取化合物d和三氟硼酸鹽溶于dmf-h2o溶液中,在抗壞血酸鈉和銅催化劑存在下,于45℃下加熱反應,并將反應液通過半制備型hplc分離純化,得到化合物1-cold;
所述步驟(1)中,還包括提純所述化合物a的步驟,具體包括:以乙酸乙酯和h2o萃取所得反應液,剩余有機相用飽和nahco3溶液洗滌,并用無水na2so4干燥;取粗產品過層析柱分離,得到化合物a。
所述步驟(1)中,所述有機溶劑為thf或dmf溶劑;所述酸液為稀hcl、稀硫酸或三氟乙酸等酸性試劑;
所述步驟(2)中,還包括提純所述化合物b的步驟,具體包括:取反應液進行減壓蒸餾,并加入乙醚沉淀,取粗產品通過半制備型hplc制備得到化合物b。
所述步驟(3)中,還包括提純所述化合物c的步驟,具體包括:取反應液旋干溶劑,將粗產品過柱層析分離,得到化合物c。
所述步驟(4)中,還包括提純所述化合物d的步驟,具體包括:取反應液進行減壓蒸餾,并加入乙醚沉淀,取粗產品通過半制備型hplc制備得到化合物d。
所述步驟(4)中,所述有機溶劑為dcm、甲醇或乙腈溶液。
所述步驟(5)中,所述銅催化劑為cuso4·5h2o、cu(i)cl或者六氟磷酸四(乙腈)銅(i)。
本發明還公開了一種制備所述18f標記的化合物的方法,取化合物1-cold與無水k18f,在加熱條件下,進行標記反應,制得式(1)所述的18f標記的化合物。
本發明還公開了一種pet成像探針,為所述的18f標記的化合物。
本發明還公開了所述的pet成像探針在檢測還原性生物硫醇顯像領域的應用。
本發明中首次將18f-ambf3引入到cbt和半胱氨酸之間的炔丙基甘氨酸殘基。當還原性生物硫醇與該探針反應時,可進行縮合反應,并進行原位納米聚集(18f-np),產生高密度的18f信號,可以對還原性生物硫醇進行高靈敏和特異性檢測。
附圖說明
為了使本發明的內容更容易被清楚的理解,下面根據本發明的具體實施例并結合附圖,對本發明作進一步詳細的說明,其中
圖1為化合物a的hplc檢測譜圖;
圖2為化合物a的esi-ms譜圖;
圖3為化合物b的hplc檢測譜圖;
圖4為化合物b的esi-ms譜圖;
圖5為化合物b的1hnmr檢測譜圖;
圖6為化合物b的13cnmr檢測譜圖;
圖7為化合物c的hplc檢測譜圖;
圖8為化合物c的esi-ms譜圖;
圖9為化合物c的1hnmr檢測譜圖;
圖10為化合物c的13cnmr檢測譜圖;
圖11為化合物d的hplc檢測譜圖;
圖12為化合物d的esi-ms譜圖;
圖13為化合物d的1hnmr檢測譜圖;
圖14為化合物d的13cnmr檢測譜圖;
圖15為化合物1-cold的hplc檢測譜圖;
圖16為化合物1-cold的esi-ms譜圖;
圖17為化合物1-cold的1hnmr檢測譜圖;
圖18為化合物1-cold的13cnmr檢測譜圖;
圖19為化合物1-cold的19fnmr檢測譜圖;
圖20為實施例2中反應液純化前后化合物情況,其中,圖(a)為純化前化合物1的含量,圖中(b)為純化后化合物1的含量,圖中(c)為化合物1-cold的含量;
圖21為放射性化合物的放射化學純度檢測結果,其中,圖(a)為在pbs中的放射化學純度,圖(b)為在人血清中的放射化學純度;
圖22為放射性反應條件優化曲線,其中,圖(a)為不同溫度的標記率曲線,圖(b)為不同標記時間的標記率曲線;
圖23為不同ph值下化合物1-cold的成環測定結果;
圖24為化合物1-cold在還原劑中的hplc檢測結果;
圖25為化合物1-cold和tcep在ph3.0條件下的esi-ms檢測結果;
圖26為化合物1-cold和tcep在ph7.4條件下的esi-ms檢測結果;
圖27為化合物1-cold納米自組裝的納米表征特征,其中,圖(a)為dls分析譜圖,圖(b)為探針1-cold的納米自組裝tem圖,圖(c)和(d)為不同視角下分子二聚體的結構;
圖28為不同濃度和培養時間下的細胞毒性研究結果;
圖29為不同溫度下化合物1-cold在噠嗪-鹽酸緩沖液(ph=2.0-2.5)中的hplc檢測結果;
圖30為不同培養時間下探針1在u87mg和hct116細胞中的吸收情況;
圖31為裸鼠中gsh的現象情況,其中,圖(a)為小鼠皮下注射化合物1(左)和同時注射化合物1和gsh(10毫米,右)的pet成像情況,箭頭所示注射部位,圖(b)為按照(a)中量化注射的輻射強度;圖(c)為小鼠皮下注射化合物1(左)和同時注射化合物1和gsh(10毫米,右)的切倫科夫發光成像結果;圖(d)按照(c)中量化注射的熒光信號強度,誤差標準差(n=3);
圖32腫瘤異種移植中小鼠的pet成像情況,其中,圖(a)為右前側形成u87mg腫瘤,圖(b)為小鼠皮下注射化合物1(103μci,100μl)的pet成像情況,圖(c)為腫瘤和肌肉的吸收情況;
圖33為10-15min下,u87mg腫瘤單獨用化合物1以及化合物1和nem的裸鼠pet成像情況。
具體實施方式
實施例1標記前體的制備
本實施例所述標記前體具有如下式(1-cold)所示的結構:
本實施例所述標記前體的合成路線如下:
本實施例所述標記前體按照如下步驟合成制得:
(1)化合物a的合成:在氮氣保護下,向含有n-boc-炔丙基甘氨酸(768mg,3.6mmol)的thf(3ml)溶液中加入n-甲基嗎啉(660μl,6.0mmol)和氯甲酸異丁酯(390μl,3.0mmol),于0℃溫度下攪拌2h,至溶液呈米黃色;反應2h后,在0℃下,加入6-氨基-2-氰基苯并噻唑(350mg,2.0mmol)的thf(5ml)溶液,反應液在rt下攪拌反應12h。12h后,向溶液中加入1mhcl(3ml),使反應停止,此時溶液呈深紅色。將含有化合物a的反應液用乙酸乙酯和h2o萃取,留下的有機相用飽和nahco3溶液洗滌3次,隨后用無水na2so4干燥,并旋干;將粗產品過層析柱(正己烷:乙酸乙酯=1:1),即得到化合物a(676mg,91%)。
測定其esi-ms:c18h18n4o3sna+([m+na]+),計算值:393.10;理論值:393.13。純化后化合物a的hplc檢測譜圖和esi-ms譜圖分別見圖1和2。
(2)化合物b的合成:將化合物a(670mg)加入反應瓶中,加入dcm(6ml)溶解,再加入tfa(6ml),于室溫下反應1h。反應結束后,將反應液減壓蒸餾,并加入乙醚沉淀,粗產品通過半制備hplc制備得到化合物b(461mg,94%)。所述hplc的條件參數見下表1。
表1化合物b純化的hplc條件參數
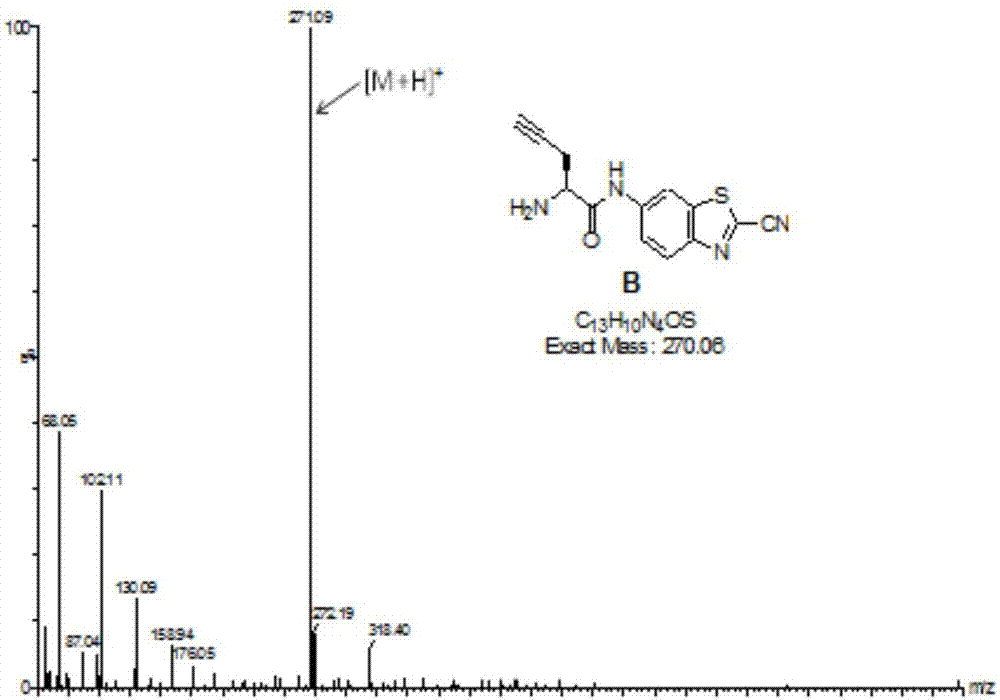
檢測化合物b數據如下:1hnmr(400mhz,d6-dmso),δ(ppm):11.06(s,1h),8.73(s,1h),8.52(s,1h),8.25(d,j=8.00hz,1h),7.79(d,j=8.00hz,1h),4.20(t,j=8.00hz,1h),3.17(s,1h),2.88(m,2h);13cnmr(101mhz,d6-dmso),δ(ppm):166.9,148.6,138.8,137.2,136.3,125.5,121.4,114.0,112.6,77.8,76.2,52.1,21.5;esi-ms:c13h11n4os+([m+h]+),計算值:271.07;理論值:271.14。
純化后化合物b的hplc檢測譜圖、esi-ms譜圖、1hnmr譜圖、13cnmr譜圖分別見圖3-6。
(3)化合物c的合成:在氮氣保護下,取化合物b(368mg,1.4mmol)和半胱氨酸(463mg,1.5mmol)加入反應瓶中,加入thf(5ml)溶解,再加入hbtu(594mg)、dipea(562μl),于室溫下反應2h。反應結束后,旋干溶劑,將粗產品過柱層析分離,得到化合物c(457mg,60%)。
檢測化合物c數據如下:1hnmr(400mhz,d6-dmso),δ(ppm):10.53(s,1h),8.73(s,1h),8.44(s,1h),8.22(d,j=8.00hz,1h),7.81(d,j=8.00hz,1h),7.17(s,1h),4.65(s,1h),4.27(s,1h),3.07(s,1h),2.93(m,2h),2.68(m,2h),1.38(s,9h),1.30(s,9h);13cnmr(100mhz,d6-dmso),δ(ppm)170.9,169.5,155.8,148.3,139.4,137.1,135.8,125.3,121.4,114.0,112.2,80.3,79.0,73.9,54.4,52.9,48.2,41.8,30.0,28.6,22.2;esi-ms:c25h31n5o4s3na+([m+na]+),計算值:584.14;理論值:584.15。
純化后化合物c的hplc檢測譜圖、esi-ms譜圖、1hnmr譜圖、13cnmr譜圖分別見圖7-10。
(4)化合物d的合成:將化合物c(280mg,0.5mmol)加入反應瓶中,加入dcm(3ml)溶解,再加入tfa(3ml),于室溫下反應1h。反應結束后,取反應液減壓蒸餾,并加入乙醚沉淀,將粗產品通過半制備型hplc制備得到化合物d(230mg,94%)。所述hplc的條件參數見下表2。
表2化合物d純化的hplc條件參數
檢測化合物d數據如下:1hnmr(400mhz,d6-dmso):δ(ppm)10.85(s,1h),9.26(s,1h),8.73(s,1h),8.43(d,j=8.00hz,2h),8.24(d,j=8.00hz,1h),7.84(d,j=8.00hz,1h),4.77(m,1h),4.16(t,j=8.00hz,1h),3.18(m,2h),2.96(s,1h),2.72(m,2h),1.34(s,9h);13cnmr(101mhz,d6-dmso),δ(ppm):169.2,167.4,148.4,139.4,137.1,135.9,125.4,121.4,114.0,112.2,79.9,74.2,53.1,52.0,48.6,41.8,29.9,22.5;esi-ms:c20h24n5o2s3+([m+h]+)462.11,計算值:462.11;理論值:462.25。
純化后化合物d的hplc檢測譜圖、esi-ms譜圖、1hnmr譜圖、13cnmr譜圖分別見圖11-14。
(5)化合物1-cold的合成:在氮氣保護下,將化合物d(210mg,0.461mmol),三氟硼酸鹽(135mg,0.692mmol),溶于3mldmf:h2o(1:1,v/v)溶劑中,將抗壞血酸鈉(182mg,0.922mmol)、cuso4·5h2o(230mg,0.922mmol)依次加入上述溶液中,于45℃下加熱反應30min。停止反應后,通過半制備型hplc分離純化,得到化合物1-cold(137mg,72%)。所述hplc的條件參數見下表3。
表3化合物1-cold純化的hplc條件參數
檢測化合物1-cold數據如下:1hnmr(400mhz,cd3od),δ(ppm):8.48(s,1h),8.00(d,j=8.00hz,1h),7.89(d,1h),7.59(d,j=8.00hz,1h),4.11(t,j=8.00hz,1h),3.71(t,j=8.00hz,2h),3.27(m,1h),3.22(m,2h),3.13(m,2h),3.02(t,j=8.00hz,2h),2.98(s,6h),2.40(d,j=4.00hz,2h),1.28(s,9h);13cnmr(101mhz,cd3od),δ(ppm):169.9,167.4,148.6,138.8,138.7,136.6,135.7,124.6,121.2,121.1,112.7,111.9,63.3,54.4,53.9,52.6,48.3,47.0,44.1,40.7,28.8,27.6;19fnmr(386mhz,cd3od),δ(ppm)76.7;esi-ms:c25h36bf3n9o2s3+([m+h]+),計算值:658.22;理論值:658.23。
純化后化合物1-cold的hplc檢測譜圖、esi-ms譜圖、1hnmr譜圖、13cnmr譜圖、19fnmr譜圖分別見圖15-19。
實施例2標記前體的制備
本實施例所述標記前體按照如下步驟合成制得:
(1)化合物a的合成:在氮氣保護下,向含有n-boc-炔丙基甘氨酸(768mg,3.6mmol)的dmf(3ml)溶液中加入n-甲基嗎啉(660μl,6.0mmol)和氯甲酸異丁酯(390μl,3.0mmol),于0℃溫度下攪拌2h,至溶液呈米黃色;反應2h后,在0℃下,加入6-氨基-2-氰基苯并噻唑(350mg,2.0mmol)的thf(5ml)溶液,反應液在rt下攪拌反應12h。12h后,向溶液中加入三氟乙酸試劑使反應停止,此時溶液呈深紅色。將含有化合物a的反應液用乙酸乙酯和h2o萃取,留下的有機相用飽和nahco3溶液洗滌3次,隨后用無水na2so4干燥,并旋干;將粗產品過層析柱(正己烷:乙酸乙酯=1:1),即得到化合物a。
(2)化合物b的合成:將化合物a加入反應瓶中,加入dcm(6ml)溶解,再加入tfa(6ml),于室溫下反應1h。反應結束后,將反應液減壓蒸餾,并加入乙醚沉淀,粗產品通過半制備hplc制備得到化合物b。
(3)化合物c的合成:在氮氣保護下,取化合物b和半胱氨酸(463mg,1.5mmol)加入反應瓶中,加入thf(5ml)溶解,再加入hbtu(594mg)、三乙胺(562μl),于室溫下反應2h。反應結束后,旋干溶劑,將粗產品過柱層析分離,得到化合物c(457mg,60%)。
(4)化合物d的合成:將化合物c(280mg,0.5mmol)加入反應瓶中,加入甲醇(3ml)溶解,再加入tfa(3ml),于室溫下反應1h。反應結束后,取反應液減壓蒸餾,并加入乙醚沉淀,將粗產品通過半制備型hplc制備得到化合物d。
(5)化合物1-cold的合成:在氮氣保護下,將化合物d(210mg,0.461mmol),三氟硼酸鹽(135mg,0.692mmol),溶于3mldmf:h2o(1:1,v/v)溶劑中,將抗壞血酸鈉(182mg,0.922mmol)、cu(i)cl(0.922mmol)依次加入上述溶液中,于45℃下加熱反應30min。停止反應后,通過半制備型hplc分離純化,得到化合物1-cold。
經檢測,所得化合物1-cold的結構正確。
實施例318f標記的化合物的制備
本實施例所述18f標記的化合物具有如下式(1)所示的結構:
本實施例所述18f標記的化合物的合成路線如下:
本實施例所述18f標記的化合物按照如下步驟合成制得:
(1)[18f]氟離子合成:放射性標記實驗中,無載體溶液的[18f]氟離子可以直接獲得使用,或經陰離子交換柱(qma)[18f]氟離子被吸附,用300-700μl的pbs的緩沖液將[18f]氟離子從qma柱上洗脫;
(2)將100nmol實施例1中制得的所述前體1-cold用20μldmf溶解在反應管中,并加入200mci[18f],在80℃下加熱30min,將反應液加入20ml去離子水中稀釋,通過c18柱(seppakplusc-18)將雜質去除,用去離子水(10ml)洗滌三次,然后用0.5ml將標記產物淋洗到西林瓶中,再用鹽水稀釋以備使用,取少量溶液稀釋,通過放射性高效液相檢測純化情況。附圖20給出了純化前后溶液中的化合物情況。
將制得的放射性化合物1(100μci)溶解在鹽水(100μl)中,測定其在pbs(0.1m;ph=7;1ml)和人血清(1ml)中的穩定性。取各溶液在37℃下培養,取樣品(50μl)通過放射性hplc測定放射化學純度(rcp),檢測結果見附圖21。可見,本發明所述放射性化合物1在pbs和胎牛血清中在37℃下4小時內非常穩定,這有利于運輸和進一步的生物學研究。
實施例4
在實施例3基礎上,對放射性實驗的條件進行優化研究,包括反應溫度和加熱時間。將凍干的前體加入到聚丙烯管中,然后僅需要加入用緩沖液洗脫的[f18]-氟化物陰離子。然后,反應混合物通過c-18光柱純化,并用含<10%etoh的鹽水配制用于進一步使用。為了測定溫度對rly(%)的影響,分別測定30,40,50,60,70,80,90,100℃下的反應情況;為了測定反應時間的影響,分別在80℃下測定0-120min的反應情況。各反應條件下的放射性標記結果見附圖22。
可見,當孵育溫度和孵育時間分別為80℃和20分鐘時,可以取得令人滿意的rly。化合物1的f18標記的總方法小于30分鐘,并且獲得了具有高比活性(1.2ci/μmol)和高純度(>99%)的良好產率(>120mci,60%)。這些結果都表明,所需的f18-放射性標記方法已經可以應用于探針1的制備,其中可以避免干燥f18-氟離子和hplc純化,其可以實施為試劑盒樣方式,其對于大規模生產和臨床應用更方便。
實驗例
本發明下述實驗例中分析型hplc的條件見下表4。
表4所有化合物的分析型hplc條件
實驗例1化合物1-cold的性質
1.1、化合物1-cold中二硫鍵還原使得分子間成環
為了確定是否化合物1-cold中二硫鍵還原使得分子間成環,將化合物1-cold(100μl,3.3mm)用檸檬酸緩沖液(ph=3.0)溶解,加入tcep·hcl(66μl,50mm)。將溶液混合在室溫下反應1h,反應1h后,通過hplc分析檢測。繼續反應后,用氫氧化鈉將反應液的ph值調節到7.4,每個實驗重復三次,結果見附圖23。
將化合物1-cold(100μl,3.3mm)用磷酸緩沖液(10mmpb,ph=7.4)溶解,分別加入gsh(66μl,50mm)和細胞裂解液反應。4h后,反應液通過hplc和lc-ms進行檢測,結果見圖24-26。
可以看出1-cold溶液在tcep中,ph=3是澄清的,結果可以通過hplc和lc-ms得到。之后,將溶液ph值調節到7.4,溶液變得渾濁,這是因為得到成環產物。同樣,在gsh和細胞裂解液中(ph=7.4)也觀察到相同的現象。
在酸性條件下將1-cold(100μl,3.3mm)與三(2-羧基乙基)膦(tcep)孵育后,溶液變澄清。然而,當將ph調節至7.4時,該溶液立即變混濁。通過高效液相色譜(hplc)和液相色譜-質譜(lc-ms)檢查后,發現1-cold中的二硫鍵在酸性條件下被切割,并且在溶液的ph變化時,轉化成其二聚產物。在生理條件(ph=7.4)下,當1-cold在gsh或細胞裂解物中孵育4小時時,還觀察到環化產物的主要部分,表明探針還特異性地響應于內源性生物硫醇。這些結果表明,以此制備探針可以在還原環境下還原,產生環狀二聚體,為特異性檢測生物硫醇狀態提供了潛在的應用。
1.2、納米自組裝特性
如圖27中顯示的化合物1-cold納米自組裝的納米表征特征,動態光散射(dls)測量表明納米顆粒具有窄的分布和140nm的平均直徑。直接將上述分散體用于透射電子顯微鏡(tem)觀察,發現納米顆粒具有120nm的平均直徑。根據二聚體的兩親性結構的理論計算,它們以與分子間π-π堆積相互作用相同的順序排列。二聚體中的熒光素面對面堆積,層間距為
1.3、化合物1-cold在細胞中的生物兼容性
通過mtt實驗測定化合物1-cold在人的惡性膠質瘤細胞u87mg中的細胞毒性。在96孔板中每孔鋪5×103細胞,細胞在37℃下含5%的co2的培養箱中培養12h。1-cold用0.1%的dmso(二甲基亞砜)溶解,再用dmem稀釋成濃度分別為12.5、25、50、100μm的溶液。細胞與不同濃度的探針1-cold在37℃,5%的co2中分別培養3、6、12、24h。培養結束后,用20μl的mtt(5mg/ml)處理細胞后再培養4h。在mtt實驗中,去除培養基后,向每孔中加入150μl的dmso。od(光密度值)用elisa儀器在470nm下讀取。所有的測試重復6次并且有至少三個獨立的實驗,細胞生存能力(%)=(實驗組的平均od值/對照組的平均od值)×100。檢測結果見附圖28所示。
通過3-(4,5-二甲基噻唑-2-基)2,5-二苯基-四唑溴化物(mtt)測定來評價1-cold在u87mg癌細胞中的生物相容性。分別在25、50和100μm的1-cold孵育24小時后,分別有97%、98%和92%的u87mg細胞存活。這證明1-cold在24小時內的細胞毒性是可忽略的。
1.4、前體(1-cold)在緩沖液(ph=2.0-2.5)中的穩定性實驗
測定前體(1-cold)在噠嗪-鹽酸緩沖液(ph=2.0-2.5)中不同溫度下的穩定性實驗。100nmol的1-cold溶解在500μl的噠嗪-鹽酸緩沖液中,分別在50、60、70、80、90、100℃下反應30min。取少量樣品用于hplc分析(uv254nm),檢測結果見附圖29。發現前體(1-cold)甚至在100℃下在噠嗪-hcl緩沖液中非常穩定,表明放射性標記可在寬的操作溫度范圍內進行。
實驗例2放射性化合物1的性質
2.1、脂水分配系數(logp)的測定
測定化合物1在正辛醇/水中的脂水分配系數。將pbs緩沖液與等體積的正辛醇充分振蕩,使兩相相互飽和,在室溫下靜置一天以上,用分液漏斗將兩相分離。取1ml正辛醇、1mlpbs緩沖液、標記產物混合,用渦旋混合器振蕩5min,充分混勻。4000轉/min,離心5min,在有機相和水相中分別平行取3個樣(100μl)于放敏管中,用γ計數儀測定其放射性活度,每個樣品測定3次。計算脂水分配系數的logp值。logp=log(co/cw),co和cw分別是探針在正辛醇和水中的放射性計量。結果至少重復三次,用±sd表示。確定的所述立體內酯的辛醇/水分配系數(logp)為0.37±0.04,表明其是親脂性的并且可能具有有利的細胞通透性。
2.2、細胞攝取實驗
人的惡性膠質瘤細胞u87mg和人的結腸癌細胞hct116用dmem,含10%(v/v)的胎牛血清(biologicalindustries,kibbutzbeithaemek,israel)在37℃下含5%的co2中培養。細胞攝取實驗用u87mg和hct116在6孔板(5×105細胞/孔)中培養過夜,細胞用pbs洗三次,加入含1μci化合物1的無太牛血清,分別在37℃下培養30、60、210、240min。在每個時間點,都要去除培養基,再用冷pbs洗滌兩次,再用0.1m的氫氧化鈉裂解。收集裂解液和pbs,放射性劑量用γ計數儀測定,細胞攝取率用%ad(總加入計量的百分數)表示,標準化為5×105細胞。然后,通過將探針1與人膠質母細胞瘤細胞u87mg和人結腸直腸癌細胞hct116一起溫育,進一步研究立體內標物的細胞通透性,并通過用γ-計數器計數放射性來定量細胞攝取。檢測結果見附圖30。
上述結果可見,化合物1的細胞攝取快速接近在u87mg中的最大值的2.83%和在30分鐘內的hct116的最大值的2.31%。這些結果表明,探針1可以快速有效地靶向癌細胞u87mg和hct116,前者具有相對較高的攝取。
2.3pet成像和切倫科夫發光成像(cli)
腫瘤通過在每只裸鼠的右肩皮下注射5×106u87mg細胞,然后大約長3到4周,腫瘤直徑大約為0.5-1.0cm,可以用于成像實驗。
pet成像使用inveondedicatedpet(siemens)儀器進行實驗。在所有的實驗中,老鼠均使用異氟烷麻醉(2%的異氟烷在流速為2l/min的氧氣中)。對于老鼠體內谷胱甘肽的成像,~100μci探針1和~100μci探針1含有10mm的谷胱甘肽在100μl生理鹽水中,直接注射到老鼠的右后腿。對于腫瘤鼠成像,探針1(~100μci探針1在100μl生理鹽水中)通過靜脈注射。對于阻斷實驗,1mgnem(100μl)預先10min注射。pet成像需要收集60min的數據。pet數據分成12幀,每一幀用micropetmanager(version6869,siemens)通過osem3d/mapalgorithm重新構建。重新構建的像素尺寸為0.78×0.78×0.80mm,在一個128×128×159圖像矩陣中。所有pet圖像糾正衰變但不衰減。圖像分析使用asipro(siemens)軟件。為了描述示蹤劑在腫瘤內的累積,感興趣區域(roi)分析通過肉眼觀察腫瘤尺寸,他們出現在皮膚下的腫塊以確定腫瘤區域內的放射性。
取化合物1(~100μci,溶解在100μl生理鹽水中)通過肌肉注射到老鼠的后腿上。注射后,小鼠通過異氟烷(2%)麻醉。切倫科夫發光用小動物熒光成像光譜測定。cli信號表示單位每球面度光子/厘米2/秒(pcm-2s-1sr-1)。
在人工生物硫醇小鼠中研究了gsh在體內誘導的探針1。將與或不與gsh(10mm)混合的探針1(106μci,100μl)的溶液分別立即皮下注射到兩個不同部位上的同一健康裸鼠中,然后使用pet掃描儀。結果見附圖31-33所示。
結果顯示,小鼠中放射性在全身迅速代謝。含有探針1和gsh的注射部位顯示出高且持久的放射性,而另一個僅注射了探針1部位的放射性降低較快。對于注射1的位點和僅注射1(左)的位點gsh(右側)(分別在10分鐘2.16倍和30分鐘3.36倍)觀察到放射性強度的增加比率。肝臟是合成和保留gsh的最重要的器官,gsh的濃度在正常肝臟中高達7mm。在整個成像期間,它也是高的和持續的攝取。然而,當肝臟受傷時,gsh水平將大大降低。因此,肝臟中生物硫醇水平的非侵入性成像對肝臟疾病和肝臟毒性的檢測至關重要。在肝臟和具有高的人工補充的gsh(右腿)的位置中的高放射性表明探針1可以被生物硫醇還原,導致納米粒子裝配用于體內持久信號。還值得注意的是,可以用cherenkov熒光圖像(cli)觀察到類似的現象。然而,即使使用近似的注射劑量,cli中的信號與pet中的信號相比也相對較弱。
通過基于可激活的探針1的pet圖像進一步檢測具有皮下u87mg腫瘤的裸鼠中的內源性生物硫醇。從體內18f放射性的生物分布觀察,觀察到肝,腎和腫瘤顯示出高水平的絕對攝取,顯示示蹤劑的主要腎清除率。肌肉中的低放射性在pet成像中承諾最小的背景信號。腫瘤中18f放射性的每克組織的注射劑量的百分比(%id/g)在15分鐘內達到最大,值為4.93±0.76%id/g,腫瘤與肌肉的攝取比為3.1。腫瘤的18f放射性在45-50分鐘逐漸降低至2.95±0.51%id/g。這些結果表明放射性探針1在具有過表達的gsh水平的u87mg腫瘤中具有良好的攝取并觸發用于持續pet成像腫瘤信號的納米聚集。當腫瘤中的生物硫醇水平被包含硫醇清除劑n-乙基馬來酰亞胺(nem)抑制時,在用10mmnem預處理時,pet信號從4.93顯著降低至2.01%id/g。這證實了探針1中的二硫化物由腫瘤中的內源性生物硫醇觸發以原位聚集18f放射性的信號。因此,探針1可以用作方便和精確檢測活體中生物硫醇水平的有利的pet成像劑。
顯然,上述實施例僅僅是為清楚地說明所作的舉例,而并非對實施方式的限定。對于所屬領域的普通技術人員來說,在上述說明的基礎上還可以做出其它不同形式的變化或變動。這里無需也無法對所有的實施方式予以窮舉。而由此所引伸出的顯而易見的變化或變動仍處于本發明創造的保護范圍之中。
- 還沒有人留言評論。精彩留言會獲得點贊!