體外共培養肺泡-毛細血管模型系統的制作方法
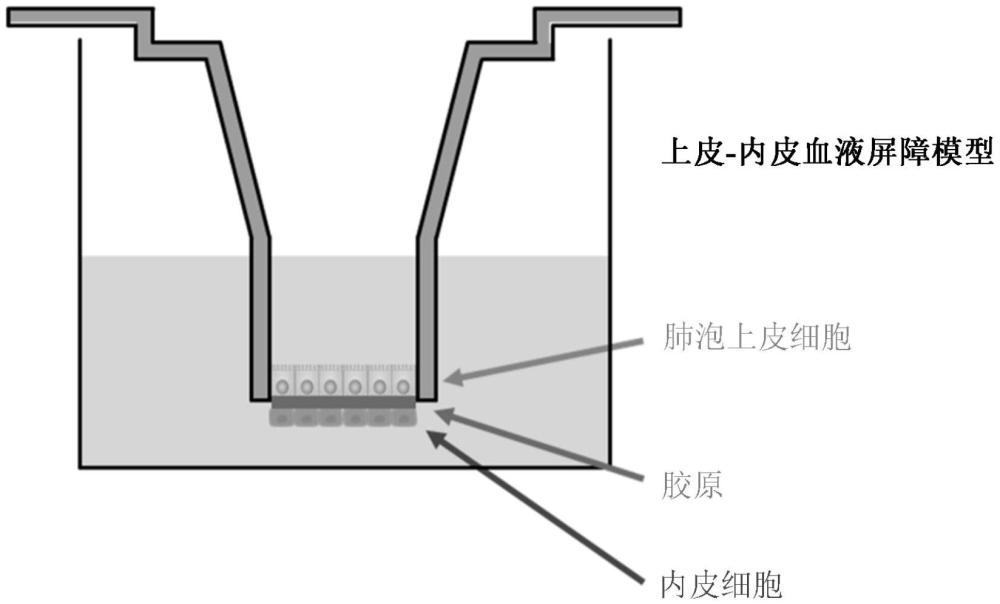
本發明利用從人肺組織分離的接種到transwell系統中的原代細胞,從而增加了體外肺模型的生理相關性,并允許在臨床環境之外研究肺泡-毛細血管屏障中的細胞相互作用。
背景技術:
1、在嚴重的呼吸道疾病中,血管滲漏和肺水腫會加速病情的發展,最終可能導致呼吸衰竭。研究表明,呼吸道內皮損傷會引發細胞浸潤和液體滲漏到肺泡腔內。另一方面,健康的呼吸道上皮為抵御外部病原體提供了物理和免疫屏障,從而保護底層組織免受直接感染。然而,在患病狀態下,上皮的完整性受到損害,進而導致內皮損傷,使病原體得以進入血流。解決這些問題的治療策略包括通過緊密/粘附連接恢復上皮和內皮的完整性,并通過特定的信號傳導通路改變細胞骨架排列。
2、隨著器官芯片(organ-on-a-chip,ooac)培養系統的出現,可以將機械拉伸應用于aa電池大小的系統,以更好地模擬呼吸期間肺組織的生理運動。然而,據報道,肺芯片(lung-on-a-chip)的反應仍無法完全再現天然肺泡上皮細胞(aec)中觀察到的反應。在藥物測試方面,由于微流體系統的尺寸極小,表面效應可能比體積效應更為顯著,這可能導致比預期更多的藥物顆粒被吸附,從而影響交叉處的流體混合效果。此外,在使用ooac模型癌癥環境或人類腸道時,可能需要特殊設備來增強數據的可靠性。
3、準確地模擬人類生理條件的預測性體外建模系統對于在臨床環境外理解驅動疾病病機的機制至關重要。目前,體外模型通常由單一培養物組成,由于缺乏微環境相互作用,所述單一培養物的表現可能與體內觀察到的表現不同。
4、此外,動物模型的倫理問題以及其對人類疾病通常較低的預測價值,進一步突顯了替代方法的必要性。雖然永生化細胞系(如來源于人肺癌的a549細胞)已被廣泛使用,但它們在體外培養條件下產生的表型差異限制了它們復制生理上皮的關鍵特征的能力。
5、在臨床環境之外研究呼吸道病毒引發的急性肺損傷的生理變化及其相關機制,面臨著諸多挑戰。在體外準確地對這些具有生理相關性的過程進行建模對于推進藥物篩選工作至關重要,特別是對于精準醫學。開發更具代表性的模型有助于推動治療干預的探索,從而更準確地預測臨床結果,最終改善患者的護理質量。
技術實現思路
1、本發明旨在增強肺模型的生理相關性,并且因此建立了共培養模型。本發明公開了一種針對原代人aec和人肺微血管內皮細胞(hmvec)培養物優化的體外共培養肺損傷形式,用于研究高致病性流感病毒感染病機和恢復的機制。
2、在經膠原涂布的transwell系統中培養人aec和hmvec。該肺損傷模型可以用于研究呼吸道病毒感染后肺泡液清除率(afc)和肺泡蛋白質通透性(app)的變化,這兩者都是嚴重呼吸道病毒感染引起的急性呼吸窘迫綜合征(ards)致命發展的重要因素。
3、在第一方面,本發明提供了一種用于研究由呼吸道病毒感染誘導的急性肺損傷的體外共培養肺泡-毛細血管模型系統。所述系統包括:transwell系統,其中原代人肺泡上皮細胞接種到所述transwell系統的頂側室表面上,并且人肺微血管內皮細胞接種到所述transwell系統的基底外側表面上;以及用于測量受感染細胞中的肺泡液清除率和肺泡蛋白質通透性的裝置。所述體外共培養肺泡-毛細血管模型系統模擬肺泡-毛細血管屏障。
4、在一個實施例中,在經膠原涂布的transwell插入物上培養所述原代人肺泡上皮細胞,以促進緊密連接的形成。
5、在一個實施例中,所述原代人肺泡上皮細胞是從非惡性肺組織中分離的。
6、在一個實施例中,以每個孔5×104至2×105個細胞的細胞密度接種所述原代人肺泡上皮細胞,并且以每個孔5×104至2×105個細胞的細胞密度接種所述人肺微血管內皮細胞。
7、在一個實施例中,所述transwell系統的孔隙大小為0.4μm。
8、在第二方面,本發明提供了一種用于體外研究由呼吸道病毒感染誘導的急性肺損傷的方法,所述方法包括:分離原代人肺泡上皮細胞和人微血管內皮細胞;將所述原代人肺泡上皮細胞接種在transwell膜的頂側室表面上,并且將所述人微血管內皮細胞接種在所述transwell系統的基底外側表面上,以形成體外共培養肺泡-毛細血管模型系統;用一種或多種呼吸道病毒感染所述體外共培養肺泡-毛細血管模型系統;以及評估病毒感染對至少一個生理參數的影響,所述生理參數包含afc和app。
9、在一個實施例中,使用酶促消化,然后使用密度梯度離心和磁珠分離來分離所述原代人肺泡上皮細胞和所述人微血管內皮細胞。
10、在一個實施例中,在經膠原涂布的transwell插入物上培養所述原代人肺泡上皮細胞,以促進緊密連接的形成。
11、在一個實施例中,所述原代人肺泡上皮細胞是從非惡性肺組織中分離的。
12、在一個實施例中,以每個孔5×104至2×105個細胞的細胞密度接種所述原代人肺泡上皮細胞,并且以每個孔5×104至2×105個細胞的細胞密度接種所述人肺微血管內皮細胞。
13、在一個實施例中,所述transwell系統的孔隙大小為0.4μm。
14、在一個實施例中,所述一種或多種呼吸道病毒選自由以下組成的組:冠狀病毒、呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒、鼻病毒、腸道病毒和單純皰疹病毒。
15、在一個實施例中,所述體外共培養肺泡-毛細血管模型系統被甲型流感病毒亞型h5n1感染。
16、在另一個實施例中,所述方法進一步包括在所述病毒感染后添加治療劑,以抑制所述人肺泡上皮細胞和所述人肺微血管內皮細胞內的病毒復制。
17、在一個實施例中,所述治療劑包括濃度為每孔1×107至1×109個細胞外囊泡粒子(ev)。所述細胞外囊泡來源于人間充質基質細胞。
18、在另一個實施例中,所述方法進一步包括測量經上皮電阻(teer)作為評估上皮-內皮屏障隨時間推移的完整性的指標,并且所述teer保持≥800ω/cm2。
19、在一個實施例中,評估病毒感染對至少一個生理參數的影響的步驟進一步包括測量所述原代人肺泡上皮細胞和所述人微血管內皮細胞中的病毒基因表達和抗病毒基因表達。
技術特征:
1.一種體外共培養肺泡-毛細血管模型系統,用于研究由呼吸道病毒感染誘導的急性肺損傷,其特征在于,其中所述體外共培養肺泡-毛細血管模型系統包含:
2.根據權利要求1所述的體外共培養肺泡-毛細血管模型系統,其中在經膠原涂布的transwell插入物上培養所述原代人肺泡上皮細胞,以促進緊密連接的形成。
3.根據權利要求1所述的體外共培養肺泡-毛細血管模型系統,其中所述原代人肺泡上皮細胞是從非惡性肺組織中分離的。
4.根據權利要求1所述的體外共培養肺泡-毛細血管模型系統,其中以每個孔5×104至2×105個細胞的細胞密度接種所述原代人肺泡上皮細胞。
5.根據權利要求1所述的體外共培養肺泡-毛細血管模型系統,其中以每個孔5×104至2×105個細胞的細胞密度接種所述人肺微血管內皮細胞。
6.根據權利要求1所述的體外共培養肺泡-毛細血管模型系統,其中所述transwell系統的孔隙大小為0.4μm。
7.一種用于體外研究由呼吸道病毒感染誘導的急性肺損傷的方法,所述方法包含:
8.根據權利要求7所述的方法,其中使用酶促消化,然后使用密度梯度離心和磁珠分離來分離所述原代人肺泡上皮細胞和所述人微血管內皮細胞。
9.根據權利要求7所述的方法,其中在經膠原涂布的transwell插入物上培養所述原代人肺泡上皮細胞,以促進緊密連接的形成。
10.根據權利要求7所述的方法,其中所述原代人肺泡上皮細胞是從非惡性肺組織中分離的。
11.根據權利要求7所述的方法,其中以每個孔5×104至2×105個細胞的細胞密度接種所述原代人肺泡上皮細胞。
12.根據權利要求7所述的方法,其中以每個孔5×104至2×105個細胞的細胞密度接種所述人肺微血管內皮細胞。
13.根據權利要求7所述的方法,其中所述transwell系統的孔隙大小為0.4μm。
14.根據權利要求7所述的方法,其中所述一種或多種呼吸道病毒選自由以下組成的組:冠狀病毒、呼吸道合胞病毒、腺病毒、流感病毒、副流感病毒、鼻病毒、腸道病毒和單純皰疹病毒。
15.根據權利要求14所述的方法,其中所述體外共培養肺泡-毛細血管模型系統被甲型流感病毒亞型h5n1感染。
16.根據權利要求7所述的方法,其中所述方法進一步包含在所述病毒感染后添加治療劑,以抑制所述人肺泡上皮細胞和所述人肺微血管內皮細胞內的病毒復制。
17.根據權利要求16所述的方法,其中所述治療劑包含每孔1×107至1×109個細胞外囊泡粒子。
18.根據權利要求17所述的方法,其中所述細胞外囊泡來源于人間充質基質細胞。
19.根據權利要求7所述的方法,其進一步包含測量經上皮電阻(teer)作為評估上皮-內皮屏障隨時間推移的完整性的指標,并且所述teer保持≥800ω/cm2。
20.根據權利要求7所述的方法,其中評估病毒感染對至少一個生理參數的影響的步驟進一步包含測量所述原代人肺泡上皮細胞和所述人微血管內皮細胞中的病毒基因表達和抗病毒基因表達。
技術總結
本發明提供了一種人肺泡上皮細胞和內皮細胞的共培養系統,以研究肺中上皮?內皮屏障內的相互作用。其表明感染高致病性甲型流感病毒A/HK/483/97(H5N1)會顯著降低肺泡液清除率(AFC)并增加蛋白質通透性(APP)。感染后施用治療性細胞外囊泡(EV)有效地恢復AFC和APP,減少病毒復制,并增強抗病毒基因的表達。本發明突出了EV的治療潛力,并且為研究急性肺損傷和改進肺部藥物遞送技術提供了有價值的工具。
技術研發人員:陳志偉,馬寶怡,程曉霞
受保護的技術使用者:免疫與感染研究中心有限公司
技術研發日:
技術公布日:2025/4/28
- 還沒有人留言評論。精彩留言會獲得點贊!