評價疫苗療效的細胞免疫學檢測試劑盒及其儲存方法與流程
本發明涉及一種用于評價疫苗療效的試劑盒、以及所屬試劑盒的儲存方法,尤其涉及一種通過細胞免疫學檢測進行疫苗療效評價的試劑盒、以及所述試劑盒的儲存方法。
背景技術:
目前,預防性疫苗的評價手段相對簡單,主要以跟蹤隨訪隊列為主,評價抗體水平及人群保護效力,如流感疫苗、乙肝預防性疫苗、天花疫苗等等。在對預防性疫苗作用進行綜合評價中,常常以疫苗所產生的抗體滴度作為一個核心指標,而近十年來隨著檢測手段的加強,特別是新型細胞免疫評價技術的發展,預防性疫苗的評價也開始觸及適應性免疫的重要細胞——T細胞,如預防性的流感、天花等疫苗的效果研究中,除了檢測了IgG之外,也對T細胞所表達的少數細胞因子IFN-γ、IL-2等進行了檢測,由此來推測疫苗的長期影響和保護效果。
治療性疫苗的研制已覆蓋了多種類型的慢性感染性疾病、腫瘤、自身免疫性疾病和神經退行性疾病等。在治療性疫苗近二三十年的發展過程中,遭遇了諸多瓶頸,以致于目前僅有4種治療性疫苗獲得成功上市。瓶頸之一就是尚未找到一種在臨床研究的早期,可以用來預測疫苗臨床療效的普適的免疫學替代終點,如預防性疫苗評價的替代終點——中和抗體。由于缺乏這一普適的替代終點,使得目前治療性疫苗的評價不得不依賴于臨床治療后最終的療效,而臨床療效的獲得要求大樣本,以及長時間、耗力、耗經費的IIb或III期臨床試驗,一旦所選擇的劑量、用法或策略存在不足,即便治療性疫苗本身確實有效,亦無法獲得滿意的療效評價,從而大大地延遲此類產品的上市,甚至扼殺了這類技術和產品。
如今,治療性疫苗的研發和各種關鍵技術手段日新月異,但對于治療替代終點與最終臨床效果平行評價方法學的研究,國內外仍屬空白,從治療性疫苗問世至今,尚無統一、標準、完善的評價手段出現。目前臨床評價治療性疫苗主要在 于受試者臨床表型的變化、治療性疫苗所誘導產生的抗體以及相應免疫記憶能力,評價體系較為單一。而這種單一的評價方式只能針對于所研發治療性疫苗的有效與否給予初步的結論,無法從治療性疫苗對于免疫系統整體影響的評價來預測其治療效果,更無法從本質上解釋受試者治療成功或失敗的根本原因。
治療性疫苗對于免疫系統的整體影響,主要體現在對各類免疫細胞的抗原特異性影響方面。但此類評價的細胞免疫學指標國內外研究尚處于初期,沒有統一的標準去對研發的治療性疫苗進行有效的評價,如何從特異性細胞免疫學水平上,通過免疫細胞上重要的生物學標志物進行治療性疫苗的評價是現今研發領域所面臨的重大問題。
對于評價體系的摸索,目前研究最多的治療性疫苗是人類免疫缺陷病毒(HIV)疫苗。HIV的治療性疫苗至今已有三十多年的時間,在不斷的失敗中摸索前進,對于HIV的治療性疫苗評價的研究也有了新的進展,最初的評價為能生成廣泛的HIV包膜特異性中和抗體,及病人病毒量、CD4+T細胞數量的變化等HIV臨床表征的評價,卻無法從免疫學角度預測疫苗的治療效果,解釋治療性疫苗有效或失敗的原因,以及以后的改進方向問題,從而大大地延遲此類疫苗的上市,甚至扼殺有效疫苗探索。隨著HIV病毒作用機理研究的深入,目前大多數的HIV疫苗誘導的保護重點是CD8+T細胞的反應,因而在評價臨床疫苗的過程中開始涉獵CD8+T細胞單一表達功能性細胞因子如IFN-γ、TNF-α等的評價,但是這種評價也是不全面的,而且如果分別獨立地進行多種指標評價將在極大程度上消耗珍貴的臨床樣品。
伴隨免疫學及病毒學的進一步發展深入,在疫苗的評價中逐漸認識到從單一的某一群淋巴細胞或者是某一種細胞因子并不能全面和系統的評價疫苗產生作用的方式及成敗的原因。于是在HIV疫苗的臨床評價方面,在受試過程及后期隨訪過程中,利用多色流式細胞儀技術對血液中CD8+T細胞表達所有相關細胞因子進行總體評價,與相關臨床表型相結合,找出多能性的一種或者幾種類型的CD8+T細胞亞群作為疫苗效果預測評價指標,已成為HIV疫苗評價的一條新的發展思路,并被逐步地應用于正在開發中的結核治療性疫苗、乙肝治療性疫苗、腫瘤治療性疫苗等的評價中。
而目前國內治療性疫苗研究的熱點之一是乙型肝炎治療性疫苗。乙肝治療性 疫苗最初的評價主要是針對于乙肝五項抗原抗體指標、HBV DNA水平和ALT的水平。這些指標只能在評價的最后給出治療和預防方法是否起到了保護作用,無法預測治療性疫苗可能起到的效果及成敗的原因。后來隨著治療性疫苗評價的深入,人們也開始關注血清中各種細胞因子的水平以及T細胞免疫應答的水平。研究表明,乙型肝炎病毒(HBV)特異性CD8+T細胞能夠通過分泌細胞因子,清除感染肝細胞的病毒。這些細胞因子主要是干擾素(IFN-γ)和腫瘤壞死因子α(TNF-α)和直接的細胞毒作用(穿孔素和顆粒酶),從而誘導細胞死亡。因此體外檢測CD8+T細胞的功能成為目前細胞免疫學檢測的重點,并且通過細胞因子表達的水平,能夠從一定程度上推測治療性疫苗可能的治療效果。但與HIV所不同的是,在慢乙肝病人中,人們發現大多數病人的T細胞處于病毒誘導的免疫耐受狀態,在體外并不能夠在抗原的再次刺激下很好地表達功能相關的細胞因子。因此,如何活化CD8+T細胞使其恢復對抗原應答的功能,成為體外評價HBV治療性疫苗治療效果的一個難點。通過研究發現,在體外采用特異性或者非特異性富集的方式,能夠很好地重新激發T細胞的活性,使其恢復對抗原的應答能力。
而且隨著進一步的探入研究,人們發現了越來越多的T細胞的分類亞群,而T細胞的整體功能的體現是各種亞群細胞相互影響、共同作用的結果,只檢測某一種T細胞亞群或者是某一類特殊功能的亞群并不能夠完整的體現免疫系統的整體影響,隨著多色流式儀器等技術的進一步發展,我們已經能夠在一個細胞中同時檢測十幾種甚至二十幾種細胞因子,因此,我們不僅可以檢測CTL細胞的功能,我們還能夠同時檢測輔助性T細胞(Th細胞)、調節性T細胞(Treg細胞)在疫苗注射后細胞因子表達水平的變化,這就為全面地評價疫苗對于細胞因子整體表達的影響及疫苗療效間關系提供了可能性。
上世紀80年代,復旦大學醫學院聞玉梅院士率領課題組通過分析我國慢性乙型肝炎患者大多為母嬰傳播所導致的對HBV耐受的特點,認為患者對乙肝表面抗原的免疫耐受為我國乙型肝炎發生慢性化的主要機理,據此提出組建新抗原、改變耐受原的提呈方式,構建乙肝治療性疫苗以消除機體對病毒抗原的免疫耐受,達到治療乙型肝炎的目的,進而構建了乙肝表面抗原(HBsAg)和人抗HBs免疫復合物疫苗——乙克(抗原抗體復合物型治療性乙型肝炎疫苗)。在研究中發現,在慢乙肝患者體內HBsAg很難被樹突狀細胞(DC細胞)識別進行 抗原遞呈,而按一定比例組建成HBsAg-抗HBs復合物,它可以通過抗體的Fc段介導,HBsAg可經抗原呈遞細胞表面的Fc受體被動地帶進抗原呈遞細胞。
目前,乙克疫苗成為唯一一個進入III期臨床試驗的慢性乙型肝炎治療性疫苗。臨床試驗結果證實了乙克對于慢性乙肝的治療效果,但是目前除了臨床表現結果之外,尚無特定的免疫學評價指標或替代終點對乙克的治療效果進行早中期評價,因此在免疫學層面上,仍缺乏對治療慢性乙肝疫苗的免疫學替代終點的研究。
技術實現要素:
為了對治療性疫苗臨床治療效果進行免疫學評價,本發明提供了一種新的評價疫苗效果的細胞免疫學檢測試劑盒。
本發明第一個方面是提供一種評價疫苗療效的細胞免疫學檢測試劑盒,包括MHC(主要組織相容性復合體,Major Histocompatibility Complex)限制性抗原肽。
所述疫苗優選為治療性疫苗。
其中,所述抗原表位肽可以是腫瘤細胞表面的抗原表位肽和/或病毒表面的抗原表位肽中的任意一種或幾種。
其中,所述病毒優選為對人和動物致病的病毒,并優選為皰疹病毒、流感病毒、狂犬病病毒、天花病毒、乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒、HIV病毒、人類乳頭瘤病毒中的任意一種或幾種。
其中,所述腫瘤可以是胃腸道腫瘤(如胃癌、結腸癌、直腸癌等)、肺癌、乳腺癌、胰腺癌、肝癌、惡性畸胎瘤、甲狀腺腫瘤、顱內腫瘤、食管癌、膀胱癌、皮膚癌、血癌、淋巴瘤、子宮肌瘤、宮頸癌、泌尿道腫瘤、骨腫瘤等。
其中,所述MHC限制性抗原肽優選為至少包括如下a)、b)抗原表位肽中的任意一種或幾種:a)針對CD4+T細胞抗原表位肽和/或CD8+T細胞抗原表位肽,b)所述表位抗原氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有該抗原表位肽功能的氨基酸序列。
在一種優選實施例中,所述MHC限制性病毒抗原肽優選為至少包括如下a1)、b1)抗原表位肽中的任意一種或幾種:a1)針對CD4+T細胞乙肝表面抗 原(HBsAg)表位肽和/或CD8+T細胞乙肝表面抗原(HBsAg)表位肽,b1)所述表位抗原氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有HBsAg抗原表位肽功能的氨基酸序列。
上述的抗原表位肽可以是任意已知的抗原表位肽。
在一種更優選實施例中,所述針對CD4+T細胞HBsAg表位肽包括、但不限于如下氨基酸序列中的任意一種或幾種:
FFLLTRILTI;
FFLLTRILTIPQSLD;
TSLNFLGGTTVCLGQ;
QSPTSNHSPTSCPPIC;
CTTPAQGNSMFPSC;
CTKPTDGN;
WASVRFSW;
LLPIFFCLW;
上述任意氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有CD4+T細胞HBsAg表位肽功能的氨基酸序列。
在一種更優選實施例中,所述針對CD8+T細胞HBsAg表位肽包括、但不限于如下氨基酸序列中的任意一種或幾種:
VLQAGFFLL;
FLLTRILTI;
FLGGTPVCL;
LLCLIFLLV;
LVLLDYQGML;
LLDYQGMLPV;
WLSLLVPFV;
GLSPTVWLSV;
SIVSPFIPLL;
ILSPFLPLL;
LLVPFVQWFV;
FLPSDFFPSI;
FLPSDFFPSV;
CLTFGRETV;
EYLVSFGVW;
TPPATRPPNAPIL;
KYTSFPWL;
IPIPSSWAF;
WMMWYWGPSLY;
ILLLCLIFLL;
RWMCLRRFII;
RFSWLSLLVPF;
LYNILSPFL;
PFLPLLPIF;
PFVQWFVGL;
上述任意氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有CD8+T細胞HBsAg表位肽功能的氨基酸序列。
在一種更優選實施例中,所述針對CD8+T細胞HBsAg表位肽包括、但不限于如下氨基酸序列組A)-C)中的任意一組或幾組:
A)CD8+T細胞A2HBsAg表位肽
VLQAGFFLL;
FLLTRILTI;
FLGGTPVCL;
LLCLIFLLV;
LVLLDYQGML;
LLDYQGMLPV;
WLSLLVPFV;
GLSPTVWLSV;
SIVSPFIPLL;
ILSPFLPLL;
上述任意氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有CD8+T細胞HBsAg表位肽功能的氨基酸序列;
B)CD8+T細胞HBV混合表位肽
FLLTRILTI;
WLSLLVPFV;
GLSPTVWLSV;
LLVPFVQWFV;
FLPSDFFPSI;
FLPSDFFPSV;
CLTFGRETV;
EYLVSFGVW;
TPPATRPPNAPIL;
KYTSFPWL;
上述任意氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有CD8+T細胞HBsAg表位肽功能的氨基酸序列;
C)CD8+T細胞非A2HBsVg混合表位肽
IPIPSSWAF;
WMMWYWGPSLY;
ILLLCLIFLL;
RWMCLRRFII;
RFSWLSLLVPF;
LYNILSPFL;
PFLPLLPIF;
PFVQWFVGL;
上述任意氨基酸序列經過取代、缺失或添加一個或多個氨基酸而衍生得到的具有CD8+T細胞HBsAg表位肽功能的氨基酸序列。
本發明上述內容中,針對CD4+T細胞HBsAg表位肽和針對CD8+T細胞HBsAg表位肽可以單獨使用,也可以組合使用。
本發明上述內容中,各組針對CD8+T細胞HBsAg表位肽可以是單獨使用, 也可以是兩組或三組組合使用。
在一種優選實施例中,所述評價疫苗療效的細胞免疫學檢測試劑盒還可以包括待測細胞的富集激活信號和共刺激信號。
在一種優選實施例中,所述富集激活信號選擇為凝集素類分子、離子霉素(Iono)和/或抗-CD3抗體中的任意一種或幾種,并優選至少包括抗-CD3抗體。
其中,本發明所述凝集素類分子指的是凝集素以及具有凝集素功能的凝集素衍生物。
其中,所述凝集素可以是豆科植物凝集素、單子葉植物甘露糖結合凝集素(如黃精凝集素)。
所述黃精凝集素如:多花黃精凝集素(PMA)、新疆黃精凝集素(PRA)、囊絲黃精凝集素(PCA)中的一種或幾種。
所述都可植物凝集素如:如刀豆凝集素(如Con A)、豌豆凝集素、花生凝集素、蠶豆凝集素、二花扁豆凝集素、菜豆凝集素中的一種或幾種。
在一種優選實施例中,所述共刺激信號優選為至少包括抗-CD28抗體。
本發明所述待測細胞優選為病毒特異性T細胞。
所述病毒特異性T細胞更優選為分離自所述病毒感染者。
本發明上述內容中,所述T細胞的亞群可以是包括輔助性T細胞(Th1、Th2和Th17)、殺傷性T細胞(Tc1和Tc17)以及調節性T細胞(Treg和Tcreg)。
本發明上述內容中,所述T細胞的標志物分子包括CD3、CD4、CD8、IFN-γ、TNF-α、IL-2、MIP-1β、IL-17A、IL-13、IL-10、IL-22、PD-1、Foxp3、TGF-β、IFN-α、IL-1β、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-12p70、IL-15、IL-16、IL-21、IL-27、IL-29、IL-33、IP-10、MIP-1α、G-CSF和CXCL9等。
在一種優選實施例中,所述評價疫苗療效的細胞免疫學檢測試劑盒還可以包括蛋白轉運阻斷劑。
在一種優選實施例中,所述評價疫苗療效的細胞免疫學檢測試劑盒還可以包括移液設備、離心管、細胞培養容器中的任意一種或幾種。
所述細胞培養容器如多孔板,如96孔預包被細胞刺激板。
本發明上述內容中,所述MHC限制性病毒表位肽在進行細胞免疫學檢測中與待檢測細胞接觸時,優選為能夠實現濃度1-20μg/ml,更優選為5-15μg/ml, 更優選為8-10μg/ml。
本發明上述內容中,所述抗-CD3和抗-CD28在進行細胞免疫學檢測中與待檢測細胞接觸時,優選為分別能夠實現濃度0.05-0.2μg/ml,更優選為0.1-0.15μg/ml,如分別為0.1μg/ml和0.05μg/ml、0.05μg/ml和0.05μg/ml、0.2μg/ml和0.05μg/ml、0.1μg/ml和0.1μg/ml以及0.1μg/ml和0.2μg/ml。
本發明第二個方面是提供一種上述評價疫苗療效的細胞免疫學檢測試劑盒的儲存方法。
所述儲存方法中,MHC限制性病毒抗原肽儲存溫度≤5℃,更優選為≤4℃,更優選為≤3℃,更優選為≤0℃,并優選為0℃至4℃。
所述儲存方法中,細胞培養容器儲存溫度≤-10℃,更優選為≤-15℃,更優選為≤-20℃,更優選為≤-30℃,并優選為-30℃至-10℃。
所述儲存方法中,如果存在的話,其他試劑和/或儀器儲存溫度優選為≤5℃,更優選為≤4℃,更優選為≤3℃,更優選為≤0℃,并優選為0℃至4℃。
本發明上述內容中,所述氨基酸序列、及其經過取代、缺失或添加一個或多個氨基酸而衍生得到的氨基酸序列,可以是通過生物合成、化學合成中的任意一種或幾種來獲得,比如設計相關基因進行表達,通過固相合成獲得相應的氨基酸序列。在本發明沒有特定限定的情況下,本領域技術人員可采用已知的氨基酸表達或合成方法來實施。
本發明評價疫苗療效的細胞免疫學檢測試劑盒,能夠利用處于臨床試驗階段的治療性疫苗研究數據庫與標本,并應用流式細胞技術,對免疫細胞及其分泌的細胞因子進行全面檢測,從而建立細胞免疫學療效評價體系。并且所述評價疫苗療效的細胞免疫學檢測試劑盒穩定性好,儲存一年以上時穩定性仍能保持90%以上。
附圖說明
圖1為慢乙肝患者未使用本發明試劑盒檢測,直接用表位肽刺激后IFN-γ表達結果,其中,陽性富集刺激物為PMA+Iono,表位肽為CD8+T細胞S表位肽肽池,陰性對照為未刺激細胞;
圖2為慢乙肝患者細胞凍存后,經復蘇、富集3天,刺激后檢測IFN-γ表 達的結果,其中,陽性刺激物為PMA+Iono,實驗組刺激物為CD8+T細胞S表位肽肽池,陰性對照為未刺激細胞;
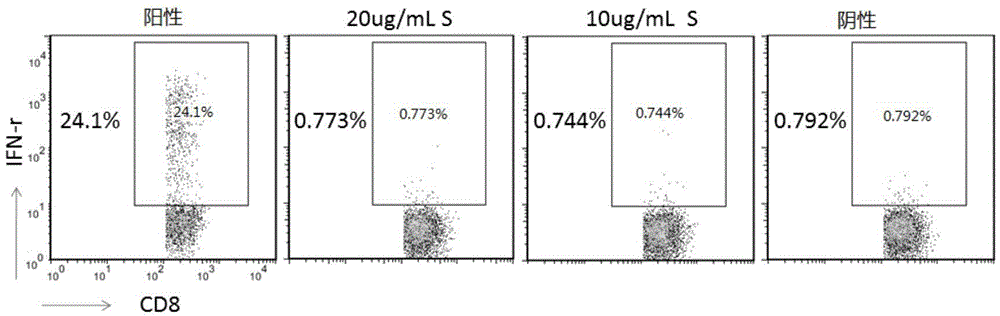
圖3為慢乙肝病人PBMC富集3天,刺激后凍存,復蘇后IFN-γ流式檢測的結果,其中,陽性刺激為PMA+Iono,實驗組所用刺激物為CD8+T細胞S抗原表位肽,陰性對照為富集3天后未刺激細胞;
圖4為實施例1中治療前后不同T細胞亞群比例的變化,其中,A為不同CD4+T細胞亞型比例隨免疫進程變化的餅圖;B為不同CD8+T細胞亞型比例隨免疫進程變化的餅圖;橫坐標為免疫次數(第0、2、4、6次免疫);YIC:乙克組;ALUM:鋁佐劑組;SALINE:生理鹽水組;
圖5為實施例1中治療前后不同亞群CD4+T細胞的細胞因子變化,其中,圖5A為三個治療組CD4+T細胞因子表達水平的平均數隨免疫進程變化趨勢圖;YIC:乙克組,綠色;ALUM:鋁佐劑組,藍色;SALINE:生理鹽水組,黑色;圖5B為乙克組(左)、鋁佐劑組(中)和生理鹽水組(右)中每個受試者CD4+T細胞IFN-γ的分泌水平隨免疫進程變化;橫坐標為免疫次數(第0、2、4、6次免疫);
圖6為實施例1中治療前后不同亞群CD8+T細胞的細胞因子變化,其中,圖6A為三個治療組CD8+T細胞因子表達水平的平均數隨免疫進程變化趨勢圖;YIC:乙克組,綠色;ALUM:鋁佐劑組,藍色;SALINE:生理鹽水組,黑色;圖6B為乙克組(左)、鋁佐劑組(中)和生理鹽水組(右)中每個受試者CD8+T細胞IL-2的分泌水平隨免疫進程變化,橫坐標為免疫次數(第0、2、4、6次免疫);
圖7為實施例2中乙克臨床樣本細胞免疫學檢測試劑盒保存1個月、3個月、6個月和12個月的穩定性,其中,圖7A為乙克臨床樣本細胞免疫學檢測試劑盒保存1個月、3個月、6個月和12個月后CD8+T細胞IFN-γ表達水平;Positive:陽性刺激孔(PMA+離子霉素iono);Negative:陰性刺激孔;圖7B為乙克臨床樣本細胞免疫學檢測試劑盒保存1個月、3個月、6個月和12個月后的穩定性百分比平均值,橫坐標均為保存時間;樣本數為3例乙克治療后慢性乙肝患者。
具體實施方式
下面結合附圖及實施例對本發明進行詳細描述,但本發明的實施不僅限于此。
下述實施例中的實驗方法,如無特別說明,均為常規方法。
下述實施例中所使用的材料、試劑等,如無特別說明,均可從已知的生物公司購買。
(1)治療性乙型肝炎疫苗(商品名:乙克)60μg/1ml/安瓿,北京生物制品研究所有限責任公司生產,批號:20120301,20100501。
(2)氫氧化鋁佐劑注射液:0.1%氫氧化鋁佐劑1ml每安瓿,外觀及一般檢定同治療用藥,由北京生物制品研究所有限責任公司提供。批號:20120302,20100801。
(3)生理鹽水注射液:1ml生理鹽水每安瓿,由北京生物制品研究所有限責任公司提供。批號:20110705。
(4)阿德福韋酯片:采用國內上市療效佳的產品,由申辦方統一提供。100mg/片,14片/盒。批號:110980,111195,120661,120871,1211105,130436,1312102。
實施例1,乙肝治療性疫苗乙克的臨床樣本細胞免疫學評價
一、材料與試劑
10ml EDTA抗凝采血管(BD,貨號:367525)、凍存管(Corning,430659)、15ml離心管(Corning,430791)、12孔細胞培養板(Costar,3513)、96孔U底細胞培養板(Costar,3799)、10ml移液管(Costar,4488)、無菌1.5ml LEP管、流式細胞管,及其他耗材。
(1)無菌磷酸緩沖液(phosphate buffer solution,PBS)購自Gibco公司,貨號為20012-027。(2)人淋巴細胞分離液(LymphoprepTM)購自Axis-Shield公司,貨號為11114547。(3)4%多聚甲醛(paraformaldehyde,PFA),購自國藥集團化學試劑有限公司):將8g PFA溶解于PBS,終體積200mL,加熱攪拌并加幾滴濃NaOH,待完全溶解后冷卻至室溫,加HCl調節溶液pH至7.4,室溫保存。(4)0.2%破膜劑(Triton X-100,購自Genview):將400μL TritonX-100加入到PBS中,終體積為200ml,放置在60℃水浴中直至完全溶解(約20min), 冷卻至室溫,4℃保存。(5)雙抗、胎牛血清(fetal bovine serum,FBS)和RPMI1640培養基:均購自gibco公司,貨號分別為10099-141和22400-089。(6)DMSO、PMA和離子霉素(Iono):均購自sigma公司。(7)蛋白轉運阻斷劑(BFA)購自BD公司。(8)抗-CD3抗體(anti-CD3)和抗-CD28抗體(anti-CD28),購自Miltenyi Biotec公司。(9)熒光標記抗體見下表。
病毒抗原肽見下表:
CD4+T細胞HBsAg表位肽
CD8+T細胞HBsAg表位肽
CD8+T細胞HBV混合表位肽池
CD8+T細胞非A2HBsAg表位肽
二、實驗方法
研究設計及研究對象:
研究采用隨機、多中心、聯和用藥的研究。研究對象為HBeAg陽性慢性病毒性乙型肝炎患者,計劃入組病例總數為60例,受試者按1:1:1的比例隨機分到下列三組:
研究對象分組治療情況
最終入組52例,其中鋁佐劑組、乙克組和生理鹽水組分別為18例、17例和17例,所有研究對象肌肉注射6針乙克、鋁佐劑或生理鹽水,每隔四周注射一次,連續注射6針。用藥結束時為24周,接著隨訪24周時間,總體研究時間為48周。出于倫理考慮,所有研究對象均結合抗病毒藥物阿德福韋酯治療。于0、4、12和20周采集抗凝血,分離外周血單個核細胞(PBMC)樣本
采血、外周血單個核細胞(PBMC)分離及體外T細胞的富集:
(1)用BD EDTA抗凝管采集10ml全血。取血后緩慢顛倒混勻5-10次,豎放靜置,室溫保存運輸,并于24小時內處理檢測。
(2)將采血管置于離心機中室溫離心(轉速為1600rpm)10min,取上層血漿,并按每管1ml分裝于凍存管內,放置于-70℃保存,待血清學檢測時用。
(3)取2支15ml離心管,分別加入5ml預熱后的淋巴細胞分離液。
(4)將步驟2中離心后的剩余血液與無菌PBS混勻,至終體積20ml,每10ml沿管壁加到5ml淋巴細胞分離液的液面上,避免血液沖到管底。
(5)將離心管置于水平轉子中,并將離心機的升降速調至最低(升降速0),在22-23℃離心(轉速為2000rpm)30min。
(6)吸取白膜層細胞(此為PBMC),吸取的液體分別置于2個新15ml離心管中,分別加入無菌PBS至15ml并重懸,在水平轉頭22-23℃離心(2000rpm)5min,棄上清。可重復此洗滌步驟一次。
(7)可重復洗滌步驟6一次。
(8)用3mL完全培養基R10(RPMI 1640培養基含10%FBS,100U/ml青霉素,100μg/ml鏈霉素)重懸細胞后,細胞計數。
(9)用含R10培養基調整細胞懸液濃度至5×106細胞/ml。
(10)取3ml步驟9中的細胞,加入anti-CD3(終濃度0.1μg/ml)和anti-CD28(終濃度0.05μg/ml),隨后按每孔1ml放入12孔細胞培養板中,在細胞培養箱中培養富集3天。
但是本領域技術人員在本發明公開內容的基礎上,可以確定其它的抗-CD3和抗-CD28抗體刺激濃度,例如0.05μg/mL和0.05μg/mL、0.2μg/mL和0.05μg/mL、0.1μg/mL和0.1μg/mL以及0.1μg/mL和0.2μg/mL等。
但是本領域技術人員在本發明公開內容的基礎上,可以確定其它的富集時間,例如一天、五天和七天等。
但是本領域技術人員在本發明公開內容的基礎上,可以確定可用的亞群包括輔助性T細胞(Th1、Th2和Th17)、殺傷性T細胞(Tc1和Tc17)以及調節性T細胞(Treg和Tcreg)。
抗原肽體外特異性刺激:
(1)3天后,將富集的細胞用R10培養基洗一次后重懸,加入anti-CD28 (終濃度0.1μg/ml)和BFA(1μl/ml),按100μl/孔加入96孔預包被細胞培養板。
(2)96孔預包被細胞培養板中設置陽性對照組、抗原肽刺激組和空白對照組。陽性對照組加入PMA(終濃度0.1μg/ml)和離子霉素(終濃度1μg/ml);抗原肽刺激組分別加入針對HBsAg的CD4/CD8肽池(每種肽的終濃度均為10μg/ml)。但是本領域技術人員在本發明公開內容的基礎上,可以確定其它的抗原肽刺激濃度,例如1μg/mL、5μg/mL和20μg/mL等。
(3)37℃,5%二氧化碳細胞培養箱培養8小時。但是本領域技術人員在本發明公開內容的基礎上,可以確定其它的刺激時間,例如4小時、6小時和12小時等。
細胞凍存:
(1)將細胞整個96孔板22-23℃離心(2000rpm)5min,棄上清。
(2)加入200μl/孔凍存液(10%DMSO+90%胎牛血清),重懸后,梯度降溫:4℃ 1小時,-20℃ 40分鐘,-80℃凍存。待統一批次流式檢測。
流式檢測:
(1)37℃快速解凍刺激后96孔細胞培養板中的細胞。1500rpm離心5min,棄上清,加入2%FBS的PBS(表面稀釋液)200μl洗一次,1500rpm離心5min,棄上清。
(2)將表面染色用抗體用表面稀釋液稀釋好,每孔50μl,吹吸混勻3-5次,冰上避光染色30min。
(3)加入150μl表面稀釋液,終止表面染色,1500rpm離心5min,棄上清。
(4)加入200μl 4%PFA室溫避光固定8min,2000rpm離心5min,,棄上清,快速加入200μl表面稀釋液吹吸重懸細胞,2000rpm離心5min,棄上清。
(5)以0.2%Triton X-100(含2%FBS)作為胞內抗體稀釋液預先配好破膜染色液,每孔50μl,吹吸混勻,避光冰上染色2小時。
(6)用表面稀釋液150μl/孔終止反應,2000rpm離心5min,棄上清。
(7)用表面稀釋液200μl/孔重懸細胞,轉移到流式管進行檢測。
(8)檢測指標:
——T細胞表面標志物:anti-CD4、anti-CD8,但是本領域技術人員在本發明公 開內容的基礎上,可以確定其它的T細胞表面標志物,如anti-CD3。
——功能相關細胞標志物:anti-IFN-γ、anti-TNF-α、anti-IL-2、anti-MIP-1β、anti-IL-17A、anti-IL-13、anti-IL-10、anti-IL-22、anti-PD-1、anti-Foxp3和anti-TGF-β,但是本領域技術人員在本發明公開內容的基礎上,可以確定其它的功能相關細胞標志物,如anti-IFN-α、anti-IL-1β、anti-IL-3、anti-IL-4、anti-IL-5、anti-IL-6、anti-IL-7、anti-IL-8、anti-IL-12p70、anti-IL-15、anti-IL-16、anti-IL-21、anti-IL-27、anti-IL-29、anti-IL-33、anti-IP-10、anti-MIP-1α、anti-G-CSF和anti-CXCL9等。
(9)細胞獲取使用LSR Fortessa多色流式細胞儀(BD Biosciences,USA),先用單熒光染色調補償。流式結果分析用FlowJo 7.6.1(TreeStar,US),結果呈現采用陽性細胞百分比。
統計分析:
兩組之間用t檢驗進行數據分析,兩組以上的數據用One-way ANOVA檢測,P<0.05的差異被認為具有統計學意義。*表示P<0.05。
三、實驗結果
1、由于慢乙肝病人的T細胞對HBV抗原具有耐受性,因此為了尋找合適的實驗條件,對慢乙肝病人的PBMC進行預處理,我們對刺激和凍存方案進行了摸索。我們以CD8+T的IFN-γ表達量為例,首先對未進行任何富集和凍存的慢乙肝病人的細胞分別用陽性刺激物PMA+Iono,10μg/mL S抗原表位肽和20μg/mL S抗原表位肽進行刺激,如圖1中結果所示,未進行任何預處理的病人PBMC對S抗原表位肽未有陽性反應。在摸索了合適的富集條件后,我們對先凍存還是先富集刺激進行了方法學上的摸索,發現,先凍存慢乙肝病人的PBMC,后進行富集和刺激,如圖2所示,慢乙肝病人CD8+T的IFN-γ表達量整體下降,而且未有明顯的陽性反應,而經過富集刺激后再進行細胞凍存,復蘇后直接流式檢測,如圖3所示,可以看到慢乙肝病人CD8+T的IFN-γ表達量經過S抗原表位肽刺激后相對于未刺激組有明顯上升,證明試劑盒說明書所提供的方法可以有效地檢測慢乙肝病人T細胞對S抗原的反應。
2、為了評價疫苗的效果,我們研究了乙克組、鋁佐劑組和生理鹽水組中不同T細胞亞型的比例隨著免疫進程變化的規律,我們按照細胞因子在免疫應答中 所發揮的不同免疫功能,將檢測到的T細胞因子分類。我們將檢測的CD4+T細胞因子歸類為Th1、Th2、Th17和Treg,Th1中的因子主要在抗病毒過程中起到活化作用,Th2中的因子主要在體液免疫中發揮作用,Th17中主要是炎癥因子,Treg中的因子主要發揮免疫抑制作用。而CD8+T細胞因子歸類為Tc1、Tc17和Tcreg,Tc1中的因子主要起殺傷作用,Tc17中主要是炎性細胞因子,Tcreg中主要是發揮免疫抑制作用的因子。
如圖4-A所示,對于CD4+T細胞,乙克治療組中Treg細胞比例從基線時的78%下降至治療終點時的35%,Th1細胞比例從7%增加至24%,Th2細胞比例從15%增加至41%;在鋁佐劑和生理鹽水治療組中并未觀察到類似的變化,Th1、Th2和Treg細胞比例隨著免疫進程基本未發生變化。如圖4-B所示,對于CD8+T細胞,乙克治療組中Tc1和Tc17細胞比例隨著免疫進程均有著一定的增加,Tcreg細胞比例從基線時的60%下降至治療終點時的39%;鋁佐劑治療組中Tc17細胞比例隨著免疫進程有著微弱的增加(從基線時的8%增加至治療終點時的14%),生理鹽水組中Tc17細胞比例隨著免疫進程呈現不規律的變化;鋁佐劑和生理鹽水治療組中Tc1細胞比例均有所下降,Tcreg細胞比例均有所增加。
3、我們進一步分析了乙克組、鋁佐劑組和生理鹽水組Th1細胞IL-2、IFN-γ、TNF-β這三種代表性細胞因子,Th2細胞代表性細胞因子IL-13,Th17細胞代表性細胞因子IL-17A,Treg細胞代表性細胞因子IL-10、TGF-β和轉錄調節因子Foxp3以及抑制性分子IL-22和PD-1在第0、2、4、6次免疫后的表達水平變化。根據三個治療組細胞因子在不同免疫次數表達水平的平均數,我們做了以上各種特征性標記物表達水平隨免疫進程變化的趨勢圖,如圖5-A所示。乙克治療組中CD4+T細胞表達IL-2、IFN-γ、TNF-α的水平隨著治療進程均有著上升趨勢,而鋁佐劑組和生理鹽水組中這三種細胞因子的表達水平呈現不規律的變化。乙克治療組中CD4+T細胞表達這五種抑制性因子的水平隨著治療進程均有著下降趨勢,而鋁佐劑組中這五種抑制性因子的表達水平首先上升隨后又下降,生理鹽水組呈現不規律的變化。
同時,根據乙克組、鋁佐劑組和生理鹽水組中每個受試者CD4+T細胞IFN-γ在不同免疫次數的表達水平,我們分析了三個治療組中每個受試者這種細胞因 子分泌水平隨免疫進程變化的趨勢,如圖5-B所示。
4、我們也研究了CD8+T細胞的細胞因子變化,并分析了乙克組、鋁佐劑組和生理鹽水組Tc1細胞代表性細胞因子IL-2、IFN-γ、TNF-α和趨化因子MIP-1β,Tc17細胞代表性細胞因子IL-17A,Tcreg細胞代表性細胞因子IL-10、TGF-β和轉錄調節因子Foxp3以及抑制性分子IL-22和PD-1在第0、2、4、6次免疫后的表達水平變化。根據三個治療組這些因子在不同免疫次數表達水平的平均數,我們做了以上各種特征性標記物表達水平隨免疫進程變化的趨勢圖,如圖6-A所示。乙克治療組中CD8+T細胞表達IL-2、IFN-γ、TNF-α的水平隨著治療進程均有著上升趨勢;而鋁佐劑組和生理鹽水組中這三種因子的表達水平呈現不規律的變化。乙克治療組中CD8+T細胞表達TGF-β、Foxp3、IL-22的水平隨著治療進程均有著下降趨勢,PD-1的表達水平有一定升高,IL-10的表達水平基本未發生變化;而鋁佐劑組中TGF-β、PD-1的表達水平隨著治療進程有明顯的升高,IL-10、Foxp3和IL-22的表達水平變化不明顯;生理鹽水組這五種抑制性因子的表達基本未發生變化。
同時,根據乙克組、鋁佐劑組和生理鹽水組中每個受試者CD8+T細胞IL-2在不同免疫次數的表達水平,我們分析了三個治療組中每個受試者這種因子分泌水平隨免疫進程變化的趨勢,如圖6-B所示。
實施例2:乙克臨床樣本細胞免疫學檢測試劑盒長期穩定性監測
材料與試劑參考實施例1,PBMC來源于乙克治療組慢性乙肝病人,檢測指標主要為CD8+T細胞IFN-γ的表達。
我們監測了乙克臨床樣本細胞免疫學檢測試劑盒保存1個月、3個月、6個月和12個月的穩定性。試劑盒中96孔預包被細胞刺激板于-20℃保存,其它試劑于4℃保存。
如圖7A所示,與0天相比,保存1個月、3個月、6個月和12個月的試劑盒經檢測,陽性刺激孔CD8+T細胞IFN-γ的表達水平基本未發生變化,陰性刺激孔作為對照。如圖7B,假定0天時試劑盒穩定性為100%,經換算,保存1個月、3個月、6個月和12個月的試劑盒的穩定性仍保持在90%以上。這些結果表明乙克臨床樣本細胞免疫學檢測試劑盒保存一年后仍有著較好地穩定性。
本發明上述內容中,CD8+T細胞S是指兩組或三組CD8+T細胞HBsAg表 位肽同時使用。
本發明雖然以乙肝疫苗為例進行了介紹,但是在本發明上述實施例的指導下,本發明試劑盒也同樣適用于其他含有針對CD4+T細胞的抗原表位肽和/或CD8+T細胞抗原表位肽的腫瘤細胞和/或病毒,以及針對所述腫瘤細胞和/或病毒的疫苗療效的評價。
以上具體實施例并不限制本發明范圍,對于本領域技術人員而言,在不脫離本發明的精神和范圍下,對本發明進行的等同修改和替代也在本發明范圍內。
- 還沒有人留言評論。精彩留言會獲得點贊!