用于鞏膜的醫學治療的裝置的制作方法
本發明總體涉及用于眼睛的鞏膜組織的局部限定和精確治療的物質施加和輻射系統(SAIS-Spot)。因此,本發明涉及在眼科外科手術過程中,用于對患者進行物質施加(和/或輻射)的醫療裝置。具體地,本發明涉及用于鞏膜的醫學治療的裝置。
背景技術:
前些年,在用于對具有角膜(眼睛前部中的外膜的半透明部分)的浸漬病的患者的治療的眼科學中,已使用膠原交聯(通過施加核黃素和UV-A光輻射)(Wollensak等人,American Journal of Ophthalmology 2003,135:620-627)。在眼睛前部中,物質和光的施加是明顯更容易的,因為該部分可直接達到而無需外科手術。
用于漸進性近視的治療的鞏膜的膠原交聯(鞏膜交聯)是新的,并且目前已僅在動物實驗中進行測試(Iseli等人,Journal of Refractive Surgery2008,24:752-755;Wollensak等人,Acta Ophthalmologica Scandinavica 2005,83:477-482)。
在此時間點,對于鞏膜的病理學變形的治療,不存在用于眼睛外部(尤其是鞏膜的后部區域和赤道區域)的全面治療的用于物質施加或輻射的系統。一方面,用于漸進性近視的治療的該治療方法(通過核黃素和藍光療法的鞏膜交聯)是全新的,并且另一方面,在眼科學中,不存在用于需要物質施加/輻射系統的其他疾病的治療方法。
在本發明人的實驗研究中,感光物質(核黃素)滴入特農氏(Tenon)空間中,并且利用設計為用于在牙科中使用的光施加系統(Bluephase 16i,Ivoclar Vivadent GmbH,Ellwangen-Jagst,德國)進行輻射。為了在我們的領域中使用,本發明人進行幾處修改(諸如,用于調節光能的量的某些附件)。利用該輔助系統進行全面且均勻的輻射(尤其對鞏膜的后部區域)是不可能的。必須將物質分開地且與輻射交替地施加,并且將遍布整個特農氏空間不均勻地散布。對于人類眼睛手術中的使用,該系統是完全不合適的,尤其因為它不能考慮到解剖(人類眼睛、肌肉和神經末梢、血管解剖等的大小和形狀)。
用于物質施加的已知儀器被設計為用于在直接位于鞏膜上的纖維結締組織(鞏膜外層,特農氏空間下(sub-Tenon’s space))上進行局部施加。已知專利描述鞏膜外層下/特農氏空間下的物質施加(WO 01/28473 A1,US 2010/0114039 A,WO 03/009784 A1),或者它們用于在結膜上進行局部施加(WO 2010/105130 A2)。這些施加針對視網膜的小規模的、相當選擇性的治療;即,眼睛最內部中的鞏膜下組織(另外參見圖1)。因此,物質必須首先穿透眼睛的外部組織(諸如,鞏膜和脈絡膜)以達到其目標位置,視網膜。已知系統僅使用向鞏膜的外部施加,以避免在視網膜的表面上直接向眼睛施加手術。這些方法仍承擔眼睛的術后炎癥以及外膜損傷的風險,并且另外不被設計為用于鞏膜組織的治療。因此,這些治療方法的治療目的是完全不同的一種。根據本發明的物質施加和輻射系統(SAIS-Spot)直接在特農氏空間(眼睛與眼窩之間的空間;參見圖1)中施加至鞏膜的待治療部位。當前要求保護的系統被準確定位在治療部位所處的位置;即,外部鞏膜組織。與已創建的手術方法相比,我們的方法不帶來術中和術后的并發癥的任何增加的風險。
目前已描述的施加器用于形成或釋放用于藥品的儲藏處(WO 01/28473 A1,US 2010/0114039 A),并且不被設計為在手術治療期間釋放藥品/藥劑并且隨后在手術之后被再次移除。
WO 03/009784 A1建議向特農氏空間下永久植入藥品儲藏處,因此它在手術結束時將不會被移除。如已經提及的,所有這些施加器利用視網膜作為主要目標組織。本申請針對鞏膜的治療。施加器都不能夠充分覆蓋鞏膜以用于治療。所有現有施加器必須被理解為局部小規模施加器,它們影響完全不同的目標組織并且具有用于不同疾病的不同治療方法。此外,所有施加器都不能真正調節物質施加/傳遞。此外,這些施加器都不能確保物質的不期望擴散,并且都不能確保相鄰組織將不會受到治療的影響。
WO 2012/058382 A2描述了用于向包括體液的部位處的目標組織傳遞活性劑的裝置。該裝置包括具有第一外表面的主體,該第一外表面包括具有形成在主體中以用于保留活性劑的局部的、不連續的凹入區域的第一截面。該主體包括以管的形式的表面流動特征,該表面流動特征形成在主體中且相對于外表面凹入。該表面流動特征與第一截面以及局部凹入區域相連接,并且被配置為引導或修改體液相對于主體的流動,使得在體液與局部凹入區域之間提供流體連通。局部凹入區域相對于管的至少一部分凹入。該裝置也可以是以具有可侵蝕構件的裝置的形式,該可侵蝕構件在規定時間段內釋放活性劑。
WO 2006/058189 A2提供具有用于溫度測量的熱敏電阻、用于流體交換和治療形式施加的沖洗/吸入端口、用于壓力測量的壓力計以及用于溫度、壓力及流速的控制的外部系統的醫療裝置。當施加至眼睛和眼眶時,該裝置可用在體溫過低或體溫過高的應用中、眼內壓(IOP)控制以及治療形式的應用中。描述了使用該裝置來治療患如下病的患者、眼睛在術前/術中/術后的治療以及通過半滲透膜來施加治療形式的方法:中心視網膜動脈阻塞、前部視神經疾病、脈絡膜以及包括黃斑的視網膜的病理、包括玻璃體片段以及前面片段的眼睛的炎癥、青光眼、眼睛的前面片段和/或后面片段的炎癥和/或感染。
在WO 2008/011125 A2中,描述了用于向眼組織傳遞藥物的裝置、系統以及技術。在至少一些實施方式中,末端組件(例如,手術針或導管的開口端)植入眼組織中,并且用于傳遞一種或多種藥物。傳遞的藥物可來自也被植入的源,或者可從外部源引入(例如,經由端口)。可使用固態和液體藥物制劑這兩種。可替換地,眼部植入物可包括向眼組織釋放藥物的薄膜涂層。
US 5725493 A公開了玻璃體內藥物傳遞裝置以及包括植入裝置的方法,通過該植入裝置,包括藥物或其他藥理學藥劑的各種有益藥品可僅利用單個初始手術在延長時間段內引入至玻璃體腔中以便植入裝置。該裝置和方法最小化植入所需的手術切口,并且避免未來或重復的侵入性手術或過程。額外量的初始藥品可容易引入,或根據需要藥品可改變或變化。此外,該裝置和方法允許控制傳遞至玻璃體腔的劑量,并且該裝置被構造為過濾傳遞至腔體的藥品,并且還在植入期間或使用期間避免對眼睛的其他部分的損害或干擾。
WO 02/074196 A1描述了用于以控制且持續的方式向眼睛傳遞治療藥劑的眼部植入器件。示出并描述了雙模式和單模式藥物傳遞設備。描述了適于結膜下放置的植入物。還描述了適于玻璃體內放置的植入物。本發明還包括與本文呈現的唯一眼部植入器件相關聯的制造和實現技術。
US 2012/0209051描述了用于向鞏膜傳遞核黃素(R/F)和UVA照射的傳遞系統和方法。R/F被傳遞并且隨后通過LED或光纖以及用于LED的分離冷卻物質通道利用UVA照射激活,由此引起膠原組織的交聯。傳遞系統包括提供與鞏膜相符合的表面的可植入結構。該傳遞系統包括用于向鞏膜表面上傳遞R/F的各種類型的結構。此外,該傳遞系統包括在鞏膜膠原組織中提供R/F的照射的UVA源。
目前的現有技術都未描述向相同施加系統引入分離系統(例如,藥劑/物質和電磁波,或不同分離藥劑的施加),這對于膠原交聯的方法可能是必要的。現有技術都未考慮到對精細調整的局部藥品釋放或輻射的同時給藥的控制。在這些施加器中,也未提供用于多余物質/藥劑的抽吸系統。
目前,不存在適于在鞏膜上使用的利用根據本發明的新的治療方法的施加系統。現有物質施加器被設計為用于在治療所針對的組織不是鞏膜而是基礎組織(主要地,眼睛內部中的視網膜)的情況下的物質的局部施加。目前要求保護的施加器可全面地且以控制的方式向鞏膜的所有部分施加物質、電磁波(諸如光或熱),這在目前是不可能的。
目前已用在動物實驗中的系統的缺點是有限空間中的輻射單元的尺寸,這導致對眼睛的嚴重或危險操縱。利用該輔助系統,也進行鞏膜的后部的全面且均勻的輻射是不可能的。此外,輻射系統僅以某一預定時間間隔輻射。不可能自由控制輻射能級。由于我們采用的輻射源中的光功率設置只是50%或100%,所以必須開發使能夠使用分等級光功率水平的輔助塑料附件。只可通過將物質滴在組織上來施加物質,這導致物質的不均勻分布。因此,物質也達到不應被處理的組織區域。此外,物質施加器及并行系統(例如,光)不能同時使用。不存在特別形成的抽吸系統。目前,還不能夠全面治療眼睛/鞏膜的中間部分和后部。
本發明分別解決來自動物實驗的輔助系統以及其他系統和治療方法的缺陷。這些缺陷是:
-考慮到所治療的眼睛的解剖,在解剖學上不適于鞏膜的全面/綜合治療;
-不同物質的局部或暫時并行施加是不可能的
-物質施加和電磁輻射(例如,光)和/或電力(單極和雙極凝固)的暫時和局部結合是不可能的;物質施加與光施加之間的必需交替導致手術/治療持續時間的相當大的增加
-蛋白質凝固或熱量施加是不可能的
-由于物質施加器和光施加器必須周期性交替連接和分離,所以治療變得不均勻,因為外科醫生總是必須重新布置一切;此外,連接和分離承擔損害周圍組織的增加的風險
-不存在用于多余物質的返回/抽吸系統,未被治療的組織總是受影響/被共同治療
-不能保護輻射敏感物質免受輻射,直至輻射到達施加部位/治療部位(不存在物質供給的屏蔽物)
-在視覺控制(視頻系統)下,不能引入已知施加系統
-已知系統不能向鞏膜提供高光量
-已知系統不能檢測施加器與鞏膜之間的接觸
目前,不存在適于在鞏膜上使用的施加系統或根據本發明的治療方法。由于鞏膜浸漬,所以用于漸進性近視或病理學變化的治療的治療方法是全新的。因此,不存在滿足該治療方法或該外科手術的需求的手術設備。用于物質施加或用于區域/組織的輻射的單獨技術方法總是被簡化以用于其特殊用途,并且不滿足我們的治療方法的需求。需要用于均勻物質施加和/或輻射的全面系統,該全面系統考慮到眼睛的精確解剖結構并且滿足治療或外科手術程序的所有技術需求。
在動物實驗中使用的物質施加和輻射單元的缺陷和缺點也將被新的施加系統(SAIS-Spot)消除。
技術實現要素:
在一個方面中,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有第一表面,其中,施加器的第一表面可表面地接觸鞏膜的區域的表面以便表面地覆蓋所述區域;并且
該施加器包括單個光學出口,該單個光學出口連接至從軸的近端向施加器的第一表面處的單個遠端光學出口延伸的單個光學引導元件,該光學引導元件被構造為朝向光學出口引導電磁波,其中,光學引導元件被構造為通過蛋白質凝固引導適于鞏膜的熱治療的波長的電磁波。
在裝置的一個實施方式中,光學出口的遠端表面被至少部分著色以適于生成熱量。
在裝置的一個實施方式中,施加器包括連接至單個光學引導元件的多個單獨光學出口。多個光學出口中的至少一個的遠端表面可被著色以適于生成熱量。
在裝置的一個實施方式中,光學出口相對于施加器的第一表面規則、不規則或不同分布,并且優選地,施加器的第一表面事實上被細分為具有光學出口的不同分布的不同區域。光學出口的密度可相對于施加器的第一表面而改變。
在裝置的一個實施方式中,施加器具有對稱形狀,并且光學出口根據施加器的對稱性而對稱布置。
在裝置的一個實施方式中,施加器包括從軸的近端向施加器的表面處的遠端通道開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。單個藥劑通道可從軸的近端向施加器的第一表面處的至少兩個遠端通道開口延伸。施加器可進一步包括用于吸走多余藥劑的通道。
在裝置的一個實施方式中,施加器包括多個藥劑通道。每個藥劑通道可從軸的近端向施加器的第一表面處的至少兩個遠端通道開口延伸。在一個實施方式中,一個或多個藥劑通道用于施加諸如核黃素的藥劑,然而一個或多個剩余通道用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構。表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
在裝置的一個實施方式中,施加器進一步包括連接至從軸的近端向施加器的第一表面處的單個遠端光學出口延伸的單個光學引導元件的單個光學出口,該光學引導元件被構造為朝向光學出口引導被配置為用于交聯(crosslink)鞏膜組織的電磁波。該施加器可包括連接至光學引導元件的多個單獨光學表面區域。
在裝置的一個實施方式中,施加器包括連接至第一光學引導元件的多個單獨第一光學表面區域以及連接至第二光學引導元件的多個單獨第二光學表面區域,該第一光學引導元件和第二光學引導元件從軸的近端向施加器的第一表面處的相應遠端光學表面區域延伸,第一光學引導元件被構造為朝向第一光學表面區域引導電磁波,并且第二引導元件與光敏劑相關聯。
在裝置的一個實施方式中,施加器進一步包括連接至從軸的近端向施加器的第一表面處的電極延伸的單個電導體元件的單個單極或雙極電極。
在裝置的一個實施方式中,施加器進一步包括連接至從軸的近端向施加器的第一表面處的電極延伸的多個電導體元件的多個單極或雙極電極。該電極可在斑點處提供電氣蛋白質凝固。
在一個方面中,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,施加器的第一表面可表面地接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至從相應軸的近端向施加器的第一表面處的單個遠端光學出口延伸的單個光學引導元件的單個光學出口,該光學引導元件被構造為朝向光學出口引導電磁波,其中,光學引導元件被構造為通過蛋白質凝固引導適于鞏膜的熱治療的波長的電磁波;并且
其中,施加器的軸近側連接至單個近端軸。
在裝置的一個實施方式中,光學出口的遠端表面被至少部分著色以適于生成熱量。
在裝置的一個實施方式中,每個施加器包括連接至單個光學引導元件的多個單獨光學出口。光學出口中的至少一個的遠端表面可被著色以適于生成熱量。光學出口可相對于施加器的第一表面規則、不規則或不同分布,并且優選地,施加器的第一表面事實上被細分為具有光學出口的不同分布的不同區域。光學出口的密度可相對于施加器的第一表面而改變。施加器可具有對稱形狀,并且光學出口根據施加器的對稱性而對稱布置。
在裝置的一個實施方式中,每個施加器包括從軸的近端向施加器的表面處的遠端通道開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。單個藥劑通道可從軸的近端向施加器的第一表面處的至少兩個遠端通道開口延伸。每個施加器可進一步包括用于吸走多余藥劑的通道。每個施加器可包括多個藥劑通道。每個藥劑通道可從軸的近端向施加器的第一表面處的至少兩個遠端通道開口延伸。
在裝置的一個實施方式中,一個或多個藥劑通道用于施加諸如核黃素的藥劑,然而一個或多個剩余通道用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,每個施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構。表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
每個施加器可進一步包括連接至從軸的近端向施加器的第一表面處的單個遠端光學出口延伸的單個光學引導元件的單個光學出口,該光學引導元件被構造為朝向光學出口引導被配置為用于交聯鞏膜組織的電磁波。每個施加器可包括連接至光學引導元件的多個單獨光學表面區域。
在裝置的一個實施方式中,每個施加器包括連接至第一光學引導元件的多個單獨第一光學表面區域以及連接至第二光學引導元件的多個單獨第二光學表面區域,該第一光學引導元件和第二光學引導元件從軸的近端向施加器的第一表面處的相應遠端光學表面區域延伸,第一光學引導元件被構造為朝向第一光學表面區域引導電磁波,并且第二引導元件與光敏劑相關聯。
在裝置的一個實施方式中,每個施加器進一步包括連接至從軸的近端向施加器的第一表面處的電極延伸的單個電導體元件的單個單極或雙極電極。
在裝置的一個實施方式中,每個施加器進一步包括連接至從軸的近端向施加器的第一表面處的電極延伸的多個電導體元件的多個單極或雙極電極。
在裝置的一個實施方式中,電極在斑點處提供電氣蛋白質凝固。
在裝置的一個實施方式中,該裝置進一步包括屏蔽元件,該屏蔽元件的大小和形狀被形成為在裝置使用過程中至少部分覆蓋角膜。
在裝置的一個實施方式中,該裝置包括形成在施加器的邊緣中的一個或多個凹部。一個或多個凹部可定位和形成為使得當施加器位于鞏膜的所述區域上時,凹部留出用于眼部肌肉、血管和/或神經的自由空間。
在裝置的一個實施方式中,施加器包括由優選地是可消毒和耐熱中的至少一種的材料制成,例如,醫用鋼或塑料的材料制成的基礎層,并且優選地,該材料不透光。
在裝置的一個實施方式中,施加器包括一個或多個附加層,其中,基礎層和一個或多個附加層布置為層疊層,且基礎層在施加器的外側上以支撐附加層,并且其中,優選地,一個或多個附加層中的每一個由塑料或金屬材料制成,更優選地,光擴散、遮光和/或海綿狀材料。附加層中的至少一個可以是適于擴散電磁波的擴散器,并且其中,遠端開口的至少一部分布置在作為擴散器的附加層(多個附加層)內或附加層的外側處。
在一個方面中,本發明提供治療受試者的鞏膜的方法,該方法包括如下步驟:
(i)將前述實施方式中任一項的裝置的施加器放入受試者眼睛中的特農氏空間中,使得施加器的第一表面與鞏膜的區域的表面表面地接觸,
(ii)通過蛋白質凝固向受試者的鞏膜施加適于鞏膜的熱治療的波長的電磁輻射。
該方法可包括向鞏膜施加用于交聯的核黃素的步驟。
該方法可包括在斑點處施加電氣蛋白質凝固。
本發明的一方面涉及用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有表面,其中,施加器的表面可表面地接觸鞏膜的區域的表面以便表面地覆蓋所述區域;并且
該施加器和軸包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
在裝置的一個實施方式中,藥劑通道的單個開口提供用于鞏膜的治療的局部斑點。
在裝置的一個實施方式中,藥劑通道針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
施加器可進一步包括可用于吸走多余藥劑的通道。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
施加器具有表面,其中,施加器的表面可表面地接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
該施加器包括連接至從軸的近端向施加器的表面處的單個遠端光學表面區域延伸的兩個引導元件的單個光學表面區域,一個光學引導元件被構造為用于朝向光學表面元件引導電磁波,并且另一個引導元件與光敏劑相關聯。
單個遠端光學表面區域可被至少部分著色以適于生成熱量。由于只有部分或半透明著色,所以不被著色吸收而是穿過著色的光可用于交聯。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的單個單極電極,或者連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的雙極電極。這可在斑點處提供電氣蛋白質凝固。
施加器可進一步包括可用于吸走多余藥劑的通道。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
施加器具有第一表面,其中,施加器的第一表面可表面地接觸鞏膜的區域的表面以便表面地覆蓋所述區域;并且
該施加器包括連接至從軸的近端向施加器的第一表面處的單個遠端光學出口延伸的單個光學引導元件的單個光學出口,該光學引導元件被構造為朝向光學出口引導電磁波。
優選地,光學引導元件被構造為引導適于鞏膜的熱治療的波長的電磁波。
光學出口的遠端表面可被至少部分著色以適于生成熱量,即,以通過顏色吸收的波長生成熱量的方式,并且利用投射光(transmitting light),交聯是可能的。
該實施方式的施加器可包括從軸的近端向施加器的表面處的遠端通道開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
施加器可進一步包括可用于吸走多余藥劑的通道。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有表面,其中,施加器的表面可表面地接觸鞏膜的區域的表面以便表面地覆蓋所述區域;并且
施加器包括連接至從軸的近端向施加器的第一表面處的單個遠端電極延伸的電導體元件的單個單極電極,或者連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的雙極電極。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個平坦施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有表面,其中,該施加器的表面可表面地接觸鞏膜的區域的表面以便表面地覆蓋所述區域;并且
施加器包括從軸的近端向施加器的第一表面處的至少兩個遠端通道開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
藥劑通道可針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
施加器可進一步包括可用于吸走多余藥劑的通道。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有第一表面,其中,該施加器的第一表面可表面地接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
施加器包括連接至第一光學引導元件的第一光學表面區域以及連接至第二光學引導元件的第二光學表面區域,該第一光學引導元件和第二光學引導元件從軸的近端向施加器的第一表面處的相應遠端光學表面區域延伸,第一光學引導元件被構造為朝向光學表面區域引導電磁波,并且第二引導元件與光敏劑相關聯。
第一光學表面區域可被至少部分著色以適于生成熱量。由于只有部分著色,所以未被著色吸收而是穿過著色的光可用于交聯。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的單個單極電極,或者連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的雙極電極。這可通過交聯在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面地接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
施加器包括連接至第一光學引導元件的多個單獨第一光學表面區域以及連接至第二光學引導元件的多個單獨第二光學表面區域,該第一光學引導元件和第二光學引導元件從軸的近端向施加器的第一表面處的相應遠端光學表面區域延伸,第一光學引導元件被構造為朝向第一光學表面區域引導電磁波,并且第二引導元件與光敏劑相關聯。
第一光學表面區域中的至少一個的遠端表面可被至少部分著色以適于生成熱量。由于只有部分或半透明著色,所以未被著色吸收而是穿過著色的光可用于交聯。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的電極(多個電極)延伸的單個(或多個)電導體元件的單個或多個單極電極或雙極電極(多個電極)。這可在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的第一表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
該施加器包括連接至從軸的近端向施加器的第一表面處的遠端光學出口延伸的單個光學引導元件的多個單獨光學出口,該光學引導元件被構造為朝向光學出口引導電磁波,其中,光學引導元件被構造為引導適于鞏膜的熱治療的波長的電磁波。
光學出口可相對于施加器的第一表面規則、不規則或不同分布,并且施加器的第一表面可事實上被細分為具有光學出口的不同分布的不同區域。
光學出口的密度可相對于施加器的第一表面而改變。
施加器可具有對稱形狀,并且光學出口根據施加器的對稱性而對稱布置。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的電極(多個電極)延伸的單個(或多個)電導體元件的單個或多個單極電極或雙極電極(多個電極)。這可在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的第一表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面地接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
該施加器包括連接至從軸的近端向施加器的第一表面處的遠端光學出口延伸的單個光學引導元件的多個單獨光學出口,該光學引導元件被構造為朝向光學出口引導電磁波,其中,光學出口中的至少一個的遠端表面被著色以適于生成熱量。
光學出口可相對于施加器的第一表面規則、不規則或不同分布,并且施加器的第一表面可事實上被細分為具有光學出口的不同分布的不同區域。
光學出口的密度可相對于施加器的第一表面而改變。
施加器可具有對稱形狀,并且優選地,光學出口根據施加器的對稱性而對稱布置。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的電極(多個電極)延伸的單個(或多個)電導體元件的單個或多個單極電極或雙極電極(多個電極)。這可在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的第一表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的單個施加器,其中:
該施加器被構造為放入特農氏空間中;
該施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
施加器包括連接至從軸的近端向施加器的第一表面處的至少兩個遠端電極延伸的單個電導體元件的至少兩個電極。
電極可在斑點處提供電氣蛋白質凝固。電極可以是單極電極或雙極電極。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,每個施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器和軸包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部;并且
其中,施加器的軸近側連接至單個近端提供軸。
在裝置的一個實施方式中,藥劑通道的單個開口提供用于鞏膜的治療的局部斑點(spot)。
在裝置的一個實施方式中,藥劑通道針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
施加器可進一步包括可用于吸走多余藥劑的通道。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,每個施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
每個施加器包括連接至從相應軸的近端向施加器的第一表面處的單個遠端光學表面區域延伸的兩個引導元件的單個光學表面區域,一個光學引導元件被構造為朝著光學表面元件引導電磁波,并且另一個引導元件與光敏劑相關聯;并且
其中,施加器的軸近側連接至單個近端軸。
單個遠端光學表面區域可被至少部分著色以適于生成熱量。由于只有部分著色,所以不被著色吸收而是穿過著色的光可用于交聯。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的單個遠端電極延伸的單個電導體元件的單個單極電極,或者連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的雙極電極。這可在斑點處提供電氣蛋白質凝固。
施加器可進一步包括可用于吸走多余藥劑的通道。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;以及
每個施加器包括連接至從相應軸的近端向施加器的第一表面處的單個遠端光學出口延伸的單個光學引導元件的單個光學出口,該光學引導元件被構造為朝向光學出口引導電磁波;并且
其中,施加器的軸近側連接至單個近端軸。
光學引導元件可被構造為引導適于鞏膜的熱治療的波長的電磁波。
光學出口的遠端表面可被至少部分著色以適于生成熱量,即,以通過顏色吸收的波長生成熱量的方式,并且利用投射光,交聯是可能的。
該實施方式的施加器可包括從軸的近端向施加器的表面處的遠端通道開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
施加器可進一步包括可用于吸走多余藥劑的通道。
在裝置的一個實施方式中,施加器的表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至從軸的近端向施加器的第一表面處的單個遠端電極延伸的電導體元件的單個單極電極,或者連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的雙極電極;并且
其中,施加器的軸近側連接至單個近端軸。
電極可在斑點處提供電氣蛋白質凝固。電極可以是單極電極或雙極電極。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括從相應軸的近端向施加器的第一表面處的至少兩個遠端通道開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部;并且
其中,施加器的軸近側連接至單個近端藥劑提供軸。
藥劑通道可針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
施加器的第一表面可具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
遠端通道出口可相對于施加器的第一表面規則、不規則或不同分布,其中,施加器的第一表面可事實上被細分為具有開口的不同分布的不同區域。
遠端通道出口的密度可相對于施加器的第一表面可變。
施加器可具有對稱形狀,并且優選地,遠端通道開口根據施加器的對稱性而對稱布置。
藥劑通道可針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
施加器的第一表面可具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
施加器可進一步包括可用于吸走多余藥劑的通道。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至第一光學引導元件的第一光學表面區域以及連接至第二引導元件的第二光學表面區域,第一引導元件和第二引導元件從相應軸的近端向施加器的第一表面處的相應遠端光學表面區域延伸,第一光學引導元件被構造為朝著光學表面區域引導電磁波,并且第二引導元件與光敏劑相關聯;并且
其中,施加器的軸近側連接至單個近端軸。
第一遠端光學表面區域可被至少部分著色以適于生成熱量。由于只有部分著色,所以不被著色吸收而是穿過著色的光可用于交聯。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的單個遠端電極延伸的單個電導體的單個單極電極,或者連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件的雙極電極。這可通過交聯在斑點處提供電氣蛋白質凝固。
施加器也可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至第一光學引導元件的多個單獨第一光學表面區域以及連接至第二引導元件的多個單獨第二光學表面區域,第一光學引導元件和第二光學引導元件從相應軸的近端向施加器的第一表面處的相應遠端光學表面區域延伸,第一光學引導元件被構造為朝著第一光學表面區域引導電磁波,并且第二引導元件與光敏劑相關聯;并且
其中,施加器的軸近側連接至單個近端軸。
第一光學表面區域中的至少一個的遠端表面可被至少部分地著色以適于生成熱量。由于只有部分或半透明著色,所以不被著色吸收而是穿過著色的光可用于交聯。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的電極(多個電極)延伸的單個(或多個)電導體元件的單個或多個單極電極或雙極電極(多個電極)。這可在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的第一表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面,其中,每個施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至從相應軸的近端向施加器的第一表面處的遠端光學出口延伸的單個光學引導元件的多個單獨光學出口,光學引導元件被構造為朝著光學出口引導電磁波,其中,光學引導元件被構造為引導適于鞏膜的熱治療的波長的電磁波;并且
其中,施加器的軸近側連接至單個近端軸。
光學出口可相對于施加器的第一表面規則、不規則或不同分布,并且施加器的第一表面事實上可被細分為具有光學出口的不同分布的不同區域。
光學出口的密度可相對于施加器的第一表面而改變。
施加器可具有對稱形狀,并且優選地,光學出口根據施加器的對稱性而對稱布置。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的電極(多個電極)延伸的單個(或多個)電導體元件的單個或多個單極電極或雙極電極(多個電極)。這可通過交聯在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的第一表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至從相應軸的近端向施加器的第一表面處的遠端光學出口延伸的單個光學引導元件的多個單獨光學出口,光學引導元件被構造為朝著光學出口引導電磁波,其中,光學出口中的至少一個的遠端表面被著色以適于生成熱量;并且
其中,施加器的軸近側連接至單個近端軸。
光學出口可相對于施加器的第一表面規則、不規則或不同分布,并且施加器的第一表面事實上可被細分為具有光學出口的不同分布的不同區域。
光學出口的密度可相對于施加器的第一表面而改變。
施加器可具有對稱形狀,并且優選地,光學出口根據施加器的對稱性而對稱布置。
施加器可進一步包括連接至從軸的近端向施加器的第一表面處的電極(多個電極)延伸的單個(或多個)電導體元件的單個或多個單極電極或雙極電極(多個電極)。這可在斑點處提供電氣蛋白質凝固。
施加器還可包括從軸的近端向施加器的第一表面處的單個遠端開口延伸的單個藥劑通道,該藥劑通道的近端可連接至藥劑提供部。
此外,可提供多個藥劑通道。在該優選實施方式中,一個或多個藥劑通道可用于施加諸如核黃素的藥劑,然而一個或多個剩余通道可用于吸走多余藥劑。
在裝置的一個實施方式中,藥劑通道(多個藥劑通道)針對電磁輻射至少部分隔離,優選地,針對具有100nm與2000nm之間的范圍中的波長的電磁輻射隔離,并且最優選地,針對具有300nm與800nm之間的范圍中的波長的電磁輻射隔離。
在裝置的一個實施方式中,施加器的第一表面具有適配為當通過藥劑通道引導藥劑時,允許改進的藥劑分布的結構,并且其中,表面結構可包括斜面或諸如桿、半球體、角錐體或圓錐體的元件。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括各自連接至相應軸的兩個、三個、四個或更多個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;
每個施加器包括連接至從相應軸的近端向施加器的第一表面處的至少兩個遠端電極延伸的單個電導體元件的至少兩個電極;并且
其中,施加器的軸近側連接至單個近端軸。
電極可在斑點處提供電氣蛋白質凝固。電極可以是單極電極或雙極電極。
根據任意實施方式的本發明的裝置可進一步包括屏蔽元件,該屏蔽元件的大小和形狀形成為在裝置使用過程中至少部分覆蓋角膜。
根據任意實施方式的施加器可具有2mm與30mm之間的長度,優選地,5mm與25mm之間的長度,或更優選地,15mm的長度。
根據任意實施方式的施加器可具有2mm與25mm之間的寬度,優選地,5mm與20mm之間的寬度,或更優選地,10mm與15mm之間的寬度。
根據任意實施方式的施加器的厚度可小于或等于5mm,或優選地,小于或等于3mm,并且優選地具有最小2mm的厚度。
根據任意實施方式,一個或多個凹部形成在施加器的邊緣中。一個或多個凹部可定位和形成為使得當施加器位于鞏膜的所述區域上時,凹部留出用于眼部肌肉、血管和/或神經的自由空間。
根據任意實施方式的施加器可包括優選地由消毒和耐熱的材料(例如,醫用鋼或塑料)中的至少一種制成的基礎層,并且優選地,該材料不透光。
在一個實施方式中,施加器的外表面中的至少一個以及施加器的邊緣不透光。
在一個實施方式中,施加器包括一個或多個附加層,其中,基礎層和一個或多個附加層布置為層疊層,且基礎層在施加器的外側上以支撐附加層,并且其中,優選地,一個或多個附加層中的每一個由塑料或金屬材料制成,更優選地,由光擴散、遮光和/或海綿狀材料制成。
在一個實施方式中,附加層中的至少一個可以是適于擴散電磁波的擴散器,并且其中,遠端開口的至少一部分布置在作為擴散器的附加層(多個附加層)內或附加層的外側處。
在一個實施方式中,把手布置在施加器的邊緣處。把手可連接至單個近端軸且布置為管,并且通道系統中的每一個的第一通道通過把手延伸。
在一個實施方式中,把手與施加器的邊緣可連接,并且其中,優選地,把手布置為管,并且藥劑通道可通過把手引導。
根據另一方面,本發明提供用于鞏膜的醫學治療的裝置,該裝置包括連接至軸的至少一個施加器,其中:
每個施加器被構造為放入特農氏空間中;
每個施加器具有第一表面和相對的第二表面,其中,施加器的第一表面可表面接觸鞏膜的區域的表面以便表面覆蓋所述區域;并且
每個施加器和軸包括:
藥劑通道,該藥劑通道從軸的近端向施加器的第一表面處的單個遠端開口延伸,該藥劑通道的近端可連接至藥劑提供部;
光學表面區域,該光學表面區域連接至從軸的近端向施加器的第一表面處的遠端光學表面區域延伸的光學引導元件,該光學引導元件被構造為朝向光學表面元件引導電磁波,以及
雙極電極,該雙極電極連接至從軸的近端向施加器的第一表面處的遠端電極延伸的電導體元件。
在所有實施方式中,裝置可進一步包括一個或多個傳感器(多個傳感器)或測量系統(多個測量系統),諸如溫度傳感器(具體地,對于使用光和電氣凝固的實施方式)和/或照相機系統(例如,對于施加器(多個施加器)的內窺鏡、微創移動)和/或生物力學傳感器(例如,用于檢測施加器是否接觸鞏膜),優選地,壓力傳感器和/或pH計。
在所有描述的實施方式中,裝置可包括施加器的圓周處的突起或輪緣。
根據另一方面,本發明提供治療受試者的鞏膜的方法,該方法包括如下步驟:
(i)將實施方式中的任一個的裝置的施加器放入受試者眼睛中的特農氏空間中,使得施加器的第一表面與鞏膜的區域的表面表面地接觸,
(ii)向受試者的鞏膜施加藥劑。
根據另一方面,本發明提供治療受試者的鞏膜的方法,該方法包括如下步驟:
(i)將實施方式中的任一個的裝置的施加器放入受試者眼睛中的特農氏空間中,使得施加器的第一表面與鞏膜的區域的表面表面地接觸,
(ii)向受試者的鞏膜施加電磁輻射。
在一個實施方式中,該方法用于治療眼鏡的病理學變化或疾病。
根據本發明的裝置:
-可適配至眼睛的解剖(anatomy)和大小
-使能夠進行鞏膜組織(以及后部鞏膜)的全面治療
-使能夠進行不同系統的暫時和局部控制使用(例如,物質施加及抽吸、輻射、視覺控制)
-由于系統的內部和外部上的表面修改,物質的均勻、全面分布是可能的(使用套管時,是不可能的)
-能夠結合不同治療(例如,互連、凝固和交聯)。
物質施加和輻射系統使能夠進行用于鞏膜膠原交聯和/或膠原凝固的外部鞏膜(眼睛的白色組織)的全面和/或局部限定治療。通過向鞏膜施加特殊化學物質和/或不同波長的光,能夠交聯膠原分子并且因此改變組織的生物力學特性。因此,可治療眼睛的某些病理學變化和疾病(例如,漸進性近視、鞏膜炎、組織浸漬炎癥、青光眼、屈光不正、老花眼)。這些病理學變化最小化鞏膜的生物力學穩定性,并且導致眼球的異常膨脹,并且由此導致嚴重的視覺缺陷或失明。另一方面,看起來可行的是,單獨照射或另一單獨治療可能影響鞏膜組織的生物力學特性以治療不同眼部疾病;例如,互補以增加用于漸進性近視防止的鞏膜硬度,可行的是,通過單獨藍光施加來降低鞏膜組織硬度以治療和/或避免青光眼發展。
此外,根據本發明的物質施加和輻射系統(SAIS-Spot)使能夠進行用于漸進性近視、鞏膜的病理學變化或可由不同原因(例如,炎癥、局部感染、鞏膜炎)造成的其他生物力學浸漬癥狀的治療的鞏膜交聯的外部鞏膜(眼睛的白色組織)的全面治療。由于眼睛的復雜解剖,對眼睛的這些特殊疾病的治療方法是新的,并且需要利用適配形狀和某些技術特征的手術施加系統。
另一方面,看起來可行的是,單獨照射或另一單獨治療可影響鞏膜組織的生物力學特性以治療不同眼部疾病;例如,互補以提高用于漸進性近視防止的鞏膜硬度,可行的是,通過單獨藍光施加來降低鞏膜組織硬度以治療和/或避免青光眼發展。
附圖說明
現將相對于以下附圖詳細描述本發明:
圖1示出眼睛的解剖及其附件的詳細表示;
圖2A-圖2D示出根據本發明的第一優選實施方式的裝置;
圖3A-圖3F示出根據本發明的第二優選實施方式的裝置;
圖4A-圖4E示出根據本發明的第三優選實施方式的裝置;
圖5A-圖5D示出根據本發明的第四優選實施方式是裝置;
圖6A-圖6E示出根據本發明的第五優選實施方式的裝置;
圖7A示出根據本發明的第六優選實施方式的裝置;
圖7B示出根據本發明的第七優選實施方式的裝置;
圖7C示出根據本發明的第八優選實施方式的裝置;
圖8A-圖8D示出根據本發明的第九優選實施方式的裝置;
圖9A-圖9C示出根據本發明的裝置的進一步實例;
圖10示出根據本發明的裝置的另一實例;
圖11示出來自各種物種的鞏膜瓣中的核黃素的完全組織滲透的平均時長。
圖12a-圖12f表明來自各種物種的有(虛線)和沒有(實線)核黃素施加的鞏膜組織的頻譜光透射特征。
圖13示出來自各種物種的有和沒有核黃素施加的以450nm的波長的新隔離鞏膜組織的光透射特征。
圖14A-圖14B示出組織學半薄截面(0.5μm厚度、甲苯胺藍染色)的光學顯微鏡圖像以比較來自各種物種的鞏膜組織的尺寸和結構。
圖15示出具有(C;左下;以及D;右下)且沒有(A和B)交聯治療的急性隔離(A;左上)與凍結/解凍(B-D)鞏膜組織的形態學特性的比較的顯微照片。
圖16示出具有(C和D)且沒有(A和B)交聯治療的鞏膜組織的急性隔離(A)與凍結/解凍(B-D)的電子微觀顯微照片。
圖17A-圖17G示出利用根據本發明的裝置可獲得的各種治療圖案。
具體實施方式
蛋白質(例如,膠原)交聯是在生物技術中創建的方法。蛋白質的交聯可由化學交聯劑/藥劑執行或利用后續輻射通過感光物質(例如,核黃素施加以及UV-A光或藍光輻射)執行。進一步機制是例如,由于熱量的施加的蛋白質凝固。
因此,推測膠原交聯會引起改變生物力學特性(固化)的分子的連接。在若干年內,在用于對具有角膜(眼睛前部中的外膜的半透明部分)的浸漬病的患者的治療的眼科學中,已使用通過施加核黃素和UV-A光輻射的膠原交聯(Wollensak等人,American Journal of Ophthalmology 2003,135:620-627)。在眼睛前部中,物質和光的施加是更容易的,因為該部分可直接達到而無需外科手術。然而,那時,不均勻輻射和物質分布的問題未被完全消除。
用于漸進性近視以及其他浸漬病的治療的鞏膜的膠原交聯(鞏膜交聯)是新的,并且目前已僅在動物實驗中進行測試(Iseli等人,Journal of Refractive Surgery 2008,24:752-755;Wollensak等人,Acta Ophthalmologica Scandinavica 2005,83:477-482)。動物實驗中的所有技術手段具有各種缺陷并且不適于患者使用。
此外,蛋白質和膠原可通過僅施加交聯化學物質來交聯而無需后續輻射(參見Wong SS、Wong LJ的“化學交聯以及蛋白質和酶的穩定化(Chemical crosslinking and the stabilization of proteins and enzymes)”,Enzyme Microb Technol,1992年11月;14(11):866-74)。
利用根據本發明的裝置,能夠第一時間從外部向局部限定且精確的鞏膜的后部和赤道部分全面提供藥劑。同時,可使用其他系統。多余藥劑被移除。表面的附加修飾分別允許藥劑的更好分布以及不被治療區域中的藥劑的更好移除。根據本發明的裝置是用于在患者和動物實驗中的新的治療方法的時間節省(短手術時間)施加的前提。根據本發明的裝置符合人體工程學地被適配為人類眼睛的解剖。其材料是可滅菌且可再用的,或者可生產作為一次性裝置。
本發明考慮到藥劑(例如,物質、藥品)的局部和暫時控制的釋放和回流,并且允許與鞏膜的限定區域上的其他物理施加(電磁輻射)相結合。它還允許交聯與膠原凝固的結合。此外,本發明考慮到局部和暫時控制電磁輻射的限定功率電平的輻射和施加(即,每一時間和區域的能量)。
眼睛的外部、周圍膠原層是鞏膜(白色部分)和角膜(半透明部分;圖1)。在某些疾病中,眼睛的該組織部分變弱。這可以是相對于生物力學穩定性、對消化的酶抗性或關于其膨脹行為的情況。眼睛(角膜和鞏膜)的該弱化可通過交聯或膠原凝固而積極影響。為此,在有或沒有附加添加劑(例如,電磁輻射,第二藥劑)的情況下,藥劑(流體)必須被引入至眼睛的相應組織層中以開始化學反應或物理反應。這些反應導致生物力學特性改變以及眼睛的治療層相對于上述缺點的改進。這種治療被稱為“交聯”。
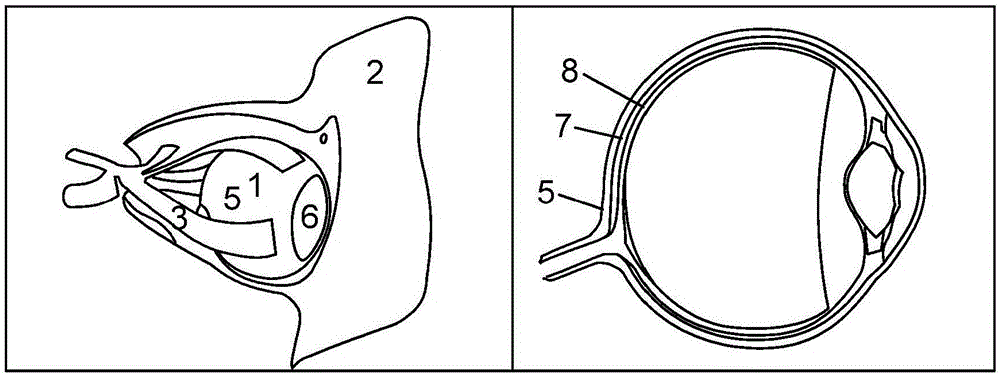
圖1示出眼睛的解剖及其附件的詳細表示。左邊圖像示出眼窩(骨頭2)中的眼睛1及其肌肉連接3。眼睛1位于圍鞏膜淋巴液空間(即,特農氏空間)的眼窩中,該空間在角膜緣4與眼瞼(此處未示出)之間通常閉合至前部。鞏膜5是外眼的白色部分,角膜6是眼睛1的半透明部分。兩種組織都由膠原組織形成。右邊圖像示出眼睛1的內部組織的解剖學層的詳細標記。在右邊圖像中,突出了鞏膜5/脈絡膜7/視網膜8的組織結構。
在鞏膜部分中,眼球由連接至鞏膜5的非常薄的黏膜下層——鞏膜外層(未分開示出)圍繞。
根據本發明的裝置使能夠進行用于鞏膜膠原交聯或膠原凝固的外部鞏膜的全面治療。優選地,根據一個實施方式的裝置(SAIS-Spot)是平坦的、大型的且勺狀的彎曲眼科手術儀器,且具有用于向鞏膜或其部分按劑量釋放物質/藥劑的可變圖形形狀。
SAIS-Spot的精確圖形形狀和尺寸起因于眼睛的準確解剖學特征或者甚至單獨患者或單獨患者的臨床和治療需要。此外,SAIS-Spot的精確圖形形狀和尺寸起因于所確定的需要被治療以用于生長抑制的最小區域。因此,SAIS-Spot可具有可變形狀,優選地,簡單或復雜形式的圖形形狀或者可甚至是帽罩狀且覆蓋眼睛的整個鞏膜部分。本發明還包括小斑點。
圖2A示出本發明的裝置的第一示例性實施方式。圖2A所示的裝置具有單個施加器21,該施加器具有軸22。在使用該裝置時,施加器21放置在兩個相鄰肌肉連接3之間。
圖2B示出本發明的裝置的變型第一示例性實施方式。圖2B所示的裝置具有兩個施加器21,該兩個施加器各自具有軸22。兩個軸22合并至近端軸23中。在使用該裝置時,每個施加器21放置在兩個相鄰肌肉連接3之間。
圖2C的截面圖示出具有由護套26圍繞的中心光學引導元件25的圓柱形施加器21。光學引導元件25適于施加例如UV光或藍光的光。這由黑色箭頭指出。此外,提供藥劑通道27、28。在該實例中,一個藥劑通道(即,藥劑通道27)用于施加諸如核黃素的藥劑(另外參見指向施加器的遠端的灰色箭頭),然而另一通道28用于吸走多余藥劑(參見近端方向上的灰色箭頭)。
圖2D的截面圖示出具有由護套26圍繞的光學引導元件25的平坦施加器21b。光學引導元件25適于施加例如UV光或藍光的光。這由黑色箭頭指出。此外,藥劑通道27、28與光學引導通道25并列設置。在該實例中,一個藥劑通道27用于施加諸如核黃素的藥劑(參見遠端方向上的灰色箭頭),然而另一通道28用于吸走多余藥劑(參見近端方向上的灰色箭頭)。
圖3A-圖3F示出本發明的裝置的第二示例性實施方式。示出的裝置具有兩個小的彎曲的或平面施加器10,每個施加器各自具有軸22。兩個軸22合并至近端軸23。在使用該裝置時,每個施加器10放置在兩個相鄰肌肉連接3之間。圖3B和圖3C還示出施加器10的兩個示例性示意性截面圖(圖3B示出稍微彎曲形狀,并且圖3C示出平面形狀)以及施加器10的三個可替換表面構造。在圖3D中,施加器包括允許精確施加光、熱量的兩個斑點(spot)25,和/或用于向鞏膜上施加藥劑的兩個斑點27、28。可替換地,如圖3E所示,四個斑點25被設置為布置在虛擬正方形的拐角處。也示出了用于向鞏膜上施加藥劑的兩個斑點27、28。作為如圖3F所示的進一步替換方案,“斑點”25覆蓋施加器10的大量區域。這些實例中的施加器的基本外部形狀是正方形。
圖4A示出本發明的裝置的第三示例性實施方式。示出的裝置具有兩個彎曲施加器20,該兩個彎曲施加器各自具有軸22。兩個軸22合并至近端軸23中。在使用該裝置時,每個施加器20放置在兩個相鄰肌肉連接3之間。圖4B示出施加器20的示意性截面圖(示出稍微彎曲的形狀)。在圖4C-圖4E中示出施加器20的三個可替換構造。在圖4C中,施加器20包括沿著允許向鞏膜上精確施加光、熱量和/或藥劑的虛擬線布置的四個斑點25。可替換地,如圖4D所示,八個斑點25的圖案設置為沿著兩條平行虛擬線布置。作為圖4E中的進一步替換方案,“斑點”25覆蓋施加器20的大量區域。在這些實例中,施加器20的基本外部形狀是細長橢圓形或具有彎曲拐角的矩形。
圖5A示出本發明的裝置的第四示例性實施方式。示出的裝置具有兩個彎曲施加器30,該兩個彎曲施加器各自具有軸22。兩個軸22合并至近端軸23。在使用該裝置時,每個施加器30放置在兩個相鄰肌肉連接3之間。圖5B還示出了施加器30的示意性截面圖(示出稍微彎曲的形狀)。圖5C和圖5D示出施加器30的兩個可替換構造。在圖5C中,施加器30包括沿著允許向鞏膜上精確施加光、熱量和/或藥劑的虛擬線布置的四個斑點25。作為進一步替代方案,圖5D中的“斑點”25覆蓋施加器30的大量區域(在示出替代方案中,以矩形形式)。在這些實例中,施加器30的基本外部形狀是矩形。此處,施加器30在形狀上也是細長且狹窄的。
圖6示出本發明的裝置的第五示例性實施方式。在該實施方式中,施加器適于較大治療區域。示出的裝置具有兩個彎曲施加器40,該兩個彎曲施加器各自具有軸22。兩個軸22合并至近端軸23。在使用該裝置時,每個施加器40放置在兩個相鄰肌肉連接3之間。圖6B示出施加器40的示意性截面圖(示出稍微彎曲的形狀)。圖6C至圖6E示出施加器40的三個可替換構造。在圖6C中,施加器40包括允許向鞏膜上精確施加光、熱量和/或藥劑的三個斑點25。替換地,如圖6D所示,六個斑點25設置為沿著兩條平行虛擬線布置。作為圖6F的進一步替代方案,“斑點”25覆蓋施加器40的大量區域。在這些實例中,施加器的基本外部形狀是正方形。
圖7A示出根據本發明的裝置的第六示例性實施方式。該實施方式類似于圖4的實施方式,但是具有四個施加器20。在使用該裝置時,每個施加器20放置在兩個相鄰肌肉連接3之間。這允許同時進行對所有區域的治療。然而,在該實施方式中,能夠單獨和分開控制每個施加器20。前視圖(圖7A的右邊)示出肌肉連接3之間的四個施加器20的布置。
在圖7B中示出進一步變型實施方式。此處,裝置另外包括角膜屏蔽29。角膜屏蔽用作至少兩個目的:它保護眼睛并且固定施加器20。
在圖7C所示的替代方案中,只存在單個施加器21,類似于圖2A所示的一個施加器。在該實施方式中,還存在角膜屏蔽29。此處,屏蔽也可用于輔助施加器21的適當定位。
通常,角膜屏蔽可僅是部分角膜屏蔽。
圖8示出另一實例。該實例類似于圖2所示的實施方式。它示出在光學通道輸出83的中心,用于光施加。此外,提供可選照相機(多個照相機)84以及兩個溫度測量傳感器85。此外,兩個藥劑通道81被設置為用于施加和抽吸核黃素。此外,兩個斑點82被設置為用于蛋白質凝固。如圖8B所示,用于凝固的光纖82被至少部分著色以適于生成熱量。由于只有部分涂層,所以未被涂層吸收而穿過涂層的光可另外用于交聯。盡管通道或斑點中的一些成對示出,但是本發明還包括只存在每個通道或斑點中的單獨一個。可選地,包括一個或兩個通道以及斑點的任意結合。
圖8C示出施加器21的示意性側視圖,然而,圖8D示出施加器21的底視圖,該施加器具有其軸22。
圖9示出根據本發明的施加器的第一表面的不同結構。根據圖9A,第一表面91是平坦的。圖9A的底視圖(即,向施加器90a的第一表面91上的視圖)示出根據圖8的布置為跨越第一表面91的四個元件80。
在圖9B的替代方案中,施加器90b是平坦的,且具有突起。圖9B的底視圖(即,向施加器90b的第一表面91上的視圖)示出根據圖8的布置為跨越第一表面91的五個元件80。
在圖9C的第三替代方案中,施加器90c是平坦的,且具有根據圖8的七個突起元件80以及輪緣92。
圖10示出包括核黃素藥劑提供部102、光和/或熱量發出元件80的另一實例。在該實例中,提供擴散器101以用于空中交聯。用于熱量施加(蛋白質凝固)的元件可造成尖銳尖端以改進施加器的定位和/或增加疤痕誘導過程(更深地透入組織)。
圖17示出利用根據本發明的裝置/施加器可獲得的不同治療圖案。根據圖17A至圖17C,治療是以期望模式進行單獨斑點的“連續”施加。如圖2A或圖7C所示的施加器可用于施加這種圖案。在圖17D至圖17F中,一次施加至少兩個斑點,即,例如,利用如圖3D、圖3E、圖4C、圖4D或圖5C所示的多斑點施加器。在圖17F中示出利用根據圖6C或圖6D的施加器獲得的圖案。它示出用于熱凝固的斑點的成對布置。在斑點之間的區域(示出為淺灰色)中,施加規則空中交聯。
光纖(還被稱為光學波導或玻璃纖維)可以以不同實現方式選擇并且必須能夠進行不同波長的電磁輻射(UV光至紅外光,從大約300nm-1100nm)。隨后,SAIS-Spot的某些結構實現方式可被優化以用于電磁輻射的特定波長以及特定光能級。因此,特定光纖材料(例如,額外UV光傳導)和特定光纖直徑(例如,用于高能級的更大線纜直徑)可用于SAIS-Spot。該裝置的光纖應能夠向裝置的內表面上投射1-300mW/cm2的輻射能級。用于SAIS-Spot中的光纖的光由外部可控制且可調節的輻射源(例如,一個LED單元中的不同LED、不同激光或不同燈類型)提供。外部輻射源可控制(i)輻射波長,(ii)輻射能級以及(iii)施加時間(輻射脈沖的長度和順序)。因此,由控制光纖的外部輻射源保證裝置的發光功率的控制(每一時間單位的輻射能級)。此外,利用該外部光源,能夠分開控制光纖的特定組,并且因此單獨照亮SAIS-Spot內表面的某些區域。因此,能夠向SAIS-Spot內的不同區域同時提供不同波長和不同輻射能級。
光纖和/或其端部可以以不同方式布置在SAIS-Spot內部上(擴散器內)。
在該裝置內,物質和輻射的供給完全分離(用于通道的光學不透明材料,可能此外,分別地,具有全內反射的反射光纖或普通光纖),使得光敏物質不受影響并且通過輻射在SAIS-Spot內變化。通過外部耦合設備,物質供給和輻射單元也可分開暫時控制。
在打開眼窩與眼球之間的組織連接之后,本發明的裝置被引入至特農氏空間中。該裝置穿過肌肉放置在鞏膜的赤道部分和側向部分上。因此,在手術期間能夠在不必從待治療部位移除裝置的情況下施加物質或輻射(優點:(i)在手術期間節省時間,(ii)物質施加和輻射的均勻或特別選定的分布,(iii)降低由于手術儀器的重復插入和移除而對周圍組織造成損害的風險)。
根據本發明的裝置也可在擴散器內(SAIS-Spot的內部部分)配備有溫度探測器。以與擴散器中的光纖的集成相同的方式,接著發生向記錄單元的供給或連接。附加設備可用于確定施加器是否接觸鞏膜。
SAIS-Spot也可與視頻監視系統相結合,其中,內窺鏡視覺系統附接至/集成至SAIS-Spot。
在該上下文中,優選地,藥劑是化學交聯劑或感光物質。例如,感光物質是核黃素。例如,在施加核黃素之后,可施加光輻射或蛋白質凝固劑。
優選地,在本發明的器件和方法的背景下的光輻射是UV-A光輻射(大約315至大約380nm,例如,大約370nm)或“藍光”輻射(優選地,“藍光”指的是它具有從大約420至大約480nm的波長,優選地,大約425至大約475nm,更優選地,大約450至大約465nm;優選的波長是大約450nm和大約465nm),具體地,當核黃素用作感光物質時。當光輻射是UV-A光輻射時,在鞏膜的表面處,例如,光強度在1至200mW/cm2的范圍中,優選地,2至4mW/cm2。當光輻射是“藍光”輻射時,在鞏膜的表面處,光強度可通常高于UV-A輻射,例如,它可在1至350mW/cm2的范圍中,優選地,它在10與200mW/cm2之間,更優選地,在20與100mW/cm2之間,并且甚至更優選地,在25與100mW/cm2之間。通常,與連續輻射的施加相比,當使用脈沖光時,可使用更高光強度。在某些實施方式中,帶通濾波器可用于創建某些光分布,例如,320至400nm或420至480nm或425至475nm或450至465nm。
在本發明的背景下,眼睛的病理學變化或疾病可例如,選自本文中以上論述的疾病和狀況,并且具體地,選自漸進性近視、鞏膜炎以及鞏膜的病理學變化(諸如,組織浸漬炎癥)。
本發明還涉及本文如上描述的用于在治療眼睛的病理學變化或疾病時所使用的裝置。
使用SAIS-Spot裝置來用于鞏膜交聯的示例性過程
外科手術的目的是通過作為光敏劑的核黃素的施加以及照射與藍光的組合,來交聯患者眼睛的鞏膜組織中的膠原分子。使用SAIS-Spot裝置來施加核黃素和/或光照射(優選地,這兩者)。還可使用其他光敏劑以及另一波長的電磁照射。
在目前用于人類眼睛的鞏膜交聯(SXL)的過程中,在照射開始之前,等滲NaCl溶液中的0.01-20%(優選地,0.5%)的核黃素施加至整個鞏膜的表面(或只施加至應被治療的區域)1秒-40分鐘,優選地,60秒至30分鐘。在施加之前,可例如,使用裝置中的加熱容器或加熱系統來預熱(例如,高達大約35℃)核黃素溶液。還可通過添加葡萄聚糖或另一補充物質來修改核黃素溶液,例如,在其粘度或其組織滲透行為方面修改。核黃素的施加可在照射期間連續/交替重復,或者可替換地,可只在一開始施加。
在人類鞏膜組織上,藍光的照射功率可大約在1至2000mW/cm2之間,優選地,在10與200mW/cm2之間,更優選地,在20與1000mW/cm2之間,并且甚至更優選地,在25與100mW/cm2之間的藍光功率。在治療期間,還能夠交替或同時施加其他電磁波長度,例如,諸如UV-A的UV光或者兩個或多個不同波長的組合。此外,能夠施加某一電磁波長度的帶寬的光(例如,具有從420至480nm的帶寬的藍光;參見以上)。
在SXL操作期間,鞏膜組織可例如,以最優藍光功率(正如以上討論的)照射1秒至40分鐘,優選地,約20分鐘。照射時間間隔可例如是1-30秒,優選地,10-30秒,且具有例如10秒的中斷以避免用于鞏膜組織的任意種類的局部分布的熱應力,或者可以以任意方式連續或搏動。在藍光照射期間,新鮮核黃素溶液可交替施加,例如,每5分鐘以更新使用過的核黃素,并且此外,冷卻照射的鞏膜組織。它還可連續施加。取決于光功率,其他照射間隔和頻率以及延長或縮短照射過程是可行的。相比較其他光源,這是SAIS-Spot裝置的關鍵優勢:在整個照射期間,SAIS-Spot的位置不需要改變或縮回以及重新定位,因為核黃素施加能夠同時進行。在SXL治療之后,SAIS-Spot裝置的物質施加和吸入通道部分可用于移除過多核黃素,并且利用無菌等滲NaCl溶液沖洗眼眶。
此外,SAIS-Spot裝置的該物質施加和吸入通道部分可用于利用各種沖洗溶液來沖洗特農氏空間。這些溶液可包含藥理學活性物質或分子以支持或穩定SXL治療結果。例如,作為對交聯治療的響應,可激活纖維原細胞。纖維原細胞可例如,改變它們的形態、細胞內超微結構和/或新陳代謝,并且可在數量上增加。膠原束和原纖維結構的變化(小尺寸膠原原纖維的增加數量)可被視為改造膠原束結構的標志。這些改造過程可通過纖維原細胞的增殖活動或遷移以及基因和蛋白質表達譜的變化來支持。因此,可能地,基質金屬蛋白酶(MMP)將被生產用于膠原和細胞外基質成分的改造過程。TIMP是用于抑制MMP活性的調節蛋白質。因此,可行的是,在SXL治療之后,施加藥理學活性物質以調制MMP和/或TIMP的活性。經由SAIS-Spot裝置施加的藥理學活性物質也可調制生成基因的膠原的活性或天然出現的膠原交聯酶(例如,賴氨酸氧化酶),或者那些物質可調節纖維原細胞和其他血源性細胞的增殖和遷移。
人類患者中的SXL的外科手術
為了執行用于鞏膜交聯(SXL)的手術,麻醉是強制的。它可能是通過麻醉劑的眼球后或眼球旁注射的任意種類的局部麻醉,或者全身麻醉。利用眼藥水的局部施加來進行局部麻醉或者麻醉的完全省略是不推薦的且非常不可能的。優選地,結合肌肉松弛劑的施加來執行全身麻醉。可能需要另外注射眼球后阻滯和/或向眼睛上滴局部麻醉劑。整個外科手術過程(麻醉、術前和術后過程以及SXL)可花費10分鐘到3小時。
對水平穩定的患者執行SXL治療。例如,可通過極度小心地向睫狀體和結膜施加聚維酮碘或任意其他消毒溶液來執行消毒。常見的外科紗布用于在眼睛保持易于操作的同時,覆蓋患者。
能夠在執行手術的同時使用間接檢眼鏡檢查、黃色帶通濾波器和/或操作顯微鏡。
在消毒之后,優選地,眼瞼窺器將插入眼瞼下方以保持眼瞼完全打開。不使用眼瞼窺器的操作是可行的但是不優選。在以下步驟過程中,人工淚水將落到眼睛的暴露部分(角膜、鞏膜和/或結膜)上。在保持眼瞼通過窺器完全打開之后,結膜將被解剖刀或小型剪刀切開,并且結膜將與異色邊緣分離。在從小血管流血的情況下,流血將被停止(例如,通過熱治療-燒灼)并且血液將被移除。推薦整個眼睛周圍的結膜(即,眼瞼/眼睛的上部和下部)的部分或完全切開以及結膜與異色邊緣的完全分離。還能夠降低切口的尺寸,或者在某些情況下,可能只需要打開結膜的一部分(上部或下部)。這取決于SAIS-Spot裝置以及待治療的鞏膜區域的形狀和結構。結膜的完全切開使得能夠進入眼眶中的特農氏空間。現在,四個直眼部肌肉通過肌肉后面的線的插入而成環形,并且使能夠進行眼睛的操縱和定向。在某些情況下,可能不需要操縱眼部肌肉或整個眼睛。這取決于將插入的SAIS-Spot裝置的形狀、結構和尺寸。SAIS-Spot可僅由一個具有簡單形狀的相對小的勺狀施加器,或者具有適配為眼睛的解剖或必須被治療的患者和/或病理的需求的復雜形狀的兩個、三個或四個施加器部分組成。形狀還可被適配為待治療的最小所需區域。施加器的各個部分可同時引入至眼球周圍的特農氏空間中,或者治療可連續執行。這取決于必須被治療的鞏膜區域。同時插入SAIS-Spot施加器的若干部分降低操作時間。SAIS-Spot裝置的具體適配形狀避免肌肉、較大血管、周圍組織以及眼睛神經的不期望交聯。能夠定制用于待治療的每個患者的施加器的形狀。
在插入SAIS-Spot裝置以及將其正確放置在眼球上之后,開始物質施加,并且鞏膜將培養有核黃素,例如,至少1秒(正如以上討論的:各種培養期和不同濃度以及核黃素與其他治療物質的混合物是可能的)。能夠通過加入其他治療物質來降低培養時間。
在該預培養之后,開始光照射(參見以上)。在照射周期過程中,在某些狀況下,核黃素物質交替施加以更新使用過/漂白過的核黃素。使用過的或過多的核黃素可由SAIS-Spot抽吸通道吸出。此外,SAIS-Spot裝置的該物質施加和抽吸部分可用于利用各種沖洗溶液來沖洗特農氏空間(參見上面)。在SXL治療以及利用各種物質的可選沖洗時間段之后,SAIS-Spot施加器/多個施加器可從眼眶縮回。隨后,眼睛肌肉周圍的線應被移除,并且結膜必須通過縫合進行手術閉合。治療后的患者眼睛可利用局部抗生素、抗真菌劑和/或類固醇藥膏或眼藥水來用藥治療。在一些情況下,該醫學治療不是強制性的。眼睛可通過眼罩、眼睛軟膏敷裹和/或填塞來封住和屏蔽。在手術之后,患者應持續處于麻醉科醫師的監督下,并且應由眼科醫師監控。
從包括附圖和權利要求的說明書中,其他方面、特征以及優點將是顯而易見的。
雖然在附圖和以上描述中詳細說明和描述了本發明,但是這種說明和描述應被視為說明性或示例性的,而并非限制性的。將理解,在以下權利要求的范圍內,本領域普通技術人員可進行變更和修改。具體地,本發明覆蓋具有以上和以下描述的不同實施方式的特征的任意組合的進一步實施方式。
此外,在權利要求中,措辭“包括”并不排除其它元件或步驟,并且不定冠詞“一(a)”或“一個(an)”并不排除多個。單個單元可履行在權利要求中敘述的幾個特征的功能。與屬性或值相結合的術語“基本上”、“大致”、“大約”等還特別地分別精確限定該屬性或精確地限定該值。權利要求中的任意附圖標記不應被解釋為限制范圍。
實施例
實施例1:兔子實驗中的外科手術
為了執行核黃素/藍光膠原交聯,通過鹽酸氯胺酮的肌肉內注射對動物進行麻醉(50mg/kg體重;氯胺酮5%,德國通益,烏爾姆,德國)以及鹽酸塞拉嗪(10mg/kg體重;龍朋;德國拜耳,勒沃庫森,德國)。為了維持麻醉,鹽酸氯胺酮(25mg/kg體重)以及鹽酸塞拉嗪(5mg/kg體重)注入肌肉內。只有右眼經歷治療,然而對側的未治療的眼睛起單獨控制的作用。為了避免在手術同時對角膜的損害,用眼睛軟膏(格哈德曼公司,柏林,德國)對左眼進行處理。此外,奧布卡因(conjuncain)用于右眼的局部麻醉。在暫時眥切開術之后,在異色邊緣處切開結膜以打開特農氏空間。隨后,在上部暫時四分體中直接切開特農氏空間。借助于5/0聚丙烯縫線(愛惜康,諾爾斯特,德國)來顯示并固定上部眼直肌和暫時眼直肌,以便允許在鞏膜治療過程中鞏膜的更好呈現以及眼睛位置的更容易操縱。隨后,在暴露鞏膜上每五分鐘下滴一次核黃素-5'-磷酸鹽(PBS中的0.5%的維他命B2,沒有任意葡萄聚糖添加劑,斯特里制藥,烏茨納赫,瑞士),以保證核黃素平面滲透至鞏膜基質中。在20分鐘的浸泡之后,使用商用牙科光源(藍相16i,Ivoclar Vivadent GmbH,埃爾萬根-雅格斯特,德國),利用不同強度(10、25、50、100、200、400以及650mW/cm2)的藍光(450±25nm)中的一個(匹配核黃素的一個最大吸收(450nm))對暫時鞏膜照射20分鐘。此處,由于藍光對角膜和視網膜組織的破壞特性,必須避免對角膜和視網膜的照射。在整個照射周期過程中,每5分鐘施加一次核黃素滴,以避免熒光團的過多光致漂白。通過定制聚丙烯隔離套管來實現對所施加的光強度的調節(10mW/cm2,高達400mW/cm2),并且利用功率計與可見光傳感器(LaserMate Q,相關公司,圣克拉拉,加利福尼亞,美國)的結合來測量光強度。在沒有額外隔離套管的情況下,由光源實現650mW/cm2的光強度。在照射之后,移除縫合線,并且使用可吸收醫用縫合線使結締組織附接至鞏膜。最后,利用可吸收醫用縫合線重新適配眥切開術。利用眼睛軟膏(格哈德曼公司,柏林,德國)進入結膜穹窿以及角膜中來處理雙眼以避免感染和干澀。動物被監測直到醒來,并且將動物在萊比錫大學的醫學實驗研究中心中保持3周。
實施例2:鞏膜組織中的核黃素滲透的測量
圖11顯示來自各種物種的在鞏膜瓣中的核黃素的總組織滲透的平均時長。通過向鞏膜組織瓣的一側施加核黃素來計算滲透時間,并且通過熒光顯微鏡將相對側上的總外表監測為最大熒光。與核黃素滲透兔子鞏膜所花費的10-20分鐘相比,核黃素滲透人類鞏膜約花費30-40分鐘。凍結/解凍鞏膜組織用于該檢查;然而,結果與新隔離(即,非凍結)組織類似。
圖12示出來自各種物種的鞏膜組織的頻譜光透射率特征。只有約0.5-1%的光(高達500nm波長)穿透所有物種的鞏膜組織。核黃素的施加進一步降低在高達530nm的波長處的透射率,這是由核黃素在該波長處的強光吸收所引起的。
圖13示出來自各種物種的以450nm的波長的新隔離鞏膜組織的光透射率特征。只有約0.5%的光穿透所有物種的鞏膜組織。核黃素(“Ribo”)的施加進一步降低在450nm處的透射率,這是由核黃素在該波長處的強光吸收所引起的。
實施例3:不同物種中的鞏膜交聯的結果
圖14:對組織半薄截面(0.5μm厚度,甲苯胺藍染色)進行光顯微鏡檢查,以比較來自各種物種的鞏膜組織的尺寸和結構。A(獼猴)鞏膜中的比例尺對于A中的所有鞏膜片段都是有效的,并且示出鞏膜的后部中的厚度的差異。B以更高放大倍率示出組織截面以反映結構差異。組織(histological)檢查顯示兔子與人類鞏膜之間的大的結構相似性以及與其他物種相比的差異。B(獼猴)鞏膜中的比例尺對于B中的所有鞏膜片段都是有效的。
圖15:具有(C和D)且沒有(A和B)交聯治療的急性隔離(A)與凍結/解凍(B-D)鞏膜組織的形態學特性的比較。顯微照片顯示通過光顯微鏡檢查(甲苯胺藍染色)顯現的鞏膜組織的組織半薄截面。A:急性隔離未治療鞏膜組織的特征在于,非常緊湊的膠原束布置以及膠原束之間的纖維原細胞(箭頭)的紡錘狀橢圓體細胞體。B:相比較急性隔離鞏膜組織,解凍(之前凍結以用于存儲)鞏膜組織示出松弛的束結構以及扭曲束(星號)。C:與B中的未治療解凍組織相比,在利用核黃素以及25mW/cm2進行交聯治療之后,(解凍)鞏膜組織的總體結構的顯著變化不是顯而易見的。纖維原細胞的細胞體出現膨脹(箭頭)并且束結構扭曲(星號)。D:在利用核黃素和200mW/cm2的藍光進行交聯治療之后,束結構進一步松弛并且膠原束出現強扭曲。內部束和內部原纖維空間增加(箭頭頭部),并且許多膠原原纖維出現分離。D中的比例尺對于A-D都是有效的。
圖16:具有(C和D)且沒有(A和B)交聯治療的鞏膜組織的急性隔離(A)與凍結/解凍(B-D)的電子微觀顯微照片。A:急性隔離非治療鞏膜組織的特征在于,具有不同方向的非常緊湊的膠原束布置(束的橫截面和橫切面切向可見)。具有微細胞過程的纖維原細胞(星號)的紡錘狀電子密集細胞體位于膠原束之間,并且子蜂窩結構被良好限定且是完整的。B:由于-20℃下的存儲,鞏膜組織的解凍纖維原細胞(星號)膨脹并且示出中斷的蜂窩結構和細胞膜。膠原原纖維看起來完整,并且通常原纖維束仍然組織緊湊。C:在利用核黃素以及25mW/cm2進行交聯治療之后,鞏膜纖維原細胞示出與B中所示的未治療解凍組織類似的中斷外觀。膠原纖維結構本身表現完整。D:在利用核黃素以及200mW/cm2的藍光進行交聯治療之后,膠原束結構出現稍微松弛,并且很少的膠原原纖維布置出現中斷(箭頭頭部)。偶爾,內部原纖維空間增加(黑色星號)并且蜂窩結構(白色星號)表現出被破壞。D中的比例尺對于A-D都是有效的。
- 還沒有人留言評論。精彩留言會獲得點贊!