一種聚乙二醇修飾的鈣基納米藥物遞送顆粒及其制備方法和應用與流程
本發明涉及生物醫藥領域,具體涉及一種聚乙二醇修飾的鈣基納米藥物遞送顆粒及其制備方法和應用。
背景技術:
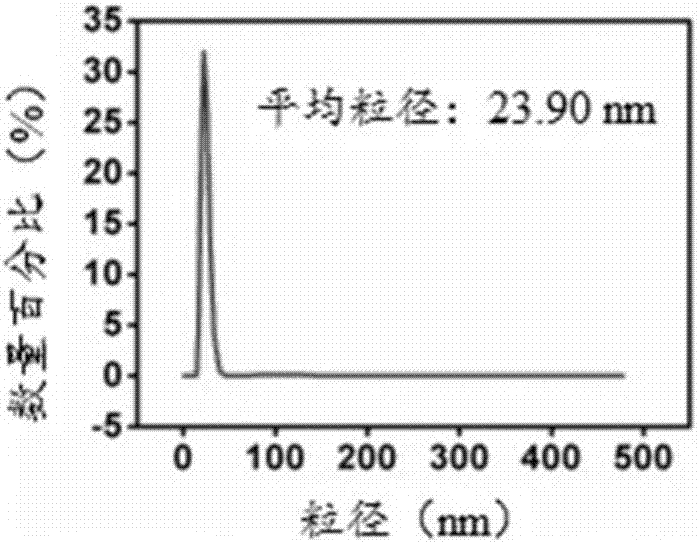
:基因治療為許多嚴重的獲得性疾病及先天性疾病帶來了治愈的希望。但是缺乏安全、高效的和穩定表達的基因投遞系統是阻礙基因治療進入臨床的最大障礙。病毒載體是一類常見的基因載體,它利用病毒對宿主細胞的感染將外源基因導入宿主細胞內。一般包括腺病毒載體(av),腺相關病毒載體(aav),逆轉錄病毒等。雖然病毒載體具有較高的轉染效率,但病毒載體裝載基因容量有限,而且具有免疫原性存在潛在的生物安全性隱患,所以病毒基因載體的臨床應用亦難以推進。近年來,微環dna(minicircledna,mcdna)的出現,成為基因載體中的一大亮點,微環dna是一個環狀的表達盒子,是通過dna重組技術,把標準質粒的細菌dna骨架去除后的產物,即微環dna只含有一個基因表達框而沒有外在的細菌骨架序列,其優點是能有效延長靶基因在細胞內的表達時間、大量攜帶功能基因片段且幾乎無任何毒性。但是由于裸露的dna在生理環境中會被迅速清除(主要是機體中各種酶的降解),不能有效進入靶細胞核,所以仍需合適的投遞系統將微環dna遞送至靶向組織或器官。常用的基因投遞系統包括硅酸鈣,陽離子脂質體,陽離子多聚物(聚乙烯亞胺pei)等。這類投遞系統免疫原性較低、基因裝載容量大,但是轉染效率低,大大限制了其臨床應用。因此,研究開發高效,具有良好生物相容性且具有靶向性的基因投遞系統是解決基因藥物臨床應用的關鍵。鈣硅基(cao·sio2-based)生物材料是近三十年興起的新型生物活性材料,鈣元素的引入使它比傳統硅基材料具有更好的生物活性、生物相容性和生物可降解性,它能在模擬體液環境下逐漸轉變為類骨磷灰石,是一類具有巨大應用前景的無機生物材料,已經在載藥、骨修復、牙齒修復等領域有廣泛的應用,而硅酸鈣作為基因載體卻鮮有報道。傳統沉淀法制備的硅酸鈣顆粒的粒度可控性差,在水溶液中易團聚,分散性不佳。本發明通過微乳液法制備單分散的硅酸鈣納米顆粒,將微環dna包裹在硅酸鈣顆粒內部,外部修飾聚乙二醇(peg),利 用聚乙二醇(peg)形成的水化層,保護dna在體內投遞過程中不被機體網狀內皮系統(res)清除和各種dna酶的降解,從而實現微環dna的靶向投遞。技術實現要素:針對現有技術的不足,本發明提供了一種聚乙二醇修飾的鈣基納米藥物遞送顆粒及其制備方法和應用。第一方面,本發明提供了一種聚乙二醇修飾的鈣基納米藥物遞送顆粒,所述聚乙二醇修飾的鈣基納米藥物遞送顆粒的粒徑為20~200nm;所述聚乙二醇修飾的鈣基納米藥物遞送顆粒包括第一目標投遞物、包裹有第一目標投遞物的鈣基顆粒,其中,所述鈣基顆粒表面修飾有聚乙二醇,所述第一目標投遞物為生物藥物、化學藥物或包載有核酸片段的第二目標投遞物,所述包載有核酸片段的第二目標投遞物為包裹、結合或共混有核酸片段的陽離子聚合物、多肽、聚氨基酸或轉染試劑。如本發明所述的,“核酸片段”包括天然或人工合成的dna片段、rna片段、mrna、sirna、shrna等。可選地,所述生物藥物包括但不限于核酸、多肽、蛋白和疫苗一種或多種;所述化學藥物包括但不限于抗腫瘤小分子藥、熒光素和淋巴示蹤劑一種或多種。優選地,所述聚乙二醇修飾的鈣基納米藥物遞送顆粒的載藥量為0.001~0.85,進一步優選為0.05~0.85。如本發明所述的,所述“載藥量”為所述的被包裹藥物與所述聚乙二醇修飾的鈣基納米藥物遞送顆粒的質量比。可選地,在第一目標投遞物中,被包裹藥物為生物藥物或化學藥物;在第二目標投遞物中,被包裹藥物為核酸片段。優選地,所述鈣基為生物可降解性鈣鹽,所述生物可降解性鈣鹽包括但不限于硅酸鈣、磷酸鈣、檸檬酸鈣或碳酸鈣。優選地,所述包裹、結合或共混有核酸片段的陽離子聚合物(如聚乙烯亞胺)、多肽、聚氨基酸或轉染試劑中,所述的陽離子聚合物、多肽、聚氨基酸、轉染試劑可分別獨立地選自表1中所例舉的陽離子聚合物、多肽、聚氨基酸、轉染試劑:表1表1中的中英文對照如表2所示:表2進一步優選地,所述的包載有核酸片段的第二目標投遞物為將陽離子聚合物(如聚乙烯亞胺)、多肽、聚氨基酸或商品化轉染試劑與含有核酸片段的溶液按照氮磷比為0.1~100:1的比例(優選按照氮磷比為10~20:1的比例)混合并孵育制得(優選為5~40min)。如本發明所述的,所述“氮磷比”為陽離子聚合物(如聚乙烯亞胺)、多肽、聚氨基酸或商品化轉染試劑中氨基的摩爾數與含有核酸片段的溶液中磷酸根的摩爾數之比。進一步優選地,所述包載有核酸片段的第二目標投遞物為將聚乙烯亞胺溶液或聚乙烯亞胺衍生物(peicl)與含有核酸片段的溶液按照氮磷比為0.1~100:1的比例混合并孵育5~40min制得,其中,所述聚乙烯亞胺的分子量為600~70000道爾頓;所述聚乙烯亞胺衍生物(peicl)的分子量為1000~70000道爾頓(優選為34000~70000道爾頓),所述聚乙烯亞胺衍生物(peicl)的結構式如式ⅰ所示,其中,x、y、z為非負整數,且x、y和z均不為零;更進一步優選地,所述聚乙烯亞胺的分子量為25000道爾頓。優選地,所述聚乙二醇修飾的鈣基納米藥物遞送顆粒的粒徑為20~40nm。第二方面,本發明提供了一種聚乙二醇修飾的鈣基納米藥物遞送顆粒的制備方法,包括如下步驟:(1)將第一目標投遞物溶液與第一可溶性鈣鹽溶液混合均勻后加至有機相中,攪拌20~60min制得微乳液a;其中,所述第一目標投遞物為生物藥物、化學藥物或包載有核酸片段的第二目標投遞物;所述有機相為將表面活性劑與碳原子數為6~12的烷烴化合物(優選按體積比為25~40:60~75的比例)混合制得,所述的表面活性劑為聚乙二醇壬基苯基醚(igepalco-520)、聚乙二醇辛基苯基醚(tritonx-100)、雙(2-乙基己基)琥珀酸酯磺酸鈉(aot)和十二烷基硫酸鈉(sds)中的一種或多種;所述包載有核酸片段的第二目標投遞物為包裹、結合或共混有核酸片段的陽離子聚合物、多肽、聚氨基酸或轉染試劑,其中,陽離子聚合物、多肽、聚氨基酸或轉染試劑中氨基的摩爾數與所述核酸片段中磷酸基團的摩爾數之比為0.1~100:1;(2)將可溶性鹽溶液加至步驟(1)所得的微乳液a中,攪拌2~4h制得微乳液b;其中,所述可溶性鹽溶液包括但不限于可溶性硅鹽溶液、可溶性磷酸鹽溶液、可溶性檸檬酸鹽溶液或可溶性碳酸鹽溶液,所述可溶性硅鹽溶液中的硅元素、可溶性磷酸鹽溶液中的磷元素、可溶性檸檬酸鹽溶液中的檸檬酸根或可溶性碳酸鹽溶液中的碳酸根與步驟(1)所述第一可溶性鈣鹽溶液中的鈣元素的摩爾比為0.01~10:1(優選為0.43~3.5);(3)將磷酸-聚乙二醇水溶液加至步驟(2)所得的微乳液b中,攪拌2~4h,得到微乳液c,其中,所述磷酸-聚乙二醇水溶液中磷酸-聚乙二醇的質量與步驟(1)第一可溶性鈣鹽溶液中鈣元素的物質的量的比為0.001~100:1(優選為0.008~100);(4)去除步驟(3)所得的微乳液c中的有機相,離心、洗滌后,用水和/或乙醇分散即得聚乙二醇修飾的鈣基納米藥物遞送顆粒;其中,所得聚乙二醇修飾的鈣基納米藥物遞送顆 粒的粒徑為20~200nm;所述聚乙二醇修飾的鈣基納米藥物遞送顆粒包括第一目標投遞物、包裹有第一目標投遞物的鈣基顆粒,其中,所述鈣基顆粒表面修飾有聚乙二醇,所述第一目標投遞物為生物藥物、化學藥物或包載有核酸片段的第二目標投遞物,所述包載有核酸片段的第二目標投遞物為包裹、結合或共混有核酸片段的陽離子聚合物、多肽、聚氨基酸或轉染試劑。在本發明第二方面提供聚乙二醇修飾的鈣基納米藥物遞送顆粒的制備方法中,所述的第二目標投遞物,采用帶正電性陽離子聚合物、多肽、聚氨基酸或轉染試劑包載核酸片段,形成幾十至幾百納米的小顆粒,為后續鈣基的生長提供軟模板;進一步地,可以通過調節水體系與有機相的體積來調節所制備的鈣基納米粒子的大小。更進一步地,本發明第二方面提供聚乙二醇修飾的鈣基納米藥物遞送顆粒的制備方法還可以通過調節核酸片段的量、核酸片段與陽離子聚合物的氮磷(n/p)比來調節所制備的鈣基納米粒子的大小。可選地,所述步驟(1)中,所述生物藥物包括但不限于核酸、多肽、蛋白和疫苗中的一種或多種;所述化學藥物包括但不限于抗腫瘤小分子藥、熒光素和淋巴示蹤劑中的一種或多種。優選地,所述步驟(1)中,所述核酸包裹、結合或共混有核酸片段的陽離子聚合物(如聚乙烯亞胺)、多肽、聚氨基酸或轉染試劑,所述的陽離子聚合物、多肽、聚氨基酸、轉染試劑可分別獨立地選自表1中所例舉的陽離子聚合物、多肽、聚氨基酸、轉染試劑。進一步優選地,所述包載有核酸片段的第二目標投遞物中,陽離子聚合物(如聚乙烯亞胺)、多肽、聚氨基酸或商品化轉染試劑中氨基的摩爾數與含有核酸片段的溶液中磷酸基團的摩爾數之比為10~20:1。可選地,所述的包載有核酸片段的第二目標投遞物為將陽離子聚合物(如聚乙烯亞胺)、多肽、聚氨基酸或商品化轉染試劑與含有核酸片段的溶液混合并孵育制得(優選為5~40min)。進一步優選地,所述包載有核酸片段的第二目標投遞物為將聚乙烯亞胺溶液或聚乙烯亞胺衍生物(peicl)與含有核酸片段的溶液按照氮磷比為0.1~100:1的比例混合并孵育5~40min制得,其中,所述聚乙烯亞胺的分子量為600~70000道爾頓;所述聚乙烯亞胺衍生物(peicl)的分子量為1000~70000道爾頓(優選為34000~70000道爾頓),所述聚乙烯亞胺衍生物(peicl)的結構式如式ⅰ所示,其中,x、y、z為非負整數,且x、y和z均不為零;更進一步優選地,所述聚乙烯亞胺的分子量為25000道爾頓。優選地,所述步驟(1)中,所述第一可溶性鈣鹽溶液的濃度為1~1000mm。優選地,所述步驟(1)中,所述第一可溶性鈣鹽溶液包括但不限于氯化鈣、硝酸鈣和溴化鈣中的一種或多種。優選地,所述步驟(1)中,所述有機相為環己烷與聚乙二醇壬基苯基醚按體積比7:3的比例混合制得。優選地,所述步驟(1)中,第一目標投遞物溶液與第一可溶性鈣鹽溶液的總體積與有機相的體積比為0.01~0.05:1,進一步優選為0.01~0.02:1。優選地,所述步驟(2)中,可溶性鹽溶液與步驟(1)所得的微乳液a的體積比為0.01~0.1:1,進一步優選為0.02~0.1:1。優選地,所述步驟(2)中,所述可溶性硅鹽包括但不限于正硅酸乙酯、硅酸鈉和硅酸鉀中的一種或多種。優選地,所述步驟(2)中,所述可溶性硅鹽溶液中,硅酸根的濃度為1~1000mm。優選地,所述步驟(2)中,所述可溶性磷酸鹽包括但不限于磷酸氫二鈉、磷酸二氫鈉、磷酸鈉、磷酸二氫鉀和磷酸氨中的一種或多種。優選地,所述步驟(2)中,所述可溶性磷酸鹽溶液中,磷酸根的濃度為1~1000mm。優選地,所述步驟(2)中,所述可溶性檸檬酸鹽包括但不限于檸檬酸鈉、檸檬酸鈣和檸檬酸鉀中的一種或多種。優選地,所述步驟(2)中,所述可溶性檸檬酸鹽溶液中,檸檬酸根的濃度為1~1000mm。優選地,所述步驟(2)中,所述可溶性碳酸鹽包括但不限于碳酸鈉、碳酸氫鈉和碳酸鉀中的一種或多種。優選地,所述步驟(2)中,所述可溶性碳酸鹽溶液中,碳酸根濃度為1~1000mm。優選地,所述步驟(2)中,所述的將可溶性鹽溶液加至步驟(1)所得的微乳液a中,攪拌2~4h制得微乳液b,具體包括:將可溶性鹽溶液加至步驟(1)所得的微乳液a中,攪拌2~4h后,再加入第二可溶性鈣鹽溶液,攪拌15~18h制得微乳液b;其中,所述第二可溶性鈣鹽溶液中的鈣元素與步驟(1)中的第一可溶性鈣鹽溶液中的鈣元素的摩爾比為0.1~10:1(進一步優選為0.45~8:1)。進一步優選地,所述第一可溶性鈣鹽溶液和第二可溶性鈣鹽溶液分別獨立地選自氯化鈣、硝酸鈣和溴化鈣中的一種或多種。進一步優選地,所述第二可溶性鈣鹽溶液的濃度為1~1000mm。進一步優選地,所述步驟(2)中,所述將可溶性鹽溶液加至步驟(1)所得的微乳液a中,攪拌2~4h制得微乳液b,具體包括:將可溶性鹽溶液加入到有機溶液中,攪拌1~2h后加至步驟(1)所得的微乳液a中,攪拌2~4h后,再加入第二可溶性鈣鹽溶液,攪拌15~18h制得微乳液b;其中,所述有機溶液為將表面活性劑與碳原子數為6~12的烷烴化合物(優選按體積比為25~40:60~75的比例)混合制得,所述的表面活性劑為聚乙二醇壬基苯基醚(igepalco-520)、聚乙二醇辛基苯基醚(tritonx-100)、雙(2-乙基己基)琥珀酸酯磺酸鈉(aot)和十二烷基硫酸鈉(sds)中的一種或多種;所述第二可溶性鈣鹽溶液中的鈣元素與步驟(1)中的第一可溶性鈣鹽溶液中的鈣元素的摩爾比為0.1~10:1(進一步優選為0.45~8:1)。進一步優選地,所述步驟(2)中,所述有機溶液與步驟(1)中的有機相的體積比為1:1。優選地,所述步驟(3)中,磷酸-聚乙二醇水溶液與步驟(2)所得的微乳液b的體積比為0.002~0.03:1。優選地,所述步驟(3)中,所述磷酸-聚乙二醇的分子量為600~12000道爾頓。進一步優選地,所述磷酸-聚乙二醇的分子量為2000道爾頓。優選地,所述步驟(3)中,所述磷酸-聚乙二醇包括但不限于單磷酸聚乙二醇、雙磷酸聚乙二醇、馬來酰亞胺磷酸聚乙二醇,其中,所述單磷酸聚乙二醇的結構式如式ⅱ所示,n為非負整數,且不為零,所述雙磷酸聚乙二醇的結構式如式ⅲ所示,n為非負整數,且不為零,所述馬來酰亞胺磷酸聚乙二醇的結構式如式ⅳ所示,n為非負整數,且不為零,進一步優選地,所述磷酸-聚乙二醇為如式ⅱ所示化合物。優選地,所述步驟(3)中,所述磷酸-聚乙二醇水溶液的濃度為1~1000mm。優選地,所述步驟(3)中,所述磷酸-聚乙二醇水溶液中磷酸-聚乙二醇與第一可溶性鈣鹽溶液中鈣元素的摩爾比為0.001~100:1(進一步優選為0.008~100)。可以理解的是,所述步驟(3)中,磷酸-聚乙二醇中的聚乙二醇端可以連接配體,所述配體包括但不限于葉酸、rgd(如本發明所述的“rgd”由精氨酸、甘氨酸和天冬氨酸組成)及其類似物、多肽、半乳糖、轉鐵蛋白或抗體,則所述步驟(4)中,所述聚乙二醇修飾的鈣基納米藥物遞送顆粒中的聚乙二醇端可以連接配體,所述配體包括但不限于葉酸、rgd及其類似物、多肽、半乳糖、轉鐵蛋白或抗體。優選地,所述步驟(4)中,所述聚乙二醇修飾的鈣基納米藥物遞送顆粒的粒徑為20~40nm。優選地,所述步驟(4)中,所述聚乙二醇修飾的鈣基納米藥物遞送顆粒的載藥量為0.001~0.85(進一步優選為0.05~0.85)。可以理解的是,在第一目標投遞物中,被包裹藥物為生物藥物或化學藥物;在第二目標投遞物中,被包裹藥物為核酸片段。優選地,本發明如第一方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒為采用如第二方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒的制備方法制得。第三方面,本發明還提供了一種藥物組合物,包括如第一方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒。第四方面,本發明還提供了一種如第一方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒或如第二方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒的制備方法在制備藥物中的應用。優選地,如第一方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒或如第二方面所述的聚乙二醇修飾的鈣基納米藥物遞送顆粒的制備方法在制備靶向投遞藥物中的應用。本發明的有益效果在于:(1)與其他無機納米顆粒相比,本發明所提供的聚乙二醇修飾的鈣基納米藥物遞送顆粒的粒徑得到有效的控制,均在200nm以下,而且可以在乙醇或水中形成單分散顆粒,且分散性質穩定,不會團聚;而且鈣基顆粒表面有聚乙二醇(peg)鏈保護,可以避免顆粒過早的被網狀內皮系統吞噬,延長體內循環的時間,用于體內轉染研究;(2)可以通過調節核酸片段的量、陽離子聚合物與核酸片段的氮磷(n/p)比、水體系的體積與有機相體積等條件調節制備的鈣基納米粒子的大小;(3)可選地,將聚乙二醇(peg)的另一端接上具有不同靶向性的配體,可以使顆粒具有特定的靶向性;(4)本發明提供的聚乙二醇修飾的鈣基納米藥物遞送顆粒具有制備成本低、毒性低、安全有效的優勢。附圖說明圖1-2是本發明實施例提供的磷酸-peg修飾的硅酸鈣-微環dna納米顆粒的透射電子顯微鏡(tem)照片(圖1)和粒徑分布圖(圖2);圖3是本發明實施例提供的磷酸-peg修飾的硅酸鈣-微環dna(egfp)納米顆粒與293t細胞株體外共培養的熒光(a)和白光(b)圖片;圖4是本發明實施例提供的聚乙二醇(peg)修飾的硅酸鈣包裹該黃綠素形成的納米顆粒的透射電子顯微鏡(tem)照片(a)和粒徑分布圖(b);圖5是本發明實施例提供的聚乙二醇(peg)修飾的硅酸鈣包裹ir820染料形成的納米顆粒透射電子顯微鏡(tem)照片(a)和粒徑分布圖(b)。具體實施方式下面結合附圖和實施例對本發明做進一步說明。本發明實施例采用的peicl的結構式如式ⅰ所示,其中,x、y、z為非負整數,且x、y和z均不為零;本發明實施例1-4、6-17采用的磷酸-聚乙二醇為單磷酸聚乙二醇,所述單磷酸聚乙二醇的結構式如式ⅱ所示,其中,n為非負整數,且不為零,實施例1無聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒的制備本發明一實施例提供了一種無聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒的制備方法,包括如下步驟:(1)將10μldna溶液(0.5μg/μl),與10μlpei25k陽離子聚合物溶液(1.3μg/μl)混合均勻,孵育30分鐘;然后,加入80μl氯化鈣溶液(500mm,ph10.0),用移液槍吹打使之混合均勻后,在攪拌下滴加到5ml有機相(有機相為環己烷與聚乙二醇壬基苯基醚520(igepalco-520)按體積比7/3混合制得)中,攪拌1h形成微乳液a;(2)將正硅酸乙酯(teos)在攪拌下滴加到步驟(1)所得的微乳液a中,攪拌一個小時形成微乳液b;(3)將100μl氯化鈣溶液(500mm,ph10.0)在攪拌下滴加到步驟(2)所得的微乳 液b中,攪拌18小時,得到微乳液c;用旋轉蒸發儀蒸發除去微乳液c中的環己烷,再在14000g下離心15分鐘,用無水乙醇洗三次,在水中分散即得到硅酸鈣-微環dna納米顆粒。1、粒徑測定:將本發明實施例所制得的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒用1ml雙蒸水溶解后,超聲30s后,采用透射電鏡觀察顆粒,以及用馬爾文動態光散射粒徑儀上測定顆粒粒徑;測定結果如表1所示。2、載藥量的測定:稱取1mg步驟(4)所得的硅酸鈣-微環dna納米顆粒,在900℃附近的重量損失,計算得到藥物的裝載量,所用升溫速率為10℃/min,所用氣氛為流動空氣氣氛;載藥量=dna的質量/納米顆粒的總質量。實驗結果:(1)本發明實施例所制備的無聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒的平均粒徑為20.36nm;(2)本發明實施例所制備的無聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒的載藥量為0.102。實施例2聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒的制備本發明一實施例提供了一種聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒的制備方法,包括如下步驟:(1)將10μldna溶液(0.5μg/μl),與10μl聚乙烯亞胺(pei25k)溶液(1.3μg/μl)混合均勻,孵育30分鐘;再加入80μl氯化鈣溶液(500mm,ph10.0),用移液槍使之混合均勻后,在攪拌下滴加到5ml有機相(有機相為環己烷與聚乙二醇壬基苯基醚520(igepalco-520)按體積比7/3混合制得)中,攪拌一個小時形成微乳液a;(2)將500μl正硅酸乙酯(teos)在攪拌下滴加到步驟(1)所得的微乳液a中,攪拌4小時后,將在攪拌下滴加入10μl氯化鈣溶液(500mm,ph10.0),攪拌18小時,得到微乳液b;(3)將15μl磷酸-peg(磷酸-peg的分子量為2000道爾頓)水溶液(100μg/μl)滴加入步驟(2)所得的微乳液b中,攪拌4小時,得到微乳液c;(4)用旋轉蒸發儀蒸發除去微乳液c中的環己烷,再在14000g下離心15分鐘,用無水乙醇洗三次,高純水洗兩次,在水中分散即得到聚乙二醇(peg)-硅酸鈣-微環dna納 米顆粒。1、粒徑測定:將本發明實施例所制得的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒用1ml雙蒸水溶解后,超聲30s后,采用透射電鏡觀察顆粒,以及用馬爾文動態光散射粒徑儀上測定顆粒粒徑。2、轉染實驗,包括如下步驟:將人腎上皮細胞系細胞(293t)經復蘇、培養,轉染前以每孔104個細胞分別均勻接種于96孔板,用含10%胎牛血清的dmem培養基培養,細胞達到70%~80%融合后,換取40μl的不含fbs的空白培養基,37℃,5%co2孵育2~6小時,分別依次加入10μl步驟(5)所得的聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒(每孔含0.5μgdna),用移液器輕柔上下吹吸混合均勻,在37℃,5%co2條件下孵育6小時后,用含10%胎牛血清的培養基換液,在37℃,5%co2條件下繼續培養,每隔24小時,用倒置熒光顯微鏡觀察細胞內表達的綠色熒光蛋白(gfp)。3、載藥量的測定:稱取1mg步驟(4)所得的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒,在900℃附近的重量損失,計算得到藥物的裝載量,所用升溫速率為10℃/min,所用氣氛為流動空氣氣氛;載藥量=dna的質量/納米顆粒的總質量。實驗結果:(1)圖1-2是本發明實施例所制得的磷酸-peg修飾的硅酸鈣-微環dna納米顆粒透射電子顯微鏡(tem)照片(圖1)和粒徑分布圖(圖2)。如圖1所示,本發明實施例所制得的磷酸-peg修飾的硅酸鈣-微環dna納米顆粒的粒徑為20~30nm。如圖2所示,本發明實施例所制得的磷酸-peg修飾的硅酸鈣-微環dna納米顆粒的平均粒徑為23.90nm。(2)圖3是本發明實施例提供的磷酸-peg修飾的硅酸鈣-微環dna(egfp)納米顆粒與293t細胞株體外共培養的熒光(a)和白光(b)圖片。從圖3可以看出,實施例2步驟(5)所得的聚乙二醇(peg)修飾的硅酸鈣-微環dna納米顆粒對293t細胞有一定的轉染效果。(3)本發明實施例所制得的磷酸-peg修飾的硅酸鈣-微環dna納米顆粒的載藥量為0.275。實施例3-4為了進一步說明本發明的有益效果,重復實施例2的實驗步驟,將實施例2中步驟(1)-(4)中各藥品的濃度和體積分別替換成如表1實施例3所示的各藥品的濃度和體積,得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒。為了進一步說明本發明的有益效果,重復實施例2的實驗步驟,將實施例2中步驟(1)-(4)中各藥品的濃度和體積分別替換成如表3實施例4所示的各藥品的濃度和體積,得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒。為了進一步說明本發明的有益效果,重復實施例2的步驟,將實施例2中步驟(2)中的正硅酸乙酯(teos)替換成硅酸鈉溶液,所述硅酸鈉溶液(ph9.0)的濃度為500mm,體積為100ul,得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒。按照實施例2的粒徑測定方法和載藥量測定方法,分別測得實施例3-5所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑和載藥量。實驗結果:(1)實施例3-4所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑分別為20.4、85.6nm。(2)實施例3-4所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的載藥量分別為0.05、0.85。表3實施例3-4各步驟所用藥品的用量注:表3中“\”表示該表格中不需要提供相關信息。實施例5為了進一步說明本發明的有益效果,重復實施例2的步驟,將實施例2中步驟(2)中的正硅酸乙酯(teos)替換成硅酸鈉溶液,所述硅酸鈉溶液(ph9.0)的濃度為500mm,體積為100ul,將實施例2中步驟(3)中的磷酸-聚乙二醇替換成雙磷酸聚乙二醇,得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒;其中,所述雙磷酸聚乙二醇的結構式如式ⅲ所示,n為非負整數,且不為零,按照實施例2的粒徑測定方法和載藥量測定方法,測得本實施例所得的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑和載藥量。實驗結果:(1)本發明實施例所得的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑分別為37.7nm。(2)本發明實施例所得的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的載藥量分別為0.366。實施例6-7氮磷(n/p)比對粒徑和載藥量的影響為了進一步說明本發明的有益效果,進一步探討聚乙烯亞胺陽離子聚合物與dna的氮磷(n/p)比對聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒粒徑的影響,重復實施例2的實驗步驟,將實施例2中步驟(1)中10ulpei25k溶液(1.3μg/ul)替換成5ulpei25k溶液(1.3μg/ul)(如表4中實施例6所示),得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒。為了進一步說明本發明的有益效果,進一步探討聚乙烯亞胺陽離子聚合物與dna的氮磷(n/p)比對聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒粒徑的影響,重復實施例2的實驗步驟,將實施例2中步驟(1)中10ulpei25k溶液(1.3μg/ul)替換成1ulpei25k溶液(1.3μg/ul)(如表4中實施例7所示),得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒,獲得所述納米顆粒的粒徑。按照實施例2的粒徑測定方法和載藥量測定方法,分別測得實施例6和實施例7所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑和載藥量。實驗結果:(1)測定結果如表4所示,本發明實施例2、6、7所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑分別為23.90、110.23、1040.50nm,隨著氮磷比(即n/p,所述聚乙烯亞胺的氨基的摩爾數與所述dna的磷酸根的摩爾數的比)的增大,聚乙烯亞胺壓縮dna大分子的效果更加明顯,pei與dna的混合物為礦化硅酸鈣提供軟模板作用,因此,形成的聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑減小。(2)如表4所示,本發明實施例2、6、7所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的載藥量分別為0.275、0.305、0.224,這說明所述的氮磷比對載藥量影響不大。表4氮磷(n/p)比對粒徑和載藥量的影響實施例8-9有機相用量對粒徑和載藥量的影響為了進一步說明本發明的有益效果,進一步探討有機相用量對聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒粒徑的影響,重復實施例2的實驗步驟,將實施例2中步驟(1)中5ml有機相替換成2.5ml有機相(如表5中實施例8所示),得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒。為了進一步說明本發明的有益效果,進一步探討有機相用量對聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒粒徑的影響,重復實施例2的實驗步驟,將實施例2中步驟(1)中5ml 有機相替換成1ml有機相(如表5中實施例9所示),得到聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒。按照實施例2的粒徑測定方法和載藥量測定方法,分別測得實施例6和實施例7所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑和載藥量。實驗結果:(1)如表5所示,實施例2、8、9所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的平均粒徑分別為23.90、175.11、788.52nm;隨著有機相體積減小(水相體積相對增大),反應過程所形成的微乳液中水滴半徑增大,產物粒徑隨著增大。(2)如表5所示,本發明實施例2、8、9所得聚乙二醇(peg)-硅酸鈣-微環dna納米顆粒的載藥量相差不大,分別為0.275、0.314;而本發明實施例9中,這是由于有機相的體積過小(即,水相體積過大)導致所制備的產物在收集過程中被包載的藥物滲漏,使得載藥量減少,為0.102。表5有機相用量對粒徑和載藥量的影響實施例有機相的體積/ml平均粒徑/nm載藥量例2523.900.245例82.5175.110.314例91788.520.102實施例10聚乙二醇(peg)修飾的硅酸鈣包裹鈣黃綠素納米顆粒的制備本發明一實施例提供了一種聚乙二醇(peg)修飾的硅酸鈣包裹鈣黃綠素納米顆粒的制備方法,包括如下步驟:(1)取5μl鈣黃綠素溶液(飽和水溶液),與100μl氯化鈣溶液(氯化鈣濃度為500mm,ph10.0)混合均勻;將上述混合溶液在攪拌下滴加到5ml有機相(有機相為環己烷與聚乙二醇壬基苯基醚520(igepalco-520)按體積比7/3混合制得)中,攪拌1h形成微乳液a;(2)將10μl正硅酸乙酯(teos)步驟(1)所得的微乳液a中,攪拌4小時后,在攪拌下滴加80μl氯化鈣溶液(氯化鈣濃度為500mm,ph10.0),攪拌18小時,得到微乳液b;(3)將15μl(100μg/μl)磷酸-peg水溶液滴加入微步驟(2)所得的微乳液b中,攪拌4小時得到微乳液c;(4)用旋轉蒸發儀蒸發除去微步驟(3)所得的微乳液c中的環己烷,再在14000g 下離心15分鐘,用無水乙醇洗三次,高純水洗兩次,再在水中分散即得到聚乙二醇(peg)-硅酸鈣-鈣黃綠素納米顆粒。按照實施例2中的粒徑和載藥量的測定方法測試步驟(4)所得的聚乙二醇(peg)-硅酸鈣-鈣黃綠素納米顆粒的粒徑和載藥量。實驗結果:(1)粒徑:圖4是本發明實施例提供的聚乙二醇(peg)修飾的硅酸鈣包裹鈣黃綠素形成的納米顆粒的透射電子顯微鏡(tem)照片(a)和粒徑分布圖(b)。如圖4(a)所示,本發明實施例所制得的聚乙二醇(peg)修飾的硅酸鈣包裹鈣黃綠素形成的納米顆粒的粒徑為30~40nm。如圖4(b)所示,本發明實施例所制得的聚乙二醇(peg)修飾的硅酸鈣包裹鈣黃綠素形成的納米顆粒的平均粒徑為34.1nm。(2)載藥量:本發明實施例所制得的聚乙二醇(peg)修飾的硅酸鈣包裹鈣黃綠素形成的納米顆粒的載藥量為0.112。實施例11聚乙二醇(peg)修飾的硅酸鈣包裹鈣ir820染料納米顆粒的制備本發明一實施例提供了一種聚乙二醇(peg)修飾的硅酸鈣包裹鈣ir820染料納米顆粒的制備方法,包括如下步驟:(1)取5μl(1μg/μl)ir820水溶液,與100μl氯化鈣溶液(500mm,ph10.0)混合均勻;將上述混合溶液在攪拌下滴加到5ml有機相(有機相為環己烷與聚乙二醇壬基苯基醚520(igepalco-520)按體積比7/3混合制得)中,攪拌一個小時形成微乳液a;(2)將100μl正硅酸乙酯(teos)步驟(1)所得的微乳液a中,攪拌4小時后,在攪拌下滴加入80μl氯化鈣溶液(500mm,ph10.0),攪拌18小時,得到微乳液b;(3)將1μl磷酸-聚乙二醇(peg)水溶液(10μg/μl)滴加入步驟(2)所得的微乳液b中,攪拌4小時,得到微乳液c;(4)用旋轉蒸發儀蒸發除去步驟(3)所得的微乳液c中的環己烷,再在14000g下離心至少15分鐘,用無水乙醇洗三次,高純水洗兩次,再在水中分散即得到聚乙二醇(peg)-硅酸鈣-ir820納米顆粒。按照實施例2中的粒徑和載藥量的測定方法測試步驟(4)所得的聚乙二醇(peg)-硅酸鈣-鈣黃綠素納米顆粒的粒徑和載藥量。實驗結果:(1)粒徑:圖5是本發明實施例提供的聚乙二醇(peg)修飾的硅酸鈣包裹ir820染料形成的納米顆粒的透射電子顯微鏡(tem)照片(a)和粒徑分布圖(b)。如圖5(a)所示,本發明實施例所制得的聚乙二醇(peg)修飾的硅酸鈣包裹ir820染料形成的納米顆粒的粒徑為30~40nm。如圖5(b)所示,本發明實施例所制得的聚乙二醇(peg)修飾的硅酸鈣包裹ir820染料形成的納米顆粒的平均粒徑為31.1nm。(2)載藥量:本發明實施例所制得的聚乙二醇(peg)修飾的硅酸鈣包裹ir820染料形成的納米顆粒的載藥量為0.144。實施例12-13磷酸-聚乙二醇(peg)修飾的磷酸鈣-微環dna-納米顆粒的制備本發明實施例12提供了一種磷酸-聚乙二醇(peg)修飾的硅酸鈣-微環dna-納米顆粒的制備方法,包括如下步驟:(1)將5μldna溶液(1μg/μl),與5μlpeicl34k陽離子聚合物溶液(3.8μg/μl)混合均勻,孵育30分鐘;再加入90μl氯化鈣溶液(100mm,ph9.0),用移液槍使之混合均勻后;在攪拌下滴加到5ml有機相(有機相為環己烷與聚乙二醇壬基苯基醚520(igepalco-520)按體積比7/3混合制得)中,攪拌一個小時形成微乳液a;(2)將100μl磷酸氫二鈉溶液(100mm,ph9.0)在攪拌下滴加到5ml有機相(有機相為環己烷與聚乙二醇壬基苯基醚520(igepalco-520)按體積比7/3混合制得)中,攪拌一個小時后,在攪拌下滴加到步驟(1)所得的微乳液a中,攪拌4小時后,在攪拌下滴加入20μl氯化鈣溶液(100mm,ph9.0),攪拌18小時得到微乳液b;(3)將20μl磷酸-聚乙二醇(1μg/μl)水溶液在攪拌下滴加到步驟(2)所得的微乳液b中,攪拌4小時,得到微乳液c;(4)用旋轉蒸發儀蒸發除去微乳液c中的環己烷,再在14000g下離心15分鐘,用無水乙醇洗三次,高純水洗兩次,在水中分散即得到聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒,得到的溶液呈淡黃褐色。為了進一步說明本發明的有益效果,重復上述實驗步驟(1)-(4),將所述的步驟(1)-(4)中各藥品的濃度和體積分別替換成如表6所示的各藥品的濃度和體積,得到聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒。表6實施例13各步驟所用藥品的用量注:表6中“\”表示該表格中不需要提供相關信息。按照實施例2的粒徑和載藥量的測定方法測試步驟(4)所得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的粒徑和載藥量。實驗結果:(1)本發明實施例12、13所制得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的平均粒徑分別為21.44、35.23nm。(2)本發明實施例所制得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的載藥量分別為0.235、0.344。實施例14-15磷酸-聚乙二醇(peg)修飾的檸檬酸鈣-dna納米顆粒的制備實施例14為重復實施例12的實驗步驟(1)-(4),將實施例12的實驗步驟(2)中的磷酸氫二鈉溶液(ph9.0)替換成檸檬酸鈉溶液(ph11.5),獲得磷酸-聚乙二醇(peg)修飾的檸檬酸鈣-dna納米顆粒。實施例15為重復實施例13的實驗步驟,將實施例13中的磷酸氫二鈉溶液(ph9.0)替換成檸檬酸鈉溶液(ph11.5),獲得磷酸-聚乙二醇(peg)修飾的檸檬酸鈣-dna納米顆粒。按照實施例2的粒徑和載藥量的測定方法測試實施例14和15所得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的粒徑和載藥量。實驗結果:(1)本發明實施例14和15所制得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒 的平均粒徑分別為30.40、29.25nm。(2)本發明實施例14和15所制得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的載藥量分別為0.307、0.115。實施例16-17磷酸(peg)修飾的碳酸鈣-dna納米顆粒實施例16為重復實施例12的實驗步驟(1)-(4),將實施例12的實驗步驟(2)中的磷酸氫二鈉溶液(ph9.0)替換成碳酸鈉溶液(ph11.5),獲得磷酸-聚乙二醇(peg)修飾的檸檬酸鈣-dna納米顆粒。實施例17為重復實施例13的實驗步驟,將實施例13中的磷酸氫二鈉溶液(ph9.0)分別替換成碳酸鈉溶液(ph11.5),獲得磷酸-聚乙二醇(peg)修飾的檸檬酸鈣-dna納米顆粒。按照實施例2的粒徑和載藥量的測定方法測試實施例16和17所得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的粒徑和載藥量。實驗結果:(1)本發明實施例所制得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的平均粒徑分別為30.12、38.55nm。(2)載藥量:本發明實施例所制得的聚乙二醇(peg)-磷酸鈣-微環dna納米顆粒的載藥量分別為0.785、0.256。以上所述,僅為本發明較佳的具體實施方式,但本發明的保護范圍并不局限于此,任何熟悉本
技術領域:
的技術人員在本發明揭露的技術范圍內,根據本發明的技術方案及其發明構思加以等同替換或改變,都應涵蓋在本發明的保護范圍之內。當前第1頁12
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1