一種靶向熒光載藥納米分子探針及其制備方法和應用與流程
本發明屬于納米材料
技術領域:
,涉及一種靶向熒光載藥納米分子探針及其制備方法和應用。
背景技術:
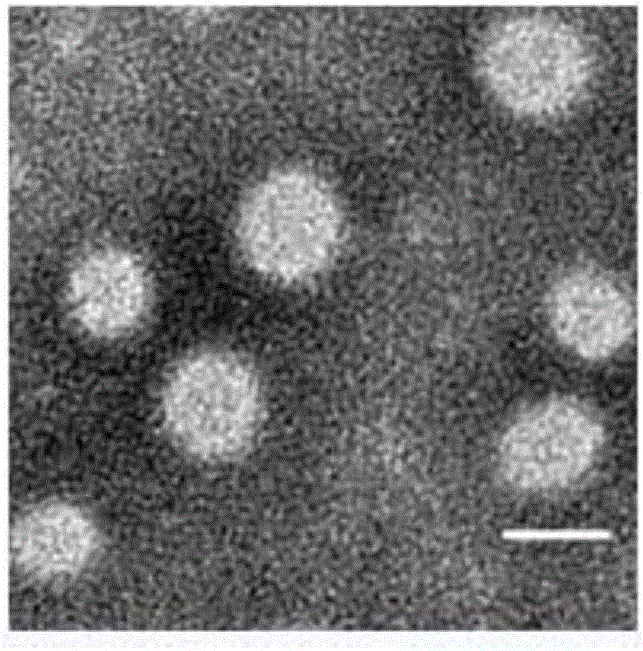
:動脈粥樣硬化的發生發展是一個復雜的多因素參與的血管壁炎癥過程。其中平滑肌細胞的遷移、表型轉換、凋亡等行為對動脈硬化的進程發揮了巨大作用。近年來,對PPAR(過氧化物酶體增殖物激活受體)類激動劑的研究對防治產生動脈硬化斑塊發揮了巨大作用,其中新型的PPAR-δ激動劑具有抑制動脈硬化斑塊微環境導致的平滑肌細胞的增殖、遷移與凋亡的作用,但其目前仍然存在一些弊端如較強的疏水性、半衰期較短等限制了其應用。由于PPAR-δ不具有靶向性,除了對動脈粥樣硬化起到治療作用外,還具有降血糖效應,因此對于血糖正常的動脈硬化患者是不利的。在現階段的生物醫學研究中,人們常常需要把PPAR-δ的激動劑溶于DMSO中去治療相應的疾病,然而現有的方法沒有靶向性,常常帶來對人體不利的藥物小分子其他效應,而且DMSO的毒性也限制了其應用,無法滿足科學研究的需求。CN105833299A公開了用于動脈粥樣硬化易損斑塊診斷的MRI/optical雙模態納米探針的制備方法,所述納米探針由OPN(骨橋蛋白)抗體和二巰基丁二酸修飾的磁性四氧化三鐵納米顆粒縮合而成,OPN抗體的活性氨基與納米顆粒表面DMSA的活性羧基通過縮合反應穩定連接。其可以提高診斷的敏感性和特異性。然而該納米探針只是一種診斷探針,對于動脈粥樣硬化的治療作用并不明顯。因此,在本領域中,期望得到一種可以具有診斷和治療雙重作用的納米分子探針。技術實現要素:針對現有技術的不足,本發明的目的在于提供一種靶向熒光載藥納米分子探針及其制備方法和應用。為達此目的,本發明采用以下技術方案:一方面,本發明提供一種靶向熒光載藥納米分子探針,所述靶向熒光載藥納米分子探針為由連接有靶向分子的載體包裹抗動脈粥樣硬化的小分子激動劑和熒光染料形成的納米顆粒,所述靶向分子為骨橋蛋白(OPN)單克隆抗體。在本發明中,所述靶向熒光載藥納米分子探針中骨橋蛋白單克隆抗體可以靶向于動脈硬化斑塊中平滑肌細胞高表達的骨橋蛋白,被細胞吞噬后,所述納米分子探針在細胞內具有緩慢降解的作用,是一種能夠用于動脈硬化疾病模型以特定細胞為靶點的載藥納米分子探針。在本發明中,所述載體為兩親性聚合物,優選馬來酰亞胺修飾的聚己內酯-聚乙二醇(PCL-PEG-MAL)。在本發明中,如果利用馬來酰亞胺修飾的其他兩親性聚合物例如DSPE-PEG、PLGA-PEG或PDLLA-PEG,雖然能夠與骨橋蛋白單克隆抗體連接,但是用這樣的載體材料會使得形成的納米膠束不夠穩定。優選地,所述抗動脈粥樣硬化的小分子激動劑為PPARδ激動劑(例如GW501516)、肝孤核受體激動劑(LXR激動劑)、SIRT1激動劑(Sirtuin1)、IP6K激動劑或大麻素受體激動劑中的任意一種或至少兩種的組合。這些小分子激動劑均具有較強的疏水性,只能溶于DMSO等有機溶劑中,而不溶于水中,使得其在體內循環時不穩定難以到達靶標部位,而運用本發明的納米分子探針可以成功解決疏水性小分子激動劑的溶解問題以及在體內循環的穩定性問題,提高藥物的生物利用度以及治療效果。優選地,所述熒光染料為近紅外波段熒光染料,優選N-羥基琥珀酰亞胺酯(Cy5.5)。包裹在本發明所述膠束中的熒光染料可以對該靶向熒光載藥納米分子探針進行視蹤,觀察期達到動物模型的部位。本發明所述靶向熒光載藥納米探針不但具有靶向性,而且有無毒性,穩定性強,較高的載藥量等優點,載藥量最高可達8.2%左右。優選地,所述靶向分子與載體的連接使通過化學鍵連接,優選酰胺鍵、酯鍵或醚鍵,進一步優選硫醚鍵。當然,也包括其他共價鍵連接類型。優選地,本發明所述靶向熒光載藥納米分子探針中所述靶向分子通過巰基與載體上的馬來酰亞胺反應連接來實現靶向分子和載體高效、穩定連接,且兩部分功能不會產生干擾。另一方面,本發明提供了如上所述靶向熒光載藥納米分子探針的制備方法,所述方法包括以下步驟:(1)利用兩親性聚合物作為載體,包裹治療動脈硬化的小分子激動劑和熒光染料得到納米膠束;(2)步驟(1)得到的納米膠束與骨橋蛋白單克隆抗體連接得到所述靶向熒光載藥納米分子探針。本發明采用納米共沉淀法來制備得到靶向熒光載藥納米分子探針,由于所述靶向熒光載藥納米分子探針的所述特征結構使得其只有通過納米共沉淀法才能形成高載藥量粒徑均一穩定的靶向納米膠束體系,如果像其他聚合物納米膠束一樣,利用乳化法和旋膜超聲法制備,則會使得體系不夠穩定,不能成功包裹藥物和熒光染料得到本發明所述靶向熒光載藥納米分子探針。作為本發明的優選技術方案,所述靶向熒光載藥納米分子探針的制備方法具體包括以下步驟:I、將馬來酰亞胺修飾的PCL-PEG、治療動脈硬化的小分子激動劑以及熒光染料溶于揮發性有機溶劑中,將其逐滴滴加至水中,攪拌,待有機溶劑揮發后,得到納米膠束;II、步驟(1)得到的納米膠束與二硫鍵被還原成巰基的骨橋蛋白單克隆抗體反應,得到所述靶向熒光載藥納米分子探針。優選地,相對于10mg步驟I所述馬來酰亞胺修飾的PCL-PEG,所述治療動脈硬化的小分子激動劑的用量為1-3mg,例如1mg、1.3mg、1.5mg、1.8mg、2mg、2.3mg、2.5mg、2.8mg或3mg。優選地,相對于10mg步驟I所述馬來酰亞胺修飾的PCL-PEG,所述熒光染料的用量為5-30μg,例如5μg、6μg、8μg、10μg、12μg、14μg、16μg、18μg、20μg、22μg、24μg、26μg、28μg或30μg。優選地,相對于10mg步驟I所述馬來酰亞胺修飾的PCL-PEG,所述揮發性有機溶劑的用量為200-500μL,例如200μL、250μL、300μL、350μL、400μL、450μL或500μL。有機溶劑或多或少會具有一定毒性,因此用量不易過多。優選地,步驟I所述揮發性有機溶劑為四氫呋喃。優選地,相對于10mg步驟I所述馬來酰亞胺修飾的PCL-PEG,所述水的用量為2-5mL,例如2mL、2.5mL、3mL、3.5mL、4mL、4.5mL或5mL。優選地,所述水為超純水。優選地,步驟I所述攪拌在避光條件下進行。步驟II所述二硫鍵被還原成巰基的骨橋蛋白單克隆抗體與馬來酰亞胺修飾的PCL-PEG的摩爾數之比為(50-1000):1,例如50:1、60:1、80:1、100:1、120:1、150:1、200:1、250:1、300:1、500:1、700:1、900:1或1000:1,優選(80-300):1。優選地,步驟II所述還原時的還原劑為2-巰基乙胺(2-MEA)。即利用2-巰基乙胺作為還原劑將骨橋蛋白單克隆抗體中的二硫鍵還原成巰基。將骨橋蛋白單克隆抗體中的二硫鍵還原成巰基時,當抗體量少于1ml時,將6mg的2-MEA溶于100μl反應液中,每10μl的抗體量對應1μl的反應體系。反應液中且必須含有(1-10)mM(例如1mM、2mM、3mM、4mM、5mM、6mM、7mM、8mM、9mM或10mM)EDTA。優選地,步驟II所述反應的條件為在pH7.4環境下常溫攪拌6-12h,例如6h、7h、8h、9h、10h、11h或12h。在本發明中,步驟II所述反應結束時,利用葡萄凝膠柱對產物進行分離純化得到靶向熒光載藥納米分子探針。另一方面,本發明提供如上所述靶向熒光載藥納米分子探針在制備治療動脈硬化的藥物中的應用。相對于現有技術,本發明具有以下有益效果:本發明的靶向熒光載藥納米分子探針可以特異性地靶向于動脈粥樣硬化中平滑肌細胞,形成的納米膠束體系穩定性好,被細胞吞噬后,所述納米分子探針在細胞內具有緩慢降解的作用,有望成為一種良好的可用于診斷治療動脈粥樣硬化的納米分子探針,可應用于生物或醫學研究中。并且本發明所述熒光分子探針的制備方法簡單易行,不涉及復雜的操作和苛刻條件,并且成本較低,穩定性好。附圖說明圖1為本發明的靶向熒光載藥納米探針的納米膠束結構模式圖,其中星形符號代表近紅外熒光物質Cy5.5,圓形代表藥物小分子GW501516即PPARδ的激動劑,外周連接的矩形代表OPN抗體。圖2為本發明實施例1制備的靶向熒光載藥納米分子探針形成的納米膠束的透射電鏡圖;圖中標尺為100nm。圖3為本發明實施例1制備的靶向熒光載藥納米分子探針形成的納米體系的水合粒徑分布圖。圖4為本發明實施例1制備的靶向熒光載藥納米分子探針形成的納米體系的Zeta電位圖。圖5為本發明實施例1中PCL-PEG構成的納米膠束在連接OPN抗體前后的紫外吸收峰的變化圖。圖6為利用本發明制備得到的靶向熒光載藥納米分子探針對動脈粥樣硬化體外模型平滑肌細胞后的單光子激光共聚焦顯微鏡圖。圖7為流式細胞技術測定的本發明的靶向熒光載藥納米分子探針Anti-OPN-PCL-PEG-GW501516與未連接靶向分子的納米膠束PCL-PEG-GW501516以及空白對照組(PBS緩沖溶液組)對動脈粥樣硬化體外模型平滑肌細胞的熒光強度對比圖。第一個峰為對照,第二個峰為被動靶向組(無連接OPN抗體),第三個為主動靶向熒光納米膠束組。圖8為流式細胞技術測定的本發明的靶向熒光載藥納米分子探針Anti-OPN-PCL-PEG-GW501516與未連接靶向分子的納米膠束PCL-PEG-GW501516的平均熒光強度定量結果圖。圖9為利用ox-LDL、GW501516(PPARδ的激動劑)、OPN-NPs-GW501516(即OPN-PCL-PEG-GW501516)以及NPs-GW501516(即PCL-PEG-GW501516)和ox-LDL-NPs(即ox-LDL-PCL-PEG)孵育平滑肌細胞后,細胞的MMP2和MMP9以及β-肌動蛋白(β-actin)表達量比較圖。圖10為ox-LDL、GW501516、OPN-NPs-GW501516(即OPN-PCL-PEG-GW501516)以及NPs-GW501516(即PCL-PEG-GW501516)和ox-LDL-NPs(即ox-LDL-PCL-PEG)孵育后的平滑肌細胞的流式細胞儀測定結果圖。圖11為本發明的靶向熒光載藥納米分子探針Anti-OPN-Cy5.5-NPs(Anti-OPN-Cy5.5-PCL-PEG-GW501516)與未連接靶向分子的納米膠束Cy5.5-NPs(Cy5.5-PCL-PEG-GW501516)對小鼠的動脈粥樣硬化模型在活體內的熒光成像圖。圖12為對比例1-3制備得到的納米體系OPN-DSPE-PEG-PPARδ、OPN-DSPE-PEG-PPARδ和OPN-PLGA-PEG-PPARδ與實施例1制備得到的納米體系OPN-PCL-PEG-PPARδ的體系穩定性對比圖。具體實施方式下面通過具體實施方式來進一步說明本發明的技術方案。本領域技術人員應該明了,所述實施例僅僅是幫助理解本發明,不應視為對本發明的具體限制。以下實施例中所用材料的來源:骨橋蛋白(OPN)單克隆抗體購自abcam(美國)公司,2-Mercaptoethylamine·HCl(2-MEA)購自Thermoscifntific(美國)公司,聚乙二醇(PEG)及聚己內酯(PCL)和熒光染料Cy5.5均購自西安瑞禧有限公司,四氫呋喃購自北京化工有限公司,整個實驗使用的超純水采用密理博公司的Milli-Q三蒸水(18.2MΩ·cm,MilliporeSystemInc.)。實施例1在本實施例中,通過以下方法制備得到靶向熒光載藥納米分子探針,制備方法具體包括以下步驟:I、將10mg馬來酰亞胺修飾的PCL-PEG、1mg治療動脈硬化的小分子激動劑PPARδ(GW501516)以及10μg熒光染料Cy5.5溶于500μL四氫呋喃中,將其逐滴滴加至5mL超純水中,攪拌24h,得到納米膠束;II、利用2-巰基乙胺作為還原劑將20μl骨橋蛋白單克隆抗體(OPN)中的二硫鍵還原成巰基,而后步驟(1)得到的納米膠束與二硫鍵被還原成巰基的骨橋蛋白單克隆抗體在pH7.4環境下常溫攪拌12h,其中所用骨橋蛋白單克隆抗體與馬來酰亞胺修飾的PCL-PEG的摩爾量之比為50:1,得到所述靶向熒光載藥納米分子探針,得到的該靶向熒光載藥納米分子探針的載藥量為7.1%。圖1為制備得到的靶向熒光載藥納米探針的納米膠束結構模式圖。利用電鏡對制備得到的納米體系進行表征,結果如圖2所示,其體系中粒徑大約為70-100nm,粒徑均一,呈單分散。利用動態光散射儀對得到的納米體系進行表征,其水合粒徑分布圖如圖3所示,其Zeta電位圖如圖4所示,其水合粒徑分布數據以及Zeta電位數據(ZP)如表1所示。表1粒徑(nm)PDIZP(mV)PCL-PEG-GW501516115.0±2.750.133±0.073.8±0.24OPN-PCL-PEG-GW501516142.5±3.060.159±0.04-18.1±0.46表1中PDI表示多分散指數。由圖3、圖4以及表1的數據可知,水合粒徑在120nm左右,Zeta電位在-18mv,本身PCL-PEG不帶電,膠束連接抗體后,Zeta電位變為負值,間接證明連接抗體成功。由圖5可知,PCL-PEG納米膠束連接OPN抗體后成功后在280nm有吸收峰,同樣證明連接抗體成功。實施例2在本實施例中,通過以下方法制備得到靶向熒光載藥納米分子探針,制備方法具體包括以下步驟:I、將10mg馬來酰亞胺修飾的PCL-PEG、3mg治療動脈硬化的小分子激動劑PPARδ以及30μg熒光染料Cy5.5溶于200μL四氫呋喃中,將其逐滴滴加至2mL超純水中,攪拌24h,得到納米膠束;II、利用2-巰基乙胺作為還原劑將20μl骨橋蛋白單克隆抗體中的二硫鍵還原成巰基,而后步驟(1)得到的納米膠束與二硫鍵被還原成巰基的骨橋蛋白單克隆抗體在pH7.4環境下常溫攪拌10h,其中所用骨橋蛋白單克隆抗體與馬來酰亞胺修飾的PCL-PEG的摩爾量之比為80:1,得到所述靶向熒光載藥納米分子探針,得到的該靶向熒光載藥納米分子探針的載藥量為8.2%。實施例3在本實施例中,通過以下方法制備得到靶向熒光載藥納米分子探針,制備方法具體包括以下步驟:I、將10mg馬來酰亞胺修飾的PCL-PEG、2mg治療動脈硬化的小分子激動劑PPARδ以及5μg熒光染料Cy5.5溶于200μL四氫呋喃中,將其逐滴滴加至3mL超純水中,攪拌24h,得到納米膠束;II、利用2-巰基乙胺作為還原劑將20μl骨橋蛋白單克隆抗體中的二硫鍵還原成巰基,而后步驟(1)得到的納米膠束與二硫鍵被還原成巰基的骨橋蛋白單克隆抗體在pH7.4環境下常溫攪拌8h,其中所用骨橋蛋白單克隆抗體與馬來酰亞胺修飾的PCL-PEG的摩爾量之比為100:1,得到所述靶向熒光載藥納米分子探針,得到的該靶向熒光載藥納米分子探針的載藥量為7.8%。實施例4在本實施例中,通過以下方法制備得到靶向熒光載藥納米分子探針,制備方法具體包括以下步驟:I、將10mg馬來酰亞胺修飾的PCL-PEG、3mg治療動脈硬化的小分子激動劑PPARδ以及10μg熒光染料Cy5.5溶于400μL四氫呋喃中,將其逐滴滴加至5mL超純水中,攪拌24h,得到納米膠束;II、利用2-巰基乙胺作為還原劑將20μl骨橋蛋白單克隆抗體中的二硫鍵還原成巰基,而后步驟(1)得到的納米膠束與二硫鍵被還原成巰基的骨橋蛋白單克隆抗體在pH7.4環境下常溫攪拌12h,其中所用骨橋蛋白單克隆抗體與馬來酰亞胺修飾的PCL-PEG的摩爾量之比為200:1,得到所述靶向熒光載藥納米分子探針,得到的該靶向熒光載藥納米分子探針的載藥量為7.6%。實施例5在本實施例中,通過以下方法制備得到靶向熒光載藥納米分子探針,制備方法具體包括以下步驟:I、將10mg馬來酰亞胺修飾的PCL-PEG、2mg治療動脈硬化的小分子激動劑PPARδ以及20μg熒光染料Cy5.5溶于400μL四氫呋喃中,將其逐滴滴加至5mL超純水中,攪拌24h,得到納米膠束;II、利用2-巰基乙胺作為還原劑將20μl骨橋蛋白單克隆抗體中的二硫鍵還原成巰基,而后步驟(1)得到的納米膠束與二硫鍵被還原成巰基的骨橋蛋白單克隆抗體在pH7.4環境下常溫攪拌12h,其中所用骨橋蛋白單克隆抗體與馬來酰亞胺修飾的PCL-PEG的摩爾量之比為500:1,得到所述靶向熒光載藥納米分子探針,得到的該靶向熒光載藥納米分子探針的載藥量為6.8%。實施例6以本實施例1制備得到的靶向熒光載藥納米分子探針在5μM濃度下孵育經氧化低密度脂蛋白(ox-LDL)刺激24h后的兔血管平滑肌細胞(VSMC)24h,在單光子激光共聚焦顯微鏡下成像,通過觀察靶向熒光載藥納米分子探針的熒光信號確定該探針在細胞中的位置和形態,結果如圖6所示,圖6顯示細胞內部的熒光信號,證明連接有OPN抗體的包載Cy5.5的納米膠束更容易被細胞吞噬。圖7為流式細胞測熒光強度圖,證明細胞對本發明的靶向熒光載藥納米分子探針Anti-OPN-PCL-PEG-GW501516與未連接靶向分子的納米膠束PCL-PEG-GW501516的吞噬能力不同,Anti-OPN-PCL-PEG-GW501516組細胞熒光強度高說明細胞更容易吞噬該靶向熒光探針。圖8為圖7的平均熒光強度定量圖,證明相同條件下,細胞更容易吞噬連接有骨橋蛋白單克隆抗體的主動靶向納米探針(Anti-OPN-GW501516-NPs),測得的熒光強度更高。結果表明:靶向熒光載藥納米分子探針標記的細胞胞漿中有出現Cy5.5熒光,說明靶向熒光載藥納米分子探針出現的位置與骨橋蛋白在細胞中表達的位置具有一致性,具有良好的標記特異性。細胞形態良好,靶向熒光載藥納米分子探針本身和標記過程不會對細胞產生毒性,適用于活細胞標記。平滑肌細胞經過氧化低密度脂蛋白遷移能力受到抑制。對利用ox-LDL、GW501516(PPARδ的激動劑)、OPN-NPs-GW501516(即OPN-PCL-PEG-GW501516)以及NPs-GW501516(即PCL-PEG-GW501516)和ox-LDL-NPs(即ox-LDL-PCL-PEG)孵育平滑肌細胞后,細胞的MMP2和MMP9表達量如圖9所示,結果表明,各種干預對ox-LDL孵育平滑肌細胞后MMP2和MMP9表達量的不同,MMP2和MMP9在動脈粥樣硬化斑塊里對平滑肌細胞(VSMC)遷移起到促進作用,促進斑塊發展,且具有增加斑塊的不穩定性。在主動靶向載藥納米膠束組OPN-NPs-PPARδ抑制MMP2,MMP9作用最強,優于被動靶向組及單純給藥組。圖10為利用流失細胞儀對ox-LDL、GW501516、OPN-NPs-GW501516(即OPN-PCL-PEG-GW501516)以及NPs-GW501516(即PCL-PEG-GW501516)和ox-LDL-NPs(即ox-LDL-PCL-PEG)孵育后的平滑肌細胞進行的測定,證明本發明的納米材料抑制此環境中平滑肌細胞凋亡的作用優于被動靶向組及單純給藥組。利用實施例2-5制備的靶向熒光載藥納米分子探針進行如上相同的試驗,得到了與實施例1的靶向熒光載藥納米分子探針相同的結果。實施例7在本實施例中,考察本發明的靶向熒光載藥納米分子探針在活體小鼠體內對動脈粥樣硬化的影響,考察方法為:利用活體成像儀,在動脈粥樣硬化模型的小鼠尾靜脈注射本發明的靶向熒光載藥納米分子探針Anti-OPN-Cy5.5-NPs(Anti-OPN-Cy5.5-PCL-PEG-GW501516)與未連接靶向分子的納米膠束Cy5.5-NPs(Cy5.5-PCL-PEG-GW501516)后,不同的時間點觀察是否有特異性光學信號變化。如圖11所示,說明動脈粥樣硬化模型的小鼠尾靜脈注射本發明的靶向熒光載藥納米分子探針Anti-OPN-Cy5.5-NPs后利用小動物活體成像儀,不同的時間點,動脈粥樣硬化斑塊的信號顯現,可以看出箭頭處信號是先增強后減弱,符合納米膠束在體內的代謝時間規律。動脈粥樣硬化模型小鼠尾靜脈注射未連接靶向分子的納米膠束Cy5.5-NPs后不同時間點測得小動物活體成像,都為非特異聚集,沒有箭頭處所標的特異斑塊的信號。后續動脈粥樣硬化小鼠分為6組,分別為持續給PBS組,單純給GW501516藥物小分子組,主動靶向納米藥物組(OPN-NPs-GW501516),被動靶向納米藥物組(NPs-GW501516),不包裹藥物小分子的空殼納米膠束組(NPs)每天給藥后,持續兩周后處死免疫組化觀察斑塊的治療效果。預期主動靶向納米藥物治療效果最佳,被動靶向組次之,單純給藥組治療效果不如前兩者。給PBS和空殼納米膠束組一樣基本上沒有治療效果。對比例1與實施例1不同之處在于,將實施例1中使用的馬來酰亞胺修飾的PCL-PEG替換為馬來酰亞胺修飾的脂酰乙醇胺-聚乙二醇(DSPE-PEG-MAL)。對比例2與實施例1不同之處在于,將實施例1中使用的馬來酰亞胺修飾的PCL-PEG替換為馬來酰亞胺修飾的聚乳酸-羥基乙酸-聚乙二醇(PLGA-PEG-MAL)。對比例3與實施例1不同之處在于,將實施例1中使用的馬來酰亞胺修飾的PCL-PEG替換為馬來酰亞胺修飾的D,L-聚乳酸-聚乙二醇(PDLLA-PEG-MAL)。對比例1-3制備的納米體系OPN-DSPE-PEG-PPARδ、OPN-DSPE-PEG-PPARδ和OPN-PLGA-PEG-PPARδ與實施例1制備得到的納米體系OPN-PCL-PEG-PPARδ的體系穩定性對比圖如圖12所示,利用納米沉淀法能成功包載PPARδ并連接OPN抗體形成的納米膠束的常規高分子材料的選擇上只有PCL-PEG比較成功適合,且OPN-PCL-PEG-PPARδ納米膠束穩定且丁達爾現象明顯,而其余常高分子如(DSPE-PEG,PLGA-PEG,PDLLA-PEG)形成的納米膠束過夜后均不穩定,出現沉淀。申請人聲明,本發明通過上述實施例來說明本發明的靶向熒光載藥納米分子探針及其制備方法和應用,但本發明并不局限于上述實施例,即不意味著本發明必須依賴上述實施例才能實施。所屬
技術領域:
的技術人員應該明了,對本發明的任何改進,對本發明產品各原料的等效替換及輔助成分的添加、具體方式的選擇等,均落在本發明的保護范圍和公開范圍之內。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1