一種紅毛五加皮提取物及制備方法和用途與流程
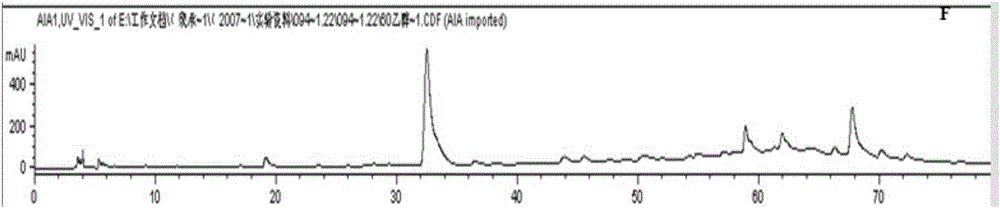
本發明涉及一種紅毛五加皮提取物及其制備方法和用途。
背景技術:
五加皮,始載于《神農本草經》,《本經》記載:“一名豺漆”,為五加最早的異名。《名醫別錄》所載:“一名豺節”。《圖經本草》載:“釀酒飲之,治風痹四肢攣急”。《本草綱目》云:“五加治風濕痿痹,壯筋骨,其功良深”。可見,歷代本草均將五加皮作為治療風濕痹痛的良藥,兼具滋補強壯之功效。全國五加皮藥用基原來自于五加屬多種植物的莖皮或根皮。
紅毛五加皮為五加科植物五加屬紅毛五加Acanthopanax giraldii Harms密生刺毛的干燥莖皮。有本草考證認為“豺漆”、“豺節”之名稱由來,是其原植物性狀的形象比喻,因其莖皮上密被類似豺毛的紅棕色刺毛。從現在全國使用的五加皮類藥材來看,最符合此性狀特征的當屬紅毛五加。《四川中藥志》言紅毛五加功效:“性溫,味辛,無毒。祛風濕,通關節,堅筋骨;治瘺痹、拘攣疼痛、風寒濕痹,足膝無力、皮膚風濕及陰痿囊濕。”用法為“作煎劑或酒劑”。與歷代本草記載的五加功效和用法相符。
紅毛五加已報道的化學成分已逾百種,主要屬于苷類、萜類、多糖、烷烴及有機酸類化合物,代表性的苷類成分包括紫丁香酚葡萄苷、刺五加苷B、D、E、胡蘿卜苷、鳥苷、腺苷、核苷,等。
現代藥理學研究認為,紅毛五加總苷部位具有明確的抗炎、鎮痛作用。
沈映君等對紅毛五加皮的藥理作用初步研究表明,紅毛五加對大鼠蛋清性或瓊脂性足跖腫脹及對小鼠因二甲苯或巴豆油所致的耳部炎癥抑制作用明顯,與紅毛五加皮祛風濕的傳統功效相符。現代研究表明,紅毛五加中的苷類成分為抗炎的主要活性成分。黨月蘭等研究證實紅毛五加總苷(TGA)具有抗急、慢性炎癥作用。
紅毛五加皮的總苷雖然效果優良,但其提取物中有效成分含量較低,若將其制備成方制劑,輔料用量較大,不利于工業生產成本的節約,且其服藥量較大,不便于患者使用。
若能提供一種有效成分含量較高、且藥效活性顯著的提取物,將會有利于上述藥物的推廣。
技術實現要素:
本發明的技術方案是提供了一種新的紅毛五加皮提取物及其制備方法和用途。
本發明紅毛五加皮提取物,它是紅毛五加皮的提取物,其HPLC指紋圖譜如圖2、圖3或者圖4所示,其中,HPLC指紋圖譜的色譜條件如下:色譜柱:以十八烷基硅烷鍵合硅膠作填充劑;檢測波長:207nm;流動相:以0.3%磷酸二氫鈉水溶液為流動相A,乙腈為流動相B,按如下程序進行梯度洗脫:從0分鐘開始至15分鐘,流動相B由2%變為6%,從15分鐘開始至25分鐘,流動相B由6%變為9%,從25分鐘開始至35分鐘,流動相B由9%變為13%,從45分鐘開始至60分鐘,流動相B由17%變為25%,從60分鐘開始至75分鐘,流動相B為25%。
其中,所述的紅毛五加皮為五加科植物五加屬紅毛五加Acanthopanax giraldii Harms密生刺毛的干燥莖皮。
本發明還提供了前述的紅毛五加皮提取物的方法,它包括如下步驟:
a、取紅毛五加皮,用6~15倍水煎煮提取2~4次,合并濾液,濃縮,去沉淀,得上清液;
b、取步驟c所得上清液,加于大孔吸附樹脂上,水洗,再用1~4倍柱體積20%~60%乙醇溶液洗脫至近無色,回收或揮去乙醇,干燥,即得。
步驟a中,用15倍水煎煮提取3次。
步驟b中,所述大孔吸附樹脂是非極性大孔樹脂或者中性大孔樹脂,優選D101大孔樹脂、AB-8大孔樹脂。
步驟b中,所述水洗的體積為1~4倍柱體積;所述乙醇溶液的用量為2~3倍柱體積;所述乙醇溶液是濃度為60%的乙醇溶液。
本發明還提供了前述紅毛五加皮提取物在制備抗炎和/或鎮痛的藥物中的用途。
本發明還提供了前述紅毛五加皮提取物在制備治療類風濕性關節炎的藥物中的用途。
本發明還提供了一種抗炎鎮痛的藥物組合物,它是含有有效量前述紅毛五加皮提取物為活性成分,加入藥學上可接受的輔料或輔助性成分制備而成的藥劑。
其中,所述的藥劑是口服制劑、注射制劑。
本發明紅毛五加皮提取物具有良好的抗炎鎮痛功效,且效果優于其他提取部位,進一步明確了紅毛五加皮抗炎鎮痛的有效部位,為制劑和藥品安全監控提供了保障。
顯然,根據本發明的上述內容,按照本領域的普通技術知識和慣用手段,在不脫離本發明上述基本技術思想前提下,還可以做出其它多種形式的修改、替換或變更。
以下通過實施例形式的具體實施方式,對本發明的上述內容再作進一步的詳細說明。但不應將此理解為本發明上述主題的范圍僅限于以下的實例。凡基于本發明上述內容所實現的技術均屬于本發明的范圍。
附圖說明
圖1對照品色譜圖,1、綠原酸對照品色譜峰;2、刺五加苷B色譜峰;3、刺五加苷E色譜峰
圖2本發明實施例1的提取物的色譜圖,1、綠原酸對照品色譜峰;2、刺五加苷B色譜峰;3、刺五加苷E色譜峰
圖3本發明實施例2的提取物的色譜圖,1、綠原酸對照品色譜峰;2、刺五加苷B色譜峰;3、刺五加苷E色譜峰
圖4本發明實施例3的提取物的色譜圖,1、綠原酸對照品色譜峰;2、刺五加苷B色譜峰;3、刺五加苷E色譜峰
具體實施方式
實施例1本發明紅毛五加皮提取物的制備
1、制備方法
稱取紅毛五加皮藥材4kg,水浸置過夜后,分別加入15倍量水煎煮3次(煎煮時間是30min),合并水煎液,加熱揮至小體積(濃縮至5000ml),濾去沉淀,上清液過D101大孔樹脂柱(大孔樹脂用量4kg,內徑15cm,柱長70cm),先用2倍柱體積(BV)蒸餾水洗去雜質,然后2BV 60%乙醇溶液洗脫,收集洗脫部位,回收乙醇,濃縮物經60℃噴霧干燥得黃棕色粉末,即為本發明紅毛五加皮提取物。
2、指紋圖譜分析
2.1分析方法
(1)色譜條件為:色譜柱為Hypersil ODS2C18柱(4.6mm×250mm,5μm,大連伊利特);柱溫:35℃;檢測波長:207nm。流動相條件:A:0.3%磷酸二氫鈉水溶液(加入磷酸調節pH約為3.5)-B:乙腈作為流動相的效果最好,色譜峰數目較多且峰形較好。梯度條件為:
紅毛五加HPLC梯度條件
(2)樣品制備方法:精密吸取洗脫部位的混懸液100μl,加乙醇900μl溶解,濾過,各精密吸取10μl,注入高效液相色譜儀分析。
(3)對照品:刺五加苷E、刺五加苷B均購自成都曼思特生物科技有限公司(供含量測定用,純度≥98%);綠原酸(中國藥品生物制品檢定所,批號110753-200413);齊墩果酸(中國藥品生物制品檢定所,批號110709-200505)。葡萄糖為分析純;試劑:甲醇(色譜純,Fisher),乙腈(色譜純,Fisher),水為超純水或蒸餾水,提取藥材用純凈水為樂百氏純凈水。
2.2分析結果
對照品的圖譜如圖1所示,本發明紅毛五加皮提取物的指紋圖譜如圖2所示。
實施例2本發明紅毛五加皮提取物的制備
1、制備方法
稱取紅毛五加藥材4kg,水浸置過夜后,分別加入15倍量水煎煮3次(煎煮時間是30min),合并水煎液,加熱揮至小體積(濃縮至5000ml),濾去沉淀,上清液過D101大孔樹脂柱(大孔樹脂用量4kg,內徑15cm,柱長70cm),先用2倍柱體積(BV)蒸餾水洗去雜質,然后3BV 40%乙醇溶液洗脫,收集洗脫部位,回收乙醇,濃縮物經60℃噴霧干燥得黃棕色粉末,即為本發明紅毛五加皮提取物。
2、指紋圖譜分析
2.1分析方法
同實施例1。
2.2分析結果
對照品的圖譜如圖1所示,本發明紅毛五加皮提取物的指紋圖譜如圖3所示,可以看出,本發明提取物含有刺五加苷B。
實施例3本發明紅毛五加皮提取物的制備
1、制備方法
稱取紅毛五加藥材4kg,水浸置過夜后,分別加入15倍量水煎煮3次(煎煮時間是30min),合并水煎液,加熱揮至小體積(濃縮至5000ml),濾去沉淀,上清液過D101大孔樹脂柱(大孔樹脂用量4kg,內徑15cm,柱長70cm),先用2倍柱體積(BV)蒸餾水洗去雜質,然后3BV 20%乙醇溶液洗脫,收集洗脫部位,回收乙醇,濃縮物經60℃噴霧干燥得黃棕色粉末,即為本發明紅毛五加皮提取物。
2、指紋圖譜分析
2.1分析方法
同實施例1。
2.2分析結果
對照品的圖譜如圖1所示,本發明紅毛五加皮提取物的指紋圖譜如圖4所示,可以看出,本發明提取物含有刺五加苷B。
實施例4本發明紅毛五加皮提取物的制備
1、制備方法
稱取紅毛五加皮藥材4kg,水浸置過夜后,分別加入6倍量水煎煮4次(煎煮時間是30min),合并水煎液,加熱揮至小體積(濃縮至5000ml),濾去沉淀,上清液過D101大孔樹脂柱(大孔樹脂用量4kg,內徑15cm,柱長70cm),先用1倍柱體積(BV)蒸餾水洗去雜質,然后4BV 60%乙醇溶液洗脫,收集洗脫部位,回收乙醇,濃縮物經60℃噴霧干燥得黃棕色粉末,即為本發明紅毛五加皮提取物。
實施例5本發明紅毛五加皮提取物的制備
1、制備方法
稱取紅毛五加皮藥材4kg,水浸置過夜后,分別加入12倍量水煎煮2次(煎煮時間是30min),合并水煎液,加熱揮至小體積(濃縮至5000ml),濾去沉淀,上清液過AB-8大孔樹脂柱(大孔樹脂用量4kg,內徑15cm,柱長70cm),先用4倍柱體積(BV)蒸餾水洗去雜質,然后1BV 60%乙醇溶液洗脫,收集洗脫部位,回收乙醇,濃縮物經60℃噴霧干燥得黃棕色粉末,即為本發明紅毛五加皮提取物。
實施例6本發明抗炎鎮痛藥物的制備
紅毛五加皮提取物膠囊,取實施例1制備的紅毛五加皮提取物,加入可溶性淀粉等口服用藥劑輔料改善流動性,填充制成膠囊。
紅毛五加皮提取物片劑,取實施例2制備的紅毛五加皮提取物,加入可溶性淀粉等口服用藥劑輔料改善流動性,壓制成片劑。
紅毛五加皮提取物軟膠囊,取實施例3制備的紅毛五加皮提取物,加入聚乙二醇400、助懸劑,混勻,用明膠做囊殼材料,壓制成軟膠囊。
紅毛五加皮提取物注射劑,取實施例1制備的紅毛五加皮提取物,溶入注射用水中,采用注射劑制備工藝,制得5mg/ml的注射劑(含輸液)。
紅毛五加皮提取物粉針劑,取實施例2制備的紅毛五加皮提取物,溶入注射用水中,采用現有粉針劑凍干制備工藝,制成粉針劑。
紅毛五加皮提取物滴丸劑,取實施例3制備的紅毛五加皮提取物,采用滴丸制備工藝,即制得滴丸劑。
紅毛五加皮提取物脂肪乳,取實施例1制備的紅毛五加皮提取物,加入大豆油、卵磷脂、注射用水等注射用藥劑輔料,均質化處理,制成脂肪乳劑。
以下通過實驗例的方式來說明本發明的有益效果:
實驗例1本發明紅毛五加皮提取物的抗炎鎮痛功效
(1)受試藥物
本發明紅毛五加皮提取物水溶液(0.3g生藥/ml,提取物按照實施例1的方法制備)及紅毛五加皮水提取物(0.3g生藥/ml。吲哚美辛腸溶片(山西太原藥業有限公司,批號:101001,規格:25mg/片)。
(2)實驗動物及實驗場地
SPF級KM種小鼠100只,由四川省醫學科學院實驗動物研究所提供。小鼠購回飼養觀察3天,作藥前體重記錄。全價飼料,自由采食飲水。鼠用全價顆粒料由四川省實驗動物專委會養殖場提供,營養成分:符合GB14924.4中的規定。實驗場地為成都中醫藥大學藥學院中藥藥理動物觀察室(川實動管015號)。空調保持室溫18~24℃,相對濕度60~70%。,光照條件:12h/12h明暗交替,通風情況:全新風。
(3)實驗儀器
BP221S型電子天平(SARTORIUS,上海良平儀器儀表有限公司,d=0.1mg);不銹鋼電熱恒溫水箱DHW-600(北京國華醫療器械廠);1ml一次性無菌注射器(江蘇康進醫療器材有限公司,批號:20050609D42)。
(4)統計方法
實驗數據以均數±標準差表示,組間差異的顯著性檢驗運用spss 18.0軟件提供的單因素方差分析方法。
(5)實驗方法
給藥劑量
本發明紅毛五加皮提取物水溶液和紅毛五加皮水提取物按紅毛五加皮臨床劑量分別配制成高劑量:4g/kg、低劑量:1g/kg兩個劑量組;吲哚美辛腸溶片按照等效劑量配制:10mg/kg。每天灌胃1次,灌胃溶劑:0.2ml/10g,對照組灌胃等體積溶媒。
鎮痛作用研究
KM種小鼠60只,SPF級,雄性,體重20±2g;按體重隨機分成10組,分別灌胃蒸餾水,吲哚美辛腸溶片溶液和各組藥物。連續灌胃4天,于末次給藥前禁食不禁水12h,末次給藥后30min,小鼠腹腔注射0.7%醋酸溶液0.2ml/只,分別以小鼠腹部凹陷,雙后肢伸展為扭體反應指標,觀察小鼠出現扭體反應的潛伏期(min)和15min內扭體反應的次數。
抗炎作用研究
KM種小鼠60只,SPF級,雄性,體重20±2g;按體重隨機分成10組,分別灌胃蒸餾水,吲哚美辛腸溶片溶液和各組藥物。連續灌胃6天,于末次給藥前禁食不禁水12h,末次給藥后1h,將20μl二甲苯涂于小鼠右耳廓兩面致炎,左耳不涂作為對照,致炎后1h處死小鼠,剪下小鼠雙耳廓,用直徑5mm的打孔器在兩耳對稱位置取下左右耳片稱重,以左右耳片重量差為耳廓腫脹度表示藥物的抗炎效應,同時計算平均抑制率,平均抑制率=(給藥組腫脹度-對照組腫脹度)/對照組腫脹度×100%
(6)實驗結果
表1紅毛五加鎮痛及抗炎實驗結果
注:*與空白組對照比較,p<0.05。▲本發明提取物組與水提物組比較,p<0.05
實驗結果說明,本發明紅毛五加皮提取物可以有效鎮痛抗炎,并且在相同生藥量下,本發明紅毛五加皮提取物在低劑量下的抗炎功效顯著優于紅毛五加皮總的水提取物,鎮痛的作用相當。
實驗例2本發明紅毛五加皮提取物的抗炎鎮痛功效
(一)、受試藥物
60%乙醇洗脫部位(本發明實施例1的方法制備)、40%乙醇洗脫部位(本發明實施例2的方法制備)、20%乙醇洗脫部位提取物(本發明實施例3的方法制備)、紅毛五加水洗液部位(實施例1中直接收集水洗洗脫部位的提取物)、95%乙醇洗脫部位(實施例1中,將60%乙醇溶液替換為95%的乙醇溶液,得到的提取物)。每個提取部位分用5‰CMC溶液作為溶劑配置成800mg/kg、400mg/kg高低兩劑量組。蔽光室低溫保存。
(二)、實驗動物及實驗場地
SPF級KM種小鼠130只,由四川省醫學科學院實驗動物研究所提供。小鼠購回飼養觀察3天,作給藥前體重記錄。全價飼料,自由采食飲水。鼠用全價顆粒料由四川省實驗動物專委會養殖場提供,營養成分:符合GB14924.4中的規定。實驗場地為成都中醫藥大學藥學院中藥藥理動物觀察室(川實動管015號)。空調保持室溫18~24℃,相對濕度60~70%。,光照條件:12h/12h明暗交替,通風情況:全新風。
(三)、實驗試劑
地塞米松磷酸鈉注射液(天津藥業焦作有限公司,批號:08020111,規格1ml:5mg);奇邁特,鹽酸曲馬多片(石藥集團歐意藥業有限公司,國藥準字:H10960106,批號:040701)。
(四)、實驗儀器
BP221S型電子天平(SARTORIUS,上海良平儀器儀表有限公司,d=0.1mg);不銹鋼電熱恒溫水箱DHW-600(北京國華醫療器械廠);1ml一次性無菌注射器(江蘇康進醫療器材有限公司,批號:20050609D42)。
(五)、統計方法
實驗數據以平均值±標準差表示,組間差異的顯著性檢驗運用spss 15.0for windows軟件提供的非參數檢驗和單因素方差分析方法。
(六)、實驗方法
1、給藥劑量
五個部位各分高劑量:800mg/kg、低劑量:400mg/kg兩個劑量組。按0.2ml/10g于實驗之前48h、24h、10min共計灌胃給藥3次。
2、紅毛五加鎮痛作用研究
取SPF級KM種小鼠25±2g者,將小鼠尾末端垂直浸入(50±0.5)℃恒溫水浴中,浸入長度為3cm左右,以尾回縮出水面的潛伏期(tail flick latency,TFL)為測痛指標。選擇在(50±0.5)℃溫水浴中痛閥值為4s左右的小鼠,隨機分為12組。10個給藥組分別po給予各部位高低劑量藥物(給藥體積:0.2ml/10g);陽性組po給予5‰CMC鹽酸曲馬多溶液(給藥體積:0.2ml/10g)、空白組po給予等體積5‰CMC溶液。末次給藥后10min、30min、1h復測TFL。
3、紅毛五加抗炎作用研究
取SPF級KM種小鼠25±2g者80只,隨機分為12個組。10個給藥組分別po給予各部位高低劑量藥物(給藥體積:0.2ml/10g);陽性組ip地塞米松(給藥體積:0.1ml/10g)、空白組po給予等體積5‰CMC溶液。給藥后1h于每鼠右耳殼均勻滴二甲苯0.03ml,左耳殼作對照,2h后剪下耳殼,用直徑8mm的打孔器取下耳片稱重,左右耳片重量差為腫脹度。
(七)實驗結果
1、紅毛五加鎮痛作用研究結果
各組給藥后10min、30min、1h的TFL如表2所示:
表2紅毛五加鎮痛作用TFL表
注:與空白組對照*p<0.05
結果表明:在給藥后10min,除陽性藥組外,各劑量組與模型組比較均不能明顯延長TFL值(p>0.05)。在給藥后30min,水洗液低劑量組、40%乙醇高劑量組、60%乙醇各劑量組、陽性藥組均能明顯延長TFL值(p<0.05)。在給藥后1h,水洗液低劑量組和陽性藥組能明顯延長TFL值(p<0.05)。
2、紅毛五加抗炎作用研究結果
各組耳腫脹度情況如表3所示:
表3紅毛五加對抗二甲苯耳腫脹模型研究情況表
注:與模型組對照*p<0.05。
結果表明:20%乙醇高劑量組、60%乙醇各劑量組、陽性藥組均能明顯抑制二甲苯致小鼠耳腫脹(p<0.05)。
(八)實驗結論
紅毛五加水洗液部位、95%乙醇洗脫部位、60%乙醇洗脫部位、40%乙醇洗脫部位、20%乙醇洗脫部位提取物分用5‰CMC溶液作為溶劑配置成800mg/kg、400mg/kg高低兩劑量組。對各部位高低劑量鎮痛作用進行考察發現,在給藥后10min時,只有陽性藥組的TFL明顯延長(p<0.05),說明各受試藥物在給藥10min時沒有產生明顯鎮痛作用(p>0.05);在給藥后30min時,水洗液低劑量組、40%乙醇高劑量組、60%乙醇各劑量組、陽性藥組均能明顯延長TFL值(p<0.05),說明水洗液低劑量組、40%乙醇高劑量組、60%乙醇各劑量組受試藥物在給藥30min時產生明顯鎮痛作用(p<0.05);在給藥后1h時,水洗液低劑量組及陽性藥組的TFL均明顯延長(p<0.05),其余各組的鎮痛作用同空白對照組比沒有明顯差異(p>0.05)。
對紅毛五加水洗液部位、95%乙醇洗脫部位、60%乙醇洗脫部位、40%乙醇洗脫部位、20%乙醇洗脫部位提取物高低劑量抗二甲苯致小鼠耳腫脹作用考察發現,20%乙醇高劑量組、60%乙醇各劑量組、陽性藥組均能明顯抑制二甲苯致小鼠耳腫脹(p<0.05),說明20%乙醇高劑量組、60%乙醇各劑量組均有明顯的抗炎作用(p<0.05)。
三、討論
本發明實施例1制備得到的提取物(60%乙醇洗脫部位)具有明確的抗炎鎮痛效果,而實施例2制備得到的提取物(40%乙醇洗脫部位)有明確的鎮痛效果,實施例3制備得到的提取物(20%乙醇洗脫部位)有明確的抗炎效果,而乙醇洗脫部位則沒有抗炎鎮痛的作用。
綜上,本發明紅毛五加皮提取物(60%乙醇大孔樹脂洗脫部位)具有良好的抗炎鎮痛功效,且效果優于其他提取部位,其中,尤以實施例1的紅毛五加皮提取物的效果最佳,進一步明確了紅毛五加皮抗炎鎮痛的有效部位,為制劑和藥品安全監控提供了保障。
- 還沒有人留言評論。精彩留言會獲得點贊!