一種仿生人工骨支架及其制備方法與流程
本發明屬于組織工程技術領域,具體涉及一種仿生人工骨支架及其制備方法。
背景技術:
全世界每年骨缺損患者數以千萬計,使得骨修復支架材料成為臨床上需求量最大的生物醫用材料之一。長期以來,研制和開發理想的人工骨支架來治療骨缺損一直是科學工作者們的熱點研究課題。
目前臨床上使用的人工骨修復材料,有以金屬、陶瓷或高分子制造的不同類型,它們在生物活性、生物相容性、生物可降解性、力學性能和使用壽命等方面具有各自的優缺點。然而,現有人工骨支架普遍存在的問題是,雖然種植體與骨界面可形成一定的骨性結合,但由于新骨生長受局部微環境的限制,爬行替代緩慢,在治療大范圍骨缺損時,成骨僅限于植體邊緣區域,難以實現支架與骨的整合以及缺損區的完整修復和重建。
研究證實,即使支架材料具有較高孔隙率和孔間貫通性,受植區的成骨量也十分有限,新骨組織長入材料的深度至多能達到其表面孔徑的10倍。(Davies JE,et al.Topographic scale-range synergy at the functional bone/implant interface.Biomaterials 2014(35):25-35)對于生物可降解性材料而言,如果材料與宿主骨不能完全融合,其內部累積的降解產物難以參與人體正常生理代謝,容易出現無菌性炎癥而導致手術失敗。
骨缺損修復和再生需要適宜的外界微環境,如果材料的內部框架結構不能模擬自然骨細胞外基質形成的網絡結構,不利于細胞相互之間的聯系及信息傳遞,參與骨修復的細胞生長和遷移受限,難以實現骨整合。要從根本上解決植入體與宿主骨組織的整合問題,需通過調控支架材料的構成組分和微觀結構來優化其性能。從材料學的角度看,自然骨是一種從納米尺度到宏觀水平分級排列精密構建的膠原纖維-磷灰石復合生物材料。骨組織中的基本結構單元—骨單位(Osteons)由同心圓排列的哈佛骨板(Haversian lamella)構成,直徑為100~500μm,中央管內為血管神經,外圍骨板中的膠原纖維呈螺旋狀走行,相鄰骨板的纖維方向互成直角,骨細胞取向分布于礦化的三維網絡矩陣中。自然狀態的骨微環境為細胞生長提供了極為有利的條件,均衡的營養和物質能量交換,促進了細胞增殖和細胞外基質的分泌。在體外如何構建這一微環境,實際上要解決納米纖維從構成組分到形貌尺寸、表面紋理、取向度及精密空間排布的協同調控,以利于不同細胞的粘附和長期生長,使支架、細胞和外基質形成一個有機的結合體并最終形成功能化組織。
靜電紡絲制備的纖維直徑與細胞外基質中的微絲相當,加之彼此連通的微小孔隙結構,能夠很好地模擬天然細胞外基質結構,為細胞生長提供理想微環境,通過改變靜電紡絲供液和接收裝置的形式,還可得到具有特殊取向結構的納米纖維,以滿足不同的細胞生長需求。美國Clemson大學生物工程研究院設計了一種新型靜電紡絲收集裝置,采用兩條平行傳送帶接收納米纖維。這種裝置能控制納米纖維取向排列并避免其相互粘連,得到稀疏層疊排列的三維支架,使細胞較好地粘附并穿透纖維支架內部生長。但該方法制備的納米纖維支架力學強度欠佳,限制了其在人工骨替代材料方面的應用。(Beachley V,et al.A novel method to precisely assemble loose nanofiber structures for regenerative medicine applications.Adv.Healthc.Mater.2013(2):343-51)近期上海東華大學聯合美國Cornell大學報道了一種各向異性的編織型納米纖維支架,通過對兩組供液針頭施加相反的電壓,以使帶相反電荷的聚合物溶液噴射流(各自從針頭拉出)向中間區域聚集,再結合電子提花和環錠捻線工藝構建出不同花紋的納米纖維平面編織網絡結構。將人主動脈瓣間質細胞(HAVIC)和人主動脈根部平滑肌細胞(HASMC)包封在水凝膠/編織型納米纖維復合材料中,構成了類心臟瓣膜細胞外基質的微環境并顯示出各向異性的生物力學特性。這種支架具有優異的力學性能,但其微觀結構與骨單位中膠原纖維的螺旋取向空間排布還有較大差異,不適用于骨組織缺損的修復重建。(Wu S,et al.Fabrication of aligned nanofiberpolymer yarn networks for anisotropic soft tissue scaffolds.ACS Appl.Mater.Interfaces 2016(8):16950-60)迄今為止,尚未見以靜電紡納米纖維按照分層交錯螺旋的方式構建仿生人工骨支架用于骨缺損修復治療的文獻報道。
技術實現要素:
有鑒于此,本發明的目的在于:(1)提供一種仿生人工骨支架的制備方法;(2)提供一種仿生人工骨支架。
為達到上述目的,本發明提供如下技術方案:
1、一種仿生人工骨支架的制備方法,包括如下步驟:
(1)將I型膠原和生物可降解高分子溶于溶劑中,制得材料溶液A;
(2)將納米羥基磷灰石加入步驟(1)中制得的溶液A中,制得材料溶液B;
(3)利用靜電紡絲法以步驟(1)中材料溶液A為原料紡制支架的中心通道層,再以步驟(2)中材料溶液B為原料在制得的中心通道層上紡制支架的外圍柱體層。
進一步,步驟(1)中,所述I型膠原和生物可降解高分子的質量比為99~50:1~50。
進一步,步驟(1)中,所述生物可降解高分子為殼聚糖、透明質酸、海藻酸鈉、聚氧化乙烯、聚丙交酯-乙交酯、聚乙烯醇、聚己內酯或聚乳酸中的一種或多種。
進一步,步驟(1)中,所述溶劑為水、乙酸、六氟異丙醇、四氫呋喃、二甲基甲酰胺、二甲基亞砜中的一種或多種。
進一步,步驟(1)中,所述材料溶液A還包含VEGF、b-FGF、Ang-1,2、TGF-β或EGF中的一種或多種,在所述材料溶液A中的質量分數為0.00001~0.01%。
進一步,步驟(2)中,所述材料溶液B還包含BMP-2,7、OGP、PDGF、TGF-β、SGF或IGF-1,2中的一種或多種,在所述材料溶液B中的質量分數為0.00001~0.01%。
進一步,步驟(2)中,所述材料溶液B中納米羥基磷灰石的質量分數為10~80%;所述納米羥基磷灰石由鈣鹽和磷酸或鈣鹽和磷酸鹽按鈣/磷摩爾配比1.67:1在pH為10~14條件下反應合成;所述鈣鹽為Ca(NO3)2、CaCl2、Ca(OH)2、Ca(CH3COO)2或CaCO3中的一種;所述磷酸鹽為(NH4)2HPO4、NH4H2PO4、Na3PO4、Na2HPO4或NaH2PO4中的一種。
進一步,步驟(3)中,所述支架的中心通道層和外圍柱體層具體由以下方法制得:
1)將所述材料溶液A和材料溶液B分別注入推注器至各推注器內無空氣;
2)利用靜電紡絲法,首先將步驟1)中的推注器安裝在靜電紡絲裝置中平移裝置的移動滑塊上,調整推進擋板位置,設置靜電紡絲參數,然后推注所述材料溶液A,調整電壓至推注器噴頭液滴形成穩定噴射流,推注過程中所述移動滑塊始終保持同向移動,待接收裝置上形成所述中心通道層后,開始推注所述材料溶液B,同時停止推注所述材料溶液A,此推注過程中所述移動滑塊移動方向交替變換,最終形成所述支架外圍柱體層。
進一步,步驟2)中,所述靜電紡絲參數具體為:溫度20~60℃,濕度40~80%,所述推注器噴頭與接收裝置之間電勢差為5~20V,電極間距10~20cm,推注速度0.01~0.60mm/min,平移速度0~500mm/min,平移行程0~100mm,接收裝置轉速1000~3000rpm。
2、由所述的一種仿生人工骨支架的制備方法制得的仿生人工骨支架,其特征在于,所述仿生人工骨支架包括中心通道層和套設在所述中心通道層上的外圍柱體層;所述中心通道層和外圍柱體層均由若干個納米纖維層同軸設置,所述中心通道層中的相鄰兩個所述納米纖維層的纖維螺旋方向相同;所述外圍柱體層中的相鄰兩個所述納米纖維層的纖維螺旋方向相反;所述納米纖維層由纖維沿其軸向螺旋排列組成。
進一步,所述納米纖維層中纖維直徑為10~800nm,纖維間孔徑為0.01~100μm。
進一步,其特征在于,所述支架的高度為0.1~10cm;所述納米纖維層的厚度為1~100μm;所述中心通道層的厚度為1~500μm;所述外圍柱體層的厚度為10μm~25mm。
本發明的有益效果在于:本發明提供一種仿生人工骨支架及其制備方法,所述方法操作簡便,條件溫和易控,使用原料來源廣泛,運用靜電紡絲制備裝置,通過裝置中的微型桿狀收集裝置,聯合輔助電極和平移裝置,并通過對溫度、濕度、電壓、電極間距、推注速度、接收轉速等參數設置,可協同調控納米纖維層中纖維的空間排列方式,排列的角度和間隙可根據實際應用需求進行靈活調控,構建出精致模擬骨單位結構的中空圓柱狀、具有中心通道層和套設在所述中心通道層上的外圍柱體層的仿生人工骨支架,其中,所述中心通道層中的相鄰兩個所述納米纖維層的纖維螺旋方向相同;所述外圍柱體層中的相鄰兩個所述納米纖維層的纖維螺旋方向相反,這種納米纖維交錯取向能夠極大地增強支架的結構穩定性,為骨缺損部位提供有效的力學支撐,實現缺損位與正常骨組織間的力學傳遞,交錯取向的納米纖維構成互通的特殊網絡結構,既能保持孔隙的貫通性,有利于細胞滲透生長及血管和神經長入,也便于營養物質傳遞和細胞代謝廢物排出。同時,在支架中分層添加不同生長因子可為種子細胞BMSCs提供差異化誘導環境,仿生構建出中心通道層血管化組織、外圍柱體層骨組織的人工骨支架,能夠增強人工骨材料修復骨缺損的能力,為大范圍骨缺損修復提供有效的治療策略,且該支架在體內可吸收降解,其降解產物無毒副作用,生物安全性高,在生物醫學材料及組織工程領域中具有理想的推廣和應用價值。
附圖說明
為了使本發明的目的、技術方案和有益效果更加清楚,本發明提供如下附圖進行說明:
圖1為仿生人工骨支架的結構示意圖;
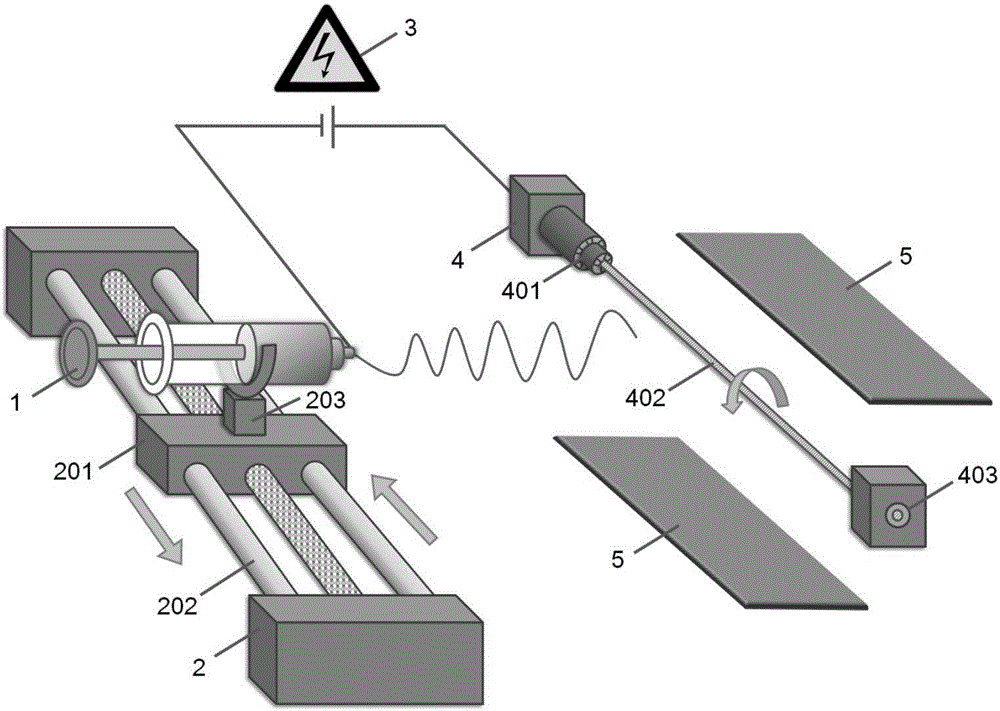
圖2為仿生人工骨支架的制備裝置示意圖;
圖3為實施例4仿生人工骨支架的實物圖;
圖4為實施例4仿生人工骨支架中納米纖維層的掃描電鏡圖和偏角分布分析圖;
圖5為實施例4中細胞沿著仿生人工骨支架取向生長的熒光顯微鏡圖。
其中,圖1中A為仿生人工骨支架示意圖,a為支架的中心通道層,b為支架的外圍柱體層;B為多個仿生人工骨支架平行并列組裝形成的類哈佛系統組合式結構體;C為中心通道層上BMSCs向血管內皮細胞分化示意圖;D為外圍柱體層上BMSCs向成骨細胞分化示意圖;
圖2中,仿生人工骨支架的制備裝置包括推注器1、平移裝置2、移動滑塊201、導軌202、加緊裝置203、高壓電源3、收集裝置4、固定夾401、接收桿402、導向器403和輔助電極5;
圖4中,A圖為中心通道層中納米纖維層的掃描電鏡圖;B圖為中心通道層中納米纖維層的偏角分布分析圖;C圖為外圍柱體層中納米纖維層的掃描電鏡圖;D圖為外圍柱體層中納米纖維層的偏角分布分析圖;
圖5中,A圖為鬼筆環肽熒光染色圖,B圖為DAPI染色圖,C圖為Merge合成圖。
具體實施方式
下面將結合附圖,對本發明的優選實施例進行詳細的描述。
采用如圖2所示的制備裝置制備仿生人工骨支架。
實施例1
(1)將I型膠原與生物可降解高分子按質量比99:1溶于六氟異丙醇和二甲基甲酰胺的復合溶劑中(六氟異丙醇與二甲基甲酰胺的體積比為2:1)中,并加入細胞生長因子,制得材料溶液A,其中,可降解高分子為聚丙交酯-乙交酯;細胞生長因子為VEGF和b-FGF,在材料溶液A中的質量分數分別為0.001%和0.00001%;
(2)將納米羥基磷灰石(n-HA)加入步驟(1)中制得的I型膠原/聚丙交酯-乙交酯混合溶液中,并加入細胞生長因子,制得材料溶液B,其中,n-HA由Ca(OH)2和磷酸按鈣/磷摩爾配比1.67:1在pH為10的條件下反應合成,在材料溶液B中的質量分數為20%;細胞生長因子為BMP-7和OGP,在材料溶液B中的質量分數分別為0.005%和0.00002%;
(3)利用靜電紡絲法以步驟(1)中材料溶液A為原料紡制支架的中心通道層,再以步驟(2)中材料溶液B為原料在制得的中心通道層上紡制支架的外圍柱體層,具體步驟如下:
1)將所述材料溶液A和材料溶液B分別注入推注器至各推注器內無空氣;
2)利用靜電紡絲法,首先將步驟1)中的推注器安裝在靜電紡絲裝置中的進樣泵上,調整推進擋板位置,選用直徑0.1mm,長度2cm的微型接收桿為接收器,制備中心通道層時靜電紡絲參數設置為:溫度50℃,濕度60%,所述推注器噴頭與接收裝置之間電勢差為5V,電極間距10cm,推注速度0.01mm/min,平移速度0mm/min,平移行程0mm,接收裝置轉速1000rpm,制備外圍柱體層時靜電紡絲參數設置為:溫度50℃,濕度60%,所述推注器噴頭與接收裝置之間電勢差為7V,電極間距10cm,推注速度0.01mm/min,平移速度200mm/min,平移行程10mm,接收裝置轉速1800rpm,然后推注所述材料溶液A,調整電壓至推注器噴頭液滴形成穩定噴射流,推注過程中固定有推注器的移動滑塊位于平移裝置中部且保持不動,待接收裝置上形成厚度為1μm的中心通道層后,開始推注所述材料溶液B,同時停止推注所述材料溶液A,此推注過程中固定有推注器的移動滑塊的移動方向交替變換,具體移動方式為:所述移動滑塊由平移裝置中心向一個方向移動后返回中心位置,再往另一個方向移動后再次返回中心位置,如此往復運動,最終形成厚度為10μm的支架外圍柱體層,制得的人工支架高度為2cm。
(4)將制得的仿生人工支架從接收桿上取下,用75%乙醇或環氧乙烷滅菌后浸泡于培養基中,按照5×104個/mL的細胞密度接種BMSCs,采用細胞轉瓶培養系統進行體外培養,促使細胞沿納米纖維框架網孔滲透生長和定向分化,最后將長有細胞的支架植入骨缺損處用以引導新骨再生重建。
實施例2
(1)將I型膠原與生物可降解高分子按質量比80:20溶于質量分數為3%的乙酸溶液中,并加入細胞生長因子,制得材料溶液A,其中,可降解高分子為殼聚糖和透明質酸的混合物(殼聚糖和透明質酸的質量比為7:3);細胞生長因子為VEGF、Ang-1和Ang-2,在材料溶液A中的質量分數分別為0.001%、0.0001%和0.0001%;
(2)將納米羥基磷灰石(n-HA)加入步驟(1)中制得的I型膠原/殼聚糖/透明質酸混合溶液中,并加入細胞生長因子,制得材料溶液B,其中,n-HA由Ca(NO3)2和(NH4)2HPO4按鈣/磷摩爾配比1.67:1在pH為11的條件下反應合成,在材料溶液B中的質量分數為60%;細胞生長因子為BMP-2和TGF-β,在材料溶液B中的質量分數分別為0.003%和0.0001%;
(3)利用靜電紡絲法以步驟(1)中材料溶液A為原料紡制支架的中心通道層,再以步驟(2)中材料溶液B為原料在制得的中心通道層上紡制支架的外圍柱體層,具體步驟如下:
1)將所述材料溶液A和材料溶液B分別注入推注器至各推注器內無空氣;
2)利用靜電紡絲法,首先將步驟1)中的推注器安裝在靜電紡絲裝置中的進樣泵上,調整推進擋板位置,選用直徑0.3mm,長度5cm的微型接收桿為接收器,制備中心通道層時靜電紡絲參數設置為:溫度30℃,濕度70%,所述推注器噴頭與接收裝置之間電勢差為8V,電極間距14cm,推注速度0.1mm/min,平移速度4mm/min,平移行程50mm,接收裝置轉速1500rpm,制備外圍柱體層時靜電紡絲參數設置為:溫度30℃,濕度70%,所述推注器噴頭與接收裝置之間電勢差為10V,電極間距14cm,推注速度0.1mm/min,平移速度300mm/min,平移行程25mm,接收裝置轉速2200rpm,然后推注所述材料溶液A,調整電壓至推注器噴頭液滴形成穩定噴射流,推注過程中固定有推注器的移動滑塊位于平移裝置一端,且始終保持同向移動,待接收裝置上形成厚度為50μm的中心通道層后,開始推注所述材料溶液B,同時停止推注所述材料溶液A,此推注過程中固定有推注器的移動滑塊位于平移裝置的中心,且移動方向交替變換,具體移動方式為:所述移動滑塊由平移裝置中心向一個方向移動后返回中心位置,再往另一個方向移動后再次返回中心位置,如此往復運動,最終形成厚度為1mm的支架外圍柱體層,制得的人工支架高度為5cm。
(4)將制得的仿生人工支架從接收桿上取下,用75%乙醇或環氧乙烷滅菌后浸泡于培養基中,按照5×104個/mL的細胞密度接種BMSCs,采用細胞轉瓶培養系統進行體外培養,促使細胞沿納米纖維框架網孔滲透生長和定向分化,最后將長有細胞的支架植入骨缺損處用以引導新骨再生重建。
實施例3
(1)將I型膠原與生物可降解高分子按質量比70:30溶于二甲基亞砜中,并加入細胞生長因子,制得材料溶液A,其中,可降解高分子為聚乳酸和聚乙烯醇的混合物(聚乳酸和聚乙烯醇的質量比為1:1);細胞生長因子為VEGF、TGF-β和b-FGF,在材料溶液A中的質量分數分別為0.002%、0.002%和0.001%;
(2)將納米羥基磷灰石(n-HA)加入步驟(1)中制得的I型膠原/聚乳酸/聚乙烯醇混合溶液中,并加入細胞生長因子,制得材料溶液B,其中,n-HA由CaCl2和Na3PO4按鈣/磷摩爾配比1.67:1在pH為12的條件下反應合成,在材料溶液B中的質量分數為40%;細胞生長因子為BMP-7和PDGF的混合物,在材料溶液B中的質量分數分別為0.004%和0.001%;
(3)利用靜電紡絲法以步驟(1)中材料溶液A為原料紡制支架的中心通道層,再以步驟(2)中材料溶液B為原料在制得的中心通道層上紡制支架的外圍柱體層,具體步驟如下:
1)將所述材料溶液A和材料溶液B分別注入推注器至各推注器內無空氣;
2)利用靜電紡絲法,首先將步驟1)中的推注器安裝在靜電紡絲裝置中的進樣泵上,調整推進擋板位置,選用直徑6.0mm,長度8cm的微型接收桿為接收器,制備中心通道層時靜電紡絲參數設置為:溫度40℃,濕度80%,所述推注器噴頭與接收裝置之間電勢差為15V,電極間距16cm,推注速度0.4mm/min,平移速度8mm/min,平移行程80mm,接收裝置轉速1800rpm,制備外圍柱體層時靜電紡絲參數設置為:溫度40℃,濕度80%,所述推注器噴頭與接收裝置之間電勢差為17V,電極間距16cm,推注速度0.4mm/min,平移速度300mm/min,平移行程40mm,接收裝置轉速2400rpm,然后推注所述材料溶液A,調整電壓至推注器噴頭液滴形成穩定噴射流,推注過程中固定有推注器的移動滑塊位于平移裝置一端,且始終保持同向移動,待接收裝置上形成厚度為100μm的中心通道層后,開始推注所述材料溶液B,同時停止推注所述材料溶液A,此推注過程中固定有推注器的移動滑塊位于平移裝置的中心,且移動方向交替變換,具體移動方式為:所述移動滑塊由平移裝置中心向一個方向移動后返回中心位置,再往另一個方向移動后再次返回中心位置,如此往復運動,最終形成厚度為10mm的支架外圍柱體層,制得的人工支架高度為8cm。
(4)將制得的仿生人工支架從接收桿上取下,用75%乙醇或環氧乙烷滅菌后浸泡于培養基中,按照5×104個/mL的細胞密度接種BMSCs,采用細胞轉瓶培養系統進行體外培養,促使細胞沿納米纖維框架網孔滲透生長和定向分化,最后將長有細胞的支架植入骨缺損處用以引導新骨再生重建。
實施例4
(1)將I型膠原與生物可降解高分子按質量比60:40溶于四氫呋喃和二甲基甲酰胺的復合溶液中(四氫呋喃與二甲基甲酰胺的體積比為1:1)中,并加入細胞生長因子,制得材料溶液A,其中,可降解高分子為聚己內酯、聚丙交酯-乙交酯(聚己內酯與聚丙交酯-乙交酯質量比為1:2);細胞生長因子為VEGF,在材料溶液A中的質量分數為0.002%;
(2)將納米羥基磷灰石(n-HA)加入步驟(1)中制得的I型膠原/聚己內酯/聚丙交酯-乙交酯混合溶液中,并加入細胞生長因子,制得材料溶液B,其中,n-HA由Ca(CH3COO)2和NaH2PO4按鈣/磷摩爾配比1.67:1在pH為13的條件下反應合成,在材料溶液B中的質量分數為10%;細胞生長因子為BMP-2和PDGF,在材料溶液B中的質量分數分別為0.004%和0.002%;
(3)利用靜電紡絲法以步驟(1)中材料溶液A為原料紡制支架的中心通道層,再以步驟(2)中材料溶液B為原料在制得的中心通道層上紡制支架的外圍柱體層,具體步驟如下:
1)將所述材料溶液A和材料溶液B分別注入推注器至各推注器內無空氣;
2)利用靜電紡絲法,首先將步驟1)中的推注器安裝在靜電紡絲裝置中的進樣泵上,調整推進擋板位置,選用直徑0.5mm,長度2cm的微型接收桿為接收器,制備中心通道層時靜電紡絲參數設置為:溫度30℃,濕度40%,所述推注器噴頭與接收裝置之間電勢差為13V,電極間距15cm,推注速度0.2mm/min,平移速度10mm/min,平移行程20mm,接收裝置轉速2000rpm,制備外圍柱體層時靜電紡絲參數設置為:溫度30℃,濕度40%,所述推注器噴頭與接收裝置之間電勢差為15V,電極間距15cm,推注速度0.2mm/min,平移速度240mm/min,平移行程10mm,接收裝置轉速2800rpm,然后推注所述材料溶液A,調整電壓至推注器噴頭液滴形成穩定噴射流,推注過程中固定有推注器的移動滑塊位于平移裝置一端,且始終保持同向移動,待接收裝置上形成厚度為200μm的中心通道層后,開始推注所述材料溶液B,同時停止推注所述材料溶液A,此推注過程中固定有推注器的移動滑塊位于平移裝置的中心,且移動方向交替變換,具體移動方式為:所述移動滑塊由平移裝置中心向一個方向移動后返回中心位置,再往另一個方向移動后再次返回中心位置,如此往復運動,最終形成厚度為2.5mm的支架外圍柱體層,制得的人工支架高度為2cm。
(4)將制得的仿生人工支架從接收桿上取下,用75%乙醇或環氧乙烷滅菌后浸泡于培養基中,按照5×104個/mL的細胞密度接種BMSCs,采用細胞轉瓶培養系統進行體外培養,促使細胞沿納米纖維框架網孔滲透生長和定向分化,最后將長有細胞的支架植入骨缺損處用以引導新骨再生重建。
實施例5
(1)將I型膠原與生物可降解高分子按質量比50:50溶于水中,并加入細胞生長因子,制得材料溶液A,其中,可降解高分子為海藻酸鈉和聚氧化乙烯的混合物(海藻酸鈉和聚氧化乙烯的質量比為4:1);細胞生長因子為VEGF和EGF,在材料溶液A中的質量分數分別為0.008%和0.002%;
(2)將納米羥基磷灰石(n-HA)加入步驟(1)中制得的溶液A中,并加入細胞生長因子,制得材料溶液B,其中,n-HA由CaCO3和Na2HPO4按鈣/磷摩爾配比1.67:1在pH為14的條件下反應合成,在材料溶液B中的質量分數為80%;細胞生長因子為SGF、IGF-1和IGF-2,在材料溶液B中的質量分數分別為0.005%、0.003%和0.002%;
(3)利用靜電紡絲法以步驟(1)中材料溶液A為原料紡制支架的中心通道層,再以步驟(2)中材料溶液B為原料在制得的中心通道層上紡制支架的外圍柱體層,具體步驟如下:
1)將所述材料溶液A和材料溶液B分別注入推注器至各推注器內無空氣;
2)利用靜電紡絲法,首先將步驟1)中的推注器安裝在靜電紡絲裝置中的進樣泵上,調整推進擋板位置,選用直徑2.0mm,長度6cm的微型接收桿為接收器,制備中心通道層時靜電紡絲參數設置為:溫度40℃,濕度60%,所述推注器噴頭與接收裝置之間電勢差為19V,電極間距20cm,推注速度0.6mm/min,平移速度12mm/min,平移行程60mm,接收裝置轉速2200rpm,制備外圍柱體層時靜電紡絲參數設置為:溫度60℃,濕度90%,所述推注器噴頭與接收裝置之間電勢差為20V,電極間距20cm,推注速度0.6mm/min,平移速度500mm/min,平移行程30mm,接收裝置轉速3000rpm,然后推注所述材料溶液A,調整電壓至推注器噴頭液滴形成穩定噴射流,推注過程中固定有推注器的移動滑塊位于平移裝置一端,且始終保持同向移動,待接收裝置上形成500μm的中心通道層后,開始推注所述材料溶液B,同時停止推注所述材料溶液A,此推注過程中固定有推注器的移動滑塊位于平移裝置的中心,且移動方向交替變換,具體移動方式為:所述移動滑塊由平移裝置中心向一個方向移動后返回中心位置,再往另一個方向移動后再次返回中心位置,如此往復運動,最終形成25mm的支架外圍柱體層,制得的人工支架高度為6cm。
(4)將制得的仿生人工支架從接收桿上取下,用75%乙醇或環氧乙烷滅菌后浸泡于培養基中,按照5×104個/mL的細胞密度接種BMSCs,采用細胞轉瓶培養系統進行體外培養,促使細胞沿納米纖維框架網孔滲透生長和定向分化,最后將長有細胞的支架植入骨缺損處用以引導新骨再生重建。
圖1為仿生人工骨支架的結構示意圖,由圖1A可知,本發明中的仿生人工骨支架包括中心通道層a和套設在所述中心通道層上的外圍柱體層b,所述中心通道層a和外圍柱體層b均由若干個納米纖維層同軸設置,所述中心通道層中的相鄰兩個所述納米纖維層的纖維螺旋方向相同,所述外圍柱體層中的相鄰兩個所述納米纖維層的纖維螺旋方向相反;所述納米纖維層由纖維沿其軸向螺旋排列組成,且多個人工仿生人工骨支架可平行并列組裝形成類哈佛系統組合式結構體(如圖1B所示);中心通道層上BMSCs沿著納米纖維取向排列延伸,并向血管內皮細胞分化(如圖1C所示),外圍柱體層中不同層面的BMSCs沿著纖維粘附鋪展并向成骨細胞分化,交錯取向分布于支架的三維網絡框架中(如圖1D所示),構建出與天然骨相類似的微環境。
圖2為仿生人工骨支架的制備裝置示意圖,包括推注器1、平移裝置2、高壓電源3、收集裝置4和輔助電極5,所述平移裝置2包括導軌202和設置在導軌上可沿導軌往復運動的移動滑塊201,所述移動滑塊201上設置有可固定推注器1的加緊裝置203;所述高壓電源3的一端與助推器1的噴嘴相連,另一端與收集裝置4相連;所述收集裝置4包括固定夾401、接收桿402和導向器403,所述固定夾401的孔徑可調節,用于固定不同尺寸的接收桿402,并通過電機帶動接收桿402沿軸心旋轉運動,所述接收桿402的直徑為0.1~8.0mm,長度為2~10cm,所述導向器403套設在接收桿402外圍末端,用于控制接收桿402的方向,防止其在高速旋轉時劇烈晃動,根據接收桿402的直徑大小來選擇與之匹配尺寸的導向器403;所述輔助電極5包含兩個極板,所述收集裝置4設置在所述兩個極板之間。
圖3為由實施例4中的方法制備得到的仿生人工骨支架的實物圖。
圖4中,A圖和C圖分別為仿生人工骨支架中心通道層和外圍柱體層中納米纖維層的掃描電鏡圖,由圖4A可以看出,納米纖維表面光滑,直徑在200~300nm,孔徑為0.8~2.2μm,圖4C中的納米纖維由于加入了羥基磷灰石成分,表面比圖4A中的納米纖維略為粗糙,其直徑在240~360nm,孔徑為0.8~3.0μm,兩組納米纖維的微觀尺寸均勻,具有良好的分散性,呈取向排列。根據材料溶液成分和所選擇溶劑的不同,以及靜電紡絲條件參數(包括溫度、濕度、電壓、電極間距、推注速度、平移速度、接收裝置轉速等)的改變,納米纖維支架的直徑和孔徑會隨之發生變化,其直徑范圍為10~800nm,纖維間孔徑范圍為0.01~100μm;B圖和D圖分別為仿生人工骨支架中心通道層和外圍柱體層中納米纖維層的偏角分布分析圖,由圖4B可以看出,纖維取向分布主要集中在偏角為70°~110°,其中偏角分布在85°~90°的概率最高,由圖4D可以看出,纖維取向分布主要集中在偏角為95°~135°,其中偏角分布在110°~115°的概率最高,兩組數據均服從正態分布。
圖5為實施例4中細胞沿著仿生人工骨支架取向生長的熒光顯微鏡圖,由圖5可見,細胞在納米纖維上粘附良好并沿著纖維取向延伸,大部分細胞呈梭形鋪展,延伸進入纖維間隙中,呈三維生長。由于納米纖維的空間排列方式,可以影響細胞的粘附、遷移、增殖和分化行為,取向排列的仿生人工骨支架,能夠引導細胞沿其三維網絡框架結構取向生長,隨著材料的降解和細胞外基質的堆積,細胞將會自組裝出一種具有組織形態的構造體,有望實現材料與骨組織的整合以及缺損區的完整修復和重建。
最后說明的是,以上優選實施例僅用以說明本發明的技術方案而非限制,盡管通過上述優選實施例已經對本發明進行了詳細的描述,但本領域技術人員應當理解,可以在形式上和細節上對其作出各種各樣的改變,而不偏離本發明權利要求書所限定的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!