治療移植物抗宿主疾病的方法與流程
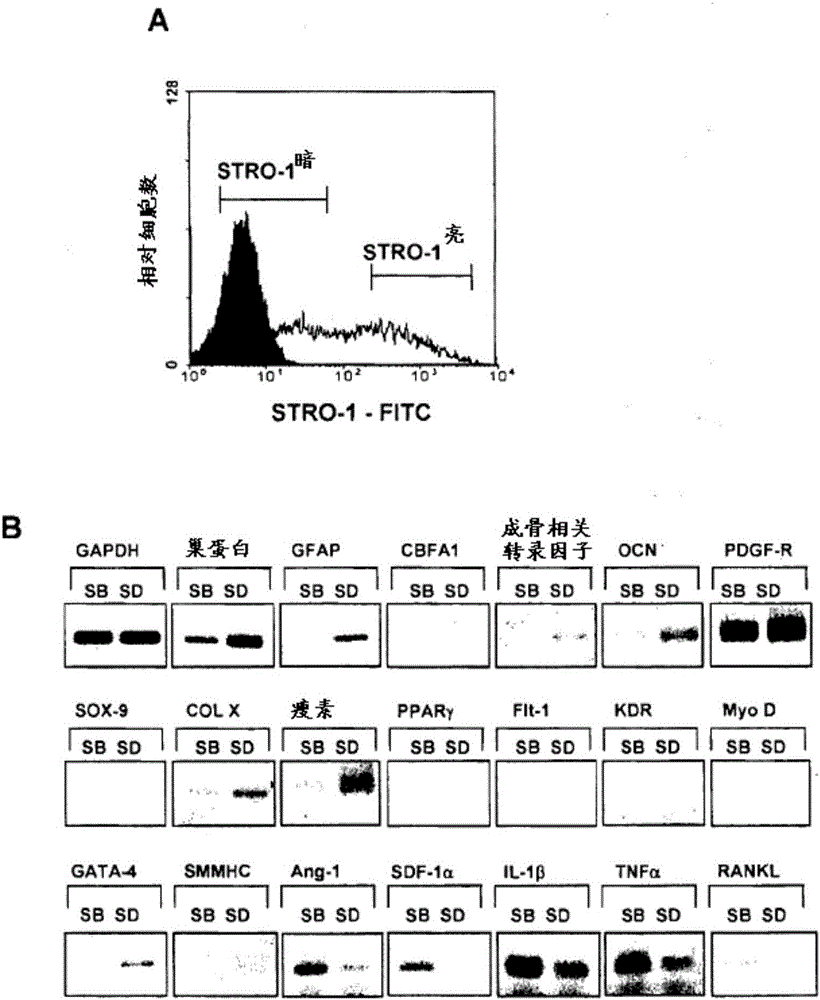
領域本發明涉及用于增強造血祖細胞的移植、增強骨髓移植和預防或減少移植物抗宿主疾病的方法。在一個實施方案中,本發明涉及預防或減輕哺乳動物患者,尤其是人患者的同種異體骨髓移植后的并發癥,即移植物抗宿主疾病。背景在破壞骨髓的過程之后要求骨髓移植。例如,在高強度全身性輻射或化學療法后,骨髓是首先衰竭的靶標。轉移性癌癥通常用極高強度的化學療法治療,所述化學療法意圖破壞癌癥,但是也有效地破壞骨髓。這誘發了對骨髓移植的需要。然而,除了最為急性的危及生命的病狀以外,利用骨髓移植來減輕涉及骨髓病癥的任何病狀通常都認為極具風險,因為有可能造成移植物抗宿主疾病(GvHD)發作。GvHD是作為限制同種異體骨髓或干細胞移植的成功和可用性的主要因素的免疫學病癥。GvHD是全身性炎癥性反應,其引起慢性疾病并且可能導致宿主動物死亡。目前,同種異體移植無不引起相關GvHD的嚴重風險,甚至在供體與宿主具有高度組織相容性的情況下。GvHD是由與全身性分布的不相容宿主抗原反應,從而引起極強炎癥的供體T細胞引起。在GvHD中,識別供體與宿主之間的差異的成熟供體T細胞被全身性活化。當前預防和治療GvHD的方法涉及施用諸如環孢菌素A和皮質類固醇等藥物。它們具有嚴重的副作用,須長期給予,并且用于施用和監測的費用高昂。已嘗試使用T細胞去除來預防GvHD,但這需要精密且昂貴的設施和專業技能。T細胞去除程度過高會導致骨髓干細胞移植失敗、造血重建失敗、感染或復發的嚴重問題。對T細胞去除限制較多會留下仍有能力引發GvHD的細胞。因此,當前治療GvHD的方法僅在有限的供體與宿主組合中獲得成功,使得許多患者不能得到有可能挽救生命的治療。間質干細胞(MSC)顯示有效的免疫抑制活性,其已在臨床環境中成功用于治療移植物抗宿主疾病(GvHD),這種疾病本來是骨髓移植的致死性并發癥。由于表征有限,因此MSC制備物異源程度相當高并且這限制了其免疫抑制作用和因此臨床效益的程度。概述在得出本發明的工作中,發明人比較間質干細胞與STRO-1亮多能細胞制備物對GvHD的影響。意外的是,在改善GvHD方面,Stro-1亮多能細胞制備物遠優于間質干細胞制備物。因此,本發明提供用于減輕哺乳動物患者的GvHD并發癥發展的方法,所述方法包括向患者施用富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子。在一個實施方案中,哺乳動物患者正進行或正要進行骨髓移植。在另一實施方案中,本發明提供用于減輕哺乳動物患者的由骨髓移植引起的GvHD并發癥發展的方法,所述方法包括向患者施用(a)骨髓譜系細胞的前體和(b)富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子,其中富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子是以有效降低患者的GvHD的嚴重性的量施用。在一個實施方案中,移植物抗宿主疾病是由T細胞免疫反應引起。在一個實例中,T細胞是來自供體并且抗原是來自接受者。例如,T細胞可以存在于移植物中。在另一實施方案中,T細胞是來自接受者并且抗原是來自供體。在此方法的另一實施方案中,Stro-1亮細胞和/或其子代細胞和/或由所述Stro-1亮細胞和/或其子代細胞得到的可溶性因子經過遺傳工程改造以表達阻斷T細胞的共刺激的分子。STRO-1亮細胞可以是自體的或同種異體的。在一個實施方案中,STRO-1亮細胞是同種異體的。在此方法的另一實施方案中,在施用或獲得可溶性因子之前,STRO-1亮細胞和/或其子代細胞已在培養物中擴增。細胞的示例性劑量包括0.1×106至5×106個之間STRO-1亮細胞和/或其子代。例如,所述方法包括施用0.3×106至2×106個之間STRO-1亮細胞和/或其子代。所述方法的一種形式涉及施用低劑量的STRO-1亮細胞和/或其子代。這種低劑量是例如0.1×105與0.5×106個之間的STRO-1亮細胞和/或其子代,諸如約0.3×106個STRO-1亮細胞和/或其子代。本發明還涵蓋多次施用所述細胞和/或可溶性因子。例如,所述方法可涉及施用所述細胞和監測受試者以確定發生或復發GvHD的一種或多種癥狀的時間,以及施用另一劑量的所述細胞和/或可溶性因子。用于評估GvHD的癥狀的適合方法對于本領域的技術人員將是顯而易見的和/或在本文中描述。在一個實例中,富含STRO-1亮細胞和/或其子代的群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子每周施用一次或頻率更低,諸如每四周一次或頻率更低。在另一實施方案中,富含STRO-1亮細胞和/或其子代細胞的細胞群體和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子是全身性施用。例如,富含Stro-1亮細胞和/或其子代細胞的細胞群體和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子可以靜脈內、動脈內、肌肉內、皮下施用、施用至主動脈中、心臟的心房或心室中或連接至器官的血管中,例如腹主動脈、腸系膜上動脈、胰十二指腸動脈或脾動脈。在另一實施方案中,本發明方法進一步包括施用免疫抑制劑。免疫抑制劑可施用持續足以允許所述移植細胞具有功能的時間。在一個實例中,免疫抑制劑是環孢菌素。環孢菌素可以每公斤體重5mg至40mg的劑量施用。在本說明書中,用語“包括(comprise)”或變形(諸如“comprises”或“comprising”)應理解為意指包括所述要素、整數或步驟或者要素、整數或步驟的組,而不排除任何其它要素、整數或步驟或者要素、整數或步驟的組。附圖簡述圖1.TNAP(STRO-3)和間質前體細胞標志物STRO-1亮在成人BMMNC中的共表達。通過孵育MACS選擇的BMMNC并用與FITC偶合的山羊抗鼠類IgM抗體間接標記的STRO-l(x軸)和用與PE偶合的山羊抗鼠類IgG間接標記的STRO-3mAb(鼠類IgG1)(y軸)進行雙色免疫熒光和流式細胞術。點陣直方圖表示以列表模式數據形式收集的5×104個事件。垂直線和水平線設定為小于用在相同條件下處理的同種型匹配對照抗體1B5(IgG)和1A6.12(IgM)獲得的平均熒光的1.0%的反應性水平。結果表明STRO-1亮細胞的較小群體共表達TNAP(右上象限),而其余STRO-1+細胞未能與STRO-3mAb反應。圖2.經過培養和擴增的STRO-1亮MPC的STRO-1亮或STRO-1暗子代的基因表達譜。通過胰蛋白酶/EDTA處理制備離體擴增的骨髓MPC的單細胞懸浮液。將細胞用STRO-1抗體染色,所述STRO-1抗體隨后通過與山羊抗鼠類IgM-異硫氰酸熒光素一起孵育加以顯現。熒光活化細胞分選(A)后,由經過純化的表達STRO-1暗或STRO-1亮的細胞的群體制備總細胞RNA。使用RNAzolB提取方法和標準程序,從各子群體分離總RNA并用作cDNA合成的模板。使用如先前所述的標準方案(Gronthos等JCellSci.116:1827-1835,2003)通過PCR擴增評估各種轉錄物的表達。此研究中所用的引物組在表2中示出。擴增后,通過1.5%瓊脂糖凝膠電泳對各反應混合物進行分析,并通過溴化乙錠染色進行觀測(B)。使用ImageQant軟件參考持家基因GAPDH的表達來評估各細胞標志物的相對基因表達(C)。圖3.經過培養和擴增的STRO-1+MPC的STRO-1亮子代表達高水平的SDF-1,STRO-1暗子代不能。(A)使用FACS根據區域STRO-1亮和STRO-1暗/深將通過MACS分離的STRO-1+BMMNC制備物劃分為不同STRO-1子集。從各STRO-1子群制備總RNA并用于構建STRO-1亮消減雜交文庫(B-C)。復制已用由經過STRO-1亮消減cDNA轉化的細菌克隆擴增的代表性PCR產物點印的硝化纖維素過濾器。過濾器接著用[32P]三磷酸脫氧胞苷(dCTP)標記的STRO-1亮(B)或STRO-1暗/深(C)消減cDNA探測。箭頭指示含有對應于人SDF-1的cDNA片段的1個克隆的差異表達。(D)逆轉錄酶(RT)-PCR分析顯示由培養前通過MACS/FACS新近分離的BMMNCSTRO-1群體制備的總RNA中SDF-1和甘油醛-3-磷酸脫氫酶(GAPDH)轉錄物的相對表達。bp表示堿基對。圖4.STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)抑制T細胞增殖的功效的比較。在不存在或存在制備物A或B下將PBMC用經過CD3/CD28涂布的珠粒刺激4天。通過3H-Tdr并入根據每分鐘計數(cpm)測量T細胞增殖。圖5.STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)抑制T細胞增殖的功效的比較。在不同濃度的制備物A或B存在下將PBMC用涂有CD3/CD28的珠粒刺激4天。通過3H-Tdr并入測量各種培養物中的T細胞增殖并報道為在不存在MSC下刺激PBMC時對照T細胞增殖的百分比。圖6.STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)對GvHD的影響的比較。將去除了T細胞的來自B10.D2(H2d)供體的骨髓單核細胞(BMMC)(5×106)和脾細胞(30×106)靜脈內注射至經過致死輻照(750cGy)的BALB/c(H2d)接受者小鼠中。4周后,向接受者小鼠每只小鼠注射1×106個MSC(制備物A1)或MPC(制備物B1)或者接受者小鼠不接受進一步處理(對照)。每組八只小鼠經受注射。以一周時間間隔對小鼠進行評估。時間表示周數。圖7.STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)對GvHD的影響的比較。將去除了T細胞的來自B10.D2(H2d)供體的骨髓單核細胞(BMMC)(5×106)和脾細胞(30×106)靜脈內注射至經過致死輻照(750cGy)的BALB/c(H2d)接受者小鼠中。4周后,向接受者小鼠注射制備物A或B(A1、A2、B1、B2)的1或2×106個細胞,或者接受者小鼠不接受進一步處理(對照)。每組八只小鼠經受注射。圖8.高劑量STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)對GvHD的影響的比較。將去除了T細胞的來自B10.D2(H2d)供體的骨髓單核細胞(BMMC)(5×106)和脾細胞(30×106)靜脈內注射至經過致死輻照(750cGy)的BALB/c(H2d)接受者小鼠中。4周后,向接受者小鼠注射制備物A或B(A2、B2)的2×106個細胞,或者接受者小鼠不接受進一步處理(對照2)。每組八只小鼠經受注射,但組B2和A2中分別有4只和3只小鼠在注射后不久死亡。圖9.低劑量STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)對GvHD的影響的比較。將去除了T細胞的來自B10.D2(H2d)供體的骨髓單核細胞(BMMC)(5×106)和脾細胞(30×106)靜脈內注射至經過致死輻照(750cGy)的BALB/c(H2d)接受者小鼠中。4周后,向接受者小鼠注射制備物A或B(A0.3、B0.3)的0.3×106個細胞,或者接受者小鼠不接受進一步處理(對照2)。每組六只小鼠經受注射。圖報道各小鼠的GvHD評分。圖10.低劑量STRO-1陰性MSC(制備物A)和STRO-1亮MPC(制備物B)對GvHD的影響的比較。將去除了T細胞的來自B10.D2(H2d)供體的骨髓單核細胞(BMMC)(5×106)和脾細胞(30×106)靜脈內注射至經過致死輻照(750cGy)的BALB/c(H2d)接受者小鼠中。4周后,向接受者小鼠注射制備物A或B(A0.3、B0.3)的0.3×106個細胞,或者接受者小鼠不接受進一步處理(對照2)。每組六只小鼠經受注射。圖報道各小鼠的平均GvHD評分。詳細描述本文呈示的結果表明,在改善GvHD方面,富含STRO-1亮細胞的細胞群體出乎意料地優于STRO-1陰性間質干細胞制備物。因此,本發明提供用于減輕哺乳動物患者的GvHD并發癥發展的方法,所述方法包括向患者施用富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子。例如,本發明提供用于減輕哺乳動物患者的由骨髓移植引起的GvHD并發癥發展的方法,所述方法包括向患者施用(a)骨髓譜系細胞的前體和(b)富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子,其中富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子以有效降低患者的GvHD的嚴重性的量施用。如本文所用,術語“可溶性因子”應理解為指可溶于水的由STRO-1亮細胞和/或其子代產生的任何分子,例如蛋白質、肽、糖蛋白、糖肽、脂蛋白、脂肽、碳水化合物等。所述可溶性因子可以在細胞內和/或由細胞分泌。所述可溶性因子可以是復雜混合物(例如上清液)和/或其組分和/或可以是純化的因子。在本發明的一個實施方案中,可溶性因子是上清液或是含于上清液內。因此,本文涉及施用一種或多種可溶性因子的任何實施方案應理解為對上清液的施用作了必要修改。本發明的方法可能涉及施用僅僅富含STRO-1亮細胞和/或其子代細胞的細胞群體,和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子。本發明方法還可能涉及施用僅僅子代細胞,或由所述子代細胞得到的可溶性因子。本發明方法還可能涉及施用STRO-1亮細胞和其子代細胞的混合群體,或來自STRO-1亮細胞和其子代細胞的混合培養物的可溶性因子。本發明優選應用于人,然而,預期本發明也適用于動物,并且它們可能包括農業動物(諸如牛、綿羊、豬等)、家養動物(諸如狗、貓)、實驗室動物(諸如小鼠、大鼠、倉鼠和兔)或者可用于運動的動物(諸如馬)。因此,STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子可用于通過在移植供體細胞之前或同時向接受者施用有效減少或消除接受者的T細胞針對移植物的免疫反應的量的STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子來使接受者的免疫系統適應供體或外來骨髓細胞。STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子影響接受者的T細胞以使得當出現供體或外來組織時T細胞反應得到減少或消除。因此,在骨髓(造血干細胞)移植的情形中,移植物對宿主的攻擊可得到減少或消除。在將骨髓或外周血液干細胞移植至接受者體內之前,供體骨髓可用接受者的STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子預處理。在一個優選實施方案中,供體骨髓首先暴露于接受者組織/細胞,隨后用STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子處理。盡管不加限制,但據信最初與接受者組織或細胞的接觸的作用是活化骨髓中的T細胞。隨后用STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子處理抑制或消除骨髓中T細胞的進一步活化,由此減少或消除供體組織的不良影響,即所述療法減少或消除移植物抗宿主反應。在另一實施方案中,可通過向罹患移植物抗宿主疾病的移植物接受者施用有效減少或消除宿主的移植物排斥反應的量的供體自身的或與供體同種異體的STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子來治療所述接受者以降低或消除所述疾病的嚴重性,所述同種異體細胞可以是與接受者同種異體的STRO-1亮細胞和/或其子代細胞或為第三方STRO-1亮細胞和/或其子代細胞。STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子抑制或阻抑供體組織中的活化T細胞免于發起針對接受者的免疫反應,由此減少或消除移植物抗宿主反應。接受者的STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子可以在移植之前從接受者獲得并且可儲存和/或培養擴增以提供足以用于治療正發生的移植物對宿主攻擊的量的STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子的儲備庫。進一步預期,可能僅需要本發明的STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子的單次治療,從而消除對長期免疫抑制藥物療法的需要。或者,可能采用多次施用Stro-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子。STRO-1亮細胞和/或其子代細胞和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子的劑量可在寬泛限度內變化,并且當然適于各特定情況下的個別要求。一般來說,在腸胃外施用的情況下,通常每公斤接受者體重施用約1萬至5百萬個細胞。所用細胞的數量將取決于接受者的體重和病狀、施用的次數或頻率以及本領域的技術人員已知的其它變量。細胞可以懸浮于適當稀釋劑中,濃度為每毫升約0.01至約5×106個細胞。所述方法的一種形式涉及施用低劑量的STRO-1亮細胞和/或其子代。這種低劑量是例如0.1×105與0.5×106個之間的STRO-1亮細胞和/或其子代,諸如約0.3×106個STRO-1亮細胞和/或其子代。適用于注射溶液的賦形劑為在生物學上和生理學上與細胞和與接受者相容的賦形劑,諸如緩沖鹽水溶液或其它適合賦形劑。用于施用的組合物優選根據符合適當無菌性和穩定性的標準方法配制、制備和儲存。以下實例進一步說明本發明的各方面。然而,它們絕不對本文所述的本發明的教導和公開構成限制。STRO-1亮細胞或子代細胞,和由其得到的上清液或者一種或多種可溶性因子STRO-1亮細胞為在骨髓、血液、牙髓細胞、脂肪組織、皮膚、脾、胰、腦、腎、肝、心臟、視網膜、腦、毛囊、腸、肺、淋巴結、胸腺、骨、韌帶、肌腱、骨骼肌、真皮和骨膜中發現的細胞;并且通常能夠分化成生殖系(germline),諸如中胚層和/或內胚層和/或外胚層。因此,STRO-1亮細胞能夠分化成大量細胞類型,包括但不限于脂肪組織、骨組織、軟骨組織、彈性組織、肌肉組織和纖維結締組織。這些細胞所進入的特定譜系決定和分化路徑取決于來自機械影響和/或內源性生物活性因子(諸如生長因子、細胞因子)和/或由宿主組織建立的局部微環境條件的各種影響。STRO-1亮細胞因此優選為非造血祖細胞,其分裂產生子細胞,所述子細胞為干細胞或適時不可逆分化產生表型細胞的前體細胞。在一個優選實施方案中,STRO-1亮細胞是從由受試者(例如欲治療的受試者或相關受試者或不相關受試者(無論是相同物種抑或不同物種))獲得的樣本富集而來。術語“富集”或其變形在本文中用于描述一種細胞群體,其中當與未處理群體相比較時,一種特定細胞類型的比例或者多種特定細胞類型的比例增加。在一個實施方案中,相對于STRO-1暗或STRO-1中間細胞,STRO-1亮細胞優先富集。在一個優選實施方案中,本發明中所用的細胞表達一種或多種個別地或全體選自由以下組成的組的標志物:TNAP+、VCAM-1+、THY-1+、STRO-2+、CD45+、CD146+、3G5+或其任何組合。“個別地”指本發明獨立地涵蓋所述標志物或標志物組,以及雖然個別標志物或標志物組不能獨立地在本文中列出,但隨附權利要求書仍可彼此獨立地和分開地定義所述標志物或標志物組。“全體”指本發明涵蓋任何數量的所述標志物或肽組或其組合,以及雖然所述數量的標志物或標志物組或其組合不能在本文中具體列出,但隨附權利要求書仍可將所述組合或子組合與標志物或標志物組的任何其它組合獨立地和分開地定義。優選地,STRO-1亮細胞另外是TNAP+、VCAM-1+、THY-1+、STRO-2+和/或CD146+中的一種或多種。對于指定標志物稱為“陽性”的細胞,其可能根據標志物存在于細胞表面上的程度而表達低(lo或暗)或高(亮(bright)、亮(bri))水平的所述標志物,其中所述術語涉及細胞分選過程中所用的熒光或其它標志物的強度。lo(或暗或深)和亮的區別應放在所分選特定細胞群體上所用的標志物的情形中加以理解。對于指定標志物稱為“陰性”的細胞不一定完全不存在于所述細胞。所述術語指細胞表達所述標志物的水平相對極低,并且當在可檢測標記時產生極低信號或者在背景水平以上不可檢測。當在本文中使用時,術語“亮”是指細胞表面上的標志物在可檢測標記時產生相對較高的信號。雖然不希望受理論限制,但提出“亮”細胞所表達的靶標志物蛋白(例如由STRO-1識別的抗原)比樣本中的其它細胞多。例如,當用綴合FITC的STRO-1抗體標記時,如通過熒光活化細胞分選(FACS)分析所測定的STRO-1亮細胞產生比非亮細胞((STRO-1深/暗)高的熒光信號。優選地,“亮”細胞構成起始樣本中所含的最亮標記的骨髓單核細胞的至少約0.1%。在其它實施方案中,“亮”細胞構成起始樣本中所含的最亮標記的骨髓單核細胞的至少約0.1%、至少約0.5%、至少約1%、至少約1.5%或至少約2%。在一個優選實施方案中,STRO-1亮細胞的STRO-1表面表達相對于“背景”(即STRO-1-細胞)具有2個對數量級以上的表達。相比之下,STRO-1暗和/或STRO-1中間細胞的STRO-1表面表達與“背景”相比具有小于2個對數量級的表達,通常與“背景”相比約1個對數以下。如本文所用,術語“TNAP”意欲涵蓋組織非特異性堿性磷酸酶的所有亞型。例如,所述術語涵蓋肝亞型(LAP)、骨亞型(BAP)和腎亞型(KAP)。在一個優選實施方案中,TNAP是BAP。在一個特別優選的實施方案中,如本文所用的TNAP是指可以結合由2005年12月19日根據布達佩斯條約(BudapestTreaty)的規定以保藏編號PTA-7282保藏于ATCC的雜交瘤細胞系產生的STRO-3抗體的分子。此外,在一個優選實施方案中,STRO-1亮細胞能夠產生克隆CFU-F。優選大比例的多能細胞能夠分化成至少兩種不同生殖系。多能細胞可以發展成的譜系的非限制性實例包括骨前體細胞;肝細胞祖細胞,其具有膽道上皮細胞和肝細胞的多潛能;神經限制細胞,其可以產生會發展成少突膠質細胞和星形膠質細胞的神經膠質細胞前體;神經元前體,其會發展出神經元;心肌和心肌細胞、葡萄糖反應性胰島素分泌胰腺β細胞系的前體。其它譜系包括但不限于成牙質細胞、牙質產生細胞和軟骨細胞,以及以下的前體細胞:視網膜色素上皮細胞、成纖維細胞、皮膚細胞(諸如角化細胞)、樹突狀細胞、毛囊細胞、輸尿管上皮細胞、平滑肌和骨骼肌細胞、睪丸祖細胞、血管內皮細胞、肌腱、韌帶、軟骨、脂肪細胞、成纖維細胞、骨髓基質、心肌、平滑肌、骨骼肌、周細胞、血管、上皮、神經膠質、神經元、星形膠質細胞和少突膠質細胞。在另一實施方案中,STRO-1亮細胞在培養時不能產生造血細胞。在一個實施方案中,細胞是取自欲治療的受試者,使用標準技術在體外培養并且用于獲得上清液或可溶性因子或擴增細胞以自體或同種異體組合物形式施用至受試者。在可選實施方案中,使用一種或多種已建立的人細胞系的細胞。在本發明的另一適用實施方案中,使用非人動物的細胞(或者如果患者不是人,則來自于另一物種)。本發明還涵蓋使用由自體外培養物產生的STRO-1亮細胞和/或其子代細胞(后者也稱為擴增細胞)獲得或得到的上清液或可溶性因子。本發明的擴增細胞根據培養條件(包括培養基中刺激因子的數量和/或類型)、傳代次數等可以具有多種表型。在某些實施方案中,子代細胞是在從親本群體傳代約2次、約3次、約4次、約5次、約6次、約7次、約8次、約9次或約10次后獲得。然而,子代細胞可以在從親本群體傳代任何次后獲得。子代細胞可以通過在任何適合培養基中培養而獲得。如本文在提及細胞培養時使用的術語“培養基”包括細胞周圍環境的組分。培養基可以是固體、液體、氣態或相和材料的混合物。培養基包括液體生長培養基以及不供養細胞生長的液體培養基。培養基也包括膠狀培養基,諸如瓊脂、瓊脂糖、明膠和膠原蛋白基質。示例性氣態培養基包括在皮氏培養皿(petridish)或其它固體或半固體支持物上生長的細胞所暴露的氣相。術語“培養基”也指意欲用于細胞培養中的材料,即使其尚未與細胞接觸。換句話說,制備用于細菌培養的富營養液體是培養基。當與水或其它液體混合時變得適于細胞培養的粉末混合物可稱為“粉狀培養基”。在一個實施方案中,適用于本發明方法的子代細胞是通過使用經過STRO-3抗體標記的磁性珠粒從骨髓分離TNAP+STRO-1+多能細胞,并接著培養擴增所分離的細胞來獲得(關于適合培養條件的實例,請參見Gronthos等Blood85:929-940,1995)。在一個實施方案中,所述擴增細胞(子代)(優選至少在5次傳代后)可以是TNAP-、CC9+、I類HLA+、II類HLA-、CD14-、CD19-、CD3-、CD11a-c-、CD31-、CD86-、CD34-和/或CD80-。然而,在與本文所述不同的培養條件下,不同標志物的表達有可能會變化。此外,雖然具有這些表型的細胞可在擴增細胞群體中占優勢,但這并不指較小比例的細胞不具有此表型(例如,小百分比的擴增細胞可以是CC9-)。在一個優選實施方案中,擴增細胞仍具有分化成不同細胞類型的能力。在一個實施方案中,用于獲得上清液或可溶性因子或細胞本身的擴增細胞群體包含其中至少25%,更優選至少50%細胞的細胞是CC9+。在另一實施方案中,用于獲得上清液或可溶性因子或細胞本身的擴增細胞群體包含其中至少40%,更優選至少45%細胞的細胞是STRO-1+。在另一實施方案中,擴增細胞可表達一種或多種全體或個別地選自由以下組成的組的標志物:LFA-3、THY-1、VCAM-1、ICAM-1、PECAM-1、P-選擇蛋白、L-選擇蛋白、3G5、CD49a/CD49b/CD29、CD49c/CD29、CD49d/CD29、CD90、CD29、CD18、CD61、整聯蛋白β6-19、血栓調節蛋白、CD10、CD13、SCF、PDGF-R、EGF-R、IGF1-R、NGF-R、FGF-R、瘦素-R(STRO-2=瘦素-R)、RANKL、STRO-1亮和CD146或這些標志物的任何組合。在一個實施方案中,來源于STRO-1亮細胞的子代細胞對于標志物Stro-1暗呈陽性。這些細胞稱為組織特異性定向細胞(TissueSpecificCommittedCell;TSCC)并且比STRO-1亮細胞更趨向于分化,因此與誘導因子反應的能力較低。TSCC可以發展成的譜系的非限制性實例包括肝細胞祖細胞,其具有膽道上皮細胞和肝細胞的多潛能;神經限制細胞,其可以產生會發展成少突膠質細胞和星形膠質細胞的神經膠質細胞前體;和神經元前體,其會發展成神經元;心肌和心肌細胞、葡萄糖反應性胰島素分泌性胰腺β細胞系的前體。其它定向譜系包括但不限于軟骨細胞、成骨細胞、成牙質細胞、牙質產生細胞和軟骨細胞,以及以下的前體細胞:視網膜色素上皮細胞、成纖維細胞、皮膚細胞(諸如角化細胞)、樹突狀細胞、毛囊細胞、輸尿管上皮細胞、平滑肌和骨骼肌細胞、睪丸祖細胞、血管內皮細胞、肌腱、韌帶、軟骨、脂肪細胞、成纖維細胞、骨髓基質、破骨細胞和造血支持基質、心肌、平滑肌、骨骼肌、周細胞、血管、上皮、神經膠質、神經元、星形膠質細胞和少突膠質細胞。前體包括明確可以產生結締組織,特別包括脂肪組織、蜂窩組織、骨組織、軟骨組織、彈性組織和纖維結締組織的那些細胞。在另一實施方案中,子代細胞是如WO2006/032092中所定義和/或所述的多能擴增STRO-1+多能細胞子代(MEMP)。制備可用于得到子代的STRO-1+多能細胞的富集群體的方法描述于WO01/04268和WO2004/085630中。在體外情形中,STRO-1+多能細胞極少以絕對純制備物形式存在,而是一般與作為組織特異性定向細胞(TSCC)的其它細胞一起存在。WO01/04268提出以約0.1%至90%的純度水平從骨髓采集所述細胞。包含可得到子代的MPC的群體可直接從組織來源采集,或者其可為已在離體擴增的群體。例如,子代可獲自大致上純化的STRO-1+多能細胞的已采集且未擴增的群體,其構成其所存在的群體總細胞的至少約0.1%、1%、5%、10%、20%、30%、40%、50%、60%、70%、80%或95%。此水平可以通過例如選擇對至少一種個別地或全體選自由TNAP、STRO-1亮、3G5+、VCAM-1、THY-1、CD146和STRO-2組成的組的標志物呈陽性的細胞來實現。MEMPS可與新鮮采集的STRO-1亮細胞的區別之處在于其對于標志物STRO-1亮呈陽性且對于標志物堿性磷酸酶(ALP)呈陰性。相比之下,新鮮分離的Stro-1亮細胞對于STRO-1亮和ALP兩者都呈陽性。在本發明的一個優選實施方案中,至少15%、20%、30%、40%、50%、60%、70%、80%、90%或95%的所施用細胞具有表型STRO-1亮、ALP-。在另一優選實施方案中,MEMPS對于標志物Ki67、CD44和/或CD49c/CD29、VLA-3、α3β1中的一種或多種呈陽性。在另一優選實施方案中,MEMP不顯示TERT活性和/或對于標志物CD18呈陰性。STRO-1亮細胞起始群體可源自任一種或多種組織類型,包括骨髓、牙髓細胞、脂肪組織和皮膚,或許更廣泛來說來自脂肪組織、牙齒、牙髓、皮膚、肝、腎、心臟、視網膜、腦、毛囊、腸、肺、脾、淋巴結、胸腺、胰、骨、韌帶、骨髓、肌腱和骨骼肌。應理解,在實施本發明時,帶有任何指定細胞表面標志物的細胞的分離可以通過多種不同方法來實現,然而,優選方法依賴于結合劑(例如抗體或其抗原結合片段)與所關注標志物的結合,隨后分離顯示結合(為高水平結合或低水平結合)或不結合的那些細胞。最適宜結合劑為抗體或基于抗體的分子,優選為單克隆抗體或基于單克隆抗體,因為后者具有特異性。抗體在兩個步驟中都可使用,然而也可以使用其它試劑,因此這些標志物的配體也可以用于富集帶有所述標志物或缺乏所述標志物的細胞。抗體或配體可連接至固體支持物以允許粗分離。分離技術優選使欲收集的部分的活力保持最大。具有不同功效的各種技術可用于獲得相對較粗的分離。所用特定技術將取決于分離效率、相關細胞毒性、執行的容易性和速度,以及復雜設備和/或技術技能的必要性。分離程序可包括但不限于使用涂有抗體的磁性珠粒的磁性分離、親和色譜和利用連接至固體基質的抗體的“淘選”。提供精確分離的技術包括但不限于FACS。實施FACS的方法對于本領域的技術人員來說是顯而易見的。針對本文所述的各標志物的抗體可商購獲得(例如抗STRO-1的單克隆抗體可從R&DSystems,USA商購獲得)、從ATCC或其它保藏組織獲得和/或可使用業內公認的技術產生。分離STRO-1亮細胞的方法優選例如包括第一步驟,其為利用例如識別STRO-1的高水平表達的磁性活化細胞分選(MACS)的固相分選步驟。必要時接著可進行第二分選步驟以產生更高水平的前體細胞表達。此第二分選步驟可能涉及使用兩種或更多種標志物。獲得STRO-1亮細胞的方法還可能包括使用已知技術進行第一富集步驟之前采集細胞來源。因此,組織將以手術方式移除。接著將構成來源組織的細胞分離為所謂單細胞懸浮液。此分離可以通過物理和或酶學方式達成。一旦獲得了適合的STRO-1亮細胞群體,就可以通過任何適合方式對其進行培養或擴增以獲得MEMP。在一個實施方案中,細胞是取自欲治療的受試者,使用標準技術在體外培養并且用于獲得上清液或可溶性因子或擴增細胞以作為自體或同種異體組合物形式施用至受試者。在可選實施方案中,使用一種或多種已建立的人細胞系的細胞來獲得上清液或可溶性因子。在本發明的另一適用實施方案中,使用非人動物的細胞(或者如果患者不是人,則來自另一物種)來獲得上清液或可溶性因子。本發明可以使用來自任何非人動物物種的細胞加以實施,包括但不限于非人靈長類動物細胞、有蹄類動物、犬科動物、貓科動物、兔類動物、嚙齒動物、鳥類動物和魚類動物細胞。可用于實施本發明的靈長類動物細胞包括但不限于黑猩猩、狒狒、食蟹獼猴和任何其它新世界或舊世界猴類的細胞。可用于實施本發明的有蹄類動物細胞包括但不限于牛、豬、綿羊、山羊、馬、水牛和野牛的細胞。可用于實施本發明的嚙齒動物細胞包括但不限于小鼠、大鼠、天竺鼠、倉鼠和沙鼠細胞。可用于實施本發明的兔類動物物種的實例包括家兔、長腿大野兔、野兔、棉尾兔、雪地兔和鼠兔。雞(原雞(Gallusgallus))為可用于實施本發明的鳥類物種的一個實例。適用于本發明方法的細胞在使用前或獲得上清液或可溶性因子前可儲存。保藏和儲存真核細胞和尤其哺乳動物細胞的方法和方案在本領域中是已知的(參見例如Pollard,J.W.和Walker,J.M.(1997)BasicCellCultureProtocols,第二版,HumanaPress,Totowa,N.J.;Freshney,R.I.(2000)CultureofAnimalCells,第四版,Wiley-Liss,Hoboken,N.J.)。遺傳修飾的細胞在一個實施方案中,對STRO-1亮細胞和/或其子代細胞進行遺傳修飾,例如表達和/或分泌目標蛋白質,例如提供治療和/或預防效益的蛋白質,例如胰島素、胰高血糖素、生長抑素、胰蛋白酶原、胰凝乳蛋白酶原、彈性蛋白酶、羧肽酶、胰脂肪酶或淀粉酶,或與血管生成增強有關或引起血管生成的多肽,或與細胞分化成胰腺細胞或血管細胞有關的多肽。遺傳修飾細胞的方法對于本領域的技術人員來說是顯而易見的。例如,使欲在細胞中表達的核酸可操作地連接至用于在細胞中誘導表達的啟動子。例如,將核酸連接至可在受試者的多種細胞中可操作的啟動子,諸如病毒啟動子,例如CMV啟動子(例如CMV-IE啟動子)或SV-40啟動子。其它適合啟動子在本領域中是已知的并且應理解為在作了必要修改的情況下適用于本發明的實施方案。優選地,核酸是以表達構建體的形式提供。如本文所用,術語“表達構建體”是指具有在細胞中將表達賦予到可操作地連接的核酸(例如報道基因和/或可反選擇的報道基因)的能力的核酸。在本發明的上下文中,應了解,表達構建體可包含或為質粒、噬菌體、噬菌粒、粘粒、病毒亞基因組或基因組片段或能夠以可表達格式維持和/或復制異源DNA的其它核酸。構建適用于實施本發明的表達構建體的方法對于本領域的技術人員來說將是顯而易見的并且描述于以下文獻中:例如Ausubel等(CurrentProtocolsinMolecularBiology.WileyInterscience,ISBN047150338,1987)或Sambrook等(MolecularCloning:MolecularCloning:ALaboratoryManual,ColdSpringHarborLaboratories,NewYork,第三版2001)。例如,使用例如PCR從適合模板核酸擴增表達構建體的各組分并隨后克隆至適合的表達構建體(諸如質粒或噬菌粒)中。適于所述表達構建體的載體在本領域中是已知的和/或在本文中描述。例如,適于哺乳動物細胞中的本發明方法的表達載體為例如由Invitrogen供應的pcDNA載體套裝的載體、pCI載體套裝的載體(Promega)、pCMV載體套裝的載體(Clontech)、pM載體(Clontech)、pSI載體(Promega)、VP16載體(Clontech)或pcDNA載體套裝的載體(Invitrogen)。本領域的技術人員將認識到其它載體和所述載體的來源,諸如Invitrogen公司、Clontech或Promega。用于將分離的核酸分子或包含所述核酸的基因構建體引入細胞中用于表達的方式對于本領域的技術人員來說是已知的。用于指定生物體的技術取決于已知成功的技術。用于將重組DNA引入細胞中的方式包括顯微注射、DEAE-葡聚糖介導的轉染、脂質體(諸如使用lipofectamine(Gibco,MD,USA)和/或cellfectin(Gibco,MD,USA))介導的轉染、PEG介導的DNA吸收、電穿孔和微粒轟擊(諸如使用涂有DNA的鎢粒子或金粒子(AgracetusInc.,WI,USA)以及其它方式。或者,本發明的表達構建體是病毒載體。適合病毒在本領域中是已知的并且可商購獲得。用于遞送核酸和使所述核酸整合至宿主細胞基因組中的常規基于病毒的系統包括例如逆轉錄病毒載體、慢病毒載體或腺相關病毒載體。或者,腺病毒載體適用于將保持游離形式的核酸引入宿主細胞中。病毒載體為靶細胞和組織中基因轉移的有效且通用的方法。另外,已在多種不同細胞類型和靶組織中觀察到高轉導效率。例如,逆轉錄病毒通常包含包裝能力高達6-10kb外來序列的順式作用長末端重復(LTR)。最小順式作用LTR就足以用于載體的復制和包裝,其接著用于將表達構建體整合至靶細胞中以提供長期表達。廣泛使用的逆轉錄病毒載體包括基于以下病毒的載體:鼠類白血病病毒(MuLV)、長臂猿白血病病毒(GaLV)、猿猴免疫缺陷病毒(SrV)、人免疫缺陷病毒(HIV)和其組合(參見例如Buchscher等,JVirol.56:2731-2739(1992);Johann等,J.Virol.65:1635-1640(1992);Sommerfelt等,Virol.76:58-59(1990);Wilson等,J.Virol.63:274-2318(1989);Miller等,J.Virol.65:2220-2224(1991);PCT/US94/05700;Miller和RosmanBioTechniques7:980-990,1989;Miller,A.D.HumanGeneTherapy7:5-14,1990;Scarpa等Virology75:849-852,1991;Burns等Proc.Natl.Acad.SciUSA90:8033-8037,1993)。已開發各種腺相關病毒(AAV)載體系統用于核酸遞送。AAV載體可以使用本領域中已知的技術容易地構建。參見例如美國專利號5,173,414和5,139,941;國際公布號WO92/01070和WO93/03769;Lebkowski等Molec.Cell.Biol.5:3988-3996,1988;Vincent等(1990)Vaccines90(ColdSpringHarborLaboratoryPress);CarterCurrentOpinioninBiotechnology5:533-539,1992;Muzyczka.CurrentTopicsinMicrobiol,andImmunol.158:97-129,1992;Kotin,HumanGeneTherapy5:793-801,1994;Shelling和SmithGeneTherapy7:165-169,1994;和Zhou等JExp.Med.179:1867-1875,1994。適用于遞送本發明的表達構建體的其它病毒載體包括例如來源于痘病毒家族的載體,諸如牛痘病毒和禽痘病毒或α病毒或綴合病毒載體(例如Fisher-Hoch等,Proc.NatlAcad.Sci.USA56:317-321,1989中所述的載體)。細胞和可溶性因子的治療/預防潛能的分析用于測定由STRO-1亮細胞得到的可溶性因子治療或預防GvHD或延遲GvHD的發作或發展的能力的方法對于本領域的技術人員來說是顯而易見的。例如,適于測定可溶性因子的免疫抑制活性的體外測試描述于本文的實施例5中。在另一實例中,可溶性因子的功效可如本文的實施例6和7所述在GvHD的體內模型中評估。本領域的技術人員根據前述內容顯而易見,本發明還提供用于鑒別或分離用于治療、預防或延遲GvHD的可溶性因子的方法,所述方法包括:(i)向罹患GvHD的測試受試者施用可溶性因子并評估所述受試者中GvHD的進展;(ii)比較(i)受試者中GvHD的水平與罹患GvHD但未施用可溶性因子的對照受試者體內GvHD的水平,其中測試受試者體內的GvHD相較于對照受試者降低表明所述可溶性因子治療、預防或延緩GvHD。細胞組合物在本發明的一個實施方案中,STRO-1亮細胞和/或其子代細胞是以組合物形式施用。優選地,所述組合物包含藥學上可接受的載體和/或賦形劑。術語“載體”和“賦形劑”是指在本領域中常規用于促進活性化合物的儲存、施用和/或生物活性的物質的組合物(參見例如Remington'sPharmaceuticalSciences,第16版,MacPublishingCompany(1980)。載體還可減少活性化合物的任何不當副作用。適合載體例如是穩定的,例如不能與載體中的其它成分反應。在一個實例中,載體在用于治療的劑量和濃度下在接受者體內不產生明顯的局部或全身性不良作用。適用于本發明的載體包括那些常規使用的載體,例如水、鹽水、右旋糖水溶液、乳糖、林格氏溶液(Ringer'ssolution)、緩沖溶液、透明質酸和二醇是優選液體載體,特別是(當等滲時)溶液的載體。適合藥用載體和賦形劑包括淀粉、纖維素、葡萄糖、乳糖、蔗糖、明膠、麥芽、稻米、面粉、白堊、硅膠、硬脂酸鎂、硬脂酸鈉、甘油單硬脂酸酯、氯化鈉、甘油、丙二醇、水、乙醇等。在另一實例中,載體是介質組合物,例如細胞在其中生長或懸浮的介質組合物。優選地,所述介質組合物不在其所施用的受試者中誘發任何不良作用。優選介質和賦形劑不會不利地影響細胞活力和/或細胞減少、預防或延遲胰腺功能異常的能力。在一個實例中,載體和賦形劑提供緩沖活性以使細胞和/或可溶性因子維持在適合pH下,由此發揮生物活性,例如載體或賦形劑是磷酸鹽緩沖鹽水(PBS)。PBS代表一種有吸引力的載體或賦形劑,因為其與細胞和因子相互作用的程度最低并且允許快速釋放細胞和因子,在這種情況下,可將本發明的組合物制造為用于例如通過注射直接應用至血流或組織或圍繞組織周圍或與組織相鄰的區域中的液體。STRO-1亮細胞和/或其子代細胞也可以并入或包埋于與接受者相容并且降解為對接受者無害的產物的骨架中。所述骨架提供對欲移植到接受受試者體內的細胞的支持和保護。天然和/或合成生物可降解性骨架為所述骨架的實例。多種不同的骨架可成功用于實施本發明。優選骨架包括但不限于生物可降解的骨架。天然生物可降解骨架包括膠原蛋白、纖連蛋白和層連蛋白骨架。適用于細胞移植骨架的合成材料應能夠支持廣泛細胞生長和細胞功能。所述骨架可被吸收。適合骨架包括聚乙醇酸骨架,例如如Vacanti等,J.Ped.Surg.23:3-91988;Cima等,Biotechnol.Bioeng.38:1451991;Vacanti等,Plast.Reconstr.Surg.88:753-91991所述,或合成聚合物,諸如聚酸酐、聚原酸酯和聚乳酸。在另一實例中,細胞可在凝膠骨架(諸如來自Upjohn公司的Gelfoam)中施用。適用于本發明的細胞組合物可以單獨施用或作為與其它細胞的混合物施用。可結合本發明組合物施用的細胞包括但不限于其它多效或多能細胞或干細胞,或骨髓細胞。不同類型的細胞可在臨施用前或施用前不久與本發明組合物混合,或者其可以在施用前一起共培養一段時間。優選地,組合物包含有效量或治療或預防有效量的細胞。例如,組合物包含約1×105個STRO-1亮細胞/kg至約1×107個STRO-1亮細胞/kg或約1×106個STRO-1亮細胞/kg至約5×106個STRO-1亮細胞/kg。欲施用的細胞的確切量取決于多種因素,包括患者的年齡、體重和性別以及胰腺功能異常的程度和嚴重性。在一些實施方案中,細胞是含于不允許細胞離開進入受試者循環中,然而允許由細胞分泌的因子進入循環中的腔室中。以此方式,可通過允許細胞分泌因子進入受試者循環中來向受試者施用可溶性因子。所述腔室同樣可植入受試者的某一部位以增加可溶性因子的局部水平,例如在移植器官中或其附近植入。在本發明的一些實施方案中,可不必或不需要在起始細胞組合物療法前對患者進行免疫抑制。因此,移植同種異體或者甚至異種的STRO-1亮細胞或其子代在一些情況下可能是耐受的。然而,在其它情況下,在起始細胞療法前以藥理學方式對患者進行免疫抑制可能是需要或適當的。這可以通過使用全身性或局部免疫抑制劑來實現,或者這可以通過在囊封裝置中遞送細胞來實現。細胞可以囊封在細胞所需要的營養物和氧以及治療因子可透過,而細胞不可透過的膠囊中來免疫體液因子和細胞。優選地,囊封劑具有低變應原性,容易地且穩定地位于靶組織中,并且對所植入的結構提供額外保護。降低或消除對移植細胞的免疫反應的這些和其它方式在本領域中是已知的。作為替代,可對細胞進行遺傳修飾以降低其免疫原性。可溶性因子的組合物在本發明的一個實施方案中,由STRO-1亮細胞得到和/或由子代細胞得到的上清液或可溶性因子是以例如包含適合載體和/或賦形劑的組合物形式施用。優選地,載體或賦形劑不會不利地影響可溶性因子或上清液的生物學作用。在一個實施方案中,組合物包含穩定可溶性因子或上清液組份(例如蛋白酶抑制劑)的物質的組合物。優選地,所包括蛋白酶抑制劑的量不足以對受試者產生不良影響。包含由STRO-1亮細胞得到和/或由子代細胞得到的上清液或可溶性因子的組合物可制備為適當液體懸浮液,例如于培養基或于穩定載體或緩沖溶液(例如磷酸鹽緩沖鹽水)中的懸浮液。適合載體在上文中描述。在另一實例中,包含由Stro-1亮細胞得到和/或由子代細胞得到的上清液或可溶性因子的懸浮液是用于注射的油性懸浮液。適合親脂性溶劑或媒劑包括脂肪油,諸如芝麻油;或合成脂肪酸酯,諸如油酸乙酯或甘油三酯;或脂質體。欲用于注射的懸浮液也可含有增加懸浮液的粘度的物質,諸如羧甲基纖維素鈉、山梨糖醇或聚葡萄糖。任選地,懸浮液也可含有適合的穩定劑或增加化合物的溶解度以允許制備高度濃縮溶液的試劑。可以通過在具有上述成分之一或其組合的適當溶劑中并入所需量的上清液或可溶性因子,需要時隨后過濾滅菌來制備無菌注射溶液。一般來說,通過將上清液或可溶性因子并入含有基本分散介質或來自以上列出成分的其它所需成分的無菌媒劑中來制備分散液。在用于制備無菌注射溶液的無菌粉末的情況下,優選制備方法是真空干燥和冷凍干燥,此舉產生活性成分加來自其前述無菌過濾溶液的任何其它所需成分的粉末。根據本發明的替代方面,上清液或可溶性因子可以與一種或多種增強它的溶解度的其它化合物一起配制。其它示例性載體或賦形劑描述于以下文獻中:例如Hardman等,(2001)GoodmanandGilman'sThePharmacologicalBasisofTherapeutics,McGraw-Hill,NewYork,N.Y.;Gennaro(2000)Remington:TheScienceandPracticeofPharmacy,Lippincott,Williams,andWilkins,NewYork,N.Y.;Avis等,(編著)(1993)PharmaceuticalDosageForms:ParenteralMedications,MarcelDekker,NY;Lieberman等,(編著)(1990)PharmaceuticalDosageForms:Tablets,MarcelDekker,NY;Lieberman等,(編著)(1990)PharmaceuticalDosageForms:DisperseSystems,MarcelDekker,NY;Weiner和Kotkoskie(2000)ExcipientToxicityandSafety,MarcelDekker,Inc.,NewYork,N.Y.。治療性組合物通常應無菌且在制造和儲存條件下穩定。組合物可配制成溶液、微乳液、脂質體或其它有序結構。載體可為含有例如水、乙醇、多元醇(例如甘油、丙二醇和液體聚乙二醇等)和其適合混合物的溶劑或分散介質。可例如通過使用包衣(諸如卵磷脂)、在分散液的情況下通過維持所需粒度和通過使用表面活性劑來維持適當流動性。在許多情況下,優選在組合物中包括等滲劑(例如糖)、多元醇(諸如甘露糖醇、山梨糖醇)或氯化鈉。可注射組合物的延長吸收可通過在組合物中包括延遲吸收的試劑(例如單硬酯酸鹽和明膠)來達成。此外,可溶性因子可以于時間釋放制劑中施用,例如于包括緩慢釋放聚合物的組合物中施用。活性化合物可用保護化合物免于快速釋放的載體制備,諸如控制釋放制劑,包括植入物和微囊化遞送系統。可以使用生物可降解的、生物相容性聚合物,諸如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、膠原蛋白、聚原酸酯、聚乳酸和聚乳酸聚乙醇酸共聚物(PLG)。多種用于制備所述制劑的方法已獲得專利或通常為本領域的技術人員所已知。上清液或可溶性因子可與例如提供可溶性因子的緩慢釋放的適當基質組合施用。施用模式由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代可手術植入、注射、遞送(例如借助于導管或注射器)或以其它方式直接或間接施用至需要修復或增強的部位(例如器官)或施用至受試者的血液系統中。優選地,由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代是遞送至受試者的血流中。例如,由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代是以腸胃外方式遞送。腸胃外施用的示例性途徑包括但不限于靜脈內、肌肉內、皮下、動脈內、腹膜內、心室內、腦室內、鞘內。優選地,由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代是動脈內遞送至主動脈、心臟的心房或心室或連接至胰腺的血管(例如腹主動脈、腸系膜上動脈、胰十二指腸動脈或脾動脈)中。在細胞遞送至心臟的心房或心室的情況下,優選將細胞施用至左心房或左心室以避免可能由細胞快速遞送至肺而引起的并發癥。優選地,例如使用注射器或通過導管或中心管線將由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代注射至遞送部位中。用于治療性制劑的施用方案的選擇取決于若干因素,包括實體的血清或組織周轉率、癥狀水平和實體的免疫原性。優選地,施用方案使與可接受水平的副作用相一致的遞送至患者的治療性化合物的量達到最大。因此,所遞送制劑的量部分取決于特定實體和所治療病狀的嚴重性。在一個實施方案中,由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代是以單次推注劑量來遞送。或者通過連續輸注、或通過間隔為例如一天、一周或每周1-7次的劑量來施用由STRO-1亮細胞得到的上清液或可溶性因子、STRO-1亮細胞或其子代。優選劑量方案是涉及最大化劑量或避免明顯不當副作用的劑量頻率的方案。總每周劑量取決于所使用化合物的類型和活性。適當劑量由臨床醫師例如使用本領域中已知或懷疑影響治療或預測影響治療的參數或因素來確定。一般來說,劑量始于稍小于最佳劑量的量并在此后以較小增量增加直至相對于任何負面副作用達成所需或最佳的效果。重要診斷指標包括糖尿病癥狀指標。實施例實施例1:MSC制備MSC是如US5,837,539中所述由骨髓重新產生。將約80-100ml骨髓抽吸至含肝素無菌注射器中并送至MDACC細胞療法實驗室(MDACCCellTherapyLaboratory)以供產生MSC。使用ficoll-hypaque分離骨髓單核細胞并置于兩個T175燒瓶中,其中每個燒瓶具有50mlMSC擴增培養基,所述培養基包括含有慶大霉素、谷氨酰胺(2mM)和20%(v/v)胎牛血清(FBS)(Hyclone)的α改良MEM(αMEM)。將細胞在37RC、5%CO2下培養2-3天,此時移除未粘附細胞;連續培養其余粘附細胞直至細胞匯合度達到70%或更高(7-10天),并接著將細胞用胰蛋白酶處理且置于六個具有MSC擴增培養基的T175燒瓶中(每個燒瓶50ml培養基)。如US5,837,539的表5中所述,以此方式分離和擴增的MSC為STRO-1陰性。實施例2:通過選擇STRO-3+細胞對MPC進行免疫選擇根據皇家阿德萊德醫院(RoyalAdelaideHospital)的機構倫理委員會(InstitutionalEthicsCommittee)批準的程序從健康正常的成人志愿者(20-35歲)采集骨髓(BM)。簡單地說,從髂后嵴抽吸40mlBM至含肝素鋰抗凝劑的試管中。如先前所述TM使用Lymphoprep(Zannettino,A.C.etal.(1998)Blood92:2613-2628)(NycomedPharma,Oslo,Norway)通過密度梯度分離制備BMMNC。在4RC下以400×g離心30分鐘后,用轉移吸管移除白細胞層并在由含有5%胎牛血清(FCS;CSLLimited,Victoria,Australia)的漢克氏平衡鹽溶液(HBSS;LifeTechnologies,Gaithersburg,MD)構成的“HHF”中洗滌三次。隨后如前所述(Gronthosetal.(2003)JournalofCellScience116:1827-1835;Gronthos,S.andSimmons,P.J.(1995)Blood85:929-940)通過磁性活化細胞分選分離STRO-3+(或TNAP+)細胞。簡單地說,在冰上將約1-3×108個BMMNC在由10%(v/v)正常兔血清于HHF中組成的阻斷緩沖液中孵育20分鐘。在冰上將細胞用200μl的STRO-3mAb于阻斷緩沖液中的10μg/ml溶液孵育1小時。隨后通過在400×g下離心將細胞在HHF中洗滌兩次。加入山羊抗小鼠γ-生物素(SouthernBiotechnologyAssociates,Birmingham,UK)于HHF緩沖液中的1/50稀釋液且在冰上將細胞孵育1小時。如上將細胞在MACS緩沖液(補充有1%BSA,5mMEDTA和0.01%疊氮化鈉的無Ca2+且無Mn2+的PBS)中洗滌兩次并再懸浮于最終體積為0.9ml的MACS緩沖液中。將100μl抗生蛋白鏈菌素微珠(MiltenyiBiotec;BergischGladbach,Germany)加入細胞懸浮液中且在冰上孵育15分鐘。將細胞懸浮液洗滌兩次并再懸浮于0.5mlMACS緩沖液中且隨后上樣至微型MACS管柱(MSColumns,MiltenyiBiotec)上,并用0.5mlMACS緩沖液洗滌三次以恢復未結合STRO-3mAb(于2005年12月19日保藏于美國典型培養物中心(AmericanTypeCultureCollection;ATCC),保藏編號PTA-7282-參見國際公布號WO2006/108229)。再加入1mlMACS緩沖液后,由磁體移除管柱并通過正壓力分離TNAP+細胞。將來自各部分的細胞等分試樣用抗生蛋白鏈菌素-FITC染色并通過流式細胞術評估純度。實施例3:通過STRO-3mAb選擇的細胞是STRO-1亮細胞設計實驗以證實使用STRO-3mAb作為用于分離細胞STRO-1亮細胞的單一試劑的可能性。鑒于STRO-3(IgG1)的同種型與STRO-1(IgM)的同種型不同,因此通過雙色FACS分析基于與使用MACS程序分離的STRO-1+細胞的共表達評估STRO-3鑒定克隆CFU-F的能力(圖1)。點陣直方圖表示以列表模式數據形式收集的5×104個事件。垂直線和水平線設定為小于用在相同條件下處理的同種型匹配對照抗體1B5(IgG)和1A6.12(IgM)獲得的平均熒光的<1.0%的反應性水平。結果表明較小群體的STRO-1亮細胞共表達TNAP(右上象限),而其余STRO-1+細胞未能與STRO-3mAb反應。隨后分析所有四個象限的通過FACS分離的細胞的CFU-F發生率(表1)。表1:通過雙色FACS分析基于細胞表面標志物STRO-1和TNAP的共表達富集人骨髓細胞(參考圖1)。將FACS分選的細胞在標準克隆條件下在補充有20%FCS的αMEM中培養。數據表示鋪板的每105個細胞中第14天群落形成細胞(CFU-F)的平均數±SE(n=3個不同骨髓抽吸物)。這些數據表明人MPC僅局限于BM(其明顯共表達STRO-1抗原)的TNAP陽性部分。骨髓部分每105個細胞中CFU-F的頻率富集(增加倍數)未分級的BMMNC11.0±2.21.0TNAP+/STRO-1亮4,511±185410TNAP+/STRO-1深0.00.0實施例4:STRO-1深和Stro-1亮細胞的相對基因和表面蛋白表達在第一系列實驗中,采用半定量RT-PCR分析來檢驗由通過熒光活化細胞分選分離的STRO-1深或STRO-1亮群體表達的各種譜系相關基因的基因表達譜(圖2A)。在第二系列實驗中,采用流式細胞術和平均通道熒光分析來檢驗由通過熒光活化細胞分選分離的STRO-1深或STRO-1亮群體表達的各種譜系相關蛋白質的表面蛋白質表達譜。從2×106個STRO-1亮或STRO-1深分選的原代細胞、軟骨細胞集結粒和其它誘導培養物制備總細胞RNA,并使用RNAzolB提取方法(BiotecxLab.Inc.,Houston,TX)根據制造商的推薦裂解。從各子群分離的RNA接著用作cDNA合成的模板,使用第一鏈cDNA合成試劑盒(PharmaciaBiotech,Uppsala,Sweden)進行制備。如前所述(Gronthosetal.,J.BoneandMin.Res.14:48-57,1999)通過PCR擴增使用標準方案評估各種轉錄物的表達。此研究中所用的引物組在表2中示出。擴增后,通過1.5%瓊脂糖凝膠電泳對各反應混合物進行分析,并通過溴化乙錠染色進行觀測。通過GAPDH的表達來評估RNA完整性。使用ImageQant軟件參考持家基因GAPDH的表達來評估各細胞標志物的相對基因表達(圖2B、2C)。另外,與STRO-1抗體組合基于多種細胞譜系相關標志物的表達使用雙色流式細胞分析來檢驗離體擴增的MPC的蛋白質表達譜。基于STRO-1深和STRO-1亮培養細胞的基因和蛋白質表達的一般表型的概述表示于表3中。數據表明,離體擴增的STRO-1亮MPC顯示與血管周圍細胞相關的標志物(包括血管位蛋白1、VCAM-1、SDF-1、IL-1β、TNFα和RANKL)的差異表達較高。STRO-1深和STRO-1亮培養細胞的蛋白質和基因表達譜之間的比較概述于表3和表4中。還進行消減雜交研究以鑒定由STRO-1亮細胞唯一表達的基因。簡單地說,如上所述分離STRO-1深和STRO-1亮(參見圖3A)。使用RNASTAT-60系統(TEL-TEST)由從5個不同骨髓樣本匯集的STRO-1深和STRO-1亮細胞制備總RNA。使用SMARTcDNA合成試劑盒(ClontechLaboratories)進行第一鏈合成。通過長程PCR(Advantage2PCR試劑盒;Clontech)使用在初始RT過程中形成的3'和5'初始末端上的特定引物位點根據制造商的說明書擴增所得mRNA/單鏈cDNA雜交體。用RsaI消化STRO-1亮cDNA后,使用2個等分試樣利用ClontechPCR-SelectcDNA消減試劑盒來連接不同特定接頭寡核苷酸。根據制造商的方案使用STRO-1亮(測試者)和STRO-1深(驅動者)cDNA且反之亦然來進行兩輪消減雜交。也使用針對STRO-1亮驅動cDNA雜交的STRO-1深測試cDNA逆向進行此程序。為鑒定由STRO-1亮群體唯一表達的基因,使用STRO-1亮消減cDNA來構建包含200個隨機選擇的轉化有連接至T/A克隆載體中的STRO-1亮消減cDNA的細菌克隆的重復低密度微陣列過濾器。隨后用[32P]dCTP標記的STRO-1亮或STRO-1深消減cDNA探測微陣列(圖3B-3C)。不同篩選鑒定出總共44個克隆,其在STRO-1深與STRO-1亮子群之間高度地差異表達。對所有差異表達的克隆進行的DNA測序揭示,僅1個克隆代表已知基質細胞有絲分裂原;即,血小板衍生生長因子(PDGF)(Gronthos和Simmons,Blood.85:929-940,1995)。有趣的是,發現44個克隆中有6個含有對應于趨化因子基質衍生因子1(SDF-1)的DNA插入。人STRO-1亮細胞中SDF-1轉錄物的高豐度通過由新鮮分選的STRO-1亮、STRO-1深和STRO-1陰性骨髓子群制備的總RNA的半定量RT-PCR得到證實(圖3D和表3)。表2.用于特異性擴增人mRNA的RT-PCR引物和條件表3.STRO-1亮和STRO-1深群體中相對基因表達的概述。示出當通過逆轉錄PCR測定時在STRO-1亮與STRO-1深群體之間顯示可測量且差異表達的基因列表。值表示參考持家基因GAPDH的相對基因表達。為使蛋白質表面表達與STRO-1表達的密度相關聯,通過胰蛋白酶/EDTA分離制備離體擴增的由骨髓MPC得到的細胞的單細胞懸浮液并隨后與STRO-1抗體與鑒定多種細胞譜系相關標志物的抗體的組合一起孵育。使用山羊抗鼠類IgM-異硫氰酸熒光素鑒定STRO-1,同時使用山羊抗小鼠或抗兔IgG-藻紅蛋白鑒定所有其它標志物。對于鑒定細胞內抗原的那些抗體,首先用STRO-1抗體標記細胞制備物,用70%冷乙醇固定以使細胞膜滲透并接著與細胞內抗原特異性抗體一起孵育。在相同條件下使用同種型匹配對照抗體。使用COULTEREPICS流式細胞儀進行雙色流式細胞分析并收集列表模式數據。點陣圖表示指示各譜系細胞標志物(y軸)和STRO-1(x軸)的熒光強度水平的5,000個列表模式事件。參考同種型匹配陰性對照抗體建立垂直和水平象限。表4.STRO-1亮和STRO-1深群體中相對蛋白質表達的概述。示出當通過流式細胞術測定時在STRO-1亮與STRO-1深群體之間顯示差異表達的蛋白質的列表。值表示染色的相對平均熒光強度。這些結果表明SDF-1α和RANKL由STRO-1亮細胞大量表達。它的重要性在于這些蛋白質都已知參與CD4+CD25+調節性T細胞的上調,所述T細胞賦予抵抗免疫病癥(諸如GVHD)的保護作用(Loser等,NatureMedicine12:1372-1379,2006;Hess,Biol.BloodMarrowTransplant,12(1Suppl2):13-21,2006;和Meiron等,J.Exp.Medicine205:2643-2655,2008)。實施例5:體外免疫抑制活性為評估培養擴增的STRO-1亮細胞(MPC(B))的免疫抑制活性,我們使用CD3/CD28刺激作為讀數。將結果與培養擴增的如實施例1中分離的骨髓來源的STRO-1陰性細胞(MSC(A))的群體相比較。在4個遞增濃度的MSC和MPC制備物存在下用涂有CD3/CD28的珠粒刺激人外周血液單核細胞(PBMC)。通過3H-Tdr并入測量T細胞的增殖。測試MSC(A)和STRO-1亮MPC(B)抑制人外周血液單核細胞(PBMC)對CD3/CD28刺激的反應的能力。加入與PBMC培養物呈不同比率的MSC和MPC或商購對照人MSC(Lonza)。3天后,加入3H-Tdr維持18個小時并接著采集培養物。PBMC回應于CD3/CD28的增殖由所有制備物以劑量依賴性方式抑制。然而,制備物B明顯優于由制備物A以及對照hMSC產生的作用(圖4)。在1:100MSC:PBMC比率下,MPCB仍抑制70%的對照T細胞增殖,而對照商購MSC(Lonza)和MSCA分別產生50%和60%抑制(圖5)。實施例6:GvHD的誘發和治療使用移植物抗宿主疾病(GvHD)模型基于多個次要組織相容性位點錯配的供體接受者對來對STRO-1亮細胞(MPC(B))的體內免疫抑制活性進行研究。將去除了T細胞的來自B10.D2(H2d)供體的骨髓單核細胞(BMMC)(5×106)和脾細胞(30×106)靜脈內注射至經過致死輻照(750cGy)的BALB/c(H2d)接受者小鼠中。在此情況下,來自B10.D2的脾淋巴細胞識別和攻擊BALB/c接受者組織并產生體重降低、纖維化和脫毛。使用常規評分系統通過在移植后4-5周對動物進行稱重并評估皮膚表現來監測疾病。作為比較,評估如實施例1中所分離的骨髓來源的STRO-1陰性細胞(MSC(A))的免疫抑制活性。雖然小鼠的陽性對照組不接受任何進一步處理,但從第4周開始每周向實驗組靜脈內注射每只小鼠2×106、1×106或0.3×106的劑量的MSC(A)或STRO-1亮MPC(B)持續3次。每周監測小鼠兩次。各組含有八只小鼠。實施例7:MSC和MPC對GvHD發展的影響小鼠接受1或2×106個MSCA(A1和A2)、1或2×106個MPCB(B1和B2)。在不存在或存在MSC處理下疾病的動力學報道于圖6中。輸注1×106個細胞后,在B與A的作用之間存在明顯差異。雖然接受制備物A的小鼠與沒有接受細胞的小鼠未顯示任何實質性差異,但注射了制備物B的組顯示對疾病嚴重性有明顯有益的影響。移植后十三周,已接受了B1的小鼠的平均GvHD評分為0.5,相比之下,其它組中為2.3。我們接著研究抗GvHD作用是否具有劑量依賴性。因此根據針對先前劑量所述的相同模態,向一組小鼠注射較高劑量(每只小鼠2×106個)且一組注射較低劑量(每只小鼠0.3×106個)的A或B。圖7報道最高劑量的作用。高劑量MPC(B2)的治療作用相對于A2較優,其中在此組中在前11周根本未見GvHD。在第14周和第15周,每只小鼠GvHD的后果甚至更明顯(圖8),其中在A1組中根本沒有小鼠存活。最后,注射較低劑量(每只小鼠0.3×106個)再次顯示到第9周時,STRO-1亮MPC(B)對GVHD評分降低具有優于A的效果(圖9和圖10)。此試驗性研究的數據一致表明,與未處理或用STRO-1陰性MSC處理相比,STRO-1亮MPC顯示較高的免疫抑制能力。這在體外分析并且更重要的是在體內分析中是明顯的。STRO-1亮MPC在每只小鼠0.3-2×106個細胞的劑量范圍內對于預防指定GvHD產生了明顯的臨床效果。本發明涉及以下實施方式:1.一種用于預防哺乳動物患者的GvHD并發癥發展或治療所述GvHD并發癥的方法,所述方法包括向所述哺乳動物施用富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子。2.如上述實施方式1所述的方法,其中所述方法包括向所述哺乳動物施用(a)骨髓譜系細胞的前體,和(b)富含STRO-1亮細胞和/或其子代的細胞群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子。3.如實施方式2所述的方法,其中在施用所述骨髓譜系細胞的前體之前向所述哺乳動物施用富含STRO-1亮細胞和/或其子代細胞的所述細胞群體和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子。4.如實施方式2所述的方法,其中富含STRO-1亮細胞和/或其子代細胞的所述細胞群體和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子與所述骨髓譜系細胞的前體共同施用。5.如實施方式2至4中任一項所述的方法,其中所述骨髓譜系細胞的前體是施用至所述哺乳動物以治療血液的惡性或遺傳性疾病的同種異體細胞。6.如實施方式1至5中任一項所述的方法,其中所述STRO-1亮細胞和/或其子代是同種異體的。7.如實施方式1至6中任一項所述的方法,其中富含STRO-1亮細胞和/或其子代細胞的所述細胞群體和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子是全身性施用。8.如實施方式7所述的方法,其中富含STRO-1亮細胞和/或其子代細胞的所述細胞群體和/或由所述STRO-1亮細胞和/或其子代細胞得到的可溶性因子是通過靜脈內注射施用。9.如實施方式1至8中任一項所述的方法,所述方法包括施用0.1×106至5×106個之間的STRO-1亮細胞和/或其子代。10.如實施方式1至9中任一項所述的方法,所述方法包括施用0.3×106至2×106個之間的STRO-1亮細胞和/或其子代。11.如實施方式1至10中任一項所述的方法,所述方法包括施用低劑量的STRO-1亮細胞和/或其子代。12.如實施方式11所述的方法,其中所述低劑量的STRO-1亮細胞和/或其子代包含0.1×105至0.5×106個之間的STRO-1亮細胞和/或其子代。13.如實施方式11所述的方法,其中所述低劑量的STRO-1亮細胞和/或其子代包含約0.3×106個STRO-1亮細胞和/或其子代。14.如實施方式1至13中任一項所述的方法,其中富含STRO-1亮細胞和/或其子代的所述群體和/或由所述STRO-1亮細胞和/或其子代得到的可溶性因子是每周一次或以更低頻率施用。15.如實施方式1至14中任一項所述的方法,其中所述哺乳動物正罹患化學療法和輻射療法后的再生障礙性貧血、骨髓纖維化或骨髓衰竭。16.如實施方式1至15中任一項所述的方法,其中所述方法進一步包括向所述哺乳動物施用免疫抑制藥物。本文件中引用的所有參考文獻都是以引用的方式并入本文。本領域的技術人員應了解,可在不背離本發明的作廣義描述的精神和范圍下如特定實施方案中所示對本發明作出多種變化和/或修改。因此在所有方面,本發明的實施方案視為僅具說明性而不具限制性。當前第1頁1 2 3
相關技術
網友詢問留言
已有0條留言
- 還沒有人留言評論。精彩留言會獲得點贊!
1