一種蛋白自組裝新型納米疫苗及其制備方法與流程
本發明屬于高分子納米生物醫藥材料領域,尤其是涉及一種蛋白自組裝新型納米疫苗及其制備方法,基于大分子抗原蛋白分子調控,通過內部巰基交聯、蛋白再折疊或自組裝的方法將抗原肽或免疫佐劑載入蛋白,形成高密度納米疫苗。
背景技術:
疫苗保護人類免受諸多致命性疾病的侵襲,是人類歷史上最成功的醫療措施,如在全世界范圍內根除了天花并且有效地減少了其它一些烈性的傳染病感染,例如:脊髓灰質炎、白喉、破傷風、百日咳、麻疹、腮腺炎以及風疹病毒的感染等,在改善了人類的生活質量的同時,更是大大延長了人類的平均壽命。根據美國國立衛生研究院2010年的統計數據顯示,疫苗每年至少減少了250萬例死亡與難以計數的其他病例。
傳統的疫苗設計采用病原微生物及其代謝產物,經過人工減毒、脫毒、滅活等方法制成疫苗,其缺點在于如果病原體滅活不徹底,會導致生物安全風險。當前的傳統疫苗主要是指滅活苗和弱毒苗,但也存在著很難解決的弊端。如,常規疫苗生產成本高,需要佐劑和多種免疫接種方式才能引起有效地免疫保護,并且容易受到母源抗體的干擾,而對新生幼畜具有很低或沒有免疫保護作用。類毒素可以引起體液免疫應答但是不產生或產生很少的細胞免疫應答;滅活苗中不能引起免疫應答的部分不僅對預防傳染沒有作用,反而有可能減弱能引起免疫反應部分產生的免疫保護作用。滅活苗中還含有對機體有害的物質,例如,內毒素等。活疫苗存在致病力并且有污染的風險,一般說來,滅活苗安全但和活疫苗相比其產生免疫保護的時間短并且保護力弱。而活疫苗中存在致病毒株和其它病原體的風險非常高。弱毒疫苗既可以產生體液免疫又能產生細胞免疫,但是弱毒疫苗僅適用于少數病原和免疫力低下的動物。
亞單位疫苗是利用微生物表面的一種或多種保護性抗原誘發機體產生保護性免疫應答,但亞單位疫苗通常免疫原性較弱,需要添加佐劑來增強免疫原性,例如經fda批準的鋁佐劑及弗氏佐劑。但是,已有許多人對鋁佐劑的安全及質量問題提出了質疑,如:鋁佐劑不能凍干,制備的疫苗批與批之間差異大,質量難控制且對佐劑的效果很難做出準確的評價;主要刺激th2相關抗體的產生,只能誘導產生體液免疫應答;增加發生超敏反應的危險。
核酸疫苗是將編碼某種抗原蛋白的外源基因(dna或rna)直接導入動物體細胞內,誘導宿主產生對該抗原蛋白的免疫應答,以達到預防或治療疾病目的。有案可查的動物用dna疫苗包括:馬西尼羅病毒疫苗、人用hivdna疫苗等。由于dna疫苗可能存在與機體細胞基因組dna發生整合的擔憂,一些疫苗學家可能對其應用于人體持謹慎態度。
納米疫苗作為一種新型納米疫苗,是目前疫苗領域的一大熱點。納米顆粒作為抗原與佐劑的遞送工具和免疫增強劑被廣泛應用,不僅提高了抗原、佐劑的穩定性,增強抗原的遞呈效率和免疫原性,促進抗原胞內加工,可與主要組織相容性復合體(majorhistocompatibilitycomplex,mhc)分子特異性結合;同時也能夠靶向遞呈抗原,具有緩釋功能;重要的是,許多納米顆粒自身具有免疫佐劑活性,可高效增強機體免疫應答。然而,納米載體如納米乳劑、脂質體、膠束、plga、硅納米粒、金納米棒等,也帶來了很多問題,如抗原與佐劑負載效率低、載體在疫苗組分中占比過高;抗原與佐劑的顆粒內包封使得抗原的表面多展示近似于無;動物或人體內產生了針對納米顆粒的抗體,例如peg是獲得公認的生物相容性良好的生物材料,但卻被發現機體內產生了針對peg的抗體;納米載體的毒性與體內代謝問題也沒有得到很好的解決。
重要的是,傳統的疫苗偏重于疾病的預防,在轉向至免疫治療時往往效果不佳,而對已發病的個體則不能誘發免疫應答,也無法抵御疾病的發生。
技術實現要素:
本發明的目的就是為了克服上述現有技術存在的缺陷而提供一種基于抗原內部二硫鍵自納米化交聯的、全抗原新型自納米化納米疫苗及其制備方法,該納米粒子能有效解決現有疫苗技術合成成本高、合成過程復雜、涉及生物安全性等問題,也有效解決了現有納米疫苗設計領域使用外源載體、化學交聯劑及抗原密度低、無抗原表面展示等傳統問題,并且結構穩定、易于儲存、具有高度模擬病毒結構的特點,實現了載體即抗原,同時納米顆粒又具有免疫佐劑的雙重作用。該納米疫苗可高效促進免疫細胞對抗原的吞噬,無細胞毒性,具有良好的生物相容性,可高效刺激樹突細胞成熟、產生免疫反應。
本發明的目的可以通過以下技術方案來實現:
新型自納米化納米疫苗,僅包括抗原蛋白與免疫佐劑。所述的抗原包括,病毒抗原、細菌抗原以及腫瘤抗原,來自于病毒、細菌、其他微生物、腫瘤或基因工程蛋白產物,所述的免疫佐劑包括,所述免疫佐劑為toll樣受體激動劑、nod樣受體激動劑、細胞因子佐劑、dna類免疫佐劑、皂苷類佐劑、多肽類佐劑及抗原肽、多糖類佐劑、無機納米佐劑、有機納米佐劑、化療藥或它們的組合。
本發明的技術方案為:一種制備具有抗原高密度的新型自納米化納米疫苗的方法,包括以下步驟:
(a)用一種溶劑溶解蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件中將免疫佐劑或其它物質加入步驟(a)中所述的蛋白溶液中,使蛋白去折疊以巰基暴露,通過二硫鍵交聯以及蛋白再折疊或自組裝,把免疫佐劑或多肽包入蛋白,形成蛋白納米顆粒;(c)將合成的納米疫苗快速冷卻,以停止反應;(d)形成的納米疫苗溶液可通過簡單的物理方法去除體系無用的小分子成分,提純或濃縮,得到新型自納米化納米疫苗。
所述的這些抗原是這樣的抗原,已經被使用或者可用于治療或預防易于影響動物界以及人的多種疾病,尤其為:白喉(diphtheria)、破傷風(tetanus)、脊髓灰質炎(polio)、狂犬病(rabies)、百日咳(whoopingcough)、甲型肝炎、乙型肝炎或丙型肝炎(hepatitisa,borc)、黃熱病(yellowfever)、傷寒(typhoidfever)、水痘(chickenpox)、麻疫(measles)、腿腺炎(mumps)、德國麻疫(germanmeasles)、乙型腦炎(japaneseencephalitis)、流感(influenza)、腦膜炎(meningitis)、霍亂(cholera);由以下病毒介導的傳染:輪狀病毒(rotavirus)、諾如病毒(norovirus)、鼻病毒(rhinovirus)、呼吸道合胞病毒(respiratorysyncytialvirus)、單純皰疫病毒(herpessimplexvirus)、乳頭狀瘤病毒(papillomavirus)、巨細胞病毒(cytomegalovirus)、西尼羅河病毒(westnilevirus)、登革熱病毒(denguevirus)、基孔肯雅病毒(chikungunyavirus)、hiv(aids);由以下引起的細菌性疾病:鏈球菌(streptococci)、沙眼衣原體和肺炎衣原體(trachomatisandpneumoniae)、淋病奈瑟氏球菌和腦膜炎奈瑟氏球菌、粘膜炎莫拉氏菌、金黃色葡萄球菌或b型流感嗜血菌influenzatypeb),李斯特菌病(listeriosis)、志賀氏菌病(shigellosis)、沙門氏菌病(salmonellosis)、結核病(tuberculosis)、萊姆病(lyme’sdisease)、寄生蟲疾病(parasiticcomplaints)諸如痕疾(malaria)、利什曼病(leishmaniosis)等;腫瘤抗原、腫瘤裂解物、腫瘤模式抗原ova等;也可來自于免疫原性較弱的蛋白,包括卵白蛋白、血清白蛋白、乳白蛋白、肌白蛋白、麥白蛋白、豆白蛋白、轉鐵蛋白、胰島素、血管內皮抑素、血紅蛋白、肌紅蛋白、溶菌酶、免疫球蛋白、α-2-巨球蛋白、纖維連接蛋白、纖層蛋白、膠原蛋白、明膠、人造多肽與蛋白,或者它們的組合。
所述的這些抗原是這樣的抗原:蛋白抗原內部之間應包含3個及三個以上巰基,已提供足夠的交聯位點,使之成為化學鍵交聯為主的納米顆粒。
所述的新型自納米化納米疫苗為具有還原敏感性的的納米粒子。
所述的新型自納米化納米疫苗平均粒徑為5~2000nm,優化的為20-800nm,最優的為30~500nm。
所述的新型自納米化納米疫苗體系中,抗原質量分數可≥80%,免疫佐劑≤20%,優化的為抗原質量分數可≥90%,免疫佐劑≤10%。
所述的新型自納米化納米疫苗體系中,toll樣受體激動劑包括tlr2識別的肽聚糖(pgs)、g+菌的酯磷壁酸(lta)、脂阿拉伯甘露聚糖(lam)、細菌dna,tlr3識別的rna病毒的雙鏈rna(dsrna),tlr4識別脂多糖(lps)、熱休克蛋白(hsp)60,tlr5識別的細菌的鞭毛,tlr6識別的支原體雙酰基脂肽,tlr7、tlr8識別呼吸道合胞病毒和流感病毒的單鏈rna,tlr7還可識別一些合成的免疫調節劑,tlr9識別細菌未甲基化的cpgdna,tlr11識別尿道病原菌和剛地弓形蟲的蛋白成分。優化的是tlr3受體識別的poly(i:c)和tlr9識別的cpgodn寡鏈核苷酸。
所述的新型自納米化納米疫苗體系中,nod樣受體激動劑包括nod1識別的配體γ-d-谷氨酸-meso-二氨基庚二酸(γ-d-glu-meso-dap),及nod2識別的配體胞壁酸二肽(n-乙酰胞壁酰-l-丙氨酰-d-異谷氨酰胺,mdp)。
所述的新型自納米化納米疫苗體系中,細胞因子佐劑包括白細胞介素類(il-2、il-6、il-12、il-15、il-18)、干擾素類(ifn-γ)、腫瘤壞死因子類、粒細胞-巨噬細胞集落刺激因子;所述的趨化因子包括巨噬細胞炎癥蛋白-1α,巨噬細胞炎癥蛋白-2,巨噬細胞衍生趨化因子、rantes等。優選的是白細胞介素-12,白細胞介素-18、干擾素-γ,粒細胞-巨噬細胞集落刺激因子。
所述的新型自納米化納米疫苗體系中,dna類免疫佐劑包括包含編碼細胞因子(白細胞介素類、干擾素類、腫瘤壞死因子類、粒細胞-巨噬細胞集落刺激因子)基因及趨化因子基因(巨噬細胞炎癥蛋白,rantes)的dna質粒,優選編碼白細胞介素-12,白細胞介素-18,干擾素-γ,粒細胞-巨噬細胞集落刺激因子的dna質粒。最優的為包含編碼白細胞介素-12、干擾素-γ基因的dna質粒。
所述的新型自納米化納米疫苗體系中,多糖類免疫佐劑為脂多糖、黃芪多糖、人參多糖、黨參多糖、枸杞多糖、淫羊藿多糖、當歸多糖、靈芝多糖、香菇多糖、牛膝多糖。
所述的化療藥是使用過程中低劑量化療促免疫的化療藥,紫杉醇、多柔比星、多西他賽、順鉑、蒽環霉素、弗達拉濱、環磷酰胺。
所述的新型自納米化納米疫苗體系中,所述的多肽為經提純的亞單位疫苗,免疫原性較弱,在使用過程中經常需和免疫佐劑(鋁佐劑、弗氏佐劑)聯用。優選的是包含巰基的多肽。為了更好的復合納米疫苗,可在多肽上人工修飾巰基。
本發明技術方案所述的步驟(a)的溶劑是水,生理鹽水,糖,凍干保護劑或蛋白穩定劑。其中,所述的凍干保護劑是磷酸鹽,醋酸鹽,3-嗎啉丙磺酸(mops)、2-(n-嗎啉)乙磺酸(mes)、檸檬酸、甘氨酸,三羥甲基氨基甲烷(tris),4-羥乙基哌嗪乙磺酸(hepes)過氧化氫,谷胱甘肽,葡萄糖、或它們的組合。所述的蛋白穩定劑是海藻糖,甘露醇,蔗糖,乙酰色氨酸,辛酸鈉或者它們的組合。其中,所述的溶劑優選水,3-嗎啉丙磺酸(mops)、2-(n-嗎啉)乙磺酸(mes)、檸檬酸、甘氨酸,三羥甲基氨基甲烷(tris),辛酸鈉或生理鹽水。最優的是mes緩沖液、pbs緩沖液、tris緩沖液、檸檬酸緩沖液、mops緩沖液中的一種或他們的組合。
本發明技術方案中所述的步驟(b)的變性劑或者適合的變性條件包括水、強酸、強堿、無機鹽、有機溶劑、結構展開劑或表面活性劑。其中,所述的強酸強堿包括鹽酸,硫酸,氫氧化鈉等。所述的有機溶劑是甲醇,乙醇,異丙醇,福爾馬林,氯仿,丙酮,硫化氫或它們的組合。所述的結構展開劑是水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲硫咪唑,乙酰半胱氨酸以及它們的組合。所述的無機鹽是水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,過氧化氫,谷胱甘肽,葡萄糖,蔗糖,甘露醇,海藻糖,乙酰色氨酸,辛酸鈉或它們的組合。
其中,優選的變性劑或者適合的變性條件是水,醋酸鹽,甘氨酸,氯化鈉,葡萄糖,乙醇,丙酮,2-巰基乙醇,尿素、直鏈烷基苯磺酸鈉、十二烷基硫酸鈉、或它們的組合。最優的是水、直鏈烷基苯磺酸鈉、十二烷基硫酸鈉、尿素或它們的組合。
本發明技術方案中所述的步驟(a)的操作ph值為2~13;優選為ph3~11;最優為ph3.5-9.5。
本發明技術方案中所述的步驟(b)的操作溫度為-20~120℃;優選為50~110℃;最優為60~100℃。
本發明技術方案中所述的步驟(b)的反應時間為30s~24h;優選為50s~12h;最優為60s~1h。
本發明技術方案中所述的步驟(b)中適合的變性條件還包括外力操作以輔助蛋白展開。其中,所述的外力包括變化壓力或光照輻射。其中,光照輻射優選紫外光。所述紫外光波長為280-315nm、強度為每平方厘米450微瓦~50毫瓦。本發明技術方案中所述的步驟(c)步驟指的是將反應溶液從反應環境中取出,置于低于反應溫度以下溫度停止反應。該溫度為-20℃-50℃,優選為-10℃-10℃,最優為-5℃-5℃(例:冰水浴)
本發明技術方案中所述的步驟(d)涉及到的物理方法,一般來說,這個步驟包括任意的能夠將小分子從納米粒中分離出去的方法。這些方法可包括鹽沉淀,超濾、透析,層析以及它們的組合。
本發明可能還需要一個步驟(e)將提純后的納米粒經過脫水步驟制成干粉利于長期保存。本發明所涉及的保護的方法包括:離心,冷凍干燥。
本領域技術人員能夠意識到本發明的范圍和精髓是變動的。解折疊的物質是變化的,同時許多的免疫佐劑是可使用的,許多的天然抗原蛋白和抗原多肽是可以用來作為載體的。本發明將會在下面的實施例中得到更加明確和清晰地描述。
下面是對本發明技術方案的進一步描述:
除上面的總的技術方案之外,本發明進一步提出了一種全抗原蛋白的新型納米疫苗的方法,所述方法包含以下幾個步驟:(a)在60~100℃,ph3.5~9.5的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下從而引起蛋白結構展開、巰基暴露,蛋白大分子再折疊或自組裝;(c)將合成的納米疫苗快速冷卻,以停止反應;(d)將納米疫苗透析,以除去無用的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。這里制得的納米疫苗抗原質量分數為100%,平均粒徑為20~800nm,都分散系數pdi<0.4。
本實施方案的方法中的所用的抗原蛋白可來自于從白喉(diphtheria)、破傷風(tetanus)、脊髓灰質炎(polio)、狂犬病(rabies)、百日咳(whoopingcough)、甲型肝炎、乙型肝炎或丙型肝炎(hepatitisa,borc)、黃熱病(yellowfever)、傷寒(typhoidfever)、水痘(chickenpox)、麻疫(measles)、腿腺炎(mumps)、德國麻疫(germanmeasles)、乙型腦炎(japaneseencephalitis)、流感(influenza)、腦膜炎(meningitis)、霍亂(cholera);由以下病毒介導的傳染:輪狀病毒(rotavirus)、諾如病毒(norovirus)、鼻病毒(rhinovirus)、呼吸道合胞病毒(respiratorysyncytialvirus)、單純皰疫病毒(herpessimplexvirus)、乳頭狀瘤病毒(papillomavirus)、巨細胞病毒(cytomegalovirus)、西尼羅河病毒(westnilevirus)、登革熱病毒(denguevirus)、基孔肯雅病毒(chikungunyavirus)、hiv(aids);由以下引起的細菌性疾病:鏈球菌(streptococci)、沙眼衣原體和肺炎衣原體(trachomatisandpneumoniae)、淋病奈瑟氏球菌和腦膜炎奈瑟氏球菌、粘膜炎莫拉氏菌、金黃色葡萄球菌或b型流感嗜血菌influenzatypeb),李斯特菌病(listeriosis)、志賀氏菌病(shigellosis)、沙門氏菌病(salmonellosis)、結核病(tuberculosis)、萊姆病(lyme’sdisease)、寄生蟲疾病(parasiticcomplaints)諸如痕疾(malaria)、利什曼病(leishmaniosis)等;腫瘤抗原、腫瘤裂解物、腫瘤模式抗原ova等;也可來自于免疫原性較弱的蛋白,包括卵白蛋白、血清白蛋白、乳白蛋白、肌白蛋白、麥白蛋白、豆白蛋白、轉鐵蛋白、胰島素、血管內皮抑素、血紅蛋白、肌紅蛋白、溶菌酶、免疫球蛋白、α-2-巨球蛋白、纖維連接蛋白、纖層蛋白、膠原蛋白、明膠、人造多肽與蛋白,或者它們的組合。
本發明技術方案所述的的溶劑是水,生理鹽水,磷酸鹽,醋酸鹽,3-嗎啉丙磺酸(mops)、2-(n-嗎啉)乙磺酸(mes)緩沖液、檸檬酸緩沖液、甘氨酸緩沖液,三羥甲基氨基甲烷(tris),4-羥乙基哌嗪乙磺酸(hepes)、如甘氨酸緩沖液、鄰苯二甲酸緩沖液、檸檬酸緩沖液、醋酸鹽緩沖液、磷酸鹽緩沖液、tris緩沖液、巴比妥鈉緩沖液、硼酸鹽緩沖液、碳酸鹽緩沖液、二(2-羥乙基)亞胺基三(羥甲基)甲烷(mops)緩沖液、二(2-羥乙基)亞胺基三(羥甲基)甲烷(mopso)緩沖液、哌嗪-n,n'-二(2-乙磺酸)(pipes)緩沖液、二(2-羥乙基)亞胺基三(羥甲基)甲烷(bis-tris)緩沖液、三乙醇胺(tea)緩沖液、n,n-雙(2-羥乙基)甘氨酸(bicine)緩沖液、三羥甲基甲胺基丙磺酸(taps)緩沖液、2-(環已胺)-1-乙磺酸(ches)緩沖液、3-(環已胺)-2-羥基-1-丙磺酸(capso)緩沖液、3-(環已胺)-1-丙磺酸(caps)緩沖液、2-氨基-2-甲基-1-丙醇(amp)緩沖液、4-(2-羥乙基)哌嗪-1-2-羥基丙磺酸(heppso)緩沖液、哌嗪-1,4-二羥基丙磺酸(popso)緩沖液、4-羥乙基哌嗪丙磺酸(epps)緩沖液、n-三-(羥甲基)甲基氨基乙酸(tricine)緩沖液、三羥甲基甲胺基丙磺酸(taps)緩沖液、3-[n-(1,1-二甲基-2-羥乙基)]氨基-2-羥丙烷磺酸(ampso)緩沖液、n-(氨基甲酰基甲基)亞氨基二乙酸(ada)緩沖液、6.86.1-7.5182.2n-氨基甲酰甲基乙磺酸(aces)緩沖液、n-雙(2-羥乙基)-2-氨基乙璜酸(bes)緩沖液、n-2-羥乙基哌嗪-n'-2-乙磺酸(hepes)緩沖液、n-3-(羥甲基)甲基-2-氨基乙磺酸(tes)緩沖液、3-[n-n-雙(2-羥乙基)氨基]-2-羥基丙磺酸(dipso)緩沖液、n-3-(羥甲基)甲氨基-2-羥基丙烷磺酸(tapso)緩沖液過氧化氫,谷胱甘肽,葡萄糖、或它們的組合。
此外,本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,福爾馬林,氯仿,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,高氯酸,三丁基膦,甲硫丙脯氨酸,過甲酸,青霉胺,谷胱甘肽,甲硫咪唑,乙酰半胱氨酸以及它們的組合。
本合成方案的方法中的變性劑或者適合的變性條件可以從本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。
本發明技術方案再進一步提出了一種將toll樣受體激動劑包入抗原蛋白,合成新型納米疫苗的方法,所述方法包含以下幾個步驟:(a)在60~100℃,ph3.5~9.5的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下,將toll樣受體激動劑加入步驟(a)中所述的蛋白溶液,從而引起蛋白展開與再折疊或自組裝,將toll受體激動劑包在所述蛋白中;(c)合成的納米粒快速冷卻,以停止反應;(d)將納米粒透析,以除去無用的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。這里制得的納米粒平均粒徑為20~300nm,抗原質量分數≥95%,toll受體激動劑小于等于5%。本合成方案的方法中的變性劑或者適合的變性條件可以從本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。此外,本實施方案的方法中的所用的抗原蛋白可來自于從以上所屬的病毒抗原蛋白、細菌抗原蛋白、其他微生物抗原蛋白、腫瘤抗原蛋白、腫瘤裂解物以及其它基因工程蛋白產物中選擇。
本發明技術方案再進一步提出了一種將抗原多肽包入抗原蛋白,合成新型納米疫苗的方法,所述方法包含以下幾個步驟:(a)在60~100℃,ph3.5~9.5的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下,將toll樣受體激動劑加入步驟(a)中所述的蛋白溶液,從而引起蛋白展開與再折疊或自組裝,將toll受體激動劑包在所述蛋白中;(c)合成的納米粒快速冷卻,以停止反應;(d)將納米粒透析,以除去無用的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。這里制得的納米粒平均粒徑為20~300nm,抗原質量分數≥97%,toll受體激動劑小于等于3%。本合成方案的方法中的變性劑或者適合的變性條件可以從本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。此外,本實施方案的方法中的所用的抗原蛋白可來自于從以上所屬的病毒抗原蛋白、細菌抗原蛋白、其他微生物抗原蛋白、腫瘤抗原蛋白、腫瘤裂解物以及其它基因工程蛋白產物中選擇。
本發明技術方案再進一步提出了一種將巰基修飾的tlr9受體激動劑—cpg-sh及抗原多肽包入抗原蛋白,合成新型納米疫苗的方法,所述方法包含以下幾個步驟:(a)在60~100℃,ph3.5~9.5的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下,將toll樣受體激動劑加入步驟(a)中所述的蛋白溶液,從而引起蛋白展開與再折疊或自組裝,將toll受體激動劑包在所述蛋白中;(c)合成的納米粒快速冷卻,以停止反應;(d)將納米粒透析,以除去無用的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。這里制得的納米粒平均粒徑為20~300nm,抗原質量分數≥97%,toll受體激動劑小于等于3%。本合成方案的方法中的變性劑或者適合的變性條件可以從本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。此外,本實施方案的方法中的所用的抗原蛋白可來自于從以上所屬的病毒抗原蛋白、細菌抗原蛋白、其他微生物抗原蛋白、腫瘤抗原蛋白、腫瘤裂解物以及其它基因工程蛋白產物中選擇。
本發明技術方案再進一步提出了一種將nod樣受體激動劑包入抗原蛋白,合成新型納米疫苗的方法,所述方法包含以下幾個步驟:(a)在60~100℃,ph3.5~9.5的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下,將toll樣受體激動劑加入步驟(a)中所述的蛋白溶液,從而引起蛋白展開與再折疊或自組裝,將toll受體激動劑包在所述蛋白中;(c)合成的納米粒快速冷卻,以停止反應;(d)將納米粒透析,以除去無用的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。這里制得的納米粒平均粒徑為20~500nm,抗原質量分數≥85%,toll受體激動劑小于等于15%。本合成方案的方法中的變性劑或者適合的變性條件可以從本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。此外,本實施方案的方法中的所用的抗原蛋白可來自于從以上所屬的病毒抗原蛋白、細菌抗原蛋白、其他微生物抗原蛋白、腫瘤抗原蛋白、腫瘤裂解物以及其它基因工程蛋白產物中選擇。
本發明技術方案再進一步提出了一種將低濃度化療藥包入抗原蛋白,合成新型納米疫苗的方法,所述方法包含以下幾個步驟:(a)在60~100℃,ph3.5~9.5的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下,將toll樣受體激動劑加入步驟(a)中所述的蛋白溶液,從而引起蛋白展開與再折疊或自組裝,將toll受體激動劑包在所述蛋白中;(c)合成的納米粒快速冷卻,以停止反應;(d)將納米粒透析,以除去無用的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。這里制得的納米粒平均粒徑為20~500nm,抗原質量分數≥85%,toll受體激動劑小于等于15%。本合成方案的方法中的變性劑或者適合的變性條件可以從本實施方案的方法中的變性劑或者適合的變性條件可以包括水,氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,甲醇,乙醇,異丙醇,丙酮,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。此外,本實施方案的方法中的所用的抗原蛋白可來自于從以上所屬的病毒抗原蛋白、細菌抗原蛋白、其他微生物抗原蛋白、腫瘤抗原蛋白、腫瘤裂解物以及其它基因工程蛋白產物中選擇。
本發明技術方案再進一步提出了一種抗原蛋白包載免疫佐劑組分的用于免疫預防和治療的新型納米疫苗,制備這種納米疫苗的方法包含以下幾個步驟:(a)在50~110℃,ph3~11的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下從而引起蛋白結構展開、巰基暴露,蛋白大分子再折疊或自組裝,將免疫佐劑包裹在所述蛋白中;(c)將合成的納米疫苗快速冷卻,以停止反應;(d)將納米疫苗透析,以除去無用的的小分子物質或者進一步濃縮。
本發明技術方案再進一步提出了一種抗原蛋白包載toll樣受體激動劑組分用于免疫預防和治療的新型納米疫苗,制備這種納米疫苗的方法包含以下幾個步驟:(a)在50~110℃,ph3~11的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下從而引起蛋白結構展開、巰基暴露,蛋白大分子再折疊或自組裝,將免疫佐劑包裹在所述蛋白中;(c)將合成的納米疫苗快速冷卻,以停止反應;(d)將納米疫苗透析,以除去多余的的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。
本發明技術方案再進一步提出了一種抗原蛋白包載nod受體激動劑組分用于免疫預防和治療的新型納米疫苗,制備這種納米疫苗的方法包含以下幾個步驟:(a)在50~110℃,ph3~11的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下從而引起蛋白結構展開、巰基暴露,蛋白大分子再折疊或自組裝,將免疫佐劑包裹在所述蛋白中;(c)將合成的納米疫苗快速冷卻,以停止反應;(d)除去納米疫苗多余的的小分子物質或進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。
本發明技術方案再進一步提出了一種抗原蛋白包載低濃度化療藥用于免疫預防和治療的新型納米疫苗,制備這種納米疫苗的方法包含以下幾個步驟:(a)在50~110℃,ph3~11的條件下,用第一種溶劑溶解所述蛋白獲得蛋白溶液;(b)在變性劑或者適合的變性條件下從而引起蛋白結構展開、巰基暴露,蛋白大分子再折疊或自組裝,將免疫佐劑包裹在所述蛋白中;(c)將合成的納米疫苗快速冷卻,以停止反應;(d)將納米疫苗透析,以除去多余的小分子物質或者進一步濃縮;(e)對所得溶液進行脫水作用,制得能夠保存的疫苗干粉。
對本發明所述技術方案的說明:
本發明所述的"納米粒",指的處于微觀體和宏觀體系之間,尺度在1-1000nm之間的超微粒子。本發明所制備的新型納米疫苗平均粒徑分布于5nm到1000nm之間,最優的區間是30nm到400nm。而且,本發明所制備的新型納米疫苗抗原組分≥80%以上,具有超高的抗原密度。
本發明中所述的將免疫佐劑包入蛋白,指的是免疫佐劑可以通抗原蛋白的結構展開、巰基暴露及去折疊,進入蛋白的中心區域。本發明中所述的免疫佐劑指代的是給人或動物服用或注射時,可引起機體免疫應答的蛋白、核苷酸、細胞因子、化合物以及混合物,該免疫應答包括免疫激活與免疫抑制。該免疫佐劑包括親水性免疫佐劑及疏水型免疫佐劑。本領域技術人員清楚疏水性免疫佐劑的水溶性不好,親水性藥理活性物質能夠優化的溶解在水中,可通過修飾巰基或其它基團,增加抗原蛋白對親水性佐劑的負載率。疏水性的免疫佐劑可與抗原蛋白的疏水區結合,故抗原蛋白對其負載率較高。
本領域技術人員能夠理解本發明中使用的免疫佐劑的量會根據抗原蛋白的量的變化而變化,同時根據納米疫苗的量的變化而變化。同時,有經驗的人能夠意識到本發明中使用的免疫佐劑,可以是純的物質,或者是它們的混合物,這些都沒有背離本發明的范圍。
本發明中,可以選擇不同的蛋白去形成本領域技術人員所感興趣的納米疫苗,該蛋白即可指代免疫原性較強的抗原蛋白,又可指代免疫原性較弱,主要發揮載體及保護作用的載體蛋白。本發明中所涉及的蛋白包括所有的能夠在變性劑作用下結構展開、巰基暴露可結合免疫佐劑的的蛋白或者多肽。合適的抗原蛋白的例子包括如下,但是不僅僅局限于此:來自于白喉(diphtheria)、破傷風(tetanus)、脊髓灰質炎(polio)、狂犬病(rabies)、百日咳(whoopingcough)、甲型肝炎、乙型肝炎或丙型肝炎(hepatitisa,borc)、黃熱病(yellowfever)、傷寒(typhoidfever)、水痘(chickenpox)、麻疫(measles)、腿腺炎(mumps)、德國麻疫(germanmeasles)、乙型腦炎(japaneseencephalitis)、流感(influenza)、腦膜炎(meningitis)、霍亂(cholera);由以下病毒介導的傳染:輪狀病毒(rotavirus)、諾如病毒(norovirus)、鼻病毒(rhinovirus)、呼吸道合胞病毒(respiratorysyncytialvirus)、單純皰疫病毒(herpessimplexvirus)、乳頭狀瘤病毒(papillomavirus)、巨細胞病毒(cytomegalovirus)、西尼羅河病毒(westnilevirus)、登革熱病毒(denguevirus)、基孔肯雅病毒(chikungunyavirus)、hiv(aids);由以下引起的細菌性疾病:鏈球菌(streptococci)、沙眼衣原體和肺炎衣原體(trachomatisandpneumoniae)、淋病奈瑟氏球菌和腦膜炎奈瑟氏球菌、粘膜炎莫拉氏菌、金黃色葡萄球菌或b型流感嗜血菌influenzatypeb),李斯特菌病(listeriosis)、志賀氏菌病(shigellosis)、沙門氏菌病(salmonellosis)、結核病(tuberculosis)、萊姆病(lyme’sdisease)、寄生蟲疾病(parasiticcomplaints)諸如痕疾(malaria)、利什曼病(leishmaniosis)等;腫瘤抗原、腫瘤裂解物、腫瘤模式抗原ova等;也可來自于免疫原性較弱的蛋白,包括卵白蛋白、血清白蛋白、乳白蛋白、肌白蛋白、麥白蛋白、豆白蛋白、轉鐵蛋白、胰島素、血管內皮抑素、血紅蛋白、肌紅蛋白、溶菌酶、免疫球蛋白、α-2-巨球蛋白、纖維連接蛋白、纖層蛋白、膠原蛋白、明膠、人造多肽與蛋白,或者它們的組合。
在一個更優化的范圍,適合于本發明的蛋白可隨著目標疾病不同而選取不同的抗原蛋白,但優化后的抗原蛋白應符合以下特點:含有3個以上巰基,可在變性劑去折疊后通過化學鍵及次級鍵自組裝形成納米顆粒。本發明在此舉例說明,包括如下:乙型肝炎或丙型肝炎(hepatitisa,borc)、乳頭狀瘤病毒(papillomavirus)、腫瘤模式抗原ova、腫瘤裂解物、白蛋白,血紅蛋白以及它們的組合物。本領域技術人員會清楚本發明方法中,所述的抗原蛋白的量隨著免疫佐劑的質量及納米疫苗的質量的變化而變化
本發明方法中的步驟(a)為用第一種溶劑為溶解或上述抗原蛋白獲得的抗原蛋白溶液。這里的抗原蛋白溶液指代兩部分,包括抗原蛋白與能將抗原蛋白溶解的溶劑,該溶劑對抗原蛋白的溶解度良好,不會出現蛋白絮凝、沉淀等變性現象。在蛋白溶液中使用的第一種溶液舉例如下,但不僅僅局限于此:水,生理鹽水,糖,凍干保護劑和蛋白穩定劑,在更精確的范圍,溶劑包括水,磷酸鹽溶液,葡萄糖溶液,海藻糖溶液,3-嗎啉丙磺酸(mops)、醋酸溶液,2-(n-嗎啉)乙磺酸(mes)、檸檬酸、甘氨酸,三羥甲基氨基甲烷(tris),辛酸鈉或生理鹽水。
在一個更加精確的范圍,第一種溶劑包括水、醋酸緩沖液、mes緩沖液、pbs緩沖液、tris緩沖液、檸檬酸緩沖液、mops緩沖液中的一種或他們的組合。本發明中所使用的抗原蛋白溶液中的溶劑的濃度只要適合溶解抗原蛋白、利于抗原蛋白再折疊及疫苗后處理,都是可行的。一般而言,蛋白溶液中溶劑的含量范圍從0.001m到2m。優化的范圍,從0.01m到1m。再優化的范圍,從0.02m到0.2m。一個更加優化的范圍,從0.05m到0.1m。本領域技術人員能夠明白用來溶解蛋白的溶劑的濃度與體積量會根據抗原蛋白的性質及溶液濃度的變化而變化。
實驗表明,本發明中的步驟(a)中的反應參數對于形成高質量的納米疫苗來說,是非常重要的。一般來說,要獲得一個理想的結果,本發明中的步驟(a)須在-20℃到120℃范圍之間反應。優選為一個較為精確的范圍是從50℃到110℃,最優的的范圍是從60℃到100℃。合成過程已經證明,要獲得一個高質量的納米疫苗來說,其實驗過程必須優化。該本發明中步驟(a)的ph須在3到9之間,一個比較精確的范圍是從5到8.5,在一個更加精確的范圍是從6到8。本領域技術人員能夠清楚步驟(a)需要一段時間以使得蛋白充分的溶解,溶解時間的多少與溶解手段的復雜程度取決于于所使用的蛋白的種類,蛋白的濃度及使用溶劑的種類,溶劑的濃度和溫度等其他因素。一般來說,本領域技術人員能夠充分意識到,反應過程和反應過程的每一個步驟都需要充足的時間,同時,反應時間過長將導致抗原蛋白的聚集體過大導致溶液絮凝。在此舉例說明,本方案反應時間需5min到12h不等。
本發明的第二個步驟即步驟(b)包括在變性劑或者合適的變性條件下,將免疫佐劑加入到經過步驟(a)所述形成的蛋白溶液中,使蛋白展開、巰基暴露,而后結構再折疊或者自納米化形成納米疫苗。這里使用的變性劑及合適的適合的變性條件指的是,該溶液及條件不僅能使抗原蛋白或者多肽三維結構發生改變,其二維結構也發生改變。一般而言,該步驟發生蛋白結構的不可逆變性。一般來說,在該步驟提到的變性劑或者適合的變性條件下誘導的變性,為溫和的蛋白變性。本領域技術人員能夠充分意識到蛋白的溫和變性指的是在蛋白解折疊/變性之后,能夠在某些條件下再折疊成合適的結構。變性劑或者適合的變性條件可以提供一個緩沖環境來破壞蛋白的二硫鍵、氫鍵,以及干擾蛋白內部的疏水作用。本步驟發生自納米化指的是抗原蛋白分子與免疫佐劑發生的巰基/二硫鍵交換反應或其它化學反應,發生化學交聯,并在疏水作用力及氫鍵的的共同作用下,產生穩定的納米疫苗的過程。
本領域技術人員能夠充分意識到許多試劑及溶液能夠充當變性劑或者適合的變性條件。這里所述的變性劑或者適合的變性條件括水,強酸,強堿,無機鹽,有機溶劑,結構展開劑和表面活性劑。合適的變性劑或者適變性條件舉例如下,但是不僅僅局限于此:水、鹽酸,硫酸,氫氧化鈉甲醇,乙醇,異丙醇,福爾馬林,氯仿,丙酮,硫化氫、十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素,十二烷基苯磺酸鈉、直鏈烷基苯磺酸鈉、谷胱甘肽,十二烷基硫酸鈉、高氯酸,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲硫咪唑,乙酰半胱氨酸、氯化鈉,磷酸鹽,醋酸鹽,甘氨酸,三羥甲基氨基甲烷,過氧化氫,谷胱甘肽,葡萄糖,蔗糖,甘露醇,海藻糖,乙酰色氨酸,辛酸鈉或它們的組合。其中,一個更精確的變性劑劑變性條件范圍是是水,醋酸鹽,甘氨酸,氯化鈉,葡萄糖,乙醇,丙酮,2-巰基乙醇,尿素、直鏈烷基苯磺酸鈉、十二烷基硫酸鈉、或它們的組合。最優的是水、直鏈烷基苯磺酸鈉、十二烷基硫酸鈉、尿素或它們的組合。實驗證明,當變性劑或者適合的變性條件的ph在3-11之間。一個更加精確的ph范圍是從3.5到9.5。
此外,所述的步驟(b)中適合的變性條件還包括外力操作以輔助蛋白展開,包括變化壓力或光照輻射。一般來說,外加壓力能使蛋白發生去折疊的力量。光照輻射致蛋白去折疊優選紫外光。所述紫外光波長為280-315nm、強度為每平方厘米450微瓦~50毫瓦。
所述的(c)步驟指的是將反應溶液從反應環境中取出,置于反應溫度以下環境,快速停止反應。該反應溫度優選為-10℃-10℃,最優為-5℃-5℃,較經濟的為冰水浴。
本發明步驟(d))除去納米疫苗多余的的小分子物質,或進一步濃縮。一般來說,這個步驟包括任意的能夠將小分子從溶液中分離出去的方法,本領域技術人員能夠充分意識到分離的方法包括任意的能夠純化蛋白或者多肽的方法。這些方法可包括這些方法可包括鹽沉淀,超濾、透析,層析以及它們的組合。這些方法應做適當的選擇。一個更加精細的范圍,透析和超濾是可行的。最精細的范圍,選擇好合適的分子量,超濾操作。
本發明可能還需要一個步驟(e),將提純或濃縮后的納米粒經過脫水步驟制備成藥物干粉,以方便儲存和運輸。本發明所涉及的保護的方法包括:減壓干燥,凍干,噴霧干燥。
本領域技術人員能夠意識到本發明的范圍和精髓是變動的。去折疊的蛋白是變化的,同時許多的免疫佐劑是可使用的,許多的抗原蛋白和抗原多肽是可以用來作為載體的。本發明將會在下面的實施例中得到更加明確和清晰地描述。
與現有技術相比,本發明具有以下優點:
(1)首先,經本發明提供的方法形成的納米疫苗組分簡單,即僅含對免疫發揮作用抗原和免疫佐劑。由于本方法沒有使用傳統的納米材料作為載體,這就避免了傳統納米載體的代謝及帶來的生物安全性問題。其次,本發明方法在合成蛋白納米顆粒時,沒有采用一般蛋白納米顆粒的合成方法使用化學交聯劑,這就避免了化學交聯劑如戊二醛帶來的毒性問題;第三,該蛋白疫苗的質量較高,可包裹核苷酸、多肽、細胞因子及具有免疫功能的化療藥、其它化合物等平臺型作用,尺寸可控性良好;第三,本方法創造性的利用抗原分子間的巰基及其它次級鍵,合成了穩定性較好的的納米顆粒,合成方法簡單、快捷,過程綠色環保,對環境無害。通過本技術方案合成的納米疫苗,其抗原組分含量可搞到85%以上,遠超過現有納米疫苗與傳統疫苗的抗原含量,抗原密度高。由于抗原密度高,在疾病的預防與治療時,可以通過更少的接種頻次與接種量,對病人更加方便,而且提高了疫苗的成本效率。
(2)通過本發明制備的新型納米疫苗的另一個意義是,該納米疫苗基本由抗原組成,其抗原密度高(一個50nm尺寸的納米顆粒含有500個抗原分子);納米顆粒表面由高度重復的抗原組分組成,可高度模擬病毒的衣殼結構。這種結構具有類似病毒的功能,可高效刺激機體產生高水平的免疫應答。此外,該疫苗除了傳統疫苗的預防功能以外,還具有疾病的治療功能。該新型納米疫苗因親水區暴露在外,其表面具有豐富的表面位點,可方便進行其他修飾,來靶向或輸送抗原、佐劑細胞因子到免疫器官發揮更有效的作用。本發明可依據季報哪個的不同選取不同的抗原蛋白模型及佐劑藥物來實現疾病的精準治療,例如,我們可以將乙肝的的膜抗原提取出來,用本發明制備出具有超高抗原密度的乙肝疫苗,用于后續的治療與預防實驗。
附圖說明
圖1為不同反應時間對本發明中納米疫苗粒徑大小的影響圖;
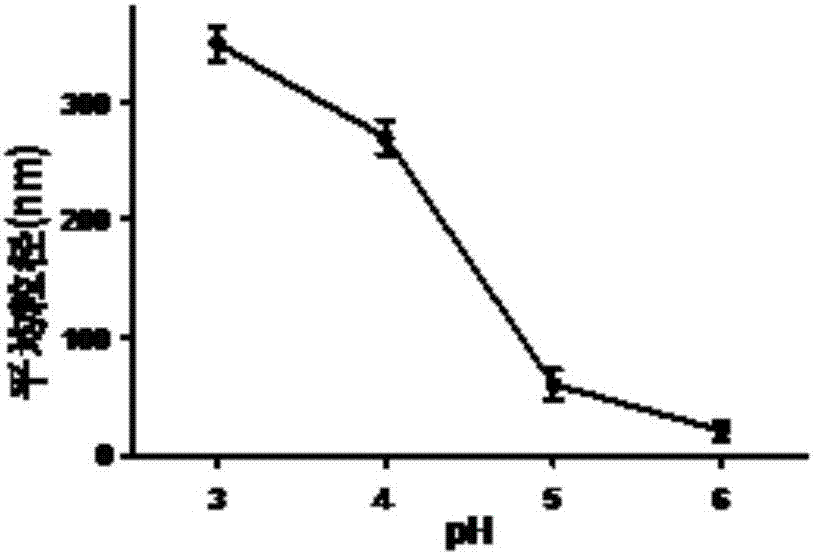
圖2為同一反應時間,不同ph對本發明中納米疫苗粒徑大小的影響圖;
圖3為本發明中的腫瘤模式蛋白ova負載免疫多肽納米疫苗粒徑-反應時間的尺寸可控圖;
圖4為本發明中不同水合粒徑大小的腫瘤模式蛋白ova@cpg納米疫苗的凝膠電泳示意圖。
具體實施方式
下面結合附圖和具體實施例對本發明進行詳細說明。以下實施例將有助于本領域的技術人員進一步理解本發明,但不以任何形式限制本發明。應當指出的是,對本領域的普通技術人員來說,在不脫離本發明構思的前提下,還可以做出若干變形和改進。這些都屬于本發明的保護范圍。
實施例1:腫瘤模式抗原的納米疫苗制備
6mgova粉末溶于2mlph3.5的0.05mmes緩沖液中,過濾或離心出去絮狀不溶物。向抗原蛋白體系中加入質量分數為6%的十二烷基硫酸鈉水溶液50微升,攪拌2分鐘,混合均勻。將反應溶液注入螺口玻璃瓶中擰緊,置于90℃油浴中加熱,在磁力攪拌器上以750轉/分鐘的速度攪拌,反應時間為4-30分鐘。隨反應時間不同,可得到乳光程度不同的、粒徑均勻的納米粒子(如圖1所示,隨著反應時間的不同,得到質量良好、可控性較強的,具有不同粒徑的納米疫苗)。反應完畢后,將反應溶液置于冰水浴中1-2min,使反應快速終止。最后使用3000分子量的超濾管離心,或用3000分子量透析袋透析48h,除去體系內的雜質及未反應的組分,得到提純濃縮的納米疫苗。隨著反應時間的不同,得到質量良好(pdi<0.2)、可控性較強的,具有不同粒徑(20-500nm)的納米疫苗。該納米疫苗進行冷凍干燥36h,得到白色絮狀固體。該納米疫苗抗原質量分數為100%。該白色固體復溶后易被生理鹽水、磷酸鹽緩沖液、水等溶解為原溶液,且納米粒粒徑及多分散系數基本保持不變改變。復溶后的納米疫苗粒徑主要分布在30-500nm。
實驗中,十二烷基硫酸鈉還可用其它變性劑代替,比如水,直鏈烷基苯磺酸鈉、強酸(硫酸、鹽酸、高氯酸),強堿(氫氧化鈉),十六烷基三甲基溴化銨、過氧化氫,谷胱甘肽,硫化氫,2-巰基乙醇,二硫蘇糖醇,鹽酸胍,尿素谷胱甘肽,三丁基膦,甲巰丙脯氨酸,過甲酸,青霉胺,甲巰咪唑,乙酰半胱氨酸以及它們的組合。結果發現,較溫和的而變性劑有利于形成質量較高的納米疫苗,實踐證明,微量的十二烷基烷基硫酸鈉、十二烷基苯磺酸鈉、尿素、還原劑和氧化劑對可以達到較好的粒徑分布(pdi較小)。
實施例2:腫瘤模式抗原的納米疫苗制備
6mgova粉末溶于2mlph為3.0、4.0、5.0、6.0的緩沖液中,過濾或離心出去絮狀不溶物。向抗原蛋白體系中加入質量分數為6%的十二烷基硫酸鈉水溶液50微升,攪拌2分鐘,混合均勻。將反應溶液注入螺口玻璃瓶中擰緊,置于90℃油浴中加熱,在磁力攪拌器上以750轉/分鐘的速度攪拌,反應時間為25分鐘。隨反應時間不同,可得到乳光程度不同的、粒徑均勻的納米粒子(如圖1所示)。反應完畢后,將反應溶液置于冰水浴中1-2min,使反應快速終止。最后使用3000分子量的超濾管離心,或用3000分子量透析袋透析48h,除去體系內的雜質及未反應的組分,得到提純濃縮的納米疫苗。冷凍干燥后的樣品能夠復融。如圖2所示,隨著溶液ph的不同,在同一反應時間內得到納米疫苗粒徑也不同。該納米疫苗抗原質量分數為100%。
附加實驗表明甘氨酸、蔗糖、乳糖和海藻糖均能作為凍干保護劑,且用乳糖做動感保護劑得到的納米疫苗干粉質量最好。
實驗中,抗原蛋白的緩沖體系替代mes緩沖液、甘氨酸緩沖液、鄰苯二甲酸緩沖液、檸檬酸緩沖液、醋酸鹽緩沖液、磷酸鹽緩沖液、tris緩沖液、巴比妥鈉緩沖液、硼酸鹽緩沖液、碳酸鹽緩沖液、二(2-羥乙基)亞胺基三(羥甲基)甲烷(mops)緩沖液、哌嗪-n,n'-二(2-乙磺酸)(pipes)緩沖液、二(2-羥乙基)亞胺基三(羥甲基)甲烷(bis-tris)緩沖液、三乙醇胺(tea)緩沖液、三羥甲基甲胺基丙磺酸(taps)緩沖液、3-[n-(1,1-二甲基-2-羥乙基)]氨基-2-羥丙烷磺酸(ampso)緩沖液、n-2-羥乙基哌嗪-n'-2-乙磺酸(hepes)緩沖液、n-3-(羥甲基)甲基-2-氨基乙磺酸(tes)緩沖液、n-3-(羥甲基)甲氨基-2-羥基丙烷磺酸(tapso)緩沖液以及它們的組合。結果發現,濃度在0.01m-0.2m之間的緩沖液有利于形成質量較高的納米疫苗,實踐證明,對同一種蛋白而言,適宜的緩沖液濃度(0.05m)及ph(4.0)可利于形成分布較窄、質量較高(pdi<0.15)的納米顆粒。
本實驗考察了不同緩沖液ph對納米疫苗的粒徑及反應時間的影響。對ova蛋白而言,ph越低,形成的納米疫苗質量越高。
實施例3腫瘤模式抗原的納米疫苗制備
6mgova粉末溶于2mlph為3.5的0.05mmes緩沖液中,過濾或離心出去絮狀不溶物。向抗原蛋白體系中加入變性劑,攪拌2分鐘,混合均勻。將反應溶液注入螺口玻璃瓶中擰緊,置于50℃-120℃溫度梯度下油浴中加熱,在磁力攪拌器上以750轉/分鐘的速度攪拌,反應時間為10分鐘。隨反應時間不同,可得到乳光程度不同的、粒徑均勻的納米粒子(如圖1所示)。反應完畢后,將反應溶液置于冰水浴中1-2min,使反應快速終止。最后使用3000分子量的超濾管離心,或用3000分子量透析袋透析48h,除去體系內的雜質及未反應的組分,得到提純濃縮的納米疫苗。結果顯示,隨著反應溫度的不同,在同一反應時間內得到納米疫苗粒徑也不同,95℃環境下形成150nm大小的納米疫苗,而80℃環境下反應形成的納米疫苗為20nm。該納米疫苗抗原質量分數為100%。
本實驗考察了不同溫度對納米疫苗的粒徑及反應時間的影響。溫度越低,在相同時間內形成的納米疫苗的粒徑也越小。結果表明,溫度在50℃-120℃均可形成納米粒,在80-100℃形成的納米疫苗質量更好。
實施例4:腫瘤模式抗原的納米疫苗制備
6mgova粉末溶于2mlph為6.0的0.05mmes緩沖液中,過濾或離心出去絮狀不溶物混合均勻。將反應溶液注入螺口玻璃瓶中擰緊,置于70℃油浴中加熱,在磁力攪拌器上以750轉/分鐘的速度攪拌,反應時間為1-10分鐘。隨反應時間不同,可得到乳光程度不同的、粒徑均勻的納米粒子(如圖1所示)。反應完畢后,將反應溶液置于冰水浴中1-2分鐘,使反應快速終止。最后使用3000分子量的超濾管離心,或用3000分子量透析袋透析48h,除去體系內的雜質,得到提純濃縮的納米疫苗。結果顯示,在不加變性劑的情況下,本方法可在較短時間內形成粒徑分布較窄的納米疫苗。但因無變性劑的調劑作用,蛋白聚集過快,導致此類納米疫苗不穩定。
實施例5:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mgova粉末溶于2mlph3.5的0.05mmes緩沖液中,過濾或離心出去絮狀不溶物。向抗原蛋白體系中加入質量分數為6%的十二烷基硫酸鈉水溶液50微升,攪拌均勻后,向將無酶水溶解的一定濃度的cpg,按照抗原:佐劑質量比(10:1,20:1,30:1)滴加到反應溶液里面,攪拌2分鐘,混合均勻。將反應溶液注入螺口玻璃瓶中擰緊,置于90℃水浴中加熱,在磁力攪拌器上以750轉/分鐘的速度攪拌,反應時間為4-30分鐘。隨反應時間不同,可得到乳光程度不同的、粒徑均勻的納米粒子(如圖1所示)。反應完畢后,將反應溶液置于冰水浴中1-2min,使反應快速終止。最后使用3000分子量的超濾管離心,或用3000分子量透析袋透析48h,除去體系內的雜質及未反應的組分,得到提純濃縮的納米疫苗。如圖3所示,隨著反應時間的不同,得到質量良好、可控性較強的,具有粒徑在20-450nm、多分散系數(pdi)小于0.15的的納米疫苗。圖4為不同水合粒徑大小的腫瘤模式蛋白ova@cpg納米疫苗的凝膠電泳示意圖,圖中依次為抗原佐劑質量比為10:1,20:1,30:1時納米疫苗的瓊脂糖凝膠電泳圖,從圖中可以看出,該納米疫苗可成功負載免疫佐劑cpg,具體來說,納米疫苗抗原質量分數為97%,免疫組分為3%。
實施例6:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mgova粉末溶于2mlph3.5的0.05mmes緩沖液中,過濾或離心出去絮狀不溶物。向抗原蛋白體系中加入質量分數為6%的十二烷基硫酸鈉水溶液50微升,攪拌均勻后,將無酶水溶解的一定濃度的巰基修飾的寡核苷酸(sh-cpg),按照抗原:佐劑質量比(10:1)滴加到反應溶液里面,攪拌2分鐘,混合均勻。將反應溶液注入螺口玻璃瓶中擰緊,置于90℃水浴中加熱,在磁力攪拌器上以750轉/分鐘的速度攪拌。反應完畢后,將反應溶液置于冰水浴中1-2min,使反應快速終止。最后使用3000分子量的超濾管離心,得到提純濃縮的納米疫苗。得粒徑分布在30-400nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為93%,佐劑成分為7%。該疫苗可高效刺激未成熟的骨髓來源的樹突狀細胞(bmdc)的表面標志物cd83、cd86上調,促進樹突細胞成熟。
實施例7:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mgova粉末溶于2mlph5的mes緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液30微升,攪拌均勻后,按照抗原:佐劑質量比(20:1)將無酶水溶解的聚肌苷酸胞苷酸poly(i:c)滴加到反應溶液里面,60℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-400nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例8:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mgova粉末溶于2mlph5的mes緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液30微升,攪拌均勻后,按照抗原:佐劑質量比(10:1)將pam3cys滴加到反應溶液里面,60℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-400nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為91%,佐劑成分為9%。
實施例9:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mgova粉末溶于2mlph4的mes緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液30微升,攪拌均勻后,將nod樣受體激動劑滴加到反應溶液里面,80℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為85%,佐劑成分為15%。
實施例10:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將cpg滴加到反應溶液里面,75℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例11:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為3%的十二烷基磺酸鈉水溶液20微升,攪拌均勻后,將cpg滴加到反應溶液里面,75℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例12:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為3%的尿素水溶液30微升,攪拌均勻后,將cpg滴加到反應溶液里面,80℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為93%,佐劑成分為7%。
實施例13:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為3%的尿素水溶液30微升,攪拌均勻后,將sh-cpg滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為92%,佐劑成分為8%。
實施例14:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將poly(i:c)滴加到反應溶液里面,70℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例15:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,80℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例16:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將nod樣受體激動劑滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為86%,佐劑成分為14%。
實施例17:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將pam3cys滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例18:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將咪唑喹啉滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例19:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將胞壁酰二肽滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為87%,佐劑成分為13%。
實施例20:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將多糖滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為87%,佐劑成分為13%。
實施例21:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph5的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將細胞因子溶液滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為87%,佐劑成分為13%。
實施例22:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
腫瘤模式抗原ova6mg溶于2mlph4的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將多糖滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例23:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
腫瘤模式抗原ova6mg溶于2mlph3的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液10微升,攪拌均勻后,將細胞因子滴加到反應溶液里面,60℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例24:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
腫瘤模式抗原ova6mg溶于2mlph3的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液10微升,攪拌均勻后,將具有免疫佐劑功能的質粒滴加到反應溶液里面,60℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例25:腫瘤模式抗原負載免疫佐劑納米疫苗的制備
6mg腫瘤裂解物溶于2mlph4的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將免疫佐劑功能的質粒滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例26:白喉病毒抗原負載免疫佐劑納米病毒疫苗的制備
6mg白喉病毒抗原溶于2mlph4的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將cpg滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例27:乙肝病毒抗原負載免疫佐劑納米病毒疫苗的制備
6mg乙肝病毒表面抗原溶于2mlph4的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將cpg滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例28:乙肝病毒抗原負載免疫佐劑納米病毒疫苗的制備
6mg乙肝病毒核心抗原溶于2mlph4的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將cpg滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例29:乙肝病毒抗原負載免疫佐劑納米病毒疫苗的制備
6mg乙肝病毒e抗原溶于2mlph4的tris緩沖液中,向抗原蛋白體系中加入質量分數為6%的sds水溶液20微升,攪拌均勻后,將cpg滴加到反應溶液里面,85℃水浴反應,750rpm磁力攪拌。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為93%,佐劑成分為7%。
實施例30:破傷風病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為破傷風病毒抗原,不加任何佐劑。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例31:破傷風病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為破傷風病毒抗原,佐劑cpg變為巰基cpg。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例32:破傷風病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為破傷風病毒抗原,佐劑cpg變為nod免疫佐劑。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例33:脊髓灰質炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為脊髓灰質炎病毒抗原,不加任何佐劑。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例34:脊髓灰質炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為脊髓灰質炎病毒抗原,佐劑cpg變為巰基cpg。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例35:脊髓灰質炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為脊髓灰質炎病毒抗原,佐劑cpg變為nod免疫佐劑。反應完畢后,冷卻終止反應。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例36:狂犬病病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為狂犬病病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例37:狂犬病病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為狂犬病病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例38:狂犬病病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為狂犬病病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例39:甲型肝炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為甲型肝炎病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例40:甲型肝炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為甲型肝炎病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例41:甲型肝炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為甲型肝炎病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例42:丙型肝炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為丙型肝炎病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例43:丙型肝炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為丙型肝炎病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例44:丙型肝炎病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為丙型肝炎病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例45:傷寒病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為傷寒病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例46:傷寒病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為傷寒病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例47:傷寒病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為傷寒病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例48:水痘病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為水痘病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例49:水痘病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為水痘病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例50:水痘病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為水痘病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例51:麻疫病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為麻疫病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例52:麻疫病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為麻疫病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例53:麻疫病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為麻疫病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例54:乳頭瘤病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為乳頭瘤病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例55:乳頭瘤病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為乳頭瘤病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例56:乳頭瘤病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為乳頭瘤病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例57:hiv病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為hiv病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例58:hiv病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為hiv病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例59:hiv病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為hiv病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例60:結核病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為結核病毒抗原,不加任何佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為100%。
實施例61:結核病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為結核病毒抗原,佐劑cpg變為巰基cpg。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為95%,佐劑成分為5%。
實施例62:結核病毒抗原負載免疫佐劑納米病毒疫苗的制備
本實施例與實施例6相同,僅改變卵清蛋白為結核病毒抗原,佐劑cpg變為nod免疫佐劑。可得粒徑分布在30-500nm,pdi小于0.2的納米疫苗。該納米疫苗抗原組分為90%,佐劑成分為10%。
實施例63
一種蛋白自組裝新型納米疫苗,該疫苗僅包含抗原蛋白和免疫佐劑,由自體內部的巰基通過巰基/二硫鍵反應形成以二硫鍵為主,以疏水作用力、氫鍵、靜電作用力弱相互作用力為輔,將免疫佐劑及抗原肽包封在形成的納米顆粒中,其中抗原蛋白質量占比為85%,免疫佐劑占比為15%,不需要使用任何化學交聯劑和納米載體,其平均粒徑在20nm,并且具有還原敏感性。
使用的抗原蛋白為含有半胱氨酸和/或二硫鍵的蛋白質。本實施例中的抗原蛋白為白喉(diphtheria),免疫佐為劑toll樣受體激動劑,本實施例選用cpgodn。
蛋白自組裝新型納米疫苗的制備方法采用以下步驟:
(a)在-10℃,ph為3的緩沖液條件下,用生理鹽水作為溶劑溶解抗原蛋白獲得蛋白溶液;
(b)在變性劑2-巰基乙醇的作用下,將免疫佐劑加入步驟(a)得到的蛋白溶液中,快速升溫至60℃,使蛋白去折疊以巰基暴露,通過二硫鍵交聯以及蛋白再折疊或自組裝,把免疫佐劑或多肽包入蛋白,自納米化形成蛋白納米顆粒,即制備得到納米疫苗。
制備得到的蛋白納米顆粒通過超濾或透析,去除體系內的雜質,得到提純或濃縮的納米疫苗,還可以經過凍干脫水制備成疫苗制劑。
實施例64
一種蛋白自組裝新型納米疫苗,該疫苗僅包含抗原蛋白和抗原肽,由自體內部的巰基通過巰基/二硫鍵反應形成以二硫鍵為主,以疏水作用力、氫鍵、靜電作用力弱相互作用力為輔,將免疫佐劑及抗原肽包封在形成的納米顆粒中。該疫苗的抗原蛋白質量占比為95%,抗原肽占比5%。不需要使用任何化學交聯劑和納米載體,其平均粒徑在500nm,并且具有還原敏感性。
抗原蛋白為含有半胱氨酸和/或含≥3個二硫鍵的抗原蛋白,本實施例選用諾如病毒(norovirus),抗原肽為具有抗原活性的寡肽或其衍生物,本實施例選用egfr237-267。
蛋白自組裝新型納米疫苗的制備方法采用以下步驟:
(a)在110℃,ph為11的緩沖液條件下,用鄰苯二甲酸緩沖液作為溶劑溶解抗原蛋白獲得蛋白溶液;
(b)在100℃、加入鹽酸,其與與抗原蛋白之間的摩爾比在30:1,將免疫佐劑加入步驟(a)得到的蛋白溶液中,快速升溫至120℃,使蛋白去折疊以巰基暴露,通過二硫鍵交聯以及蛋白再折疊或自組裝,把免疫佐劑或多肽包入蛋白,自納米化形成蛋白納米顆粒,即制備得到納米疫苗。
制備得到的蛋白納米顆粒通過超濾或透析,去除體系內的雜質,得到提純或濃縮的納米疫苗,還可以經過減壓蒸餾脫水制備成疫苗制劑。
以上對本發明的具體實施例進行了描述。需要理解的是,本發明并不局限于上述特定實施方式,本領域技術人員可以在權利要求的范圍內做出各種變形或修改,這并不影響本發明的實質內容。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 一種具有葡萄糖敏感性和溫度敏感性的自組裝納米粒子及其制備方法
- 一種基于納米材料自組裝的土霉素sers檢測方法
- 暴露高能晶面納米片自組裝的三維網絡結構α?Fe<sub>2</sub>O<sub>3</sub>的制備方法
- 一種三氧化鎢納米帶自組裝成微納米星的制備方法
- 一種葡萄糖和溫度敏感性的自組裝納米粒子及其制備方法和應用
- 允許通過嵌段共聚物的自組裝產生納米結構體的方法
- 一種自組裝納米止血劑、其制備方法及應用
- 一種納米片自組裝棱臺狀(NH<sub>4</sub>)<sub>2</sub>V<sub>3</sub>O<sub>8</sub>的制備方法
- 一種干燥介導金納米顆粒自組裝制備金基底的方法及其應用
- 一種以桿菌肽為模板自組裝合成球狀金納米粒子的方法
- 一種基于納米材料自組裝的土霉素sers檢測方法
- 暴露高能晶面納米片自組裝的三維網絡結構α?Fe<sub>2</sub>O<sub>3</sub>的制備方法
- 一種三氧化鎢納米帶自組裝成微納米星的制備方法
- 一種葡萄糖和溫度敏感性的自組裝納米粒子及其制備方法和應用
- 允許通過嵌段共聚物的自組裝產生納米結構體的方法
- 一種自組裝納米止血劑、其制備方法及應用
- 一種納米片自組裝棱臺狀(NH<sub>4</sub>)<sub>2</sub>V<sub>3</sub>O<sub>8</sub>的制備方法
- 一種干燥介導金納米顆粒自組裝制備金基底的方法及其應用
- 一種以桿菌肽為模板自組裝合成球狀金納米粒子的方法
- 一種果膠-多臂聚乙二醇自組裝制備納米藥物的方法