基于空心普魯士藍(lán)的熱刺激響應(yīng)型藥物釋放納米載體及其制備方法與流程
本發(fā)明屬于納米材料技術(shù)領(lǐng)域,具體涉及一種熱刺激響應(yīng)型藥物釋放納米載體及其制備方法。
背景技術(shù):
在癌癥治療中,化療是臨床治療癌癥的重要手段之一,而化療藥物由于其本身的細(xì)胞毒性,在殺滅癌細(xì)胞的同時(shí),帶給患者的副作用也是巨大的,而且往往是全身性的毒副作用。刺激響應(yīng)釋放是一種既能降低毒副作用,又能提高藥物利用率的解決方法。隨著藥物納米載體研究的不斷推進(jìn),刺激響應(yīng)型藥物釋放納米載體逐漸成為研究者們關(guān)注的重點(diǎn)。刺激響應(yīng)型藥物釋放納米載體是利用一種或多種生物相容的材料合成的具有在特定的外源性或內(nèi)源性刺激下進(jìn)行如質(zhì)子化、水解、超分子構(gòu)象變化或物理相變等響應(yīng)能力的納米載體,通過(guò)其裝載藥物可以達(dá)到在病變部位定點(diǎn)釋放的目的。外源性刺激包括熱、光、磁場(chǎng)等,內(nèi)源性刺激包括酶的濃度、ph值、氧化還原梯度等。
普魯士藍(lán)是一種生物相容性極好的材料,美國(guó)食品藥品管理局(foodanddrugadministration)認(rèn)證其為對(duì)人體無(wú)害物質(zhì),并在2003年批準(zhǔn)其醫(yī)用于鉈中毒解毒劑。近年來(lái)的研究發(fā)現(xiàn),普魯士藍(lán)同時(shí)還具有很強(qiáng)的近紅外光吸收能力和較高的光熱轉(zhuǎn)換效率,是一個(gè)優(yōu)秀的光熱治療劑。目前將普魯士藍(lán)納米粒子用于刺激響應(yīng)型納米載體的研究少,其中具有代表性的是將普魯士藍(lán)納米粒子與藥物交聯(lián)的明膠結(jié)合,利用內(nèi)源性刺激——明膠水解酶作為刺激源,將與粒子結(jié)合的明膠水解,達(dá)到刺激響應(yīng)型藥物釋放的目的。但因?yàn)槊髂z水解酶在正常組織細(xì)胞同樣存在,藥物的選擇上也存在一定的限制性。
技術(shù)實(shí)現(xiàn)要素:
本發(fā)明的目的是在于提供一種基于空心普魯士藍(lán)的熱刺激響應(yīng)型藥物釋放納米載體,以期望可以使其具有外源性刺激響應(yīng)型能力,避免對(duì)正常細(xì)胞的傷害,并同時(shí)適用于親水和疏水藥物。
本發(fā)明為解決技術(shù)問(wèn)題,采取如下技術(shù)方案:
本發(fā)明基于空心普魯士藍(lán)的熱刺激響應(yīng)型藥物釋放納米載體,其特點(diǎn)在于:所述納米載體是以空心普魯士藍(lán)納米粒子為外殼結(jié)構(gòu),在所述外殼結(jié)構(gòu)的空心中填充有溫敏性材料;所需負(fù)載的藥物均勻混合于所述溫敏性材料中,從而構(gòu)成載藥納米載體;
利用所述溫敏性材料的固-液相變現(xiàn)象,實(shí)現(xiàn)藥物響應(yīng)釋放的方式為:在低于所述溫敏性材料熔點(diǎn)的溫度環(huán)境下,混合有藥物的溫敏性材料在所述空心普魯士藍(lán)納米粒子中呈固態(tài),藥物不釋放;當(dāng)以外部刺激作用于納米載體時(shí),所述空心普魯士藍(lán)納米粒子產(chǎn)生熱量,使內(nèi)部空心位置的溫度達(dá)到所述溫敏性材料熔點(diǎn)及以上時(shí),混合有藥物的溫敏性材料在所述空心普魯士藍(lán)納米粒子中呈液態(tài),而從空心普魯士藍(lán)納米粒子的介孔處溢出,實(shí)現(xiàn)藥物釋放。
優(yōu)選的,所述溫敏性材料為十四醇、石蠟、十五醇或十四酸。
所述外部刺激為光刺激、微波刺激、磁力刺激、超聲刺激或體熱引發(fā)的熱刺激。其中體熱引發(fā)的熱刺激是指當(dāng)人體溫度升高到高于溫敏性材料的熔點(diǎn)時(shí),空心普魯士藍(lán)納米粒子的溫度同時(shí)升高,從而使內(nèi)部空心位置的溫度達(dá)到所述溫敏性材料熔點(diǎn)及以上。
本發(fā)明的納米載體同時(shí)適用于親水性或疏水性藥物,如阿霉素、喜樹(shù)堿、長(zhǎng)春花堿、紫杉醇、吉西他濱或卡培他濱等。
上述基于空心普魯士藍(lán)的熱刺激響應(yīng)型藥物釋放納米載體的制備方法,包括如下步驟:
(1)首先通過(guò)水熱法制備空心普魯士藍(lán)納米粒子;
(2)將熱敏性材料和藥物溶解在揮發(fā)性有機(jī)溶劑中,獲得混合溶液;將所述空心普魯士藍(lán)納米粒子分散到相同有機(jī)溶劑中,獲得納米粒子重懸液;
(3)將所述混合溶液和所述納米粒子重懸液混合后,攪拌,使部分溶有熱敏性材料和藥物的有機(jī)溶劑進(jìn)入空心普魯士藍(lán)納米粒子的空心中;然后升溫至所述有機(jī)溶劑的沸點(diǎn)以上,恒溫?cái)嚢瑁箍招钠蒸斒克{(lán)納米粒子內(nèi)部和外部的有機(jī)溶劑揮發(fā)完全,獲得分散于液態(tài)熱敏性材料中的載藥納米載體分散液;
(4)繼續(xù)恒溫,并在所述載藥納米載體分散液中加溫度不低于溫敏性材料熔點(diǎn)的去離子水,攪拌,然后離心分離,獲得載藥納米載體;室溫下,所述載藥納米載體中的熱敏性材料凝固。
以十四醇為例,上述制備方法包括如下步驟:
(1)首先通過(guò)水熱法制備空心普魯士藍(lán)納米粒子;
(2)將100~600mg十四醇溶解在6ml、1~2mg/ml藥物的甲醇溶液中,20~50℃下攪拌至混合均勻,獲得混合溶液;將5~30mg所述空心普魯士藍(lán)納米粒子分散到3ml甲醇溶液中,獲得納米粒子重懸液;
(3)將所述混合溶液和所述納米粒子重懸液混合后,攪拌1~2h,使部分溶有十四醇和藥物的甲醇溶液進(jìn)入空心普魯士藍(lán)納米粒子的空心中;然后升溫至70~90℃,恒溫?cái)嚢?~4h,使空心普魯士藍(lán)納米粒子內(nèi)部和外部的甲醇溶液揮發(fā)完全,獲得分散于液態(tài)十四醇中的載藥納米載體分散液;
(4)繼續(xù)恒溫,并在所述載藥納米載體分散液中加溫度70~90℃的去離子水,攪拌30min;然后在溫度設(shè)定為40℃的離心機(jī)上離心分離,離心轉(zhuǎn)速13000r/min、離心時(shí)間10min,獲得載藥納米載體;室溫下,所述載藥納米載體中的十四醇凝固。
離心過(guò)程中,十四醇中的載藥納米載體轉(zhuǎn)移至水相并沉淀,十四醇密度比水小,浮與溶液上方。
如圖1所示,以溫敏性材料十四醇為例,其在常溫下為無(wú)色固體,其熔點(diǎn)為38℃,高于人體內(nèi)正常體溫,具有作為刺激響應(yīng)型藥物釋放納米載體組成材料的潛力。將其與藥物同時(shí)裝載于空心普魯士藍(lán)納米粒子中,低于38℃時(shí),十四醇混合藥物相變?yōu)楣腆w,利用近紅外光照射等刺激普魯士藍(lán)產(chǎn)生熱量,使環(huán)境溫度高于38℃,十四醇相變?yōu)橐后w并且釋放藥物。此刺激響應(yīng)型藥物釋放體系對(duì)于親水藥物或疏水藥物都有效。
本發(fā)明的有益效果體現(xiàn)在:
1、本發(fā)明的納米載體具有熱刺激響應(yīng)藥物釋放能力,同時(shí)還是優(yōu)秀的光熱治療劑,是光熱治療與化療聯(lián)合的一種形式。
2、本發(fā)明的納米載體即可以裝載親水藥物又可以裝載疏水藥物,克服了一般納米載體只能單一裝載親水或疏水藥物的不足。
3、本發(fā)明制備過(guò)程簡(jiǎn)單、條件溫和,具有大規(guī)模生產(chǎn)的可能,具有工業(yè)和實(shí)際應(yīng)用的潛力。
4、本發(fā)明所使用的材料具有很好的生物相容性,對(duì)人體無(wú)直接或間接毒害作用,人體均能排出,無(wú)潛在毒性。
5、本發(fā)明的納米載體具有良好的分散性和穩(wěn)定性,有利于臨床使用。
6、本發(fā)明的熱刺激響應(yīng)型納米載體,其所用外源性刺激可為808nm近紅外光,做出的響應(yīng)為溫度升高并進(jìn)行藥物釋放,這樣的方式減少了藥物對(duì)其他組織細(xì)胞的傷害,實(shí)現(xiàn)了藥物的靶向釋放,提高了藥物的利用率。
附圖說(shuō)明
圖1為本發(fā)明的原理示意圖;
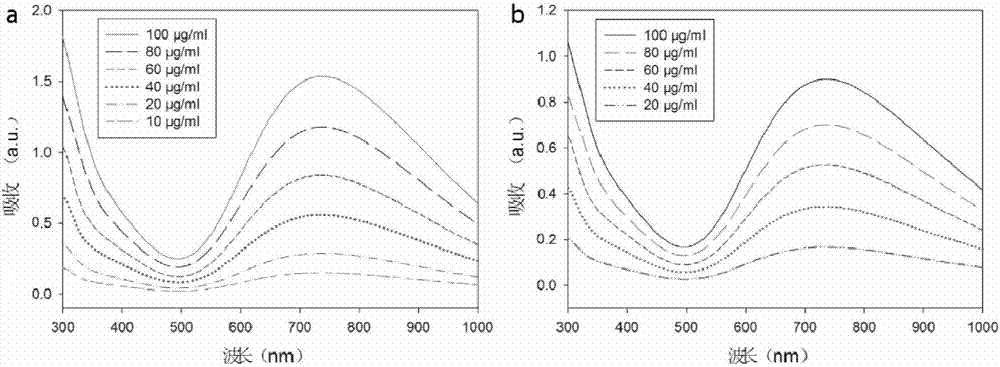
圖2為實(shí)施例1中制備的空心普魯士藍(lán)納米粒子(圖2a)和未載藥的空白納米載體的紫外吸收光譜圖(圖2b);
圖3為實(shí)施例2制備的搭載親水藥物阿霉素的納米載體與實(shí)施例1中的空白納米載體以及游離阿霉素的紫外吸收光譜對(duì)比圖(圖3a)、及實(shí)施例3制備的搭載疏水藥物喜樹(shù)堿的納米載體與實(shí)施例1中的空白納米載體以及游離喜樹(shù)堿的紫外吸收光譜對(duì)比圖(圖3b)。
圖4為空心普魯士藍(lán)納米粒子和實(shí)施例2制備的載藥納米載體的熱重分析圖。
圖5a為實(shí)施例2中不同濃度的載藥納米載體水分散液的升溫曲線圖,圖5b為濃度150μg/ml的載藥納米載體水分散液的相應(yīng)升溫穩(wěn)定性曲線圖。
圖6a為實(shí)施例2制得的搭載親水藥物阿霉素的納米載體在不同溫度下的藥物釋放曲線,圖6b為實(shí)施例3制得的搭載疏水藥物喜樹(shù)堿的納米載體在不同溫度下的藥物釋放曲線,
圖7a為實(shí)施例2制得的搭載親水藥物阿霉素的納米載體在間斷激光照射下的藥物釋放曲線,圖7b為實(shí)施例3制得的搭載疏水藥物喜樹(shù)堿的納米載體在間斷激光照射下的藥物釋放曲線。
圖8a為未經(jīng)激光照射時(shí),游離阿霉素、實(shí)施例1中的空白納米載體及實(shí)施例2的載藥納米載體對(duì)hela細(xì)胞的殺傷效果,圖8b為經(jīng)過(guò)808nm激光照射5min時(shí)三者對(duì)hela細(xì)胞的殺傷效果。
圖9a為未經(jīng)激光照射時(shí),游離喜樹(shù)堿、實(shí)施例1中的空白納米載體及實(shí)施例3的載藥納米載體對(duì)hela細(xì)胞的殺傷效果,圖9b為經(jīng)過(guò)808nm激光照射5min時(shí)三者對(duì)hela細(xì)胞的殺傷效果。
具體實(shí)施方式
實(shí)施例1
本實(shí)施例按如下方法制備空白納米載體:
(1)首先通過(guò)水熱法制備空心普魯士藍(lán)納米粒子:
稱取3g的聚乙烯吡咯烷酮(pvp)溶于40ml的0.01mol/l的鹽酸溶液,攪拌至完全溶解,再加入132mg的鐵氰化鉀,攪拌至完全溶解,置于80℃下反應(yīng)20小時(shí),得到介孔普魯士藍(lán);
將20mg的介孔普魯士藍(lán)溶于20ml的0.1mol/l的鹽酸溶液,再加入200mg的聚乙烯吡咯烷酮,攪拌1小時(shí),置于140℃下反應(yīng)2小時(shí),得到空心普魯士藍(lán)納米粒子;
(2)將300mg十四醇溶解在6ml甲醇溶液中,50℃下攪拌至混合均勻,獲得十四醇溶液;將15mg空心普魯士藍(lán)納米粒子分散到3ml甲醇溶液中,獲得納米粒子重懸液;
(3)將十四醇溶液和納米粒子重懸液混合后,攪拌1h,使部分溶有十四醇的甲醇溶液進(jìn)入空心普魯士藍(lán)納米粒子的空心中;然后升溫至70℃,恒溫?cái)嚢?h,使空心普魯士藍(lán)納米粒子內(nèi)部和外部的甲醇溶液揮發(fā)完全,獲得分散于液態(tài)十四醇中的空白納米載體分散液;
(4)繼續(xù)恒溫,并在空白納米載體分散液中加溫度70℃的去離子水,攪拌30min;然后在溫度設(shè)定為40℃的離心機(jī)上離心分離,離心轉(zhuǎn)速13000r/min、離心時(shí)間10min,獲得空白納米載體;室溫下,空白納米載體中的十四醇凝固。
圖2a為空心普魯士藍(lán)納米粒子的紫外吸收光譜,其表征方法為:將所得空心普魯士藍(lán)納米粒子的水溶液稀釋至不同濃度(10μg/ml、20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml),并測(cè)試其紫外-可見(jiàn)吸收光譜圖;圖2b為未載藥的空白納米載體的紫外吸收光譜,其表征方法為:將空白納米載體稀釋至不同濃度(20μg/ml、40μg/ml、60μg/ml、80μg/ml、100μg/ml),并測(cè)試其紫外-可見(jiàn)吸收光譜。對(duì)比圖2a和圖2b可知,十四醇成功載入空心普魯士藍(lán)納米粒子的空心中,而使得其在相同質(zhì)量濃度下的吸收峰降低。
實(shí)施例2
本實(shí)施例按如下方法制備搭載親水藥物的納米載體:
(1)按實(shí)施例1相同的方法制備空心普魯士藍(lán)納米粒子。
(2)將300mg十四醇溶解在6ml、1mg/ml親水藥物阿霉素的甲醇溶液中,50℃下攪拌至混合均勻,獲得混合溶液;將15mg空心普魯士藍(lán)納米粒子分散到3ml甲醇溶液中,獲得納米粒子重懸液;
(3)將混合溶液和所述納米粒子重懸液混合后,攪拌1h,使部分溶有十四醇和阿霉素的甲醇溶液進(jìn)入空心普魯士藍(lán)納米粒子的空心中;然后升溫至70℃,恒溫?cái)嚢?h,使空心普魯士藍(lán)納米粒子內(nèi)部和外部的甲醇溶液揮發(fā)完全,獲得分散于液態(tài)十四醇中的載藥納米載體分散液;
(4)繼續(xù)恒溫,并在載藥納米載體分散液中加溫度90℃的去離子水,攪拌30min;然后在溫度設(shè)定為40℃的離心機(jī)上離心分離,離心轉(zhuǎn)速13000r/min、離心時(shí)間10min,獲得搭載親水藥物阿霉素的納米載體;室溫下,載藥納米載體中的十四醇凝固。
圖3a為本實(shí)施例搭載親水藥物阿霉素的納米載體與實(shí)施例1中的空白納米載體以及游離阿霉素的紫外吸收光譜對(duì)比圖,從圖中可以看到,在400-500nm范圍內(nèi),阿霉素有一個(gè)吸收峰,同時(shí)在這個(gè)范圍內(nèi),載藥納米載體的吸收相應(yīng)提高,這表明納米載體成功搭載藥物。
圖4為空心普魯士藍(lán)納米粒子和本實(shí)施例所得載藥納米載體的熱重分析圖,其表征方法為:將制得的納米粒子和載藥納米載體凍干后,利用熱重分析儀,將待測(cè)的粒子置于空氣氣氛下,由室溫逐步升高至400℃,實(shí)時(shí)測(cè)量粒子質(zhì)量,如圖所示,空心普魯士藍(lán)納米粒子質(zhì)量比載藥納米載體質(zhì)量的下降程度小,表明十四醇從粒子中去除。
圖5a為不同濃度的載藥納米載體水分散液的升溫效果圖,其表征方式為:取3ml待測(cè)溶液于808nm激光照射器照射,照射時(shí)間為10min、激光強(qiáng)度為2w,間隔10s記錄一次溫度。結(jié)果說(shuō)明隨著納米載體濃度的升高,升溫效果增加。圖5b為濃度150μg/ml載藥納米載體水分散液的相應(yīng)升溫穩(wěn)定性測(cè)試圖,可以看出,載藥納米載體具有很好的光熱穩(wěn)定性。
圖6a為本實(shí)施例制得的搭載親水藥物阿霉素的納米載體在不同溫度下的藥物釋放曲線,其表征方式為:將載藥納米載體溶于去離子水中(濃度150μg/ml),然后取1ml置于5000da的透析袋中,再將透析袋置于30ml的去離子水中,加熱至不同溫度(25℃、37℃、38℃、42℃、45℃)并攪拌。從釋放曲線的變化可以看出,十四醇在熔點(diǎn)溫度以下時(shí)為固體,幾乎不釋放藥物,而溫度達(dá)到熔點(diǎn)后,十四醇液化,開(kāi)始大量釋放藥物,說(shuō)明了十四醇具有良好的溫度響應(yīng)能力。
圖7a為本實(shí)施例制得的搭載親水藥物阿霉素的納米載體在間斷激光照射下的藥物釋放曲線,其表征方式為:將載藥納米載體溶于去離子水中(濃度150μg/ml),然后取1ml置于離心管中。首先將離心管置于恒溫37℃的細(xì)胞孵育箱中10min(激光關(guān)),然后13000r/min離心5min,采集上清液并測(cè)試?yán)塾?jì)釋放量;將沉淀重懸為1ml溶液并再置于恒溫37℃的細(xì)胞孵育箱中,開(kāi)激光照射5min(同時(shí)以不照射的對(duì)照組樣品作為對(duì)比),再次離心并采集上清液、測(cè)試?yán)塾?jì)釋放量;再將沉淀重懸為1ml溶液并置于恒溫37℃的細(xì)胞孵育箱中10min(激光關(guān))。重復(fù)激光開(kāi)關(guān)多次。結(jié)果表明了載藥納米載體具有良好的光刺激響應(yīng)藥物釋放能力。
圖8a為未經(jīng)激光照射時(shí),游離阿霉素、實(shí)施例1中的空白納米載體及本實(shí)施例的載藥納米載體對(duì)hela細(xì)胞的殺傷效果,圖8b為經(jīng)過(guò)808nm激光照射5min時(shí)三者對(duì)hela細(xì)胞的殺傷效果。可以看出,未經(jīng)激光照射時(shí),游離阿霉素對(duì)hela細(xì)胞具有一定的殺傷效果,但空白納米載體及本實(shí)施例的載藥納米載體對(duì)細(xì)胞的傷害很小,再經(jīng)過(guò)激光照射后,游離阿霉素對(duì)細(xì)胞的殺傷效果無(wú)顯著變化,但空白納米載體及本實(shí)施例的載藥納米載體對(duì)細(xì)胞殺傷效果明顯增強(qiáng)且超過(guò)游離阿霉素造成的效果,載藥納米載體的殺傷效果強(qiáng)于空白納米載體的殺傷效果。
實(shí)施例3
本實(shí)施例按實(shí)施例2相同的方法制備搭載藥物的納米載體,區(qū)別僅在于將實(shí)施例2中的親水藥物阿霉素?fù)Q為疏水藥物喜樹(shù)堿。
圖3b為本實(shí)施例搭載疏水藥物喜樹(shù)堿的納米載體與實(shí)施例1中的空白納米載體以及游離喜樹(shù)堿的紫外吸收光譜對(duì)比圖,從圖中可以看到,在350-400nm范圍內(nèi),喜樹(shù)堿有一個(gè)吸收峰,同時(shí)在這個(gè)范圍內(nèi),載藥納米載體的吸收相應(yīng)提高,這表明納米載體成功搭載藥物。
圖6b為本實(shí)施例制得的搭載疏水藥物喜樹(shù)堿的納米載體在不同溫度下的藥物釋放曲線,其表征方式為:將載藥納米載體溶于去離子水中(濃度150μg/ml),然后取1ml置于5000da的透析袋中,再將透析袋置于30ml的0.1vt%的吐溫-80的水溶液中,加熱至不同溫度(25℃、37℃、38℃、42℃、45℃)并攪拌。從釋放曲線的變化可以看出,疏水藥物的釋放與親水藥物的釋放具有相同的趨勢(shì),即都是在超過(guò)十四醇熔點(diǎn)溫度后,大量釋放,說(shuō)明了載體對(duì)親疏水藥物都具有刺激響應(yīng)載體的作用。
圖7b為本實(shí)施例制得的搭載疏水藥物喜樹(shù)堿的納米載體在間斷激光照射下的藥物釋放曲線,其表征方式與實(shí)施例1相同,區(qū)別僅在于是將載藥納米載體溶于0.1vt%的吐溫-80的水溶液中。結(jié)果表明了納米載體對(duì)疏水藥物同樣具有良好的光刺激響應(yīng)藥物釋放能力。
圖9a為未經(jīng)激光照射時(shí),游離喜樹(shù)堿、實(shí)施例1中的空白納米載體及本實(shí)施例的載藥納米載體對(duì)hela細(xì)胞的殺傷效果,圖9b為經(jīng)過(guò)808nm激光照射5min時(shí)三者對(duì)hela細(xì)胞的殺傷效果。結(jié)果可以看出未經(jīng)激光照射時(shí),空白納米載體和載藥載體對(duì)細(xì)胞殺傷較小,而經(jīng)過(guò)激光照射后殺傷效果遠(yuǎn)大于游離喜樹(shù),且載藥納米載體殺傷效果強(qiáng)于空白納米載體。
- 還沒(méi)有人留言評(píng)論。精彩留言會(huì)獲得點(diǎn)贊!
- 基于普魯士藍(lán)的光熱?化療聯(lián)合治療劑及其制備方法
- 一種類普魯士藍(lán)納米材料的制備方法及其在鈉離子電池中的應(yīng)用
- 一種以水滑石為模板構(gòu)建無(wú)基底連接二維普魯士藍(lán)類化合物納米片的方法
- 一種靶向性普魯士藍(lán)納米粒子的制備方法及其應(yīng)用
- 基于超順磁氧化鐵納米顆粒聚集體聯(lián)合普魯士藍(lán)染色的免疫層析試紙條及其制備方法和應(yīng)用
- 一種用于Cs<sup>+</sup>離子分離的鐵氰化鎳/石墨烯復(fù)合材料的制備方法
- 一種普魯士藍(lán)立方塊/二硫化鉬納米復(fù)合材料的制備方法
- 一種空心普魯士藍(lán)納米立方體的制備方法及其應(yīng)用
- 磁珠轉(zhuǎn)化普魯士藍(lán)的禽流感病毒免疫生物傳感器及方法
- 一種電化學(xué)轉(zhuǎn)化磁珠制備普魯士藍(lán)的方法及其應(yīng)用
- 一種普魯士藍(lán)納米空心橄欖球的制作方法
- 微乳液法制備聚吡咯包裹普魯士藍(lán)納米粒子用于電化學(xué)分析的制作方法
- 普魯士藍(lán)類配合物的新用途的制作方法
- 一步制備金-聚吡咯/普魯士藍(lán)核-殼多重納米復(fù)合物的方法
- 聚丙烯酸鈉原位生長(zhǎng)普魯士藍(lán)納米晶復(fù)合材料及其制備方法和應(yīng)用的制作方法
- 一種新型普魯士藍(lán)介晶及其制備方法
- 用于電致變色器件的普魯士藍(lán)涂膜的制備的制作方法
- 加強(qiáng)布匹染色用的開(kāi)纖裝置的制作方法
- 加強(qiáng)布匹染色用的開(kāi)纖裝置的制作方法
- 一種基于鉍的普魯士藍(lán)化合物納米ct造影劑及其制備方法
- 一種普魯士藍(lán)納米顆粒造影劑及其制備方法與應(yīng)用
- 一種普魯士藍(lán)及類普魯士藍(lán)納米片薄膜材料及其原位制備方法
- 一種普魯士藍(lán)/n-摻雜碳納米復(fù)合材料的制備及應(yīng)用
- 一種負(fù)載普魯士藍(lán)納米晶的石墨烯復(fù)合材料的制備方法及其應(yīng)用
- 普魯士藍(lán)殼聚糖復(fù)合納米粒子作為基因載體的新應(yīng)用
- 一種制備磁性鐵鈷普魯士藍(lán)空心納米方塊的方法
- 一種普魯士藍(lán)納米空心橄欖球的制作方法
- 一種納米Co-Fe普魯士藍(lán)配合物-碳納米管復(fù)合雙氧水傳感器的制備方法
- 一種普魯士藍(lán)修飾的鐵蛋白納米顆粒及其制備方法
- 反膠束法制備普魯士藍(lán)納米粒子用于電化學(xué)分析的制作方法