一種具有光熱增強效應的金納米星@硫化銅光熱探針的制備方法及其應用與流程
本發明涉及納米探針技術領域,采用籽晶生長法和異質生長法制備了一種具有光熱增強效應的金納米星@硫化銅光熱探針,實現對癌細胞的靶向光熱治療。
背景技術:
癌癥仍然是威脅最大和最具挑戰性的疾病之一。據統計,2008年約760萬人死于癌癥,這一數字在2030年預計將達到1310萬,人類與癌癥的斗爭還任重道遠。近年來,納米材料的光熱療法是生物醫學領域內的一個研究熱點,所謂的光熱療法是指利用納米材料的強吸收效應,將入射光中的光子能量轉換為熱能或聲子,產生局部高溫,從而殺死其周圍的癌細胞,達到癌癥治療的目的。硫化銅(cus)納米材料作為新興的光熱治療材料,是一種p型半導體材料,具有良好的光學和電學性質,已在光熱治療、藥物傳輸、傳感器、分子成像等領域得到廣泛的應用。其優勢在于:一方面,cus作為一種半導體納米顆粒,具有制備工藝簡單、顆粒尺寸較小、價格低廉、毒性較低等內在特征,非常適用于生物醫學領域的研究和應用;另一方面,硫化銅納米顆粒的光學吸收特性集中在近紅外光(700-1100nm)波段,光熱治療過程中使用的正是對生物組織穿透能力較強的近紅外光光源,可以有效降低生物組織對光的吸收,同時由于cus材料的吸收特性來源于其銅離子內部帶隙間的d-d能級躍遷,其吸收波段基本不受外界介質的干擾,提高了其光學穩定性。基于以上兩個原因,cus納米顆粒被視為最具前景的納米光熱材料之一。近年來,硫化銅以其制備工藝簡單、顆粒尺寸小、價格低廉、毒性低等優點被科研人員視為理想的光熱探針的首選,但是硫化銅材料的光熱轉換效率相對偏低一直是科研人員的一塊心病。
技術實現要素:
為了提高硫化銅納米材料的光熱轉換效率,制備納米金屬與硫化銅的復合結構,本發明利用了納米金屬的局域表面等離子體共振(lspr)效應實現對硫化銅光熱轉換效率的提高。基于此,本發明的第一目的在于提供一種具有光熱增強效應的金納米星@硫化銅光熱探針的制備方法。
本發明的另一目的在于提供所述方法制備的光熱探針。
本發明的還一目的在于提供所述制備方法及其制備的探針在腫瘤治療中的應用。
在本發明中通過液相方法制備了金納米星@硫化銅的光熱探針,基于金納米星的局域表面等離子體共振效應增強硫化銅的光熱轉換效率,達到增強光熱治療的目的。復合光熱探針基于納米顆粒的強吸收效應可以實現癌細胞的光熱治療。利用金納米星良好的生物特性提高復合探針的生物相容性。
本發明采用籽晶生長法與異質生長法制備金納米星@硫化銅光熱探針。首先利用水熱方法制備小金納米顆粒,對小金納米顆粒用十六烷基溴化銨進行表面修飾;在十六烷基溴化銨修飾的小金納米顆粒中加入硫代苯甲酸鎳和銅鹽,然后將混合溶液進行高溫處理,得到金顆粒@硫化銅顆粒;然后以金顆粒@硫化銅顆粒為籽晶,通過籽晶生長法制備金納米星@硫化銅復合結構;最后在復合結構表面進行交聯劑的修飾以方便鏈接各種生物分子,得金納米星@硫化銅光熱探針。
具體地,本發明的方法包括以下步驟:
(1)小金納米顆粒@硫化銅的制備:
向50ml質量分數為0.015mmol的氯金酸溶液中加入0.1ml-50ml濃度為1%的檸檬酸鈉(或者硼氫化鈉、抗壞血酸、四羥甲基氯化磷)溶液,反應10-360分鐘后,得小金納米顆粒;向反應溶液中加入10ml濃度為0.5m的ctab(十六烷基溴化銨)進行修飾;然后將硫代苯甲酸鎳和銅鹽加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行100-300攝氏度反應1至96小時,對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中;
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4中加入4ml的步驟(1)所得小金納米顆粒@硫化銅顆粒后攪拌5分鐘,該溶液中混有50ulhcl溶液;然后加入硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用;
(3)金納米星@硫化銅光熱探針的制備:
利用金納米星@硫化銅復合結構表面的修飾基團與多種生物分子進行交聯反應,得金納米星@硫化銅光熱探針。
優選的,所述小金納米顆粒為金納米球、金納米棒、金納米立方體、金多邊形中的任意一種。
優選的,步驟(1)中所述硫代苯甲酸鎳與氯金酸摩爾比為1:0.1至1:2;所述銅鹽與硫代苯甲酸鎳的摩爾比為1:0.3至1:10,銅鹽可以是氯化銅、硫酸銅、硝酸銅。
優選的,步驟(2)中所述硝酸銀與氯金酸的摩爾比為1:10至1:40。
優選的,所述修飾基團包括氨基基團、羧基基團等;所述生物分子包括抗體、dna片段和生物配體中的任意一種。
進一步地,本發明提供了所述方法制備的金納米星@硫化銅光熱探針光熱探針。
更進一步地,本發明提供了所述金納米星@硫化銅光熱探針在癌細胞定向追蹤,癌細胞的光熱治療中的應用。所述癌細胞包括所有惡性腫瘤細胞如乳癌細胞等。
有益效果
相對于傳統的探針,此探針是光熱增強型的光熱探針,可以有效的定向殺死癌細胞,硫化銅自身的光熱轉換效應被增強,另外還提高了硫化銅的生物相容性。
(1)利用金納米星的表面等離子體效應,實現對硫化銅光熱轉換效應的提高,相比于單獨的硫化銅和金納米星,復合探針的光吸收效應被增強。
(2)在復合探針中,基于金納米顆粒良好的生物特性,提高了復合探針的生物相容性。
附圖說明
圖1金納米星@硫化銅探針的應用示意圖;
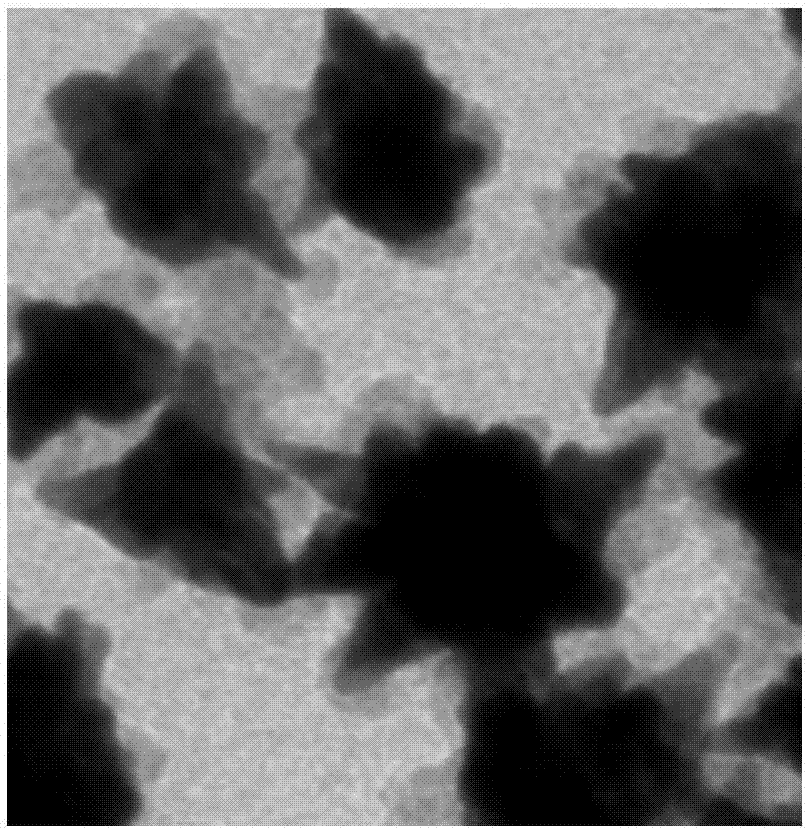
圖2金納米星@硫化銅復合探針的透射電鏡圖片;
圖3復合探針及單獨硫化銅、金納米星的吸收光譜;
圖4金納米星@硫化銅光熱探針對乳腺癌細胞的光熱療效;
圖5是六個實施例得到的復合探針的吸收光譜圖;
圖6是六個實施例得到的復合探針的升溫曲線圖。
具體實施方式
以下實施例用于說明本發明,但不用來限制本發明的范圍。若未特別指明,實施例中所用的技術手段為本領域技術人員所熟知的常規手段。
實施例中所用的試劑均可市場購買得到。
壓釜廠家:上海予名儀器設備有限公司,型號:100ml,工作溫度:≤220攝氏度,工作壓力:≤3mpa。
實施例1:
(1)小金納米顆粒@硫化銅的制備:
向50ml物質的量為0.015mmol的的氯金酸溶液中加入1ml濃度為1%的檸檬酸鈉溶液,反應20分鐘后得到小金納米顆粒,向反應溶液中加入10ml濃度為0.5m的ctab,然后將0.008mmol的硫代苯甲酸鎳和0.003mmol的氯化銅加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行135攝氏度反應2小時。對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中。
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4(混有50ulhcl溶液)中加入4ml的小金納米顆粒@硫化銅顆粒后攪拌5分鐘,然后加入0.0005mmol的硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用。
(3)金納米星@硫化銅光熱探針的制備
利用復合結構表面的氨基基團、羧基基團可以發生交聯反應,從而實現對多種生物分子(抗體)的鏈接。37度環境下,將0.05mmol的抗體分子加入到0.005mmol的復合結構中,然后在37度下進行交聯4小時,然后進行洗滌離心,最后在外界光場作用下,實現對癌細胞的熒光標記和光熱治療。
本發明制備的金納米星@硫化銅光熱探針結構示意圖如圖1所示;圖中:黑色主體部分代表硫化銅,星狀灰度部分代表金納米星,外側曲線代表功能基團。
金納米星@硫化銅復合探針的透射電鏡圖片如圖2所示。金納米星和硫化銅的物理特性不同,在透射電鏡中顯示的灰度有所區別,圖中深黑色部分是金納米星,淺灰色色部分是硫化銅納米顆粒,從圖中可以看出復合探針是由金納米星和硫化銅兩部分組成的,復合探針實現了兩者的有效結合。
復合探針及單獨硫化銅、金納米星的吸收光譜如圖3所示,從圖中可以看中復合探針的吸收強度要顯著好于二者混合物和單獨硫化銅、金納米星,尤其在波長大于800納米時。通過測量吸收譜線的吸收面積,可以得到復合探針的吸收強度是單純硫化銅探針的3.7倍。
復合探針與硫化銅的光熱殺滅癌細胞整體對比圖如圖4所示,a圖為硫化銅的光熱效果,b圖示復合探針的光熱效果。從圖上可以看出復合探針殺滅癌細胞的情況明顯好于硫化銅的光熱效果。
實施例2:
(1)小金納米顆粒@硫化銅的制備:
向50ml物質的量為0.015mmol的的氯金酸溶液中加入1ml濃度為1%的硼氫化鈉溶液,反應20分鐘后得到小金納米顆粒,向反應溶液中加入10ml濃度為0.5m的ctab,然后將0.0015mmol的硫代苯甲酸鎳和0.003mmol的氯化銅加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行135攝氏度反應2小時。對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中。
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4(混有50ulhcl溶液)中加入4ml的小金納米顆粒@硫化銅顆粒后攪拌5分鐘,然后加入0.0005mmol的硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用。
(3)金納米星@硫化銅光熱探針的制備
利用復合結構表面的氨基基團、羧基基團可以發生交聯反應,從而實現對多種生物分子(抗體)的鏈接。37度環境下,將0.05mmol的抗體分子加入到0.005mmol的復合結構中,然后在37度下進行交聯4小時,然后進行洗滌離心,最后在外界光場作用下,實現對癌細胞的熒光標記和光熱治療。
實施例3:
(1)小金納米顆粒@硫化銅的制備:
向50ml物質的量為0.015mmol的的氯金酸溶液中加入1ml濃度為1%的四羥甲基氯化磷溶液,反應20分鐘后得到小金納米顆粒,向反應溶液中加入10ml濃度為0.5m的ctab,然后將0.03mmol的硫代苯甲酸鎳和0.003mmol的氯化銅加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行135攝氏度反應2小時。對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中。
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4(混有50ulhcl溶液)中加入4ml的小金納米顆粒@硫化銅顆粒后攪拌5分鐘,然后加入0.0005mmol的硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用。
(3)金納米星@硫化銅光熱探針的制備
利用復合結構表面的氨基基團、羧基基團可以發生交聯反應,從而實現對多種生物分子(如抗體)的鏈接。37度環境下,將0.05mmol的抗體分子加入到0.005mmol的復合結構中,然后在37度下進行交聯4小時,然后進行洗滌離心,最后在外界光場作用下,實現對癌細胞的熒光標記和光熱治療。
實施例4:
(1)小金納米顆粒@硫化銅的制備:
向50ml物質的量為0.015mmol的的氯金酸溶液中加入1ml濃度為1%的抗壞血酸溶液,反應20分鐘后得到小金納米顆粒,向反應溶液中加入10ml濃度為0.5m的ctab,然后將0.008mmol的硫代苯甲酸鎳和0.003mmol的氯化銅加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行135攝氏度反應2小時。對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中。
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4(混有50ulhcl溶液)中加入4ml的小金納米顆粒@硫化銅顆粒后攪拌5分鐘,然后加入0.0001mmol的硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用。
(3)金納米星@硫化銅光熱探針的制備
利用復合結構表面的氨基基團、羧基基團可以發生交聯反應,從而實現對多種生物分子(如抗體)的鏈接。37度環境下,將0.05mmol的抗體分子加入到0.005mmol的復合結構中,然后在37度下進行交聯4小時,然后進行洗滌離心,最后在外界光場作用下,實現對癌細胞的熒光標記和光熱治療。
實施例5:
(1)小金納米顆粒@硫化銅的制備:
向50ml物質的量為0.015mmol的的氯金酸溶液中加入1ml濃度為1%的檸檬酸鈉溶液,反應20分鐘后得到小金納米顆粒,向反應溶液中加入10ml濃度為0.5m的ctab,然后將0.008mmol的硫代苯甲酸鎳和0.003mmol的氯化銅加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行135攝氏度反應2小時。對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中。
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4(混有50ulhcl溶液)中加入4ml的小金納米顆粒@硫化銅顆粒后攪拌5分鐘,然后加入0.001mmol的硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用。
(3)金納米星@硫化銅光熱探針的制備
利用復合結構表面的氨基基團、羧基基團可以發生交聯反應,從而實現對多種生物分子(如抗體、dna片段、生物配體等)的鏈接。37度環境下,將0.05mmol的抗體分子加入到0.005mmol的復合結構中,然后在37度下進行交聯4小時,然后進行洗滌離心,最后在外界光場作用下,實現對癌細胞的熒光標記和光熱治療。
實施例6:
(1)小金納米顆粒@硫化銅的制備:
向50ml物質的量為0.015mmol的的氯金酸溶液中加入1ml濃度為1%的四羥甲基氯化磷溶液,反應20分鐘后得到小金納米顆粒,向反應溶液中加入10ml濃度為0.5m的ctab,然后將0.008mmol的硫代苯甲酸鎳和0.003mmol的氯化銅加入到小金納米顆粒中,然后將此混合物放入高壓釜中,進行135攝氏度反應2小時。對制備的小金納米顆粒@硫化銅顆粒進行離心洗滌,溶解在20ml高純水中。
(2)金納米星@硫化銅復合結構的制備:
向50ml物質的量為0.02mmol的haucl4(混有50ulhcl溶液)中加入4ml的小金納米顆粒@硫化銅顆粒后攪拌5分鐘,然后加入0.002mmol的硝酸銀和0.025mol的抗壞血酸,反應1分鐘后進行離心后備用。
(3)金納米星@硫化銅光熱探針的制備
利用復合結構表面的氨基基團、羧基基團可以發生交聯反應,從而實現對多種生物分子(如抗體)的鏈接。37度環境下,將0.05mmol的抗體分子加入到0.005mmol的復合結構中,然后在37度下進行交聯4小時,然后進行洗滌離心,最后在外界光場作用下,實現對癌細胞的熒光標記和光熱治療。
應用例
本發明針對6個實施例的得到的復合探針做了光熱殺滅癌細胞的情況分析。癌細胞是人乳腺癌細胞mda-mb-231(商業購買)。
乳腺癌細胞mda-mb-231細胞的殺滅實驗:將乳腺癌細胞生長到96孔培養板上,然后在37度下生長24小時,然后用pbs緩沖液對培養基沖洗三次,然后將連接有生物分子(如抗體)的復合探針和1.9ml的dmem(dulbecco'smodifiedeaglemedium)加入到培養基中,當培養基在37度下培養4小時后,對培養基用pbs緩沖液進行沖洗三次以除去未連接的復合探針。最后進行光熱效應研究,所用激光器的波長是808nm,功率是2w/cm2。對于培養基中的癌細胞照射10分鐘后,對細胞進行染色(使用雙色試劑盒,橙紅色代表死細胞,綠色代表活細胞),并在奧里帕斯顯微鏡下進行觀察并拍攝細胞圖像。具體如圖4所示,在b圖片中明亮位置周圍有大量碎片(實際是細胞膜的碎片)表示細胞已經凋亡,而無碎片表示細胞生存狀況良好)。
如圖5所示,從圖中可以看到實施例1的吸收特性是最強的。如圖6所示,從圖中可以看到實施例1的升溫曲線是最強的。
雖然,上文中已經用一般性說明及具體實施方案對本發明作了詳盡的描述,但在本發明基礎上,可以對之作一些修改或改進,這對本領域技術人員而言是顯而易見的。因此,在不偏離本發明精神的基礎上所做的這些修改或改進,均屬于本發明要求保護的范圍。
- 還沒有人留言評論。精彩留言會獲得點贊!
- 具有提高的靈敏度的納米線場效應晶體管生物傳感器的制作方法與工藝
- 一種具有三乙胺敏感效應的NiO納米片/α?Fe2O3納米立方體異質結材料的制作方法與工藝
- 一種具有立體藝術效果的背景材料的制作方法與工藝
- 一種具有三甲胺敏感效應的CoMoO4納米顆粒/MoO3納米帶異質結材料的制作方法與工藝
- 一種具有非常好耐光性的化纖材料的制作方法與工藝
- 具有調制的納米線數目的半導體器件的制作方法與工藝
- 具有多個LED以及光效應材料的可穿戴發光單元的制造方法與工藝
- 具有三維結構的FeS2納米材料、其制備方法與應用與流程
- 具有可調諧功能的平面納米振蕩器的制造方法與工藝
- 一種具有納米片層組裝的三維環狀微納結構的硫化鈷的制備方法及其應用與流程